Сепсис и гемолитическая анемия
Обновлено: 18.04.2024
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!
Гемолитическая анемия – патологическое состояние, при котором снижение уровня эритроцитов и гемоглобина происходит в результате ускоренного разрушения красных кровяных телец.
Врожденные генетические виды гемолитической анемии
- Дефекты мембраны эритроцитов (нарушение строения эритроцитов):
- микросфероцитарная
- овалоцитарная
- акантоцитарная
- Нехватка или отсутствие ферментов эритроцитов
- дефицит ферментов пентозо-фосфатного ряда
- дефицит ферментов гликолиза
- дефицит ферментов, участвующих в образовании, окислении и восстановлении глутатиона
- дефицит ферментов, участвующих в использовании АТФ
- дефицит ферментов, участвующих в синтезе порфиринов
- Гемоглобинопатии:
- Серповидно-клеточная анемия
- Талассемия
Неврожденные виды гемолитической анемии
- Аутоиммунные анемии. Поражение эритроцитов иммунными клетками собственного организма.
Подробнее о данном виде анемий читайте в статье: Аутоиммунная анемия.
- Токсические поражения. Гемолитические анемии при приеме лекарственных средств и гемолитических ядов.
Как повысить гемоглобин? Как поднять гемоглобин в домашних условиях? Продукты, поднимающие гемоглобин
Анемия - железодефицитная, гемолитическая, В12 дефицитная, апластическая. Причины, диагностика и степени анемии
Комментировать или поделиться опытом:
Наши видеоканалы


Ваши персональные данные обрабатываются на нашем сайте в целях его функционирования. Если вы не согласны с этим фактом - вам следует немедленно покинуть его. Если вы продолжите пользоваться сайтом, это значит, что вы согласились на обработку Ваших персональных данных.
Под названием гемолитические анемии объединяется группа приобретенных и наследственных заболеваний, характеризующихся повышением внутриклеточным или внутрисосудистым разрушением эритроцитов.
Аутоиммунные гемолитические анемии включают формы заболевания, связанные с образованием антител к собственным антигенам эритроцитов.
В общей группе гемолитических анемий чаще встречаются аутоиммунные гемолитические анемии. Частота их составляет 1 случай на 75 000-80 000 населения.
Что провоцирует / Причины Аутоиммунной гемолитической анемии:
Иммунные гемолитические анемии могут возникать под влиянием антиэритроцитарных изо- и аутоантител и, соответственно, подразделяются на изоиммунные и аутоиммунные.
К изоиммунным относятся гемолитические анемии новорожденных, обусловленные несовместимостью по системам АВО и резус между матерью и плодом, посттрансфузионные гемолитические анемии.
При аутоиммунных гемолитических анемиях происходит срыв иммунологической толерантности к неизмененным антигенам собственных эритроцитов, иногда - к антигенам, имеющим сходные с эритроцитами детерминанты. Антитела к подобным антигенам способны вступать во взаимодействие и с неизмененными антигенами собственных эритроцитов. Неполные тепловые агглютинины являются наиболее частой разновидностью антител, способных вызывать развитие аутоиммунных гемолитических анемий. Эти антитела относятся к IgG, редко - к IgM, IgA.
Иммунные гемолитические анемии подразделяются на изоиммунные и аутоиммунные. Серологический принцип дифференциации аутоиммунных гемолитических анемий позволяет выделить формы, обусловленные неполными тепловыми агглютининами, тепловыми гемолизинами, холодовыми агглютининами, двухфазными холодовыми гемолизинами (типа Доната - Ландштейнера) и эритроопсонинами. Некоторые авторы выделяют форму гемолитической анемии с антителами против антигена нормобластов костного мозга.
По клиническому течению выделяют острые и хронические варианты.
Различают симптоматические и идиопатические аутоиммунные гемолитические анемии. Симптоматические аутоиммунные анемии возникают на фоне различных заболеваний, сопровождающихся нарушениями в иммунокомпетентной системе. Наиболее часто они встречаются при хроническом лимфолейкозе, лимфогранулематозе, остром лейкозе, системной красной волчанке, ревматоидном артрите, хронических гепатитах и циррозах печени. В тех случаях, когда появление аутоантител не удается связать с каким-либо патологическим процессом, говорят об идиопатической аутоиммунной гемолитической анемии, которая составляет около 50 % всех аутоиммунных анемий.
Образование аутоантител происходит в результате нарушения в системе иммунокомпетентных клеток, которые воспринимают эритроцитарный антиген как чужеродный и начинают вырабатывать к нему антитела. После фиксации аутоантител на эритроцитах последние захватываются клетками ретикулогистиоцитарной системы, где подвергаются агглютинации и распаду. Гемолиз эритроциов происходит главным образом в селезенке, печени, костном мозге. Аутоантитела к эритроцитам принадлежат к различным типам.
По серологическому принципу аутоиммунные гемолитические анемии делятся на несколько форм:
- анемии с неполными тепловыми агглютининами
- анемии с тепловыми гемолизинами
- анемии с полными холодовыми агглютининами
- анемии с двухфазными гемолизинами
- анемии с агглютининами против нормобластов костного мозга
Каждая из этих форм имеет некоторые особенности в клинической картине, течении и серологической диагностике. Наиболее часто встречаются анемии с неполными тепловыми агглютининами, составляющие 70 - 80 % всех аутоиммунных гемолитических анемий.
Патогенез (что происходит?) во время Аутоиммунной гемолитической анемии:
Сущность аутоиммунных процессов состоит в том, что в результате ослабления Т-супрессорной системы иммунитета, контролирующей аутоагрессию, происходит активация В-системы иммунитета, синтезирующей при этом антитела против неизмененных антигенов различных органов. В реализации аутоагрессии принимают участие также Т-лимфоциты-киллеры. Антитела - это иммуноглобулины (Ig), принадлежащие чаще всего к классу G, реже - М и А; они специфичны и направлены против определенного антигена. К IgM относятся, в частности, холодовые антитела и двухфазные гемолизины. Эритроцит, несущий на себе антитела, фагоцитируется макрофагами и в них разрушается; возможен лизис эритроцитов с участием комплемента. Антитела класса IgM могут вызвать агглютинацию эритроцитов непосредственно в кровеносном русле, а антитела класса IgG способны разрушать эритроцит только в макрофагах селезенки. Во всех случаях гемолиз эритроцитов происходит тем интенсивнее, чем больше на их поверхности находится антител. Описана гемолитическая анемия с антителами к спектрину.
Симптомы Аутоиммунной гемолитической анемии:
При остром начале аутоиммунных гемолитических анемий у больных появляются быстро нарастающая слабость, одышка и сердцебиение, боли в области сердца, иногда в пояснице, повышение температуры тела и рвота, интенсивная желтуха. При хроническом течении процесса отмечают относительно удовлетворительное самочувствие больных даже при глубокой анемии, нередко выраженную желтуху, в большинстве случаев увеличение селезенки, иногда и печени, чередование периодов обострения и ремиссии.
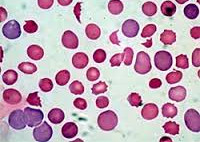
Анемия носит нормохромный, иногда гиперхромный характер, при гемолитических кризах обычно отмечается выраженный или умеренный ретикулоцитоз. В периферической крови обнаруживается макроцитоз и микросфероцитоз эритроцитов, возможно появление нормобластов. СОЭ в большинстве случаев увеличена. Содержание лейкоцитов при хронической форме бывает нормальным, при острой - встречается лейкоцитоз, достигающий иногда высоких цифр со значительным сдвигом лейкоцитарной формулы влево. Количество тромбоцитов обычно нормальное.
При синдроме Фишера - Ивенса аутоиммунная гемолитическая анемия сочетается с аутоиммунной тромбоцитопенией. В костном мозге эритропозз усилен, редко выявляются мегалобласты. У большинства больных снижена осмотическая резистентность эритроцитов, что обусловлено значительным числом микросфероцитов в периферической крови. Содержание билирубина увеличено за счет свободной фракции, повышено и содержание стеркобилина в кале.
Неполные тепловые агглютинины обнаруживаются с помощью прямой пробы Кумбса с поливалентной антиглобулиновой сывороткой. При положительном тесте с помощью антисывороток к IgG, IgM и т. д. уточняется, к какому классу иммуноглобулинов относятся выявляемые антитела. Если на поверхности эритроцитов менее 500 фиксированных молекул IgG, проба Кумбса отрицательна. Подобное явление наблюдается обычно у больных с хронической формой аутоиммунной гемолитической анемии или перенесших острый гемолиз. Кумбс-негативными оказываются и случаи, когда на эритроцитах фиксированы антитела, принадлежащие к IgA или IgM (в отношении которых поливалентная антиглобулиновая сыворотка менее активна).
Примерно в 50% случаев идиопатических аутоиммунных гемолитических анемий одновременно с появлением иммуноглобулинов, фиксированных на поверхности эритроцитов, выявляются антитела к собственным лимфоцитам.
Гемолитическая анемия, обусловленная Холодовыми агглютининами (холодовая гемагглютининовая болезнь) имеет хроническое течение. Она развивается при резком повышении титра Холодовых гемагглютининов. Различают идиопатические и симптоматические формы заболевания. Ведущим симптомом болезни является чрезмерно повышенная чувствительность к холоду, которая проявляется в виде посинения и побеления пальцев рук и ног, ушей, кончика носа. Расстройства периферического кровообращения приводят к развитию синдрома Рейно, тромбофлебитов, тромбозов и трофических изменений вплоть до акрогангрены, иногда холодовой крапивницы. Возникновение вазомоторных нарушений связано с образованием при охлаждении крупных внутрисосудистых конгломератов из агглютинированных эритроцитов с последующим спазмом сосудистой стенки. Эти изменения сочетаются с усиленным преимущественно внутриклеточным гемолизом. У части больных встречается увеличение печени и селезенки. Наблюдаются умеренно выраженная нормохромная или гиперхромная анемия, ретикулоцитоз, нормальное количество лейкоцитов и тромбоцитов, увеличение СОЭ, незначительное повышение уровня свободной фракции билирубина, высокий титр полных Холодовых агглютининов (выявляемый методом агглютинации в солевой среде), иногда признаки гемоглобинурии. Характерной является агглютинация эритроцитов in vitro, возникающая при комнатной температуре и исчезающая при подогревании. При невозможности выполнения иммунологических тестов диагностическое значение приобретает провокационная проба с охлаждением (в сыворотке крови, полученной от перетянутого жгутом пальца после опускания его в ледяную воду, определяется повышенное содержание свободного гемоглобина).
При холодовой гемагглютининовой болезни в отличие от пароксизмальной холодовой гемоглобинурии гемолитический криз и вазомоторные нарушения возникают только от переохлаждения тела и гемоглобинурия, начавшаяся в условиях холода, прекращается с переходом больного в теплое помещение.
Симптомокомплекс, свойственный холодовой гемагтлютининовой болезни, может возникнуть на фоне различных острых инфекций и некоторых форм гемобластозов. При идиопатических формах заболевания полного выздоровления не наблюдается, при симптоматических прогноз зависит главным образом от тяжести основного процесса.
Пароксизмальная холодовая гемоглобинурия относится к числу редких форм гемолитических анемий. Ею заболевают люди обоего пола, чаще дети.
У больных с пароксизмальной холодовой гемоглобинурией после пребывания на холоде могут появиться общее недомогание, головная боль, ломота в теле и другие неприятные ощущения. Вслед за этим начинается озноб, повышается температура, отмечается тошнота и рвота. Моча приобретает черную окраску. Одновременно иногда выявляются желтушность, увеличение селезенки и вазомоторные нарушения. На фоне гемолитического криза у больных обнаруживают умеренную анемию, ретикулоцитоз, повышение содержания свободной фракции билирубина, гемосидеринурию и протеинурию.
Окончательный диагноз пароксизмальной холодовой гемоглобинурии устанавливают на основании обнаруженных двухфазных гемолизинов по методу Доната - Ландштейнера. Для нее не характерна аутоагглютинация эритроцитов, постоянно наблюдающаяся при холодовой гемагтлютинацией ной болезни.
Гемолитическая анемия, обусловленная эритроопсонинами. Существование аутоопсонинов к клеткам крови является общепризнанным. При приобретенной идиопатической гемолитической анемии, циррозе печени, гипопластической анемии с гемолитическим компонентом и лейкозах обнаружен феномен аутоэритрофагоцитоза.
Приобретенная идиопатическая гемолитическая анемия, сопровождающаяся положительным феноменом аутоэритрофагоцитоза, имеет хроническое течение. Периоды ремиссии, длящиеся иногда значительное время, сменяются гемолитическим кризом, характеризующимся иктеричностью видимых слизистых оболочек, потемнением мочи, анемией, ретикулоцитозом и повышением непрямой фракции билирубина, иногда увеличением селезенки и печени.
При идиопатических и симптоматических гемолитических анемиях выявление аутоэритрофагоцитоза при отсутствии данных, указывающих на наличие других форм аутоиммунных гемолитических анемий, дает основание отнести их к гемолитической анемии, обусловленной эритроопсонинами. Диагностическая проба аутоэритрофагоцитоза проводится в прямом и непрямом вариантах.
Иммуногемолитические анемии, обусловленные применением лекарств. Различные лечебные препараты (хинин, допегит, сульфаниламиды, тетрациклин, цепорин и др.), способные вызывать гемолиз, образуют комплексы со специфическими гетероантителами, затем оседают на эритроциты и присоединяют к себе комплемент, что приводит к нарушению мембраны эритроцитов. Такой механизм медикаментозно обусловленных гемолитических анемий подтверждается обнаружением на эритроцитах больных комплемента при отсутствии на них иммуноглобулинов. Анемии характеризуются острым началом с признаками внутрисосудистого гемолиза (гемоглобинурия, ретикулоцитоз, повышение содержания свободной фракции билирубина, усиление эритропоэза). На фоне гемолитического криза иногда развивается острая почечная недостаточность.
Несколько по-иному протекают гемолитические анемии, развивающиеся при назначении пенициллина и метилдофа. Введение за сутки 15 000 и более ЕД пенициллина может привести к развитию гемолитической анемии, характеризующейся внутриклеточным гипергемолизом. Наряду с общими клинико-лабораторными признаками гемолитического синдрома обнаруживается также положительная прямая проба Кумбса (выявляемые антитела относятся к IgG). Пенициллин, связываясь с антигеном мембраны эритроцитов, образует комплекс, против которого в организме вырабатываются антитела.
При длительном применении метилдофа у части больных возникает гемолитический синдром, имеющий черты идиопатической формы аутоиммунных гемолитических анемий. Выявляемые антитела идентичны с тепловыми агглютининами и относятся к IgG.
Гемолитическая анемия, обусловленная механическими факторами, связана с разрушением эритроцитов при их прохождении через измененные сосуды или через искусственные клапаны. Эндотелий сосудов изменяется при васкулитах, злокачественной артериальной гипертензии; при этом адгезия и агрегация тромбоцитов активированы, как и система свертывания крови и образования тромбина. Развиваются распространенный стаз крови и тромбоз мелких кровеносных сосудов (ДВС-синдром) с травматизацией эритроцитов, в результате чего они фрагментируются; в мазке крови находят многочисленные фрагменты эритроцитов (шистоциты). Разрушаются эритроциты также при их прохождении через искусственные клапаны (чаще - при многоклапанной коррекции); описана гемолитическая анемия на фоне сенильного кальцинированного аортального клапана. Диагноз базируется на признаках анемии, повышении концентрации свободного билирубина в сыворотке крови, наличии шистоцитов в мазке периферической крови и симптоматике основного заболевания, ставшего причиной механического гемолиза.
Реже встречается в клинической практике гемолитическая анемия, обусловленная воздействием свинца, при отравлении кислотами, ядами змей или дефицитом витамина Е, а также внутриклеточными паразитами. Гемолитическая анемия развивается, например, после укуса змеи, случайного или намеренного (суицид) приема уксусной кислоты, при контакте с парами свинца, на фоне малярии. Анемия носит нормоцитарный, нормохромный, регенераторный характер; в сыворотке крови повышено содержание свободной фракции билирубина и железа.
Гемолитико-уремический синдром (болезнь Мошковича, синдром Гассера) может осложнять течение аутоиммунных гемолитических анемий. Заболевание аутоиммунной природы характеризуется гемолитической анемией, тромбоцитопенией, поражением почек. Отмечаются диссеминированное поражение сосудов и капилляров с вовлечением практически всех органов и систем, выраженные изменения со стороны коагулограммы, характерные для ДВС-синдрома.
Диагностика Аутоиммунной гемолитической анемии:
Диагноз аутоиммунной гемолитической анемии ставят на основании наличия клинико-гематологических признаков гемолиза и выявления на поверхности эритроцитов аутоантител с помощью пробы Кумбса (положительная почти в 60% аутоиммунного гемолиза). Дифференцируют заболевание от наследственного микросфероцитоза, гемолитических анемий, связанных с дефицитом ферментов.
В крови - нормохромная или умеренно гиперхромная анемия различной выраженности, ретикулоцитоз, нормобласты. В ряде случаев в мазках крови обнаруживаются микросфероциты. Количество лейкоцитов может повышаться при гемолитическом кризе. Число тромбоцитов, как правило, в пределах нормы, но может встречаться тромбоцитопения. СОЭ значительно увеличена. В костном мозге наблюдается выраженная гиперплазия эритроидного ростка. Содержание билирубина в крови, как правило, повышено за счет непрямого.
Лечение Аутоиммунной гемолитической анемии:
При острых формах приобретенных аутоиммунных гемолитических анемиях назначают преднизолон в суточной дозе 60-80 мг. При неэффективности она может быть увеличена до 150 мг и больше. Суточная доза препарата делится на 3 части в соотношении 3:2:1. По мере стихания гемолитического криза доза преднизолона постепенно снижается (по 2,5-5 мг в день) до половины исходной. Дальнейшее снижение дозы препарата во избежание рецидивирования гемолитического криза осуществляют по 2,5 мг в течение 4-5 дней, затем еще в меньших дозах и с большими интервалами до полной отмены препарата. При хронической аутоиммунной гемолитической анемии достаточно назначить 20-25 мг преднизолона, а по мере улучшения общего состояния больного и показателей эритропоэза переводить на поддерживающую дозу (5-10 мг). При холодовой гемагглютининовой болезни показана аналогичная терапия преднизолоном.
Спленэктомия при аутоиммунной гемолитической анемии, связанных с тепловыми агглютининами и аутоэритроопсонинами, может быть рекомендована лишь больным, у которых кортикостероидная терапия сопровождается непродолжительными ремиссиями (до 6-7 мес.) или имеется резистентность к ней. У больных гемолитической анемией, обусловленной гемолизинами, спленэктомия не предотвращает гемолитические кризы. Однако они наблюдаются реже, чем до операции, и легче купируются с помощью кортикостероидных гормонов.
При рефрактерных аутоиммунных гемолитических анемиях в сочетании с преднизолоном могут быть использованы иммунодепрессаты (6-меркаптопурин, имуран, хлорбутин, метотрексат, циклофосфамид и др.).
В стадии глубокого гемолитического криза применяют переливания эритроцитной массы, подобранной с помощью непрямой пробы Кумбса; для снижения выраженной эндогенной интоксикации назначают гемодез, полидез и другие дезинтоксикационные средства.
Лечение гемолитико-уремического синдрома, который может осложнять течение аутоиммунных гемолитических анемий, включает кортикостероидные гормоны, свежезамороженную плазму, плазмаферез, гемодиализ, трансфузии отмытых или криоконсервированных эритроцитов. Несмотря на использование комплекса современных терапевтических средств, прогноз часто неблагоприятный.
К каким докторам следует обращаться если у Вас Аутоиммунная гемолитическая анемия:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Аутоиммунной гемолитической анемии, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Сепсис представляет собой заражение крови продуктами гнилостного распада, имеющего место в организме вследствие воспалительного неадекватного леченого процесса. По сути, сепсис - это воспаление, распространившееся на весь организм. Это системный ответ на обильное пребывание в крови бактерий, независимо от места их проникновения и скопления.
Это достаточно опасное для организма состояние, стремительно идущее к летальному исходу и потому требующее немедленной и адекватной терапии.
Вопреки постоянно совершенствующимся медицинским технологиям сепсис сегодня, как и много лет назад остается актуальной проблемой. Для лечения сепсиса используются новые поколения антибактериальных препаратов, однако и это не устраняет болезнь из рейтинга причин смерти в отделениях интенсивной терапии. Примечательно, что 18% из тех, по отношению к кому применялась интенсивная терапия лечения в условиях медицинского учреждения, сталкивались с развитием сепсиса, еще в 63% случаев он сопровождал внутрибольничные инфекции.
К инфекциям, распространение которых по организму рискует завершиться сепсисом, относят:
- бактерии
- стафилококк,
- стрептококк,
- пневмококк,
- синегнойная палочка,
- клебсиелла,
- кандида,
- герпес,
- токсоплазмоз.
Для того чтобы инфекционный процесс в организме перерос в сепсис необходимо сочетание трех обстоятельств:
- наличие возбудителя инфекции;
- отрицательное состояние первичного очага инфекции;
- соответственная реактивность организма.
Риск развития сепсиса обуславливается не столько свойствами инфекции, сколько ее концентрацией в первичном очаге, распространением отсюда вглубь организма и ток крови. Непоследнюю роль играет и резистентность организма, которая легко подавляется под воздействием неблагоприятных факторов. Среди последних:
- любые заболевания
- эндокринные и обменные, в частности сахарный диабет,
- онкологические,
- гематологические,
- иммунологические,
- низкое содержание белка,
- хронические гиповитаминозы,
Механизм развития сепсиса берет начало с того, что из первичного очага инфицирования через кровеносные или лимфатические сосуды происходит, соответсвенно, гематогенная или лимфогенная диссеминация инфекции. Следственно, происходит образование вторичных септических очагов, так называемых метастазов, из которых инфекция также распространяется в кровь. Каковой будет локализация метастазов, зависит от типа возбудителя. Гнойники могут образовываться в любых внутренних органах.
![сепсис]()
При сепсисе случаются органно-системные повреждения, чем продолжается механизм заболевания. Это случается в силу отсутствия контроля над распространением провоспалительных медиаторов из первичного очага инфекции. Затем происходит их активация под влиянием макрофагов, нейтрофилов, лимфоцитов и других клеток в любых органах и тканях; повторно выделяются те же провоспалительные медиаторы и повреждается эндотелий.
Разновидности сепсиса
Чаще всего сепсис случается после воспалительного процесса конкретной локализации. Однако не менее распространен и раневой сепсис. И тот, и другой развивается на фоне сниженной резистентности макроорганизма к распространяющейся патогенной микрофлоре и на фоне ослабленного иммунитета. Упадок защитных способностей организма вследствие воспаления, раны, операционного вмешательства или тяжелого заболевания нередко дополняется крупной кровопотерей и недостаточным питанием.
Частыми источниками септической инфекции медики называются нагноения при выше описанных условиях. Нечто подобное способно развиться и при местных гнойных заболеваниях как то фурункул, карбункул, флегмона.
Зависимо от первичного очага сепсиса и его происхождения различают:
- хирургический сепсис - вследствие нагноения в ране, локализированных гнойниках;
- акушерско-гинекологический сепсис - вследствие родов или абортов, случившихся в нестерильных условиях, когда микротрещины или разрывы в родовых путях становятся "входными воротами" для инфекции;
- урологический сепсис - вследствие гнойных процессов и отяжеленных воспалений в мочеполовых органах, что обычно сопровождается и застоем, инфицированием мочи;
- риногенный, тонзилогенный, отогенный сепсис - редкие формы заражения крови, которые берут начало с локализации инфекции в полости рта, носу, околоносовых пазухах, носоглотке, ухе; для того чтобы течение инфекции обрело столь тяжелую форму необходимым условием становится тромбофлебит кавернозного синуса или тромбоз вен клетчатки глазницы, тромбофлебит сигмовидного и каменистого синусов.
Кроме того, выделяют септичемическую и септикопиемическую разновидность сепсиса:
- септицемическая - не сопровождается образованием метастатических очагов гнойной инфекции, однако склонная к перерастанию в септикопиемическую;
- септикопиемическую - характеризуется образованием метастатических очагов гнойной инфекции, откуда происходит все более глубокое распространению инфекции.
Заражение крови может протекать в четырех формах:
- молниеносная - несколько суток;
- острая - 5-7 суток;
- подострая - менее 6 недель;
- хроническая - более 6 недель.
Симптомы сепсиса
Коварство заболевания заключается в риске его симптомов оказаться размытыми. Объясняется это тем, что в разгар первичного заболевания свойства возбудителей поддаются изменениям из-за массивной антибиотикотерапии, несколько угнетаются, однако не всегда сам возбудитель уничтожается. Такое латентное его пребывание в организме чревато дальнейшим распространением даже при относительно невысокой температуре тела. Хотя именно устоявшаяся лихорадка гектического типа считается отличительным признаком сепсиса при наличии предпосылок к тому, то есть выше перечисленных факторов. Кроме нее возможны:
- обильное потоотделение при снижении температуры тела,
- в соответствии со скачками температуры скачкообразным становится и пульс,
- ознобы и головная боль, общая слабость,
- рвота и понос,
- утрата аппетита,
- обезвоживание и стремительная утрата веса,
- землистый цвет кожных покровов (если нарушается функция печени, кожа желтеет), утрата ими эластичности и упругости;
- образование флегмон и абсцессов различной локализации.
Возможны изменения психоэмоционального статуса вплоть до грубых общемозговых расстройств - коматозное состояние. В последующем присоединяются воспалительные изменения со стороны внутренних органов: почек, эндокарда, печени, кишечника, селезенки.
При сепсисе наблюдается тахикардия (более 90 ударов в минуту) и тахипноэ (более 20 вдохов в минуту).
Диагностика сепсиса
Заподозрить сепсис стоит если при инфекционно-воспалительном заболевании, вследствие ранения или операционного вмешательства лихорадка держится более 5 дней, и скачки температуры становятся немотивированными. Лабораторные анализы крови показывают:
- лейкоцитоз;
- лейкопению;
- палочко-ядерный сдвиг влево;
- тромбоцитопению.
Положительные результаты бактериологического исследования крови - обнаружение гемокультуры. Для получения достоверного результата необходим 3-кратный забор крови в объеме 20-30 мл. с интервалами 1 ч. во время подъема температуры по возможности до начала антибиотикотерапии.
При диагностике на предмет наличия сепсиса важно различить:
- синдром системного воспалительного ответа - системная реакция организма на воздействие различных сильных раздражителей (инфекция, травма, операция и т.д.);
- сепсис - та же совокупность изменений, что и при ССВО, но дополнительно обнаруживаются патогенны в одной или нескольких тканях, признаки перитонита, пурпуры, пневмонии и пр.;
- отяжеленный сепсис - клиническая картина сепсиса дополняется гипотензией и гипоперфузией, нарушением функций отдельных органов, например, печени или почек;
- септический шок - тяжелая форма заражения формы, когда нарушение функций не удается восстановить даже интенсивной терапией и реанимирующими мероприятиями; отличается высокой летальностью.
Лечение сепсиса
Лечение сепсиса представляет собой комплекс процедур, которые проводятся преимущественно в условиях медицинского учреждения. Так называемая интенсивная терапия состоит из мер, нацеленных на санацию очага инфекции, и дополняется антибиотикотерапией, призванной устранить инфекцию в крови. Отмечается, что сохранение жизни больного и устранение органных дисфункций не будет возможным без назначения интенсивной терапии.
Этиотропное лечение сепсиса должно быть не просто своевременным, а максимально ранним. Изначально препараты назначаются в столь высоких дозировках, чтобы обеспечить достаточную концентрацию действующего вещества в зараженной крови, а также в очагах инфекции. Этиотропная терапия может быть эффективной лишь при условии выявления возбудителя, конкретной инфекции, а также его чувствительности к выбираемым антибиотикам. Верный выбор антибиотика лежит в основе качественного лечения сепсиса.
Этиотропная терапия длится вплоть до достижения устойчивой положительной динамики состояния пациента и исчезновения основных симптомов инфекции. Если этого не происходит в течение первой недели лечения, необходимо провести дополнительное обследование для выявления осложнений или очага инфекции другой локализации.
Если установить первичный очаг инфекции не удается, равно как и выявить тип возбудителя, как минимум необходимо определить условия возникновения сепсиса - вследствие пребывания пациента в клинических условиях и развития инфекции на фоне определенной болезни (госпитальная форма) или внебольничная.
Как показывает практика, внебольничный сепсис поддается лечению:
- нефалоспоринами 3-го и 4-го поколения,
- фторхинолонами - благодаря широкому спектру действия являются препаратами выбора при лечении инфекций неизвестной этиологии
Госпитальная форма сепсиса лечится:
- карбапенемами - препаратами с широким спектром действия, к которым внутрибольничные штаммы грамнегативных бактерий низкорезистентны.
Лечение разных форм сепсиса определяется его происхождением:
- при анаэробном сепсисе применяются метронидазол, линкомицин, клиндамицин;
- для лечения сепсиса, вызванного грамотрицательными бактериями, уместен препарат с моноклональными антителами против эндотоксина грамотрицательных бактерий;
- сепсис вследствие распространения грибковой инфекции лечится амфотерными оксидами и флуконазолом;
- при стафилококковом сепсисе эффективен противостафилококковый иммуноглобулин, а также внутривенное введение противостафилококковой плазмы;
- когда инфекционный процесс достиг уровня генерализированной септической болезни, назначают ацикловир, ганцикловир, фамцикловир.
Параллельно с этиотропными средствами целесообразно использование пассивной иммунотерапии, среди разнообразия которых предпочтение отдается иммуноглобулину, идеально подходящему для внутривенного введения.
Ведущую роль в лечении сепсиса любой локализации играет инфузионная терапия. Она относится к первичным мероприятиям поддержания гемодинамики и сердечного выброса. Основными задачами, которые стоят перед врачом и которые удается решить посредством инфузионной терапии, оказываются:
- восстановление адекватной тканевой перфузии,
- нормализация клеточного метаболизма,
- коррекция расстройств гомеостаза,
- снижение концентрации медиаторов септического каскада и токсических метаболитов.
Использование этого алгоритма действий способствует выживаемости при септическом шоке и тяжелом сепсисе. Объем инфузионной терапии рекомендуют поддерживать на таком уровне, чтобы давление заклинивания в легочных капиллярах не превышало коллоидно-онкотическое давление плазмы. Это позволяет исключить риск отека легких и увеличить сердечный выброс.
Инфузионная терапия - это составляющая общей целенаправленной интенсивной терапии сепсиса. Для инфузий применяют кристаллоидные и коллоидные инфузионные растворы. Отмечается, что адекватная коррекция венозного возврата и уровня перенапряжения требует вдвое, а порой и вчетверо большего введения кристаллоидов, нежели коллоидов. Инфузия кристаллоидов более связана с риском отека тканей, а их гемодинамический эффект менее продолжителен, чем у коллоидов. Вместе с тем кристаллоиды не влияют на коагуляционный потенциал и не вызывают анафилактических реакций. В связи с этим выбор того или иного раствора диктуется особенностями течения сепсиса в конкретном случае:
- степенью гиповолемии,
- фазой ДВС-синдрома,
- наличием периферических отеков,
- уровнем альбумина крови,
- тяжестью острого легочного повреждения.
При выраженном дефиците объема циркуляционной крови показаны плазмозаменители:
- декстраны,
- гидроксиэтилкрохмал - имеет потенциальное преимущество перед декстранами вследствие низкого риска утечки через мембрану и отсутствия клинически значимого влияния на гемостаз.
В ранние сроки в связи с наличием тромбогеморрагического синдрома назначают гепарин, введение которого проводят под контролем клинических проявлений и коагулограммы.
В случае развития тяжелой степени сепсиса проноз неблагоприятен, оправданным становится гемодиализ. Для профилактики стрессовых язв в пищеварительном канале обязательны ингибиторы протонной помпы или блокаторы гистаминорецепторов. Назначают также препараты, ингибирующие протеолиз.
Иммунные гемолитические анемии – группа заболеваний, обусловленных повышенным разрушением эритроцитов вследствие выработки антител против неизмененных красных кровяных телец или гаптенов, появившихся на мембране эритроцита. Различают изоиммунные, трансиммунные, гетерогенные и аутоиммунные гемолитические анемии. Клинические признаки: бледность или желтушность кожных покровов, умеренное увеличение печени и селезенки, боли в поясничной области, одышка и другие симптомы. Диагностика основана на изучении клинических данных, результатов лабораторных и инструментальных исследований. Лечение: гемотрансфузии, введение препаратов крови и кортикостероидов, иногда – спленэктомия.
![Иммунные гемолитические анемии]()
Общие сведения
Иммунные гемолитические анемии – группа заболеваний, характеризующихся повреждением и преждевременной гибелью эритроцитов или эритрокариоцитов в связи с развитием иммунной реакции с участием IgG и IgM или иммунных лимфоцитов. Основные факторы, вызывающие разрушение эритроцитов – аутоиммунный процесс, гемотрансфузионные осложнения, эритробластоз плода и гемолиз, обусловленный действием некоторых лекарственных средств.
Гемолиз может происходить в самом кровеносном русле или вне сосудов: в печени, селезенке, костном мозге. В результате массовой гибели красных кровяных телец развиваются анемический и желтушный синдромы, свидетельствующие о нарушении функции печени, почек, дыхательной системы, системы кровообращения, других органов и систем организма. По данным статистики, распространенность иммунных гемолитических анемий составляет примерно 1 случай на 70-80 тысяч населения.
![Иммунные гемолитические анемии]()
Причины иммунных гемолитических анемий
Возникновение этой группы заболеваний связано с воздействием различных неблагоприятных факторов внешней и внутренней среды, приводящих к развитию иммунных реакций против собственных эритроцитов. Чаще всего встречается аутоиммунный механизм, при котором происходит выработка антител против неизмененных естественных антигенов мембраны эритроцитов, находящихся в кровяном русле, или их предшественников – эритрокариоцитов костного мозга. Первичный причинный фактор, вызывающий разрушение эритроцитов, неизвестен (идиопатическая форма).
При вторичных анемиях патологический процесс развивается на фоне хронического лимфолейкоза, лимфомы, антифосфолипидного синдрома или иммунодефицитных состояний. Чаще встречается тепловая форма аутоиммунной анемии, при которой внутренняя среда организма имеет нормальные температурные параметры, а на эритроцитах располагаются иммуноглобулины класса G и компоненты комплемента C3 и C4. Красные кровяные тельца разрушаются макрофагами в печени и селезенке. Менее распространенная холодовая форма может быть идиопатической или вторичной, связанной с инфекцией (инфекционным мононуклеозом и микоплазменной пневмонией), переохлаждением и лимфопролиферативными заболеваниями у больных старше 60 лет. Реакция антиген-антитело с гемолизом развивается в периферическом кровяном русле, где температура опускается ниже 32 градусов.
Иммунная гемолитическая анемия может возникать при фиксации на мембране эритроцита фрагмента, имеющего лекарственное, вирусное или бактериальное происхождение (гетероиммунная форма). Образовавшиеся гаптены превращают красные кровяные тельца в чужеродные клетки-мишени для иммунной системы, что в итоге приводит к гемолизу. Чаще всего такую реакцию вызывают антибиотики из группы пенициллинов, цефалоспоринов и тетрациклинов, противотуберкулезные препараты, анальгетики и антиаритмические средства.
Изоиммунная форма встречается при несовместимости крови матери и плода по группе крови или резус-фактору. При этом антиэритроцитарные антитела матери через плаценту проникают к плоду и вызывают разрушение эритроцитов. Подобный механизм наблюдается и при переливании (гемотрансфузии) несовместимой крови от донора пациенту.
Классификация иммунных гемолитических анемий
Выделяют изоиммунные, трансиммунные, гетерогенные и аутоиммунные гемолитические анемии.
- К изоиммунным вариантам заболевания относятся посттрансфузионные осложнения, связанные с непереносимостью крови донора или неправильным соблюдением процедуры трансфузии, а также гемолитическая болезнь новорожденных.
- При трансиммунных анемиях гемолиз возникает при попадании к плоду через плаценту антител от матери, болеющей аутоиммунной анемией.
- Гетероиммунная (гаптеновая) анемия – результат изменения мембраны эритроцита при воздействии вирусов или лекарственных препаратов.
- Аутоиммунные гемолитические анемии (с тепловыми и холодовыми агглютининами).
Симптомы иммунных гемолитических анемий
Болезнь чаще начинается остро: повышается температура тела, появляется озноб, головная боль и головокружение, одышка, боли в эпигастральной области и пояснице. Кожные покровы становятся бледными, затем желтушными, могут появиться геморрагии, увеличивается селезенка, печень, цвет мочи становится темным.
При холодовой форме иммунной гемолитической анемии нередко нарушается периферическое кровообращение с развитием синдрома Рейно, посинением и отечностью кожных покровов кистей рук, лица, ушных раковин. В некоторых случаях нарушение кровоснабжения тканей конечностей может привести к развитию гангрены пальцев стоп.
Тяжелое течение эритробластоза плода характеризуется развитием ядерной желтухи с поражением центральной нервной системы – билирубиновой энцефалопатии. При этом отмечается вялость, заторможенность, снижение аппетита, частые срыгивания, судорожный синдром. При пальпации обнаруживают увеличение селезенки, печени, периферических лимфоузлов.
Диагностика иммунных гемолитических анемий
Чтобы установить правильный диагноз, определить форму заболевания, необходимо тщательное обследование пациента со сбором анамнеза, проведением клинического физикального осмотра врачом-гематологом, аллергологом-иммунологом, инфекционистом, ревматологом и другими специалистами. Уже на этапе осмотра можно обнаружить бледность, желтушность кожных покровов и слизистых, пропальпировать увеличенную селезенку и печень. Выраженность спленомегалии и гепатомегалии уточняется при проведении ультразвукового исследования (УЗИ печени и селезенки).
Лабораторная диагностика подтверждает наличие нормо- или гипохромной (реже – гиперхромной) анемии, ретикулоцитоза, увеличение СОЭ, гипербилирубинемию. В анализе мочи может выявляться протеинурия, уробилинемия, гемоглобинурия. При исследовании пунктата костного мозга обнаруживаются признаки гиперплазии за счет активации эритропоэза. При гемолитической болезни новорожденных выявляется выраженный эритробластоз (100-150 тысяч в 1 мкл).
Диагноз аутоиммунной гемолитической анемии подтверждается положительной прямой пробой Кумбса (прямым антиглобулиновым тестом) или полибреновым тестом (сенсибилизированная проба Кумбса). Дифференциальная диагностика проводится с другими иммунными болезнями, различными формами анемий, гемобластозами, тяжелыми отравлениями, болезнями печени и почек.
Лечение иммунных гемолитических анемий
Лечебная тактика различается при различных формах болезни. При аутоиммунном характере гемолиза с тепловыми антигенами проводится введение высоких доз иммуноглобулина, кортикостероидов, иногда - циклофосфамида и других иммуносупрессивных препаратов. Возможно применение плазмафереза. При неэффективности консервативной терапии рекомендуется проведение спленэктомии. При холодовой иммунной гемолитической анемии используется введение моноклональных антител (ритуксимаба), плазмаферез, трансфузия индивидуально подобранных, отмытых и подогретых эритроцитов.
При эритробластозе плода проводится дезинтоксикационная терапия, переливание крови или эритроцитарной массы. При пострансфузионных осложнениях необходимо проведение неотложных противошоковых мероприятий, борьба с синдромом диссеминированного внутрисосудистого свертывания.
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
МКБ-10
![Гемолитическая анемия]()
![Гемолитическая анемия]()
![Аутоиммунная гемолитическая анемия]()
Общие сведения
Гемолитическая анемия (ГА) - малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
![Гемолитическая анемия]()
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
![Гемолитическая анемия]()
Патогенез
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии- анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические - анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом - обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.
![Аутоиммунная гемолитическая анемия]()
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
4. Клинические рекомендации по диагностике и лечению аутоиммунных гемолитический анемий/ Цветаева Н.В., Никулина О.Ф. - 2014.
Читайте также: