Сепсис и пониженные тромбоциты
Обновлено: 19.04.2024
Сепсис — это самая тяжелая, генерализованная форма инфекционного процесса, которая развивается либо при высокой патогенности возбудителя, либо при недостаточном ответе защитных систем организма. Международным консенсусом рекомендовано использовать следующее определение: сепсис — это опасная для жизни дисфункция внутренних органов, вызванная нарушением регуляции ответа организма на инфекцию. При сепсисе наблюдается общий интоксикационный синдром, тромбогеморрагический синдром (кровоизлияния) и поражение внутренних органов.
Причины возникновения сепсиса
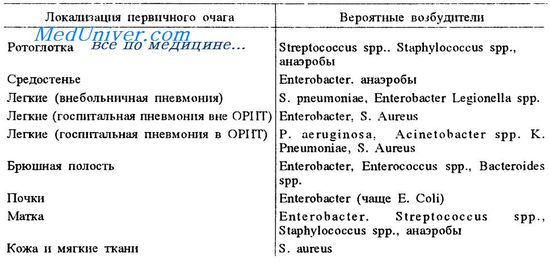
Сепсис может быть вызван большинством известных в эпидемиологии микроорганизмов, среди которых бактерии, вирусы (в том числе сезонные вирусы гриппа), грибы, паразиты. Обычно возбудитель инфекции попадает в организм из внешней среды. При определенных условиях, например, при иммунодефицитах, заболевание может развиться от естественной, условно-патогенной флоры организма, которая в норме присутствует у каждого человека. [1]
Само по себе наличие инфекции еще не является гарантией развития сепсиса. Необходимы дополнительные условия, которые приведут к генерализации процесса и патологическому ответу организма. Вероятность таких событий увеличивается в следующих случаях:
- Возраст больного старше 75 лет.
- Выполнение операций или инвазивных процедур.
- Наличие травм и ожогов.
- Нарушения иммунной системы — СПИД, онкологические заболевания, проведение химиотерапии, необходимость применения иммуносупрессивной терапии (например, после трансплантации органов), необходимость приема высоких доз глюкокортикостероидов.
- Долгое лечение в условиях стационара.
- Наличие катетеров, канюль, зондов и других инвазивных устройств.
- Беременность и роды.
- Наличие химической зависимости — алкоголизм, наркомания.
- Наличие хронических заболеваний — хроническая почечная недостаточность, дыхательная недостаточность, сахарный диабет и многое другое.
Виды сепсиса
В зависимости от расположения первичного очага инфекции, выделяют первичный (криптогенный) и вторичный сепсис. При первичном, очаг инфекции установить не удается. При вторичном сепсисе таковой очаг имеется. В зависимости от его локализации, выделяют:
- Чрескожный сепсис. Первичный очаг находится на коже, это могут быть раны, ожоги, гнойные заболевания кожи (гнойные абсцессы, фурункулы и др).
- Одонтогенный сепсис. Причиной его развития может стать кариес, пульпит, периодонтит, челюстной остеомиелит и другие заболевания зубочелюстной системы.
- Отогенный сепсис. Первичным очагом является воспалительный процесс в ухе. Как правило, это гнойные отиты среднего уха.
- Гинекологический сепсис — первичный очаг располагается в половых органах женщины.
- Хирургический сепсис — развивается в результате инфицирования хирургической раны или при инфицировании во время проведения инвазивных процедур. 2
Первые признаки и симптомы сепсиса
Определить первые признаки сепсиса бывает непросто, даже для специалистов. Это связано с тем, что, во-первых, этот синдром развивается уже на фоне существующей патологии, которая может иметь самую разнообразную симптоматику, а во-вторых, при наличии иммунодефицита, клиническая картина может быть стертой. Тем не менее, есть некоторые симптомы, которые позволяют заподозрить начало сепсиса:
- Повышение или понижение температуры тела — выше 38 и ниже 36 градусов.
- Снижение давления ниже рабочего значения.
- Увеличение частоты пульса.
- Увеличение частоты дыхательных движений (одышка).
- Снижение количества выделенной мочи.
- Общая слабость, изможденность.
- Нарушение сознания или поведения.
Особое внимание возникновению этих признаков уделяют у хронических больных, при наличии лейкопении, онкологических заболеваний и у пациентов, перенесших травмы или хирургические вмешательства. При возникновении хотя бы 2-3 таких симптомов, следует немедленно связаться с врачом.
Диагностика сепсиса
Своевременная диагностика сепсиса имеет решающее значение для выздоровления больного. Чем раньше начато лечение, тем больше шансов на успех. Диагноз выставляется на основании данных клинического осмотра и лабораторно-инструментального обследования.

Клинические критерии:
- Температура тела более 38 градусов или менее 36 градусов.
- Частота сердечных сокращений более 90 или превышает возрастную норму.
- Частота дыхания более 20 раз в минуту.
- Наличие отеков.
- Спутанность сознания.
- Повышение уровня глюкозы в крови более 7,7 мкмоль/л при отсутствии диабета.
- Нарушение гемодинамических процессов — снижение систолического артериального давления менее 90 мм.рт.ст, либо его снижение более чем на 40 мм.рт.ст. от привычного значения. [5,6]
Лабораторные критерии
Проводят общий анализ крови с подсчетом лейкоцитарной формулы и определением количества тромбоцитов. При сепсисе определяется лейкоцитоз более 12*109/л или лейкопения, когда количество лейкоцитов ниже 4*109/л. Также отмечается выход в кровяное русло незрелых форм гранулоцитов и уменьшение количества тромбоцитов.
В биохимическом анализе крови отмечается увеличение С-реактивного белка, креатинина, билирубина. Но это неспецифичные признаки, которые могут наблюдаться и при других заболеваниях. Поэтому продолжается поиск более информативных методов диагностики.
На сегодняшний день главными таким маркерами являются прокальцитонин, пресепсин, СРБ. По данным этого лабораторного показателя устанавливают диагноз и отслеживают динамику заболевания.
Бактериологический посев
Обнаружение в крови микроорганизмов является важным, но не обязательным проявлением сепсиса. Даже при использовании самых современных диагностических систем и при тщательном соблюдении техники забора материала, выделить возбудитель из крови удается менее, чем в половине случаев. Поэтому отрицательный результат бакпосева при наличии клинической симптоматики не должен расцениваться как отсутствие сепсиса, и, наоборот, выделение микроорганизмов из крови при отсутствии симптоматики, должно расцениваться как транзиторная бактериемия или вирусемия, но не как сепсис.
Тем не менее, биологические исследования в любом случае должны присутствовать, как один из этапов диагностики сепсиса по следующим причинам:
- Возможность определения этиологии возбудителя.
- Подбор или смена режимов антибиотикотерапии.
- Контроль эффективности лечения.
- В некоторых случаях позволяет определить источник инфекции, например, катетер-связанная инфекция, эндокардиты и др.
Стадии развития сепсиса
Развитие и течение септического процесса индивидуально и зависит как от свойств возбудителя, так и от особенностей организма больного. Тем не менее, можно выделить несколько фаз течения данного заболевания:
Что касается продолжительности заболевания, то здесь все опять же индивидуально. У одних, более сильных пациентов, сепсис купируется в течение 3-4 недель, у других он может протекать годами, периодически стихая и вспыхивая.
Кроме того, при диагностике сепсиса выделяют следующие состояния.
Токсико-резорбтивная лихорадка
Токсико-резорбтивная лихорадка — состояние, которое развивается при всасывании бактериальных токсинов или продуктов тканевого распада из первичного патологического очага. Как правило, это характерно для бактериальных инфекций ран, катетеров и др. Характерны общие типовые синдромы, которые сопровождают инфекционные процессы — лихорадка, изменения в общем анализе крови и мочи (лейкоцитоз, протеинурия). При ликвидации первичного очага, состояние пациента стабилизируется.
Септицемия
Септицемия — форма сепсиса, при которой наблюдается выраженный интоксикационный синдром, гиперэргия (повышенная реакционность организма) и быстрое течение. Септические очаги либо выражены минимально, либо отсутствуют. Такая форма сепсиса больше характерна для детей первых лет жизни. Для клинической картины больше характерны общие проявления:
- Гемолитическая желтуха, сопровождающаяся пожелтением кожных покровов и склер.
- Сыпь. Сначала она проявляется в виде мелких розовых точек, которые разрастаются и сливаются между собой, образуя бледно-розовые или пурпурные пятна.
- У некоторых пациентов элементы сыпи могут покрываться пузырями или язвами. При глубоких поражениях может затрагиваться подкожная жировая клетчатка с развитием флегмонозного воспаления.
- Геморрагический синдром — кровоизлияния во внутренние органы.
Септикопиемия
Септикопиемия — это форма сепсиса, при которой в организме, помимо общей интоксикации, начинают возникать метастатические абсцессы в органах и тканях, которые являются результатом бактериальной эмболии. Чаще всего первые абсцессы обнаруживаются в легких, а затем процесс распространяется на другие органы: печень, печень, сердце, менингиальные оболочки, синовиальные оболочки. Абсцессы могут прорваться и вызвать развитие эмпиемы плевры, флегмоны, перитонита и др.
Клиническая классификация сепсиса по стадиям
Клиническое стадирование сепсиса играет важную роль, так как оно помогает врачам выбирать оптимальную тактику и добиваться наилучших из возможных в каждом конкретном случае результатов лечения. Выделяют следующие стадии:
- Сепсис диагностируют, когда внутренняя температура (измеряется на слизистых оболочках) тела поднимается больше 38 градусов или опускается ниже 36 градусов, частота сердечных сокращений 90 в минуту и более, частота дыхания 20 в минуту и более, либо парциальное давление углекислого газа в артериальной крови (PaCO2) опускается ниже 32 мм. рт. ст. При этом уровень лейкоцитов в крови поднимается более 12000/мкл или опускается ниже ≤4000/мкл, либо среди них появляется более 10% незрелых форм.
- Тяжелый сепсис – сепсис, который сочетается с острой органной дисфункцией.
- Септический шок диагностируют, когда у пациента имеется стойкая гипотензия (снижение артериального давления) или гипоперфузия (недостаточное кровоснабжение) тканей, несмотря на адекватную инфузионную терапию.
- Синдром полиорганной дисфункции – состояние, при котором у больного имеется органная дисфункция (нарушение работы внутренних органов), и его гомеостаз не удается поддерживать без медикаментозного вмешательства.
Лечение сепсиса
Лечение сепсиса базируется на трех принципах:
Санация первичного очага. Это может быть достигнуто с помощью хирургического вмешательства и/или адекватной антибактериальной терапии. При обнаружении первичного очага, который можно санировать хирургически, необходимо провести это как можно скорее. Это может быть вскрытие и дренирование абсцессов, удаление инфицированных инвазивных устройств (катетеры, имплантаты и др.), дренирование и лаваж брюшной полости, и др.
Антимикробная терапия является еще одним краеугольным камнем лечения сепсиса, при этом важна ее своевременность и адекватность. Например, при развитии септического шока, препараты должны быть введены в течение часа от начала симптомов. При этом препарат должен охватывать весь спектр предполагаемых возбудителей и, что немаловажно, проникать в первичный инфекционный очаг. При необходимости назначения комбинированной терапии из нескольких препаратов, их применяют не более 5 дней, после чего должны быть получены данные биологических методов исследования и произведена коррекция схемы лечения. [7]
Обеспечение транспорта кислорода — все клинические проявления сепсиса усугубляются в условиях недостатка кислорода, поэтому очень важно контролировать этот процесс. Для этого проводят:
- Гемодинамическую поддержку — вливание растворов, которые обеспечивают восполнение водно-электролитного баланса, назначаются препараты, поддерживающие артериальное давление и др.
- Респираторную поддержку — искусственную вентиляцию легких, кислородные маски и др.
Коррекция метаболических нарушений
Одним из эффективных способов лечения сепсиса является селективная сорбция на колонках TORAYMYXIN. Данная методика успешно применяется во многих странах мира. В настоящее время такое лечение прошли более 200 тысяч пациентов с септическим шоком и тяжелыми формами сепсиса. Эффективность и безопасность технологии подтверждена в ходе клинических исследований. [11,12]

Осложнения при сепсисе
- Осложнения со стороны дыхательной системы. Нарушение вентиляции легких приводит к повышению аэрогематического барьера и, как следствие, пропотеванию жидкости в альвеолы. Это еще больше нарушает газообмен и приводит к развитию шокового легкого и респираторного дистресс-синдрома, который усугубляется усталостью дыхательных мышц.
- Осложнения со стороны почек. Наблюдается снижение фильтрационной функции почек из-за повреждения канальцев, развившееся в результате снижения давления. Сопровождается резким уменьшением выделяемой мочи, протеинурией, азотемией.
- Нарушение свертывания крови из-за падения уровня тромбоцитов и развития ДВС-синдрома — грозного состояния, при котором сначала происходит массовое образование тромбов в кровеносном русле, а затем массивные кровотечения из-за недостаточности кровесвертывающих факторов.
- Неврологические осложнения. Длительно протекающий сепсис может привести к развитию полинейропатии, которая, в частности, приводит к ослаблению дыхательной мускулатуры и невозможности самостоятельного дыхания.
- Септический шок — самое тяжелое проявление сепсиса, сопровождающееся стойким снижением кровяного давления, которое сложно восстановить даже с применением инфузионной терапии и вазопрессоров. Он развивается из-за выхода жидкости из кровеносных сосудов и из-за общего обезвоживания. При этом, нарушения настолько тяжелые, что могут привести к гибели пациента от полиорганной недостаточности.[13]
Прогноз при сепсисе
Прогноз при сепсисе очень осторожный. На возможность выздоровления оказывают влияние особенности этиологической микрофлоры, общее состояние пациента в начале заболевания, а также своевременность и адекватность проводимого лечения. Наиболее неблагоприятно сепсис протекает у людей старческого возраста и у ослабленных пациентов, имеющих сопутствующие заболевания.
В целом в крупных клиниках летальность при данном состоянии составляет 30-40%. При развитии септического шока, ситуация усугубляется и согласно некоторым данным, в таком случае от него погибает до 90% больных.
Сепсис. ДВС синдром при сепсисе
Активация при сепсисе системы гемостаза обусловлена эндото-ксемией и бактериальными липополисахаридами. Центральным медиатором сепсиса является фактор некроза опухоли (TNF—tumor necrosis factor), который вырабатывается в ответ на поступление эндотоксина. Вторичный медиатор — интерлейкин-1, концентрация которого резко возрастает после поступления в сосудистое русло TNF. Вслед за выработкой этих провоспалительных медиаторов происходит повышение уровня интерлейкина-6, который активизирует синтез в печени белков острой фазы.
Полисахариды грампозитивных бактерий также могут посредством цитокинов активизировать систему гемостаза, что резко увеличивает риск ДВС.
Иногда ДВС индуцируется фулминантной вирусной инфекцией. Тяжело протекающие инфекции сопровождаются обычно лейкоцитозом. Нейтрофильные лейкоциты вырабатывают ряд субстанций (в том числе нейтрофильную эластазу), которые вызывают дефицит AT III, а гепаринотерапия усугубляет этот процесс.
Следует иметь в виду, что применение бактерицидных антибиотиков увеличивает риск возникновения септического шока вследствие массивного поступления в русло эндотоксинов из разрушенных бактерий. Молниеносные формы сепсиса возникают на фоне иммуносупрессивнои терапии. Смертность при септическом шоке достигает 40 %. Септический шок, рефракторный к терапии, быстро, в течение нескольких часов приводит к полиорганной недостаточности и ДВС-синдрому.
В ряде случаев не удается установить возбудителя инфекции в гемокультуре больных сепсисом. Концепция системного воспалительного ответа предполагает наличие сепсиса при отсутствии (невозможности определения) возбудителя в крови в случаях выраженной характерной клиники:
• фебрильная температура (> 38 °С) или гипотермия (> 35,5 °С встречается у 10 % больных);
• тахикардия;
• тахипноэ, гипервентиляция с респираторным алкалозом. Для лабораторных показателей характерно:
• лейкоцитоз > 15 000 /мм3 или лейкопения > 3500 /мм3;
• сдвиг лейкоцитарной формулы влево, токсическая зернистость;
• изменения коагуляции — снижение числа тромбоцитов более чем на 30 % за 24 ч, снижение AT III;
• метаболические сдвиги — гиперлактатемия, гипергликемия, гипофосфатемия.
Для сепсиса характерен дефицит системы естественных антикоагулянтов, причем снижение AT III происходит ранее основных клинических проявлений сепсиса. При снижении содержания AT III ниже 60 % смертность резко возрастает.
Причины сепсиса
Количество тромбоцитов при сепсисе снижается вследствие тромбоцитопении потребления — тромбоциты связываются с фибрином, адгезируют к поврежденному эндотелию, секвестрируются в легких и печени. Тромбоцитопатия — снижение агрегирующих свойств тромбоцитов — может быть вызвана длительным применением антибиотиков.
Лечение сепсиса, септического шока и ДВС-синдрома должно носить комплексный характер и основываться на следующих принципах:
1. Хирургическое лечение очага инфекции (санация и дренирование).
2. Антибиотикотерапия, основанная на идентификации возбудителя и определении его чувствительности к соответствующей группе антибиотиков.
3. Адекватная оксигенация — необходима ранняя ИВЛ в различных режимах.
4. Инфузионная терапия — высока опасность гипергидратации, особенно в условиях тканевой гипоксии и повышения капиллярной проницаемости. Трансфузия эритроцитов не только повышает кислородтранспортную функцию крови, но и обеспечивает эффективность трансфузионной терапии. Критическим для септических больных считается содержание гемоглобина менее 70—80 г/л. Предпочтительна трансфузия свежезаготовленной эритроцитной массы.
5. Применение катехоламинов. Содержание фактора некроза опухоли (TNF) при сепсисе значительно возрастает (TNF — медиатор, обладающий выраженным кардиодепрессйвным действием).
6. Препараты AT III.
В 1985 году В. Blauhut опубликовал результат клинических исследований по применению препарата AT III (кубернина HS). У пациентов с клиникой септического шока и ДВС, которым был назначен кубернин HS, отмечено ускоренное восстановление показателей коагуляции, хотя и не было отмечено снижение смертности.
Некоторые исследователи рекомендуют поддерживать содержание AT III на уровне 140 %, это возможно при введении препарата в суммарной дозе 18 000 ЕД. Содержание AT III не должно снижаться менее 80 %.
9. Поливалентные иммуноглобулины используются для нейтрализации эндотоксинов. Отмечено снижение смертности при их применении у кардиохирургических больных.
10. Методы экстракорпоральной детоксикации: гемофильтрация, плазмаферез.
Профилактика тромбоза глубоких вен при сепсисе - методы
Генерализованное воспаление и полиорганная дисфункция/недостаточность являются характерными проявлениями тяжелого сепсиса и септического шока. Тяжелый сепсис и септический шок являются неблагоприятным прогностическим признаком исхода заболевания.
Возникновение осложнений требует использования дополнительных резервов организма и снижает вероятность выздоровления. В связи с этим меры, направленные на профилактику осложнений (тромбоза глубоких вен, возникновения стрессовых язв), замещение функции органов и создание условий для полноценного питания больных, имеют большое практическое значение.
Данные, полученные в результате многочисленных исследований к настоящему времени, позволили сформулировать заключение: меры, направленные на профилактику тромбоза глубоких вен, улучшают результаты лечения больных сепсисом. В целом подходы к профилактике тромбоза глубоких вен разработаны для различных категорий больных: послеоперационных, больных инфарктом миокарда и других.
Несмотря на то что степень доказательности этих исследований была различной, общая тенденция совпадала — выявлено снижение летальности больных.
Больные сепсисом, находящиеся на лечении в ОРИТ, как правило, имеют несколько факторов риска развития тромбоэмболических осложнений: возраст (старше 40 лет), наличие тромбоэмболических осложнений в прошлом, онкологических заболеваний, постельный режим (более 5 сут), тяжелые операции, сердечную недостаточность, лабораторные признаки гиперкоагуляции.
Появление двух факторов и более резко увеличивает риск тромбоэмболических осложнений. Другими факторами риска у больных сепсисом являются продолжительная катетеризация центральных вен, применение миорелаксантов, глубокая седация больных и наличие признаков коагулопатии.
Фармакологические методы профилактики тромбоэмболических осложнений не имеют преимуществ перед другими методами. Фармакологическая профилактика тромбоза глубоких вен заключается в применении низких доз нефракционированного гепарина (5000 ЕД 2—3 раза в сутки) или соответствующих доз фракционированных гепаринов (фраксипарин 0,3—0,6 мл 1 раз в сутки).
При проведении сравнительных исследований фракционированных и нефракционированных гепаринов не получено данных, указывающих на преимущество одного из них, хотя в отношении безопасности имеются данные, указывающие на преимущества фракционированных гепаринов. Поэтому рекомендации сводятся к использованию тех препаратов, которые обладают приемлемыми свойствами с точки зрения стоимости и эффективности для конкретного лечебного учреждения.
При наличии противопоказаний к применению гепарина (тромбоцитопения, тяжелая коагулопатия, кровотечение, церебральное кровоизлияние) рекомендованы механические профилактические устройства.
Наличие у больных сепсисом гемостазиологических нарушений, связанных как с коагулопатией потребления, так и печеночной недостаточностью, снижение активности тромбоцитов и высокая опасность кровотечений приводят к необходимости применения альтернативных методов профилактики — механической компрессии ног эластическими бинтами или специальными чулками, эффективность которой доказана у хирургических больных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Тромбоцитопения у гематологических больных - показания к коррекции
В онкогематологии причиной тромбоцитопении могут являться побочные эффекты цитостатической терапии, опухолевая инфильтрация костного мозга или его замещение лейкемическим клоном, спленомегалия, аутоиммунные процессы. Кроме того, необходимо помнить, что тромбоцитопения может быть следствием побочного действия сопутствующей терапии или проявлением синдрома ДВС (диссеминированного внутрисосудистого свертывания).
Кроме изменения количества тромбоцитов, возможно и нарушение их функции, что также может приводить к клинически значимым последствиям. Нарушение функции тромбоцитов, заключающееся в снижении их способности к агрегации и тромбообразованию, может наблюдаться при остром миелолейкозе, множественной миеломе, макроглобулинемии Вальденстрема, моноколональных гаммапатиях.
Первые заместительные трансфузии тромбоцитов при тромбоцитопении были проведены в 50-х годах прошлого века у пациентов с острыми лейкозами, получающими цитостатическую терапию. Уже к 60-м годам исследователями из Национального Института Рака США (NCI) была выявлена четкая зависимость между уровнем тромбоцитов в период индукции ремиссии и риском гибели от геморрагических осложнений. Также была показана способность донорских тромбоцитов снижать риск развития тяжелых кровотечений или прекращать уже начавшиеся тромбоцитопенические кровотечения.
Кроме того, было отмечено, что донорские тромбоциты более эффективны для предотвращения, чем для лечения уже начавшегося кровотечения.
Донорские тромбоциты для заместительных трансфузий могут быть получены двумя основными методами. В одном случае богатую тромбоцитами плазму получают при центрифугировании 1 дозы (400 мл) цельной донорской крови. Полученный продукт обычно содержит около 0,5—0,6 • 10" тромбоцитов. Для адекватной заместительной поддержки необходимо 6—8 доз данного продукта от соответствующего количества доноров, в связи с чем в зарубежной литературе он получил название multiple-donors platelets (тромбоциты множественных доноров).
Как показывают некоторые исследования, при использовании тромбоплазмы чаще и раньше развиваются аллоиммунизация и рефрактерность (отсутствие клинического эффекта) к трансфузиям донорских тромбоцитов. Кроме того, большее количество доноров увеличивает риск заражения гемотрансмиссивными инфекциями. Необходимо учитывать и тот факт, что различен и контингент доноров, сдающих кровь для получения тромбоплазмы и тромбоконцентрата с сепаратора. К получению тромбоконцентрата на сепараторе обычно допускаются кадровые доноры, в то время как цельную кровь, из которой в дальнейшем получают тромбоплазму, могут сдавать и однократно обратившиеся люди.
Как показывает исследование, проведенное в США, риск обнаружить гемотрансмиссивную вирусную инфекцию у доноров, сдающих кровь на сепараторе, на 50 % ниже, чем у доноров, сдающих цельную кровь для приготовления тромбоплазмы.
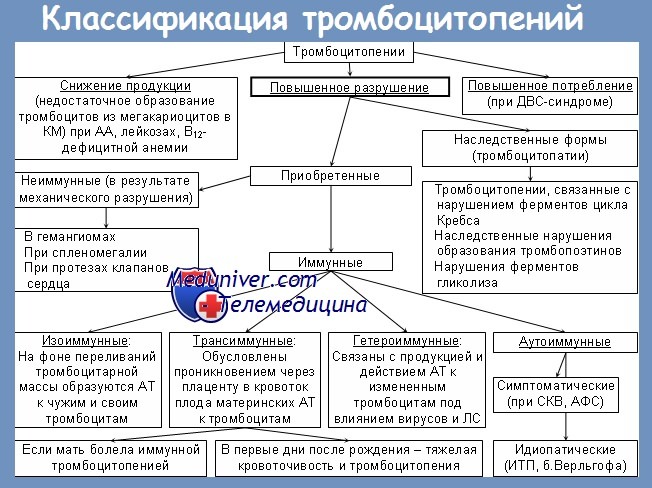
Необходимо четко разграничить два понятия — профилактические и терапевтические трансфузии тромбоцитов. Под профилактическими трансфузиями понимается введение донорских тромбоцитов для предотвращения развития кровотечений, в то время как терапевтические трансфузии проводятся пациентам, уже имеющим клинически выраженное кровотечение, с целью его остановки. Как отмечено ранее, более эффективны профилактические трансфузии.
При наличии перечисленных выше признаков профилактические трансфузии начинают при уровне тромбоцитов ниже 20•10 9 /л. Как показывают некоторые исследования, использование больших доз тромбоцитов позволяет увеличить интервал между трансфузиями. Однако даже эти показания считаются некоторыми исследователями слишком либеральными. Согласно данным J. Gmur и соавт., повышения частоты тяжелых кровотечений не происходит и в случае, если профилактические трансфузии проводятся лишь при уровне тромбоцитов менее 5•10 9 /л и отсутствии лихорадки и кровоточивости или при уровне менее 10•10 9 /л и наличии этих признаков. В двух рандомизированных исследованиях было показано, что риск развития выраженных кровотечений у больных острым лейкозом не отличается, если профилактические трансфузии начинаются при уровне тромбоцитов менее 10•10 9 /л или менее 20•10 9 /л. Такой подход позволяет статистически значимо снизить потребность в донорских тромбоцитах.
Эффективность трансфузий оценивают с использованием скорригированного прироста тромбоцитов (СПТ):
СПТ = (абс. прирост тромбоцитов, 10 9 /л) х (площадь поверхности тела, м2)/(количество перелитых тромбоцитов, 10 11 ).
Через 18—24 ч после трансфузии СПТ обычно составляет 10—20. Более низкий показатель может свидетельствовать о повышенном потреблении или разрушении тромбоцитов либо о неадекватности их получения и хранения. Последняя причина не будет рассматриваться в дальнейшем, однако ее необходимо заподозрить в случае, если не удается получить достаточного СПТ у нескольких пациентов, получавших трансфузии тромбоцитов из одной и той же станции переливания крови.
Причиной недостаточного СПТ может являться наличие у пациента инфекции и/или лихорадки, что обусловлено повышенным потреблением тромбоцитов (даже без лабораторных признаков коагулопатии потребления). Также причиной низкого СПТ может быть секвестрация тромбоцитов в селезенке, особенно при спленомегалии. Одной из причин рефрактерности является выработка антител к тромбоцитам, ассоциированная с лекарственными веществами. Ряд препаратов способен присоединяться к специфическим белкам мембраны тромбоцитов, вызывая их временное структурное изменение или действуя в качестве гаптена, что приводит к выработке антител.
Другим важным фактором, приводящим к рефрактерности к трансфузиям тромбоцитов, является выработка антител к антигенам доноров (HLA-A и HLA-В, АВ-Н системы). Данные о риске развития и факторах, предрасполагающих к аллоиммунизации, противоречивы. Как показывает большинство исследований, около 50—90 % больных, получающих множественные трансфузии, имеют аллоиммунизацию. В то же время возрастание доли аллоиммунизированных больных одновременно с увеличением количества трансфузий донорских тромбоцитов показано далеко не во всех исследованиях. Более того, у части пациентов аллоиммунизация не развивается, несмотря на множественные переливания компонентов крови. К сожалению, при развитии аллоиммунизации даже при использовании в дальнейшем HLA совместимых донорских тромбоцитов добиться их прироста удается далеко не всегда. В связи с этим предпочтительным является не борьба с уже развившейся аллоиммунизацией, а ее профилактика.
Как показывают исследования, совместимость по системе AB0 и резус-фактору не является абсолютно обязательной при трансфузиях тромбоцитов, так как не было показано, что такая несовместимость приводит к нарушению функции или структурным изменениям тромбоцитов. Такой подход позволяет значительно расширить возможности для трансфузий, не ограничивая пул доноров только совместимыми по группе крови с реципиентом. В то же время при наличии выбора предпочтительно использование AB0 совместимых тромбоцитов, так как в рандомизированном исследовании было показано, что многократное переливание AB0 несовместимых тромбоцитов хотя и не приводит к рефрактерности, но снижает СПТ.
В последние годы широко исследуются альтернативные пути борьбы с тромбоцитопенией у онкологических пациентов. Большое количество ростовых факторов и цитокинов было тестировано с этой целью (Г-КСФ и ГМ-КСФ, ИЛ-1, -3, -6, -11, c-kit-лиганд и т. д.). До настоящего времени только ИЛ-11 был одобрен в качестве препарата, назначаемого при тромбоцитопениях, однако его эффект в основном доказан при незначительном снижении уровня тромбоцитов. Исследования, посвященные эффективности рекомбинантного тромбопоэтина (c-mpl-лиганд), в настоящее время практически прекращены из-за его способности индуцировать развитие антител к эндогенному тромбопоэтину, что сопровождается развитием тромбоцитопении даже у здоровых доноров. В качестве альтернативы трансфузиям донорских тромбоцитов исследуют эффективность лиофилизированных тромбоцитов и их мембран, модифицированных эритроцитов, синтетических липосом, состоящих из фосфолипидов и гликопептидных комплексов тромбоцитов и т. д.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Когда нужно сдать анализ крови на сепсис?
Врач может заподозрить, что у пациента развивается сепсис, и назначить анализы, если:
- У больного возникли соответствующие симптомы.
- Лабораторные исследования, которые были проведены ранее, дают повод заподозрить это состояние.
Иногда симптомы сепсиса бывают выражены слабо, их легко спутать с признаками других заболеваний. У пациента повышается температура тела до 38° C, учащаются сердечные сокращения и дыхание, он сильно потеет, при этом имеются симптомы инфекции, из-за которой развилась системная воспалительная реакция в организме. Возникают признаки нарушений работы различных органов.
В тяжелых случаях возникает спутанность сознания, больной становится вялым, снижается артериальное давление, ноги, руки и губы холодные, синюшные, на коже появляются пятна, как при менингите.
Для того чтобы вовремя распознать сепсис и назначить необходимые анализы, традиционно врачи используют критерии шкалы quick SOFA (qSOFA). Если есть все три критерия, скорее всего, это сепсис:
Более точно установить диагноз помогают критерии по шкале SOFA, в них учитываются данные лабораторных анализов:
| Показатели | Баллы | ||||
| 0 | 1 | 2 | 3 | 4 | |
| Индекс оксигенации (измеряется в отделении интенсивной терапии) | Более 400 мм рт. ст. | 300–399 мм рт. ст. | 200–299 мм рт. ст. | 100–199 мм рт. ст. | Менее 100 мм рт. ст. |
| Уровень тромбоцитов | Более 150×109/л | Менее 150×109/л | Менее 100×109/л | Менее 50×109/л | Менее 20×109/л |
| Уровень билирубина в крови (функция печени) | Менее 20 мкмоль/л | 20–30 мкмоль/л | 33–101 мкмоль/л | 102–204 мкмоль/л | Более 204 мкмоль/л |
| Снижение артериального давления | Нет | Менее 70 мм рт. ст. | Удается удерживать лишь с помощью медикаментозных препаратов. | ||
| Оценка по шкале комы Глазго | 15 | 13–14 | 10–12 | 6–9 | Менее 6 |
| Уровень креатинина в крови (функция почек) | Менее 110 мкмоль/л | 110–170 мкмоль/л | 171–299 мкмоль/л | 300–440 мкмоль/л | Более 440 мкмоль/л |
| Количество мочи в сутки | Менее 500 мл в день | Менее 200 мл в день | |||
Процедура проведения анализа крови при сепсисе
Анализ активности эндотоксина (Endotoxin Activity Assay — EAA) — единственный метод количественного определения бактериального токсина, который одобрен Управлением по контролю качества пищевых продуктов и медикаментов США (Food and Drug Administration — FDA).
Что такое эндотоксин? Вещество, по химической природе липополисахарид, встроенное в клеточную мембрану грамотрицательных бактерий. Это мощный медиатор воспаления, и его уровень в крови повышается уже на ранних этапах развития сепсиса.
Для того чтобы определить уровень эндотоксина, у пациента берут кровь и добавляют в нее специфические антитела. Они связываются с бактериальным липополисахаридом, и эти комплексы поглощают нейтрофилы (особая разновидность лейкоцитов). В этих клетках происходят некоторые биохимические реакции, они начинают быстро поглощать и расходовать кислород. В присутствии люминофора возникает свечение, которое можно зарегистрировать с помощью особого инструмента — люминометра. По интенсивности свечения судят об уровне эндотоксина в крови.
Результат измеряется от 0 до 1:
- 0 — отсутствует;
- менее 0,4 — низкий уровень;
- 0,4–0,59 — промежуточный уровень;
- 0,6 и более — высокий уровень;
- 1 — максимальный уровень.
Показатели эритроцитов при сепсисе
Эритроциты — красные кровяные клетки, которые содержат гемоглобин и отвечают за транспорт кислорода, углекислого газа. При тяжелом сепсисе с ними происходят следующие изменения:
Показатели СОЭ при сепсисе
Скорость оседания эритроцитов, сокращенно СОЭ, характеризует скорость оседания эритроцитов под действием силы тяжести в крови, в которой искусственно заблокированы процессы свертывания (образования тромба). У мужчин этот показатель в норме составляет 2–15 мм/час, у женщин — 1–10 мм/час. При сепсисе СОЭ повышается, что является признаком воспалительного процесса в организме.
Показатели лейкоцитов при сепсисе
При сепсисе количество белых кровяных телец в крови увеличивается — возникает лейкоцитоз. Причины вполне объяснимы, ведь в организме развивается воспалительный процесс. В некоторых случаях уменьшается количество нейтрофилов — особого вида лейкоцитов. Это состояние называется нейтропенией, и оно связано с худшим прогнозом.
Показатели тромбоцитов при сепсисе
Снижение количества тромбоцитов в крови — тромбоцитопения — один из симптомов и критериев диагностики сепсиса по шкале SOFA. Риск смерти пациента напрямую зависит от того, насколько сильно у него снижено число тромбоцитов, и как долго сохраняется это состояние. При тромбоцитопении менее 100×109/л риск кровотечения больше не повышается, но уровень смертности продолжает расти.

Как определить заражение крови?
Сепсис характеризуется смертностью от 10 до 40%. На этот показатель влияет вид возбудителя, состояние организма пациента и, что немаловажно, время, в течение которого установлен точный диагноз и начато лечение. Иногда патология протекает в виде септического шока: нарушается кровообращение, обменные процессы в клетках, резко падает артериальное давление, и поддерживать его на цифрах больше 65 мм рт. ст. удается только с помощью лекарств. Среди больных септическим шоком смертность значительно выше.
Кроме того, мы применяем инновационный метод очистки крови от эндотоксина — селективную сорбцию на картриджах для экстракорпоральной гемоперфузии Toramyxin PMX-20R. Эта процедура действует как плазмаферез: кровь больного пропускают через специальный аппарат, в котором задерживается эндотоксин — один из главных виновников системной воспалительной реакции. Фильтр аппарата состоит из волокон, к которым прикреплены молекулы антибиотика полимиксина Б. Он связывается с эндотоксином и образует с ним стабильный комплекс.
Сорбция эндотоксина на картриджах помогает эффективно бороться с тяжелым сепсисом, вызванным грамотрицательными бактериями и смешанной флорой.
Читайте также:

