Сепсис инфекционный эндокардит пархоменко
Обновлено: 24.04.2024
- Не страдавший какой-либо патологией мужчина 32 лет заболевает острым респираторным заболеванием, на этом фоне получает физическую травму. Через несколько часов у него появляется потрясающий озноб, гипертермия, затем резкое падение артериального давления, и больной госпитализируется в стационар в состоянии некупируемого шока. На аутопсии макроскопически какой-либо патологии не выявлено. При гистологическом исследовании в сосудах микроциркуляторного русла печени, селезенки, почек, легких обнаружены скопления стафилококка.
- Девушка 15 лет, после кратковременной гипертермии поступила в стационар в состоянии некупируемого шока. На аутопсии обнаружена перфорация матки после внебольничного аборта, с незначительной местной воспалительной реакцией. При гистологическом исследовании, также как и в первом примере, обнаружены скопления стафилококка в сосудах микроциркуляторного русла.
Таким образом, сепсис протекает по-разному у лиц с отягощенным и неотягощенным преморбидным фоном, поэтому патогенез и танатогенез у этих двух групп больных принципиально различается и предложенная консенсусом концепция развития сепсиса (ССВР → сепсис → тяжелый сепсис → септический шок → рефрактерный септический шок → полиорганная недостаточность) не состоятельна, поэтому мы предлагаем свою концепцию генеза сепсиса (рис.) в зависимости от преморбидного фона.
В настоящее время в лабораторном подтверждении диагноза наибольшее значение предается уровню прокальцитонина. Действительно, прокальцитониновый тест у больных сепсисом, подтвержденным выделением гемокультуры и/или ПЦР, был положительным у 86,7% больных (10 и более нг/л). У больных с тяжелым течением инфекции, при отрицательных результатах бактериологического исследования и ПЦР прокальцитониновый тест был положительным у 43,7% больных. Полученные данные позволяют рассматривать этот тест как критерий тяжести инфекционного процесса. При эффективной антибактериальной терапии уровень прокальцитонина в течение 2–3 суток резко снижается, что позволяет его использовать как надежный критерий эффективности антибактериальной терапии. Для лабораторного подтверждения диагноза сепсиса мы по-прежнему, прежде всего, придаем значение выделению гемокультуры возбудителя, что позволяет определить чувствительность возбудителя к антимикробным препаратам, а также проводить мониторирование динамики чувствительности возбудителя. Недостатками метода являются: отрицательный результат при начатой антибактериальной терапии, возможность экзогенного загрязнения, возможность транзиторной бактериемии. Для повышения эффективности бактериологического метода следует исследовать содержимое гнойных очагов (содержание пустул, пунктата гнойных очагов, спинномозговой жидкости, мочи, мокроты и т. д.). Важнейшую роль в подтверждении диагноза сепсиса имеет ПЦР, которая обладает 100% специфичностью, позволяет определить интенсивность бактериемии (микробную нагрузку), получить положительный результат в первые 1–2 суток лечения антибиотиками. Отрицательный результат ПЦР при выделении гемокультуры свидетельствует об экзогенном загрязнении. При обследовании 40 ВИЧ-инфицированных больных со стафилококковым сепсисом мы во всех случаях получили положительный результат ПЦР, причем микробная нагрузка варьировала от 8 × 10 2 до 1,38 × 10 5 .
Лечение сепсиса должно быть комплексным и включать антибактериальную, детоксикационную терапию, иммунотерапию, интенсивную терапию и реанимацию, нутритивную поддержку, по показаниям — хирургическое вмешательство, профилактику и лечение дисбиоза.
Подробные рекомендации по антибактериальной терапии даны в практических руководствах по сепсису [20, 21]. Следует остановиться только на отдельных аспектах проблемы. Во-первых, антибактериальная терапия должна проводиться поэтапно. Целью первого этапа является купирование бактериемии, что достигается постоянным поддерживанием высоких концентраций препарата в крови (минимальные промежутки между введением разовых доз препарата или непрерывное капельное введение). После купирования бактериемии стоит задача эрадикации возбудителя из септических очагов, где его биодоступность значительно ниже (воспалительный инфильтрат, биопленка на поверхности колонии возбудителя), поэтому интервалы между введением препарата и разовые дозы следует максимально увеличить [6]. При этом в крови достигаются пиковые концентрации препарата и происходит его пассаж в септический очаг. В качестве этиотропного средства не следует забывать о бактериофагах (стафилококковый, пиофаг и другие). Особенно эффективно применение индивидуальных фагов, полученных против культуры возбудителя, выделенной у больного. Важно то, что бактериофаги не обладают побочным действием и не имеют противопоказаний для применения. Иммунотерапия включает специфические (антистафилококковый иммуноглобулин) и неспецифические иммуноглобулины. При этом следует иметь в виду, что большинство препаратов иммуноглобулинов содержат IgG, которые обладают преимущественно протективным действием. Кроме того, они при избыточном введении блокируют рецепторы иммунокомпетентных клеток и подавляют продукцию собственных антител, обладающих большей овидностью к возбудителю. Эффективен только пентаглобин и его аналоги, в меньшей степени нормальный человеческий иммуноглобулин, которые содержит IgM. Важное значение имеет детоксикация, особенно экстракорпоральная. Наиболее эффективна ультрафильтрация плазмы. Хирургическая санация доступных септических очагов является важным звеном в комплексном лечении сепсиса, хотя не гарантирует полного эффекта. Методы интенсивной терапии, искусственная вентиляция легких снижают летальность при наиболее тяжелой молниеносной форме сепсиса. Интенсивность катаболических процессов, невозможность или малая эффективность, из-за ферментативной недостаточности энтерального питания, требуют полноценного парентерального питания с использованием расчетных доз белковых, аминокислотных, липидных, углеводных растворов, витаминов. Массивная антибактериальная терапия вместе с нарушениями питания приводит к развитию тяжелого дисбиоза кишечника и требует применения с первых дней лечения пробиотиков, не подверженных действию антибактериальных препаратов.
Рациональная комплексная терапия сепсиса приводит к резкому снижению летальности, хотя она остается достаточно высокой (10–20% и выше) [24–26].
Приведенные сведения свидетельствуют о необходимости дальнейшего изучения всех аспектов проблемы сепсиса, особенно патогенеза, диагностики и лечения.
Литература
Ю. Я. Венгеров*, доктор медицинских наук, профессор
М. В. Нагибина* , 1 , кандидат медицинских наук
А. П. Угринова*
А. П. Сафонова**
С. В. Матосова**
Т. С. Свистунова***, кандидат медицинских наук
О. Ю. Шипулина**
Т. М. Коваленко***
Т. Н. Молотилова***
Д. В. Чернышов***
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ФБУН ЦНИИЭ Роспотребнадзора, Москва
*** ГБУЗ ИКБ № 2 ДЗМ, Москва
Патологоанатомическая диагностика сепсиса : методические рекомендации / О.Д.Мишнёв, А.И.Щёголев, О.А.Трусов. — Москва, 2004.
библиографическое описание:
Патологоанатомическая диагностика сепсиса : методические рекомендации / Мишнёв О.Д., Щёголев А.И., Трусов О.А. — 2004.
код для вставки на форум:
Российское общество патологоанатомов
О.Д.Мишнев, А.И.Щеголев, О.А.Трусов
ПАТОЛОГОАНАТОМИЧЕСКАЯ ДИАГНОСТИКА СЕПСИСА
Введение
Сепсис – полиэтиологическое инфекционное заболевание, характеризующееся генерализованным характером, ацикличностью течения и особым образом измененной реактивностью. Сепсис развивается из местных очагов инфекции и рассматривается, как правило, в качестве осложнения заболеваний, послуживших причиной генерализации инфекции. Последние годы, несмотря на интенсивную терапию, характеризуются ростом числа больных сепсисом и высокой летальностью.
Сепсис представляет собой заболевание, в отношении этиологии, патогенеза, патологической анатомии, диагностики, лечения которого всегда были и ещё будут проводиться дискуссии. Клиницисты обращаются к патологоанатомам в надежде получить желаемое и в то же время, по их мнению, объективное и адекватное объяснение летального исхода при сепсисе. Однако, справедливости ради, следует констатировать, что, как правило, такое объяснение для них a priori, до вскрытия, в современных клиниках уже имеется, и оно может быть получено на основании комплекса клинических и лабораторных признаков доказательной медицины.
Именно эти показатели, очевидно, следует использовать и патологоанатому при анализе истории болезни и результатов вскрытия для решения своих диагностических проблем. Многие клиницисты интересуются на вскрытии, т.е. a posteriori, не столько познанием на морфологическом субстрате причины и действия, сколько прагматичным согласованием формальных параметров, определяемых при сличении клинического и патологоанатомического диагнозов. Это определяет первоочередную задачу совместной междисциплинарной работы – нахождения общих точек соприкосновения клиницистов и патологоанатомов для полноценного и современного анализа результатов патологоанатомического исследования умерших от сепсиса.
Теоретические аспекты проблемы сепсиса, представленные в мировой литературе конца ХХ – начала нынешнего века и воспринимаемые как революционные и во многом совершенные, дающие основания для разработки оптимальных методов лечения и недопущения летальных исходов при сепсисе, не были неожиданными для патологоанатомов России. В этом заслуга наших Учителей и в первую очередь И.В. Давыдовского, а также А.В.Смольянникова, Д.С.Саркисова, А.П.Авцына, Н.К.Пермякова и других, которые первоочередное внимание уделяли макробиологической составляющей сепсиса, не забывая при этом об этиопатогенетической роли возбудителей инфекции.
Принятие и выполнение решений Согласительной конференции пульмонологов и специалистов по интенсивной терапии (ACCP/SCCV), состоявшейся в 1991 году в Чикаго, привело к унификации терминологии и к упрощению клинической диагностики сепсиса. Однако отсутствие рандомизированных патологоанатомических исследований и, соответственно, клинико-морфологических сопоставлений является одной из важных причин неполного взаимопонимания клиницистов и патологоанатомов при оценке формы и танатогенеза заболевания, а также при обсуждении расхождений клинического и патологоанатомического диагнозов. К сожалению, до настоящего времени предметом дискуссий является отнесение тех или иных клинических и морфологических признаков к проявлениям сепсиса.
Также следует остановиться на распространённой ныне тенденции считать условным выделение разновидностей сепсиса по входным воротам, поскольку генерализованная реакция организма на инфекцию по своей сути является единой и требует незамедлительного лечения, а в Международной классификации болезней отсутствует подразделение сепсиса на разновидности по данному основанию. Возможно, что такой прагматичный подход является обоснованным, однако мы рекомендуем патологоанатомам не забывать о морфологических особенностях различных форм сепсиса в зависимости от входных ворот.
Действительно, для патологоанатома и клинициста не будет представлять большой сложности достижение взаимопонимания при анализе результатов секции больного, погибшего от сепсиса при наличии типичных морфологических признаков и соответствующих клинических данных. Гораздо большие трудности возникнут в том случае, когда больного лечили от сепсиса (и по результатам вскрытия довольно успешно – именно так!), а смерть наступила от другой причины, видимо не связанной с сепсисом. В этом случае необходимо учитывать не только медицинские составляющие (организационные, научно–практические), но также социальные и экономические вопросы, которые в настоящее время никогда не следует упускать из вида. Также сложными для патологоанатомической диагностики являются наблюдения лечённого сепсиса в плане танатогенеза и установления непосредственной причины смерти. Наконец, наблюдения посмертно диагностированного сепсиса, который не был выявлен в клинике, должны стать предметом обсуждения на клинико–патологоанатомических конференциях.
Определения терминов и понятий
Сепсис (в переводе с греческого sēpsis – гниение) – представляет собой особую форму тяжелой генерализованной инфекции, при которой макроорганизм не способен локализовать инфекционный процесс (Белянин В.Л., Рыбакова М.Г., 2004).
Бактериемия – симптом, обозначающий наличие в крови живых микроорганизмов (не обязательно только при сепсисе).
Диссеминация – употребляется, как правило, для характеристики распространения поражений при инфекционном процессе в пределах одного органа (например, диссеминированный туберкулез легких).
Генерализация – обозначает, как правило, поражение многих органов и систем (например, генерализованная вирусная, туберкулезная инфекция).
Синдром системного воспалительного ответа (ССВО) (Systemic Inflammatory Response Syndrome (SIRS), синдром системной воспалительной реакции (ССВР)) патологическое состояние, обусловленное одной из форм хирургической инфекции или альтерации ткани неинфекционной природы (травма, панкреатит, ожог, ишемия или аутоиммунные повреждения тканей и др.). Это понятие предложено классификацией ACCP/SCCV, что привело к существенному пересмотру концептуальных положений о патогенезе, клинике, лечении, профилактике возникновения сепсиса и его осложнений. ССВР (SIRS) характеризуется наличием более чем одного из четырёх следующих основных клинических признаков: гипертермия, тахикардия, тахипноэ, лейкоцитоз (или лейкопения). Подобные клинические признаки встречаются при сепсисе, но при этом обязательным является наличие инфекционного очага поражения в тканях или органах. Патологоанатомическая характеристика SIRS является объектом перспективных научных исследований.
Септицемия – клинико–патологоанатомическая форма сепсиса, при которой отсутствуют метастатические септические очаги. Септицемия – это сепсис без гнойных метастазов. По поводу правомочности применения этого понятия в качестве диагноза одной из форм сепсиса до сих пор продолжается дискуссия. Некоторые клиницисты и патологоанатомы советуют вообще отказаться от этого термина (Пермяков Н.К., 1992). Этот термин не представлен и в классификации ACCP/SCCV. Тем не менее, он рекомендован МКБ-10 как унифицированный для всех разновидностей сепсиса, и вплоть до нового пересмотра он должен применяться клиницистами и патологоанатомами при определении шифра большинства клинико–патологоанатомических форм сепсиса.
Септикопиемия – клинико–патологоанатомическая форма сепсиса. Для неё характерно наличие гнойного воспаления (абсцессов, апостем, флегмон, интерстициального гнойного воспаления) в различных органах и тканях, возникающего в результате гематогенного распространения микробных эмболов из септического очага. Септикопиемия – это сепсис с гнойными метастазами.
Термин септикопиемия не представлен в МКБ–10.
Термин сепсис носит обобщающий характер, как и термин септический процесс. Классификация ACCP/SCCV рекомендует в клинике использовать термин сепсис, а не септицемия или септикопиемия. В настоящее время не рекомендуется использовать термин септическое состояние, лишенный конкретной основы.
Тяжёлый сепсис (или сепсис-синдром) – форма сепсиса, предложенная в классификации ACCP/SCCV, при котором отмечаются признаки полиорганной недостаточности. В.Л.Белянин и М.Г.Рыбакова (2004) считают, что с точки зрения патоморфолога понятие тяжёлый сепсис (сепсис–синдром) нельзя признать удачной терминологической находкой.
Септический шок – другая форма тяжёлого сепсиса в классификации ACCP/SCCV, сопровождающаяся артериальной гипотонией, не устраняющейся с помощью инфузионной терапии и требующей назначения катехоламинов.
Септический (бактериальный, инфекционный) эндокардит (острый и подострый) характеризуется, прежде всего, воспалительными поражениями клапанного аппарата сердца, развивающимися наряду с септическими проявлениями. Представляет собой самостоятельное заболевание (первоначальную причину смерти) и имеет собственный шифр. Следует отличать от поражений эндокарда при других формах сепсиса.
Септический очаг – различают первичный и метастатические септические очаги. Первичный септический очаг представляет собой фокус воспаления, преимущественно гнойного, в котором происходит накопление микроорганизмов, распространяющихся затем гематогенно и лимфогенно по тканям и органам. Метастатические септические очаги (вторичные септические очаги, метастатические очаги при сепсисе, септические метастазы, метастатические гнойники, гнойные метастазы) представляют собой очаги воспаления, возникающие вследствие гематогенного перемещения септического процесса в ткани и органы из другого очага.
Системный инфекционный процесс – поражение какой-либо системы органов (например: нервной при клещевом энцефалите; пищеварительной при шигеллезе и т.д.).
Гнойно-резорбтивная лихорадка. Понятие гнойно-резорбтивной лихорадки предложено И.В.Давыдовским для обозначения клинических и патологоанатомических проявлений местного гнойно-некротического процесса, морфологически ограниченного демаркационным валом (в отличие от септических очагов) от окружающих тканей. В настоящее время этот термин почти не используется, а состояние больного обозначается как интоксикация или разновидность эндотоксикоза.
Эндотоксикоз – очень широкое понятие для обозначения осложнений и проявлений заболеваний и состояний организма. Основным фактором патогенеза эндотоксикоза является воздействие на организм токсических продуктов, образующихся в нем в результате нарушения тех или иных функций.
Этиология
Возбудителями сепсиса могут являться многие микроорганизмы (табл. 1). Это многочисленные бактерии: стрептококки, стафилококки, менингококки, пневмококки, кишечная палочка, синегнойная палочка, клебсиеллы, протей, сальмонеллы, а также грибы преимущественно Кандида и аспергиллус. Сепсисом может осложниться течение туберкулеза, сыпного тифа, брюшного тифа и других инфекционных заболеваний, возбудителями которых являются патогенные микроорганизмы. Генерализованные вирусные инфекции не принято рассматривать в качестве сепсиса, хотя об этом имеются указания в современных зарубежных клинических исследованиях.
Таблица. 1. Наиболее вероятная этиология сепсиса в зависимости от локализации первичного очага инфекции
Сепсис — симптомокомплекс, обусловленный постоянным или периодическим поступлением в кровь микроорганизмов из очага гнойного воспаления. В клинической картине преобладают тяжёлые полиорганные нарушения, тогда как местные воспалительные изменения выражены слабо. Характерно образование метастатических очагов гнойного воспаления в различных органах и тканях.
Классификация • Эпидемиологическая •• Внутрибольничный сепсис (послеродовый, послеоперационный, посткатетеризационный, постинъекционный, после гинекологических осмотров, сепсис новорождённых) •• Внебольничный сепсис (криптогенный, тонзиллогенный, кишечный, ожоговый) • Клиническая классификация учитывает следующие признаки: •• Этиология •• Локализация входных ворот инфекции •• Длительность ••• Молниеносный сепсис — 1–3 дня ••• Острый сепсис — до 6 нед ••• Подострый или затяжной сепсис — более 6 нед ••• Хронический сепсис (характерен для пациентов с иммунодефицитными состояниями, особенно при СПИДе) — более 6 мес •• Клиническая форма ••• Септицемия — форма сепсиса, не сопровождающаяся образованием метастатических очагов гнойной инфекции ••• Септикопиемия — форма сепсиса, характеризующаяся образованием метастатических очагов инфекции (в т.ч. инфарктов) ••• Септический (бактериальный) эндокардит. Примечание. Септицемия может трансформироваться в септикопиемию, что даёт основания считать эти формы стадиями одного процесса •• Ведущие клинико-патофизиологические синдромы ••• Тромбогеморрагический синдром (например, ДВС) ••• Септический (инфекционно-токсический) шок ••• Токсико-дистрофическое состояние.
Патогенез • Для развития сепсиса необходимо проникновение условно-патогенного возбудителя через входные ворота (чаще травмированная кожа или слизистая оболочка) с развитием местной реакции (первичного аффекта), реактивного лимфаденита (лимфангоита), гнойного тромбофлебита с последующей бактериемией и токсемией. Поражение сосудистой стенки на большом протяжении, флебиты приводят к образованию инфицированных микротромбов, обусловливающих абсцессы и инфаркты внутренних органов • Клиническая картина не зависит от этиологии, отсутствуют морфологические признаки, указывающие на специфику процесса • Глубокое нарушение обмена веществ вследствие выраженной интоксикации, преобладание процессов катаболизма (гипоальбуминемия, диспротеинемия, гипергликемия, дефицит эссенциальных жирных кислот, гиповитаминоз, метаболический ацидоз). Тяжёлые дистрофические изменения дополнительно ухудшают функции органов, что даже при отсутствии в них клинически выраженных метастазов приводит к системной полиорганной недостаточности, характерной для поздних необратимых стадий сепсиса.
Клиническая картина. Инкубационный период, цикличность течения, характерные для инфекционных заболеваний, отсутствуют. Патогномоничных признаков не существует • Интоксикационный синдром •• Вялость, анорексия, изменения психоэмоционального статуса до грубых общемозговых расстройств (коматозное состояние) •• Лихорадка (температурная кривая чаще всего неправильного типа). Подозрение на наличие сепсиса возникает при продолжительности лихорадки более 5 дней и наличии немотивированных подъёмов температуры тела до фебрильных значений с последующим падением до субфебрильных •• Признаки дистрофии и нарушения питания с развитием гипотрофии и уменьшением массы тела, снижением эластичности кожи, тургора мягких тканей • Дисфункция ЖКТ, тошнота, рвота (в т.ч. и вследствие интоксикации) • Нарушения микроциркуляции — бледность кожных покровов с землистым оттенком, геморрагическая сыпь, одышка, снижение диуреза • Гепатолиенальный синдром • Симптомы поражения органов и тканей соответственно локализации метастатических очагов или входных ворот инфекции.
Лабораторные признаки • Лейкоцитоз или лейкопения (при этиологической роли грамотрицательной флоры и СПИДе), нейтрофилёз с гиперрегенераторным сдвигом влево, прогрессирующая анемия, тромбоцитопения • Гипопротеинемия с диспротеинемией (снижение соотношения альбумины/глобулины) • Высокая концентрация белков острой фазы воспаления • Изменения коагулограммы, свидетельствующие о развитии ДВС • Лейкоцитурия, бактериурия, цилиндрурия, эритроцитурия • Положительные результаты бактериологического исследования крови (обнаружение гемокультуры), кала, мочи, ликвора. Для получения положительного результата необходим трёхкратный забор крови в объёме 20–30 мл с интервалом в 1 ч по возможности до начала антибиотикотерапии • Гиперферментемия, гипербилирубинемия при поражении соответствующих органов.
Диагностические критерии клинических форм сепсиса • Септикопиемия — обнаружение одного или нескольких очагов метастатического воспаления с идентификацией возбудителя • Септицемия — преобладают признаки интоксикационного синдрома с выраженными расстройствами микроциркуляции и центральной гемодинамики, развёрнутой клиникой тромбогеморрагического синдрома. Характерен септический (инфекционно-токсический) шок • Септический (бактериальный) эндокардит (см. Эндокардит инфекционный). Особенности инфекционного процесса: входные ворота — чаще слизистая оболочка глотки, но местный очаг (источник постоянного поступления микроорганизмов в системный кровоток) — эндокард.
ЛЕЧЕНИЕ
Тактика ведения • Госпитализация • Этиотропная терапия. До получения результатов бактериологического исследования антибиотики выбирают эмпирически • Иммуностимулирующая терапия • Дезинтоксикационная терапия (её адекватность в конечном итоге определяет прогноз), в т.ч. по показаниям экстракорпоральная дезинтоксикация: плазмаферез, гемосорбция, перфузия крови через донорские органы животных (селезёнка, печень) • Симптоматическая терапия • Лечение носит характер интенсивной терапии и дополнительно включает экстренную коррекцию расстройств функций жизненно важных органов (инфекционно-токсический шок при септицемии, декомпенсированная сердечная недостаточность при бактериальном эндокардите) • Выраженность локального воспалительного процесса любой локализации не коррелирует с тяжестью течения сепсиса. Следует учитывать, что отдалённый очаг гнойного воспаления может быть как следствием сепсиса (метастазирование), так и его причиной, что важно при определении лечебной тактики.
Лекарственная терапия
• Этиотропная терапия •• До получения результатов бактериологического исследования, особенно при неясной этиологии, наиболее эффективно сочетание гентамицина или тобрамицина 3–5 мг/кг/сут в/в и антибиотика из группы цефалоспоринов или имипенем+циластатин 500 мг в/в каждые 6 ч •• Антибиотики назначают в максимальной дозировке, в/в, в течение не менее 2 нед (несмотря на нормализацию температуры тела) •• Критерии эффективности — очевидная положительная динамика общего состояния и лабораторных показателей.
• Иммуностимулирующие препараты •• Иммуноглобулин человеческий нормальный для внутривенного введения, иммуноглобулин человеческий нормальный (IgG+IgA+IgM) для внутривенного введения •• Препараты ИФН.
• Дезинтоксикационная терапия — внутривенное введение большого количества жидкости в сочетании с диуретиками, например фуросемидом (метод форсированного диуреза) •• Количество вводимой жидкости не должно превышать объём выделенной мочи (при отсутствии у пациента признаков обезвоживания) •• Следует контролировать показатели центральной гемодинамики (АД, ЦВД) и содержание электролитов сыворотки крови и мочи •• Следует дополнительно ввести вазодилататоры.
• Симптоматическая терапия •• При анемии и тромбоцитопении — переливание крови, эритроцитарной и тромбоцитарной масс •• Противовоспалительная терапия: НПВС и ГК (следует учесть иммунодепрессивное действие ГК) •• Регидратация и парентеральное питание при выраженной дисфункции ЖКТ и тяжёлых расстройствах питания •• Купирование сердечной недостаточности и аритмий •• Противошоковые мероприятия при инфекционно-токсическом шоке (септицемия): ГК, адреномиметические средства, плазмозамещающие препараты, например полиглюкин.
Оперативное лечение при наличии доступного оперативному вмешательству очага гнойной инфекции.
Синоним. Инфекция общая гнойная
МКБ-10 • O85 Послеродовой сепсис • P36 Бактериальный сепсис новорождённого • T80.2 Инфекции, связанные с инфузией, трансфузией и лечебной инъекцией
Код вставки на сайт
Сепсис — симптомокомплекс, обусловленный постоянным или периодическим поступлением в кровь микроорганизмов из очага гнойного воспаления. В клинической картине преобладают тяжёлые полиорганные нарушения, тогда как местные воспалительные изменения выражены слабо. Характерно образование метастатических очагов гнойного воспаления в различных органах и тканях.
Классификация • Эпидемиологическая •• Внутрибольничный сепсис (послеродовый, послеоперационный, посткатетеризационный, постинъекционный, после гинекологических осмотров, сепсис новорождённых) •• Внебольничный сепсис (криптогенный, тонзиллогенный, кишечный, ожоговый) • Клиническая классификация учитывает следующие признаки: •• Этиология •• Локализация входных ворот инфекции •• Длительность ••• Молниеносный сепсис — 1–3 дня ••• Острый сепсис — до 6 нед ••• Подострый или затяжной сепсис — более 6 нед ••• Хронический сепсис (характерен для пациентов с иммунодефицитными состояниями, особенно при СПИДе) — более 6 мес •• Клиническая форма ••• Септицемия — форма сепсиса, не сопровождающаяся образованием метастатических очагов гнойной инфекции ••• Септикопиемия — форма сепсиса, характеризующаяся образованием метастатических очагов инфекции (в т.ч. инфарктов) ••• Септический (бактериальный) эндокардит. Примечание. Септицемия может трансформироваться в септикопиемию, что даёт основания считать эти формы стадиями одного процесса •• Ведущие клинико-патофизиологические синдромы ••• Тромбогеморрагический синдром (например, ДВС) ••• Септический (инфекционно-токсический) шок ••• Токсико-дистрофическое состояние.
Патогенез • Для развития сепсиса необходимо проникновение условно-патогенного возбудителя через входные ворота (чаще травмированная кожа или слизистая оболочка) с развитием местной реакции (первичного аффекта), реактивного лимфаденита (лимфангоита), гнойного тромбофлебита с последующей бактериемией и токсемией. Поражение сосудистой стенки на большом протяжении, флебиты приводят к образованию инфицированных микротромбов, обусловливающих абсцессы и инфаркты внутренних органов • Клиническая картина не зависит от этиологии, отсутствуют морфологические признаки, указывающие на специфику процесса • Глубокое нарушение обмена веществ вследствие выраженной интоксикации, преобладание процессов катаболизма (гипоальбуминемия, диспротеинемия, гипергликемия, дефицит эссенциальных жирных кислот, гиповитаминоз, метаболический ацидоз). Тяжёлые дистрофические изменения дополнительно ухудшают функции органов, что даже при отсутствии в них клинически выраженных метастазов приводит к системной полиорганной недостаточности, характерной для поздних необратимых стадий сепсиса.
Клиническая картина. Инкубационный период, цикличность течения, характерные для инфекционных заболеваний, отсутствуют. Патогномоничных признаков не существует • Интоксикационный синдром •• Вялость, анорексия, изменения психоэмоционального статуса до грубых общемозговых расстройств (коматозное состояние) •• Лихорадка (температурная кривая чаще всего неправильного типа). Подозрение на наличие сепсиса возникает при продолжительности лихорадки более 5 дней и наличии немотивированных подъёмов температуры тела до фебрильных значений с последующим падением до субфебрильных •• Признаки дистрофии и нарушения питания с развитием гипотрофии и уменьшением массы тела, снижением эластичности кожи, тургора мягких тканей • Дисфункция ЖКТ, тошнота, рвота (в т.ч. и вследствие интоксикации) • Нарушения микроциркуляции — бледность кожных покровов с землистым оттенком, геморрагическая сыпь, одышка, снижение диуреза • Гепатолиенальный синдром • Симптомы поражения органов и тканей соответственно локализации метастатических очагов или входных ворот инфекции.
Лабораторные признаки • Лейкоцитоз или лейкопения (при этиологической роли грамотрицательной флоры и СПИДе), нейтрофилёз с гиперрегенераторным сдвигом влево, прогрессирующая анемия, тромбоцитопения • Гипопротеинемия с диспротеинемией (снижение соотношения альбумины/глобулины) • Высокая концентрация белков острой фазы воспаления • Изменения коагулограммы, свидетельствующие о развитии ДВС • Лейкоцитурия, бактериурия, цилиндрурия, эритроцитурия • Положительные результаты бактериологического исследования крови (обнаружение гемокультуры), кала, мочи, ликвора. Для получения положительного результата необходим трёхкратный забор крови в объёме 20–30 мл с интервалом в 1 ч по возможности до начала антибиотикотерапии • Гиперферментемия, гипербилирубинемия при поражении соответствующих органов.
Диагностические критерии клинических форм сепсиса • Септикопиемия — обнаружение одного или нескольких очагов метастатического воспаления с идентификацией возбудителя • Септицемия — преобладают признаки интоксикационного синдрома с выраженными расстройствами микроциркуляции и центральной гемодинамики, развёрнутой клиникой тромбогеморрагического синдрома. Характерен септический (инфекционно-токсический) шок • Септический (бактериальный) эндокардит (см. Эндокардит инфекционный). Особенности инфекционного процесса: входные ворота — чаще слизистая оболочка глотки, но местный очаг (источник постоянного поступления микроорганизмов в системный кровоток) — эндокард.
ЛЕЧЕНИЕ
Тактика ведения • Госпитализация • Этиотропная терапия. До получения результатов бактериологического исследования антибиотики выбирают эмпирически • Иммуностимулирующая терапия • Дезинтоксикационная терапия (её адекватность в конечном итоге определяет прогноз), в т.ч. по показаниям экстракорпоральная дезинтоксикация: плазмаферез, гемосорбция, перфузия крови через донорские органы животных (селезёнка, печень) • Симптоматическая терапия • Лечение носит характер интенсивной терапии и дополнительно включает экстренную коррекцию расстройств функций жизненно важных органов (инфекционно-токсический шок при септицемии, декомпенсированная сердечная недостаточность при бактериальном эндокардите) • Выраженность локального воспалительного процесса любой локализации не коррелирует с тяжестью течения сепсиса. Следует учитывать, что отдалённый очаг гнойного воспаления может быть как следствием сепсиса (метастазирование), так и его причиной, что важно при определении лечебной тактики.
Лекарственная терапия
• Этиотропная терапия •• До получения результатов бактериологического исследования, особенно при неясной этиологии, наиболее эффективно сочетание гентамицина или тобрамицина 3–5 мг/кг/сут в/в и антибиотика из группы цефалоспоринов или имипенем+циластатин 500 мг в/в каждые 6 ч •• Антибиотики назначают в максимальной дозировке, в/в, в течение не менее 2 нед (несмотря на нормализацию температуры тела) •• Критерии эффективности — очевидная положительная динамика общего состояния и лабораторных показателей.
• Иммуностимулирующие препараты •• Иммуноглобулин человеческий нормальный для внутривенного введения, иммуноглобулин человеческий нормальный (IgG+IgA+IgM) для внутривенного введения •• Препараты ИФН.
• Дезинтоксикационная терапия — внутривенное введение большого количества жидкости в сочетании с диуретиками, например фуросемидом (метод форсированного диуреза) •• Количество вводимой жидкости не должно превышать объём выделенной мочи (при отсутствии у пациента признаков обезвоживания) •• Следует контролировать показатели центральной гемодинамики (АД, ЦВД) и содержание электролитов сыворотки крови и мочи •• Следует дополнительно ввести вазодилататоры.
• Симптоматическая терапия •• При анемии и тромбоцитопении — переливание крови, эритроцитарной и тромбоцитарной масс •• Противовоспалительная терапия: НПВС и ГК (следует учесть иммунодепрессивное действие ГК) •• Регидратация и парентеральное питание при выраженной дисфункции ЖКТ и тяжёлых расстройствах питания •• Купирование сердечной недостаточности и аритмий •• Противошоковые мероприятия при инфекционно-токсическом шоке (септицемия): ГК, адреномиметические средства, плазмозамещающие препараты, например полиглюкин.
Оперативное лечение при наличии доступного оперативному вмешательству очага гнойной инфекции.
Синоним. Инфекция общая гнойная
МКБ-10 • O85 Послеродовой сепсис • P36 Бактериальный сепсис новорождённого • T80.2 Инфекции, связанные с инфузией, трансфузией и лечебной инъекцией
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
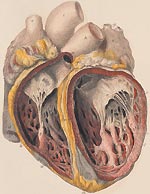
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

