Сепсис при дистресс синдроме
Обновлено: 25.04.2024
В 1994 г. на Американо-Европейской согласительной конференции (АЕСК) было предложено следующее определение острого респираторного дистресс-синдрома:
Помимо этого, на AECK было предложено выделять две формы данного заболевания:
1. Острое повреждение легких (ОПЛ) (acute lung injury), которое включает в себя как начальный, более легкий, этап заболевания, так и наиболее тяжелые формы.
2. Собственно ОРДС, являющийся наиболее тяжелым заболеванием.
Таким образом, любой ОРДС можно отнести к ОПЛ, но не все формы ОПЛ являются ОРДС.
В 2012 г. Европейское общество интенсивной терапии (ESICM) иницировало новый подход к проблеме, результатом которого стало так называемое Берлинское соглашение (консенсус) по ОРДС. Согласно этому соглашению, ОРДС получил новое определение:
Острый респираторный дистресс-синдром - это острое, диффузное, воспалительное поражение легких, ведущее к повышению проницаемости сосудов легких, повышению массы легких и уменьшению аэрации легочной ткани.
Основные клинико-физиологические звенья: гипoксемия и двусторонние инфильтраты на рентгенограмме органов грудной клетки, увеличение венозного шунтирования, рост физиологического мертвого пространства, снижение податливости легочной ткани.
Термин "острое повреждение легких" был исключен, ввиду того, что многие клиницисты на практике стали так называть любую нетяжелую гипоксемию.
Примечание. В связи с изменением определения и отсутствием исследований, соответствующих новым критериям, далее в тексте рубрики иногда будет встречаться старый термин ОПЛ (СОПЛ).
Период протекания
Чаще всего почти у всех пациентов между фактором, вызвавшим поражение, и ОРДС, проходит не менее 72 часов и не более 7 дней.
Классификация
Согласно Берлинскому консенсусу ESICM - 2012, имеются три взаимоисключающие формы острого респираторного дистресс-синдрома:
- легкий;
- средней тяжести;
- тяжелый.
Разделение на указанные выше формы осуществляется по тяжести нарушения оксигенации (гипоксемии):
2. Умеренная: 100 мм рт.ст. < PaO2/FiO2 ≤ 200 при ПДKВ или CPАP ≥ 5 см вод.ст.
3. Тяжелая: PaO2/FiO2 ≤ 100 при ПДKВ или CPАP ≥ 5 см вод.ст.
Этиология и патогенез
Острый респираторный дистресс-синдром (ОРДС) может быть следствием “прямого” или “непрямого” повреждения легких.
“Непрямой” механизм ОПЛ/ОРДС связан с внелегочными заболеваниями, при которых в результате системной воспалительной реакции организма возникает повреждение легких. То есть повреждение легких ассоциировано с повреждающими эффектами цитокинов и других биохимических и клеточных медиаторов.
Примечания:
1 Сепсис с двумя или более факторами из группы "А" + один или более признаков из группы "Б". Наибольшая вероятность развития ОРДС (23% против 8%) возникает при сепсисе вызванном грамнегативной флорой.
Группа признаков "А":
- температура выше 38,5 о или ниже 36 о;
- число лейкоцитов более 12х10 9 /мкл или менее 3х10 9 /мкл;
- установленный гнойный очаг;
- выделение гемокультуры.
Группа признаков "Б":
- артериальная гипотония в течение 2 и более часов, систолическое артериальное давление < 80 мм.рт. ст.;
- необходимость применения ионотропных средств для поддержания среднего АД > 85 мм.рт.ст;
- метаболический ацидоз - ВЕ менее 5 ммоль/л;
| Риск | Fowler, 1983 | Shelling, 1998 | Hudson, 1995 |
| Бактериемия | 3,8 | ||
| Сепсис | 28,8 | 41,2 | |
| Травма | 33,3 | 25,5 | |
| Переломы | 5,3 | 11,1 | |
| Контузия легких | 21,8 | ||
| Ожоги | 2,3 | ||
| Тяжелая пневмония | 11,9 | 27,3 | |
| ДВС-синдром | 22,2 | ||
| Аспирация | 35,6 | 22,0 | |
| Утопление | 33,3 | ||
| Передозировка наркотиков | 8,5 | ||
| Неизвестная причина | 22,7 | 10,6 | 21,1 |
Воспаление при ОРДС проходит следующие патофизиологические стадии:
Механика дыхания
У пациентов с ОРДС наблюдаются выраженные изменения механики дыхания.
Статический комплаенс респираторной системы (Crs), представляющий собой изменение легочного объема на заданное изменение транспульмонального давления, у больных ОРДС практически всегда снижен.
Согласно исследованиям, в которых использовались пищеводные катетеры, легочный комплаенс CL также снижен до 32-72 мл/см H2O (40-60% от нормы), комплаенс грудной клетки Ccw составляет 59-147 мл/см H2O (50-80% от нормы). Ccw снижен вследствие нарушений эластических свойств грудной клетки и стенок брюшной полости (повышение давления в брюшной полости и повышение ригидности стенок).
Поскольку статический комплаенс не дает информации о региональных особенностях легких у больных ОРДС, большое значение приобретает оценка кривой “давление-объем”. Данная кривая обычно строится во время инфляции в дыхательные пути последовательных порций заданных объемов с помощью большого шприца (super-syringe method).
Полученная кривая имеет два “колена”: нижнее “колено” (low inflection point) и верхнее “колено” (upper inflection point). Считается, что альвеолы находятся в спавшемся, коллабированном состоянии при уровне давления менее точки нижнего “колена”; альвеолы перерастянуты при давлении больше точки верхнего “колена”. В идеале во время респираторной поддержки колебания положительного давления в дыхательных путях больного должны происходить между точками верхнего и нижнего “колен”.
При ОРДС также, как правило, значительно повышены все компоненты сопротивления в дыхательных путях. Такие изменения обусловлены накоплением клеточных элементов и жидкости в дыхательных путях, отеком бронхов, бронхиальной гиперреактивностью, уменьшением легочных объемов и количества функционирующих дыхательных путей.
Легочная гемодинамика
Повышение давления в легочной артерии - достаточно типичный признак ОРДС. Среднее давление в легочной артерии обычно составляет около 30 мм рт. ст. Вследствие легочной гипертензии у больных ОРДС возникают нарушение функции правого желудочка, снижение сердечного выброса и снижение транспорта кислорода к тканям. Легочная гипертензия также может выступать дополнительным фактором развития полиорганной недостаточности.
Легочная гипертензия при ОРДС, как правило, имеет мультифакторный генез: гипоксическая вазокoнстрикция, вазоспазм, вызванный вазоактивными медиаторами (тромбоксан, лейкотриены и эндотелин), внутрисосудистая обструкция тромбоцитарными тромбами и периваскулярный отек.
На поздних этапах ОРДС большую роль могут играть такие механизмы, как фиброз и облитерация легочных сосудов (ремоделирование).
Эпидемиология
Заболеваемость острым респираторным дистресс-синдромом (ОРДС) варьирует в широких пределах, частично вследствие того, что при исследованиях использовались различные определения этого заболевания. Статистика из США и статистика, приведенная в международных исследованиях, могут, хотя и не бесспорно, прояснить истинную частоту этого заболевания.
В 1970-х годах, когда Национальный Институт Здоровья (NIH) начал изучение ОРДС, по некоторым оценкам, ежегодная частота составляла 75 случаев на 100000 населения. Данные, полученные в последнее время из NIH-спонсируемых исследований ОРДС, позволяют предположить, что частота ОРДС на самом деле может быть выше первоначальной оценки. В проспективном исследовании с использованием критериев Американо-Европейской согласительной конференции (АЕСК) 1994 года выявлено, что с поправкой на возраст заболеваемость острым повреждением легких (ОПЛ) составляет 86,2 на 100000 человеко-лет. С возрастом заболеваемость увеличивается до 306 случаев на 100000 человеко-лет для людей в возрасте 75-84 лет.
На основании этих статистических данных, по оценкам экспертов, в США ежегодно регистрируется 190 600 случаев ОРДС и что эти случаи связаны с 74500 смертей.
В первом исследовании с использованием критериев AECK 1994 года в Скандинавии, годовой показатель составил 17,9 случаев ОПЛ на 100000 населения и 13,5 случаев ОРДС на 100000 населения.
Российская Федерация
При острой хирургической и соматической патологии синдром ОПЛ развивается в среднем у 15,4±3,6% больных, а ОРДС - у 11,7±4,7%.
В различных регионах Российской Федерации частота ОРДС у взрослых в 2001-2002 годах находилась в пределах 4,8±0,9 - 7,5±0,9 случаев на 100 000 населения в год. На 1000 больных, переводимых в отделения анестезиологии и реанимации клинических медицинских учреждений, в год частота ОРДС достигала 22,7±8,6%.
ОРДС может возникнуть у людей любого возраста. Его частота увеличивается с возрастом, от 16 случаев на 100000 человеко-лет у лиц в возрасте 15-19 лет до 306 случаев на 100000 человеко-лет у лиц в возрасте 75 и 84 лет. Распределение по возрасту отражает заболеваемость в связи с основными причинами развития ОРДС.
Для ОРДС, связанного с сепсисом и большинством других причин, никаких различий в заболеваемости между мужчинами и женщинами по всей видимости, не существуют. Тем не менее, только у травматологических больных , заболеваемость может быть немного выше среди женщин.
Приблизительное распределение по тяжести ОРДС (согласно анализу баз данных при выработке Берлинского соглашения 2012 года):
- легкий ОРДС ((по сути - ОПЛ из старой классификации)) - 22% больных клинической базы данных (95% ДИ 21-24%);
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
диспноэ, дискомфорт в грудной клетке, сухой кашель, цианоз, тахипноэ, тахикардия, участие в дыхании вспомогательных мышц, диффузная крепитация, жесткое, а иногда и бронхиальное “амфорическое” дыхание; расстройство сознания.
Cимптомы, течение
Возникновение острого респираторного дистресс-синдрома (ОРДС) наиболее часто происходит в первые 12-48 часов от начала развития основного заболевания или события. В ряде случаев возможно развитие ОРДС и спустя 5 дней.
Облигатный признак ОРДС - гипоксемия (SpO2 ниже 90%, часто - ниже 75%).
Больные с ОРДС практически всегда рефрактерны к терапии кислородом, что отражает основной механизм нарушения газообмена при ОРДС – развитие внутрилегочного шунта.
Диагностика
Критерии Delphi - 2005
4. Некардиогенный характер определяется по субъективным признакам (отсутствие клиники сердечной недостаточности).
Диагноз ОРДС, согласно критериям Delphi, выставляется при наличии первых четырех признаков + один признак 5а или 5b.
1. Временной интервал: возникновение синдрома (новые симптомы или усугубление симптомов поражения легких) в пределах одной недели от момента действия известного причинного фактора.
3. Механизм отека: дыхательную недостаточность нельзя объяснить сердечной недостаточностью или перегрузкой жидкостью. Если факторов риска сердечной недостаточности нет, необходимы дополнительные исследования, прежде всего эхокардиография.
4. Нарушение оксигенации (гипоксия):
- легкая: 200 мм рт.ст. < PaO2/FiO2 ≤ 300 при ПДКВ или CPAP ≥ 5 см вод.ст.;
- умеренная: 100 мм рт.ст. < PaO2/FiO2 ≤ 200 при ПДКВ или CPAP ≥ 5 см вод.ст.;
- тяжелая: PaO2/FiO2 ≤ 100 при ПДКВ или CPAP ≥ 5 см вод.ст..
Примечания к методам диагностики ОРДС, согласно Берлинским соглашениям - 2012
Визуализация
Рентгенологическое исследование имеет меньшую диагностическую ценность по сравнению с компьютерной томографией (КТ и КТВР КТВР - компьютерная томография высокого разрешения
).
Тяжелый ОРДС предполагает затемнение минимум 3-4 полей.
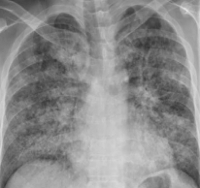
Характерная рентгенологическая находка - возникновение картины “матового стекла” и диффузных мультифокальных инфильтратов довольно высокой плотности с хорошо очерченными воздушными бронхограммами, то есть развитие обширного поражения паренхимы легких.
Часто может визуализироваться небольшой плевральный выпот.
Определенные трудности возникают при дифференциации рентгенографической картинй ОРДС с кардиогенным отеком легких. В пользу ОРДС свидетельствуют:
- более периферическое расположение инфильтративных теней;
- нормальные размеры сердечной тени;
- отсутствие или небольшое количество линий Керли Линии Керли - горизонтальные линейные тени на рентгенограмме нижних отделов легких, наблюдаемые при уплотнении (отеке) междольковых перегородок, например у больных с легочной гипертензией
типа В (короткие, параллельные, располагающиеся на периферии легких).
На рентгенологическую картину ОРДС могут влиять терапевтические вмешательства. Например, избыточное введение растворов может привести к усилению альвеолярного отека и усилению выраженности рентгенологических изменений; терапия диуретиками, наоборот, может уменьшить рентгенологические изменения. Уменьшение регионарной плотности легких, приводящее к ошибочному впечатлению об улучшении патологического процесса, может быть вызвано искусственной вентиляцией легких (в особенности при использовании РЕЕР), которая повышает среднее давление в дыхательных путях и инфляцию легких.
На поздних этапах развития ОРДС очаги консолидации сменяются интерстициальными изменениями, возможно появление кистозных изменений.
Компьютерная томография (КТ) позволяет получить данные, которые не могут быть получены при обычной рентгенографии. В частности, получить дополнительную информацию о степени и протяженности поражения паренхимы легких, а также выявить наличие баротравмы Баротравма - повреждение воздухсодержащих органов (ухо, придаточные пазухи носа, легкие), вызванное разницей давлений между внешней средой (газ или жидкость) и внутренними полостями
или локализованной инфекции.
Ранние КТ-исследования структуры легких показали, что локализация легочных инфильтратов носит пятнистый, негомогенный характер, причем существует вентрально-дорсальный градиент легочной плотности:
- нормальная аэрация легочной ткани в вентральных (так называемых независимых) отделах;
- картина “матового стекла” в промежуточных зонах;
- плотные очаги консолидации в дорсальных (зависимых) отделах.
Возникновение плотных очагов в дорсальных отделах обусловдено зависимым от силы тяжести распределением отека легких и, в большей степени, развитием “компрессионных ателектазов” зависимых зон вследствие их сдавления вышележащими отечными легкими.
Из критериев диагностики в Берлинских соглашениях - 2012 устранено давление в левом предсердии, поскольку в настоящее время редко используют соответствующий катетер.
Предполагать развитие ОРДС возможно в тех случаях, когда нарастающая дыхательная недостаточность не может быть объяснена сердечной недостаточностью и перегрузкой жидкостью.
В случае отсутствия явной причины ОРДС требуется проведение дополнительных исследований. Например, эхокардиоскопии для исключения застоя в легких.
Оксигенация. Согласно Берлинским соглашениям - 2012, минимальный уровень ПДКВ, при котором замеряется отношение PaO2/FiO2, составляет 5 см вод. ст., для тяжелого ОРДС – 10 см вод.ст.
Дополнительные показатели
Поскольку измеить мертвое пространство в клинике нелегко, специалисты рекомендуют использовать взамен минутную легочную вентиляцию, стандартизированную к PaCO2 40 мм рт.ст. (VECORR = МВЛ * PaCO2/40). Для определения ОРДС предложено использовать высокую VECORR > 10 л/мин. или низкий комплайенс (< 40 мл/см.вод.ст.), или и то, и другое вместе.
Согласно Берлинским соглашениям - 2012, результаты регистрации массы легких по результатам КТ, маркеры воспаления и прочие методы, использовавшиеся ранее для оценки повышенной проницаемости капилляров являются малодоступными и зачастую опасными для больного в критическом состоянии часто опасными, поэтому эксперты пришли к заключению, что особой пользы это не принесет.
Лабораторная диагностика
Лабораторные признаки малоспецифичны для ОРДС. За исключением кислотно-щелочного состояния (КЩС), большинство лабораторных признаков связаны с основным заболеванием, поскольку ОРДС часто сопутствует системной воспалительной реакции организма на инфекцию или другие факторы.
2. Общий анализ крови:
- лейкоцитоз или лейкопения;
- анемия;
- нередко - тромбоцитопения, отражающачя системную воспалительную реакцию или повреждение эндотелия.
3. Биохимия: возможно выявление недостаточности функции печени (цитолитиз, холестаз) или почек (повышение креатинина, мочевины). это связано с тем, что ОРДС часто является проявлением полиорганной недостаточности.
4. Бронхоальвеолярный лаваж. В первые дни заболевания характерной находкой у больных ОРДС является высокое содержание нейтрофилов – более 60% (в норме менее 5%), которое по мере обратного развития заболевания уступает место альвеолярным макрофагам.
Дифференциальный диагноз
Проводят дифференциальную диагностику ОРДС со следующими заболеваниями:
1. Кардиогенный отек легких. Для исключения данного заболевания проводится эхокардиография.
2. Острая интерстициальная пневмония является редкой и быстро прогрессирующей формой поражения легких. Характерные проявления: эозинофилия и нейтрофилия жидкости, полученной при бронхоальвеолярном лаваже (БАЛ). Для подтверждения диагноза проводят патогистологическое исследование.
3. Идиопатическая острая эозинофильная пневмония развивается на фоне полного здоровья и проявляется кашлем, одышкой, лихорадкой, иногда болью в грудной клетке. Содержание эозинофилов (обычно порядка 40%) повышено в крови и в жидкости, полученной при БАЛ. Заболевание имеет место быстрый ответ на кортикостероиды (в течение 48 часов).
4. Диффузное альвеолярное кровоизлияние определяется если у пациента с признаками острой респираторной недостаточности присутствует резкое снижение содержания гемоглобина в крови. При бронхоскопии, как правило, видна кровь, даже при отсутствии кровохарканья. Диагностическое значение имеет появление макрофагов, насыщенных гемосидерином, через 48 часов после начала заболевания.
5. Злокачественное новообразование (в особенности лимфогенный карциноматоз) может симулировать картину ОРДС в случае быстрого диссеминирования в тканях легких. Для дифференциации применяют бронхоскопию с БАЛ и биопсией.
МКБ-10
Общие сведения
Резкое снижение оксигенации и вентиляции организма вызывает кислородную недостаточность сердца и головного мозга и развитие угрожающих для жизни состояний. При РДСВ летальность в случае несвоевременно или неадекватно оказанной помощи достигает 60-70%.

Причины РДСВ
Механизмом, запускающим развитие респираторного дистресс-синдрома, служит эмболизация мелких сосудов легких микросгустками крови, частичками поврежденных тканей, каплями жира на фоне образующихся в тканях токсичных биологически активных веществ — кининов, простагландинов и др. Микроэмболизация легочных сосудов развивается в результате прямого или опосредованного воздействия на капиллярно-альвеолярную мембрану легочных ацинусов различного рода повреждающих факторов.
Прямое повреждающее воздействие оказывает аспирация крови, рвотных масс и воды, вдыхание дыма и токсических веществ, контузия легких, перелом ребер, разрыв диафрагмы, передозировка наркотических средств. Опосредованное, непрямое повреждение капиллярно-альвеолярных мембран вызывает активация и агрегация форменных элементов крови при бактериальных и вирусных пневмониях, сепсисе, ожогах, сочетанных травмах и травматическом шоке, сопровождающихся массивной кровопотерей, панкреатите, аутоиммунных процессах, электротравме, эклампсии и т. д.
Патогенез
Повышение проницаемости мембраны для белка и жидкости вызывает отек интерстициальной и альвеолярной тканей, снижение растяжимости и газообменной функции легких. Эти процессы приводят к развитию гипоксемии, гиперкапнии и острой дыхательной недостаточности. Респираторный дистресс-синдром может развиваться на протяжении нескольких часов или суток от момента воздействия повреждающего фактора. В течении РДСВ выделяют три патоморфологические фазы РДСВ:
- Острая фаза (до 2-5 суток) – интерстициальный и альвеолярный отек легких, поражение капилляров легких и эпителия альвеол, развитие микроателектазов. В случае благоприятного течения респираторного дистресс-синдрома спустя несколько дней острота явлений стихает, транссудат рассасывается; в противном случае возможен переход в подострое либо хроническое течение.
- Подострая фаза – развитие бронхоальвеолярного и интерстициального воспаления.
- Хроническая фаза – соответствует развитию фиброзирующего альвеолита. Происходит утолщение и уплощение капиллярно-альвеолярных мембран, разрастание в них соединительной ткани, формирование микротромбозов и запустевание сосудистого русла. Исходом хронической фазы респираторного дистресс-синдрома служит развитие легочной гипертензии и хронической дыхательной недостаточности. Выраженный альвеолярный фиброз может возникнуть уже спустя 2-3 недели.
Симптомы РДСВ
Развитие респираторного дистресс-синдрома взрослых характеризуется последовательной сменой стадий, отражающих патологические изменения в легких и типичную картину остро нарастающей дыхательной недостаточности.
- I (стадия повреждения) – первые 6 часов со времени воздействия стрессового фактора. Жалобы, как правило, отсутствуют, клинико-рентгенологические изменения не определяются.
- II (стадия мнимого благополучия) – от 6 до 12 часов со времени воздействия стрессового фактора. Развиваются нарастающая одышка, цианоз, тахикардия, тахипноэ (учащение дыхания более 20 в мин.), беспокойство пациента, кашель с пенистой мокротой и прожилками крови. Одышка и цианоз не купируются кислородными ингаляциями, содержание кислорода в крови неуклонно падает. Аускультативно в легких – хрипы, крепитация; рентгенологические признаки соответствуют диффузному интерстициальному отеку.
- III (стадия дыхательной недостаточности) – спустя 12-24 часа после воздействия стрессового фактора. Клокочущее дыхание с выделением пенистой розовой мокроты, нарастающая гипоксемия и гиперкапния, поверхностное дыхание, увеличение центрального венозного и снижение артериального давления. По всей поверхности легких выслушиваются влажные, множественные хрипы различного калибра. На рентгенограммах определяется слияние очаговых теней. В этой стадии происходит образование гиалиновых мембран, заполнение альвеол фибрином, экссудатом, распадающимися кровяными тельцами, поражение эндотелия капилляров с образованием кровоизлияний и микроателектазов.
- IV (терминальная стадия) - метаболический ацидоз, гипоксемия и гиперкапния не устраняются предельно большими объемами интенсивной терапии и ИВЛ. Ложноположительная рентгенологическая динамика (появление очагов просветлений) вызвана разрастанием соединительной ткани, замещающей паренхиму легких. В этом терминальном периоде респираторного дистресс-синдрома развивается полиорганная недостаточность, характеризующаяся:
- артериальной гипотонией, выраженной тахикардией, фибрилляцией предсердий, желудочковой тахикардией;
- гипербилирубинемией, гиперферментемией, гипоальбуминемией, гипохолестеринемией;
- ДВС-синдромом, лейкопенией, тромбоцитопенией ;
- повышением мочевины и креатинина, олигурией;
- желудочно-кишечными и легочными кровотечениями;
- угнетением сознания, комой.
Осложнения
В ходе купирования респираторного дистресс-синдрома возможны осложнения в виде баротравм легких, бактериальных пневмоний, развития ДВС-синдрома, левожелудочковой сердечной недостаточности. Проявлениями баротравмы, развивающейся вследствие проведения аппаратной вентиляции легких, служат подкожная эмфизема, пневмоторакс, пневмомедиастинум. Повышенный риск развития баротравм у пациентов с респираторным дистресс-синдромом обусловлен перерастяжением альвеол при снижении эластичности легочной ткани.
Острая левожелудочковая недостаточность (или кардиогенный отек легких) при РДСВ обусловлена застоем кровообращения в малом круге. ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) развивается при сепсисе, панкреонекрозе и других повреждающих факторах и выражается в полиорганном поражении различных систем.
Диагностика
Характерным показателем газового состава крови при РДСВ является РаО2 ниже 50 мм рт. ст. (гипоксемия), несмотря на проводимую оксигенотерапию (при FiО2 более >60%.), нарастание гиперкапнии. У пациентов с РДСВ выраженная дыхательная недостаточность и гипоксемия сохраняются даже при ингаляциях высококонцентрированной кислородной смеси.
Биохимические показатели венозной крови характеризуются гипоальбуминемией, повышением свертывающих факторов, нарастанием трансаминаз и билирубина. При рентгенографии легких на периферии выявляются диффузные множественные тени (симптом "снежной бури"), снижение прозрачности легочной ткани, плевральный выпот обычно отсутствует.
Лечение респираторного дистресс-синдрома
Лечение респираторного дистресс-синдрома осуществляется в условиях отделения интенсивной терапии и реанимации. Мероприятия по купированию РДСВ включают:
- устранение стрессового повреждающего фактора;
- коррекцию гипоксемии и острой дыхательной недостаточности;
- лечение полиорганных нарушений.
На первом этапе лечения респираторного дистресс-синдрома устраняются прямые повреждающие факторы легких, назначается массивная антибактериальная терапия при бактериальных пневмониях, сепсисе, осуществляется соответствующее лечение ожогов и травм. Для устранения гипоксии проводится подбор адекватного режима кислородотерапии с динамическим контролем газов крови (с поддержанием РО2 не менее 60 мм рт.ст.). Подача кислорода может осуществляться чрез маску или носовой катетер, при неэффективной оксигенации показана ИВЛ (при ЧД 30 в минуту).
Для профилактики развития ДВС-синдрома назначаются ацетилсалициловая кислота, дипиридамол и реополиглюкин, гепарин. Несмотря на интерстициальный и альвеолярный отек, проводится инфузионная терапия для улучшения питания органов, нормализации диуреза и поддержания уровня АД. Эффективность лечения респираторного дистресс-синдрома зависит от его своевременности: оно успешно лишь на ранних стадиях данного состояния до наступления необратимых поражений легочной ткани.
Прогноз и профилактика
Летальность в III стадии респираторного дистресс-синдрома составляет около 80%, в терминальной стадии, соответствующей полиорганной недостаточности, обычно все пациенты погибают. При благоприятном исходе после купирования РДСВ функция легких может практически полностью восстановиться, однако чаще требуется длительная поддерживающая терапия.
Специфические профилактические мероприятия респираторного дистресс-синдрома отсутствуют. Следует остерегаться воздействия стрессовых повреждающих факторов, ведущих к развитию РДСВ.
2. Острый респираторный дистресс-синдром в педиатрической практике/ Александрович Ю.С., Пшениснов К.В.// Вестник интенсивной терапии. – 2014 - No3.
4. Классификация острого респираторного дистресс-синдрома/ Мороз В.В., Голубев А. М. .// Общая реаниматология. – 2012 - №4(4).

Острый респираторный дистресс-синдром характеризуется сложными механизмами патогенеза, тяжелыми нарушениями газообмена в легких и высокой летальностью, что и определяет необходимость поиска новых путей улучшения диагностики и результатов лечения этого заболевания.
Несмотря на развитие медицинских технологий, за последние 20 лет отмечается только тенденция к снижению летальности больных с ОРДС, которая, к сожалению, остается очень высокой - от 22% до 74%.
Благодаря развитию современных медицинских технологий, имеется большой арсенал методов диагностики и лечения ОРДС.
Глава I: Этиология. Патогенез.Патоморфологические изменения.
Этиология
Синдром описан Эсбахом в 1967 г. и назван по аналогии с дистресс-синдромом новорожденных, который обусловлен врожденным дефицитом сурфактанта. При респираторном дистресс-синдроме взрослых дефицит сурфактанта вторичен. В литературе часто используются синонимы респираторного дистресс-синдрома взрослых: шоковое легкое, некардиогенный отек легких.
Непосредственными и наиболее частыми причинами острого респираторного дистресс-синдрома взрослых являются сепсис (в том числе абдоминальный), панкреатит, генерализованные лёгочные инфекции. К развитию синдрома может привести аспирация кислого желудочного содержимого, пресной или солёной воды, вдыхание ядовитых газов или дыма, ингаляция кислорода в высоких концентрациях. Часто первичными этиологическими факторами острого респираторного дистресс-синдрома взрослых служат травма и травматический шок. Острый респираторный дистресс-синдром взрослых осложняет ожоги и механические повреждения, в том числе переломы костей, травмы головы, ушиб лёгких, повреждения внутренних органов. Это осложнение нередко развивается после оперативных вмешательств, у пациентов с онкологическими заболеваниями после операций типа Герлока и Льюиса. Массивная трансфузия консервированной крови без микрофильтров также может быть источником значительного лёгочного микроэмболизма и первичным этиологическим фактором заболевания. Доказана возможность развития респираторного дистресс-синдрома взрослых после применения экстракорпорального кровообращения ("постперфузионное лёгкое").
Диссеминирование внутрисосудистое свёртывание крови – одна из причин полиорганной недостаточности и лёгочной дисфункции. Перенесённые критические состояния (длительная гипотензия, гиповолемия, гипоксия, кровопотеря), переливание больших объёмов крови и растворов рассматриваются как возможные этиологические факторы острого респираторного дистресс-синдрома взрослых. Жировая эмболия – одна из причин лёгочного поражения. Лекарственные препараты (наркотические анальгетики, декстраны, салицилаты, тиазиды и другие) также можно стать причиной этого осложнения.
Патогенез
Основная патология – повреждение (разрушение) лёгочного альвеолярно-капиллярного барьера. Патофизиологические изменения: набухание и отёк альвеолярно-капиллярной мембраны, образование в ней межклеточных щелей, развитие интерстициального отёка. Острый респираторный дистресс-синдром взрослых – это не просто форма лёгочного отёка, вызванная повышенной капиллярной проницаемостью, но и проявление общей системной патологической реакции, приводящей к дисфункции не только лёгких, но и других органов.
Патофизиологические последствия лёгочного отёка при респираторном дистресс-синдроме взрослых включают уменьшение лёгочных объёмов, значительное снижение податливости лёгких и развитие больших внутрилёгочных шунтов. Преобладание кровотока в соотношении вентиляция/кровоток обусловлено перфузией невентилируемых сегментов лёгкого. Снижение остаточного объёма лёгких тоже отражается на неравномерности этого соотношения.
Разрушение лёгочного сурфактанта и уменьшение его синтеза также могут быть причинами снижения функциональных лёгочных объёмов и способствовать нарастанию отёка лёгких. Увеличение поверхностного натяжения альвеол снижает гидростатическте давление в интерстиции и способствует повышению содержания воды в лёгких. Уменьшение податливости отёчного лёгкого приводит к интенсификации работы органов дыхания и сопровождается усталостью дыхательной мускулатуры. Количественно степень отёка лёгких соответствует объёму внутрисосудистой воды в лёгких, величина которого постепенно увеличивается, что во многом обусловливает клиническую и рентгенологическую картину нарушения. Неспецифическая диссеминированная реакция способствует образованию внутрисосудистых тромбов в системе лёгочной артерии и повышению давления в ней. Симптом повышения давления в системе лёгочной артерии обычно обратим, не связан с левожелудочковой недостаточностью и, как правило, не превышает 18 мм Hg. Обратимость лёгочной гипертензии при остром респираторном дистресс-синдроме взрослых в пределах 72 часов его развития подтверждается при назначении нитропруссида. Иными словами, лёгочная гипертензия при остром респираторном дистресс-синдроме взрослых не носит столь манифестирующего характера, как при гидростатическом (кардиогенном) отёке лёгких. Обычно давление заклинивания лёгочной артерии бывает в пределах нормы. Лишь в терминальной стадии острого респираторного дистресс-синдрома взрослых возможно повышение давления заклинивания лёгочной артерии, что связано с сердечной недостаточностью. У пациентов, умирающих от прогрессирования лёгочной недостаточности и неспособности лёгких выполнять газообменную функцию при остром респираторном дистресс-синдроме взрослых, обычно наблюдается выраженное снижение податливости (растяжимости) лёгких, глубокая гипоксемия и увеличение мёртвого пространтсва с гиперкапнией. При патоморфологических исследованиях у них выявляется обширный интерстициальный и альвеолярный фиброз.
Глава II: Клиническая картина. Диагностика.Лечение острого респираторного дистресс-синдрома взрослых. Осложнения. Прогноз.
Клиническая картина
Признаки острого респираторного дистресс-синдрома взрослых могут быть вначале невыраженными и оставаться незамеченными: могут развиваться в течение нескольких часов или дней (например, при сепсисе). Иногда развитие острого респираторного дистресс-синдрома взрослых совпадает с инцидентом, который может вызвать это осложнение (например, аспирация желудочного содержимого). Общие признаки – одышка, сухой кашель, дискомфорт за грудиной, состояние неполной адекватности. Более отчётливые признаки появляются при умеренно выраженной или тяжёлой форме острого респираторного дистресс-синдрома взрослых. В этот период развивается цианоз. При аускультации лёгких – бронхиальное дыхание, возможны грубые крипитирующие хрипы. Состояние пациента ухудшается: у него нарастает тяжёлая дыхательная недостаточность по гипоксемическому варианту. Острый респираторный дистресс-синдром взрослых достигает пика в среднем через 24—48 часов от начала повреждения и заканчивается массивным, обычно двусторонним поражением лёгочной ткани.
Выделяются 4 стадии острого респираторного дистресс-синдрома взрослых:
1-я стадия – повреждение (до 6 часов после стрессового воздействия).§ Пациент, как правило, не предъявляет никаких жалоб. Обычно при клиническом и рентгенологическом исследованиях изменений в лёгких не выявляются;
2-я стадия – мнимое благополучие (6—12 часов после стрессового воздействия). Наиболее ранний признак острого респираторного дистресс-синдрома взрослых – одышка; затем появляется тахикардия, снижается РаО2, возникают сухие хрипы в лёгких, жёсткое дыхание. На рентгенограмме – усиление сосудистого компонента лёгочного рисунка, переходящее в интерстициальный отёк лёгких.
3-я стадия – дыхательная недостаточность (12—24 часа после стрессового воздействия). Одышка, тахипноэ, участие вспомогательной мускулатуры в дыхании, тахикардия, цианоз, РаО2 менее 50 мм Hg, несмотря на ингаляцию 60 % кислорода. Появление влажных хрипов в лёгких свидетельствует о накоплении жидкости в альвеолах. На рентгенограмме – выраженный интерстициальный отёк лёгких, на фоне усиленного сосудистого рисунка очаговоподобные тени, иногда горизонтальные линии. Видны явные инфильтративные тени, представляющие периваскулярную жидкость. В связи с тяжестью состояния рентгеноргафическое исследование лёгких приходится проводить в положении пациента лёжа, при этом он ме не может сделать полноценный вдох и задержать дыхание. В этих случаях на рентгенограмме – кажущееся расширение скрдечно-сосудистой тени, что иногда трактуется как кардиогенный отёк лёгких.
4-я стадия – терминальная. Прогрессирование симптомов: глубокая артериальная гипоксемия, цианоз, сердечно-сосудистая недостаточность, шок, полиорганная недостаточность, альвеолярный отёк лёгких.
Диагностика
В связи с отсутствием чувствительных маркёров лёгочного эпителиального и эндотелиального повреждения диагноз острого респираторного дистресс-синдрома взрослых ставится на основании комплекса клинических, лабораторных и рентгенологических данных.
Газовый состав артериальной крови. Обычно наблюдается выраженная артериальная гипоксеми, во многих случаях гипокапния. При прогрессировании синдрома РаО2 < 50 мм Hg, несмотря на оксигенотерапию (FiО2 >0,6), в поздней стадии заболевания возможна гиперкапния.
Рентгенография грудной клетки. На рентгенограмма вначале отмечаются малоинтенсивные пятнистые затемнения с нечёткими контурами диаметром 0,3 см, располагающиеся по периферии на фоне умеренного снижения прозрачности лёгочной ткани и значительного усиления лёгочного рисунка; в дальнейшем – усиление мелкоклеточной пятнистости по всему лёгочному полю, но с преобладанием её по периферии. Снижается прозрачность лёгочной ткани, и это распространяется на большие участки лёгких (диффузные двусторонние инфильтраты). Во многих случаях бывает рентгенологически трудно дифференцировать некардиогенный отёк лёгких от кардиогенного.
Лечение острого респираторного дистресс-синдрома взрослых
Основные цели терапии острого респираторного дистресс-синдрома взрослых:
поддержание адекватного транспорта кислорода;
уменьшение лёгочного отёка (накопления воды в лёгких) без угрозы для почечной функции;
профилактика и борьба с инфекциями и суперинфекциями; адекватное питание (энтеральное и парэнтеральное).
При остром респираторном дистресс-синдроме взрослых катетеризация лёгочной артерии является важной диагностической манипуляцией, позволяющей в процессе лечения дать оценку давления заклинивания лёгочной артерии, уровня кислорода, провести выбор величины положительного давления в конце выдоха и баланса жидкости в организме.
Поддержание адекватного транспорта кислорода. Ликвидация гипоксии достигается путём улучшения лёгочного, циркуляторного, гемического и тканевого транспортов кислорода.
Респираторная поддержку необходимо проводить у всех пациентов с острым респираторным дистресс-синдромом лёгких при первых же признаках дыхательной недостаточности. Необходимо подчеркнуть важность ранней вспомогательной вентиляции, поскольку длительная дисфункция лёгких не обеспечивает потребностей тканей в кислороде, что приводит к клеточной смерти и полиорганной недостаточности. Если масочный способ вспомогательной искусственной вентиляции лёгких не даёт положительного результата, следует провести интубацию трахеи. Решающую роль играет выбор режима вспомогательной искусственной вентиляции лёгких. В некоторых случаях отказ от применения традиционной искусственной вентиляции лёгких даёт больший эффект. Сразу же после интубации трахеи респиратор необходимо установить в режим вспомогательной искусственной вентиляции лёгких при сохранённм самостоятельном дыхании. Наиболее целесообразным считается режим синхронизированной перемежающейся принудительной вентиляции (SIMV) в сочетании с поддержкой давлением (CPAP). Важен контроль концентрации вдыхаемого кислорода, давления на вдохе и дыхательного объёма (8—12 мл/кг массы тела пациента). Нет доказательств, что режимы высокочастотной искусственной вентиляции лёгких могут улучшить результаты лечения пациентов с острым респираторным дистресс-синдромом взрослых.
Режим положительного давления в конце выдоха – наиболее эффективный способ поддержания адекватного насыщения организмом кислородом у пациентов с острым респираторным дистресс-синдромом взрослых. Этот метод улучшает насыщение крови кислородом, способствует повышению функциональной остаточной ёмкости лёгких и восстановлению спавшихся альвеол. При остром респираторном дистресс-синдроме взрослых нужно обращать внимание как на показатели газового состава крови, так и на гемодинамику. Поддержание адекватного транспорта кислорода требует постоянного контроля параметров гемодинамики. Снижение сердечного выброса обусловливает необходимость обязательного применения средств инотропной поддержки. При этом используются симпатомиметические лекарственные препараты – добутамин в дозе 2—15 мкг/кг/мин или допамин в низких или средних дозах (до 10 мкг/кг/мин). В более высоких дозах допамин вызывает сужение лёгочных вен и повышает давление заклинивания лёгочной артерии. Вазоплегические лекарственные препараты при остром респираторном дистресс-синдроме взрослых противопоказаны. Величины доставки и потребления кислорода – важные критерии в лечении острого респираторного дистресс-синдрома взрослых. Доставку (норма 110 мл/м2) нужно поддерживать на сверхнормальном уровне.
Профилактика и лечение инфекций. Если острый респираторный дистресс-синдром взрослых возник в результате сепсиса или системной воспалительной реакции, применяются все методы лечения, включая массивную антибактериальную терапию. Важно не допустить развития новых инфекционных осложнений: нозокомиальной пневмонии и других суперинфекций, значительно ухудшающих результаты лечения.
Осложнения
В процессе лечения острого респираторного дистресс-синдрома взрослых важно учитывать возможность осложнений: баротравмы лёгких, бактериальной пневмонии, левожелудочковой недостаточности, синдрома диссеминированного внутрисосудистого свёртывания крови. Баротравма лёгких (клинические симптомы: пневмоторакс, пневмомедиастинум, подкожная эмфизема) – частое осложнение при проведении искусственной вентиляции лёгких у пациентов с респиратоным дистресс-синдромом взрослых. Высокий риск баротравмы обусловлен значительным снижением податливости лёгких. Этот риск особенно велик при показателе податливости лёгких менее 20 см Н2О.
Скорее всего, баротравма обусловлена перерастяжением отдельных альвеол, что коррелирует с высоким пиковым давлением вдоха. Левожелудочковая недостаточность может быть вызвана многими причинами, и надёжным контролем служит гемодинамический мониторинг, включая давление заклинивания лёгочной артерии.
Прогноз
Статистически не было доказано преимущество какой-либо методики лечения в уменьшении показателя смертности при остром респираторном дистресс-синдроме взрослых. Частота летальных исходов возрастает , если в процесс вовлечены другие органы. Смертность у пациентов с острым респираторным дистресс-синдромом взрослых в большей степени зависит от наличия полиорганной недостаточности и в меньшей – от лёгочной дисфункции. После перенесённого отсрого респираторного дистресс-синдрома взрослых, как это ни удивительно, лёгкие могут восстановить почти нормальную функцию. Однако в исходе этого синдрома могут развиваться состояния, требующие длительного респираторного лечения.
Заключение
Однако сложные механизмы патогенеза, отсутствие научно обоснованного комплексного подхода к профилактике, дифференциальной диагностике и дифференцированному лечению ОРДС, вызванного различными причинами на разных стадиях заболевания, определяют сохраняющуюся высокую летальность данного контингента больных. Этим обусловлена необходимость поиска новых путей улучшения результатов лечения ОРДС.
Список литературы
Афонин А. Н., Мороз В. В., Карпун Н. А. Острое повреждение лёгких, ассоциированное с трансфузионной терапией. Общая реаниматология 2009;
Багненко С. Ф., Шах Б. Н., Лапшин В. Н. Коррекция расстройств микроциркуляции и профилактика реперфузионных нарушений у пострадавших с сочетанной шокогенной травмой. Клиническая физиология микроциркуляции 2007;
Бородай Е. А. Морфологические изменения в легких у пострадавших с тяжелой механической травмой. Труды НИИ общей реаниматологии РАМН. М., 2003:
Власенко А.В., Закс И.О., Мороз В.В. Нереспираторные методы терапии синдрома острого паренхиматозного поражения легких (обзор зарубежной литературы, часть I)// Вестник интенсивной терапии, 2001. - №2.
Галушка С. В., Мороз В. В., Власенко А. В. Кислородный долг как критерий прогноза у больных с полиорганной недостаточностью. Анест. и реаниматол. 2001;
Городовикова Ю. А., Голубев А. М., Мороз В. В. Аспирационное острое повреждение лёгких (экспериментальное, морфологическое исследование). Общая реаниматология 2008;
ФГБОУ ВО СГМУ Минздрава России, Архангельск, Россия
Взаимосвязь параметров гемодинамики с метаболическими показателями и клиническим исходом при сепсисе и остром респираторном дистресс-синдроме
Журнал: Анестезиология и реаниматология. 2018;(4): 69‑75
ФГБОУ ВО СГМУ Минздрава России, Архангельск, Россия
В отличие от гипотетической модели равенства органов и схожести сосудистой архитектоники в реальности практически все органы имеют систему ауторегуляции кровотока через собственную сосудистую систему, которая находится под иерархическим влиянием глобальной системы регуляции кровообращения, определяемой важностью данного органа для жизнеобеспечения [4, 5]. Кроме того, некоторые органы, такие как почки и печень, имеют сложную сосудистую архитектонику, что возлагает на их систему ауторегуляции особую ответственность за обеспечение адекватного кровоснабжения органа. В таких сложных сосудистых системах кровоток определяется не столько глобальным потоком крови, сколько давлением крови, которое создается на входе в систему кровоснабжения органа [4]. Вместе с тем все органы компактно размещены в различных полостях (полость черепа, грудная клетка, брюшная полость, фасциальное пространство и т. д.), и эффективность кровоснабжения органов данной полости среди прочего будет определяться перфузионным давлением — разницей между средним артериальным давлением (АДср), обеспечивающим приток крови в данную полость, и внутриполостным давлением [6].
Определенная загадка регуляции кровообращения заключается в том, что кровеносные сосуды не имеют рецепторов потока, тогда как содержат достаточно хорошо изученные рецепторы давления. По всей видимости отсутствие рецепторов потока компенсируется за счет метаболической регуляции локального и глобального кровотока веществами, вырабатываемыми органами в зависимости от адекватности их кровоснабжения [4, 7].
Цель исследования — оценка кумулятивного влияния гипотензии, низкого сердечного выброса и их комбинации на показатели метаболизма и клинический исход у пациентов с сепсисом и острым респираторным дистресс-синдромом (ОРДС).
Материал и методы
После сбора всего пула данных и объединения их в общую базу с целью выявления влияния параметров гемодинамики (АДср и СИ) на исход критического состояния выполнена оценка распределения соответствующих гемодинамических показателей, а также сопоставленных пар данных АДср и СИ (АДср—СИ) в зависимости от клинического исхода.
Для последующего анализа сформированные пары АДср—СИ разделены на четыре гемодинамические группы в зависимости от значения отдельных показателей в паре относительно нижней границы нормы для данного показателя (65 мм рт.ст. для АДср и 2,5 л/мин/м 2 для СИ): низкое АДср—низкий СИ (низ.АДср—низ.СИ); низкое АДср—нормальный и высокий СИ (низ.АДср—норм.в.СИ); нормальное и высокое АДср—низкий СИ (норм.в.АДср—низ.СИ); и нормальное и высокое АДср—нормальный и высокий СИ (норм.в.АДср—норм.в.СИ). В дальнейшем выполнена оценка усредненной частоты пребывания пациентов в каждой гемодинамической группе в зависимости от клинического исхода — соотношение количества пар данных в отдельной гемодинамической группе к общему количеству пар АДср—СИ в каждом из клинических исходов. Кроме того, определили распределение частот пребывания пациентов в состоянии неоптимальной гемодинамики (объединенные данные групп низ. АДср—низ.СИ, низ. АДср—норм.в.СИ и норм.в.АДср—низ.СИ) в зависимости от клинического исхода.
В последующем провели оценку абсолютных значений метаболических показателей (лактата, избытка оснований) (BE — base excess) и центральной венозной сатурации — ScvO2), а также распространенности лактат-ацидоза (лактат >2 ммоль/л и BE
Статистический анализ. Количественные непрерывные данные представлены в виде медианы (25-го—75-го процентилей), частотные характеристики представлены в виде процентов от общего. Межгрупповые различия частотных показателей оценивали, используя тест χ 2 . Межгрупповые различия в количественных непрерывных данных оценивали с помощью теста Краскела—Уоллиса, с последующим попарным сравнением, используя тест Манна—Уитни с поправкой на множественные сравнения. Для всех тестов различия считались значимыми при p
Результаты
В анализ включены данные 106 пациентов, при этом получено 730 гемодинамических пар данных. Общая летальность составила 58%. За исключением двух пациентов летальный исход у всех умерших наступил в отделении интенсивной терапии.
На рисунке Распределение гемодинамических пар данных среднее артериальное давление—сердечный индекс в зависимости от клинического исхода. Черными линиями отмечены нижние границы нормальных значений для сердечного индекса (вертикальная линия) и среднего артериального давления (горизонтальная линия). представлен график распределения гемодинамических пар данных АДср—СИ в зависимости от клинического исхода. Усредненная частота выявления гемодинамических пар в каждой из 4 гемодинамических групп в зависимости от клинического исхода представлена в табл. 2. Таблица 2. Усредненная частота выявления гемодинамических пар данных в зависимости от клинического исхода Примечание. Данные представлены в виде процентов (%) от общего. норм.в.АДср—низ.СИ — гемодинамическая группа с показателями СИ p<0,001).
Значения метаболических показателей и частота наблюдения лактат-ацидоза в зависимости от гемодинамической группы представлены в табл. 3, а Таблица 3. Показатели плазменной концентрации лактата, избытка оснований, центральной венозной сатурации и частота выявления лактат-ацидоза в зависимости от гемодинамической группы Примечание. Данные представлены в виде медианы (25-го—75-го процентилей); *— p
В проведенном нами анализе выявлено, что низкое АДср определялось на 14,7% этапов исследований у умерших пациентов и лишь на 5,9% этапов у выживших. В цифровом выражении это близко к распределению частоты выявления низкого СИ среди умерших и выживших (13,7 и 4,7% соответственно). Однако при графическом сопоставлении соответствующих пар данных АДср—СИ в зависимости от клинического исхода отмечено, что среди выживших пациентов практически не наблюдалось ситуаций, когда какой-либо из показателей гемодинамической пары АДср—СИ был ниже границы своей нормы, тогда как среди показателей у умерших пациентов выявлено достаточно много таких отклонений (см. рисунок). В целом состояние неоптимальной гемодинамики наблюдалось более чем 25% этапов исследований у умерших пациентов, при этом не превышало 10% у выживших пациентов. Известно, что неблагоприятный исход может развиться не только при кратковременном высокоинтенсивном воздействии патологического фактора, приводящем к моментальному нарастанию значительной кислородной задолженности, но и в случае длительного или повторного субмаксимального воздействия, сопровождающегося проградиентным ухудшением органной функции. Наши результаты согласуются и с результатами других авторов. Так, в ряде работ [14, 15] показано, что эпизоды гипотензии при некардиохирургических вмешательствах ассоциируются с ростом частоты острого повреждения почек и повреждением миокарда. Кроме того, кумулятивная гипотензия во время некардиохирургических вмешательств ассоциируется с ростом вероятности летального исхода [16, 17].
Предпочтительность стратегии норм.в.АДср—норм.в.СИ (АДср ≥65 мм рт.ст. и СИ ≥2,5 л/мин/м 2 ) в нашей работе подтверждается наименьшими показателями лактата, дефицита оснований и частоты лактат-ацидоза в сравнении с группами неоптимальной гемодинамики. При этом параллельно с нарастанием нарушений гемодинамики отмечается прогрессивное ухудшение метаболических показателей, достигающее максимума при АДср
Наше исследование имеет ряд ограничений. В связи с техническими сложностями, возникшими в период проведения отдельных проспективных исследований, в ретроспективный анализ не включен ряд данных по метаболическим показателям, что несколько снизило мощность анализа. Также одним из ограничений является использование целевого значения АДср в большинстве исследований, что искусственно могло ограничить количество пар данных с АДсрср ≥65 мм рт. ст. и СИ ≥2,5 л/мин/м 2 , мы не можем однозначно ответить на вопрос, какими средствами следует достигать этих целей.
Заключение
1. Комбинация среднего артериального давления выше 65 мм рт.ст. и сердечного индекса выше 2,5 л/мин/м 2 является более оптимальной гемодинамической целью, чем изолированное поддержание каждой из составляющей.
2. Продолжительная экспозиция субнормальных параметров гемодинамики (среднее артериальное давление ниже 65 мм рт.ст. и/или сердечный индекс ниже 2,5 л/мин/м 2 ) ассоциируется с неблагоприятным исходом критических состояний.
3. Среднее артериальное давление ниже 65 мм рт.ст. в сочетании с сердечным индексом выше 2,5 л/мин/м 2 сопровождается более выраженными метаболическими сдвигами, чем среднее артериальное давление выше 65 мм рт.ст. в сочетании с сердечным индексом ниже 2,5 л/мин/м 2 .
4. Ухудшение гемодинамических показателей в комбинации с отрицательными метаболическими сдвигами может свидетельствовать об увеличении вероятности развития неблагоприятного клинического исхода.
Финансирование. Исследование не имело спонсорской поддержки.
Авторы заявляют об отсутствии конфликта интересов
Сведения об авторах
Читайте также:

