Септический шок акушерские перитониты
Обновлено: 18.04.2024
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Особенностями течения гнойных ВЗОМТ в современных условиях являются следующие:
1. Изменение характера микробного фактора, снижение его роли на последующих этапах воспалительного процесса при возрастании роли системных нарушений. Воспалительный процесс теряет специфичность и поддерживается вторичной, преимущественно условно-патогенной флорой (эпидермальный, сапрофитный стафилококк) в ассоциации с атипичными возбудителями (хламидии, микоплазмы, вирусы генитального герпеса, цитомегаловирусы) или патогенными штаммами с множественной устойчивостью к антибиотикам.
2. Высокая инфицированность девушек возбудителями инфекций, передаваемых половым путем (ИППП), начиная с подросткового возраста. Так, в последние десятилетия отмечается рост распространенности курения, пьянства, наркомании, а также свободных сексуальных отношений среди подростков. Этому способствует снижение роли семьи, многих нравственных ценностей - целомудрия, моногамного брака, не только свободный доступ к порнографической литературе, но и прямая пропаганда свободных сексуальных отношений. Так, по данным диссертационной работы Ю.М. Белой [3], 13,5% девочек-подростков Московской области сексуально активны уже в возрасте 14 лет, к 17-летнему возрасту их число увеличивается до 27,5%, более 1 /3 девочек имели 2 половых партнеров и более. Инфицированность онкогенными штаммами ВПЧ среди сексуально-активных девочек-подростков составляет 50,5%. У всех ВПЧ-позитивных девочек диагностированы другие ИППП: генитальные микоплазмы (16,6%), хламидии (6,6%), трихомонады (13,3%), гонорея (3,3%), цитомегаловирус (23,3%), генитальный герпес (16,6%); 78% опрошенных девочек курят (64% - до 10 сигарет в день, 36% - пачку и более), алкоголь употребляют 59%.
5. Преобладание инфильтративных и некротических форм воспаления, описанных еще К.П. Улезко-Строгановой (1939) как септические, в отсутствие сопряженных с тяжестью заболевания клинических и лабораторных признаков инфекции.
7. Присоединение системных нарушений:
а) тяжелых гемостазиологических нарушений с наличием тромбоза вен матки и магистральных сосудов малого таза у 35,7% больных;
б) иммунных нарушений, которые при длительном течении воспалительного процесса носят более тяжелый характер, связанный с повреждением рецепторного аппарата и присоединением аутоиммунного компонента воспаления: повышенный уровень антител к рецепторам γ-интерферона наблюдается у 81,8% больных, при этом средний уровень их концентрации превышает физиологические показатели в среднем на 71%, отражая тяжесть деструкции (при средней степени превышая физиологическую на 14%, при тяжелой - на 80%). У 65,8% больных определяется повышенный (в среднем от 35 до 85% от физиологических значений) уровень аутоантител к фосфолипидам, ДНК, коллагену, мембранам нейтрофилов, при этом также имеется достоверное сопряжение продукции данных аутоантител и тяжести гнойного воспаления;
Таким образом, течение гнойного процесса (особенно длительное) приводит к выраженным функциональным и морфологическим нарушениям (метаболическим, иммунным, аутоиммунным, гемостазиологическим, гормональным), повреждению рецепторного аппарата и тканей матки.
Тактика ведения
Поскольку гнойное воспаление всегда сопровождается необратимыми морфологическими изменениями, понятно, что тактика ведения таких больных должна быть только активной, консервативно-хирургической с обязательным хирургическим компонентом и последующим полноценным этапом реабилитации для восстановления естественной фертильности или подготовки к вспомогательным репродуктивным технологиям. Это относится как к гинекологическим, так и акушерским больным.
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
МКБ-10
Общие сведения

Причины
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Патогенез
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Классификация
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
Осложнения
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
Диагностика
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
Прогноз и профилактика
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Акушерский перитонит — это острое воспаление брюшины, возникающее вследствие её бактериального обсеменения в родах или послеродовом периоде. Проявляется разлитой болью в животе, напряжённостью брюшной стенки, метеоризмом, задержкой стула, повышением температуры и нарастанием общей интоксикации. Для постановки диагноза используют физикальные методы обследования, УЗИ, обзорную рентгенографию живота, лабораторные методы диагностики. Лечение обычно хирургическое с экстирпацией матки и её труб. После операции пациентке показана активная антибактериальная и инфузионная терапия.
МКБ-10
Общие сведения
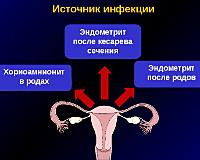
В настоящее время воспаление брюшины у родильниц возникает сравнительно редко – частота патологии обычно не превышает 0,05-0,3%. При этом из-за высокой летальности именно акушерский перитонит является одним из самых тяжёлых осложнений родов и наиболее частых причин материнской смертности. Более чем в 98% случаев заболевание развивается после оперативного родоразрешения методом кесарева сечения, гораздо реже (у 1-2% пациенток) – на фоне гнойного сальпингоофорита или септикопиемии. Распространённость патологии напрямую зависит от контингента беременных и уровня оказания медпомощи в акушерских стационарах.

Причины
Воспаление брюшины после кесарева сечения или родов — следствие дисбаланса между вирулентностью патогенных микроорганизмов и уровнем иммунной резистентности женщины. Возбудителями акушерского перитонита обычно являются грамотрицательные бактерии (протей, синегнойная и кишечная палочки) и неспорообразующие анаэробы (клостридии, фузобактерии, пептококки и особенно бактероиды). В трети случаев в перитонеальном экссудате определяются грамположительные стафилококки и энтерококки. Наиболее тяжёлые формы заболевания вызываются анаэробно-аэробными ассоциациями.
Риск возникновения послеродового перитонита повышается при длительном безводном периоде (свыше 12 часов), бактериальной обсеменённости влагалища, хорионамнионите, послеродовом эндометрите, хроническом цервиците, сальпингите, аднексите и продолжительном парезе кишечника. Специалисты в сфере акушерства и гинекологии выделяют три способа инфицирования брюшины:
- Заражение в родах. Микроорганизмы попадают в брюшную полость вместе с содержимым матки при оперативном родоразрешении беременной с хориоамнионитом.
- Проникновение через кишечную стенку. После родов на фоне длительного пареза стенка кишечника становится проницаемой для патогенной микрофлоры.
- Обсеменение из-за расхождения швов. Больше чем в половине случаев причиной перитонита является несостоятельность послеоперационных швов на матке.
При попадании микроорганизмов воспаление возникает далеко не всегда, существенную роль в развитии перитонита играет снижение резистентности. Даже при нормальной беременности и неосложнённых родах наблюдается иммунодефицит, обусловленный угнетающим действием эстрогенов, прогестерона и плацентарных белков. Вероятность акушерского перитонита увеличивается в разы при массивной кровопотере, анемии, тяжёлых гестозах, затяжном течении родов, стрессе из-за недостаточного обезболивания, нерациональном приёме антибактериальных и кортикостероидных препаратов, травматизации мягких тканей во время родов, врачебных манипуляций, оперативных вмешательств.
Патогенез
Ключевым звеном в развитии заболевания является выделение значительного количества тканевых и бактериальных токсинов при массивном обсеменении полости матки, а затем и брюшины патологическими микроорганизмами. Поступающие в кровь токсины стимулируют выход гистамина, серотонина и ряда других биоактивных веществ. В результате нарушается проницаемость сосудов и микроциркуляция крови, что приводит к её депонированию и секвестрированию, в первую очередь – в сосудах брюшины и органов брюшной полости.
Вследствие нарастающего отёка кишечника нарушается его моторика и процессы всасывания, что провоцирует накопление газов и жидкости в кишечных петлях. Дальнейшее перерастяжение стенки кишечника усугубляет расстройства микроциркуляции, усиливает дегидратацию и гидроионные нарушения. На фоне общей интоксикации, дефицита внутри- и внеклеточной жидкости нарастает ацидоз, гипокалиемия, гиповолемия, что сопровождается сгущением крови, олигурией, сердечно-сосудистыми и дыхательными расстройствами. В терминальной фазе акушерского перитонита декомпенсируются основные жизненные функции.
Классификация
При классификации воспалений брюшины, возникающих в акушерской практике, учитывают механизм инфицирования, степень распространённости патологического процесса, характер экссудата и клиническое течение. С учётом возможных путей распространения возбудителей различают:
- Первичный перитонит, при котором микроорганизмы попадают на брюшину во время кесарева сечения из матки (ранний перитонит) или из кишечника после операции.
- Вторичный перитонит, вызванный расхождением несостоятельных швов на прооперированной матке при наличии послеродового эндометрита.
По данным акушеров-гинекологов, первичное инфицирование наблюдается приблизительно в 45% случаев заболевания, симптомы воспаления возникают на 1-2 сутки при обсеменении брюшины при операции и на 3-4 сутки при парезе кишечника. Вторичный перитонит развивается на 4-9 день после вмещательства у 55% заболевших. В зависимости от степени поражения брюшины воспаление может быть общим, распространённым (диффузным или разлитым), местным ограниченным (абсцесс) или неограниченным (пельвиоперитонит). По характеру экссудата воспалительный процесс бывает серозным, фибринозным и гнойным. С учётом степени выраженности клинических проявлений различают реактивную, токсическую и терминальную стадии болезни.
Симптомы
О переходе заболевания во вторую (токсическую) фазу свидетельствует выраженный интоксикационный синдром. Пациентка ощущает слабость, заторможенность, разбитость, головокружение. Уменьшается количество мочи, нарастает метеоризм, отсутствует перистальтика кишечника. Сохраняется высокая температура. Учащается дыхание и частота сердечных сокращений. Боль и мышечное напряжение несколько уменьшаются. При неадекватном лечении через 1-3 суток заболевание переходит в терминальную стадию. Родильница продолжает жаловаться на выраженную слабость, головокружение, ощущение вздутия живота и его разлитую болезненность. Температура зачастую падает ниже 36° С.
Осложнения
При несвоевременной диагностике и неправильном лечении акушерский перитонит осложняется абсцессами брюшной полости, динамической кишечной непроходимостью, острым тромбофлебитом воротной вены, инфекциями верхних и нижних дыхательных путей (трахеобронхитом, нозокомиальной пневмонией), уроинфекцией, ДВС-синдромом, кровотечением, сепсисом и септическим шоком. В терминальной стадии у пациенток развивается полиорганная недостаточность с расстройствами сердечно-сосудистой и дыхательной деятельности, нарушениями работы почек и печени, спутанностью сознания, переходящими в кому и смерть. Отдалёнными последствиями излеченного перитонита являются нарушенная моторика кишечника, послеоперационные грыжи и спаечная болезнь, которая в 20% случаев приводит к бесплодию. У женщин, перенесших воспаление брюшины, возрастает риск развития странгуляционной кишечной непроходимости.
Диагностика
Своевременное выявление акушерского перитонита — ключевое условие для выбора правильной тактики лечения и предупреждения возможных осложнений. В диагностике применяют такие физикальные, инструментальные и лабораторные методы обследования, как:
- Пальпация живота. При воспалении брюшины определяется разлитая болезненность, метеоризм, положительные симптомы Щёткина-Блюмберга, Кулленкампфа, Раздольского.
- Перкуссия брюшной полости. В боковых флангах и внизу живота наблюдается притупление, свидетельствующее о наличии жидкости.
- Аускультациякишечника. При прослушивании отсутствуют характерные кишечные шумы.
- Микробиологическое исследование. Возбудитель заболевания определяется в отделяемом матки, крови, перитонеальном экссудате. Оценивается его чувствительность к антибиотикам.
- Общий анализ крови. Обнаруживается умеренный или выраженный лейкоцитоз, палочкоядерный сдвиг формулы, токсическая зернистость нейтрофилов, высокая СОЭ.
- Биохимическое исследование крови. Присутствуют признаки метаболического ацидоза, нарушений белкового и липидного обмена, респираторного алкалоза, повышено содержание азотистых шлаков.
- Оценка системы гемостаза. Характерна гиперкоагуляция и коагулопатия потребления.
- Общий анализ мочи. В составе мочи определяются лейкоциты, гиалиновые цилиндры, белок.
- УЗИ брюшной полости. Позади матки, в кишечнике и между его петлями выявляется жидкость, кишечная стенка гиперэхогенна, шов на матке имеет неравномерную толщину и структуру.
- Обзорная рентгенография живота. О наличии перитонита свидетельствует гиперпневматоз кишечника и чаши Клойбера.
По показаниям может быть рекомендована КТ брюшной полости и диагностическая лапароскопия. Для оценки состояния сердечно-сосудистой системы назначают ЭКГ, контролируют в динамике артериальное давление и пульс.
Дифференциальная диагностика
Дифференциальная диагностика проводится с тяжёлым послеродовым эндометритом, острым гнойным пиелонефритом, хирургическими заболеваниями (аппендицитом, острым холециститом, панкреатитом, прободением язвы желудка и т. п.). К ведению пациентки привлекают хирурга, анестезиолога-реаниматолога, терапевта, инфекциониста, клинического фармаколога.
Лечение акушерского перитонита
Консервативное лечение
Выбор лечебной тактики зависит от типа, стадии и тяжести заболевания. Консервативная терапия эффективна только в реактивной фазе раннего перитонита. Схема лечения включает:
- Антибактериальные препараты. До определения чувствительности возбудителя назначают антибиотики из групп полусинтетических пенициллинов, цефалоспоринов, аминогликозидов. В последующем лечение корригируют с учётом результатов микробиологического исследования.
- Инфузионно-трансфузионная терапия. Осуществляют управляемую гемодилюцию с использованием реокорректоров, дезинтоксикационных растворов, белковых препаратов, электролитов, анаболических гормонов. При необходимости вводят свежезамороженную плазму крови.
Хирургическое лечение
Длительность консервативной терапии обычно составляет 12-24 часа. При неэффективности медикаментозного лечения, нарастании признаков кишечной непроходимости и общей интоксикации показано хирургическое вмешательство. Релапаротомия также выполняется при акушерском перитоните, возникшем из-за пареза кишечника или расхождения шва на матке. На коротком этапе предоперационной подготовки пациентке вводят назогастральный зонд для декомпрессии желудка, назначают активную инфузионную терапию и антибиотики. В ходе операции экстирпируется матка с трубами, при гнойном оофорите производится оофорэктомия (удаляются яичники). Брюшная полость после тщательной ревизии санируется, дренируется через переднюю брюшную стенку и влагалище. Для декомпрессии кишечника по показаниям используют интестинальные зонды Эббота-Миллера.
В послеоперационном периоде продолжается инфузионная и антибиотикотерапия, корригируется гемостаз. Показано назначение общеукрепляющих средств, иммунокорректоров, гормональных и десенсибилизирующих препаратов. Симптоматическая терапия направлена на коррекцию нарушений дыхательной, сердечно-сосудистой деятельности, неврологических расстройств, возобновление полноценного функционирования печени и почек. Используются препараты, которые стимулируют и восстанавливают эвакуаторную функцию ЖКТ. Для профилактики дисбактериоза применяются различные виды эубиотиков.
Прогноз и профилактика
Акушерский перитонит принадлежит к категории тяжёлых инфекционных заболеваний. При его распространённой форме смертность составляет от 15 до 30%. Профилактика предусматривает своевременную диагностику воспалительных заболеваний женской половой сферы, обоснованное назначение инвазивных процедур во время беременности, выбор правильной акушерской тактики при преждевременном излитии или подтекании околоплодных вод. Поскольку послеродовое воспаление брюшины зачастую становится следствием кесарева сечения, важную роль играет обоснованный выбор в пользу оперативного родоразрешения. В профилактических целях всем родильницам в послеродовом периоде показана термометрия и скрининг для своевременного выявления признаков интоксикации и симптомов раздражения брюшины.
Септический шок (бактериальный, эндотоксический, инфекционно-токсический шок) представляет собой клинический синдром, который протекает на фоне генерализации септического процесса и который можно рассматривать как осложнение послеродовых и послеабортных воспалительных заболеваний.
Что провоцирует / Причины Септического шока в послеродовом периоде:
Септический шок, представляющий собой самую тяжелую клиническую форму генерализованной инфекции, развивается на фоне имеющегося сепсиса и эндотоксемии и характеризуется неполноценной перфузией системы микроциркуляции жизненно важных органов.
Летальность больных с септическим шоком достигает 62-80 %.
Патогенез (что происходит?) во время Септического шока в послеродовом периоде:
Понятие "септический шок" подчеркивает полиэтиологичность данного патологического состояния. Понятие "шок" характеризует общебиологическую сущность синдрома и отражает состояние организма, находящегося в крайне неблагоприятной ситуации, обусловленной нарушениями механизмов регуляции сосудистого тонуса, микроциркуляции и адекватной тканевой перфузии.
Среди акушерских осложнений, заболеваний и клинических состояний чаще всего к септическому шоку приводят инфицированные аборты, хориоамнионит, мастит, пиелонефрит, оперативное родоразрешение (кесарево сечение). Следовательно, септический очаг в случае послеродового сепсиса располагается чаще всего в матке. При этом входными воротами инфекции служит огромная всасывающая поверхность плацентарной площадки.
Сепсис в послеродовом периоде скоротечен, поэтому выраженные иммунные нарушения, требующие временного интервала, не успевают развиться. Тяжесть состояния в данном случае обусловливается гиперергической реакцией организма на возбудитель, который быстро размножается в матке, имеющей большую раневую поверхность и богатое кровоснабжение.
Факторы риска развития септического шока аналогичны таковым при любых других послеродовых гнойно-воспалительных заболеваний.
В ответ на острую микробную инвазию в организме повреждается практически вся система регуляции гомеостаза: гуморальная регуляция и адаптация, метаболизм, иммунитет, транспортировка кислорода, газообмен. Однако определяющими являются изменения гемодинамики по типу стойкой гипотонии с характерным для этого нарушением перфузии тканей.
Активным началом развития септического шока являются:
- компоненты оболочки грамположительных бактерий - мукопептиды;
- стафилококковый протеин А;
- эндотоксины, продуцируемые грамотрицательными микроорганизмами.
Эндотоксины представляют собой высокомолекулярный комплекс моно- и полисахаридов, который образует часть наружной клеточной стенки грамотрицательных бактерий. Биологически активным эндотоксин становится лишь при гибели микроорганизмов.
Эндотоксин воздействует на клеточно-гуморальные механизмы, поддерживающие гомеостаз, и вызывает выделение биологически активных веществ, приводящих к развитию септического шока.
Эндотоксин вызывает повреждение эндотелия, а также циркулирующих лейкоцитов и тромбоцитов. Это приводит к слущиванию клеток эндотелия сосудов, обнажению базальной мембраны сосудов, выделению гистамина и серотонина, агрегации и разрушению лейкоцитов с высвобождением в просвет сосудов протеолитических ферментов из лизосом лейкоцитов.
Важнейшим компонентом патогенеза септического шока является ДВС-синдром, развитию которого способствует:
- активация фактора XII (Хагемана);
- повреждение эндотелия сосудов с выделением тканевого тромбопластина;
- агрегация тромбоцитов;
- высвобождение АДФ, серотонина, гистамина;
- активация факторов 3 и 4 свертывания крови;
- высвобождение тромбоксана А;
- ингибиция простациклина;
- гемолиз эритроцитов;
- воздействие эндотоксина на систему комплемента и каллекреин-кининовую систему.
Таким образом, на ранних этапах действия эндотоксина происходит:
- нарушение правильного распределения кровотока в капиллярах за счет дистонии артериол вследствие чрезмерного выброса веществ, влияющих на сосудистый тонус;
- спазм артериол, их паралитическое расширение, открытие артериовенозных шунтов и сброс из них части крови;
- образование мельчайших фибриновых, тромбоцитарных и смешанных микротромбов;
- увеличение вязкости крови за счет появления мономеров фибрина в кровотоке и явлений эритроцитарного сладжа;
- ухудшение капиллярной перфузии.
Септический шок сопровождается острой циркуляторной недостаточностью с критическим снижением периферического кровотока.
В связи с изменением характера гемодинамики при сепсисе возрастает работа сердца, и в первую очередь - сердечный выброс. Существенно увеличивается работа левого желудочка. Сердечный индекс незначительно превышает норму. В связи с дальнейшим неизбежным повышением периферического сопротивления из-за развития ДВС-синдрома усиливается тканевая гипоксия, развиваются миокардиодистрофия и вторичный гиповолемический синдром, характеризующийся уменьшением притока венозной крови к сердцу и минутного объема из-за задержки жидкости на периферии. Выраженное повышение легочного сосудистого сопротивления и легочная гипертензия способствуют прогрессированию сердечной недостаточности. Избыточная нагрузка на внешнее дыхание и миокард, несоответствие между ОЦК и емкостью сосудистого русла приводят к несоответствию между потребностями организма в кислороде и питательных веществах и возможностями их доставки, к неспособности организма элиминировать продукты обмена. Результатом этого являются органные и метаболические расстройства.
Нарушение капиллярной перфузии тканей вызывает включение компенсаторно-приспособительных механизмов:
- Усиливается фибринолиз в клетках эндотелия сосудов, находящихся в контакте с тромбом, что приводит к последующему лизису тромба и восстановлению проходимости сосудов.
- Активизируются клетки системы макрофагов, обеспечивающие фагоцитоз бактерий и обезвреживание токсичных продуктов.
При существовании длительной эндотоксемии наступает декомпенсация системы гомеостаза, что приводит к дальнейшему ухудшению условий функционирования тканей организма.
Блокада микроциркуляции обусловливает:
- развитие анаэробного гликолиза;
- депонирование крови в выключенных из циркуляции участках тканей;
- нарастание метаболического ацидоза;
- резкое увеличение проницаемости клеточных мембран;
- спазм и микротромбоз капилляров почечных клубочков с нарушением их функции вплоть до анурии;
- гипоксию, отек, жировую дистрофию и некроз частей печеночных долек;
- массовую обструкцию фибриново-тромбоцитарными тромбами капилляров легочной артерии;
- отек внутриальвеолярной перегородки;
- открытие артериовенозных шунтов;
- геморрагическое пропитывание легочной ткани.
Все эти многочисленные изменения являются патофизиологической основой клинических проявлений септического шока.
Симптомы Септического шока в послеродовом периоде:
Первым проявлением шока у больных обычно является озноб, сопровождающийся гипертермией до 39-40С с последующим снижением температуры тела до субнормальной или нормальной. С первых часов заболевания отмечаются частый, но ритмичный пульс, одышка, в легких выслушиваются влажные хрипы. Артериальное давление снижается до 60/20 мм рт. ст. и менее.
При диагностике шока часто основываются на показателях артериального давления, определяемого на плечевой артерии. Однако необходимо учитывать, что септический шок может развиться и при нормальном артериальном давлении. У отдельных больных могут наблюдаться даже повышенные цифры артериального давления.
Нередко при септическом шоке на первый план выступает острая сердечная недостаточность, основными клиническими признаками которой являются гипотония или коллапс, а также увеличение и болезненность печени. Это состояние обусловлено депонированием крови на периферии, уменьшением венозного оттока, снижением сердечного дебита и уменьшением систолического выброса крови.
В диагностике септического шока крайне важное значение имеет оценка функции легких, которая нарушается вследствие блокады легочного кровотока тромбоцитарно-фибриновыми агрегатами. Обычно нарушения функции легких проявляются в виде отека и развития острой легочной недостаточности, для которых характерны тахипноэ и метаболический ацидоз. Рентгенологически во всех отделах легких обнаруживают облаковидные затемнения, являющиеся проявлением интерстициального отека легочной ткани.
В начальных стадиях развития септического шока печень и селезенка определяются в обычных границах. С увеличением продолжительности шока у больных появляются схваткообразные боли в животе, частый обильный стул. Моча кровянистая, с большим содержанием белка. Позже она становится бурой, а в последующие дни цвет ее вновь становится обычным.
Одним из характерных для септического шока объективных симптомов неадекватного кровоснабжения жизненно важных органов является нарушение функции почек, проявляющееся олигурией (выделение до 20 мл мочи за 1 ч). В дальнейшем снижается относительная плотность мочи и развивается почечная недостаточность.
При септическом шоке имеет место появление парестезии, сильных мышечных болей, которые усиливаются даже при прикосновении постельного белья.
Отмечаются некоторые изменения психики больных с септическим шоком, что вначале выражается чувством беспокойства, возбуждением, а через 4-6 ч сменяется безразличием к окружающему, некритическим отношением к своему состоянию, эйфорией.
Следует отметить, что картина септического шока во многом определяется нарушением микроциркуляции, обусловленным ДВС-синдромом, клиническая диагностика которого неотделима от диагностики септического шока.
Клиническими проявлениями ДВС-синдрома являются:
- кровоточивость в одном или нескольких местах (в месте уколов, из матки, из поврежденных при операции тканей);
- клинически выраженный гемолиз и геморрагический диатез;
- бледность и акроцианоз кожных покровов;
- нарушение функции печени и почек;
- дыхательная недостаточность;
- нарушение сознания.
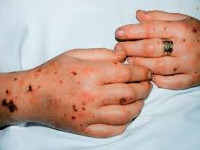
В первые часы шока багрово- красный цвет кожных покровов резко контрастирует с цианотичной окраской губ, ногтевого ложа и кончиков пальцев. К 6-12 ч заболевания на коже губ, носа и других участках появляются высыпания геморрагического характера. Геморрагический некроз кожи лица, синюшность кожи рук, ног, носа, щек и ушных раковин указывают на признаки ДВС-синдрома.
Геморрагический диатез часто также проявляется желудочно-кишечными кровотечениями, кровоизлияниями в склеры глаз и метроррагиями.
Независимо от причин шока его тяжелые клинические признаки обычно отодвигают на задний план симптомы заболевания, являющегося причиной возникновения шока.
При исследовании периферической крови в первые часы заболевания выявляется лейкопения, сменяющаяся к концу 1-х суток прогрессирующим лейкоцитозом. При бактериологическом анализе у 1/4 больных удается высеять возбудитель из крови, почти у 1/2 - из мочи и у 90 % - из шеечного канала.
Точная диагностика патологического внутри-сосудистого свертывания крови возможна лишь при своевременном лабораторном исследовании системы гемостаза.
Подострая и острая формы ДВС-синдрома у больных с септическим шоком характеризуются выраженной тромбоцитопенией (50,0 * 109/л), гипофибриногенемией (менее 1,5 г/л), повышенным потреблением антитромбина и плазминогена, резким повышением содержания дериватов фибрина и фибриногена, ПДФ, удлинением век.
При хроническом ДВС-синдроме имеют место умеренная тромбоцитопения (менее 150,0* 109/л), гипофибриногенемия, усиленное потребление антитромбина III, повышение концентрации РКМФ и ПДФ, а также реальная гиперактивность системы гемостаза.
При затянувшемся шоке (более 1 сут), как правило, имеет место волнообразное его течение со сменой в периферической крови гиперкоагуляции на гипокоагуляцию, и наоборот. Эти изменения гемостаза находятся во взаимосвязи с расстройствами микроциркуляции (спазм артериол, уменьшение количества функционирующих капилляров, внутрисосудистая агрегация эритроцитов).
Адаптационная реакция организма в ответ на инфекцию сопровождается задержкой жидкости в организме. В первые часы шока, несмотря на увеличение ОЦК, содержание натрия в плазме крови сохраняется на физиологическом уровне, а концентрация калия снижается вплоть до развития острой почечной недостаточности. Одновременно отмечаются накопление в крови недоокисленных продуктов обмена, сдвиг КОС крови в сторону дыхательного алкалоза и метаболического ацидоза.
К концу 1-х суток происходит декомпенсация метаболических нарушений, снижается рН и развивается выраженный метаболический ацидоз.
При патологоанатомическом исследовании больных, умерших от септического шока, изменения в родовых путях нередко бывают обусловлены повреждениями тканей при абортах, выкидышах или вследствие гнойно-септического процесса в матке.
Матка при этом атонична, с дряблыми стенками, зияющими сосудами, полость ее расширена, содержит сгустки крови и участки некротизированных тканей.
Если смерть больной наступает вследствие нарушения процесса отделения плаценты, то макро- и микроскопически обнаруживаются признаки септического процесса в плаценте и матке, при этом плацента имеет вид вареного мяса с резким гнилостным запахом. При микроскопическом исследовании в плаценте или ее остатках определяются очаги некроза, где содержится большое количество бактерий. В субплацентарной зоне выявляются кровоизлияния и некрозы поверхностных отделов мышцы матки. В сосудистом русле плаценты и спиральных артериях обнаруживаются множественные тромбоцитарно-фибриновые тромбы.
Для патоморфологической картины внутренних органов (почек, печени, легких, надпочечников, гипофиза, желудочно-кишечного тракта) умерших больных характерно наличие большого количества тромбоцитарно-фибриновых тромбов в микроциркуляторном русле в сочетании с многочисленными участками кровоизлияний. Эти морфологические изменения сопровождаются переполнением венозной системы кровью, депонированием ее в портальной системе кровообращения. Кровоизлияния обычно имеют петехиальный характер, они наблюдаются преимущественно в коже, слизистой оболочке желудочно-кишечного тракта, в миокарде, легких, почках, яичниках. Наиболее постоянно они возникают в корковом веществе надпочечников и стволовом отделе головного мозга.
Диагностика Септического шока в послеродовом периоде:
Диагноз септического шока устанавливают на основании анализа данных анамнеза, результатов клинического и лабораторного обследования, свидетельствующих о проявлениях бактериемии, а также на основании данных инструментальных методов исследования.
Для уточнения диагноза септического шока и проведения целенаправленной терапии в первую очередь необходимо проведение следующих мероприятий:
- контроль артериального давления, ЦВД, частоты дыхания каждые 30 мин;
- измерение ректальной температуры 4 раза в сутки, особенно после озноба, для сопоставления с данными температуры тела в подмышечной области;
- посевы крови в момент госпитализации и во время ознобов с определением чувствительности выделенной микробной флоры к антибиотикам;
- почасовой контроль за диурезом;
- выделение микробной культуры из мочи, определение чувствительности микробов к антибиотикам;
- определение содержания электролитов сыворотки, азота, мочевины, креатинина, мочевой кислоты, газов артериальной крови, рН;
- постоянный мониторный контроль ЭКГ, частоты сердечных сокращений;
- рентгенологическое исследование грудной клетки, брюшной полости при вертикальном положении пациентки для обнаружения свободного газа под диафрагмой, а также исключения инородного тела в брюшной полости;
- общий анализ крови с оценкой лейкоцитарной формулы, определение гематокритного числа;
- исследование показателей свертывания крови: количество тромбоцитов, фибриногена, РКМФ, ПДФ, антитромбина III, показателей тромбоэластограммы.
Ультразвуковое и рентгенологическое исследование, КТ и МРТ выполняют для уточнения расположения первичных и вторичных (метастатических) гнойных очагов.
Лечение Септического шока в послеродовом периоде:
Лечение септического шока основывается на следующих принципах.
- Раннее и полное удаление септического очага (матки) с широким дренированием брюшной полости.
- Проведение массивной и длительной антибактериальной терапии. При этом возможны следующие сочетания антибиотиков:
- ампициллин (4-6 г/сут) и гентамицин (240 мг/сут);
- ампициллин (4-6 г/сут) и канамицин (2 г/сут);
- бензилпенициллина натриевая соль (6000000-20000000 ЕД/сут) и гентамицин (240 мг/сут) или канамицина (2 г/сут);
- клафоран (4-8 г/сут) или цефамезин (4-8 г/сут) с гентамицином (240 мг/сут).
Эти компоненты терапии должны применяться сочетанно в наиболее ранние сроки заболевания с учетом состояния больных и показателей гемостаза.
К каким докторам следует обращаться если у Вас Септический шок в послеродовой период:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Септического шока в послеродовом периоде, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Читайте также:

