Септический шок клиника диагностика интенсивная терапия
Обновлено: 23.04.2024
Диагностика септического шока - критерии
Учитывая отсутствие в настоящее время разработанной единой научно обоснованной теории сепсиса, которая позволила бы систематизировать это заболевание, было принято прагматическое решение о достижении согласованного описательного определения сепсиса с целью его единообразной оценки, открывающей возможности проведения эпидемиологических, микробиологических, клинических и других исследований, направленных на совершенствование диагностики и лечения.
Согласно предложению совместной конференции торакального общества и специалистов по интенсивной терапии США, септическим шоком следует считать состояние тяжелого сепсиса (неконтролируемый инфекционный процесс + генерализованная воспалительная реакция + полиорганная дисфункция/недостаточность), сопровождающееся гипотонией (систолическое АД < 90 мм рт. ст. или его снижение на 40 мм рт. ст. и более от исходного), несмотря на адекватную инфузионную поддержку, наряду с присутствием признаков снижения периферического кровотока, которые могут сопровождаться повышением уровня лактата крови, олигурией или нарушением сознания, но не ограничиваться ими.
Пациенты, получающие препараты, повышающие сократительную способность сердца (инотропы) или сосудистый тонус (стимулирующие а- и допаминергические рецепторы), могут иметь признаки периферической гипоперфузии при нормальном АД.
Таким образом, можно выделить четыре ключевых признака развития септического шока (СШ):
- клиническое или лабораторное подтверждение инфекции:
• выделение бактерий из крови, стерильных полостей (плевральной и абдоминальной полостей, субарахноидального пространства, полости сустава) или воспалительных очагов в тканях;
• клинические проявления инфекции (например, перфорация полого органа);
• дополнительные признаки инфекционного заболевания (повышенное количество лейкоцитов в экссудатах из стерильных полостей, признаки пневмонии на рентгенограммах легких и др.);
- признаки генерализованной воспалительной реакции (ГВР):
• температура тела выше 38 °С или ниже 36 С;
• тахикардия более 90 в минуту;
• одышка более 20 в минуту, либо РаСО2 (напряжение углекислого газа в артериальной крови) 32 мм рт. ст. и менее, либо необходимость ИВЛ;
• лейкоцитоз более 12*10 9 /л или менее 4*10 9 /л либо количество юных форм лейкоцитов более 10%.

- артериальная гипотензия, не устраняемая с помощью адекватной по объему инфузии, или необходимость использования вазопрессоров (см. ранее);
- клинико-лабораторные признаки органной гипоперфузии:
• нарушение сознания менее 14 баллов по шкале Глазго (оценивают сумму трех видов активности в баллах: открывание глаз, двигательная активность и речевой ответ). При самостоятельном открывании глаз, способности к адекватной двигательной активности, нормальном речевом контакте выставляют оценку 15 баллов. Нарушение хотя бы одного из указанных видов активности приводит к соответствующему снижению оценки;
• гипотензия: АД + 90 мм рт. ст., либо снижение более чем на 40 мм рт. ст. ниже нормального индивидуального уровня, либо среднее АД ± ± 70 мм рт. ст. (более 1 ч);
• респираторный дистресс-синдром: острое начало, двусторонние инфильтраты на рентгенограмме легких, РаО2 < 70 мм рт. ст. при инсуфляции дыхательной смеси с концентрацией кислорода (FiО2) более 40 %, снижении величины дыхательного коэффициента (PaО2/FiО2 нормальное значение более 300) ниже 200; давление заклинивания легочной артерии (определяется в легочной артерии прямым методом с помощью катетера типа Сван-Ганса) менее 18 мм рт. ст. в отсутствие признаков перегрузки левого желудочка (необходимо исключить инфаркт миокарда и тромбоэмболию легочной артерии как причину перегрузки левого желудочка);
• нешоковое поражение легких: частота дыхания менее 5 или более 50 в минуту; проведение ИВЛ более 3 сут; необходимость инсуффляции дыхательной смеси с повышенным содержанием кислорода (Fi02 > 40 %), необходимость применения респираторной поддержки (ИВЛ) с повышенным положительным давлением в конце выдоха (ПДКВ) более 5 см вод. ст.;
• острая почечная недостаточность: уровень креатинина сыворотки более 280 ммоль/л или необходимость проведения гемофильтрации;
• острая печеночная недостаточность: желтуха, уровень общего билирубина в крови более 51 мкмоль/л или двукратное повышение АЛТ, признаки печеночной энцефалопатии;
• тромбогеморрагический синдром: снижение содержания тромбоцитов на 50 % и более от исходного уровня; увеличение протромбинового времени или активированного частичного тромбопластинового времени на 20 % и более; увеличение концентрации продуктов деградации фибриногена на 20 %, появление D-димеров в концентрации 1:40 или более 500 нг/мл.
Применительно к детям были предложены следующие критерии септического шока (СШ):
- двукратная регистрация артериальной гипотензии (снижение систолического АД более чем на 1/3 от возрастной нормы), или
- необходимость назначения вазопрессоров (за исключением пациентов, получающих допамин в дозе менее 5 мкг/кг в минуту), или - наличие одного и более признаков тяжелого сепсиса.
Признаки тяжелого сепсиса у детей включают наличие синдрома генерализованной воспалительной реакции в сочетании с неврологическими нарушениями (оценка по шкале Глазго менее 14 баллов) либо с повышением уровня лактата в крови более 1,6 ммоль/л), либо со снижением диуреза (менее 1 мл/(кг*ч) в течение 2 ч). Оценку частоты дыхания и сердечных сокращений для диагностики генерализованного воспаления проводят, исходя из границ возрастной нормы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Септический шок — это системная патологическая реакция на тяжелую инфекцию. Ее характеризуют лихорадка, тахикардия, тахипноэ, лейкоцитоз при идентификации очага первичной инфекции. При этом микробиологическое исследование крови нередко выявляет бактериемию. У части пациентов с синдромом сепсиса бактериемии не выявляют. Когда составляющими синдрома сепсиса становятся артериальная гипотензия и множественная системная недостаточность, то констатируют развитие септического шока.
Причины и патогенез развития септического шока:
Частота сепсиса и септического шока неуклонно возрастает с тридцатых годов прошлого века и, по-видимому, будет продолжать возрастать.
Тому причинами являются:
1. Все более широкое использование для интенсивной терапии инвазивных устройств, то есть внутрисосудистых катетеров и др.
2. Распространенное применение цитотоксических и иммуносупрессивных средств (при злокачественных заболеваниях и трансплантациях), которые вызывают приобретенный иммунодефицит.
3. Рост продолжительности жизни больных сахарным диабетом и злокачественными опухолями, у которых высок уровень предрасположенности к сепсису.
Бактериальная инфекция — это наиболее частая, причина септического шока. При сепсисе первичные очаги инфекции чаще локализованы в легких, органах живота, брюшине, а также в мочевыводящих путях. Бактериемию выявляют у 40-60% больных в состоянии септического шока. У 10-30% больных в состоянии септического шока невозможно выделить культуру бактерий, действие которых вызывает септический шок. Можно предположить, что септический шок без бактериемии — это результат патологической иммунной реакции в ответ на стимуляцию антигенами бактериального происхождения. По-видимому, данная реакция сохраняется после элиминации из организма патогенных бактерий действием антибиотиков и других элементов терапии, то есть происходит ее эндогенизация.
В основе эндогенизации сепсиса могут лежать многочисленные, усиливающие друг друга и реализуемые через выброс и действие цитокинов, взаимодействия клеток и молекул систем врожденного иммунитета и, соответственно, иммуно-компетентных клеток.
Сепсис, системная воспалительная реакция и септический шок — это следствия избыточной реакции на стимуляцию бактериальными антигенами клеток, осуществляющих реакции врожденного иммунитета. Избыточная реакция клеток систем врожденного иммунитета и вторичная по отношению к ней реакция Т-лимфоцитов и В-клеток вызывают гиперцитокинемию. Гиперцитокинемия — это патологический рост содержания в крови агентов ауто- паракриннои регуляции клеток, осуществляющих реакции врожденного иммунитета и приобретенные иммунные реакции.
При гиперцитокинемии в сыворотке крови аномально возрастает содержание первичных провоспалительных цитокинов, фактора некроза опухолей-альфа и интерлейкина-1. В результате гиперцитокинемии и системной трансформации нейтрофилов, эндотелиальных клеток, мононуклеарных фагоцитов и тучных клеток в клеточные эффекторы воспаления во многих органах и тканях возникает лишенный защитного значения воспалительный процесс. Воспаление сопровождается альтерацией структурно-функциональных элементов органов-эффекторов.
Критический дефицит эффекторов обуславливает множественную системную недостаточность.
Симптомы и признаки септического шока:
О развитии системной воспалительной реакции говорит наличие двух или более следующих признаков:
• Температура тела более высокая, чем 38 о С, или на уровне ниже 36 о С.
• Частота дыханий выше 20/минуту. Дыхательный алкалоз при напряжении углекислого газа в артериальной крови ниже 32 мм рт. ст.
• Тахикардия при частоте сердечных сокращений большей 90/минуту.
• Нейтрофилия при росте содержания полиморфноядерных лейкоцитов в крови до уровня выше 12х10 9 /л, или нейтропения при содержании нейтрофилов в крови на уровне ниже 4х10 9/ л.
• Сдвиг лейкоцитарной формулы, при котором палочкоядерные нейтрофилы составляют более 10% общего числа полиморфноядерных лейкоцитов.
О сепсисе свидетельствуют два или более признаков системной воспалительной реакции при подтвержденном данными бактериологических и других исследований наличии патогенных микроорганизмов во внутренней среде.
Течение септического шока
При септическом шоке гиперцитокинемия повышает активность синтетазы оксида азота в эндотелиальных и других клетках. В результате снижается сопротивление резистивных сосудов и венул. Снижение тонуса данных микрососудов уменьшает общее периферическое сосудистое сопротивление. Часть клеток организма при септическом шоке страдает от ишемии, обусловленной расстройствами периферического кровообращения. Расстройства периферического кровообращения при сепсисе и септическом шоке — это следствия системной активации эндотелиоцитов, полиморфоядерных нейтрофилов и мононуклеарных фагоцитов.
Воспаление данного генеза имеет сугубо патологический характер, происходит во всех органах и тканях. Критическое падение числа структурно-функциональных элементов большинства органов-эффекторов составляет основное звено патогенеза так называемой множественной системной недостаточности.
Согласно традиционным и верным представлениям, сепсис и системную воспалительную реакцию вызывает патогенное действие грамотрицательных микроорганизмов.
В возникновении системной патологической реакции на инвазию во внутреннюю среду и кровь грамотрицательных микроорганизмов определяющую роль играют:
• Эндотоксин (липид А, липополисахарид, ЛПС). Этот термостабильный липополисахарид составляет наружное покрытие грамотрицательных бактерий. Эндотоксин, воздействуя на нейтрофилы, вызывает высвобождение полиморфноядерными лейкоцитами эндогенных пирогенов.
• ЛПС-связывающий белок (ЛПССБ), следы которого определяют в плазме в физиологических условиях. Данный протеин образует с эндотоксином молекулярный комплекс, циркулирующий с кровью.
• Рецептор клеточной поверхности мононуклеарных фагоцитов и эндотелиальных клеток. Его специфическим элементом является молекулярный комплекс, состоящий из ЛПС и ЛПССБ (ЛПС-ЛПССБ).
В настоящее время растет частота сепсиса, обусловленного инвазией во внутреннюю среду грамположительных бактерий. Индуцирование сепсиса грамположительными бактериями обычно не связано с высвобождением ими эндотоксина. Известно, что предшественники пептидогликана и другие компоненты стенок грамположительных бактерий вызывают высвобождение клетками систем иммунитета фактора некроза опухолей-альфа и интерлейкина-1. Пептидогликан и другие компоненты стенок грамположительных бактерий активируют систему комплемента по альтернативному пути. Активация системы комплемента на уровне всего организма вызывает системное патогенное воспаление и вносит свой вклад в эндотоксикоз при сепсисе и системной воспалительной реакции.
Ранее считалось, что септический шок всегда вызывается эндотоксином (липополисахаридом бактериального происхождения), который высвобождается грамотрицательными бактериями. Теперь общепризнанным является тот факт, что менее чем в 50% случаев септический шок вызывается грамположительными возбудителями.
Расстройства периферического кровообращения при септическом шоке, адгезия активированных полиморфоядерных лейкоцитов к активированным эндотелиоцитам — все это ведет к выходу нейтрофилов в интерстиций и воспалительной альтерации клеток и тканей. Одновременно эндотоксин, фактор некроза опухолей-альфа, а также интерлейкин-1 повышают образование и высвобождение эндотелиальными клетками тканевого фактора свертывания. В результате активируются механизмы внешнего гемостаза, что вызывает отложение фибрина и диссеминированное внутрисосудистое свертывание.
Артериальная гипотензия при септическом шоке в основном представляет собой следствие снижения общего периферического сосудистого сопротивления. Гиперцитокинемия и рост концентрации в крови оксида азота при септическом шоке обуславливает расширение артериол. При этом посредством тахикардии компенсаторно растет минутный объем кровообращения. Артериальная гипотензия при септическом шоке возникает, несмотря на компенсаторный рост минутного объема кровообращения. Общее легочное сосудистое сопротивление при септическом шоке растет, что можно отчасти связать с адгезией активированных нейтрофилов к активированным эндотелиоцитам легочных микрососудов.
Выделяют следующие основные звенья патогенеза расстройств периферического кровообращения при септическом шоке:
1)рост проницаемости стенки микрососудов;
2) рост сопротивления микрососудов, который усиливается клеточной адгезией в их просвете;
3) низкая реакция микрососудов на вазодилатирующие влияния;
4) артериоло-венулярное шунтирование;
5) падение текучести крови.
Гиповолемия — это один из факторов артериальной гипотензии при септическом шоке.
Выделяют следующие причины гиповолемии (падения преднагрузки сердца) у больных в состоянии септического шока:
1) дилатация емкостных сосудов;
2) потеря жидкой части плазмы крови в интерстиций из-за патологического роста проницаемости капилляров.
Можно считать, что у большинства больных в состоянии септического шока падение потребления кислорода организмом преимущественно обусловлено первичными нарушениями тканевого дыхания. При септическом шоке умеренный лактатный ацидоз развивается при нормальном напряжении кислорода в смешанной венозной крови.
Лактатный ацидоз при септическом шоке считают следствием снижения активности пируватдегидрогеназы и вторичной аккумуляции лактата, а не падения тока крови на периферии.
Расстройства периферического кровообращения при сепсисе носят системный характер и развиваются при артериальной нормотензии, которую поддерживает рост минутного объема кровообращения. Системные нарушения микроциркуляции проявляют себя снижением рН в слизистой оболочке желудка и падением насыщения кислородом гемоглобина крови в печеночных венах. Гипоэргоз клеток кишечного барьера, действие иммуносупрессивных звеньев патогенеза септического шока — все это снижает защитный потенциал кишечной стенки, что служит еще одной из причин эндотоксемии при септическом шоке.
Диагноз септического шока
- Септический шок - сепсис (синдром системной воспалительной реакции плюс бактериемия) в сочетании со снижением АД сист. менее 90 мм рт. ст. при отсутствии видимых причин для артериальной гипотензии (дегидратация, кровотечение). Наличие признаков гипоперфузии тканей несмотря на проведение инфузионной терапии. Перфузионные нарушения включают ацидоз, олигурию, острые нарушения сознания. У пациентов, получающих инотропные препараты, перфузионные нарушения могут сохраняться при отсутствии артериальной гипотензии.
- Рефрактерный септический шок - септический шок, продолжающийся более одного часа, рефрактерный к инфузионной терапии.
Лечение септического шока:
1. Инфузионная терапия
- Катетеризация двух вен.
- 300-500 мл раствора кристаллоидов в/в в виде болюса, затем 500 мл раствора кристаллоидов в/в капельно в течение 15 минут. Оценить венозную гипертензию и наличие сердечной декомпенсации.
- При наличии сердечной недостаточности целесообразна катетеризация a. pulmonalis катетером Swan-Ganz для оценки волемического статуса: оптимальное PCWP = 12 мм рт. ст. при отсутствии ОИМ и 14-18 мм рт. ст. при наличии ОИМ;
- если после инфузионного болюса величина PCWP превысит 22 мм рт. ст., то следует предположить прогрессирование сердечной недостаточности и прекратить активную инфузию кристаллоидов.
- Если, несмотря на высокие значения давления заполнения левого желудочка, артериальная гипотензия сохраняется - допамин 1-3-5 и более мкг/кг/мин, добутамин 5- 20 мкг/кг/мин.
- Бикарбонат натрия в расчетной дозе с целью коррекции метаболического ацидоза.
2. Терапия гипоксемии/РДСВ - оксигенотерапия, ИВЛ с использование PEEP.
3. Терапия сниженной контрактильной способности миокарда - строфантин К 0,5 мг 1-2 раза в сутки в/в в 10-20 мл 5- 20 %-ного раствора глюкозы или физиологического раствора; дигоксин 0,25 мг 3 раза в сутки per os в течение 7- 10 суток, затем 0,25-0,125 мг в сутки; добутамин 5- 20 мкг/кг/мин в/в.
6. Эмпирическая антибиотикотерапия (учитывается локализация источника септического процесса и предполагаемый спектр возможных микроорганизмов).
7. Хирургическое дренирование очагов инфекции.
8. Препараты, эффективность которых не подтверждена:
Септический шок является осложнением многих заболеваний, связанных с инфекцией, особенно хирургических. В нашей практике септический шок встречается при лечении больных с диабетической флегмоной, гангреной. Иногда сепсис развивается у пациентов с нагноением сосудистых протезов.
Наиболее тяжелым течением сепсис отличается при развитии госпитальной инфекции, когда процесс развивается, как осложнение после проведенных операций. Для предупреждения подобного осложнения применяются меры асептики и антисептики, профилактическое назначение антибиотиков.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
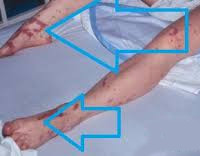
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Сепсис и септический шок - клиника, диагностика
Многие годы сепсис и септический шок остаются одной из самых актуальных проблем интенсивной терапии. Частота тяжелого сепсиса среди пациентов ОРИТ составляет от 2% до 18%, а септического шока -3-4%. Примечательно, что в ОРИТ сепсис развивается почти в 30 раз чаще, чем в других клинических отделениях больниц.
Увеличению частоты возникновения сепсиса и септического шока способствуют постарение населения, рост продолжительности жизни лиц с тяжелыми хроническими заболеваниями, значительная частота иммунодефицитных состояний у населения, рост штаммов микроорганизмов, резистентных к антибактериальной терапии, связанный с неконтролируемым назначением антибиотиков, применение в интенсивной терапии препаратов, снижающих иммунитет (цитостатаки, гормоны), повышением инвазивности лечения (расширением показании к обширным операциям, длительная катетеризация сосудов, использование экстракорпоральной детоксикации), нарушение правил асептики и антисептики.
Частота грамположительного и грамотрицательного сепсиса встречается практически одинаково - в 39 и 40% случаев соответственно. В 21% случаев диагносцируются полимикробные ассоциации. Это произошло в результате увеличения роли таких бактерий, как Streptococcus spp., Enterococcus spp., Staphylococcus spp., причем среди них отмечается рост метициллинрезистентных штаммов. Выросла частота сепсиса, вызванного рефрактерными к антибактериальной терапии бактериями (Р. Aeruginosa, Acinetobacter spp., Klebsiella spp.), которые, как правило, выступают в качестве возбудителей нозокомиальной инфекции. Увеличение продолжительности жизни больных, перенесших критические состояния, широкое использование комбинаций цефалоспоринов с ами-ногликозидами обусловили появление новых "ужасов" иифектологии -Enterococcus faecium, Stenothrophamonas maltophylia, Flavobacterium spp. и др. У больных, находящихся в стационаре более трех недель и получавших глюкокортикостероиды и парентеральное питание, сеансы гемодиализа, возросла частота грибкового (кандидозного) сепсиса.
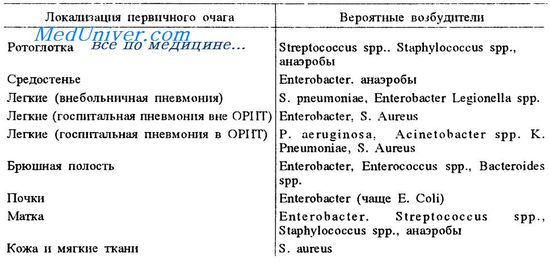
Наиболее вероятная этиология сепсиса в зависимости от локализации очага инфекции представлена в таблице.
Несмотря на использование самых современных методов интенсивной терапии, достаточно высокой остается летальность, которая при тяжелом сепсисе и септическом шоке составляет 60-70%.
Высокой летальности способствуют поздняя диагностика, неадекватное хирургическое лечение и антибактериальная терапия, полимикробные инфекции, грибковая суперинфекция.
Сепсис классифицируется по темпу развития, по локализации, по виду возбудителя и стадии компенсации.
Клиника и диагностика сепсиса
В 1992 году была сформулирована концепция сепсиса на основе синдрома системного воспалительного ответа (ССВО), которая вошла в клиническую практику большинства стран мира, включая Россию. Главными достоинствами концепции являются простота диагностических критериев, четкое определение реально встречающихся в клинической практике ситуаций, возможность установления диагноза в короткий срок в лечебном учреждении любого уровня.
Бактериемия является одним из возможных, но необязательных признаков сепсиса. Даже при самом скрупулезном соблюдении техники забора крови и использовании современной технологии, как правило, в среднем высев микроорганизмов не превышает 45%, причем при сепсисе положительные результаты посева достигают 17%, при тяжелом сепсисе - 25%, при септическом шоке - 60-70%.
Клиническое значение результатов высева заключается в подтверждении диагноза и определении этиологии инфекционного процесса, обоснованности схемы и оценке эффективности интенсивной терапии, доказательстве механизма развития сепсиса (например, катетеризация).

Обнаружение микроорганизмов в крови у пациентов без признаков ССВО должно расцениваться как транзиторная бактериемия, часто возникающая после различных диагностических процедур.
Одним из первых проявлений ранней стадии септического шока (гипердинамическая фаза) является гипертермия (до 40-41 °С) с ознобами, сочетающаяся с тахипноэ и тахикардией. Лихорадке часто сопутствует изменение психического статуса в виде неадекватности поведения, возбуждения, двигательного беспокойства. Дыхание у больных частое, поверхностное. Артериальное давление нормальное или несколько снижено, тахикардия до ПО ударов в минуту. Темп диуреза снижен до 25 мл/ч. В крови отмечается леГпсоцитоз с высоким уровнем ЛИИ, лимфо- и тромбоцитопения, гипохромия, пойкилоцитоз, компенсированный метаболический ацидоз.
В поздней стадии септического шока (гиподинамическая фаза) гипертермия сменяется гипотермией, отмечается нарушение сознания, вплоть до комы. Кожные покровы бледные с мраморным рисунком. Бледно-цианотичная, холодная кожа, влажные кисти и стопы являются неблагоприятным признаком исхода заболевания. В легких при аускультации определяются рассеянные влажные хрипы, тахипноэ достигает 40-50 в минуту. Систолическое артериальное и пульсовое давление снижено, тахиаритмия выраженная - до 120 ударов в минуту и более.
Со стороны ЖКТ наблюдается развитие пареза кишечника. Уровень билирубина, АЛТ, ACT, ЛДГ возрастает.
Олигурия (менее 10 мл/ч) сопровождается ростом азотемии, снижением концентрационного индекса по осмолярности до 1,0, возрастанием фракционной экскреции натрия выше 2%.
В крови определяется анемия, выраженный лейкоцитоз, лимфопения. Метаболический ацидоз становится декомпенспровапным. Гипергликемия сменяется гипогликемией.
Септический шок - эпидемиология, смертность
Тяжелый сепсис и септический шок являются актуальной проблемой современной медицины вследствие увеличения количества больных, высокой летальности и возрастания социально-экономических проблем, связанных с лечением и реабилитацией таких пациентов.
Септический шок является жизнеугрожающим состоянием, наиболее тяжелой стадией или формой развития генерализованной инфекции (сепсиса), характеризующейся наличием неконтролируемого инфекционного процесса, реактивного генерализованного воспаления, полиорганной дисфункции/недостаточности и артериальной гипотензии.
Многообразие сходных названий исторически связано с субъективными факторами: разработкой проблемы сепсиса и септического шока в различных областях медицинской науки, отсутствием до недавнего времени единой классификации сепсиса и объективными факторами — наличием существенных патогенетических различий механизмов развития сепсиса при ряде нозологических форм, недостаточной научной разработкой проблемы септического шока в целом.
На этой же конференции были даны определения других стадий инфекции: бактериемии, сепсиса, тяжелого сепсиса, септического шока и синдрома полиорганной дисфункции (СПД). Разработка этих определений открыла новые перспективы как для развития фундаментальных и прикладных научных исследований в области тяжелых инфекций, так и для клинической практики, заложив основу систематической разработки рекомендаций по диагностике и лечению.
Возбудители сепсиса

Эпидемиология септического шока
Септический шок как синдром, стадия или форма заболевания пока не включен в Международную классификацию болезней, поэтому ориентировочные эпидемиологические данные были получены при проведении нескольких многоцентровых проспективных рандомизированных контролируемых исследований с целью оценки эффективности лекарственных препаратов у больных сепсисом. Обнаружено, что пациенты с септическим шоком составляют 58 % от всех больных с тяжелым сепсисом. Математическое моделирование позволило примерно определить количество пациентов с септическим шоком в США — 435 580 человек в год.
Другим источником информации могут быть данные, полученные в ходе международного многоцентрового эпидемиологического исследования 14 364 пациентов в 28 отделениях реанимации и интенсивной терапии (ОРИТ): пациенты с септическим шоком составили 6,3 % от всех больных ОРИТ, причем в 63,2 % случаев септического шока был осложнением нозокомиальных инфекций (НИ). Согласно отечественным данным, доля больных с септическим шоком составила только 26,1 % среди всех пациентов с тяжелым сепсисом.
При включении критериев сепсиса, тяжелого сепсиса и септического шока в программу регистрации пациентов ОРИТ хирургического профиля было обнаружено, что среди 25,9 % пациентов с сепсисом доля больных септическим шоком составила 4,1 %.
Близкие данные по количеству больных септическим шоком приведены в исследованиях многих авторов — 2—4 %, однако имеются данные и о более высоких показателях —7—18 %, что может свидетельствовать о значительной разнородности исследованных групп пациентов.
Летальность в группе больных с септическим шоком. Причиной летальных исходов больных сепсисом и септическим шоком является органная недостаточность, причем комбинация недостаточности нескольких органов увеличивает вероятность летального исхода. В нескольких исследованиях произведена оценка летальности в группе пациентов с септическим шоком по сравнению с больными сепсисом и тяжелым сепсисом. Летальность в группе больных с септическим шоком составила от 46 до 82 %, что в 1,5—2,5 раза превосходило летальность больных тяжелым сепсисом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

