Септический шок лечение перитонита
Обновлено: 23.04.2024
По степени распространенности воспалительного процесса в брюшной полости выделяют:
1. Отграниченный (местный) перитонит (занимает до 2-х из девяти анатомических областей брюшной полости).
2. Распространенный перитонит (занимает три и более анатомических области живота):
По характеру экссудата: серозный, серозно-фибринозный и гнойный перитонит.
Диагностика.
Диагноз перитонита должен быть установлен на основании первичного физикального обследования.
В ходе обследования пациента в приемном отделении на основании клинико-инструментального обследования следует установить возможные причины перитонита.
В приемном отделении в экстренном порядке производят общий клинический анализ крови, биохимический анализ крови, коагулограмму, общий анализ мочи; определяют группу крови и резус-фактор; выполняются ЭКГ, рентгенография грудной клетки в прямой проекции и обзорная рентгенография брюшной полости (у лежачих больных – в латеропозиции), УЗИ брюшной полости (оценка наличия газа и жидкости в брюшной полости, дилатация кишечных петель, перистальтика); по показаниям проводятся консультации врачами терапевтических специальностей.
Лечебная тактика.
Диагноз перитонита является показанием к экстренному оперативному вмешательству. Больной подлежит экстренному оперативному вмешательству в течение 1 часа с момента установления диагноза.
Больным с выраженными явлениями интоксикации, синдромными расстройствами и с тяжелыми сопутствующими заболеваниями показано проведение кратковременной (в течение 1,5-2 часов) предоперационной подготовки в условиях реанимационного отделения. Вопрос о необходимости и объеме предоперационной подготовки больного к хирургическому вмешательству решается совместно хирургом и анестезиологом.
Любое оперативное вмешательство по поводу перитонита необходимо выполнять под эндотрахеальным наркозом.
Доступ.
- при клинической картине отграниченного перитонита,
- при необходимости проведения дифференциального диагноза (острый панкреатит, мезентериальный тромбоз),
- в случае диагностированных до операции аппендицита, холецистита и перфоративной язвы.
- при клинической картине распространенного перитонита,
- при лапароскопической находке, исключающей возможность выполнения оперативного приема лапароскопическим доступом, показано выполнение конверсии к срединной лапаротомии.
Хирургическая тактика.
Обязательными этапами оперативного вмешательства при перитонита являются:
- Забор материала для микробиологического исследования;
- Полная и планомерная ревизия брюшной полости;
- Эвакуация экссудата;
- Устранение источника перитонита;
- Санация брюшной полости;
- Назо-интестинальная интубация – по показаниям;
- Дренирование брюшной полости;
- Формирование лапаростомы для последующих программных санаций – по показаниям.
Радикальное устранение источника перитонита предусматривает:
- удаление воспаленного органа (аппендэктомия, холецистэктомия);
- герметичное ушивание перфораций и свежих сквозных ранений полых органов;
- резекцию органа (при язве, опухоли, травмах или нарушении мезентериальногокровобращения); - формирование колостомы (илеостомы) для выключения из пассажа пораженных участков толстой кишки.
При отсутствии условий для радикальной ликвидации источникаинфицирования возможна его локализация (отграничение тампонами в брюшной полости), экстраабдоминизация органа.
Формирование межкишечных анастомозов на воспаленных участках кишечных петель при гнойном перитоните противопоказано. В таких случаях целесообразно выведение концевых кишечных стом, включая, при необходимости и тощую кишку.
При правосторонней гемиколэктомии вопрос о формировании первичного илеотрансверзоанастомоза или формировании илеостомы решается индивидуально в зависимости от состояния стенки подвздошной кишки.
При резекции левой половины толстой кишки формируется одноствольная колостома.
При выраженном парезе и расширении кишечных петель более 4-5 см показано проведение декомпрессии пищеварительной трубки путем назоинтестинальной интубации на всем протяжении тонкой кишки широким 2-х канальным (неприсасывающимся) силиконовым зондом.Одновременно с установкой назо-интестинального зонда устанавливается назо-гастральный зонд.
Введение тампонов в брюшную полость допустимо только при невозможности радикального устранения источника перитонита и в целях гемостаза.
Варианты завершения операции:
· распространенный фибринозно-гнойный или каловый перитонит;
· признаки анаэробного инфицирования брюшной полости;
· тяжелый абдоминальный сепсис, септический шок;
· основное заболевание (его осложнение), не позволяющее одномоментно ликвидировать или локализовать источник перитонита;
· сопутствующее заболевание или состояние, не позволяющее выполнить адекватный объем операции;
· синдром интраабдоминальной гипертензии;
· состояние лапаротомной раны (гнойно-некротический процесс), не позволяющее ушить брюшную полость.
· прогрессирование перитонита (неустраненный первичный источник, появление нового источника, недиагностированный источник, третичный перитонит);
· осложнение основного заболевания, требующее хирургической коррекции (абсцесс, флегмона, кровотечение в брюшную полость или ЖКТ, ранняя спаечная кишечная непроходимость);
· возникновение или осложнение в послеоперационном периоде конкурирующего заболевания, требующего хирургического вмешательства (кровотечение из гастродуоденальных язв, деструктивный панкреатит, перфорация острых и стресс-язв, острое нарушение мезентериального кровотечения);
· осложнения, связанные с нарушением техники хирургического вмешательства, манипуляции (ятрогенные повреждения, несостоятельность ЖКА, несостоятельность культи или кровотечение вследствиесоскальзывание лигатуры, клипсы, инородные тела брюшной полости).
- изоляция органов брюшной полости от париетальной брюшины и лапаротомной раны перфорированной полиэтиленовой пленкой;
- сведение краев операционной раны отдельными редкими кожными швами с оставлением диастаза краев раны в 5 – 10 см; после каждой санации швы накладывать в новых местах;
Критерии окончания режима программируемых санаций:
· гарантированная ликвидация или локализация источника перитонита;
· отсутствие неудалимых очагов некроза и гнойных очагов;
· прозрачный серозный экссудат;
· наличие перистальтики тонкой кишки;
· отсутствие распространенного гнойно-некротического поражения операционной раны или передней брюшной стенки, исключающее возможность одномоментной хирургической коррекции.
Антибактериальная терапия начинаться непосредственно после установления диагноза перитонита. Первая доза антибактериального препарата вводится перед оперативным вмешательством. До получения результатов микробиологического исследования экссудата брюшной полости применяется "эмпирическое" назначение антибиотиков со спектром действия, включающим грамотрицательные бактерии в сочетании с анаэробными микроорганизмами:
- цефалоспорины (цефоперазон 4 г/сутки) + аминогликозиды (тобрамицин, сизомицин, амикацин 150 мг - 2 г/сутки) + метронидазол (1500 мг/сутки);
- офлоксацины (ципрофлоксацин 800 мг/сут) + метронидазол (1500 мг/сутки);
- карбаценемы (меропенем 3-6 г/сутки) в виде монотерапии.
После получения результатов микробиологических исследований необходима коррекция антибиотикотерапии по чувствительности микрофлоры.
Патогенетическая посиндромная терапия.
1. Инфузионно-трансфузионная терапия проводится с целью ликвидации дефицита жидкости и электролитов, коррекции КЩС с учетом показателей гомеостаза, гемодинамики, темпа диуреза в режиме умеренной гемодилюции (Ht 27-32%), при необходимости - форсированный диурез. Суточный объем инфузии 3000-3500 мл/сутки при темпе диуреза 80-100 мл/час. При восполненном ОЦК в отсутствие гипопротеинемии и снижении диуреза - стимуляция фуросемидом до 2 мг/кг/сутки. Коррекция анемии препаратами крови - при снижении гемоглобина ниже 100 г/л.
2. Коррекция метаболических нарушений:
- нормализация белкового и углеводного обменов;
- использование энергетических материалов в виде растворов декстрозы, концентрированной глюкозы (с введением адекватного количества инсулина), солей калия, коферментов (витаминов);
- введение антигистаминных средств;
- введение ингибиторов протеаз.
3. Коррекция агрегатного состояния крови, профилактика ДВС-синдрома:
- улучшение реологии крови путем создания гемодилюции и применения дезагрегантов (трентал 30-50 мл/сутки, курантил 6-8 мл/сутки, ацетилсалициловая кислота 0,5 г/сутки);
- гепаринотерапия (наиболее рационально постоянно дозированное введение гепарина 20000-30000 ед./сутки под контролем АЧТВ и тромбинового времени);
- препараты крови, содержащие факторы свертывания и фибринолиза;
- профилактика цитотоксического эффекта, мембраностабилизирующий эффект - даларгин (0,6-0,8 мг/сутки), дексазон 16-32 мг/сутки.
4. Коррекция иммунологического статуса:
- пассивная иммунизация гипериммунными плазмами и сыворотками;
- использование иммуномодуляторов (т-активин, тималин, миелопид) и препаратов неспецифической иммунокоррекции (дибазол, аскорбиновая кислота);
- ультрафиолетовая и лазерная обработка крови.
5. Постоянная декомпрессия тонкого кишечника при малых цифрах разряжения (10-20 мм. вод. ст.) с проведением кишечного лаважа растворами электролитов (СЭР - солевым электролитным раствором) в объеме 1000-1500 мл/сутки.
6. Коррекция состояния сердечно-сосудистой системы:
7. Респираторная терапия, профилактика бронхолегочных осложнений:
8. Активные методы детоксикации следует использовать при II и III степени эндогенной интоксикации:
- методом выбора считать проведение плазмафереза с момента стабилизации гемодинамики (целесообразен забор плазмы 500-1000 мл с возмещением адекватным количеством донорской плазмы и альбумина);
- в случае выраженной нефропатии целесообразно проведение гемодиализа или гемодиафильтрации;
- УФО крови (объем облученной крови 300-500 мл).
9. Обезболивание в послеоперационном периоде:
- перидуральная анальгезия растворами анестетиков, наркотических анальгетиков;
- традиционное обезболивание: наркотические и ненаркотические анальгетики.
10. Коррекция энергетического потенциала путем:
- регуляции кислородного и углеводного обменов (адекватная функция дыхания, улучшение микроциркуляции, снятие инсулиновой резистентности);
Перитонит – локальное или диффузное воспаление серозного покрова брюшной полости – брюшины. Клиническими признаками перитонита служат боль в животе, напряжение мышц брюшной стенки, тошнота и рвота, задержка стула и газов, гипертермия, тяжелое общее состояние. Диагностика перитонита основывается на сведениях анамнеза, выявлении положительных перитонеальных симптомов, данных УЗИ, рентгенографии, вагинального и ректального исследований, лабораторных тестов. Лечение перитонита всегда хирургическое (лапаротомия, санация брюшной полости) с адекватной предоперационной и послеоперационной антибактериальной и дезинтоксикационной терапией.
МКБ-10
Общие сведения
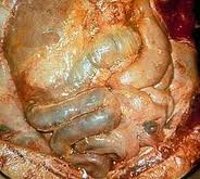
Перитонит – тяжелое осложнение воспалительно-деструктивных заболеваний органов брюшной полости, сопровождающееся выраженными местными и общими симптомами, развитием полиорганной недостаточности. Летальность от перитонита в гастроэнтерологии составляет 20-30%, а при наиболее тяжелых формах достигает 40-50%.
Брюшина (peritoneum) образована двумя переходящими друг в друга серозными листками - висцеральным и париетальным, покрывающими внутренние органы и стенки брюшной полости. Брюшина является полупроницаемой, активно функционирующей мембраной, выполняющей множество важных функций: резорбтивную (всасывание экссудата, продуктов лизиса, бактерий, некротических тканей); экссудативную (выделение серозной жидкости), барьерную (механическая и противомикробная защита органов брюшной полости) и др. Важнейшим защитным свойством брюшины является ее способность к отграничению воспаления в брюшной полости благодаря фиброзным спайкам и рубцам, а также клеточным и гуморальным механизмам.

Причины перитонита
Этиологическим звеном при перитоните выступает бактериальная инфекция, в большинстве случаев представленная неспецифической микрофлорой желудочно-кишечного тракта. Это могут быть грамотрицательные (энтеробактер, кишечная палочка, протей, синегнойная палочка) и грамположительные (стафилококки, стрептококки) аэробы; грамотрицательные (фузобактерии, бактероиды) и грамположительные (эубактерии, клостридии, пептококки) анаэробы. В 60-80% наблюдений перитонит вызывается ассоциацией микробов – чаще кишечной палочкой и стафилококком. Реже развитие перитонита бывает обусловлено специфической микрофлорой – гонококками, гемолитическим стрептококком, пневмококками, микобактериями туберкулеза. Поэтому для выбора рационального лечения перитонита первостепенное значение имеет бактериологический посев содержимого брюшной полости с определением чувствительности выделенной микрофлоры к антибактериальным препаратам.
В соответствии с этиологией различают первичные (идиопатические) и вторичные перитониты. Для первичных перитонитов характерно проникновение микрофлоры в брюшную полость лимфогенным, гематогенным путем или по фаллопиевым трубам. Непосредственное воспаление брюшины может быть связано с сальпингитами, энтероколитами, туберкулезом почек или гениталий. Первичные перитониты встречаются нечасто – в 1-1,5% случаев.
В клинической практике гораздо чаще приходится сталкиваться с вторичными перитонитами, развивающимися вследствие детсруктивно-воспалительных заболеваний или травм брюшной полости. Наиболее часто перитонит осложняет течение аппендицита (перфоративного, флегмонозного, гангренозного), прободной язвы желудка или 12-перстной кишки, пиосальпинкса, разрыва кисты яичника, кишечной непроходимости, ущемления грыжи, острой окклюзии мезентериальных сосудов, болезни Крона, дивертикулита, флегмонозно-гангренозного холецистита, панкреатита, панкреонекроза и др. заболеваний.
Посттравматический перитонит развивается вследствие закрытых и открытых повреждений органов брюшной полости. Причинами послеоперационных перитонитов могут служить несостоятельность анастомозов, дефекты наложения лигатур, механическое повреждение брюшины, интраоперационное инфицирование брюшной полости, гемоперитонеум при неадекватном гемостазе. Отдельно выделяют канцероматозные, паразитарные, гранулематозные, ревматоидные перитониты.
Классификация
По этиологии различают бактериальные и абактериальные (асептические, токсико-химические) перитониты. Последние развиваются в результате раздражения брюшины агрессивными неинфекционными агентами (желчью, кровью, желудочным соком, панкреатическим соком, мочой, хилезной жидкостью). Абактериальный перитонит довольно быстро принимает характер микробного вследствие присоединения инфекционных возбудителей из просвета ЖКТ.
В зависимости от характера перитонеального выпота различают серозный, фибринозный, геморрагический, желчный, гнойный, каловый, гнилостный перитонит.
По клиническому течению перитониты делятся на острые и хронические. С учетом распространенности поражения по поверхности брюшины различают отграниченный (местный) и диффузный перитонит. К вариантам местного перитонита относят поддиафрагмальный, аппендикулярный, подпеченочный, межкишечный, тазовый абсцессы. О диффузном перитоните говорят, когда воспаление брюшины не имеет тенденции к ограничению и четких границ. По степени поражения брюшины диффузные перитониты подразделяются на местные (развивающиеся в одной анатомической области, вблизи от источника инфекции), распространенные (охватывают несколько анатомических областей) и общие (при тотальном поражении брюшины).
В развитии перитонита принято выделять раннюю фазу (до 12 часов), позднюю (до 3-5 суток) и конечную (от 6 до 21 дня от начала заболевания). В соответствии с патогенетическими изменениями различают реактивную, токсическую и терминальную стадии перитонита. В реактивную стадию перитонита (24 часа от момента поражения брюшины) отмечается гиперергическая реакция на раздражение брюшины; в эту фазу максимально выражены местные проявления и менее выражены общие симптомы. Токсическая стадия перитонита (от 4 до 72 часов) характеризуется нарастанием интоксикации (эндотоксическим шоком), усилением и преобладанием общих реакций. В терминальной стадии перитонита (позднее 72 часов) происходит истощение защитно-компенсаторных механизмов, развиваются глубокие нарушения жизненно важных функций организма.
Симптомы перитонита
В реактивном периоде перитонита отмечаются абдоминальные боли, локализация и интенсивность которых определяются причиной воспаления брюшины. Первоначально боль имеет четкую локализацию в области источника воспаления; может иррадиировать в плечо или надключичную область вследствие раздражения нервных окончаний диафрагмы гнойно-воспалительным экссудатом. Постепенно боли распространяются по всему животу, становятся незатихающими, теряют четкую локализацию. В терминальном периоде в связи с параличом нервных окончаний брюшины болевой синдром становится менее интенсивным.
Характерными симптомами перитонита служат тошнота и рвота желудочным содержимым, которые в начальной стадии возникают рефлекторно. В более поздние сроки перитонита рвотная реакция обусловлена парезом кишечника; в рвотных массах появляется примесь желчи, затем - содержимое кишечника (фекальная рвота). Вследствие выраженного эндотоксикоза развивается паралитическая кишечная непроходимость, клинически проявляющаяся задержкой стула и неотхождением газов.
При перитоните, даже в самой ранней стадии, обращает на себя внимание внешний вид больного: страдальческое выражение лица, адинамия, бледность кожных покровов, холодный пот, акроцианоз. Пациент принимает вынужденное положение, облегчающее боль – чаще на боку или спине с поджатыми к животу ногами. Дыхание становится поверхностным, температура повышенная, отмечается гипотония, тахикардия 120-140 уд. в мин., не соответствующая субфебрилитету.
Диагностика
Изменения в общем анализе крови при перитоните (лейкоцитоз, нейтрофилез, увеличение СОЭ) свидетельствуют о гнойной интоксикации. Лапароцентез (пункция брюшной полости) и диагностическая лапароскопия показаны в неясных для диагностики случаях и позволяют судить о причине и характере перитонита.
Лечение перитонита
Выявление перитонита служит основанием для экстренного хирургического вмешательства. Лечебная тактика при перитоните зависит от его причины, однако во всех случаях в ходе операции придерживаются одинакового алгоритма: показано выполнение лапаротомии, проведение изоляции или удаления источника перитонита, осуществление интра- и послеоперационной санации брюшной полости, обеспечение декомпрессии тонкой кишки.
Послеоперационное ведение пациентов с перитонитом включает инфузионную и антибактериальную терапию, назначение иммунокорректоров, переливание лейкоцитарной массы, внутривенное введение озонированных растворов и др. Для противомикробной терапии перитонита чаще используется комбинация цефалоспоринов, аминогликозидов и метронидазола, обеспечивающая воздействие на весь спектр возможных возбудителей.
С целью стимуляции перистальтики и восстановления функций ЖКТ показано назначение антихолинэстеразных препаратов (неостигмина), ганглиоблокаторов (димеколония йодид, бензогексония), антихолинэргических средств (атропина), препаратов калия, физиопроцедур (электростимуляции кишечника, диадинамотерапии).
Прогноз и профилактика
Успех лечения перитонита во многом зависит от срока выполнения операции и полноты объема послеоперационной терапии. Летальность при разлитом перитоните достигает 40% и более; гибель пациентов наступает от гнойной интоксикации и полиорганной недостаточности.
Поскольку большинство перитонитов являются вторичными, их профилактика требует своевременного выявления и лечения основной патологии - аппендицита, язвы желудка, панкреатита, холецистита и др. Предупреждение послеоперационного перитонита включает адекватный гемостаз, санацию брюшной полости, проверку состоятельности анастомозов при абдоминальных операциях.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
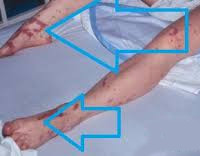
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Острый перитонит – одна из разновидностей хирургической инфекции брюшины, сопровождающаяся выраженными местными изменениями и общими функциональными расстройствами в организме. В клинической картине преобладают явления шока, пареза кишечника, боли в животе, тошнота, рвота, напряжение передней брюшной стенки, обезвоживание. Диагностика острого перитонита предусматривает проведение обзорной рентгенографии ОБП, УЗИ и МСКТ органов брюшной полости, электроэнтерографии, лапароцентеза либо диагностической лапароскопии, клинических и биохимических анализов крови. Лечение комплексное, включает как консервативные, так и хирургические мероприятия.
МКБ-10
Общие сведения
Острый перитонит является одной из самых важных проблем ургентной хирургической службы. Пациенты с воспалительными процессами брюшины составляют около 20% всех больных, требующих неотложной хирургической помощи по поводу острых заболеваний и травм брюшной полости. В структуре причин перитонитов преобладают перфорации различных отделов пищеварительного тракта (треть пациентов), деструктивные аппендициты и другая патология толстого кишечника (каждый второй случай), заболевания тонкого кишечника (каждый десятый случай). Отдельную группу составляют пациенты с проникающими ранениями органов брюшной полости, послеоперационными осложнениями. Развитие перитонита тесно связано с поздним обращением за медицинской помощью, и соответственно, с поздним оперативным вмешательством.
Причины острого перитонита
В подавляющем большинстве случаев источником острого перитонита является неспецифический воспалительный процесс. Непосредственной причиной при этом может выступать аппендицит (до 65%), прободная язва желудка или ДПК (до 15%), гнойный либо калькулезный холецистит и гнойный панкреатит (до 10%), некроз внутренних органов (кишечная непроходимость, ущемление грыжи, тромбоз мезентериальных сосудов) – до 5%, воспалительные процессы малого таза (до 12%), травма, послеоперационные осложнения.
Наиболее благоприятной для излечения является реактивная фаза – при осуществлении оперативного вмешательства на этом этапе прогрессирование острого перитонита останавливается, летальность очень низкая. В токсической фазе погибает каждый пятый пациент. Терминальная фаза развивается при отсутствии своевременного лечения и у девяти пациентов из десяти приводит к летальному исходу.
Классификация
В отечественной абдоминальной хирургии единой классификации острых перитонитов не существует. Согласно классификации от 2009 года, принято разделение по таким критериям:
- По этиологии – первичный (туберкулезной этиологии, спонтанный) в одном случае из 100; вторичный (связанный с воспалением и перфорацией внутренних органов, послеоперационными осложнениями, травмами и ранениями) в 95% наблюдений; третичный (вялотекущий и персистирующий) не более 5% пациентов.
- По распространенности – отграниченный (абсцессы и инфильтраты брюшной полости), неотграниченный (местный распространяется не более чем на три анатомических региона; распространенный - более чем на три).
- По свойствам выпота в брюшной полости – серозный, фибринозный, гнойный, геморрагический, каловый, химический, смешанный.
- По характеристикам возбудителя – аэробный и анаэробный, грамположительный и грамотрицательный, специфический.
- По тяжести течения – с отсутствием либо наличием признаков сепсиса, инфекционно-токсического шока.
- По характеру осложнений – с внутрибрюшными осложнениями, ангиогенной инфекцией, вторичной инфекцией дыхательных путей, мочеполового тракта и др.
Симптомы острого перитонита
В реактивной фазе острого перитонита пациент предъявляет жалобы на интенсивную боль в животе, тошноту, отсутствие отхождения газов и стула, появление напряжения передней брюшной стенки и симптомов напряжения брюшины. Явления интоксикации выражаются в высокой лихорадке, сухости и обложенности языка, тахикардии.
Примерно на вторые-третьи сутки от начала острого перитонита состояние пациента ухудшается за счет нарастания органной дисфункции. Отмечаются начальные изменения психики, больной становится беспокойным. Появляется одышка, нарастает вздутие живота. Напряжение передней брюшной стенки уменьшается, но симптомы раздражения брюшины сохраняются. Перистальтика кишечника отсутствует, появляется рвота кофейной гущей. В анализах регистрируются воспалительные изменения, признаки недостаточности функций печени, почек.
На третьи-четвертые сутки развивается терминальная стадия, во время которой отмечается мнимое улучшение состояния пациента за счет отграничения воспалительного процесса. Боли в животе ослабевают, но на прогрессирование интоксикации указывает то, что черты лица заостряются и принимают страдальческое выражение. Больной становится безучастным, неподвижно лежит в постели. Дыхание поверхностное и частое, передняя брюшная стенка не участвует в акте дыхания. Отмечается тахикардия, пульс ослаблен. Рвота принимает каловый характер.
Дифференцировать острый перитонит следует с острым инфарктом миокарда, осложнениями беременности, острым животом без перитонита. Острый перитонит может осложняться инфицированием краев раны, формированием кишечных свищей и компартмент-синдрома (критическое повышение внутрибрюшного давление, приводящее к полиорганной дисфункции и смерти пациента), сепсисом и ДВС-синдромом, дистресс-синдромом взрослого типа, полиорганной недостаточностью, кишечной мальабсорбцией.
Диагностика острого перитонита
При подозрении на острый перитонит требуется консультация гастроэнтеролога, врача-эндоскописта, хирурга. Отсутствие перистальтики кишечника и резорбции жидкости брюшиной на фоне острого перитонита приводит к тяжелым водно-электролитным нарушениям. Недостаточность работы печени и почек проявляется значительной гипопротеинемией, повышением уровня азотистых шлаков, анемией. Неспецифическими признаками перитонеального сепсиса являются лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение уровня прокальцитонина и С-реактивного пептида.
Из инструментальных методов диагностики наиболее информативными являются обзорная рентгенография и МСКТ органов брюшной полости. Проведение компьютерной томографии обычно требует значительных временных и финансовых затрат, поэтому для диагностики острого перитонита практически не применяется. На обзорной рентгенографии ОБП визуализируются перераздутые петли кишечника, чаши Клойбера, свободный газ в брюшной полости, релаксация или ограничение подвижности куполов диафрагмы.
Проведение УЗИ органов брюшной полости может быть затруднено из-за пареза кишечника, однако при остром перитоните помогает выявить выпот в брюшной полости, первичный очаг; может использоваться для дифференциальной диагностики. Вспомогательное значение имеет и электроэнтерография. При затруднениях постановки диагноза проводится лапароцентез либо диагностическая лапароскопия.
Лечение острого перитонита
Пациенты с острым перитонитом требуют ургентной госпитализации в отделение интенсивной терапии для предоперационной подготовки. После оперативного лечения восстановительная терапия может проводиться в отделении хирургии либо гастроэнтерологии.
Лечение острого перитонита должно быть комплексным, включать в себя консервативные и хирургические мероприятия. Целями лечения острого перитонита являются: контроль инфекционного процесса, эрадикация бактерий и устранение их токсинов, восстановление функций внутренних органов. Консервативные мероприятия включают в себя введение антибиотиков широкого спектра действия, интенсивную инфузионную терапию, респираторную и гемодинамическую поддержку, мероприятия по замещению функции почек, эфферентные методы детоксикации, парентеральное питание и т. д.
Хирургическая тактика также может быть консервативной и оперативной. Консервативная хирургическая тактика включает в себя чрескожное дренирование абсцесса брюшной полости. Операция при перитоните проводится в несколько этапов: разрез передней брюшной стенки, новокаиновая блокада, устранение источника острого перитонита, тщательная санация всей брюшной полости, декомпрессия кишечной трубки, наложение дренажей брюшной полости и ушивание операционной раны. Антибактериальная терапия продолжается и после операции, курс должен быть достаточно длительным для эрадикации микробных агентов и полного регресса воспалительного процесса.
Прогноз и профилактика
Индивидуальный прогноз при остром перитоните составить достаточно сложно, так как он зависит от многих факторов. В качестве прогностических признаков острого перитонита используют такие показатели: ректальная температура, среднее артериальное давление и частота сокращений сердца, частота дыхания, рН крови, уровень электролитов, гематокрита, лейкоцитов, креатинина, возраст пациента, длительность заболевания от появления первых симптомов до обращения в клинику и др. Профилактика острого перитонита вторична и заключается в своевременном выявлении и лечении заболеваний, которые могут привести к этому состоянию.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
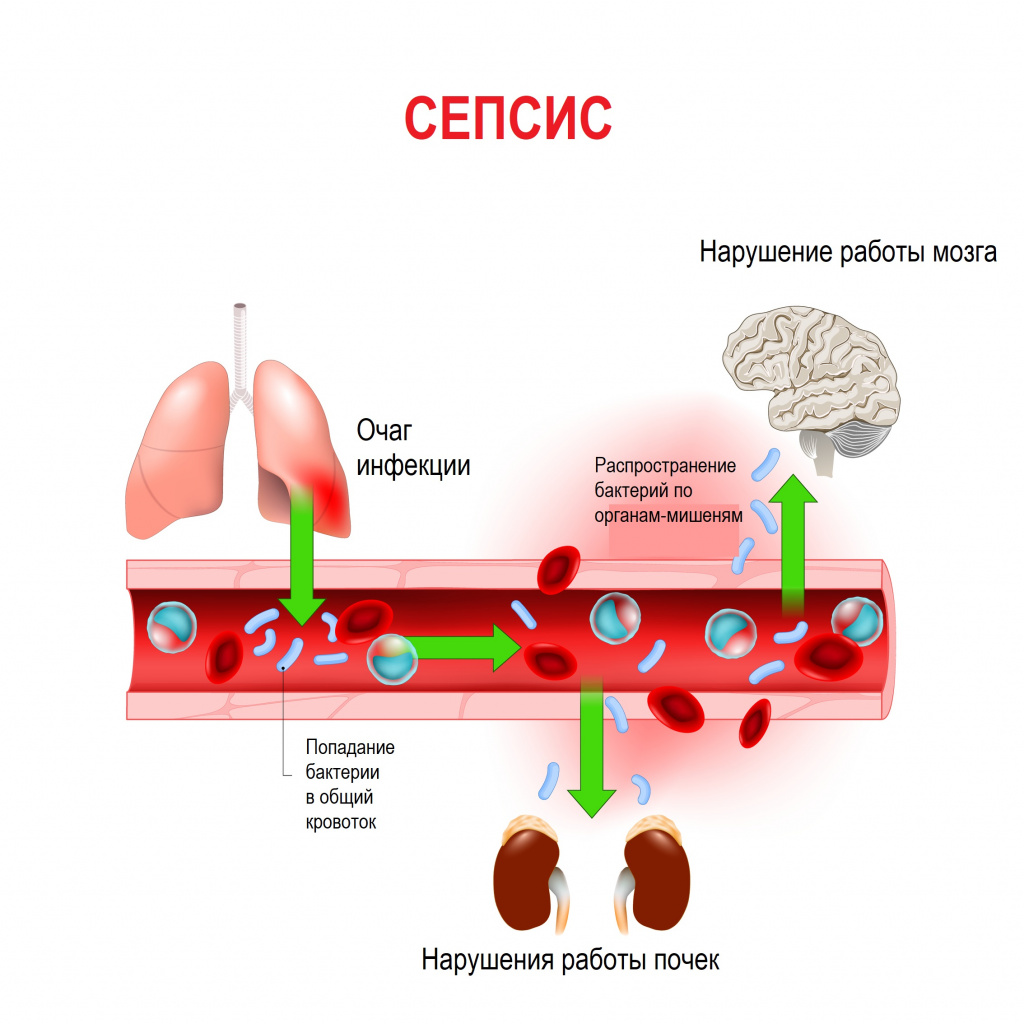
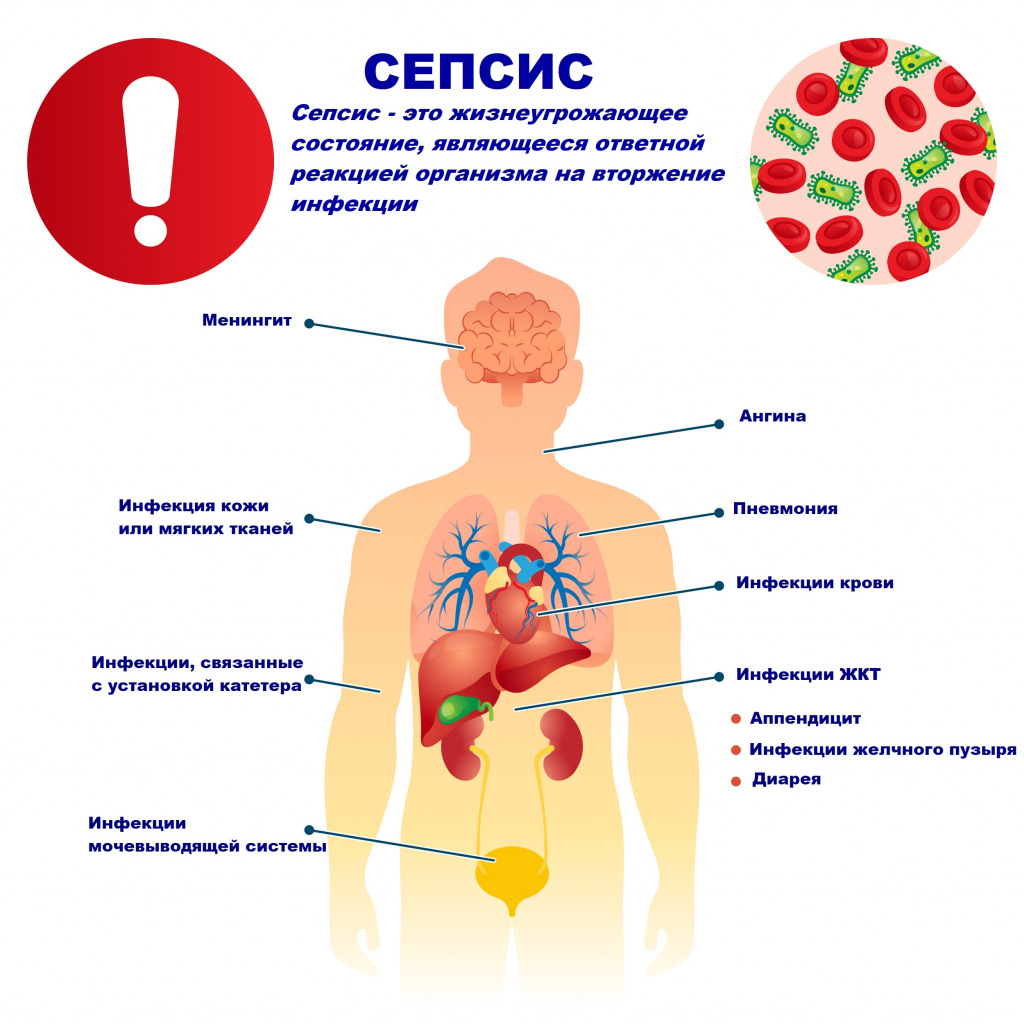
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.
Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.
Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Читайте также:

