Септический шок после родов что это
Обновлено: 25.04.2024
Септический шок (бактериальный, эндотоксический, инфекционно-токсический шок) представляет собой клинический синдром, который протекает на фоне генерализации септического процесса и который можно рассматривать как осложнение послеродовых и послеабортных воспалительных заболеваний.
Что провоцирует / Причины Септического шока в послеродовом периоде:
Септический шок, представляющий собой самую тяжелую клиническую форму генерализованной инфекции, развивается на фоне имеющегося сепсиса и эндотоксемии и характеризуется неполноценной перфузией системы микроциркуляции жизненно важных органов.
Летальность больных с септическим шоком достигает 62-80 %.
Патогенез (что происходит?) во время Септического шока в послеродовом периоде:
Понятие "септический шок" подчеркивает полиэтиологичность данного патологического состояния. Понятие "шок" характеризует общебиологическую сущность синдрома и отражает состояние организма, находящегося в крайне неблагоприятной ситуации, обусловленной нарушениями механизмов регуляции сосудистого тонуса, микроциркуляции и адекватной тканевой перфузии.
Среди акушерских осложнений, заболеваний и клинических состояний чаще всего к септическому шоку приводят инфицированные аборты, хориоамнионит, мастит, пиелонефрит, оперативное родоразрешение (кесарево сечение). Следовательно, септический очаг в случае послеродового сепсиса располагается чаще всего в матке. При этом входными воротами инфекции служит огромная всасывающая поверхность плацентарной площадки.
Сепсис в послеродовом периоде скоротечен, поэтому выраженные иммунные нарушения, требующие временного интервала, не успевают развиться. Тяжесть состояния в данном случае обусловливается гиперергической реакцией организма на возбудитель, который быстро размножается в матке, имеющей большую раневую поверхность и богатое кровоснабжение.
Факторы риска развития септического шока аналогичны таковым при любых других послеродовых гнойно-воспалительных заболеваний.
В ответ на острую микробную инвазию в организме повреждается практически вся система регуляции гомеостаза: гуморальная регуляция и адаптация, метаболизм, иммунитет, транспортировка кислорода, газообмен. Однако определяющими являются изменения гемодинамики по типу стойкой гипотонии с характерным для этого нарушением перфузии тканей.
Активным началом развития септического шока являются:
- компоненты оболочки грамположительных бактерий - мукопептиды;
- стафилококковый протеин А;
- эндотоксины, продуцируемые грамотрицательными микроорганизмами.
Эндотоксины представляют собой высокомолекулярный комплекс моно- и полисахаридов, который образует часть наружной клеточной стенки грамотрицательных бактерий. Биологически активным эндотоксин становится лишь при гибели микроорганизмов.
Эндотоксин воздействует на клеточно-гуморальные механизмы, поддерживающие гомеостаз, и вызывает выделение биологически активных веществ, приводящих к развитию септического шока.
Эндотоксин вызывает повреждение эндотелия, а также циркулирующих лейкоцитов и тромбоцитов. Это приводит к слущиванию клеток эндотелия сосудов, обнажению базальной мембраны сосудов, выделению гистамина и серотонина, агрегации и разрушению лейкоцитов с высвобождением в просвет сосудов протеолитических ферментов из лизосом лейкоцитов.
Важнейшим компонентом патогенеза септического шока является ДВС-синдром, развитию которого способствует:
- активация фактора XII (Хагемана);
- повреждение эндотелия сосудов с выделением тканевого тромбопластина;
- агрегация тромбоцитов;
- высвобождение АДФ, серотонина, гистамина;
- активация факторов 3 и 4 свертывания крови;
- высвобождение тромбоксана А;
- ингибиция простациклина;
- гемолиз эритроцитов;
- воздействие эндотоксина на систему комплемента и каллекреин-кининовую систему.
Таким образом, на ранних этапах действия эндотоксина происходит:
- нарушение правильного распределения кровотока в капиллярах за счет дистонии артериол вследствие чрезмерного выброса веществ, влияющих на сосудистый тонус;
- спазм артериол, их паралитическое расширение, открытие артериовенозных шунтов и сброс из них части крови;
- образование мельчайших фибриновых, тромбоцитарных и смешанных микротромбов;
- увеличение вязкости крови за счет появления мономеров фибрина в кровотоке и явлений эритроцитарного сладжа;
- ухудшение капиллярной перфузии.
Септический шок сопровождается острой циркуляторной недостаточностью с критическим снижением периферического кровотока.
В связи с изменением характера гемодинамики при сепсисе возрастает работа сердца, и в первую очередь - сердечный выброс. Существенно увеличивается работа левого желудочка. Сердечный индекс незначительно превышает норму. В связи с дальнейшим неизбежным повышением периферического сопротивления из-за развития ДВС-синдрома усиливается тканевая гипоксия, развиваются миокардиодистрофия и вторичный гиповолемический синдром, характеризующийся уменьшением притока венозной крови к сердцу и минутного объема из-за задержки жидкости на периферии. Выраженное повышение легочного сосудистого сопротивления и легочная гипертензия способствуют прогрессированию сердечной недостаточности. Избыточная нагрузка на внешнее дыхание и миокард, несоответствие между ОЦК и емкостью сосудистого русла приводят к несоответствию между потребностями организма в кислороде и питательных веществах и возможностями их доставки, к неспособности организма элиминировать продукты обмена. Результатом этого являются органные и метаболические расстройства.
Нарушение капиллярной перфузии тканей вызывает включение компенсаторно-приспособительных механизмов:
- Усиливается фибринолиз в клетках эндотелия сосудов, находящихся в контакте с тромбом, что приводит к последующему лизису тромба и восстановлению проходимости сосудов.
- Активизируются клетки системы макрофагов, обеспечивающие фагоцитоз бактерий и обезвреживание токсичных продуктов.
При существовании длительной эндотоксемии наступает декомпенсация системы гомеостаза, что приводит к дальнейшему ухудшению условий функционирования тканей организма.
Блокада микроциркуляции обусловливает:
- развитие анаэробного гликолиза;
- депонирование крови в выключенных из циркуляции участках тканей;
- нарастание метаболического ацидоза;
- резкое увеличение проницаемости клеточных мембран;
- спазм и микротромбоз капилляров почечных клубочков с нарушением их функции вплоть до анурии;
- гипоксию, отек, жировую дистрофию и некроз частей печеночных долек;
- массовую обструкцию фибриново-тромбоцитарными тромбами капилляров легочной артерии;
- отек внутриальвеолярной перегородки;
- открытие артериовенозных шунтов;
- геморрагическое пропитывание легочной ткани.
Все эти многочисленные изменения являются патофизиологической основой клинических проявлений септического шока.
Симптомы Септического шока в послеродовом периоде:
Первым проявлением шока у больных обычно является озноб, сопровождающийся гипертермией до 39-40С с последующим снижением температуры тела до субнормальной или нормальной. С первых часов заболевания отмечаются частый, но ритмичный пульс, одышка, в легких выслушиваются влажные хрипы. Артериальное давление снижается до 60/20 мм рт. ст. и менее.
При диагностике шока часто основываются на показателях артериального давления, определяемого на плечевой артерии. Однако необходимо учитывать, что септический шок может развиться и при нормальном артериальном давлении. У отдельных больных могут наблюдаться даже повышенные цифры артериального давления.
Нередко при септическом шоке на первый план выступает острая сердечная недостаточность, основными клиническими признаками которой являются гипотония или коллапс, а также увеличение и болезненность печени. Это состояние обусловлено депонированием крови на периферии, уменьшением венозного оттока, снижением сердечного дебита и уменьшением систолического выброса крови.
В диагностике септического шока крайне важное значение имеет оценка функции легких, которая нарушается вследствие блокады легочного кровотока тромбоцитарно-фибриновыми агрегатами. Обычно нарушения функции легких проявляются в виде отека и развития острой легочной недостаточности, для которых характерны тахипноэ и метаболический ацидоз. Рентгенологически во всех отделах легких обнаруживают облаковидные затемнения, являющиеся проявлением интерстициального отека легочной ткани.
В начальных стадиях развития септического шока печень и селезенка определяются в обычных границах. С увеличением продолжительности шока у больных появляются схваткообразные боли в животе, частый обильный стул. Моча кровянистая, с большим содержанием белка. Позже она становится бурой, а в последующие дни цвет ее вновь становится обычным.
Одним из характерных для септического шока объективных симптомов неадекватного кровоснабжения жизненно важных органов является нарушение функции почек, проявляющееся олигурией (выделение до 20 мл мочи за 1 ч). В дальнейшем снижается относительная плотность мочи и развивается почечная недостаточность.
При септическом шоке имеет место появление парестезии, сильных мышечных болей, которые усиливаются даже при прикосновении постельного белья.
Отмечаются некоторые изменения психики больных с септическим шоком, что вначале выражается чувством беспокойства, возбуждением, а через 4-6 ч сменяется безразличием к окружающему, некритическим отношением к своему состоянию, эйфорией.
Следует отметить, что картина септического шока во многом определяется нарушением микроциркуляции, обусловленным ДВС-синдромом, клиническая диагностика которого неотделима от диагностики септического шока.
Клиническими проявлениями ДВС-синдрома являются:
- кровоточивость в одном или нескольких местах (в месте уколов, из матки, из поврежденных при операции тканей);
- клинически выраженный гемолиз и геморрагический диатез;
- бледность и акроцианоз кожных покровов;
- нарушение функции печени и почек;
- дыхательная недостаточность;
- нарушение сознания.
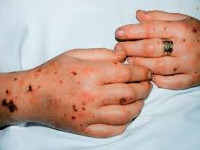
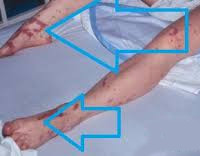
В первые часы шока багрово- красный цвет кожных покровов резко контрастирует с цианотичной окраской губ, ногтевого ложа и кончиков пальцев. К 6-12 ч заболевания на коже губ, носа и других участках появляются высыпания геморрагического характера. Геморрагический некроз кожи лица, синюшность кожи рук, ног, носа, щек и ушных раковин указывают на признаки ДВС-синдрома.
Геморрагический диатез часто также проявляется желудочно-кишечными кровотечениями, кровоизлияниями в склеры глаз и метроррагиями.
Независимо от причин шока его тяжелые клинические признаки обычно отодвигают на задний план симптомы заболевания, являющегося причиной возникновения шока.
При исследовании периферической крови в первые часы заболевания выявляется лейкопения, сменяющаяся к концу 1-х суток прогрессирующим лейкоцитозом. При бактериологическом анализе у 1/4 больных удается высеять возбудитель из крови, почти у 1/2 - из мочи и у 90 % - из шеечного канала.
Точная диагностика патологического внутри-сосудистого свертывания крови возможна лишь при своевременном лабораторном исследовании системы гемостаза.
Подострая и острая формы ДВС-синдрома у больных с септическим шоком характеризуются выраженной тромбоцитопенией (50,0 * 109/л), гипофибриногенемией (менее 1,5 г/л), повышенным потреблением антитромбина и плазминогена, резким повышением содержания дериватов фибрина и фибриногена, ПДФ, удлинением век.
При хроническом ДВС-синдроме имеют место умеренная тромбоцитопения (менее 150,0* 109/л), гипофибриногенемия, усиленное потребление антитромбина III, повышение концентрации РКМФ и ПДФ, а также реальная гиперактивность системы гемостаза.
При затянувшемся шоке (более 1 сут), как правило, имеет место волнообразное его течение со сменой в периферической крови гиперкоагуляции на гипокоагуляцию, и наоборот. Эти изменения гемостаза находятся во взаимосвязи с расстройствами микроциркуляции (спазм артериол, уменьшение количества функционирующих капилляров, внутрисосудистая агрегация эритроцитов).
Адаптационная реакция организма в ответ на инфекцию сопровождается задержкой жидкости в организме. В первые часы шока, несмотря на увеличение ОЦК, содержание натрия в плазме крови сохраняется на физиологическом уровне, а концентрация калия снижается вплоть до развития острой почечной недостаточности. Одновременно отмечаются накопление в крови недоокисленных продуктов обмена, сдвиг КОС крови в сторону дыхательного алкалоза и метаболического ацидоза.
К концу 1-х суток происходит декомпенсация метаболических нарушений, снижается рН и развивается выраженный метаболический ацидоз.
При патологоанатомическом исследовании больных, умерших от септического шока, изменения в родовых путях нередко бывают обусловлены повреждениями тканей при абортах, выкидышах или вследствие гнойно-септического процесса в матке.
Матка при этом атонична, с дряблыми стенками, зияющими сосудами, полость ее расширена, содержит сгустки крови и участки некротизированных тканей.
Если смерть больной наступает вследствие нарушения процесса отделения плаценты, то макро- и микроскопически обнаруживаются признаки септического процесса в плаценте и матке, при этом плацента имеет вид вареного мяса с резким гнилостным запахом. При микроскопическом исследовании в плаценте или ее остатках определяются очаги некроза, где содержится большое количество бактерий. В субплацентарной зоне выявляются кровоизлияния и некрозы поверхностных отделов мышцы матки. В сосудистом русле плаценты и спиральных артериях обнаруживаются множественные тромбоцитарно-фибриновые тромбы.
Для патоморфологической картины внутренних органов (почек, печени, легких, надпочечников, гипофиза, желудочно-кишечного тракта) умерших больных характерно наличие большого количества тромбоцитарно-фибриновых тромбов в микроциркуляторном русле в сочетании с многочисленными участками кровоизлияний. Эти морфологические изменения сопровождаются переполнением венозной системы кровью, депонированием ее в портальной системе кровообращения. Кровоизлияния обычно имеют петехиальный характер, они наблюдаются преимущественно в коже, слизистой оболочке желудочно-кишечного тракта, в миокарде, легких, почках, яичниках. Наиболее постоянно они возникают в корковом веществе надпочечников и стволовом отделе головного мозга.
Диагностика Септического шока в послеродовом периоде:
Диагноз септического шока устанавливают на основании анализа данных анамнеза, результатов клинического и лабораторного обследования, свидетельствующих о проявлениях бактериемии, а также на основании данных инструментальных методов исследования.
Для уточнения диагноза септического шока и проведения целенаправленной терапии в первую очередь необходимо проведение следующих мероприятий:
- контроль артериального давления, ЦВД, частоты дыхания каждые 30 мин;
- измерение ректальной температуры 4 раза в сутки, особенно после озноба, для сопоставления с данными температуры тела в подмышечной области;
- посевы крови в момент госпитализации и во время ознобов с определением чувствительности выделенной микробной флоры к антибиотикам;
- почасовой контроль за диурезом;
- выделение микробной культуры из мочи, определение чувствительности микробов к антибиотикам;
- определение содержания электролитов сыворотки, азота, мочевины, креатинина, мочевой кислоты, газов артериальной крови, рН;
- постоянный мониторный контроль ЭКГ, частоты сердечных сокращений;
- рентгенологическое исследование грудной клетки, брюшной полости при вертикальном положении пациентки для обнаружения свободного газа под диафрагмой, а также исключения инородного тела в брюшной полости;
- общий анализ крови с оценкой лейкоцитарной формулы, определение гематокритного числа;
- исследование показателей свертывания крови: количество тромбоцитов, фибриногена, РКМФ, ПДФ, антитромбина III, показателей тромбоэластограммы.
Ультразвуковое и рентгенологическое исследование, КТ и МРТ выполняют для уточнения расположения первичных и вторичных (метастатических) гнойных очагов.
Лечение Септического шока в послеродовом периоде:
Лечение септического шока основывается на следующих принципах.
- Раннее и полное удаление септического очага (матки) с широким дренированием брюшной полости.
- Проведение массивной и длительной антибактериальной терапии. При этом возможны следующие сочетания антибиотиков:
- ампициллин (4-6 г/сут) и гентамицин (240 мг/сут);
- ампициллин (4-6 г/сут) и канамицин (2 г/сут);
- бензилпенициллина натриевая соль (6000000-20000000 ЕД/сут) и гентамицин (240 мг/сут) или канамицина (2 г/сут);
- клафоран (4-8 г/сут) или цефамезин (4-8 г/сут) с гентамицином (240 мг/сут).
Эти компоненты терапии должны применяться сочетанно в наиболее ранние сроки заболевания с учетом состояния больных и показателей гемостаза.
К каким докторам следует обращаться если у Вас Септический шок в послеродовой период:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Септического шока в послеродовом периоде, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Показатели летальности при септическом шоке (СШ), по данным разных авторов, сильно разнятся, но в любом случае, остаются очень высокими – 30-80%.
Симптомы, связанные с септическими состояниями (Bone RC., 1994, в сокращении). Сепсис
Системный ответ на инфекцию, который проявляется двумя (или более) следующими признаками:
температура выше 38°С или
ЧСС более 90 в минуту;
Частота дыхания более 20 в минуту или РаСO2
Сепсис с артериальной гипотензией, развивающейся, несмотря на адекватную инфузионную терапию, и нарушением тканевой перфузии, которая может сопровождаться (но не ограничиваться) лактатацидозом, олигурией и острыми нарушениями психического статуса. У пациентов, находящихся на инотропной поддержке, гипотонии может и не быть, в то время, когда нарушения перфузии регистрируются.
Гемодинамика при СШ Стадия сепсиса
Низкое ДЗЛК/высокий СВ/низкое ОПСС
Высокое ДЗЛК/нормальный СВ/нормальное ОПСС
Высокое ДЗЛК/низкий СВ/высокое ОПСС
Методы лечения септического шока
Инфузионная терапия
Направлена на восстановление тканевой перфузии и нормализацию артериального давления.
В течение первых 6 часов инфузионной терапии следует добиваться следующих параметров:
В дальнейшем гемодинамические показатели рекомендуется поддерживать на субнормальном уровне – САД 90-110 мм рт. ст., АД сред. 75-85 мм рт. ст. На сегодня применение гидроксиэтилкрахмалов (ГЭК) даже третьего поколения (ГЭК 130/0,4), не говоря уже о первом и втором, у больных с тяжелым сепсисом и септическим шоком не рекомендуется.
Их назначение увеличивает летальность и частоту повреждения почек. Так что в качестве основы инфузионной терапии при сепсисе и септическом шоке используются сбалансированные солевые растворы. Ориентировочный начальный объем кристаллоидов – 30 мл/кг, после чего следует оценить состояние гемодинамики и необходимость назначения вазопрессоров. К альбумину несколько лет назад было очень осторожное отношение, но в настоящее время он полностью реабилитирован. Альбумин может быть препаратом выбора, когда у пациента имеется значительная (менее 25 г/л) гипоальбуминемия, либо развился ОРДС, абдоминальный компартмент-синдром.
Сочетание инфузии 500 мл 10% альбумина с последующим внутривенным введением фуросемида в дозе 1-2 мг на кг тела больного – вполне эффективный прием, действующий при олигурии, остром респираторном дистресс-синдроме, парезе кишечника. Гиперосмолярные растворы кристаллоидов (например – натрия хлорид 7,5%) могут использоваться у пациентов с повышенным ВЧД.
Компоненты крови
После устранения тканевой гипоперфузии и при отсутствии усугубляющих факторов, (острая кровопотеря, ИБС, лактатацидоз), переливание крови рекомендуется тогда, когда уровень гемоглобина падает ниже 70 г/л. Оптимальный уровень гемоглобина – 70-90 г/л. При снижении центральной венозной сатурации < 70% показано переливание эритроцитарной массы. Рутинное применение свежезамороженной плазмы для коррекции нарушений коагуляции, при отсутствии кровотечения, не рекомендуется.
При тяжелом сепсисе и отсутствии кровотечения переливание тромбоцитов применяю тогда, когда их уровень снижается ниже 5×109/л (абсолютные показания для трансфузии). Относительными показаниями является уровень 5-30 ×109/л. При уровне тромбоцитов > 50 ×109/л риск кровотечения небольшой.
![Септический шок]()
Введение вазопрессоров
Введение вазопрессоров (или их сочетаний) показано в случае, когда адекватная инфузионная терапия не в состоянии восстановить нормальное кровяное давление и перфузию внутренних органов. Норэпинефрин (Норадреналин) следует выбирать в первую очередь. Фенилэфрин (Мезатон) несколько снижает ударный объем, но в меньшей степени, по сравнению с другими вазопрессорами, вызывает тахикардию. Сравнительные исследования по применению норэпинефрина и фенилэфрина при септическом шоке показали преимущество первого – применение норэпинефрина в меньшей степени вызывало развитие ацидоза и реже приводило к развитию почечного повреждения.
Хотя в последнее время появилось достаточное количество публикаций, где было показано, что допамин не является оптимальным препаратом у пациентов с СШ – увеличивает летальность, вызывает выраженную тахикардию и является слабым вазопрессором, его продолжают достаточно широко использовать. В любом случае низкие дозы допамина (1-5 мкг/кг/мин) не должны назначаться для профилактики нарушений функции почек.
Некоторые специалисты предпочитают начинать терапию СШ с введения эпинефрина (Адреналина). При назначении вазопрессоров медики ориентируются на те же значения артериального давления, как было рекомендовано выше при проведении инфузионной терапии. При резистентной к терапии гипотензии, используют одновременно два препарата. Наиболее часто: сочетание добутамина (5-20 мкг/кг/мин) с норэпинефрином, реже – эпинефрина или допамина с норэпинефрином. После стабилизации гемодинамики и улучшения общего состояния больного, скорость введения вазопрессоров нужно снижать постепенно (за 24-36 часов).
Вазопрессин. Препарат назначают при рефрактерном к инфузионной терапии и введению вазопрессоров СШ. Препарат вызывает стойкую вазоконстрикцию, что восстанавливает АД и органный кровоток. Применяется в виде длительной постоянной инфузии со скоростью 0,01-0,04 ед/мин до стойкого улучшения состояния. Ранняя отмена вазопрессина приводит к развитию глубокой гипотензии.
Терлипрессин (синтетический аналог вазопрессина) – также применяется для лечения СШ. Вводится в/в болюсом, в дозе 1-2 мг. Эффект проявляется приблизительно через 20 минут и длится около 4-5 часов.
При применении данных препаратов отмечается высокая частота серьезных побочных эффектов в результате их системого действия – церебральная, сердечная, мезентериальная ишемия, флебиты. Для уменьшения побочных действий, введение препаратов этой группы всегда сочетают с введением традиционных вазопрессоров (норэпинефрин и др.).
Метиленовый синий обеспечивает снижение продукции оксида азота за счет угнетения аденилциклазы. Его применение может быть полезным в лечении рефрактерного септического шока. Применяют внутривенно из расчета: 2 мг/кг за 15 минут, затем через 2 ч в виде инфузии с постепенно возрастающей скоростью (0,25; 0,5; 1; 2 мг/кг/ч) по 1 ч.
Назначение кортикостероидов
Гидрокортизон подавляет гиперактивность иммунной системы, препятствуя миграции лейкоцитов в участок воспаления, уменьшают активацию макрофагов и эндотелиальных клеток, уменьшают продукцию оксида азота. При СШ возможно развитие как абсолютной, так и относительной надпочечниковой недостаточности. По этой причине больным вводят именно гидрокортизон в небольших дозах – 150-300 мг/сут.
Очень важна правильная методика введения. Рекомендуется: нагрузочная доза – 50 мг. Далее внутривенно непрерывно в течение 24 часов дозатором со скоростью приблизительно 10 мг/час. Возможен и другой вариант введения гидрокортизона – по 50 мг в/в × 4-6 раз в сутки. Введение начинать в наиболее ранние сроки после развития СШ. Вводить до стойкого улучшения состояния, т.е. длительно (несколько суток, а чаще – не менее 7 дней).
Крупнейшее на сегодняшний день исследование CORTICUS не смогло подтвердить влияние назначения гидрокортизона при сепсисе на выживаемость больных. Нет данных, подтверждающих эффективность назначения других кортикостероидов (дексаметазона, преднизолона) при сепсисе.
Проведение антиинфекционной терапии
Причиной сепсиса могут быть не только бактерии, но и вирусы, грибы, простейшие и т.д, но в подавляющем большинстве случаев СШ имеет бактериальную природу.
Понятие рациональной антибиотикотерапии подразумевает, что:
- Внутривенная антибактериальная терапия должна быть начата в течение первого часа с момента установления диагноза сепсиса или септического шока;
- Желательно до начала антибактериальной терапии осуществить забор микробиологического материала для определения возбудителя (мазок из раны, кровь, мокрота, моча и т.д.);
- Метод деэскалационной эмпирической антибактериальной терапии демонстрирует лучшие результаты лечения, но требует наличия в больнице современной бактериологической лаборатории.
Традиционная начальная эмпирическая терапия должна включать в себя один, или более, антибактериальных препаратов, способных проникать в предполагаемый источник сепсиса и обладающих активностью против всех вероятных инфекционных агентов. Так для пациентов с СШ, где имеется вероятность инфицирования P. Aeruginosa (например, при перитоните, гнойных ранах) назначается бета-лактамный антибиотик широкого спектра в сочетании с аминогликозидом или фторхинолоном. А для легочных нагноительных процессов, где самым частым возбудителем является Streptococcus pneumoniae, для стандартной стартовой терапии используется комбинация беталактама и макролида.
Режим введения антибиотиков должен регулярно пересматриваться с учетом микробиологических и клинических данных с целью назначения препаратов более узкого спектра действия, для предотвращения развития устойчивости и снижения побочных эффектов антибактериальной терапии в целом. В большинстве случаев, длительность антибиотикотерапии составляет 7-10 дней. Но она может варьировать в широких пределах в зависимости от симптомов.
Хирургическая ликвидация септического очага
Когда источник инфекции, подлежащий хирургическому лечению, идентифицирован, меры по санации очага должны приниматься сразу после стабилизации состояния больного. В большинстве случаев – в первые 12 часов после установления диагноза СШ. Исключением, по мнению большинства специалистов, является инфицированный перипанкреатический некроз, когда вмешательство должно быть отложено до образования четких границ между инфицированными и не пораженными тканями. Если предположительным источником сепсиса служит в/в кате-тер или другие внутрисосудистые устройства, они должны быть немедленно удалены.
Респираторная терапия
Во многом схожа с лечением больных с ОРДС. Если нет противопоказаний, больные, которым проводится ИВЛ, должны находиться в полусидячем положении – головной конец кровати приподнят на 30-45 градусов. Что позволяет снизить частоту пневмоний, связанных с ИВЛ. Применения мышечных релаксантов при сепсисе необходимо, по возможности, избегать из-за риска длительной нервно-мышечной блокады.
Большие величины дыхательных объемов (ДО), особенно, если их использование сопровождается высоким уровнем давления в дыхательных путях, не должны применятся. Рекомендуемые величины: ДО – 6-7 мл/кг идеальной массы тела, давление в дыхательных путях < 30 см вод. ст. Положительное давление в конце выдоха (ПДКВ) должно использоваться во всех случаях для уменьшения ателектазирования альвеол.
Профилактика венозного тромбоза и ТЭЛА
Показана всем больным, не имеющим противопоказаний. Использование низкомолекулярных гепаринов, по сравнению с нефракционированным гепарином, ассоциируется с меньшей частотой геморрагических осложнений.
Профилактика стрессовых язв ЖКТ
Показана больным с тяжелым сепсисом и септическим шоком при наличии факторов риска (например, ИВЛ, геморрагические проявление, язвенная болезнь, прием кортикостероидов и т.д). Применяют ингибиторы протонной помпы (омепразол и др.) или блокаторы H2-гистаминовых рецепторов.
Контроль уровня глюкозы в крови
Исследования показали, что высокие концентрации инсулинподобного связывающего фактора роста (insulin-like growth factor binding protein) коррелирует с высоким уровнем летальности. Эти больные, как правило, имеют наиболее низкие уровни инсулина, что указывает на абсолютную недостаточность его секреции. Отсюда рекомендация – поддержание верхнего уровня глюкозы ниже 6,1 ммоль/л путем введения инсулина.
При всей кажущейся простоте, поддержание оптимального уровня глюкозы в крови – сложная организационная задача и доступна очень немногим ОРИТ. Возникающая гипогликемия может свести на нет все потенциальные положительные эффекты нормогликемии. В настоящее время считается, что инсулин для коррекции гипергликемии должен быть назначен, если уровень глюкозы превышает 10 ммоль/л. Если назначается инсулин, настоятельно рекомендуется контролировать уровень глюкозы в крови, по крайней мере, через каждые четыре часа. И не использовать для этих целей, по возможности, капиллярную кровь.
Кормление больных
Известно, что раннее энтеральное питание способствует поддержанию целостности слизистой оболочки кишки и тем самым препятствует бактериальной транслокации. В то же время попытки проводить полное энтеральное питание на фоне тяжелого сепсиса сопровождались большой частотой развития диареи, задержки пищи в желудке. Что, в конечном итоге, приводило к росту гнойных осложнений. Также раннее полное парентеральное питание увеличивало частоту гипергликемий и инфекционных осложнений.
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
МКБ-10
![Акушерский сепсис]()
Общие сведения
![Акушерский сепсис]()
Причины
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Патогенез
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Классификация
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
Осложнения
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
Диагностика
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
Прогноз и профилактика
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
![Септический шок]()
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.
![Септический шок]()
Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Читайте также: