Септический шок при переливании крови
Обновлено: 23.04.2024
Патогенетическая терапия септического шока - коррекция гемодинамики
Гемодинамическая поддержка при септическом шоке. Шок представляет собой дисбаланс между доставкой и потреблением клетками кислорода и других метаболических веществ в результате нарушения тканевой перфузии с формированием дисфункции органов. Септический шок, кроме того, включает патофизиологические изменения, наступающие в результате генерализованного воспаления и участия широкого спектра медиаторов: цитокинов, простагландинов, оксида азота и многих других.
Септический шок характеризуется артериальной гипотензией со снижением среднего уровня АД ниже 65—70 мм рт. ст. Обычно гипотензия сопровождается нарушением тканевой перфузии: олигурией, микроциркуляторными нарушениями, снижением восприятия окружающей обстановки. Адекватность регионарной перфузии оценивается на основании клинических симптомов, функции органов, степени коагуляционных нарушений, лабораторных тестов, указывающих на органную или полиорганную недостаточность.
Адекватность тканевой перфузии при септическом шоке. Целью трансфузионной терапии септического шока является восстановление тканевой перфузии и нормализация метаболизма клеток. Применение трансфузионной терапии достоверно увеличивает сердечный выброс, доставку кислорода и других метаболитов, является средством коррекции гипотензии и восстановления гемодинамической стабильности. Выбор оптимального объема инфузии не всегда является простой задачей, и для оценки адекватности объемной нагрузки обычно применяют такие показатели, как достижение определенного уровня АД, частоты сердечных сокращений и темпа диуреза. Измерение центрального венозного давления используется для оценки исходного соотношения объема циркулирующей крови и насосной функции сердца, так как определение оптимального давления заполнения правого сердца является слишком сложным для рутинной клинической практики.
Необходимо помнить, что увеличение объема циркулирующей крови и плазмы приводит к увеличению сердечного выброса и снижению летальности больных септическим шоком.
Виды инфузионных растворов при септическом шоке. В лечении больных септическим шоком используют инфузии коллоидных и кристаллоидных растворов. До настоящего времени оживленно обсуждается практика применения этих видов растворов, причем в Европе предпочтение отдается коллоидным растворам, в Северной Америке — кристаллоидам. Коллоидные растворы разделяются на натуральные (альбумин, препараты плазмы) и синтетические (желатины, декстраны, гидроэтилкрахмал).
В принципе инфузионная терапия применяется для повышения конечного диастолического давления в сердце и, согласно закону Старлинга, увеличения сердечного выброса. Для достижения гемодинамической цели лечения может быть использован любой из имеющихся растворов. Гемодинамический эффект может быть достигнут несколько быстрее с помощью коллоидных растворов, чем кристаллоидных. Однако стоимость коллоидных растворов существенно превосходит стоимость кристаллоидных. В связи с этим качество, вид, объем, соотношение коллоидных и кристаллоидных растворов выбирается в зависимости от особенностей конкретной клинической ситуации и противопоказаний к применению того или иного лекарственного препарата.
Чем тяжелее состояние пациента, нуждающегося в инфузионной терапии, тем точнее требуется подбор (титрование) объема инфузионной терапии из-за опасности гипергидратации.
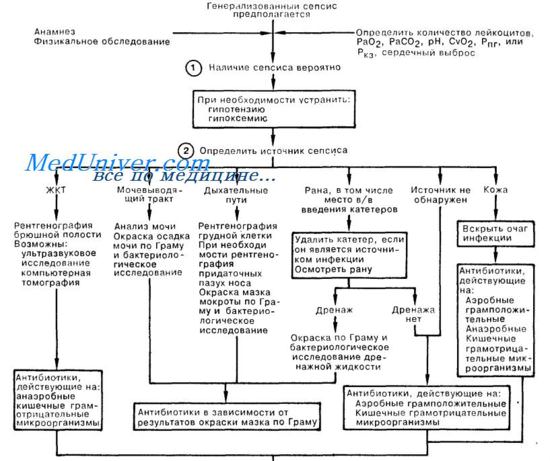
До настоящего времени не получено убедительных данных, подтверждающих преимущество кристаллоидных или коллоидных растворов для улучшения результатов лечения септического шока. Известно, что для достижения одинакового улучшения перфузии тканей объем кристаллоидов должен превышать объем коллоидов в 2—4 раза, следовательно, инфузия кристаллоидов требует более продолжительного периода времени.
Альбумин составляет около 80 % белков плазмы и определяет коллоидно-осмотическое давление у здоровых людей. В условиях высокой сосудистой проницаемости, интерстициального отека тканей, характерных для больных тяжелым сепсисом и септическим шоком, для привлечения в кровяное русло избытка интерстициальной жидкости необходимо применять гипертонические растворы альбумина (20—25 %). Следует помнить, что суточная потребность организма в альбумине в норме составляет 80 г, т. е. для ее компенсации требуется 400 мл 20 % раствора альбумина. Однако такой объем ежедневных инфузии альбумина, по-видимому, необходим только пациентам с тяжелым нарушением белково-синтетической функции печени, поэтому растворы альбумина целесообразно вводить только в концентрированном виде для коррекции гипоальбуминемии или низкого онкотического давления крови.
Объем инфузии концентрированного раствора подбирается индивидуально в соответствии с указанными показателями пациента. С целью коррекции гемодинамических нарушений применение раствора альбумина нецелесообразно.
Гидроэтилкрахмал (ГЭК) представляет собой 6 % синтетический коллоид в изотоническом солевом растворе. Имеются экспериментальные данные, указывающие на то, что ГЭК обладает способностью снижать степень эндотелиальных повреждений и выраженность синдрома высокой сосудистой проницаемости. Однако из-за способности взаимодействовать с VIII фактором свертывания и удлинения времени свертывания объем инфузии ГЭК должен быть ограничен.
Раствор желатина оказался существенно дешевле, но и значительно менее эффективным.
В целом необходимо отметить, что внутривенная трансфузия коллоидных и кристаллоидных растворов направлена на повышение давления заполнения правого предсердия, что по закону Старлинга приводит к увеличению сердечного выброса и оптимизации кровотока. Выбор растворов для коррекции гемодинамических нарушений определяется традициями отделения, возможностями адекватного мониторинга гемодинамических параметров, индивидуальными предпочтениями лечащего врача. Исследований, которые бы доказывали преимущества коллоидных препаратов над кристаллоидными, или каких-то определенных соотношений коллоидных и кристаллоидных препаратов не имеется. Общий объем суточной инфузии растворов у больных с септическим шоком заранее определить невозможно, поэтому обычно применяют методику титрования объема вводимых растворов в зависимости от их эффекта на центральную гемодинамику, диурез и другие показатели тканевого кровотока.
Переливание крови при септическом шоке. Переливание крови показано только при снижении концентрации гемоглобина ниже уровня 90 г/л. Однако известно, что анемия до 70 г/л достаточно хорошо переносится больными сепсисом. Основными признаками, указывающими на необходимость гемотрансфузии, следует считать очень низкую сатурацию смешанной венозной крови (SvО2) и электрокардиографические признаки ишемии сердца. При трансфузии крови с целью улучшения оксигенации преимущество имеет свежезаготовленная кровь.
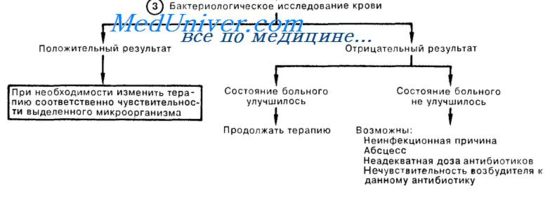
Применение вазопрессоров при септическом шоке. Если внутривенная трансфузия растворов оказывается неспособной поддерживать приемлемый уровень АД и тканевой перфузии, возникает необходимость применения вазопрессорных препаратов.
Определение АД непрямым методом у больных септическим шоком может быть недостаточно точным, поэтому рекомендуется производить прямое измерение с помощью катетеризации артерии. Для оценки эффективности вазопрессоров обычно проводят мониторинг среднего АД. В экспериментальных исследованиях показано, что при среднем АД выше 60 мм рт. ст. имеются условия для адекватной ауторегуляции коронарных, почечных и мозговых сосудов. Однако у пожилых и пациентов с хронической артериальной гипертонией для обеспечения тканевой перфузии возникает необходимость в поддержании более высокого уровня среднего АД, которое определяется адекватностью диуреза (50— 100 мл/ч).
Во многих исследованиях доказано, что при применении адекватных доз вазопрессоров происходит улучшение перфузии почек. Нормальный почечный кровоток обычно обеспечивается средним АД на уровне 75 мм рт. ст., однако возможны индивидуальные колебания. У большинства пациентов поддержание среднего АД на уровне 60—65 мм рт. ст. позволяет получить адекватный диурез. У некоторых олигурия может оставаться даже при нормальном почечном кровотоке из-за снижения гломерулярного перфузионного давления или необратимых ишемических повреждений почек. Перфузия спланхнического бассейна (мезентериальные, печеночные и селезеночные артерии) и сохранность слизистой кишечника играют важную роль в патогенезе полиорганной недостаточности, причем адреналин способен снизить объем кровотока в этом бассейне.
Низкие дозы допамина увеличивают доставку кислорода органам спланхнического бассейна на 65 %, при этом потребление кислорода возрастает только на 16 %. Этот феномен до настоящего времени не получил объяснения. Для минимизации ятрогенного эффекта на кровообращение рекомендуется комбинированная инфузия норадреналина и допамина. Однако одновременное введение норадреналина и низких доз допамина (1— 4 мкг/кг в минуту) у пациентов с септическим шоком не приводило к снижению летальности.
Для оценки гемодинамического эффекта допамина необходимо вспомнить соотношение основных параметров центральной гемодинамики. Минутный объем кровообращения является величиной, характеризующей в целом объем крови, который проходит через сердце и необходим для поддержания жизненных функций организма. Минутный объем кровообращения вычисляется по произведению ударного объема на частоту сердечных сокращений. Из-за значительных различий абсолютной величины ударного объема у людей с разным конституционным типом часто применяют показатель ударного индекса, представляющий собой частное от деления ударного объема на площадь тела. Этот показатель в большей степени позволяет сравнивать насосную функцию сердца различных пациентов.
Сердечный индекс представляет собой произведение ударного индекса на частоту сердечных сокращений. Если рассчитать периферическое сосудистое сопротивление, т. е. то сопротивление, которое создается периферическими сосудами объему крови, который выбрасывается сердцем, можно определить работу левого желудочка сердца. Таким образом, увеличение ударного и сердечного индекса нужно трактовать как позитивный эффект применения вазопрессоров. Возрастание работы сердца за счет увеличения частоты сердечных сокращений или повышения сосудистого тонуса, не соответствующего ударному индексу (объему), нужно рассматривать как отрицательное влияние применения вазопрессоров.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение посттрансфузионных реакций. Гемотрансфузионные осложнения переливания крови
Реакции легкой и средней степени тяжести не требуют специального лечения. Больного укрывают теплым одеялом, к ногам кладут теплые грелки, дают пить горячее сладкое питье. Терапию пирогенных реакций производят, используя жаропонижающие (325—500 мг ацетаминофена). Следует избегать назначения аспиринсодержащих препаратов из-за их неблагоприятного воздействия на функцию тромбоцитов. Десенсибилизирующие и симптоматические средства.
При тяжелой реакции проводится комплексная медикаментозная терапия по показаниям:
• адреналин 0,1 %-ный — 1 мл;
• хлористый кальций 10 %-ный или глюконат кальция 10 %-ный — по 10 мл;
• гидрокортизон (не менее 100 мг), целестон — 4 мг, дексаметазон 4 мг или другие глюкокортикоиды — в дозе, эквивалентной 60 мг преднизолона, и выше;
• лазикс — 20—40 мг (после купирования метаболического ацидоза);
• кристаллоидные растворы на фоне нормального венозного давления.
Лечение анафилактического шока зависит от быстроты и эффективности экстренной и интенсивной терапии, включает ингаляцию кислородом, восстановление проходимости дыхательных путей и, при необходимости, ИВЛ. Внутривенно медленно вводят 100—200 мг преднизолона в 20 мл 5 %-ного раствора глюкозы или физиологического раствора. При бронхоспазме внутривенно ввводят 10 мл 2,4 %-ного раствора эуфиллина с 10—20 мл 5 %-ного р-ра глюкозы. Острый отек гортани с асфиксией служит показанием к срочной трахеостомии. При нарастании процесса развития дыхательной недостаточности применяют искусственную легочную вентиляцию.
При судорожном синдроме вводится внутривенно 2—4 мл 0,5 %-ного р-ра седуксена в 10—20 мл физиологического раствора.
Важным моментом лечебных мероприятий является коррекция ацидоза. С этой целью внутривенно назначают 200 мл 4 %-ного р-ра гидрокарбоната натрия.
Для стимуляции диуреза применяют внутривенное введение 20—40 мг лазикса.

Гемотрансфузионные осложнения и методы их профилактики
В отличие от посттрансфузионных реакций, гемотрансфузионные осложнения характеризуются тяжелыми клиническими проявлениями, представляющими опасность для жизни больного вследствие нарушения деятельности органов и систем организма, осуществляющих жизненно важные функции.
Основные причины осложнений
Осложнения могут быть обусловлены: 1) качеством и свойствами крови (компонентов) вследствие несоблюдения правил заготовки;
2) несоблюдением правил переливания;
3) серологической несовместимостью;
4) вирусной зараженностью;
5) бактериальным загрязнением;
6) нарушением режима и сроков хранения, транспортировки и т. д.;
7) наличием у реципиентов заболеваний или состояний (например, сенсибилизация), при которых переливание крови или определенного компонента противопоказано.
Непосредственно при гемотрансфузии или в раннем посттрансфузионном периоде наиболее часто наблюдаются гемотрансфузионный шок, острый внутрисосудистый гемолиз и геморрагический синдром. У оперированных больных может развиться острая почечно-печеночная недостаточность.
В.А. Аграненко (1998) приводит анализ 766 гемотрансфузионных осложнений у больных в различных лечебных учреждениях. Было установлено, что в 625 случаях (81,6 %) причина заключалась в переливании крови, несовместимой по групповым факторам крови, из них 274 (35,8 %) — по системе АВО, 328 (42,8 %) — по резус-фактору и 23 (3 %) — по антигенам других систем. Осложнения, связанные с переливанием недоброкачественной крови, ее компонентов и препаратов были зафиксированы в 95 случаях (12,4 %); в 23 (3 %) — в связи с состоянием реципиента до трансфузии, в 3 случаях (0,4 %) они наступили из-за погрешностей в технике трансфузии (воздушная эмболия); в 20 (2,6 %) причина осложнений не была установлена ввиду отсутствия необходимых сведений.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Септический шок - эпидемиология, смертность
Тяжелый сепсис и септический шок являются актуальной проблемой современной медицины вследствие увеличения количества больных, высокой летальности и возрастания социально-экономических проблем, связанных с лечением и реабилитацией таких пациентов.
Септический шок является жизнеугрожающим состоянием, наиболее тяжелой стадией или формой развития генерализованной инфекции (сепсиса), характеризующейся наличием неконтролируемого инфекционного процесса, реактивного генерализованного воспаления, полиорганной дисфункции/недостаточности и артериальной гипотензии.
Многообразие сходных названий исторически связано с субъективными факторами: разработкой проблемы сепсиса и септического шока в различных областях медицинской науки, отсутствием до недавнего времени единой классификации сепсиса и объективными факторами — наличием существенных патогенетических различий механизмов развития сепсиса при ряде нозологических форм, недостаточной научной разработкой проблемы септического шока в целом.
На этой же конференции были даны определения других стадий инфекции: бактериемии, сепсиса, тяжелого сепсиса, септического шока и синдрома полиорганной дисфункции (СПД). Разработка этих определений открыла новые перспективы как для развития фундаментальных и прикладных научных исследований в области тяжелых инфекций, так и для клинической практики, заложив основу систематической разработки рекомендаций по диагностике и лечению.
Возбудители сепсиса
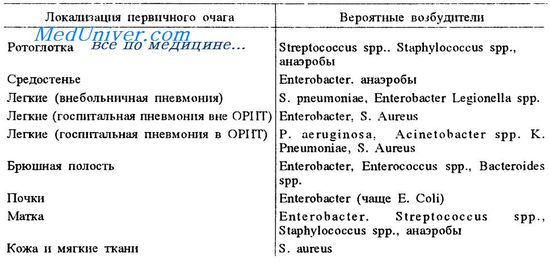
Эпидемиология септического шока
Септический шок как синдром, стадия или форма заболевания пока не включен в Международную классификацию болезней, поэтому ориентировочные эпидемиологические данные были получены при проведении нескольких многоцентровых проспективных рандомизированных контролируемых исследований с целью оценки эффективности лекарственных препаратов у больных сепсисом. Обнаружено, что пациенты с септическим шоком составляют 58 % от всех больных с тяжелым сепсисом. Математическое моделирование позволило примерно определить количество пациентов с септическим шоком в США — 435 580 человек в год.
Другим источником информации могут быть данные, полученные в ходе международного многоцентрового эпидемиологического исследования 14 364 пациентов в 28 отделениях реанимации и интенсивной терапии (ОРИТ): пациенты с септическим шоком составили 6,3 % от всех больных ОРИТ, причем в 63,2 % случаев септического шока был осложнением нозокомиальных инфекций (НИ). Согласно отечественным данным, доля больных с септическим шоком составила только 26,1 % среди всех пациентов с тяжелым сепсисом.
При включении критериев сепсиса, тяжелого сепсиса и септического шока в программу регистрации пациентов ОРИТ хирургического профиля было обнаружено, что среди 25,9 % пациентов с сепсисом доля больных септическим шоком составила 4,1 %.
Близкие данные по количеству больных септическим шоком приведены в исследованиях многих авторов — 2—4 %, однако имеются данные и о более высоких показателях —7—18 %, что может свидетельствовать о значительной разнородности исследованных групп пациентов.
Летальность в группе больных с септическим шоком. Причиной летальных исходов больных сепсисом и септическим шоком является органная недостаточность, причем комбинация недостаточности нескольких органов увеличивает вероятность летального исхода. В нескольких исследованиях произведена оценка летальности в группе пациентов с септическим шоком по сравнению с больными сепсисом и тяжелым сепсисом. Летальность в группе больных с септическим шоком составила от 46 до 82 %, что в 1,5—2,5 раза превосходило летальность больных тяжелым сепсисом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Посттрансфузионные осложнения – понятие, объединяющее совокупность тяжелых патологических реакций, развивающихся вследствие переливания крови или ее компонентов и сопровождающихся нарушением функции жизненно важных органов. Посттрансфузионные осложнения могут включать в себя воздушную эмболию и тромбоэмболию; гемотрансфузионный, цитратный, бактериальный шок; циркуляторную перегрузку, заражение гемоконтактными инфекциями и др. Распознаются на основании симптоматики, возникшей на фоне гемотрансфузии или вскоре после ее окончания. Развитие посттрансфузионных осложнений требует немедленного прекращения гемотрансфузии и оказания неотложной помощи.

Общие сведения
Посттрансфузионные осложнения – тяжелые, нередко представляющие угрозу для жизни больного состояния, обусловленные гемотрансфузионной терапией. Ежегодно в России осуществляется порядка 10 млн. гемотрансфузий, а частота осложнений составляет 1 случай на 190 переливаний крови. В большей степени посттрансфузионные осложнения характерны для ургентной медицины (хирургии, реаниматологии, травматологии, акушерства и гинекологии), возникают в ситуациях, требующих экстренной гемотрансфузии, и в условиях дефицита времени.
В гематологии принято разделять посттрансфузионные реакции и осложнения. Различного рода реактивные проявления, обусловленные гемотрансфузиями, встречаются у 1-3 % пациентов. Посттрансфузионные реакции, как правило, не вызывают серьезной и длительной органной дисфункции, в то время как осложнения могут приводить к необратимым изменениям в жизненно важных органах и гибели больных.
Причины посттрансфузионных осложнений
Переливание крови является серьезной процедурой, представляющей собой трансплантацию живой донорской ткани. Поэтому она должна производиться только после взвешенного учета показаний и противопоказаний, в условиях строго соблюдения требований техники и методики проведения гемотрансфузии. Такой серьезный подход позволит избежать развития посттрансфузионных осложнений.
Абсолютными витальными показаниями к гемотрансфузии служат острая кровопотеря, гиповолемический шок, продолжающееся кровотечение, тяжелая постгеморрагическая анмия, ДВС-синдром и др. Основные противопоказания включают декомпенсированную сердечную недостаточность, гипертоническую болезнь 3 степени, инфекционный эндокардит, ТЭЛА, отек легких, ОНМК, печеночную недостаточность, острый гломерулонефрит, системный амилоидоз, аллергические заболевания и т. д. Вместе с тем, при наличии серьезных оснований трансфузии крови могут проводиться, несмотря на противопоказания, под прикрытием профилактических мероприятий. Однако в этом случае риск посттрансфузионных осложнений возрастает в разы.
Чаще всего осложнения развиваются при повторном и значительном по объему переливании трансфузионной среды. Непосредственные причины посттрансфузионных осложнений в большинстве случаев носят ятрогенный характер и могут быть связаны с переливанием крови, несовместимой по системе АВО и Rh-антигену; использованием крови ненадлежащего качества (гемолизированной, перегретой, инфицированной); нарушением сроков и режима хранения, транспортировки крови; переливанием избыточных доз крови, техническими погрешностями при проведении трансфузии; недоучетом противопоказаний.
Классификация посттрансфузионных осложнений
Наиболее полную и исчерпывающую классификацию посттрансфузионных осложнений предложил А.Н.Филатов, разделивший их на три группы:
I. Посттрансфузионные осложнения, обусловленные погрешностями переливания крови:
- циркуляторная перегрузка (острое расширение сердца)
- эмболический синдром (тромбозы, тромбоэмболии, воздушная эмболия)
- нарушения периферического кровообращения вследствие внутриартериальных гемотрансфузий
II. Реактивные посттрансфузионные осложнения:
III. Заражение гемоконтактными инфекциями (сывороточным гепатитом, герпесом, сифилисом, малярией, ВИЧ-инфекцией и др.).
Посттрансфузионные реакции в современной систематике в зависимости от выраженности делятся на легкие, средней тяжести и тяжелые. С учетом этиологического фактора и клинических проявлений они могут быть пирогенными, аллергическими, анафилактическими.

Посттрансфузионные реакции
Могут развиваться уже в первые 20-30 минут после начала гемотрансфузии или вскоре после ее окончания и длятся несколько часов. Пирогенные реакции характеризуются внезапным ознобом и лихорадкой до 39-40°С. Повышению температуры тела сопутствуют боли в мышцах, цефалгия, стеснение в груди, цианоз губ, боли в области поясницы. Обычно все эти проявления стихают после согревания больного, приема жаропонижающих, гипосенсибилизирующих препаратов или введения литической смеси.
Посттрансфузионные аллергические реакции могут проявляться затруднением дыхания, ощущением удушья, тошнотой или рвотой, сыпью и кожным зудом, отеком Квинке. Возможно присоединение озноба, лихорадки, диареи, артралгий. Для купирования данных реакций применяются антигистаминные средства, при необходимости – глюкокортикоиды.
Реакции анафилактического типа, обусловленные гемотрансфузией, характеризуются острыми вазомоторными нарушениями: беспокойством больного, гиперемией кожи лица и груди, удушьем, артериальной гипотонией, тахикардией. При развитии подобного сценария показано немедленное введение антигистаминных препаратов, адреналина, эуфиллина, ингаляции кислорода. Данное состояние может перейти в тяжелое посттрансфузионное осложнение – анафилактический шок.
Гемотрансфузионные реакции могут иметь различную степень выраженности. Так, при легких реактивных состояниях температура тела повышается не более 38°С; отмечаются умеренные мышечные и головные боли, незначительное познабливание. Все проявления кратковременны и не требуют медикаментозного купирования. Для реакций средней степени выраженности характерно повышение температуры до 38,5-39°С; потрясающие ознобы, тахипноэ, учащение пульса, болевой синдром, крапивница. При тяжелых посттрансфузионных реакциях температура достигает 40°С; выражены озноб, боли в костях и мышцах, одышка, цианоз губ. Возможно развитие ангионевротического отека Квинке, спутанности сознания.
Посттрансфузионные осложнения
Острое расширение сердца
Развивается в результате слишком быстрого или массивного поступления консервированной крови в венозное русло больного. При этом правые отделы сердца не справляются с перекачиванием всего поступающего объема, следствием чего служит застой крови в правом предсердии и системе полых вен.
Симптоматика возникает во время гемотрансфузии или ближе к ее окончанию. Данное посттрансфузионное осложнение клинически проявляется затруднением дыхания, цианозом, болями в правом подреберье и в области сердца, снижением АД, повышением ЦВД, тахиаритмией, асистолией.
Первая помощь при остром расширении сердца заключается в немедленном прекращении вливания крови, проведении кровопускания в объеме 200–300 мл для разгрузки малого круга кровообращения. Больному обеспечивается подача увлажненного кислорода, введение сердечных гликозидов (коргликон, строфантин), сосудосуживающих средств (фенилэфрин, норадреналин), фуросемида.
Эмболический синдром
Воздушная эмболия является следствием попадания воздуха сначала в периферическую вену, а затем в легочную артерию с закупоркой ее ствола или ветвей. Это осложнение целиком связно с нарушением техники внутривенного вливания, а для его развития достаточно попадания в периферическую вену 2-3 см3 воздуха. Посттрансфузионная тромбоэмболия возникает при закупорке сосудов кровяными сгустками или венозными тромбами.
В типичных случаях развивается клиника ТЭЛА, сопровождающаяся резкими болями в грудной клетке, сильным кашлем, одышкой, цианозом, частым нитевидным пульсом, падением АД, беспокойством и возбуждением больного. При массивной тромбоэмболии легочной артерии прогноз, как правило, неблагоприятный.
При закупорке небольшими тромбами мелких ветвей легочной артерии развивается инфаркт легкого, признаками которого выступают боль в груди, кашель с выделением кровянистой мокроты, субфебрильная или фебрильная температура тела. Данные рентгенографии легких соответствуют картине очаговой пневмонии.
При первых признаках тромбоэмболических посттрансфузионных осложнений следует незамедлительно прекратить вливание крови, начать ингаляции кислорода, проведение тромболитической терапии (введение гепарина, фибринолизина, стрептокиназы), при необходимости – реанимационных мероприятий. При неэффективности медикаментозного тромболизиса показано выполнение тромбоэмболэктомии из легочной артерии.
Цитратная и калиевая интоксикация
Цитратная интоксикация обусловлена как прямым токсическим воздействием консерванта - лимоннокислого натрия (цитрата натрия), так и изменением соотношения в крови ионов калия и кальция. Цитрат натрия связывает ионы кальция, вызывая гипокальциемию. Обычно возникает при высокой скорости введения консервированной крови. Проявлениями данного посттрансфузионного осложнения служат артериальная гипотензия, повышение ЦВД, судорожные подергивания мышц, изменения ЭКГ (удлинение интервала Q-Т). При высоком уровне гипокальциемии возможно развитие клонических судорог, брадикардии, асистолии, апноэ. Ослабить или устранить цитратную интоксикацию позволяет вливание 10 % р-ра глюконата кальция.
Калиевая интоксикация может возникнуть при быстром введении эритроцитной массы или консервированной крови, хранившейся свыше 14 суток. В этих трансфузионных средах уровень калия значительно увеличивается. Типичными признаками гиперкалиемии служат вялость, сонливость, брадикардия, аритмия. В тяжелых случаях может развиться фибрилляция желудочков и остановка сердца. Лечение калиевой интоксикации предполагает внутривенное введение р-ра глюконата или хлорида кальция, отмену всех калийсодержащих и калийсберегающих препаратов, внутривенные инфузии физиологического раствора, глюкозы с инсулином.
Гемотрансфузионный шок
Причиной данного посттрансфузионного осложнения чаще всего выступает вливание несовместимой по AB0 или Rh-фактору крови, приводящее к развитию острого внутрисосудистого гемолиза. Различают три степени гемотрансфузионного шока: при I ст. систолическое АД снижается до 90 мм рт. ст.; при II ст.- до 80-70 мм рт. ст.; III ст. - ниже 70 мм рт. ст. В развитии посттрансфузионного осложнения выделяют периоды: собственно гемотрансфузионного шока, острой почечной недостаточности и реконвалесценции.
Первый период начинается либо во время трансфузии, либо сразу после нее и продолжается до нескольких часов. Возникает кратковременное возбуждение, общее беспокойство, боли в груди и пояснице, одышка. Развиваются циркуляторные нарушения (артериальная гипотония, тахикардия, нарушение сердечного ритма), покраснение лица, мраморность кожи. Признаками острого внутрисосудистого гемолиза служат гепатомегалия, желтуха, гипербилирубинемия, гемоглобинурия. Коагуляционные нарушения включают повышенную кровоточивость, ДВС-синдром.
При первых признаках гемотрансфузионного шока следует прекратить трансфузию, сохранив при этом венозный доступ. Незамедлительно начинается проведение инфузионной терапии кровезамещающими, полионными, щелочными растворами (реополиглюкин, пищевой желатин, бикарбонат натрия). Собственно противошоковая терапия включает введение преднизолона, эуфиллина, фуросемида. Показано использование наркотических анальгетиков и антигистаминных средств.
Одновременно осуществляется медикаментозная коррекция гемостаза, нарушений функции органов (сердечной, дыхательной недостаточности), симптоматическая терапия. С целью удаления продуктов острого внутрисосудистого гемолиза применяется плазмаферез. При тенденции к развитию уремии требуется проведение гемодиализа.
Профилактика посттрансфузионных осложнений
Развитие посттрансфузионных реакций и осложнений возможно предотвратить. Для этого необходимо тщательно взвешивать показания и риски переливания крови, строго соблюдать правила заготовки и хранения крови. Гемотрансфузии должны осуществляться под наблюдением врача-трансфузиолога и опытной медицинской сестры, имеющей допуск к проведению процедуры. Обязательна предварительная постановка контрольных проб (определение группы крови больного и донора, проба на совместимость, биологическая проба). Гемотрансфузию предпочтительно проводить капельным методом.
В течение суток после переливания крови больной подлежит наблюдению с контролем температуры тела, АД, диуреза. На следующий день больному необходимо исследовать общий анализ мочи и крови.
Читайте также:

