Септический шок у животных
Обновлено: 18.04.2024
Гиповолемический шок в ветеринарии. Кардиогенный и септический шок
Наиболее целесообразным представляется деление шока на виды с учетом патогенеза происходящих в организме изменений. С этой точки зрения выделяют гиповолемический, кар-диогенный, септический и анафилактический шок. При каждом из этих видов шока происходят специфические изменения.
Гиповолемический шок. Циркуляторная система организма состоит из трех основных частей: сердца, сосудов, крови. Изменения параметров деятельности сердца, тонуса, сосудов и объема циркулирующей крови (ОЦК) определяют развитие симптомов, характерных для шока. Гиповолемический шок вызывается острой потерей организмом крови, плазмы или жидкости циркулирующей крови. Гиповолемия (снижение ОЦК) приводит к уменьшению венозного возврата крови и снижению давления наполнения сердца (ДНС). В свою очередь, это ведет к снижению ударного объема сердца (УОС) и падению артериального давления (АД).
Вследствие стимуляции симпатоадреналовой системы возрастает частота сердечных сокращений (ЧСС) и возникает вазоконстрикция [рост общего периферического сопротивления (ОПС) току крови, что поддерживает центральную гемодинамику и вызывает централизацию кровообращения]. При этом существенное значение в централизации кровотока (наилучшее снабжение кровью сердца, мозга и легких) имеет преобладание альфа-адренорецепторов в сосудах, иннервируемых внутренностным, или чревным, нервом, а также в сосудах почек, мышц и кожи. Такая реакция организма вполне оправдана, но, если гиповолемия корригируется, то вследствие недостаточной тканевой перфузии развивается шок.
Для гиповолемического шока, таким образом, характерны снижение ОЦК, снижение ДНС и сердечного выброса, снижение АД и возрастание ОПС.

Кардиогенный шок. Наиболее частой причиной кардиогенного шока является острый инфаркт миокарда, реже миокардит и токсическое поражение миокарда. При нарушении насосной функции сердца, аритмии и других острых причинах падения эффективности сердечных сокращений происходит снижение УОС. Вследствие этого возникает снижение АД, в то же время возрастает ДНС из-за неэффективности работы сердца. В результате стимулируется симпатоадреналовая система, возрастает ЧСС и ОПС. Изменения в принципе сходны с таковыми при гиповолемическом шоке. Это гиподинамические формы шока. Патогенетическое различие заключается лишь в значении ДНС: при гиповолемическом шоке оно снижено, а при кардиогенном повышено.
Септический шок. При септическом шоке первичные расстройства касаются периферии кровообращения. Под влиянием бактериальных токсинов открываются короткие артериовенозные шунты, через которые кровь устремляется, обходя капиллярную сеть, из артериального русла в венозное. При уменьшении поступления крови в капиллярное русло ток на периферии высок и ОПС снижено. Соответственно снижается АД, компенсаторно увеличивается УОС и ЧСС. Это так называемая гипердинамическая реакция циркуляции при септическом шоке. Снижение АД и ОПС происходит при нормальном или увеличенном УОС. При дальнейшем развитии гипердинамическая форма переходит в гиподинамическую.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Несмотря на достижения современной ветеринарии, сепсис остается самым серьезным осложнением гнойных заболеваний и хирургических вмешательств у животных. Высокая летальность (до 90%), тяжесть клинического течения и недостаточная изученность делают его лечение наиболее сложной задачей любого клинического специалиста.
-повышение (более 40, 0 С) или понижение (менее 38, 0 С) температуры тела;
-тахикардия (130-200 уд/мин);
-одышка (учащенное дыхание), более 40 – 50 дыхательных движений в минуту);
-изменение картины крови -- увеличение количества лейкоцитов (более 15 тысяч) или их уменьшение (меньше 4 тысяч);
При наличии трех-четырех этих симптомов в сочетании с признаками инфекционного поражения органов и систем ставят диагноз - сепсис. Подтверждается этот диагноз с помощью множества анализов, в том числе и бактериальным посевом крови. Выявить возбудителя в крови удается далеко не всегда (не более, чем в 60% случаях), и тогда диагноз ставят по совокупности клинических признаков.
Течение, степень тяжести и исход болезни бывают различными, поэтому, для более дифференцированного подхода к лечению была принята международная классификация форм сепсиса. Наиболее тяжелая форма – септический шок – характеризуется наиболее серьезными расстройствами сердечно-сосудистой системы, снижением артериального давления, отсутствием положительной динамики на проведение интенсивной терапии, летальность достигает 80 %. Следующим по тяжести протекания выделен тяжелый сепсис или сепсис-синдром - с признаками поражения отдельных органов и систем, гипоксией и системным ацидозом.
Просто сепсис – генерализованная инфекция, с наличием положительной динамики при интенсивном лечении, это наиболее легкая форма заболевания с летальностью 10 – 20%.

По остроте клинического течения сепсис подразделяют на:
молниеносный, развивается, как правило, в течение 12-48 часов, протекает по типу септического шока и имеет летальность, близкую к 100 %. Развивается у животных крайне редко, на фоне других тяжелых заболеваний.
острый сепсис характеризуется более медленным развитием и постоянным наличием всех симптомов;
подострый сепсис бывает при волнообразном течении инфекционного процесса, когда фаза улучшении сменяется рецидивом симптомов;
хронический сепсис – если признаки заболевания сохраняются более 6 месяцев, редко встречается у животных.
Основная причина летальности при сепсисе – развитие шока. Если диагноз септического шока устанавливается в начальной фазе сепсиса, то, достаточно часто, своевременное лечение может привести к выздоровлению. Если же диагноз септического шока устанавливают на фоне уже продолжающегося сепсиса, что говорит о срыве последних компенсаторных возможностей организма, то эффекта от проводимого лечения, как правило, не наблюдается.
Лечение сепсиса – не менее сложно, чем диагностика, и должно проводится только в условиях клиники, с постоянной возможностью лабораторной диагностики, хорошим материальным оснащением, с современным оборудованием.
Терапия сепсиса требует комплексного подхода, нередко одного пациента лечат хирурги, анестезиологи-реаниматологи, терапевты. При наличии гнойного очага, инициирующего генерализованную инфекцию, необходимо хирургическое вмешательство для срочного удаления очага инфекции. Наиболее часто у животных развивается сепсис на фоне перитонита, вызванного разрывом гнойных полостей (матки, кишечника и т.д.) или проникающими ранениями брюшной полости. Без тщательного устранения источника инфекции и многократной местной санации всякое лечение сепсиса будет заведомо неэффективно. Антибиотикотерапия имеет первостепенное значение при терапии сепсиса. При выделении возбудителя болезни из крови антибиотики титруются по степени эффективности, при лечении используют комбинации из двух и более препаратов. Проводится интенсивная терапия, направленная на поддержание давления, улучшение гемодинамики, коррекцию метаболических нарушений и детоксикацию организма, иногда требуется переливание крови или плазмы, введение питательных растворов, иммунотерапия. Состояние больных животных может быстро меняться, все изменения должны постоянно контролироваться мониторами сердечно-сосудистой деятельности, лабораторной диагностикой анализов крови и врачом. Только комплексный подход к диагностике и лечению, адекватный мониторинг и своевременная коррекция всех метаболических нарушений может привести к успешному излечению сепсиса.

Анафилактический шок вид аллергической реакции немедленного типа, возникающей при повторном введении в организм аллергена. Анафилактический шок характеризуется быстро развивающимися преимущественно общими проявлениями: снижением АД (артериального давления), температуры тела, свертываемости крови, расстройством ЦНС, повышением проницаемости сосудов и спазмом гладкомышечных органов.
Термин "анафилаксия" (греч. ana-обратный и phylaxis-защита) был введен P.Portier и C.Richet в 1902 г. для обозначения необычной, иногда смертельной реакции у собак на повторное введение им экстракта из щупалец актиний. Аналогичную анафилактическую реакцию на повторное введение лошадиной сыворотки у морских свинок описал в 1905 г. русский патолог Г.П. Сахаров. Вначале анафилаксия считалась экспериментальным феноменом. Затем аналогичные реакции были обнаружены у людей. Их стали обозначать как анафилактический шок.
Этиология и патогенез
В основе патогенеза анафилактического шока лежит реагиновый механизм. В результате освобождения медиаторов падает сосудистый тонус и развивается коллапс. Повышается проницаемость сосудов микроциркуляторного русла, что способствует выходу жидкой части крови в ткани и сгущению крови. Объем циркулирующей крови снижается. Сердце вовлекается в процесс вторично. Результатом этих нарушений является снижение венозного возврата, падение ударного объема и развитие глубокой гипотензии. Вторым ведущим механизмом в патогенезе анафилактического шока является нарушение газообмена на фоне развития бронхоспазма или обструкции верхних дыхательных путей (стеноз гортани). Обычно животное выходит из состояния шока самостоятельно или с врачебной помощью. При недостаточности гомеостатических механизмов процесс прогрессирует, присоединяются нарушения обмена веществ в тканях, связанные с гипоксией, развивается фаза необратимых изменений шока
Клиническая картина анафилактического шока
Наиболее типичной является генерализованная форма лекарственного анафилактического шока.
Гемодинамический вариант характеризуется превалированием в клинической картине гемодинамических нарушений с развитием выраженной гипотонии, вегетососудистых изменений и функциональной (относительной) гиповолемии.
При асфиксическом варианте доминирующими являются развитие бронхо- и ларингоспазма, отека гортани с появлением признаков тяжелой острой дыхательной недостаточности. Возможно развитие респираторного дистресс-синдрома с выраженной гипоксией.
Церебральный вариант. Отличительной чертой данного клинического варианта является развитие судорожного синдрома на фоне психомоторного возбуждения, страха, нарушения сознания. Довольно часто эта форма сопровождается дыхательной аритмией, вегетососудистыми расстройствами, менингеальным и мезенцефальным синдромами.
Тромбоэмболический вариант напоминает картину тромбоэмболии легочной артерии.
Тяжесть клинической картины лекарственного анафилактического шока определяется степенью, скоростью развития гемодинамических нарушений, а также продолжительностью этих нарушений.
Лекарственный анафилактический шок имеет три степени тяжести.
Легкая степень — клиническая картина характеризуется не резко выраженными симптомами шока: появляются бледность кожных покровов, головокружение, кожный зуд, крапивница, осиплость голоса. Нередко отмечаются признаки бронхоспазма, схваткообразные боли в животе. Сознание сохранено, но животное может быть заторможено (обнубиляция). Отмечается умеренное снижение АД, пульс частый, нитевидный. Продолжительность лекарственного анафилактического шока легкой степени от нескольких минут до нескольких часов.
Средняя степень тяжести характеризуется развернутой клинической картиной: у животного развивается общая слабость, беспокойство, страх, нарушение зрения и слуха, кожный зуд.
Могут быть тошнота, рвота, кашель и удушье (часто стридорозное дыхание). Сознание животного угнетено. При осмотре кожных покровов выявляется крапивница, ангионевротический отек Квинке.
Характерна резкая смена гиперемии слизистых бледностью. Кожные покровы холодные, цианоз губ, зрачки расширены. Нередко отмечается появление судорог. Со стороны сердечно-сосудистой системы выявляется тахикардия, пульс нитевидный (или не определяется), АД не определяется. Могут отмечаться непроизвольные мочеиспускание и дефекация, пена в углу рта.
Практически все лекарственные вещества могут вызывать анафилактический шок. Одни из них, имея белковую природу, являются полными аллергенами, другие, будучи простыми химическими веществами, — гаптенами. Последние, соединяясь с белками, полисахаридами, липидами и другими макромолекулами организма, модифицируют их, создавая высокоиммуногенные комплексы. На аллергические свойства препарата влияют различные примеси, особенно белковой природы.
Наиболее часто лекарственный анафилактический шок возникает при введении антибиотиков, особенно пенициллинового ряда. Часто лекарственная анафилаксия развивается при применении пиразолоновых анальгетиков, местных анестетиков, витаминов, преимущественно группы В, рентгеноконтрастных веществ. У высокосенсибилизированных животных ни доза, ни способ введения лекарства не играют решающей роли в возникновении шока. Однако наиболее быстрое (молниеносное) развитие ЛАШ происходит при парентеральном введении лекарственных препаратов.
Некоторые лекарственные вещества могут способствовать высвобождению гистамина и других БАВ из клеток не иммунным путем, а прямым фармакологическим действием на них. Эти препараты называются либераторами гистамина. К ним относятся рентгеноконтрастные вещества, некоторые плазмозамещающие растворы, полимиксиновые антибиотики, протеолитические ферменты, антиферментные препараты (контрикал), общие анестетики, морфин, кодеин, промедол, атропин, фенобарбитал, тиамин, D-тубокурарин и др. В случае развития немедленной реакции вследствие либерации гистамина или активации системы комплемента под влиянием лекарственного вещества состояние расценивается как анафилактоидный шок. При этом отсутствует иммунологическая стадия, и реакция может развиться на первое введение препарата.
Таким образом, лекарственный анафилактический шок независимо от патогенеза имеет однотипные клиническую симптоматику и тактику лечения. В настоящее время клиницисты еще не располагают эффективными и простыми экспресс-методами диагностики патологии, характеризующей механизмы лекарственного шока. В связи с этим в клинической практике можно лишь предположить вероятность их развития, анализируя анамнестические сведения и препарат-аллерген.
Лечение анафилактического шока
Терапия анафилактического шока включает комплекс неотложных мероприятий, направленных на ликвидацию главных нарушений, вызванных аллергической реакцией:
• ликвидацию острых нарушений сосудистого тонуса;
• блокирование высвобождения, нейтрализацию и ингибицию медиаторов аллергической реакции;
• компенсацию возникшей адренокортикальной недостаточности;
• поддержание функций различных жизненно важных органов и систем
При лечении анафилактического шока врачи ветеринарного центра Зоовет советуют применять следующие группы препаратов:
• Катехоламины (Адреналин)
• Глюкокортикоиды (Преднизолон, Дексаметазон, Метилпреднизолон)
• Бронхолитики (Эуфиллин)
• Антигистаминные препараты (Димедрол, Тавегил, Супрастин)
• Адекватная инфузионная терапия
Что же делать, если у вашего животного появились признаки анафилактического шока:
1. НЕМЕДЛЕННО ОБРАТИТЬСЯ К ВРАЧУ
2. Положить холод на место укуса или введения препарата и перетянуть жгутом выше (если был укус насекомого, или введение препарата)
3. Уколоть внутримышечно Преднизолон - 0, 3 - 0, 6 млкг
4. Уколоть внутримышечно Димедрол 0, 1 - 0, 3 млкг
Больше, к сожалению, ничего вы сделать не сможете (если у вас нет специальных знаний и навыков), всю остальную терапию и наблюдение должен проводить врач.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
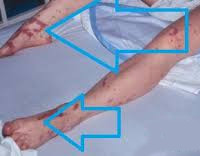
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Септический шок - эпидемиология, смертность
Тяжелый сепсис и септический шок являются актуальной проблемой современной медицины вследствие увеличения количества больных, высокой летальности и возрастания социально-экономических проблем, связанных с лечением и реабилитацией таких пациентов.
Септический шок является жизнеугрожающим состоянием, наиболее тяжелой стадией или формой развития генерализованной инфекции (сепсиса), характеризующейся наличием неконтролируемого инфекционного процесса, реактивного генерализованного воспаления, полиорганной дисфункции/недостаточности и артериальной гипотензии.
Многообразие сходных названий исторически связано с субъективными факторами: разработкой проблемы сепсиса и септического шока в различных областях медицинской науки, отсутствием до недавнего времени единой классификации сепсиса и объективными факторами — наличием существенных патогенетических различий механизмов развития сепсиса при ряде нозологических форм, недостаточной научной разработкой проблемы септического шока в целом.
На этой же конференции были даны определения других стадий инфекции: бактериемии, сепсиса, тяжелого сепсиса, септического шока и синдрома полиорганной дисфункции (СПД). Разработка этих определений открыла новые перспективы как для развития фундаментальных и прикладных научных исследований в области тяжелых инфекций, так и для клинической практики, заложив основу систематической разработки рекомендаций по диагностике и лечению.
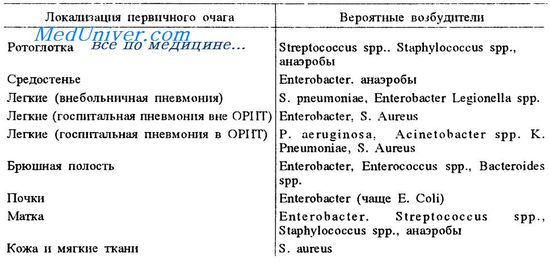
Возбудители сепсиса
Эпидемиология септического шока
Септический шок как синдром, стадия или форма заболевания пока не включен в Международную классификацию болезней, поэтому ориентировочные эпидемиологические данные были получены при проведении нескольких многоцентровых проспективных рандомизированных контролируемых исследований с целью оценки эффективности лекарственных препаратов у больных сепсисом. Обнаружено, что пациенты с септическим шоком составляют 58 % от всех больных с тяжелым сепсисом. Математическое моделирование позволило примерно определить количество пациентов с септическим шоком в США — 435 580 человек в год.
Другим источником информации могут быть данные, полученные в ходе международного многоцентрового эпидемиологического исследования 14 364 пациентов в 28 отделениях реанимации и интенсивной терапии (ОРИТ): пациенты с септическим шоком составили 6,3 % от всех больных ОРИТ, причем в 63,2 % случаев септического шока был осложнением нозокомиальных инфекций (НИ). Согласно отечественным данным, доля больных с септическим шоком составила только 26,1 % среди всех пациентов с тяжелым сепсисом.
При включении критериев сепсиса, тяжелого сепсиса и септического шока в программу регистрации пациентов ОРИТ хирургического профиля было обнаружено, что среди 25,9 % пациентов с сепсисом доля больных септическим шоком составила 4,1 %.
Близкие данные по количеству больных септическим шоком приведены в исследованиях многих авторов — 2—4 %, однако имеются данные и о более высоких показателях —7—18 %, что может свидетельствовать о значительной разнородности исследованных групп пациентов.
Летальность в группе больных с септическим шоком. Причиной летальных исходов больных сепсисом и септическим шоком является органная недостаточность, причем комбинация недостаточности нескольких органов увеличивает вероятность летального исхода. В нескольких исследованиях произведена оценка летальности в группе пациентов с септическим шоком по сравнению с больными сепсисом и тяжелым сепсисом. Летальность в группе больных с септическим шоком составила от 46 до 82 %, что в 1,5—2,5 раза превосходило летальность больных тяжелым сепсисом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

