Шкала софа сепсис интерпретация
Обновлено: 18.04.2024
Ранее основным диагностическим критерием сепсиса у пациентов любого возраста был синдром системной воспалительной реакции (systemic inflammatory response syndrome, SIRS) [5]. Основными клиническими критериями SIRS считались циркуляторные (тахикардия) и респираторные нарушения (тахипноэ), расстройства терморегуляции (гипо- или гипертермия) и воспалительные изменения в гемограмме. Для подтверждения SIRS у пациента необходимо констатировать не менее двух из перечисленных выше симптомов. При установлении диагноза сепсиса, в том числе у новорожденных, требовалось наличие признаков SIRS в сочетании с очагом инфекции и/или бактериемией, клиническими симптомами инфекции, полиорганной недостаточностью. При отсутствии SIRS диагноз сепсиса считался необоснованным.
Попытки оценить органную дисфункцию у новорожденных при сепсисе проводились постоянно. В частности, для этой цели было предложено использовать шкалу неонатальной полиорганной дисфункции (Neonatal Multiple Organ Dysfunction Score, NEOMOD) [12]. Впоследствии эта шкала была модифицирована, и проспективное исследование показало, что количество задействованных систем было выше у умерших младенцев [13], поэтому NEOMOD применяется в большей степени как прогностическая. В контексте новой концепции сепсиса для оценки органной дисфункции у пациентов детского возраста, в том числе у новорожденных, была предложена возраст-адаптированная шкала pSOFA (педиатрическая SOFA) [14, 15]. У детей с предполагаемой инфекцией в качестве критерия педиатрического сепсиса и риска летального исхода можно также использовать шкалу PЕLОD-2 17. Для прогнозирования летального исхода у недоношенных с сепсисом была разработана и протестирована шкала nSOFA 19. Однако валидность этой шкалы еще недостаточно изучена.
В качестве дополнительных диагностических критериев сепсиса у новорожденных используются острофазовые белки. Следует отметить особенности чувствительности и прогностической ценности этих маркеров воспаления при неонатальном сепсисе. Наиболее изученным острофазовым маркером у новорожденных является С-реактивный белок (СРБ). В качестве нормального верхнего уровня предлагается предельно допустимая концентрация СРБ у новорожденных – 6 мг/л [22]. Известно, что увеличение уровня СРБ обычно происходит через 4-6 часов от начала воспаления и для дальнейшего значимого повышения СРБ необходимо еще 12-24 часа [23], а пик концентрации возникает через 36-48 часов, при этом полураспад следует ожидать через 19 часов, с ежедневным снижением на 50%. В связи с этими особенностями продукции СРБ показано его серийное определение.
В неонатальном периоде провоцировать увеличение СРБ могут и неинфекционные заболевания, которые опосредованно связаны с воспалительной реакцией – родовой стресс, аспирация мекония, внутрижелудочковое кровоизлияние [24]. Поэтому прогностическая ценность СРБ для диагностики сепсиса относительно низкая. В последнее десятилетие для диагностики неонатального сепсиса в качестве альтернативы СРБ используется прокальцитонин (ПКТ), который также является острофазовым белком. ПКТ не проникает через плаценту, и поэтому на него не влияет лихорадка в родах у матери [25]. Уровень ПКТ начинает повышаться через 2 часа после начала септического процесса и достигает пика через 12 часов [26]. Диагностически значимым является повышение уровня ПКТ более 2 нг/мл [22]. Повышение уровня ПКТ также могут вызывать хориоамнионит, преэклампсия и другие факторы [27]. Следует отметить, что в настоящее время недостаточно качественных исследований, посвященных ПКТ, для диагностики, например, раннего сепсиса у новорожденных [28].
Целью данного исследования было оценить диагностические возможности использования оценочной шкалы pSOFA при сепсисе новорожденных.
Материалы и методы исследования
Результаты и их обсуждение
Критериям включения в исследование соответствовали 18 новорожденных. Характеристика исследуемых пациентов представлена в таблице 1.
Для выяснения этиологии сепсиса проводилось бактерио-логическое обследование пациентов. Этиологически значимыми принято считать микроорганизмы, выделенные из стерильных в норме биологических субстратов (кровь, ликвор, экссудат, биоптат), а также из гнойно-воспалительных очагов (гноя, отделяемого из различных ран и дренажей) [30]. При отсутствии положительной гемокультуры принимались во внимание положительные результаты посевов из 3 и более локусов. В случаях летального исхода проводилось бактериологическое исследование секционного материала (легких, кишечника, печени, селезенки). У 39% обследованных пациентов не удалось уточнить этиологию сепсиса (7 случаев). У 61% пациентов этиология сепсиса была идентифицирована: Staphylococcus epidermidis – 5 пациентов; Staphylococcus saprophyticus – 2; Staphylococcus aureus – 1; Enterococcus faecalis – 1; Klebsiella pneumoniae – 1; Сitrobacter freundii – 1. При этом положительные посевы крови получены только у 4 пациентов (22%). Из них в 2 случаях обнаруживался Staphylococcus epidermidis, в 1 – Staphylococcus saprophyticus, в 1 – Klebsiella pneumoniae. Таким образом, в этиологии сепсиса превалировали грамположительные микроорганизмы (8 пациентов) над грамотрицательными (2 пациента).
При использовании для диагностики сепсиса острофазовых белков получены следующие результаты. Увеличение уровня СРБ и ПКТ отмечено в 5 случаях, при этом только у 2 пациентов наблюдалось одновременное увеличение уровня СРБ и ПКТ.
Для оценки органной дисфункции у детей с заподозренной или документированной инфекцией применялась шкала pSOFA. Подозреваемая инфекция – это клиническая ситуа-ция, когда у пациента имеются признаки инфекционного заболевания, требующие назначения антибиотиков и взятия биологических сред для бактериологического исследования, без микробиологических доказательств инфекции на данный момент времени. Документированная инфекция – это наличие у пациента бактериологически подтвержденной инфекции (положительная гемокультура и/или обнаружение возбудителей не менее чем в 3 локусах). Следует отметить, что у авторов этой шкалы используются единицы измерений различных показателей в мг/дл в возрасте от 0 до 18 лет [14]. Нами представлена шкала pSOFA, в которой произведен пересчет для каждого лабораторного показателя в мкмоль/л (система СИ/SI) и возрастной критерий был ограничен до 1 месяца в связи с возрастом исследуемых пациентов (табл. 2).
Результаты сравнительного анализа оценки по шкале pSOFA у новорожденных при поступлении в ОРИТ (подозреваемая или документированная инфекция) и при ухудшении состояния с острым нарастанием органной дисфункции представлены в табл. 3.
При сравнении суммарного базового значения балла по шкале pSOFA у пациентов при поступлении в ОРИТ исходное значение медианы (Ме) составляло 3,00 (интеквартильный размах – ИКР – 3,00-4,00), а при нарастании органной дисфункции – 10,0 (ИКР – 8,25-13,50). Выявленное увеличение суммарного балла диагностической оценки по шкале pSOFA при нарастании органной дисфункции у пациентов с сепсисом, оцененное с помощью критерия Уилкоксона, было статистически значимым (p < 0,05). Эти данные свидетельствуют о том, что нарастание органной дисфункции у новорожденных с подозреваемой или документированной инфекцией на 2 балла и выше базового (исходного) значения по шкале pSOFA позволяет диагностировать сепсис (р < 0,05).
Результаты сравнительного анализа оценки по шкале pSOFA при нарастании органной дисфункции у выживших и умерших пациентов представлены в табл. 4.
Среднее значение суммарного балла по мере нарастания органной дисфункции по шкале pSOFA у выживших пациентов с сепсисом составило 9,6 ± 2,59. У умерших пациентов среднее значение суммарного балла составило 12,25 ± 4,56. Различия показателей были статистически не значимы (p > 0,05).
Выводы
- Выявленное статистически значимое увеличение суммарного балла оценки по шкале pSOFA при нарастании органной дисфункции у обследованных пациентов свидетельствует о целесообразности ее использования для диагностики сепсиса у новорожденных.
- При сравнении суммарного балла оценки по шкале pSOFA при нарастании органной дисфункции у выживших и умерших новорожденных с сепсисом статистически достоверного результата не получено. Поэтому для корректной оценки исхода сепсиса у новорожденных шкала pSOFA недостаточно информативна, что требует дополнительных исследований.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
1 ФГБОУ ВО Астраханский ГМУ Минздрава России; 414000, Россия, Астрахань, ул. Бакинская, 121
2 ФГБОУ ВО Саратовский ГМУ им. В. И. Разумовского Минздрава России; 410000, Россия, Саратов, ул. Большая Садовая, 137
Сведения об авторах:
Information about the authors:

Определение
Определение сепсиса показывает эволюцию взглядов на этиологию и патогенез данного состояния. Само определение неоднократно менялось, ранее считалось, что главенствующую роль в патогенезе играет системный воспалительный ответ, однако на данный момент центральную роль отводят нарушению действий воспалительной и противовоспалительной систем. Решение о необходимости изменения дефиниции было принято в 2017 году European Society of Intensive Care Medicine и Society of Critical Care Medicine.
Сепсис ― угрожающая жизни органная дисфункция, вызванная дезрегулирующим ответом организма хозяина на инфекцию.
Септический шок ― подвид сепсиса, в основе которого лежит нарушение циркуляции, а патологические изменения в клетках и метаболизме достаточно глубоки, чтобы в значительной степени увеличить летальность.
Диагностика
Исходя из определения и патогенеза, для скрининга сепсиса было предложено использовать шкалу qSOFA (quick Sepsis-related Organ Failure Assessment).
- Системное артериальное давление ≤ 100 мм рт. ст.;
- Частота дыхания ≥ 22 в минуту;
- Любое нарушение сознания ( < 14 баллов по Шкале комы Глазго).

При наличии ≥ 2 баллов, а также признаков наличия инфекции необходимо обратить внимание на данного пациента и оценить вероятность сепсиса по развернутой шкале SOFA. Данная шкала в отношении определения органной дисфункции имеет специфичность 96 % и чувствительность 30 %, а в отношении определения смертности ― специфичность 91 % и чувствительность 50 %. По сравнению с критериями синдрома системного воспалительного ответа (ССВО/SIRS) данная шкала имеет большую специфичность, однако меньшую чувствительность.

После прохождения скрининга и при наличии ≥ 2 баллов по qSOFA или сохранении подозрения на сепсис проводится оценка по развернутой шкале SOFA.
В критерии SOFA входит определение функций:
- Дыхания: отношение PaO2/FiO2;
- Коагуляции: уровень тромбоцитов;
- Печени: уровень билирубина;
- Сердечно-сосудистой системы: уровень артериального давления и инотропной поддержки;
- ЦНС: определение уровня по Шкале комы Глазго;
- Почек: уровень креатинина и диурез.
При наличии ≥ 2 баллов по развернутой шкале SOFA правомочно выставление сепсиса.

Таблица 1 | Критерии SOFA
После выставления диагноза проводится начальная интенсивная терапия, важной частью которой является проведение массивной инфузии, далее определяется среднее артериальное давление (СрАД), а также уровень лактата. Среднее артериальное давление определяется по формуле: СрАД = САД – ДАД + ⅓ ДАД, где САД ― систолическое артериальное давление, а ДАД ― диастолическое артериальное давление. При необходимости применения вазопрессоров для поддержания адекватного среднего артериального давления ( ≥ 65 мм рт. ст.), а также при высоком уровне лактата ( > 2 ммоль/л) выставляется диагноз септический шок.
Начальная терапия
Интенсивная терапия сепсиса должна начинаться сразу же после постановки диагноза. Рекомендации по ведению сепсиса 2012 года предлагали использовать цели, которые необходимо было достигнуть за определенное время. К сожалению, после проведения крупных испытаний данная стратегия не показала преимуществ по сравнению со стандартной терапией, а также оказалась более затратной.
После выявления сепсиса для коррекции сепсис-индуцированной гипоперфузии в начальном периоде используются кристаллоиды в объеме 30 мл/кг внутривенно в первые 3 часа. Последующая инфузия должна проводиться на основании имеющихся в наличии данных о физиологии пациента (частота сердечных сокращений, артериальное давление, артериальная сатурация кислорода, частота дыхания, температура и другие данные), полученных с помощью неинвазивных и инвазивных методов. Предпочтение желательно отдавать динамическим методам измерения.
У пациентов с септическим шоком, требующим применения вазопрессоров, необходимо поддерживать среднее артериальное давление на уровне не менее 65 мм рт. ст. Пациентам с повышенными уровнями лактата (маркер тканевой гипоперфузии) необходимо проводить интенсивную инфузионную терапию с целью его снижения до нормальных уровней.
Всем организациям здравоохранения рекомендуется разрабатывать собственные или усовершенствовать имеющиеся программы по ведению сепсиса и септического шока, методам скрининга у тяжелобольных пациентов, а также оценке риска развития сепсиса. Допустимо применение других шкал для скрининга состояния тяжелобольных пациентов: привычная шкала ССВО, LODS (Logistic Organ Disfunction System), NODS (National Organ Disfunction System).
Интенсивная терапия сепсиса
Антибактериальная терапия
До начала антибактериальной терапии необходимо взять посевы (кровь, спинномозговую жидкость, мочу, секрет из дыхательных путей, раневое отделяемое или другие жидкости организма) для определения чувствительности микроорганизмов к антибиотикам с использованием как минимум двух наборов культур: анаэробной и аэробной. Однако взятие посевов не должно существенно затягивать начало антибактериальной терапии сепсиса. Антибиотикотерапия должна начинаться в максимально ранние сроки, до 1 часа после постановки диагноза сепсиса или септического шока. Любое промедление в назначении антибактериальных средств значительно повышает смертность пациентов. Эмпирическую антимикробную терапию рекомендуется начинать с одного или нескольких антибиотиков (АБ) из двух разных классов, с широким спектром активности, действующих на предполагаемую флору (бактериальную и/или грибковую).
При выборе АБ необходимо учитывать: анатомический источник и типичную его флору, преобладающую флору в госпитале или вне его, резистентность преобладающего патогена, иммунные нарушения у пациента (нейтропения, спленэктомия, плохо контролируемая ВИЧ-инфекция, приобретенные или врожденные дефекты иммуноглобулина, системы комплемента или функции лейкоцитов), а также возраст пациента и наличие сопутствующей патологии, хронических заболеваний. Дозу и время введения необходимо оптимизировать на основании фармакодинамики/фармакокинетики и специфических свойств препаратов. Необходимо помнить о том, что у пациентов зачастую есть нарушение функции почек и/или печени, а также о возможной резистентности микроорганизмов. При применении бета-лактамных АБ важно достигнуть концентраций выше минимальной ингибирующей в течение как можно более длительного времени, в то время как для аминогликозидов и фторхинолонов главную роль играет достижение пиковой концентрации.
Деэскалацию (замена АБ широкого спектра действия на АБ более узкого спектра действия) антибактериальной терапии проводят в течение нескольких последующих дней после того, как определены микроорганизмы, вызвавшие сепсис и септический шок, и их спектр чувствительности к антибиотикам, либо наступает значительное клиническое улучшение/ухудшение. По возможности каждый день оцениваются клинические данные, и на их основании проводится решение об деэскалации. Рекомендуемая длительность антибактериальной терапии составляет 7–10 дней, что зачастую достаточно для большинства серьезных инфекций, ассоциированных с развитием сепсиса и септического шока.
При проведении антибиотикотерапии необходимо руководствоваться уровнем прокальцитонина (ПКТ), это позволяет сократить продолжительность курса, а также отменить АБ у пациентов, у которых имелись подозрение на сепсис и слабые доказательства наличия инфекции. При снижении уровня прокальцитонина более, чем на 80 % от пикового значения или снижении ПКТ менее 0,5 мкг/л необходимо прекратить введение АБ.
Контроль очага
Необходимо как можно быстрее (не позже 6‒12 часов после постановки диагноза) выявить или исключить наличие очага инфекции в организме и провести вмешательство по его удалению. Следует обратить особое внимание на внутрисосудистые девайсы (центральные венозные катетеры), так как они могут быть источниками инфекции.
Инфузионная терапия
Препаратами выбора для инфузионной терапии при развитии сепсиса и септического шока являются кристаллоиды. Предпочтительней применять сбалансированные растворы, так как они не вызывают развитие гиперхлоремического метаболического ацидоза (раствор Хартмана или Рингер-лактат), при их отсутствии допустимо применение несбалансированных растворов (Рингер или физиологический раствор NaCl 0,9 %). Недостаточно данных об использовании препаратов желатина для восстановления объема внутрисосудистого русла при сепсисе.
При необходимости инфузии значительных объемов кристаллоидов допускается добавление инфузии коллоидов (альбумина 20 %) с целью достижения плазменного уровня альбумина > 30 г/л. На основании данных проведенных исследований не рекомендуется использование при сепсисе и септическом шоке растворов гидроксиэтилкрахмала.
Вазоактивные препараты
Добутамин может назначаться пациентам, имеющим признаки тканевой гипоперфузии, на фоне адекватной инфузии и использовании других вазопрессоров. Дозу данного препарата необходимо тщательно титровать для достижения желаемого эффекта (восстановление тканевой перфузии), а при развитии аритмий или усугублении гипотензии незамедлительно прекратить его введение. Всем пациентам с септическим шоком желательно установить артериальный катетер для контроля показателей гемодинамики.
Кортикостероиды
Нет необходимости использовать глюкокортикоиды, когда на фоне инфузионной терапии и применения вазопрессоров достигнута гемодинамическая стабильность. Если же невозможно поддерживать гемодинамику на должном уровне на фоне приведенной выше терапии (инфузия + прессоры), допускается применение гидрокортизона внутривенно в дозе 200 мг/сутки.
Препараты крови
Трансфузия эритроцитов проводится при снижении уровня гемоглобина менее 70 г/л у взрослых без признаков тяжелой гипоксемии, ишемии миокарда или острого кровотечения. Эритропоэтин у пациентов с сепсисом не применяется. Свежезамороженная плазма может использоваться при нарушениях свертываемости крови перед планированием инвазивных процедур или при наличии активного кровотечения.
Трансфузия тромбоцитов проводится в зависимости от клинической необходимости при уровне:
Иммуноглобулины
Эксперты не рекомендуют использовать иммуноглобулины у пациентов с сепсисом и септическим шоком.
Очистка крови
Эффект применения различных технологий очистки крови не доказан. Необходимо провести дополнительные исследования.
Искусственная вентиляция легких (ИВЛ)
На фоне сепсиса у пациентов часто развивается сепсис-индуцированный острый респираторный дистресс синдром (ОРДС). При развитии ОРДС проводится ИВЛ со следующими параметрами:
- Целевой дыхательный объем 6 мл/кг на прогнозируемую массу тела (ПМТ). ПМТ у мужчин = 50 + 0,91 * (рост в см – 152,4), ПМТ у женщин = 45,5 + 0,91 * (рост в см –152,4);
- Верхний предел давления плато (Рplat) = 30 см вод. ст.;
- Высокий PEEP — около 10‒12 см вод. ст., для подбора оптимального PEEP можно использовать таблицы, основанные на значениях FiO2;
- Использование рекрутмент маневра и прон-позиции при отношении PaO2/FiO2 < 150 мм рт. ст.;
- Использование мышечных релаксантов в течение ≤ 48 часов у пациентов с сепсис-индуцированным ОРДС и в отношении PaO2/FiO2 < 150 мм рт. ст.;
- В особо тяжелых случаях рефрактерной гипоксемии могут использоваться альтернативные техники: экстракорпоральная мембранная оксигенация и режимы ИВЛ с инверсией отношения вдох/выдох и PEEP (airway pressure release ventilation, APRV);
- Не рекомендовано использование высокочастотной осцилляторной ИВЛ у взрослых, применение бета-2-агонистов (при отсутствии бронхоспазма), рутинная установка катетера в легочной артерии.
При проведении ИВЛ пациентам без ОРДС необходимо использовать низкие дыхательные объемы (4 ‒ 6 мл/кг), поднять изголовье кровати на 30–45° для снижения риска аспирации и развития вентилятор-ассоциированной пневмонии, а также как можно раньше начинать отучение от ИВЛ.
Седация и анальгезия
Необходимо избегать продолжительной или интермиттирующей седации пациентов, которым проводится ИВЛ. Если же все-таки необходима седация, то предпочтительнее использовать короткодействующие препараты (пропофол или дексмедетомидин).
Контроль гликемии
Рекомендуется поддержание уровня глюкозы ≤ 10 ммоль/л. При наличии двух последовательных проб крови с превышением данного уровня глюкозы необходимо незамедлительно начать введение инсулина. Мониторинг гликемии проводится каждые 1–2 часа до момента, когда уровни глюкозы и инфузия инсулина не стабилизируются; после стабилизации контроль проводится каждые 4 часа. Для измерения уровней глюкозы предпочтительнее использовать артериальную кровь. Допустимо использование портативных глюкометров, однако нужно критически относиться к результатам данных исследований.
Почечно-заместительная терапия (ПЗТ)
При развитии у пациентов с сепсисом острого повреждения почек и наличии показаний к диализу может применятся длительная или перемежающаяся почечно-заместительная терапия. Во время ПЗТ возможен контроль и изменение баланса жидкости у гемодинамически нестабильных пациентов.
Применение бикарбоната натрия
Не рекомендуется раннее применение бикарбоната натрия при индуцированном гипоперфузией лактат-ацидозе с pH ≥ 7,15.
Профилактика венозной тромбоэмболии (ВТЭ)
Рекомендуется проводить профилактику ВТЭ у пациентов с сепсисом и септическим шоком, предпочтительнее низкомолекулярными гепаринами (НМГ) либо с помощью нефракционированного гепарина (НФГ). Возможно использование механических методов профилактики (компрессионные чулки или устройства для перемежающейся пневматической компрессии) как дополнение к основной терапии или как самостоятельный метод при наличии противопоказаний к применению НМГ и НФГ .
Не рекомендуется применение антитромбина III.
Профилактика язв
У пациентов с сепсисом и септическим шоком, имеющих факторы риска желудочно-кишечного кровотечения (проведение ИВЛ > 48 часов, заболевания печени, коагулопатии, проведение ПЗТ), необходимо проводить профилактику стрессовых язв с помощью блокаторов протонной помпы или антагонистов Н2-гистаминовых рецепторов.
Питание
Рекомендуется раннее начало энтерального питания у пациентов с сепсисом. В зависимости от переносимости могут использоваться трофические/гипокалорические смеси или полное раннее энтеральное питание. Начинать парентеральное питание следует не ранее 8 суток при невозможности обеспечить раннее энтеральное питание. При непереносимости энтерального питания или наличии высокого риска аспирации может проводиться измерение остаточного объема желудка, а также использоваться пост-пилорические зонды для кормления. Пациентам с гастропарезом, диабетом или получающим седативные и вазоактивные препараты может потребоваться применение прокинетиков (метоклопрамид, домперидон). При применении прокинетиков необходим ЭКГ мониторинг для ранней детекции синдрома удлиненного QT и снижения риска внезапной смерти.
Отсутствуют данные о положительном эффекте применения омега-3-жирных кислот, внутривенного введения селена, аргинина, глютамина и карнитина.
Изучение осведомленности врачей разных специальностей о новом определении сепсиса, предложенном на международной конференции Sepsis-3 в 2016 г., критериях и методах его диагностики, частоты применения данных критериев на практике и мнения врачей о предпочтительных методах лабораторной диагностики при подозрении на сепсис.
Материалы и методы
Проведен опрос 922 врачей, в том числе 444 анестезиологов-реаниматологов, 280 врачей терапевтического профиля, 106 врачей хирургического профиля и 92 акушеров-гинекологов. В опрос не включались специалисты с опытом работы менее двух лет. В опросе приняли участие 720 врачей, работающих в стационаре, и 202 врачей поликлинического звена.
Только 336 (36,5%) опрошенных сообщили, что им известны новые критерии сепсиса, и они используют их на практике. Новым определением сепсиса достаточно часто пользуются анестезиологи-реаниматологи (64,9% опрошенных), в то время как осве домленность врачей других специальностей оказалась низкой. 66,7% анестезиологов-реаниматологов оценивают состояние каждого пациента по шкале SOFA. О пресепсине, являющемся биомаркером сепсиса, знают 70,4% опрошенных, однако большинство из них никогда не использовали этот показатель в клинической практике в связи с недоступностью в лечебно-профилактическом учреждении.
Осведомленность о новом определении сепсиса низкая среди врачей терапевтического и хирургического профиля и акушеров-гинекологов и значительно выше среди анестезиологов-реаниматологов. Пресепсин остается мало доступным биомаркером для лечебно-профилактических учреждений.
На рубеже ХХ-ХХI веков медицинское сообщество столкнулось с проблемой ежегодного роста регистрации числа случаев сепсиса, тяжелых инфекций и, как следствие, повышением смертности по этой причине. Например, в США ежегодная смертность от сепсиса увеличилась на 31% (с 139086 в 1999 г. до 182242 в 2014 г.) и составила 6% от общей смертности за данный период [1]. Точных данных об эпидемиологии сепсиса в мире нет, однако, согласно расчетам, данное состояние ежегодно развивается более чем у 30 млн человек и уносит жизни 6 млн человек [2]. Отдельно обсуждается проблема материнского и неонатального сепсиса. Ежегодно сепсис развивается у 3 млн новорожденных и 1,2 млн детей [3]. Каждая десятая смерть в связи с беременностью и родами происходит по причине материнского сепсиса [4]. Ежегодно в связи с материнскими инфекциями, в частности материнским сепсисом, умирает 1,0 млн новорожденных [5].
Установлено, что наиболее частыми причинами сепсиса в странах восточной Европы и России были инфекции дыхательных путей (71,6%), абдоминальные инфекции (21,8%) и инфекции мочевыводящих путей (19,7%) [6], что согласуется с данными отечественного исследования, в котором причины сепсиса были распределены таким же образом (44,9%, 19,4% и 11,9%, соответственно) [7]. Сепсис может быть следствием инфекций, приобретенных как за пределами, так и внутри медицинских учреждений. Инфек ции, связанные с оказанием медицинской помощи, являются одной из наиболее распространенных причин сепсиса и ежегодно затрагивают миллионы пациентов по всему миру [8].
Сепсис остается сложной проблемой, что обусловлено, с одной стороны, отсутствием единых критериев ранней диагностики данного состояния, а, с другой стороны, низкой информированностью клиницистов о методах и правилах ранней диагностики и действующих клинических рекомендациях. Накопленный опыт показал, что критерии сепсиса 1991 г. не являются специфичными для данного диагноза и синдрома системного воспалительного ответа (ССВР), не учитывают отсутствие единых лабораторных норм и наличия у пациентов сопутствующих заболеваний, а также могут быть проявлением физиологической реакции организма на воспалительный ответ. В 2016 г. на международной конференции Американ ской коллегии торакальных врачей (American College of Chest Physicians) и Общества специалистов интенсивной терапии (Society of Critical Care Medicine) "Sepsis-3" было принято решение об изменении определения сепсиса и исключении из его концепции терминов "ССВР" и "тяжелый сепсис" [9]. По определению экспертов, сепсис – это угрожающая жизни полиорганная недостаточность, вызванная нарушением ответа хозяина на инфекцию. Для оценки полиорганной недостаточности было предложено использовать шкалу SOFA (Sepsis-related sequential organ failure assessment – SOFA), которая сегодня имеет наиболее важное значение для анализа динамики состояния пациентов и прогноза смертности [9]. Шкала основана на оценке 6 показателей (табл. 1). Если общий балл по шкале в результате инфекции остро увеличивается до 2 и более, то риск смерти превышает 10%.
| Оцениваемый показатель | Баллы | ||||
|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | |
| Примечание: дозы допамина, адреналина и норадреналина указаны в мкг/кг/мин | |||||
| Оксигенация | |||||
| РаО2/FiO2, мм рт. ст. | >400 | ≤400 | ≤300 | ≤200 c респ. | ≤100 c респ. |
| Коагуляция | поддержкой | поддержкой | |||
| Тромбоциты, ×10 9 /л | >150 | ≤150 | ≤100 | ≤50 | ≤20 |
| Сердечно-сосудистая система | |||||
| Гипотензия или степень инотропной поддержки | Нет гипотензии | Среднее АД | Допамин ≤5 или любая доза добутамина | Допамин >5, или адреналин ≤0,1, или норадреналин ≤0,1 | Допамин >15, или адреналин >0,1, или норадреналин >0,1 |
| Центральная нервная система | |||||
| Показатель шкалы комы Глазго, баллы | 15 | 13-14 | 10-12 | 6-9 | |
| Выделительная функция | |||||
| Креатинин, мкмоль/л или диурез | 110-170 | 171-299 | 300-440 или &ly;500 мл мочи/сут | >440 или | |
| Печень | |||||
| Билирубин, мкмоль/л | 20-32 | 33-101 | 102-204 | >204 | |
Кроме того, разработана упрощенная шкала qSOFA (Quick SOFA), которая позволяет оценить наличие органной недостаточности на основании наличия по крайней мере двух из трех перечисленных критериев [9]: (1) снижение уровня сознания до 13 и менее баллов по шкале комы Глазго; (2) снижение систолического артериального давления (САД) менее 100 мм рт. ст.; (3) частота дыхания 22 в минуту и более.
Участники конференции пришли также к выводу, что на сегодняшний день не существует "золотого стандарта" подтверждения сепсиса. Вышеописанные шкалы являются инструментом оценки вероятной смерти пациента в ближайшие сутки и выявления органной дисфункции, которая может быть не связана с инфекционным процессом. Одним из прогностически значимых биологического маркеров сепсиса является пресепсин, который по некоторым данным превосходит общепринятые маркеры воспаления, в том числе прокальцитонин [10].
- 1. Включить меры профилактики, диагностики и лечения сепсиса в национальные системы здравоохранения и укреплять их в сообществах и медицинских учреждениях в соответствии с рекомендациями ВОЗ.
- 2. Повышать осведомленность населения о риске развития сепсиса в результате инфекционных болезней в рамках санитарного просвещения.
- 3. Разработать программы специальной подготовки для всех специалистов здравоохранения в области профилактики инфекций и безопасности пациентов и в отношении важности распознавания сепсиса;
- 4. Содействовать проведению научных исследований, направленных на изучение инновационных методов диагностики и лечения сепсиса.
Целью исследования было изучение осведомленности врачей разных специальностей о новом определении сепсиса, критериях и методах диагностики септических состояний, частоты применения данных критериев на практике и изучение мнения врачей о предпочтительных методах лабораторной диагностики при подозрении на сепсис.
Материал и методы
Был проведен опрос анестезиологов-реаниматологов, врачей терапевтического и хирургического профиля и акушеров-гинекологов путем направления электронной ссылки в медицинские государственные и частные учреждения города Москвы и Московской области. К врачам терапевтического звена относили терапевтов, неврологов, урологов (консультирующих на амбулаторном этапе), кардиологов, пульмонологов, врачей общей практики, гастроэнтерологов и инфекционистов, к врачам хирургического профиля – хирургов, трансплантологов, урологов (работающих в стационаре и проводящих хирургические вмешательства), онкологов. В опрос не включали специалистов с опытом работы менее двух лет.
Результаты
Всего были опрошены 922 врача, в том числе 444 анестезиолога-реаниматолога, 280 врачей терапевтического профиля, 106 врачей хирургического профиля, 92 акушера-гинеколога. В опросе приняли участие 720 врачей, работающих в стационаре, и 202 врача поликлинического звена.
Только 336 (36,5%) опрошенных сообщили, что им известны новые критерии сепсиса, и они используют их в работе, в то время как 332 (36,1%) врачам не известны новые критерии, 96 (10,4%) специалистов их не используют, так как они им не понятны, а 156 (17%) врачей слышали о новых критериях, но точно не знают область их применения. Распределение врачей, использующих и не использующих новые критерии сепсиса в своей практике, по специальностям приведено на рис. 1.
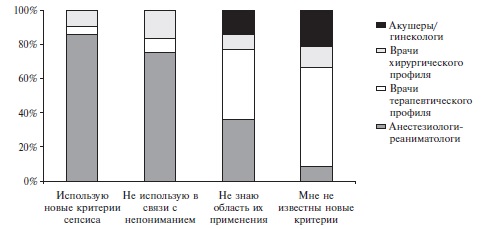
Рис. 1. Распределение(%) врачей, использующихинеиспользующихновыекритериисепсиса, поспециальностям
Осведомленность анестезиологов-реаниматологов о новых критериях сепсиса оказалась достаточно высокой: 64,9% опрошенных врачей используют их в своей практике, в то время как доля врачей, которым не известно об изменении критериев, составила всего 6,3%. Еще 16,2% врачей сообщили, что новые критерии им не понятны, а 12,6% специалистов не могут найти им область применения. При поступлении в отделение реанимации и интенсивной терапии (ОРИТ) 66,7% врачей оценивают состояние каждого пациента по шкале SOFA, 16,4% анестезиологов-реаниматологов данной шкалой пользуются не постоянно, а 15,1% опрошенных никогда ее не используют в связи с "неэффективностью данной шкалы" или "невозможностью ее применения". Ежедневно в ОРИТ проводят оценку состояния по шкале SOFA 50,8% опрошенных, один раз в 2 дня – 15,9%, один раз в 3 дня – 7,1%, не чаще одного раза в неделю – 11,1%, никогда – 15,1%.
Среди врачей терапевтического профиля только 5,7% используют в клинической практике новые критерии сепсиса, в то время как 68,6% не известно об их наличии. 22,8% опрошенных специалистов слышали об изменении критериев сепсиса, однако не могут найти область их применения, а 2,9% не используют свои знания в связи с непониманием. Тем не менее, 11,4% врачей терапевтического профиля проводят оценку состояния больного по шкале qSOFA при подозрении на сепсис. При этом 112 (40,0%) врачей, в том числе 72 и 40 специалистов, работающих в стационаре и амбулаторном звене, соответственно, не знают о существовании данной шкалы, а 76 (27,1%) врачей, в том числе 40 врачей стационара и 36 врачей поликлиники, никогда не использовали ее в связи с отсутствием в клинической практике пациентов с подозрением на сепсис. Приведенные данные свидетельствуют о низкой осведомленности о шкале не только врачей, редко встречающихся с пациентами с сепсисом, но и врачей, работающих с пациентами, у которых повышен риск его развития.
Среди акушеров-гинекологов 17,4% используют шкалу qSOFA у каждой пациентки при подозрении на сепсис, 52,2% не известно о существовании данной шкалы, 30,4% не встречали пациенток с подозрением на сепсис. Новые критерии сепсиса в своей практике не использует ни один акушер-гинеколог. Следует отметить, что все акушеры-гинекологи, пользующиеся шкалой qSOFA, осведомлены о новых критериях сепсиса, но не могут найти область их применения, или они им не до конца ясны.
Большая часть респондентов используют прокальцитонин с диагностической целью. При этом доверяют данному маркеру только 69,8% опрошенных, еще 13,5% сомневаются в диагностической ценности данного маркера и 7,0% уверены, что он не информативен. О новом маркере сепсиса – пресепсине знают 70,4% опрошенных, однако 18,7% из них не знают критерии его применения в клинической практике. 29,6% врачей никогда не слышали о данном маркере. 530 (80,3%) из 669 врачей, знающих о существовании пресепсина, никогда не использовали его в клинической практике в связи с недоступностью в лечебно-профилактическом учреждении.
Полученные при анкетировании результаты указывают на низкую осведомленность врачей о новом определении сепсиса. В ряде случаев существует проблема в использовании имеющихся знаний в связи с непониманием, что говорит об отсутствии единого взгляда на проблему сепсиса. Осведомленность была выше среди анестезиологов-реаниматологов, которые чаще сталкиваются с такими пациентами. В то же время результаты опроса показали низкую информированность о проблеме сепсиса врачей терапевтического и хирургического профиля и акушеров-гинекологов, которые должны предупреждать и своевременно диагностировать это состояние. Проблема сепсиса является не меж-, а мультидисциплинарной, учитывая спектр основных причин сепсиса в Российской Федерации (инфекции дыхательных путей, абдоминальные и урологические инфекции) [7], а также актуальность материнского и неонатального сепсиса [3,5]. Низкая осведомленность врачей о сепсисе приводит к тому, что мы начинаем говорить о сепсисе, когда он уже сам "кричит о себе". Низкая осведомленность врачей терапевтического и хирургического профиля и акушеров-гинекологов о новом определении сепсиса может быть причиной поздней диагностики этого состояния и летального исхода. Очевидны необходимость внедрения в практику российских врачей унифицированных критериев диагностики сепсиса и контроля за эффективностью лечения, а также целесообразность изучения и внедрения новых лабораторных методов диагностики септических состояний. Широко используемых в настоящее время лабораторных методов недостаточно для своевременной и точной диагностики сепсиса. При этом новый биомаркер сепсиса – пресепсин остается малодоступным для врачей, хотя он считается высокочувствительным и специфичным [11,12]. Актуальным представляется изучение возможности применения пресепсина для диагностики септических состояний, стратификации риска сепсиса и воспалительных состояний в рамках новых критериев.
На протяжении последних десятилетий лечение сепсиса представляет собой одну из наиболее остро стоящих проблем. Ежегодная заболеваемость сепсисом продолжает расти и только в США достигает свыше 700 тыс. случаев. Прежде всего
На протяжении последних десятилетий лечение сепсиса представляет собой одну из наиболее остро стоящих проблем. Ежегодная заболеваемость сепсисом продолжает расти и только в США достигает свыше 700 тыс. случаев. Прежде всего это связывают с изменением качественного состава возбудителей сепсиса, увеличением мультирезистентных госпитальных штаммов, а также с появлением контингента более тяжелых больных, сформировавшегося в результате значительного прогресса в лечении ранее некурабельных заболеваний (оптимизация хирургической и реанимационной техники, прогресс в трансплантологии, современные химиотерапевтические подходы в гематологии и онкологии, лечении ВИЧ-инфекции). Несмотря на появление большого количества высокоэффективных антибиотиков, летальность, связанная с сепсисом, за последние 50 лет снизилась лишь на 20% и на сегодня составляет около 40%, достигая 80–90% при синдроме полиорганной дисфункции и септическом шоке.
Классические представления о бактериемии и отдаленных пиемических очагах не отражают всей полноты развития генерализованного инфекционного процесса и являются лишь возможными клиническими вариантами течения сепсиса при определенной локализации первичного очага. Клинической интерпретацией современного взгляда на патогенез сепсиса явились критерии диагностики и классификация, предложенные на согласительной конференции Американского колледжа пульмонологов и Общества специалистов критической медицины — ACCP/SCCM (R. Bone et. al., 1992). Согласно ACCP/SCCM, сепсис определяется как системный ответ организма на инфекцию, характеризующийся четко установленной инфекционной причиной заболевания и двумя или более признаками синдрома системного воспалительного ответа (ССВО). ССВО — это патологическое состояние, обусловленное как инфекционными, так и неинфекционными причинами и характеризующееся наличием двух или более признаков: 1) температура > 38°С или < 36°С; 2) ЧСС >90/мин; 3) ЧД > 20/мин, РаСО2 < 32 мм рт. ст.; лейкоциты >12000 или < 4000 в мл и/или палочко-ядерные >10%. Тяжелым считается сепсис с органными нарушениями, гипоперфузией и/или гипотензией. Септический шок определяется как вызванная сепсисом артериальная гипотензия, сохраняющаяся, несмотря на адекватную инфузию растворов; может сочетаться с нарушением перфузии, которое проявляется в виде лактат-ацидоза, олигурии, острого нарушения сознания, но не ограничивается только этими признаками.
Фармакологические подходы к лечению сепсиса
Многочисленные иммунные нарушения, возникающие как результат воздействия инфекционного агента и проявляющиеся системной воспалительной реакцией, характеризуются активацией системы комплемента, повышенным синтезом цитокинов, метаболитов арахидоновой кислоты и других вазоактивных веществ. При системном воспалении запускаются многоступенчатые каскады иммунных реакций, происходит дисрегуляция свертывающей-противосвертывающей систем, возникает дисфункция сердечно-сосудистой системы, формируются различные варианты метаболических нарушений, в том числе предопределяющие развитие шока [1].
Сложность в определении фармакологических подходов при тяжелом сепсисе и септическом шоке заключается в комплексности данного синдрома, затрудняющей выбор тактики лечения. Необходимость комбинированной терапии диктуется проявлением собственно инфекционной нозологии, приведшей к развитию септического шока, а также формированием многочисленных синдромов, сопутствующих тяжелому сепсису.
Лекарственные средства (ЛС), назначаемые при сепсисе и патогенетически связанных с ним синдромах, могут быть разделены на три группы:
- препараты с высокой степенью доказательности, влияющие на прогноз заболевания;
- препараты, демонстрирующие позитивный симптоматический эффект без влияния на выживаемость;
- экспериментальные средства.
Единственной группой лекарственных средств, достоверно влияющих на прогноз заболевания, являются антибактериальные препараты. Из нефармакологических подходов к этой же категории можно причислить хирургические вмешательства, направленные на борьбу с инфекцией. С практической точки зрения, за исключением использования вышеперечисленных групп препаратов, терапия сепсиса предполагает применение средств, направленных на борьбу с отдельными симптомами и поддержание функции жизненно важных органов и систем (как, например, при септическом шоке адекватная инфузионная терапия и назначение вазопрессоров или искусственная вентиляция легких при дыхательной недостаточности). В свою очередь, к группе экспериментальных могут быть отнесены препараты, эффективность которых при сепсисе требует дальнейшего изучения, например глюкокортикостероиды, а также медикаментозные средства, проходящие клинические испытания, но уже продемонстрировавшие определенную клиническую эффективность (С1-эстеразный ингибитор, активированный протеин С, антитела к фактору некроза опухоли альфа и т. д.).
Антибактериальные средства
Эффективность антибактериальных средств, наблюдаемая при неосложненном течении бактериальной инфекции, значительно ограничена при тяжелом течении сепсиса. Поэтому актуальной является задача наиболее раннего и адекватного назначения антимикробных препаратов. Правила эмпирического выбора антибиотиков основываются на локализации первичного очага, определении тяжести состояния, сопутствующих заболеваний, выяснении аллергологического анамнеза.
Выявление первичной локализации процесса с высокой долей вероятности позволяет предположить возможного возбудителя. При этом правильный и своевременный забор биологического материала (кровь, моча, плевральная жидкость, биоптат и т. д.) должен быть непременным атрибутом диагностических мероприятий при сепсисе. Повысить эффективность лечения позволяет назначение антимикробных средств в наиболее ранние сроки с момента верификации бактериального процесса, что представляется возможным только при быстром и полноценном клиническом и лабораторно-инструментальном анализе состояния пациента. Учет фармакокинетических и фармакодинамических особенностей назначенной группы антибиотиков обеспечивает создание необходимой концентрации препарата в первичном очаге инфекции с минимальными нежелательными реакциями, в особенности у пациентов с тяжелым течением заболевания и синдромом полиорганной дисфункции (табл. 1).
Лекарственные средства,влияющие на систему свертывания крови
Разнонаправленные изменения и разнообразные варианты дисфункций в системе гемостаза при сепсисе затрудняют создание единых алгоритмизированных рекомендаций и требуют максимально полноценной клинико-лабораторной и инструментальной оценки состояния пациента. При прогрессировании патологии наряду с нарушениями в синтезе и потреблении факторов свертывания возникают тромбоцитопения и признаки диссеминированного внутрисосудистого свертывания (ДВС). Подозрение на развитие ДВС-синдрома требует неотложного начала терапевтических мероприятий (табл. 2).
Лекарственные средства, влияющие на выраженность системной воспалительной реакции
Данные, указывающие на способность глюкокортикостероидов (ГКС), с одной стороны, улучшать функцию сердечно-сосудистой системы за счет увеличения синтеза β-адренорецепторов и катехоламинов, с другой — модулировать иммунный ответ, угнетая агрегацию и адгезию лейкоцитов, а также уменьшая активацию системы комплемента, создают теоретические предпосылки к их использованию при сепсисе [3]. Кроме того, любой тяжелый стресс для организма (хирургическое вмешательство, травма, тяжелое инфекционное заболевание) активирует гипоталамо-гипофизарную систему, тем самым увеличивая синтез кортизола. Поэтому в случае даже относительной надпочечниковой недостаточности ГКС рассматриваются как возможный вариант заместительной терапии. Основываясь на результатах клинических исследований, применение ГКС можно рекомендовать при септическом шоке только пациентам с признаками надпочечниковой недостаточности по результатам кортикотропинового теста (концентрация кортизола крови > 9 мг/дл после введения кортикотропина). Положительный эффект от назначения ГКС описан при применении 50 мг гидрокортизона каждые 6 ч в комбинации с флудрокортизоном в дозе 50 мг/сут на протяжении 7 дней [4].
Одним из наиболее перспективных на сегодняшний день направлений в лечении тяжелого сепсиса и септического шока является воздействие на систему комплемента, так как ее чрезмерная активация приводит к тяжелому системному воспалению, повышению проницаемости капилляров и деструкции тканей [5]. Классический способ активации осуществляется через С1 фактор системы комплемента. С1-эстеразный ингибитор является единственным из известных ингибиторов С1s и С1r — компонентов классического способа активации комплемента и инактиватором факторов свертывания XII, XIa и калликреина. Несмотря на то что С1-эстеразный ингибитор является белком острой фазы, у пациентов с тяжелым сепсисом или септическим шоком наблюдается абсолютная и функциональная недостаточность С1-эстеразного ингибитора при сепсисе, связанная с его повышенным расщеплением и потреблением как в системном кровотоке, так и в очаге воспаления [6]. Назначение высоких доз экзогенного С1-эстеразного ингибитора предполагает торможение как локального, так и системного воспаления, а также стабилизацию гемодинамики в связи уменьшением проницаемости капилляров [7]. Результаты нескольких слепых плацебо-контролируемых клинических испытаний подтвердили безопасность раннего назначения высоких доз С1-эстеразного ингибитора (до 12 000 ЕД в течение 2 сут), а также выявили положительное влияние препарата на скорость восстановления почечной функции у пациентов с сепсисом или септическим шоком, уменьшение полиорганных проявлений, выражавшихся в снижении индексов тяжести ряда шкал (LOD, SOFA). Кроме того, в ходе обсервационных исследований отмечалась позитивная тенденция, выразившаяся в уменьшении смертности пациентов, получавших С1-эстеразный ингибитор. Таким образом, раннее назначение С1-ингибитора позволяет избежать нежелательных последствий системного воспаления [8] и улучшить прогноз у пациентов с сепсисом или септическим шоком, у которых традиционная терапия оказалась неэффективна [9, 10, 11].
Коррекция гемодинамических расстройств при сепсисе и септическом шоке
Своевременная коррекция артериальной гипотензии позволяет восстановить тканевую перфузию, поддержать гомеостаз и улучшить прогноз при шоке любого происхождения. Терапия, проводимая с использованием принципов стратегии, получившей название EGRT (early-goal related therapy), продемонстрировала, что эффективная коррекция перфузионных нарушений при тяжелом сепсисе возможна только при раннем применении инвазивного гемодинамического мониторинга (измерение центрального венозного давления, давления заклинивания легочной артерии, сатурации центральной венозной крови). Среди ключевых мишеней терапии рассматриваются сатурация центральной венозной крови и уровень гематокрита, значение которых уже на ранних стадиях тяжелого сепсиса позволяет выделить лиц с миокардиальной дисфункцией и высоким риском перфузионных нарушений. Необходимость поддерживать показатель центральной венозной сатурации на уровне более 70% требует инотропной терапии добутамином (добутрекс, добутамин cолвей, добутамин лахема 250) и больших объемов инфузии у пациентов в группе риска. Данная тактика способствует ранней отмене вазопрессоров, сокращению сроков искусственной вентиляции легких, оптимизирует пред- и постнагрузку, улучшает сердечную сократимость и достоверно снижает смертность у пациентов с тяжелым сепсисом и септическим шоком [12].
Базисом для проведения традиционной интенсивной фармакотерапии септического шока являются инфузионные растворы, препараты с инотропной и вазопрессорной активностью. По различным рекомендациям, первоначально требуемый режим дозирования кристаллоидов для пациентов с септическим шоком составляет 6–10 л за первые 24 ч, а для коллоидов колеблется от 2–4 л за первые сутки [13]. Прирост сердечного индекса (СИ) при данном темпе инфузии достигает 25–40% [14]. Если ранее осуществлявшаяся инфузия не привела к повышению сократительной функции левого желудочка и СИ по-прежнему составляет менее 2,5 л/мин/м2, целесообразно применение инотропных средств. Препаратом выбора в данной ситуации является добутамин (табл. 3) [15]. При использовании добутамина у пациентов с септическим шоком необходимо учитывать его β2-агонистические свойства, в то время как комбинация с вазопрессорами, в частности с норадреналином, позволяет избежать вазодилатации.
Комплексность патологических реакций значительно усложняет лечение сепсиса. Несомненно, активное изучение патогенеза заболевания будет способствовать формированию новой стратегии в современной фармакотерапии сепсиса.
И. Б. Лазарева, кандидат медицинских наук
А. А. Игонин, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Читайте также:

