Шок виды шока при различных инфекционных заболеваниях
Обновлено: 15.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Шок: причины появления, симптомы, диагностика и способы лечения.
Определение
Шок – остро развивающееся, угрожающее жизни критическое состояние, которое является ответной реакцией организма на чрезвычайные раздражители и сопровождается нарушением деятельности центральной нервной системы, органов дыхания, системы кровообращения. При шоке сердечно-сосудистая система не способна обеспечить адекватное кровоснабжение органов и тканей, что приводит к гипоксии, нарушению метаболизма, развитию синдрома полиорганной недостаточности. Шок возникает при различных заболеваниях, повреждениях и патологических состояниях.
Причины шока
Пусковыми факторами развития шока могут быть внешние причины (травма, отравление, анафилактическая реакция) и внутренние - декомпенсация хронических болезней (ишемической и гипертонической болезни сердца, нарушения сердечного ритма), тромбоэмболические осложнения, нейроэндокринные нарушения (диабетический кетоацидоз, острая надпочечниковая недостаточность), желудочно-кишечные кровотечения, острая кишечная непроходимость.
Шок представляет собой динамический процесс, начинающийся с момента действия фактора агрессии, который приводит к системному нарушению кровообращения, и при прогрессировании нарушений заканчивающийся необратимыми повреждениями органов и смертью больного.
Эффективность компенсаторных механизмов, степень клинических проявлений и обратимость возникающих изменений позволяют выделить в развитии шока ряд последовательных стадий:
- компенсаторные реакции организма (со временем обычно исчерпываются);
- метаболические и электролитные нарушения вследствие гипоксии;
- последствия ишемии органов (полиорганная недостаточность).
- Гиповолемический (геморрагический) шок, характеризующийся уменьшением общего объема крови вследствие кровотечения, большой внешней или внутренней кровопотери, ожогов, обезвоживания.
- Распределительный (дистрибутивный) шок, который сопровождается расширением кровеносных сосудов:
- анафилактический шок - вызванный падением сосудистого тонуса при острой аллергической реакции;
- септический шок – наблюдается при сепсисе или вызван токсинами стафилококков или стрептококков;
- нейрогенный шок – возникает как следствие выраженной спинальной травмы, инсульта, отека головного мозга, расширения сосудов в ответ на боль;
- шок, обусловленный гормональными нарушениями (острой недостаточностью надпочечников, тиреотоксическим кризом, гиперметаболической комой).
- Кардиогенный шок, характеризующийся нарушением работы сердца в результате острого инфаркта миокарда, нарушений сердечного ритма или дисфункции клапанов.
- Обструктивный шок характеризуется снижением сердечного выброса из-за физического препятствия кровотоку и встречается при напряженном пневмотораксе, синдроме повышенного внутрибрюшного давления, опухоли сердца и тромбах в полостях сердца, тромбоэмболии легочной артерии, острой легочной гипертензии в результате острой дыхательной недостаточности.
- со стороны кожи — бледность, охлаждение и потливость (при септическом шоке вначале кожа обычно сухая и теплая, а при обезвоживании — сухая и неэластичная), замедление капиллярного наполнения (после прекращения нажатия на ноготь побледнение исчезает через >2 с), цианоз, мраморность;
- со стороны ЦНС — чувство страха, беспокойство, спутанность сознания, психомоторное возбуждение, сонливость, ступор, кома, очаговый неврологический дефицит;
- со стороны почек — олигурия или анурия и другие симптомы острой почечной недостаточности;
- со стороны мышц — слабость;
- со стороны желудочно-кишечного тракта — тошнота, рвота, вздутие, ослабление или отсутствие перистальтики, кровотечение;
- со стороны печени — желтуха является редким симптом и возникает поздно или уже после вывода из шока;
- со стороны дыхательной системы — возможны различные нарушения функции дыхания; оно может вначале быть поверхностным и учащенным, затем замедленным, остаточным или апноэ; на фоне гиповентиляции легких может возникнуть острая дыхательная недостаточность.
Уменьшение общего объема крови (гиповолемический шок) наступает в результате кровотечения, обезвоживания (рвоты, диареи), полиурии, ожогов.
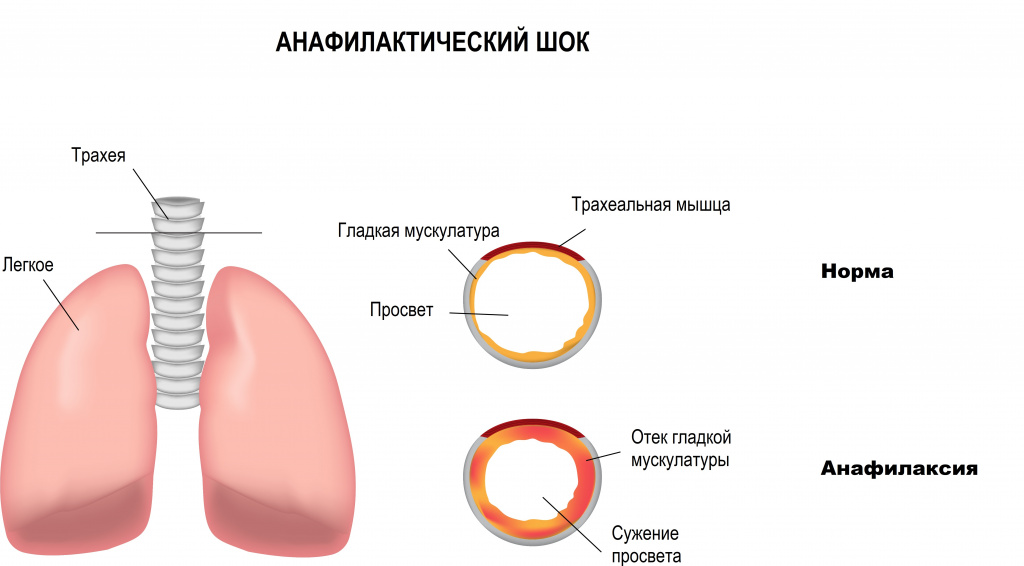
Депонирование крови в венозных бассейнах (распределительный, дистрибутивный шок) наблюдается при анафилаксии, острой надпочечниковой недостаточности, сепсисе, нейрогенных факторах.
Малый сердечный выброс (кардиогенный шок) возникает из-за несостоятельности насосной функции сердца, а также в результате обструкции венозного притока к сердцу или сердечного выброса (обструктивный шок).
Диагностика шока
Шок не оставляет времени для упорядоченного сбора информации и уточнения диагноза до начала лечения. В экстренном случае диагноз ставится на основе клинической картины. Дальнейшие диагностические исследования при шоке включают:
1. Исследование системы кровообращения:
- измерение артериального давления (инвазивное при продолжительном шоке);
- ЭКГ в 12 отведениях и постоянный мониторинг нарушений ритма, симптомов ишемии, инфаркта миокарда либо другого заболевания сердца;
ЭКГ представляет собой исследование, в основе которого - регистрация биопотенциалов сердца. Применяется для диагностики функциональной активности миокарда.
Категории МКБ: Гиповолемический шок (R57.1), Гипотензия неуточненная (I95.9), Гипотензия, вызванная лекарственными средствами (I95.2), Другие виды гипотензии (I95.8), Другие виды шока (R57.8), Идиопатическая гипотензия (I95.0), Кардиогенный шок (R57.0), Септицемия неуточненная (A41.9), Шок неуточненный (R57.9), Шок, не классифицированный в других рубриках (R57)
Общая информация
Краткое описание
Российское общество неонатологов
Клинические рекомендации
Диагностика и лечение шока у новорожденных детей
Год создания: 2019

По мере своего развития шок сопровождается снижением артериального давления. Однако, изолированное снижение артериального давления ниже нормативных значений для данного возраста и срока гестации без нарушения перфузии органов и тканей, не является шоком и требует принципиально иных терапевтических подходов.
Классификация
Выделяют несколько основных видов шока: дистрибутивный шок, кардиогенный шок и гиповолемический шок, который в практике неонатолога, как правило, связан с кровопотерей. В соответствии с этиологической классификацией существует также болевой шок, анафилактический шок, ожоговый шок и другие, однако эти виды шока редко встречаются в неонатальной практике. Особенностью новорожденных является возможность развития некоторых видов шока, нехарактерных для взрослых и детей более старшего возраста (шок на фоне закрытия ОАП при дуктус-зависимом ВПС, шок при фиброэластозе, шок фето-фетальном синдроме, шок при персистирующей легочной гипертензии и др). Кроме того, некоторые врожденные нарушения метаболизма, сопровождающиеся гипераммониемией или гипергликемией, могут также симулировать клинику септического шока.
Наиболее тяжёлым, молниеносно развивающимся, имеющим высокую летальность и наибольшую частоту осложнений является септический шок. В основе диагностического поиска и планирования тактики всегда нужно в первую очередь исключить развитие септического шока.
Особенности наиболее часто встречающихся видов неонатального шока.
Классически выделяют три стадии шока – стадия компенсации, стадия декомпенсации и необратимая стадия. В неонатальной практике четкое выделение стадий шока не всегда возможно.
Лечение следует начинать вне зависимости от подозреваемой стадии шока.


Этиология и патогенез
ЭТИОЛОГИЯ ШОКА
В основе развития шока лежит снижение сердечного выброса и/или снижение периферического сосудистого сопротивления. Сердечный выброс определяется:
Любой из факторов (низкая преднагрузка и сократительная способность или высокая постнагрузка) может привести к снижению сердечного выброса.

Патологические состояния, которые приводят к описанным изменениям, перечислены в таблице.
Клиническая картина
Cимптомы, течение
В отличие от артериальной гипотонии, которая может протекать бессимптомно, при шоке отмечаются следующие клинические симптомы:
- Со стороны сердечно-сосудистой системы: Нарушения сердечного ритма. Наиболее частый признак развивающегося шока – нарастающая тахикардия. Учащая сердечный ритм, ребенок компенсирует падающий сердечный выброс, не имея возможности адекватно увеличить силу сокращения. У недоношенных детей признаком развивающегося шока, напротив, может быть брадикардия. Нарушения частоты сердечных сокращений – ранний признак развития шока у новорожденного.
- Со стороны дыхательной системы: Тахипное характерно для септического и кардиогенного шока, в частности на фоне ацидоза и повышения уровня лактата. При наличии патологии легких возможно быстрое прогрессирование дыхательных нарушений. Периодическое дыхание и апноэ являются следствием сниженной перфузии головного мозга, что может отмечаться при всех видах шока.
- Со стороны ЦНС: Неврологические нарушения могут быть различными – от резкого угнетения вплоть до отказа от кормления до двигательного возбуждения с быстрым истощением. Как правило, развивается мышечная гипотония в покое, сниженная спонтанная двигательная активность с постепенным нарастанием неврологических нарушений.
- Артериальная гипотония. Следует помнить, что артериальная гипотония – это относительно поздний признак шока. В идеальном варианте диагностика и терапия шока должна быть начата раньше развития тяжелой гипотонии. Нижней допустимой границей среднего артериального давления в мм рт ст эмпирически принято считать ГВ в неделях. Однако нижняя граница артериального давления вне зависимости от ГВ не должна опускаться ниже 30 мм рт ст [1] Только для новорожденных с весом 600г и менее – нижняя допустимая граница среднего артериального давления может быть 28 мм рт ст
- Со стороны мочевыделительной системы: Может отмечаться олигурия вплоть до анурии. Однако, при высокой осмолярности (например, в условиях гипергликемии), а также при массивной диуретической терапии нормальные показатели диуреза могут сохраняться достаточно долго.
- Низкая корреляция между АД и тканевой перфузией
- Низкая специфичность симптома белого пятна. Для новорожденных ≤ 30 недель гестации выявлена незначительная специфичность только при длительности заполнения капилляров более 5 сек
- На фоне шока часто отмечается брадикардия. Характерна клиническая ситуация, когда эпизоды выраженной брадикардии чередуются нормальным или учащенным сердечным ритмом. Нарушения сердечного ритма практически всегда предшествуют снижению АД.
- У глубоконедоношенных детей следует различать артериальную гипотонию, (связанную с незрелостью регуляторных механизмов, относительной адреналовой недостаточностью) и собственно шок. Терапевтические подходы к этим двум состояниям кардинально отличаются.
Диагностика
Сердечный выброс (СВ) – это количество крови, выброшенной сердцем за минуту – величина, характеризующая системный кровоток, синоним - минутный объем кровообращения.
Величина СВ зависит от ЧСС. При значительных нарушениях сердечного ритма – тахикардии или брадикардии – данные могут быть недостоверны.
В педиатрической практике, как правило, под СВ подразумевается СВ левого желудочка. В неонатологии и, в особенности у недоношеннных новорожденных, актуально измерение СВ левого и правого желудочков. Измеряется в мл/кг/мин.
• Недоношенные (без ГЗФАП) - 221 ± 56 мл/кг/мин. У недоношенных новорожденных со значимым шунтированием крови через ОАП СВ левого желудочка не характеризует системный кровоток, так как к его значение может достигать 300 мл/кг/мин и более, характеризуя при этом кровоток в малом круге кровообращения. В такой гемодинамической ситуации для оценки системного кровотока используется СВ правого желудочка.
СВ правого желудочка. Объем крови, выброшенной правым желудочком за минуту. Величина кровотока оценивается на уровне бифуркации легочной артерии. Нормальные показатели соответствуют показателям СВ левого желудочка. В связи с тем, что на сердечный выброс ПЖ не влияет ГЗФАП, этот показатель рекомендуется использовать в первые 24 часа после рождения, а также у недоношенных новорожденных с ГЗФАП. Однако, при значительном шунтировании крови через овальное окно СВ ПЖ также не будет характеризовать системный кровоток. В этой ситуации для косвенной оценки системного кровотока используют данные о возврате крови к сердцу – кровоток в верхней полой вене.
Кровоток в верхней полой вене (ВПВ). Объем крови, проходящий через верхнюю полую вену на уровне ее впадения в правое предсердие. Характеризует кровоток в верхней половине туловища, 70-80% которого составляет кровоток в головном мозге. Измеряется в мл/кг/мин. Составляет 30-50% выброса правого желудочка. Кровоток значительно возрастает в первые 48 часов жизни – от 70 мл/кг/мин в возрасте 5 часов жизни до 90 мл/кг/мин в возрасте 48 часов. Таким образом, с учетом данных о значительном приросте в первые 48 часов, нормальные значения: 40-120 мл/кг/мин.
Ударный объем (УО) - объем крови, который выбрасывается сердцем за одно сокращение. Таким образом, у новорожденного с нормальным сердечным ритмом без значимого шунтирования крови через фетальные коммуникации для оценки уровня системного кровотока используется СВ левого желудочка и кровоток в ВПВ. При наличии значимого шунтирования – используют данные о СВ правого желудочка и кровоток в ВПВ.
Для оценки функции миокарда используются данные о фракции выброса и фракции укорочения. Основной проблемой достоверности этих измерений у недоношенных новорожденных является традиционное использование для этого М-режима, при котором оценивается движение задней стенки ЛЖ и межжелудочковой перегородки. Особенностью недоношенных является малая подвижность межжелудочковой перегородки при сокращении. Для недоношенных новорожденных предпочтительно измерение ФУ методом Симпсона.
Фракция укорочения (ФУ) - отношение конечного систолического размера ЛЖ к конечному диастолическому. Величина, характеризующая способность волокон миокарда сокращаться. Нормальные значения: 35% (26-40%).
Для оценки значимости шунтирования используются данные о диаметре ОАП и признаки переполнения легочного и обеднения системного кровотока.
• Индекс сосудистой резистентности (Ri) передней мозговой артерии >0,8
Оценка давления в ЛА по шунтированию через ОАП. Метод может быть использован при наличии шунтирования через ОАП и данных о системном АД. Для оценки используется модифицированная формула Bernoulli : 4 ∗ 𝑉𝑉ОАПP 2 , где 𝑉𝑉ОАП – скорость кровотока в ОАП.
Например, при шунтировании крови слева-направо и скорости кровотока в ОАП 2м/с (4*22) давление в ЛА будет ниже системного АД на 16 мм рт ст, а при право- левом шунтировании давление в ЛА будет на 16 мм выше системного АД.
Оценка давления в ЛА по степени недостаточности на трикуспидальном клапане. При отсутствии обструкции выходного тракта ПЖ давление в ПЖ рано давлению в ЛА. Давление в правом предсердии на 5-10 м м р т с т н иже д авления в Л А. М етод м ожет б ыть и спользован при наличии недостаточности трикуспидального клапана, так как отсутствие регургитации на клапане будет говорить о том, что давление в ПЖ равно давлению в ПП. Таким образом, если градиент на трикуспидальном клапане равен 36 мм рт ст, давление в ЛА будет равным 42 мм рт ст (36мм рт ст +5мм рт ст).
Оценка давления в ЛА по отношению времени ускорения кровотока в ЛА к времени изгнания. Метод основан на том, что по мере роста давления в ЛА сокращается время достижения пиковой скорости в момент изгнания крови из ПЖ. На основании отношения времени достижения максимальной скорости кровотока в ЛА к полному времени изгнания (TPV/RVET) можно судить о легочной гипертензии.
Лечение
1. В первую очередь следует обеспечить адекватную респираторную терапию. Как правило, требуется перевод на ИВЛ.
2. Обеспечение сосудистого доступа (если отсутствует). Желательно катетеризировать две вены (одну центральную и одну периферическую или две центральных вены) для исключения вероятности изменения скорости введения инотропных препаратов при одновременном назначении других инфузий. В исключительных случаях при наличии жизненных показаний в отсутствие возможности катетеризации центральной вены допустима непродолжительная инфузия вазоактивных препаратов (допамин, адреналин) в периферическую вену. Задержка с назначением инотропных препаратов связана с 20-кратным увеличением риска летальности.
3. Если ребенок получал энтеральное питание, оно должно быть отменено, содержимое желудка эвакуировано. Парентеральное питание должно быть продолжено с учетом клинической картины и особенностей новорожденного (см. протокол проведения парентерального питания).
3. Непосредственно после катетеризации вены, как можно скорее, вводится 10–20 мл/кг физиологического раствора медленно болюсно или капельно. На ранней стадии дистрибутивного шока (септического шока) предпочтительно в первую очередь использовать волюм-эспандерный раствор (физиологический раствор) для поддержания внутрисосудистого пространства. Инотропные препараты назначаются одновременно или немногим позднее. При отсутствии эффекта возможны повторные введения еще 10-15 мл/кг за 15-20 мин, с одновременным назначением инотропного препарата. Волюм-эспандерная терапия при септическом (дистрибутивном) шоке может достигать 40 и более мл/кг в течение первого часа терапии шока.
4. Инотропные препараты. Допамин – вазоактивный препарат первой линии в начальной дозе 5 мкг/кг/мин с повышением дозы по мере необходимости. Повышение дозы производят пошагово, шаг - 2,0-2,5 мкг/кг/мин до 10 мкг/кг/мин каждые 10- 15 мин. Исключение составляет состояние персистирующей легочной гипертензии, когда препаратом первой линии может стать добутамин с 5 мкг/кг/мин, увеличивая дозу с шагом 2,0 -5,0 мкг/кг/мин каждые 10-15 мин. Добутамин (как стартовый препарат) может назначаться при персистирующей легочной гипертензии как изолированно, так и одновременно с допамином
5. Предварительная оценка вида шока (гиповолемический, дистрибутивный (септический), кардиогенный). Начальные мероприятия направлены на поддержание сосудистого пространства и обеспечение поддержки тонуса миокарда и стенок сосудов, коррекцию гипоперфузии органов и тканей. Дальнейшие действия будут зависеть от полученных результатов обследования.
6. Анализ крови на КОС, электролиты, глюкозу, лактат, посев крови (другие исследования, предусмотренные при ухудшении состояния, в соответствии с внутренним протоколом отделения). Подсчет диуреза за предыдущие часы. В случае необходимости – коррекция анемии, ацидоза, дисэлектолитных нарушений, смена антибактериальной терапии.
7. Эхокардиография* для исключения ВПС с оценкой сократительной способности миокарда, системного кровотока (сердечный выброс ЛЖ, кровоток в ВПВ), гемодинамической значимости фетальных коммуникаций:
а. При нормальной сократительной способности миокарда и низком АД - продолжить увеличение дозы допамина до 15-20 мкг/кг/мин.
б. При сниженной сократительной способности миокарда и/или высокой легочной гипертензии – добутамин с 5 мкг/кг/мин до 20 мкг/кг/мин, увеличивая на 2 - 5 мкг/кг/мин каждые 15 мин.
Если у новорожденного сохраняется гиповолемия, высокие дозы инотропных препаратов могут вызвать тахикардию. В этом случае следует увеличить волемическую нагрузку.
а. Для детей с ЭНМТ – назначаются кортикостероиды - гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости доза увеличивается до 2-2,5 мг/кг каждые 4 часа). Возможно также использование дексаметазона (0,5 мг/кг, при необходимости повторное введение каждые 2-6 часов). При отсутствии эффекта от введения кортикостероидов или кратковременном эффекте – в терапию включается адреналин 0,05-0,3 мкг/кг/мин. Каждые 15 мин увеличение дозы на 0,1 мкг/ кг/мин, максимальные дозы при шоке могут достигать 3-5 мкг/кг/мин.
У детей с ЭНМТ оправдано использование нескольких инотропных препаратов одновременно с целью снижения необходимой дозы адреналина, так как использование адреналина сопряжено с рядом побочных эффектов (повышение тонуса мезентериальных сосудов, гипергликемия, увеличение тонуса легочных сосудов, развитие гипертрофии миокарда, лактат-ацидоз)
б. Для детей с весом более 1000г – назначается адреналин (0,1-0,5 мкг/кг/мин). Каждые 15 мин увеличение дозы на 0,1 мкг/кг/мин. При отсутствии эффекта от увеличения дозы адреналина – назначаются кортикостероиды – гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости доза увеличивается до 2-2,5 мг/ кг каждые 4 часа).
Возможно также использование дексаметазона (0,5 мг/кг, при необходимости повторное введение каждые 2-6 часов). После назначения адреналина возможен переход на монотерапию адреналином или сочетание нескольких инотропных препаратов.
9. При неэффективности описанной терапии и подтвержденной нормальной сократимости миокарда возможно использование норадреналина.
Норадреналин в большей степени увеличивает общее периферическое сопротивление сосудов, что приводит к увеличению постнагрузки. При условии здорового миокарда это может привести к увеличению сократимости. При пораженном миокарде повышение постнагрузки сопровождается снижением сердечного выброса. Эффективное и безопасное применение норадреналина возможно после эхокардиографического исследования с оценкой сократительной способности миокарда. Применяется при артериальной гипотонии на фоне сохранной сократительной способности миокарда, только после волемической нагрузки, обычно в комбинации с другими инотропными препаратами. Рекомендована начальная доза и скорость введения от 0,1 до 0,3 мкг/кг/мин. Максимальная доза и скорость введения может достигать 3–5 мкг/кг/мин.
10. Решение о необходимости продолжения введения повышенного объема инфузии принимается на основании клинических данных и данных эхокардиографии:

* Функциональная эхокардиография является основой эффективной терапии шока у новорожденных. В жизнеугрожающей ситуации (например, септический шок) эхокардиографическая оценка может проводиться обученным неонатологом. В случае отсутствия возможности ЭХО-исследования, после проведения начальных мероприятий по стабилизации больного с шоком, возможен выбор любой тактики в рамках предложенных алгоритмов.
При использовании высоких доз адреналина возможна как отмена других инотропных препаратов (допамин, добутамин), так и использование нескольких инотропных препаратов одновременно.
При стабилизации состояния в первую очередь снижают дозу и отменяют норадреналин, затем, по возможности, адреналин, затем добутамин, инфузия допамина в невысоких дозах может потребоваться в течение нескольких суток. Кортикостероиды отменяются сразу после стабилизации АД, в том числе на фоне использования инотропных препаратов.
Следствием шокового состояния может быть повреждение и дисфункция многих органов и систем. В связи с этим после стабилизации состояния необходимо:
b. своевременная коррекция объема вводимой жидкости, состава парентерального питания, дозировки нефротоксичных препаратов в зависимости от функции почек.
d. УЗИ головного мозга
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Синдром токсического шока — тяжелое острое полиорганное поражение, вызванное экзотоксинами золотистого стафилококка или пиогенного стрептококка. Проявляется внезапным повышением температуры до 38,9°С и более, падением артериального давления, эритематозными кожными высыпаниями с последующим шелушением, профузным поносом, рвотой, признаками поражения разных органов и систем. Диагноз СТШ устанавливают на основе клинической картины, данных физикального обследования, лабораторных, в том числе бактериологических, анализов. Лечение предусматривает санацию бактериального очага, назначение антибиотиков, инфузионной и симптоматической терапии.
МКБ-10
Общие сведения
Синдром токсического шока (СТШ) впервые диагностирован в 1978 г. у семи детей со стафилококковой инфекцией. Специалисты в области гинекологии столкнулись с ним двумя годами позже, отметив связь развития синдрома у молодых женщин с использованием суперадсорбирующих гигиенических тампонов во время месячных. Абсолютное большинство пациенток — женщины в возрасте 17-30 лет. Приблизительно у половины из них развитие синдрома связано с менструацией. В четверти случаев неменструального СТШ заболевание возникает в послеродовом периоде у носительниц Staphylococcus aureus, в 75% — в результате других причин (кожного и подкожного инфицирования, перенесенных операций с тампонированием и пр.).

Причины СТШ
Синдром токсического шока вызывают экзотоксин-продуцирующие микроорганизмы, оказывающие системное воздействие на разные органы и ткани, — золотистый стафилококк (Staphylococcus aureus) и пиогенный β-гемолитический стрептококк группы А (Streptococcus pyogenes). В большинстве случаев заболевание возникает не в момент первичного заражения бактериями, а на фоне носительства инфекционных возбудителей при воздействии следующих предрасполагающих факторов:
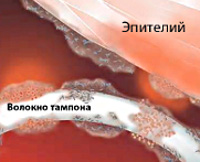
- Использование тампонов. Вероятность развития СТШ возрастает при пользовании гигиеническими средствами с повышенными адсорбирующими свойствами и нарушении рекомендуемой частоты их замены.
- Использование интравагинальных контрацептивов. Наличие во влагалище диафрагм, губок, колпачков создает благоприятные условия для размножения микроорганизмов.
- Нарушение целостности слизистых оболочек. При травмах половых органов, наличии в матке остатков плацентарной ткани, плодных оболочек, крови после родов и гинекологических операций возникают оптимальные условия для бактериального обсеменения и проникновения микроорганизмов или их токсинов в кровь.
Неменструальный синдром токсического шока может осложнять хирургические процедуры, при которых применяется перевязочный материал, накапливающий кровь (операции на полости носа с использованием турунд, тампонирование ран и др.), и травматические повреждения кожи. Сочетание указанных факторов с вирусными заболеваниями (ветрянкой, гриппом), приемом иммуносупрессивных препаратов повышает риск развития токсемии и бактериемии.
Патогенез
Ключевую роль в развитии синдрома токсического шока играют механические и химические воздействия, которые способствуют размножению бактерий и влияют на проницаемость тканей. Пусковым моментом служит проникновение в кровь значительных количеств специфических токсинов (TSST) и их взаимодействие с Т-лимфоцитами. В результате массивно высвобождаются цитокины, вызывающие полиорганную токсическую реакцию. Расширяются сосуды и повышается проницаемость их стенки, что приводит к перемещению плазмы крови и сывороточных протеинов во внесосудистое пространство. При этом наблюдается резкое падение давления, возникают отеки, нарушается коагуляция, повышается температура. Под влиянием опосредованных иммунных реакций и прямого действия токсинов поражаются кожа, паренхима печени, легких и других органов.
Симптомы СТШ
У менструирующих женщин, использующих тампоны, признаки СТШ появляются на 3—5-й день менструации. При синдроме токсического шока, осложнившем роды или гинекологические операции, патология проявляется в первые 2 дня послеродового или послеоперационного периода. Как правило, заболевание возникает остро. В редких случаях наблюдается продром в виде общего недомогания, тошноты, головной и мышечных болей. Первым признаком СТШ становится сильный озноб с повышением температуры до 39—40°С, после чего в течение 1—4 суток разворачивается полная клиническая картина.
Практически у всех пациенток возникают мышечная слабость и диффузные боли в мышцах, особенно в мускулатуре проксимальных отделов конечностей, брюшного пресса и спины. Часто беспокоят боли в суставах. Более чем 90% заболевших отмечают упорную рвоту и профузный водянистый понос, скудное количество мочи. Возникают першение в горле, парестезии, головная боль, светобоязнь, головокружение и обмороки на фоне падения АД. В ряде случаев беспокоит кашель, болезненные ощущения при глотании. В острой стадии, длящейся от 24 до 48 часов, пациентка выглядит заторможенной и дезориентированной.
Специфическое проявление синдрома — кожные высыпания в виде диффузного покраснения, которое напоминает солнечный ожог и начинает постепенно бледнеть на протяжении первых 3 дней. В последующем возникает грубое шелушение кожи, особенно заметное на подошвах и ладонях. У некоторых женщин покраснение носит характер пятен различных размеров, к которым присоединяются мелкие узелковые высыпания или точечные петехиальные кровоизлияния. Почти у четверти заболевших на 5—10-е сутки возникает сильный зуд на фоне пятнисто-узелковой сыпи. Практически у 100% пациенток к концу 1—2-ой недели наблюдается неглубокое генерализованное чешуйчатое отслаивание кожного эпителия с более выраженным пластинчатым шелушением ладоней, подошв, пальцев рук и ног. Половина пациенток, перенесших СТШ, к концу 2—3-го месяца отмечает выпадение волос и схождение ногтей.
Почти в 3/4 случаев выявляются гиперемия конъюнктивы, покраснение задней стенки глотки и слизистой рта, малиново-красный цвет языка. Каждую третью менструирующую женщину с СТШ беспокоят болезненность и отечность в области больших и малых половых губ. При тяжелом течении синдрома возникают признаки токсического поражения печени, почек, дыхательной системы с преходящей желтушностью кожи, болью в животе, пояснице, правом подреберье, помутнением мочи, одышкой и т. п.
Кроме клинически выраженного синдрома токсического шока, существует его стертая форма (при первичном проявлении или повторном эпизоде): у пациентки повышается температура, возникает озноб, умеренные мышечные боли, тошнота, рвота, понос, першение в горле. Однако артериальное давление не снижается, и патологическое состояние разрешается без лечения.
Осложнения
При тяжелом течении синдрома наблюдается токсический шок, приводящий к нарушению микроциркуляции и усугубляющий поражение паренхиматозных органов. Возникает дыхательная недостаточность с одышкой и ухудшением оксигенации крови, ДВС-синдром с тромбоэмболией и обильными кровотечениями, нарушается сердечный ритм, в результате острого тубулярного некроза отказывают почки. У пациенток со стрептококковым СТШ более чем в 50% случаев развиваются бактриемия и некротизирующий фасциит. В отдаленном периоде возможна временная потеря ногтей и волос, неврологические нарушения (парестезии, расстройства памяти, повышенная утомляемость).
Диагностика
С учетом полиорганного характера заболевания для постановки диагноза необходимо оценивать как локальные изменения со стороны женских органов, так и признаки нарушения других систем. В комплексное обследование включены:
- Осмотр гинеколога. Выявляются отечность и гиперемия половых органов, в некоторых случаях — скудные выделения гнойного характера из цервикального канала. Пальпаторно может определяться болезненность в области придатков.
- Физикальное обследование. В 100% случаев наблюдается повышение температуры более 38,9°С и падение систолического давления ниже 90 мм рт.ст. (обычно с ортостатическим снижением на 15 мм рт.ст.).
- Общеклинические анализы. Для ОАК характерны лейкоцитоз с высоким нейтрофилезом, сдвиг лейкоцитарной формулы влево, тромбоцитопения, анемия, повышение СОЭ. В общем анализе мочи определяется аномальный мочевой осадок с выщелоченными эритроцитами и стерильной пиурией.
- Биохимический анализ крови. При нарушенной функции печени повышаются уровень билирубина и активность трансфераз (выявляется почти у половины заболевших), при почечной недостаточности возникает азотемия, креатининемия, при поражении мышц — повышенное содержание КФК. В коагулограмме увеличивается протромбиновое время и частичное тромбопластиновое время, определяются продукты деградации фибрина. Анализ крови на электролиты выявляет метаболический ацидоз, снижение уровня кальция, фосфора, натрия, калия.
- Методы определения возбудителя. Для выявления инфекционного агента используют бакпосев мазка из половых органов с антибиотикограммой и посев крови (показан при подозрении на стрептококковый СТШ). Серологические исследования позволяют провести оценку показателей иммунной системы, исключить инфекционные заболевания со сходной клинической картиной.
- Инструментальная диагностика. ЭКГ позволяет своевременно выявить нарушения сердечного ритма. Флюорография или рентгенография ОГК рекомендованы для оценки состояния легких.
Синдром ТШ дифференцируют от сепсиса и инфекционных заболеваний (кори, скарлатины, лептоспироза, гепатита В, пятнистой лихорадки Скалистых гор, брюшного тифа, менингококцемии, вирусных экзантем). Пациентку консультируют анестезиолог-реаниматолог, инфекционист, кардиолог, хирург, уролог, дерматолог, пульмонолог, невропатолог.
Лечение синдрома токсического шока
При выборе схемы лечения синдрома токсического шока важно предусмотреть воздействие на факторы, вызвавшие заболевание, и мероприятия для стабилизации функций пораженных систем. Пациентке показаны:
- Санация бактериального очага. В первую очередь удаляют тампон, диафрагму, колпачок (при их наличии) и промывают влагалище стерильным раствором. При выявлении бактериально обсемененных ран возможно иссечение тканей с участками некроза.
- Антибиотикотерапия. Выбор препарата основан на результатах определения чувствительности к противомикробным средствам. До получения таких данных назначается эмпирическая терапия с учетом вероятного возбудителя и его возможной антибиотикорезистентности. Курс составляет до 10 дней.
- Инфузионная терапия. Ключевой элемент лечения — восстановление внутрисосудистого объема жидкости и стабилизация показателей гемодинамики. В зависимости от характера нарушений пациентке вливают кристаллоидные растворы, электролиты, свежезамороженную плазму крови, тромбоцитарную массу и т. п.
- Вазопрессорные средства. Если коррекция объема внутрисосудистой жидкости не позволяет нормализовать АД, вводят препараты с прессорным эффектом.
При выраженной органной недостаточности пациентке могут назначаться гемодиализ (при острой почечной недостаточности), искусственная вентиляция легких с положительным давлением на выдохе (при респираторном дистресс-синдроме). Ряд авторов отмечают более быстрое выздоровление при назначении кортикостероидов и иммуноглобулинов.
Прогноз и профилактика
В большинстве случаев благодаря достижениям современной гинекологии, своевременной диагностике и лечению пациентки со стафилококковым СТШ выздоравливают за 1—2 недели, при этом смертность на современном этапе составляет 2,6%. Температура и АД нормализуются в течение 2-х суток с момента госпитализации, а лабораторные показатели — на 7—14-ый день. Уровень эритроцитов восстанавливается через 4—6 недель. При стрептококковом токсическом шоке смертность до сих пор остается высокой и достигает 50%. Для профилактики СТШ важно соблюдать рекомендации по использованию тампонов и протоколы обследования перед родами и гинекологическими операциями для своевременного выявления возбудителей.
Читайте также:

