Шок во время отравления
Обновлено: 24.04.2024
Клиника экзотоксического шока. Лечение шока при отравлении
Для восполнения объема циркулирующей крови и борьбы с гнповолемией вводятся жидкости-плазмозаменители: полиглюкип, реополиглюкин, растворы альбумина, поляризующие смеси (гипертонические растворы глюкозы с инсулином). При некомпенсированном метаболическом ацидозе применяются внутривенно 3—8% растворы гидрокарбоната натрия. При тяжелом шоке в торпидной фазе необходимо быстрое струйное введение 1—3 л подогретых жидкостей. По мере восстановления основных показателей гемодинамики (прежде всего центрального венозного давления) переходят на капельное (поддерживающее) введение жидкостей. При хорошем диурезе за сутки может быть введено до 3—6 л и более жидкости. Инфузионная терапия (помимо нормализации гемодинамики) оказывает и дезинтоксицирующее действие на организм.
Для быстрого введения жидкостей проводится катетеризация кубитальной, подключичной или большой поверхностной вены бедра. При интенсивном введении жидкостей нужно помнить о возможной перегрузке малого круга кровообращения.
К фармакологическим средствам, благоприятно влияющим на гемодинамику при шоке, относятся глюкокортикоиды (преднизолон, гидрокортизон и др.). Они уменьшают проницаемость сосудов и оказывают благоприятное влияние на гемодинамику (улучшают периферическое кровообращение, повышают сократительную способность миокарда), стабилизируют лизосомные мембраны и препятствуют вредному действию кининов. Чаще всего преднизолон применяется внутривенно в дозах 90—120 мг (в крайне тяжелых случаях в больших дозах и повторно). Во избежание осложнений терапия глюкокортикоидами проводится непродолжительно (2—7 сут). При острой почечной недостаточности и тяжелой гипергидратации тканей глюкокортикоиды противопоказаны.

Для ликвидации адренергических реакций при шоке (вазоконстрикция) применяются вазодилятаторы — ганглиоблокаторы (пентамин, ганглерон и др.); ганглиоблокирующими и адренолитическими действиями обладает новокаин (50 мл 2% раствора в 500 мл 5% раствора глюкозы) и дроперидол с фентанилом (нейролептанальгезирущая смесь).
Для повышения тонуса сосудов применяются вазопрессоры — мезатон (1—3 мл 1% раствора) и эфедрина гидрохлорид (1—2 мл 5% раствора), для борьбы с токсической коагулопатией и рассеянным внутрисосудистым свертыванием — гепарин до 50 000—75 000 ЕД в сутки внутривенно; при явлениях фибринолиза после введения 2500 ЕД гепарина — 4—5 г фибриногена; для профилактики тром-боэмболических осложнений и улучшения кровообращения в почках, легких и печени — гепарин 20 000 ЕД внутривенно.
При гиповолемическом шоке для угнетения активности кининкалликреиновои системы применяют контрикал или трасилол внутривенно 40 000—60 000 ЕД и более в сутки.
При экзотоксическом шоке, сопровождающемся болевым синдромом (отравления веществами прижигающего действия), применяются аналгезирующие наркотики (морфина гидрохлорйд, промедол и др.), а в последние годы с той же целью — нейролентаналгезирующая смесь (фентанил, дроперидол).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
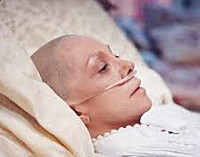
Раковая интоксикация – патологическое состояние, обусловленное распространенным онкологическим процессом и распадом злокачественной опухоли. Возникает на поздних стадиях онкологического заболевания. Может провоцироваться активной противораковой терапией. Проявляется слабостью, утомляемостью, бледностью кожи, сухостью слизистых, тошнотой, рвотой, потерей веса и аппетита, потливостью, гипертермией, костно-суставными болями, нарушениями сна, психическими расстройствами, анемией и снижением иммунитета. Диагноз выставляется на основании анамнеза, клинической симптоматики, результатов анализов и инструментальных исследований. Лечение симптоматическое.
Общие сведения
Раковая интоксикация – комплекс расстройств, возникающих у онкологических больных при отравлении организма продуктами распада злокачественной опухоли. Выявляется преимущественно на терминальных стадиях заболевания, рассматривается как одна из основных причин гибели пациентов. Кроме того, раковая интоксикация часто наблюдается при проведении химиотерапии, является закономерным следствием активного противоракового лечения, вызывающего разрушение опухоли.
Раковая интоксикация может провоцировать нарушения деятельности различных органов и систем, в том числе – почечную и печеночную недостаточность, сепсис и другие тяжелые инфекционные осложнения, что обуславливает важность продуманного подбора дозировок и видов лекарственных препаратов с учетом общего состояния больного, а также наличия тех или иных хронических заболеваний. Лечение осуществляют специалисты в области онкологии.

Причины раковой интоксикации
Одной из отличительных особенностей злокачественной опухоли является ее способность к быстрому неконтролируемому росту. Как правило, темпы роста сосудов, обеспечивающих кровоснабжение новообразования, отстают от скорости роста опухолевой ткани. Злокачественные клетки достаточно устойчивы к гипоксии и могут некоторое время существовать в условиях недостаточного кровоснабжения, однако рано или поздно умирают. Обычно этот процесс наблюдается при опухолях достаточно большого размера. Массовая гибель клеток становится причиной распада новообразования и вызывает раковую интоксикацию.
В организм попадает большое количество продуктов распада, которые провоцируют расстройства всех видов обмена веществ и нарушения деятельности различных органов и систем. Раковая интоксикация становится причиной повышения уровня мочевины. Кристаллы мочевины оседают в почечных канальцах, вызывая развитие почечной недостаточности, которая еще больше усугубляет обменные нарушения. Из-за увеличения количества фосфатов возникает дефицит ионов кальция, следствием которого становятся нарушения работы нервной системы. Повышение уровня кальция негативно влияет на работу сердца. У пациентов с раковой интоксикацией возникают аритмии, в тяжелых случаях возможно прекращение сердечной деятельности. Увеличение количества свободных радикалов стимулирует распад эритроцитов и развитие анемии.
Проявления раковой интоксикации весьма вариабельны. Формирование клинической картины определяется тяжестью состояния пациента, скоростью разрушения новообразования, количеством токсических веществ, попадающих в основной кровоток, особенностями локализации и течения онкологического процесса, масштабом хирургического вмешательства, наличием и объемом кровопотери (как возникшей в ходе операции и послеоперационном периоде, так и связанной с распадом опухоли), присоединением воспалительных осложнений, дозой химиопрепарата и другими факторами.
Симптомы раковой интоксикации
Наиболее постоянными признаками раковой интоксикации являются прогрессирующая слабость и беспричинная утомляемость. Наблюдаются характерные изменения внешнего вида: дефицит массы тела (в тяжелых случаях – вплоть до кахексии), бледный, землистый или желтоватый оттенок кожи, сухость кожи и слизистых оболочек. Возможен цианоз дистальных отделов конечностей. У больных с нарушениями функции печени выявляется иктеричность склер. Пациенты с раковой интоксикацией предъявляют жалобы на усиленное потоотделение. Как правило, потливость более выражена в ночное время.
В ходе опроса врач устанавливает, что резкое снижение веса произошло в течение короткого промежутка времени и сопровождалось нарушениями аппетита: отвращением к еде (особенно – к мясным продуктам), извращением вкуса и т. д. Кроме того, при раковой интоксикации наблюдаются диспепсические расстройства: тошнота, рвота и нарушения стула. Возможны запоры, поносы или чередование запоров и поносов. Отмечается длительное повышение температуры до субфебрильных (при некоторых заболеваниях – до фебрильных) цифр. Возникают боли в костях и суставах.
Больные с раковой интоксикацией могут сообщать о периодических мигренях и приступах головокружения. Расспрос пациентов и их родственников позволяет выявить изменения психического и эмоционального статуса. Могут наблюдаться апатия, раздражительность и эмоциональная лабильность. Раковая интоксикация нередко сопровождается депрессивными расстройствами. Возможны нарушения сна: бессонница, поверхностный сон, трудности при засыпании, ночные и ранние пробуждения. Часто обнаруживаются нарушения сердечного ритма. При раковой интоксикации существует высокая вероятность развития тромбозов и склонность к возникновению инфекционных осложнений. В анализе крови обнаруживаются признаки анемии (обычно – умеренной нормохромной).
Диагностика раковой интоксикации
Диагноз выставляется с учетом анамнеза, жалоб, данных объективного осмотра и результатов дополнительных исследований. Решающую роль в определении причины раковой интоксикации играет выявление основной патологии. При характерной клинической картине и отсутствии установленного диагноза онкологического заболевания пациентам с подозрением на раковую интоксикацию назначают комплексное обследование, которое включает в себя общие анализы крови и мочи, биохимический анализ крови, анализ крови на онкомаркеры, рентгенографию грудной клетки, сцинтиграфию костей скелета, УЗИ брюшной полости, УЗИ малого таза, гинекологический осмотр и другие исследования. План обследования определяется индивидуально.
При уже диагностированном онкологическом заболевании требуется оценка выраженности раковой интоксикации для определения тактики лечения (составления плана химиотерапии, принятия решения об оперативном вмешательстве, подбора симптоматических препаратов и т. д.). Для оценки тяжести раковой интоксикации используются стандартные показатели крови: уровень мочевины, креатинина и С-реактивного белка, реактивный ответ нейтрофилов, лейкоцитарный индекс интоксикации и т. д. Наряду с перечисленными показателями могут потребоваться данные о состоянии различных органов и систем больного с раковой интоксикацией, полученные при проведении ЭКГ, анализов мочи, анализов крови на гормоны и других исследований.
Лечение раковой интоксикации
Лечение симптоматическое, включает в себя мероприятия по детоксикации, устранению или смягчению клинических проявлений и коррекции нарушений деятельности различных органов и систем. Осуществляют энтеросорбцию, гемосорбцию и аппликационную сорбцию. Пациентам выписывают сорбенты для приема внутрь. При тяжелой раковой интоксикации применяют гемодиализ или плазмаферез. При наличии открытых ран в области распада опухоли проводят перевязки с сорбентами местного действия.
При рвоте больным с раковой интоксикацией назначают противорвотные средства (домперидон, метоклопрамид), при запорах – слабительные для перорального приема и ректальные свечи (макрогол, препараты сены, бисакодил, касторовое масло и пр.). При анемии используют препараты железа внутрь и парентерально, применяют эритропоэтин. Выбор медикаментов при раковой интоксикации, сопровождающейся психическими расстройствами, зависит от вида и тяжести расстройств. При эмоциональной лабильности назначают мягкие седативные средства, при нарушениях сна – снотворные, при депрессии – транквилизаторы и антидепрессанты.
Прогноз определяется причинами раковой интоксикации, тяжестью основного процесса, возрастом и общим состоянием больного, наличием и тяжестью сопутствующей соматической патологии. Состояния, возникающие при распаде крупных распространенных опухолей в запущенных стадиях заболевания, являются прогностически неблагоприятными. Больные с раковой интоксикацией погибают от кровотечений, нарушений деятельности органов, пораженных первичной опухолью или гематогенными метастазами, а также от истощения, инфекционных осложнений, почечной недостаточности, тромбозов, нарушений сердечной деятельности или полиорганной недостаточности, обусловленной обменными расстройствами и ослаблением организма. При раковой интоксикации, возникшей в процессе химиотерапии, прогноз может быть благоприятным. При приеме химиопрепаратов это – временное состояние, являющееся частью лечебного процесса.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
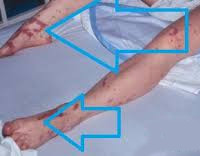
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Синдром токсического шока — тяжелое острое полиорганное поражение, вызванное экзотоксинами золотистого стафилококка или пиогенного стрептококка. Проявляется внезапным повышением температуры до 38,9°С и более, падением артериального давления, эритематозными кожными высыпаниями с последующим шелушением, профузным поносом, рвотой, признаками поражения разных органов и систем. Диагноз СТШ устанавливают на основе клинической картины, данных физикального обследования, лабораторных, в том числе бактериологических, анализов. Лечение предусматривает санацию бактериального очага, назначение антибиотиков, инфузионной и симптоматической терапии.
МКБ-10
Общие сведения
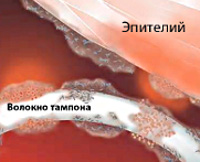
Синдром токсического шока (СТШ) впервые диагностирован в 1978 г. у семи детей со стафилококковой инфекцией. Специалисты в области гинекологии столкнулись с ним двумя годами позже, отметив связь развития синдрома у молодых женщин с использованием суперадсорбирующих гигиенических тампонов во время месячных. Абсолютное большинство пациенток — женщины в возрасте 17-30 лет. Приблизительно у половины из них развитие синдрома связано с менструацией. В четверти случаев неменструального СТШ заболевание возникает в послеродовом периоде у носительниц Staphylococcus aureus, в 75% — в результате других причин (кожного и подкожного инфицирования, перенесенных операций с тампонированием и пр.).

Причины СТШ
Синдром токсического шока вызывают экзотоксин-продуцирующие микроорганизмы, оказывающие системное воздействие на разные органы и ткани, — золотистый стафилококк (Staphylococcus aureus) и пиогенный β-гемолитический стрептококк группы А (Streptococcus pyogenes). В большинстве случаев заболевание возникает не в момент первичного заражения бактериями, а на фоне носительства инфекционных возбудителей при воздействии следующих предрасполагающих факторов:
- Использование тампонов. Вероятность развития СТШ возрастает при пользовании гигиеническими средствами с повышенными адсорбирующими свойствами и нарушении рекомендуемой частоты их замены.
- Использование интравагинальных контрацептивов. Наличие во влагалище диафрагм, губок, колпачков создает благоприятные условия для размножения микроорганизмов.
- Нарушение целостности слизистых оболочек. При травмах половых органов, наличии в матке остатков плацентарной ткани, плодных оболочек, крови после родов и гинекологических операций возникают оптимальные условия для бактериального обсеменения и проникновения микроорганизмов или их токсинов в кровь.
Неменструальный синдром токсического шока может осложнять хирургические процедуры, при которых применяется перевязочный материал, накапливающий кровь (операции на полости носа с использованием турунд, тампонирование ран и др.), и травматические повреждения кожи. Сочетание указанных факторов с вирусными заболеваниями (ветрянкой, гриппом), приемом иммуносупрессивных препаратов повышает риск развития токсемии и бактериемии.
Патогенез
Ключевую роль в развитии синдрома токсического шока играют механические и химические воздействия, которые способствуют размножению бактерий и влияют на проницаемость тканей. Пусковым моментом служит проникновение в кровь значительных количеств специфических токсинов (TSST) и их взаимодействие с Т-лимфоцитами. В результате массивно высвобождаются цитокины, вызывающие полиорганную токсическую реакцию. Расширяются сосуды и повышается проницаемость их стенки, что приводит к перемещению плазмы крови и сывороточных протеинов во внесосудистое пространство. При этом наблюдается резкое падение давления, возникают отеки, нарушается коагуляция, повышается температура. Под влиянием опосредованных иммунных реакций и прямого действия токсинов поражаются кожа, паренхима печени, легких и других органов.
Симптомы СТШ
У менструирующих женщин, использующих тампоны, признаки СТШ появляются на 3—5-й день менструации. При синдроме токсического шока, осложнившем роды или гинекологические операции, патология проявляется в первые 2 дня послеродового или послеоперационного периода. Как правило, заболевание возникает остро. В редких случаях наблюдается продром в виде общего недомогания, тошноты, головной и мышечных болей. Первым признаком СТШ становится сильный озноб с повышением температуры до 39—40°С, после чего в течение 1—4 суток разворачивается полная клиническая картина.
Практически у всех пациенток возникают мышечная слабость и диффузные боли в мышцах, особенно в мускулатуре проксимальных отделов конечностей, брюшного пресса и спины. Часто беспокоят боли в суставах. Более чем 90% заболевших отмечают упорную рвоту и профузный водянистый понос, скудное количество мочи. Возникают першение в горле, парестезии, головная боль, светобоязнь, головокружение и обмороки на фоне падения АД. В ряде случаев беспокоит кашель, болезненные ощущения при глотании. В острой стадии, длящейся от 24 до 48 часов, пациентка выглядит заторможенной и дезориентированной.
Специфическое проявление синдрома — кожные высыпания в виде диффузного покраснения, которое напоминает солнечный ожог и начинает постепенно бледнеть на протяжении первых 3 дней. В последующем возникает грубое шелушение кожи, особенно заметное на подошвах и ладонях. У некоторых женщин покраснение носит характер пятен различных размеров, к которым присоединяются мелкие узелковые высыпания или точечные петехиальные кровоизлияния. Почти у четверти заболевших на 5—10-е сутки возникает сильный зуд на фоне пятнисто-узелковой сыпи. Практически у 100% пациенток к концу 1—2-ой недели наблюдается неглубокое генерализованное чешуйчатое отслаивание кожного эпителия с более выраженным пластинчатым шелушением ладоней, подошв, пальцев рук и ног. Половина пациенток, перенесших СТШ, к концу 2—3-го месяца отмечает выпадение волос и схождение ногтей.
Почти в 3/4 случаев выявляются гиперемия конъюнктивы, покраснение задней стенки глотки и слизистой рта, малиново-красный цвет языка. Каждую третью менструирующую женщину с СТШ беспокоят болезненность и отечность в области больших и малых половых губ. При тяжелом течении синдрома возникают признаки токсического поражения печени, почек, дыхательной системы с преходящей желтушностью кожи, болью в животе, пояснице, правом подреберье, помутнением мочи, одышкой и т. п.
Кроме клинически выраженного синдрома токсического шока, существует его стертая форма (при первичном проявлении или повторном эпизоде): у пациентки повышается температура, возникает озноб, умеренные мышечные боли, тошнота, рвота, понос, першение в горле. Однако артериальное давление не снижается, и патологическое состояние разрешается без лечения.
Осложнения
При тяжелом течении синдрома наблюдается токсический шок, приводящий к нарушению микроциркуляции и усугубляющий поражение паренхиматозных органов. Возникает дыхательная недостаточность с одышкой и ухудшением оксигенации крови, ДВС-синдром с тромбоэмболией и обильными кровотечениями, нарушается сердечный ритм, в результате острого тубулярного некроза отказывают почки. У пациенток со стрептококковым СТШ более чем в 50% случаев развиваются бактриемия и некротизирующий фасциит. В отдаленном периоде возможна временная потеря ногтей и волос, неврологические нарушения (парестезии, расстройства памяти, повышенная утомляемость).
Диагностика
С учетом полиорганного характера заболевания для постановки диагноза необходимо оценивать как локальные изменения со стороны женских органов, так и признаки нарушения других систем. В комплексное обследование включены:
- Осмотр гинеколога. Выявляются отечность и гиперемия половых органов, в некоторых случаях — скудные выделения гнойного характера из цервикального канала. Пальпаторно может определяться болезненность в области придатков.
- Физикальное обследование. В 100% случаев наблюдается повышение температуры более 38,9°С и падение систолического давления ниже 90 мм рт.ст. (обычно с ортостатическим снижением на 15 мм рт.ст.).
- Общеклинические анализы. Для ОАК характерны лейкоцитоз с высоким нейтрофилезом, сдвиг лейкоцитарной формулы влево, тромбоцитопения, анемия, повышение СОЭ. В общем анализе мочи определяется аномальный мочевой осадок с выщелоченными эритроцитами и стерильной пиурией.
- Биохимический анализ крови. При нарушенной функции печени повышаются уровень билирубина и активность трансфераз (выявляется почти у половины заболевших), при почечной недостаточности возникает азотемия, креатининемия, при поражении мышц — повышенное содержание КФК. В коагулограмме увеличивается протромбиновое время и частичное тромбопластиновое время, определяются продукты деградации фибрина. Анализ крови на электролиты выявляет метаболический ацидоз, снижение уровня кальция, фосфора, натрия, калия.
- Методы определения возбудителя. Для выявления инфекционного агента используют бакпосев мазка из половых органов с антибиотикограммой и посев крови (показан при подозрении на стрептококковый СТШ). Серологические исследования позволяют провести оценку показателей иммунной системы, исключить инфекционные заболевания со сходной клинической картиной.
- Инструментальная диагностика. ЭКГ позволяет своевременно выявить нарушения сердечного ритма. Флюорография или рентгенография ОГК рекомендованы для оценки состояния легких.
Синдром ТШ дифференцируют от сепсиса и инфекционных заболеваний (кори, скарлатины, лептоспироза, гепатита В, пятнистой лихорадки Скалистых гор, брюшного тифа, менингококцемии, вирусных экзантем). Пациентку консультируют анестезиолог-реаниматолог, инфекционист, кардиолог, хирург, уролог, дерматолог, пульмонолог, невропатолог.
Лечение синдрома токсического шока
При выборе схемы лечения синдрома токсического шока важно предусмотреть воздействие на факторы, вызвавшие заболевание, и мероприятия для стабилизации функций пораженных систем. Пациентке показаны:
- Санация бактериального очага. В первую очередь удаляют тампон, диафрагму, колпачок (при их наличии) и промывают влагалище стерильным раствором. При выявлении бактериально обсемененных ран возможно иссечение тканей с участками некроза.
- Антибиотикотерапия. Выбор препарата основан на результатах определения чувствительности к противомикробным средствам. До получения таких данных назначается эмпирическая терапия с учетом вероятного возбудителя и его возможной антибиотикорезистентности. Курс составляет до 10 дней.
- Инфузионная терапия. Ключевой элемент лечения — восстановление внутрисосудистого объема жидкости и стабилизация показателей гемодинамики. В зависимости от характера нарушений пациентке вливают кристаллоидные растворы, электролиты, свежезамороженную плазму крови, тромбоцитарную массу и т. п.
- Вазопрессорные средства. Если коррекция объема внутрисосудистой жидкости не позволяет нормализовать АД, вводят препараты с прессорным эффектом.
При выраженной органной недостаточности пациентке могут назначаться гемодиализ (при острой почечной недостаточности), искусственная вентиляция легких с положительным давлением на выдохе (при респираторном дистресс-синдроме). Ряд авторов отмечают более быстрое выздоровление при назначении кортикостероидов и иммуноглобулинов.
Прогноз и профилактика
В большинстве случаев благодаря достижениям современной гинекологии, своевременной диагностике и лечению пациентки со стафилококковым СТШ выздоравливают за 1—2 недели, при этом смертность на современном этапе составляет 2,6%. Температура и АД нормализуются в течение 2-х суток с момента госпитализации, а лабораторные показатели — на 7—14-ый день. Уровень эритроцитов восстанавливается через 4—6 недель. При стрептококковом токсическом шоке смертность до сих пор остается высокой и достигает 50%. Для профилактики СТШ важно соблюдать рекомендации по использованию тампонов и протоколы обследования перед родами и гинекологическими операциями для своевременного выявления возбудителей.
Острая сердечно-сосудистая недостаточность при острых отравлениях. Шок при отравлении
Острая сердечно-сосудистая недостаточность при острых отравлениях является одной из наиболее частых причин смертельных исходов. В настоящее время экзогенные отравления рассматриваются с позиции реакции организма, находящегося в экстремальных условиях (стресс-реакция). Одним из частых вариантов такой реакции на воздействие токсического фактора является своеобразный симптомокомплекс экзотоксического шока. В этом сложном патологическом процессе острой сердечно-сосудистой (преимущественно сосудистой) недостаточности принадлежит главная роль,
При экзотоксическом шоке (как и при болевом) выделяют две фазы — компенсированную (эректильную) и декомпенсированную (торпидную). В эректильной фазе шока артериальное давление повышено, при этом отмечается снижение центрального венозного давления, уменьшение сердечного выброса, массы циркулирующей крови, повышение периферического сопротивления; в торпидной фазе все эти показатели понижены еще значительнее.
Так, центральное венозное давление достигает нуля и даже отрицательного значения.

За счет падения тонуса сосудов в большей мере расширяется венозное русло — наблюдается перераспределение крови в организме. Возникает гиповолемия сначала относительная, а затем абсолютная, причем последняя связана с капилляропатией и плазмореей. Этому способствует симпатическая стимуляция, приводящая к спазму сосудов, нарушению питания тканей, повышению сосудистой проницаемости, накоплению в организме недоокисленных продуктов метаболизма.
В развитии общей цепи патологического процесса при шоке большое значение придается изменению функции системы гипофиз — кора надпочечников (сначала наблюдается гиперфункция, а затем истощение функции этой системы). Не последняя роль принадлежит и кининовой системе. Свободные кинины, являясь вазоактивными полипептидами, увеличивают сосудистую проницаемость, нарушают функцию миокарда. Увеличение кининов при шоке связывают с повышением протеолитической активности поджелудочной железы, стимулирующей кининовую систему. Существенное значение при шоке имеют также изменения коагулирующих и реологических свойств крови. В основе этого патологического процесса лежит коагулопатия потребления.
Клинически коагулопатия проявляется в виде синдрома рассеянного внутрисосудистого свертывания крови. Характерна стадийность развития коагулопатии: гиперкоагуляция постепенно переходит в гипокоагуляцию и заканчивается фибринолизом. Для раннего периода (гиперкоагуляции) характерна агрегация эритроцитов и тромбоцитов, стаз крови в капиллярах, тромбообразование, изменение реологических свойств крови (увеличение ее вязкости).
Конечным звеном экзотоксического шока является синдром нарушения микроциркуляции, приводящий к повышению проницаемости сосудистой стенки, плазмопотере, гиповолемии, гипоксии, обменным нарушениям в тканях и др.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

