Сифилитическая пузырчатка новорожденных диф диагностика
Обновлено: 24.04.2024
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
РМАПО Минздрава России, Москва, Россия
РМАПО Минздрава России, Москва, Россия
Диагностика буллезных дерматозов с поражением слизистой оболочки рта
Журнал: Стоматология. 2015;94(4): 49‑52
Буллезные дерматозы, при которых поражается слизистая оболочка рта (СОР), в большинстве случаев являются аутоиммунными заболеваниями. Наиболее распространенные заболевания этой группы — вульгарная пузырчатка, буллезный пемфигоид, плоский лишай. На ранних стадиях пузырных дерматозов, особенно при изолированном поражении СОР, диагноз не всегда удается поставить своевременно; требуется междисциплинарный подход к дифференциальной диагностике.
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
РМАПО Минздрава России, Москва, Россия
РМАПО Минздрава России, Москва, Россия
При буллезных дерматозах изолированное поражение полости рта встречается в 60—90% случаев. Диагноз при первичном обращении за медицинской помощью больным с пузырными дерматозами ставится лишь в 9—30% случаев [4, 9].
На ранних стадиях развития заболевания при изолированном поражении слизистой оболочки рта (СОР) особую сложность представляет дифференциальная диагностика вульгарной пузырчатки, буллезного пемфигоида и плоского лишая (ПЛ), которая проводится с учетом клинических, патоморфологических, иммунологических признаков.
Вульгарная пузырчатка (пемфигус) — тяжелое аутоиммунное буллезное заболевание, характеризующееся нарушением межклеточных контактов в супрабазальных слоях эпидермиса, обусловленным продукцией IgG к белкам межклеточной адгезии, приводящим к акантолизу и образованию пузырей и эрозий на коже и (или) слизистых оболочках [6, 9, 11]. Пузырчаткой чаще болеют женщины трудоспособного возраста (40—60 лет).
Основной мишенью аутоантител являются структурные элементы десмосом на клеточной поверхности кератиноцитов: десмоглеины 1-го типа (молекулярная масса антигена — 160 kD), десмоглеины 3-го типа (молекулярная масса — 130 kD), а также десмоколлины, адгезирующие молекулы кадгеринового типа — трансмембранные гликопротеины с внеклеточным доменом — и другие белки [10].
При вульгарной пузырчатке в 67—85% случаев первые признаки заболевания отмечаются на слизистых оболочках. Поражения СОР длительное время (до нескольких лет от начала заболевания) остаются основным симптомом [4, 12].
Больных беспокоят резкая болезненность в местах высыпаний, затруднения при жевании и глотании, выраженная саливация, глубокие трещины в углах рта, препятствующие его открыванию [17].
Клиническая картина вульгарной пузырчатки характеризуется образованием пузырей размером от 1—2 мм до 10 см и более с тонкой покрышкой, прозрачным или мутным содержимым, овальной, грушевидной или неправильной формы на видимо неизмененных слизистых оболочках зева, щек (преимущественно в ретромолярной области), боковой поверхности языка, твердого и мягкого неба, подъязычной области, гортани, глотки, пищевода. Пузыри, быстро вскрываясь, образуют легкокровоточащие эрозии розовато-желтоватого цвета с блестящей влажной поверхностью, покрытые легко снимающимся фибринозным налетом, окаймленные обрывками эпителия (остатки покрышки пузыря) [5, 17] (рис. 1,). В некоторых случаях эрозии быстро увеличиваются в размерах, поражая обширные поверхности СОР. Преобладание эрозий над пузырными элементами на СОР приводит к трудностям в диагностике пузырчатки. Характерна медленная эпителизация эрозий даже при адекватной глюкокортикостероидной терапии [7].

Рис. 1. Клинические и морфологические признаки вульгарной пузырчатки. а — эрозии на слизистой оболочке рта у больного М. с вульгарной пузырчаткой; б — патоморфологическая картина в биоптате, взятом со слизистой оболочки рта: акантоз эпителия, надбазальный пузырь, акантолитические клетки в полости пузыря; в — реакция прямой иммунофлюоресценции (конфокальная лазерная сканирующая микроскопия ×1000). Фиксация IgG в межклеточных промежутках эпидермиса у больной вульгарной пузырчаткой.
Симптомы Никольского, Асбо-Хансена у больных пузырчаткой — положительные. При цитологическом методе диагностики в мазках-отпечатках со дна эрозий обнаруживаются акантолитические клетки.
Характерными признаками при патоморфологическом исследовании биоптатов, полученных из очага поражения на СОР, являются супрабазальные щели и пузыри (в некоторых случаях — в нижних отделах шиповидного слоя эпидермиса), в полости которых присутствуют нити фибрина и акантолитические клетки округлой формы с эозинофильной цитоплазмой и крупным гиперхромным ядром, которые могут располагаться изолированно или в виде небольших скоплений. В полости пузыря возможно наличие единичных эозинофильных лейкоцитов [16] (см. рис. 1, б). Биопсия неповрежденного пузыря СОР крайне затруднительна вследствие высокой ранимости покрышек пузырей.
Диагностическое значение имеют результаты РИФ, получаемые при исследовании биоптатов видимо непораженной кожи. При вульгарной пузырчатке фиксированный иммуноглобулин IgG (реже — IgA, IgM и компоненты комплемента) выявляются в коже уже на ранних стадиях заболевания и локализуются в межклеточных промежутках шиповидного слоя эпидермиса (см. рис. 1, в). В отдельных случаях отложение иммуноглобулинов и компонентов комплемента наблюдается не только в межклеточном пространстве эпидермиса, что характерно для вульгарной пузырчатки, но и в зоне дермоэпидермального соединения, что осложняет дифференциальную диагностику пемфигуса и пемфигоида [3, 13].
Методом иммуноферментного анализа (серологический метод диагностики) выявляют циркулирующие антитела к десмоглеинам 1-го и 3-го типов. При вульгарной пузырчатке с изолированным поражением СОР определяются антитела к десмоглеину 3-го типа, тогда как при наличии высыпаний на слизистых оболочках и коже обнаруживаются антитела к десмоглеину как 1-го типа, так и 3-го. Уровень аутоантител к десмоглеинам статистически значимо коррелирует со степенью тяжести заболевания [12].
Буллезный пемфигоид — приобретенный аутоиммунный субэпидермальный пузырный дерматоз доброкачественного течения, характеризующийся отложением IgG к трансмембранным гликопротеинам десмосом вдоль базальной мембраны и чаще встречающийся у пожилых больных (60—70 лет) [11, 12].
При буллезном пемфигоиде образуются антитела к белкам базальной мембраны: гликопротеину внутренней пластинки полудесмосомы BP230 (BPAG1; молекулярная масса — 230 kD) и трансмембранному гемидесмосомальному гликопротеину BP180 (BPAG2; молекулярная масса — 180 kD [13].
Изолированное поражение СОР при буллезном пемфигоиде встречается в 10—20% случаев. Больных беспокоит зуд при появлении высыпаний.
Для клинической картины буллезного пемфигоида характерны пузыри на слизистых оболочках щек и десен, а также твердого неба, редко — глотки, гортани, размерами от нескольких миллиметров до 5—10 см в диаметре и больше, с толстой покрышкой, серозным или серозно-геморрагическим содержимым на гиперемированном фоне, сохраняющиеся в течение нескольких дней [11].
При вскрытии пузырей образуются болезненные эрозии с четкими границами без тенденции к периферическому росту, легкокровоточащие, без фибринозного налета, покрытые серозными или серозно-геморрагическими корками, сравнительно быстро эпителизирующиеся с образованием пигментации [9] (рис. 2, а,).

Рис. 2. Клинические и морфологические признаки буллезного пемфигоида. а, б — эрозии на слизистой оболочке рта у больного К. с буллезным пемфигоидом; в — патоморфологическая картина при буллезном пемфигиде; г — реакция прямой иммунофлюоресценции (конфокальная лазерная сканирующая микроскопия ×1000). Фиксация IgG вдоль базальной мембраны у больного буллезным пемфигоидом.
Симптом Никольского на видимо неизмененной коже — отрицательный, однако при потягивании за обрывки покрышки пузыря определяется симптом перифокальной отслойки на расстоянии более 2—3 мм. Симтом Асбо-Хансена — положительный.
У больных пемфигоидом при цитологическом методе диагностики в мазках-отпечатках, полученных со дна свежих пузырей, обнаруживается большое количество эозинофилов (>20—30%), акантолитические клетки отсутствуют [11].
При патоморфологическом исследовании биоптатов определяется субэпидермальная полость или пузырь. В большинстве случаев полость пузыря и подлежащие участки дермы содержат многочисленные эозинофильные лейкоциты, лимфоциты и примесь нейтрофильных лейкоцитов. Межклеточный отек с проникновением эозинофильных лейкоцитов в эпидермис (эозинофильный спонгиоз) может наблюдаться в эпидермисе по периферии полости [14] (см. рис. 2, б).
При непрямой РИФ выявляется линейное отложение IgG вдоль базальной мембраны (см. рис. 2, в). РИФ выявляет циркулирующие IgG к белкам базальной мембраны в 65—90% случаев [10].
На ранних стадиях развития при изолированном поражении СОР дифференциальная диагностика вульгарной пузырчатки и буллезного пемфигоида представляет особую сложность (табл. 1).

Таблица 1. Диагностические признаки вульгарной пузырчатки и буллезного пемфигоида
ПЛ — хроническое аутоиммунное, опосредованное Т-клетками, в том числе CD4 + и CD8 + , заболевание кожи и слизистых оболочек, отличающееся полиморфизмом высыпаний. ПЛ встречается в любом возрасте, чаще — у женщин 30—60 лет [2, 7, 8].
В развитии воспалительного процесса в эпителии СОР при ПЛ важную роль играют как Т-хелперы, так и Т-киллеры. Однако непосредственно в эпителиальный пласт проникают только CD8 + Т-клетки; CD4 + Т-лимфоциты и В-клетки в эпителии отсутствуют. Обнаружение большой фракции CD4 + -лимфоцитов в инфильтратах подтверждает роль Т-хелперных клеток в формировании местной иммунной реакции. Вместе с тем только CD8 + Т-клетки оказывают непосредственное разрушающее действием на эпителиоциты [1]. При разных формах ПЛ СОР отмечается поликлональная активация В-клеток — увеличение уровня в сыворотке IgG, IgM, IgA. В то же время происходит снижение уровня IgE [7].
Поражение СОР при ПЛ (изолированное или в сочетании с поражением кожи) встречается в 60—80% случаев. Больных беспокоят болезненность при приеме пищи, жжение.
Клиническая картина ПЛ многообразна и характеризуется множеством форм: типичная (кератотические узелки образуют сетку на слизистой); экссудативно-гиперемическая; эрозивно-язвенная; буллезная и атипичная. Наиболее часто при ПЛ поражена слизистая оболочка щек, языка, ретромолярное пространство, меньше — десна, дно полости рта, твердое небо [15].
Тяжелое течение заболевания отмечается при эрозивно-язвенной (встречается в 23% случаев) и буллезной формах П.Л. При эрозивно-язвенной форме появляются эрозии (реже — язвы) полигональной формы, покрытые фибринозным налетом, склонные к слиянию, вокруг которых на гиперемированном и отечном основании располагаются типичные папулезные высыпания (рис. 3, а,). Буллезная форма характеризуется появлением наряду с типичными папулезными высыпаниями на СОР пузырьков и пузырей размерами от 2—3 мм до 1—1,5 см в диаметре, с серозным или серозно-геморрагическим содержимым, с толстой покрышкой, сохраняющихся до 2 сут. Пузыри формируются только в пределах папулезных элементов и лишь при генерализованном процессе могут возникать и на видимо неизмененной коже. При вскрытии пузырей образуются эрозии, покрытые фибринозным налетом, геморрагическими или серозно-геморрагическими корками (геморрагическая форма ПЛ). Дно эрозий легко кровоточит [11, 14] (см. рис. 3, б).

Рис. 3. Клинические и морфологические признаки плоского лишая. а — эрозивно-язвенная форма плоского лишая; б — буллезная форма плоского лишая; в — патоморфологическая картина при плоском лишае. Электронограмма. Шиповатая клетка с признаками активации лизосомального аппарата. Крупные лизосомы (Л) и формирование на базе лизосомы лизофагосомы (ЛФ). Вымывание матрикса митохондрии (М). Десмосомы (Д) эпителиальных клеток; г — электроннограмма. Группа мегамитохондрий с атипическими мембранными структурами; д — реакция непрямой иммунофлюоресценции, окрашивание на CD45. Массивная лимфоидная инфильтрация слизистой оболочки рта при плоском лишае. Диапедез лимфоцитов, множество дендритных клеток в эпителии; е — патологическая экспрессия молекулы CD29 на эпителиальных клетках слизистой оболочки рта при плоском лишае.
Разные формы ПЛ могут трансформироваться одна в другую [1, 8, 15]. На слизистой оболочке щек и красной кайме губ в редких случаях ПЛ может озлокачествляться [11, 14].
Важное диагностическое значение при ПЛ имеют изоморфная реакция Кебнера (появление новых элементов на месте раздражения СОР под действием экзогенных факторов); тусклое белое свечение пораженного участка в лучах Вуда.
В мазках-отпечатках обнаруживают разрушенные, безъядерные эпителиальные клетки или клетки с эксцентрично расположенными ядрами, обилие кокковой флоры.
Патоморфологическими признаками ПЛ являются: субэпидермальные полости, гипер- и паракератоз; гипергранулез; лимфоцитарный инфильтрат; вакуольная дегенерация в шиповидном слое; акантоз, неравномерная гиперплазия эпителия; периваскулиты; фрагменты малых слюнных желез, окруженные инфильтратом круглоклеточного типа [1, 16] (см. рис. 3, в).
Главной особенностью строения эпителиального покрова СОР при ПЛ, по данным Е.В. Ивановой (2003), является появление апоптозных телец и гигантских митохондрий в базальном и шиповидных слоях (см. рис. 3, г). Типичные морфологические признаки — проникновение в базальный слой эпидермиса лимфоцитов и выраженная реакция в нем дендритных клеток (см. рис. 3, д). В участках поражения при ПЛ на клетках СОР наблюдается снижение экспрессии молекул CD 29 в клетках базального слоя [1] (см. рис. 3, е).
При исследовании методом прямой иммунофлюоресценции на границе между эпидермисом и дермой выявляют обильные скопления фибрина, в тельцах Сиватта — IgM, реже — IgA, IgG и компонент комплемента [11] (табл. 2).

Таблица 2. Дифференциальная диагностика вульгарной пузырчатки и ПЛ
Врачи разных специальностей испытывают трудности в дифференциальной диагностике буллезных дерматозов при изолированном поражении СОР. Диагностические ошибки приводят к отсрочке терапии больных с тяжелыми дерматозами: вульгарной пузырчаткой, буллезным пемфигоидом, ПЛ и другими.
Основными моментами, препятствующими своевременному установлению диагноза, являются:
— многообразие заболеваний, при которых патологические изменения (элементы) локализуются на СОР, и сходство их клинических проявлений;
— быстрые изменения клинической картины под воздействием экзогенных и эндогенных факторов;
— преимущественно хроническое рецидивирующее течение заболеваний.
В повседневной практической деятельности врачи зачастую ставят диагноз пузырных дерматозов только на основании результатов клинических и (или) цитологических исследований, что часто приводит к диагностическим ошибкам. Ни один из современных клинических и лабораторных методов диагностики не позволяет с абсолютной достоверностью поставить диагноз, в связи с чем для своевременной постановки диагноза и назначения адекватной терапии целесообразны тщательное обследование больного врачами смежных специальностей и использование совокупности данных клинического, морфологического, иммунологического тестирования в качестве дифференциально-диагностических критериев.
Таким образом, при изолированном поражении СОР при буллезных заболеваниях актуально применение междисциплинарного подхода, что может помочь распознать и диагностировать ранние проявления этих заболеваний.
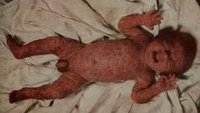
Эпидемическая пузырчатка новорожденных — это высоко контагиозное стафилококковое поражение кожи новорожденных, проявляющееся возникновением мелких пузырьков с гнойным содержимым, которые увеличиваются и лопаются с образованием эрозий. Может сопровождаться поражением слизистых оболочек. Диагностировать эпидемическую пузырчатку новорожденных позволяет возраст заболевших, типичная клиника и результаты бактериологических исследований жидкости из пузырей и отделяемого эрозий. Лечение включает применение антибиотиков, витаминов, альбумина, ванны с марганцовкой, УФО, вскрытие пузырей и обработку эрозий. Учитывая контагиозность эпидемической пузырчатки новорожденных, обязательно проведение карантинных мероприятий и дезинфекции.
МКБ-10
Общие сведения
Эпидемическая пузырчатка новорожденных (пемфигоид пиококковый) - острая стафилодермия, протекающая с образованием множественных пустул на кожном покрове и нарушением общего состояния младенца. Заболевание является высоко заразным и может быстро распространяться среди новорожденных, вызывая эпидемические вспышки в родильных домах. До начала эры антибиотикотерапии смертность детей от пиококкового пемфигоида достигала 50-60%. Несмотря на достижения современной педиатрии, заболевание не утратило своей актуальности и эпидемиологической опасности.

Причины
Возбудителем эпидемической пузырчатки новорожденных является золотистый стафилококк. Инфицирование происходит от медицинского персонала или матерей, которые переболели пиодермией или являются носителями стафилококка. Наиболее предрасположены к развитию заболевания:
- дети, получившие родовую травму;
- дети, матери которых перенесли тяжелый токсикоз беременных.
Высокая контагиозность заболевания обуславливает его быструю передачу от одного ребенка к другому через руки медперсонала, что может стать причиной вспышки эпидемической пузырчатки новорожденных в родильном доме.
Симптомы пузырчатки новорожденных
Эпидемическая пузырчатка новорожденных возникает в первые 10 дней жизни ребенка. Она начинается с подъема температуры тела и беспокойства новорожденного. Затем на коже появляются высыпания в виде мелких пузырьков, содержащих серозно-желтоватую жидкость. Элементы сыпи при эпидемической пузырчатке новорожденных чаще всего располагаются в околопупочной области, на животе, ягодицах и спине, а также на коже конечностей. Наиболее редко встречаются высыпания на коже ступней и ладоней. Пузырьки быстро растут в размерах, их содержимое становиться гнойным и мутным. Процесс интенсивно распространяется по телу ребенка и может захватывать слизистую ротовой полости, глаз, преддверия носа и гениталий.
Вскрытие пузырей сопровождается излитием гнойного содержимого и образованием ярких эрозивных поверхностей красного цвета. Эрозии покрываются серозно-гнойными корочками и эпителизуются. Характерно толчкообразное течение заболевания с высыпаниями новых пузырьков через короткие промежутки времени. При неосложненном варианте эпидемической пузырчатки новорожденных через 3-5 недель наблюдается выздоровление ребенка.
У ослабленных новорожденных заболевание протекает с общей симптоматикой (потерей аппетита, беспокойством, нарушением сна) и сопровождается признаками воспаления в клиническом анализе крови. Возможно присоединение септических осложнений: флегмоны, отита, пневмонии, пиелонефрита и пр. Как отдельное заболевание в дерматологии выделяют тяжелую клиническую форму эпидемической пузырчатки новорожденных — эксфолиативный дерматит Риттера.
Диагностика
Характерная клиническая картина и развитие заболевания в первые дни жизни ребенка, как правило, позволяют сразу диагностировать эпидемическую пузырчатку новорожденных. Для выявления вызвавшего ее возбудителя производится бакпосев отделяемого эрозивных поверхностей.
Важное значение имеет исключение сифилитической пузырчатки, являющейся проявлением врожденного сифилиса. С этой целю дерматолог назначает микроскопию содержимого пузырей на бледную трепонему, проведение RPR-теста и ПЦР диагностики. Дифдиагностика проводится также с врожденным эпидермолизом, другими клиническими формами буллезного дерматита, герпетической инфекцией.
Лечение эпидемической пузырчатки новорожденных
Стафилококки, вызывающие эпидемическую пузырчатку новорожденных, как правило, резистентны к пенициллину. Поэтому лечение проводится устойчивыми к пенициллиназе пенициллинами (амоксиклав, оксациллин и др.) и цефалоспоринами (цефалоридин, цефазолин). Применяются инфузии 5% альбумина из расчета на килограмм массы тела новорожденного, а также введение витаминов группы В, ретинола, аскорбиновой кислоты.
Обработку кожи вокруг пузырей производят салициловым или борным спиртом. Пузыри прокалывают и тушируют растворами анилиновых красителей. На подсохшие эрозивные поверхности накладывают синтомициновую эмульсию, аэрозоли и мази с антибиотиками: гентамициновую, неомициновую, эритомициновую и пр. При эпидемической пузырчатке новорожденных эффективны ежедневные ванны с раствором перманганата калия, общее и локальное УФО.
Профилактика
Эпидемическая пузырчатка новорожденных способна быстро распространяться, используя контактный путь передачи. Возбудитель достаточно устойчив во внешней среде и может сохраняться на коже рук медицинских работников, белье и предметах ухода. Основная задача профилактики - не допустить заражения здоровых детей. С этой целью обязательно проводится изоляция больного ребенка, выявление стафилококковой инфекции или носительства у матери и медицинского персонала, стерилизация белья и дезинфекция помещений. Родильный дом, в котором отмечалась вспышка эпидемической пузырчатки, закрывают для полной санитарно-гигиенической обработки.
Врожденный сифилис — клиническая форма сифилиса, возникающая при внутриутробном заражении ребенка бледными трепонемами. Врожденный сифилис может проявляться в различные периоды жизни ребенка от внутриутробного до подросткового. Он характеризуется специфическим сифилитическим поражением кожи, слизистых, костной ткани, соматических органов и нервной системы. Диагностика врожденного сифилиса основана на выделении возбудителя из крови, отделяемого кожных элементов и спинномозговой жидкости; положительных результатах серологических реакций и ПЦР-диагностики, обследовании состояния внутренних органов. Лечение врожденного сифилиса проводится антибиотиками, препаратами висмута и неспецифическими средствами, направленными на повышение иммунитета.
МКБ-10
Общие сведения
Сифилис относится к одним из самых распространенных венерических заболеваний. Наряду с гонореей, хламидиозом, цитомегалией и трихомониазом он является инфекцией, передаваемой половым путем. Кроме полового способа передачи, заражение может произойти внутриутробно и привести к развитию врожденного сифилиса. Больной врожденным сифилисом ребенок представляет инфекционную опасность для окружающих, особенно, если заболевание протекает с кожными проявлениями.

Причины возникновения врожденного сифилиса
Заболевание ребенка врожденным сифилисом обусловлено передачей инфекции от больной матери в период внутриутробного развития. Бледная трепонема (возбудитель сифилиса) не способна проходить сквозь здоровый трансплацентарный барьер. Однако сифилис у женщин в период беременности приводит к поражению плаценты и вызывает нарушение ее защитной барьерной функции. В результате трепонемы проникают в организм плода.
Передача трепонем от матери плоду наиболее вероятна в первые годы заболевания матери, со временем эта способность угасает. Риск рождения ребенка с врожденным сифилисом особенно велик у женщин с вторичной формой этого заболевания, сопровождающейся диссеминацией возбудителя с током крови. У зараженного трепонемами плода поражения внутренних органов развиваются только на 5-6-ом месяце беременности. Поэтому проведенное на ранних сроках противосифилитическое лечение может привести к рождению здорового ребенка.
Симптомы врожденного сифилиса
В зависимости от особенностей протекания врожденного сифилиса и сроков появления его клинических признаков венерология выделяет 4 основные формы заболевания.
Ранний врожденный сифилис проявляется у ребенка в возрасте до 2-х лет и подразделяется на врожденный сифилис грудничкового возраста и сифилис раннего детского возраста. У грудных детей симптомы врожденного сифилиса могут появляться на протяжении первых 1-2 месяцев жизни. Наиболее часто это поражение кожи и слизистых оболочек с развитием сифилитической пузырчатки.
При врожденном сифилисе грудного возраста может происходить язвенное поражение гортани с возникновением осиплости голоса. Поражения костной ткани проявляются остеохондритами и периоститами преимущественно длинных трубчатых костей. Как при вторичном сифилисе могут наблюдаться обусловленные врожденным сифилисом специфические поражения соматических органов: гепатит, миокардит, перикардит, эндокардит, гломерулонефрит, гидроцефалия, менингит, менингоэнцефалит. У мальчиков часто наблюдается специфический орхит, иногда — водянка яичка. Поражение легких при врожденном сифилисе протекает с развитием интерстициальной диффузной пневмонии, что часто приводит к гибели ребенка на первых днях жизни.
В раннем детском возрасте врожденный сифилис может проявляться заболеваниями глаз, поражением нервной системы и ограниченными кожными проявлениями в виде немногочисленных крупных папул и широких кондилом. При врожденном сифилисе у детей раннего возраста поражения внутренних органов выражены слабее. Изменения костной ткани выявляются лишь на рентгенограммах.
Поздний врожденный сифилис начинает проявляться клинически после 2-х летнего возраста, чаще всего — в подростковом периоде (14-15 лет). Его симптомы схожи с картиной третичного сифилиса. Это гуммозные или бугорковые сифилиды, локализующиеся на туловище, лице, конечностях, слизистой носа и твердого неба. Они быстро распадаются с образованием язв. К часто встречающимся симптомам позднего врожденного сифилиса относится специфический гонит, саблевидные голени, а также дистрофические изменения (стигмы), обусловленные влиянием возбудителя на формирующиеся ткани и органы. Стигмы носят неспецифический характер и могут наблюдаться при других инфекционных заболеваниях (например, при туберкулезе). Специфической для позднего врожденного сифилиса является триада Гетчинсона: сифилитический лабиринтит, диффузный кератит и зубы Гетчинсона — дистрофические изменения центральных верхних резцов.
Скрытый врожденный сифилис может наблюдаться у ребенка в любом возрасте. Он протекает при полном отсутствии клинических симптомов и выявляется только по результатам серологических исследований.
Диагностика врожденного сифилиса
Диагноз врожденного сифилиса подтверждается обнаружением бледных трепонем в содержимом пузырей сифилитической пузырчатки или отделяемом язв. Однако в случае отсутствия кожных проявлений применить этот метод диагностики не представляется возможным. Выявление возбудителя при врожденном сифилисе может быть проведено путем микроскопического исследования спинномозговой жидкости, полученной в результате люмбальной пункции. Но отрицательный результат этого исследования не исключает наличие скрытой формы врожденного сифилиса.
Решающую роль в диагностике врожденного сифилиса имеют серологические реакции. Неспецифические исследования (реакция Вассермана, RPR-тест) могут давать ложноположительные результаты. Поэтому при подозрении на врожденный сифилис широко применяются также специфические серологические исследования: РИФ, РИБТ, РПГА. ПЦР-выявление бледной трепонемы проводят с кровью, соскобом, отделяемым кожных элементов пациентов с врожденным сифилисом. Точность результата — 97%.
Диагностика сифилитического поражения различных внутренних органов может включать консультацию пульмонолога, невролога, гепатолога, нефролога, окулиста, отоларинголога, проведение рентгенографии легких, рентгенографического исследования костей, ультрасонографии, ЭХО-ЭГ, люмбальной пункции, УЗИ органов брюшной полости и печени, УЗИ почек и пр.
Лечение врожденного сифилиса
Бледная трепонема, в отличие от большинства других микроорганизмов, до сих пор остается высоко чувствительной к воздействию антибиотиков пенициллинового ряда. Поэтому основная терапия врожденного сифилиса заключается в длительном системном назначении пенициллинов (бензилпенициллины в комбинациях и в сочетании с экмолином). При возникновении у ребенка аллергической реакции на пенициллин или выявлении устойчивости трепонемы по результатам бакпосева с антибиотикограммой, лечение проводится эритромицином, цефалоспоринами или производными тетрациклина.
При поражении врожденным сифилисом нервной системы с развитием нейросифилиса показано эндолюмбальное введение антибиотиков и проведение пиротерапии (продигиозан, пирогенал), улучшающей их проникновение через гемато-энцефалический барьер. В лечении позднего врожденного сифилиса наряду с антибиотикотерапией назначают препараты висмута (бисмоверол, бийохинол). Применяются также витамины, биогенные стимуляторы, иммуномодуляторы.
Профилактика врожденного сифилиса
ГБОУ ВПО "Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого" Минздрава РФ
Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
ГБОУ ВПО "Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого" Минздрава РФ;
МБУЗ "Городская детская клиническая больница №1"
Ранний врожденный сифилис: эпидемиологические и клинико-лабораторные аспекты течения
Журнал: Клиническая дерматология и венерология. 2014;12(2): 27‑34
Мартынова Г.П., Прохоренков В.И., Кузнецова Н.Ф. Ранний врожденный сифилис: эпидемиологические и клинико-лабораторные аспекты течения. Клиническая дерматология и венерология. 2014;12(2):27‑34.
Martynova GP, Prokhorenkov VI, Kuznetsova NF. Early congenital syphilis: epidemiological, clinical and laboratory aspects of the clinical course. Klinicheskaya Dermatologiya i Venerologiya. 2014;12(2):27‑34. (In Russ.).
ГБОУ ВПО "Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого" Минздрава РФ
В статье представлены исторические и современные сведения о раннем врожденном сифилисе, эпидемиологические и клинико-лабораторные особенности различных форм его течения, на основании проведенного комплексного мониторинга течения различных форм заболевания у 150 детей.
ГБОУ ВПО "Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого" Минздрава РФ
Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
ГБОУ ВПО "Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого" Минздрава РФ;
МБУЗ "Городская детская клиническая больница №1"
Врожденный сифилис (ВС) - внутриутробная инфекция (ВУИ), передающаяся плоду трансплацентарно от больной сифилисом матери и характеризующаяся своеобразной клинической картиной и возрастной периодичностью [1, 2].
Актуальность проблемы ВС обусловлена сохраняющимся стабильно высоким уровнем заболеваемости, тяжелой мультиорганной патологией у детей, высокой летальностью у новорожденных 5. Большинство случаев ВС - результат недостаточного выявления и лечения сифилиса у беременных 7. На современном этапе отмечается увеличение числа женщин с впервые выявленной сифилитической инфекцией после родов, у каждой третьей сифилис диагностируется во второй половине беременности - то есть часть женщин не успевают пройти курс терапии, что снижает шансы рождения здорового ребенка [12, 13]. Также следует отметить, что после введения в широкую практику зарубежных дюрантных препаратов пенициллина - экстенциллина и ретарпена - участились случаи рождения детей с ВС [14, 15].
При отсутствии явных клинических признаков заболевания сифилис вызывает анатомо-функциональные изменения, реализующиеся в виде разнообразных нарушений в течение беременности и родов [5, 16, 17].
Согласно Международной классификации болезней, травм и причин смерти десятого пересмотра (МКБ-10), введенной в России с 1995 г., выделяют ранний ВС (РВС), наблюдаемый у детей до 2 лет, поздний ВС (позже 2-летнего возраста) и стигмы. Различают РВС манифестный (с клиническими проявлениями) и скрытый (без клинических проявлений).
Общепризнано, что единственный путь инфицирования плода - трансплацентарный. Полагают, что бледная трепонема не инфицирует плод до 16 нед беременности, так как плод является недостаточно зрелым, чтобы прореагировать на антиген образованием антител [18, 19]. Именно поэтому адекватное лечение матери на ранних сроках беременности обычно предотвращает поражение плода [20].
Риск вертикальной передачи возбудителя зависит от стадии заболевания у матери, и он максимален при первичном, вторичном и раннем скрытом сифилисе. Данные стадии у беременных обеспечивают до 85-90% случаев ВС, из них 35% - сифилитические мертворождения [19, 21]. Неуточненный и поздний скрытый сифилис матери составляют до 10% случаев ВС, что связано с уменьшением числа возбудителя в организме женщины [22]. Риск инфицирования плода увеличивается у женщин, имеющих клинические признаки заболевания [23]. У женщин с серологической резистентностью отмечается значительное число самопроизвольных абортов, мертворождений, преждевременных родов [22], однако считается, что при проведении профилактического лечения во время беременности у этой группы женщин возможно рождение здорового потомства [24].
Бледная трепонема попадает в организм плода тремя путями: в виде эмбола через пупочную вену; через лимфатические щели пупочных сосудов; через поврежденную токсинами бледной трепонемы плаценту с током крови матери. Непораженная плацента непроницаема для возбудителя. В плаценте трепонема вызывает тяжелые анатомо-морфологические изменения, но при явном сифилисе у матери и плода они могут отсутствовать. Поражается зародышевая часть плаценты, а в материнской подобных изменений не наблюдается [25, 26].
С развитием плацентарного кровообращения возбудитель проникает в организм плода, в результате чего развивается специфическая септицемия. При этом поражаются сосуды, печень, селезенка, легкие, эндокринные железы, центральная нервная система (ЦНС) и кости. В этих органах развивается диффузная межклеточная инфильтрация, изменение стенок сосудов, разрастание соединительной ткани, образуются милиарные сифиломы. Особенно выражены изменения в печени и селезенке. Данные изменения могут сделать плод нежизнеспособным [5, 17].
Клинические проявления РВС у новорожденных в целом соответствуют вторичному периоду приобретенного сифилиса. Наряду со специфическими признаками ему может быть присуща картина генерализованной ВУИ, при которой наблюдается полиорганная симптоматика (недоношенность и незрелость, поражение паренхиматозных органов, органов кроветворения, ЦНС) [1].
По данным М.М. Райц [28], у детей с РВС ранее отмечалось поражение кожи в 70% случаев, слизистых - в 78%, лимфатических узлов - в 70%, печени и селезенки - в 80%, костной системы - в 82-85%, глаз - в 22,18% случаев [28]. Наблюдения последних лет указывают на изменение патоморфоза ВС, проявляющегося рядом сдвигов как в клинической картине болезни, так и лабораторных показателей [1, 29].
Под нашим наблюдением (2005-2008 гг.) находились 150 детей с РВС в возрасте от 0 до 12 мес. Диагноз 134 детям установлен на 1-м месяце жизни при обследовании в инфекционном стационаре, куда они были переведены из родильных домов. У 14 больных ВС диагностирован в возрасте 1-6 мес, поскольку дети родились внешне здоровыми и были выписаны из родильного дома, а далее уже с клиническими проявлениями заболевания они поступили в соматические стационары под маской другого заболевания, где при обследовании обнаружены положительные серологические реакции на сифилис. При случайном обследовании были выявлены и госпитализированы со скрытым течением ВС двое детей в возрасте от 6 мес до 1 года.
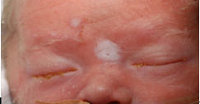
Патогномоничным симптомом РВС является сифилитическая пузырчатка, которая локализуется на коже подошв, ладоней, сгибательных участках рук и ног. Пузыри имеют полушаровидную форму от 0,3 до 1,0 см в диаметре, находятся на инфильтративном основании и окружены красновато-лиловым венчиком. Их содержимое изначально прозрачное, затем - мутное, изредка геморрагическое и содержит массу бледных трепонем. Такие больные чрезвычайно контагиозны. Пузыри вскрываются, превращаясь в эрозии, затем в корки, которые в дальнейшем отторгаются, оставляя после себя мелкое шелушение. В настоящее время пузырчатка обычно проявляется единичными элементами или десквамацией кожи только на ладонях и подошвах [1, 29, 30]. Из 76 (50,7%) случаев манифестного РВС сифилитическую пузырчатку мы наблюдали только у 8 (10,5%) новорожденных. Высыпания локализовались на ладонях и подошвах, были представлены эрозиями с обрывками эпидермиса по периферии очагов на слегка инфильтрированном основании (рис. 1, а, б). Рисунок 1. (а, б). Сифилитическая пузырчатка у новорожденного.
Диффузный сифилитический инфильтрат Гохзингера обычно локализуется на ладонях, подошвах, ягодицах, в области губ и подбородка, реже - в области лба и надбровных дуг, а также на ягодицах. Спустя 2-3 мес он разрешается, но на месте глубоких трещин остаются радиарные рубцы (рубцы Робинсона-Фурнье). Рубцы являются важным симптомом перенесенного РВС [1]. Инфильтрация Гохзингера нами не наблюдалась ни у одного из детей.
Папулезный сифилид чаще локализуется на конечностях, ягодицах, лице, распространяется на все тело и возникает через 4-8 нед после рождения [5]. Папулезную сыпь мы наблюдали у 3 детей в возрасте от 2,5 до 3 мес (рис. 2, а, б). Рисунок 2. (а, б). Папулезные сифилиды у ребенка 1,5 мес с РВС.

У детей грудного возраста также может наблюдаться диффузная или мелкоочаговая алопеция, а также поражение ногтей в виде онихий и паронихий (рис. 3). Рисунок 3. Мелкоочаговая алопеция у ребенка 11 мес с РВС.
Патогномоничным симптомом для РВС является специфический ринит. В его основе лежит диффузная воспалительная инфильтрация слизистой оболочки носа. Hochsinger (1927 г.) выделил три стадии сифилитического ринита: I - сухая, характеризующаяся своеобразным дыханием из-за значительного набухания слизистой носа; II - катаральная, когда из носовых ходов выделяется слизистый, затем гнойный и кровянистый секрет и III - язвенная, характеризующаяся гнойно-кровянистыми зловонными выделениями, трещинами, эрозиями, изъязвлениями слизистой, иногда приводящих к кровотечениям. У ребенка возникает сопящее дыхание и затрудняется акт сосания [1, 27, 29]. Сифилитический ринит, который, по мнению исследователей, является довольно частым признаком РВС, в нашем наблюдении выявлен лишь у 14 (18,4%) больных. Однако в связи с тяжестью состояния весомая доля детей с рождения находились на искусственной вентиляции легких (ИВЛ), что затрудняло их осмотр оториноларингологом.
Специфическим признаком РВС является остеохондрит Вегенера - поражение длинных трубчатых костей на границе эпифиза и диафиза, обусловленное нарушением образования кальция и торможением развития остеобластов. Выделяют три степени остеохондрита. Характерными для РВС являются II и III степени. Наряду с остеохондритом, у детей грудного возраста часто обнаруживаются периостальные наложения при рождении и в первые месяцы жизни, поражающие длинные трубчатые кости и череп. Остеохондриты и периоститы обнаруживаются симметрично в нескольких костях. Возможно развитие гумм в метафизах и диафизах, вызывающих переломы и псевдопаралич Парро. При этом наблюдается локальная болезненность и отек в зоне поражения. Конечность выглядит парализованной, но чувствительность и движения пальцев сохранены. Возможно развитие фалангитов или дактилитов с деструктивными гуммозными и периостальными изменениями [1, 5, 29]. Данные поражения протекают безболезненно и не образуют свищей. По нашим данным, самым частым признаком РВС на сегодня является поражение костей. У 43 (56,6%) больных был диагностирован остеохондрит II степени, а у 3 (3,9%) - III (рис. 4, а, б). Рисунок 4. (а, б). Остеохондрит II степени у новорожденного с РВС. Часто выявлялись периоститы трубчатых костей, сочетающиеся с остеохондритами II степени (рис. 5, а, б). Рисунок 5. Сифилитический диффузный остиомиелит трубчатых костей (внутриметадиафизарный перелом проксимального отдела плечевой кости) до проведения специфической терапии (а) и после лечения (б). Псевдопаралич Парро наблюдался у 1 ребенка (рис. 6). Рисунок 6. Псевдопаралич Парро левой руки у ребенка 1,5 мес с РВС. Также у 1 ребенка, поступившего в возрасте 2,5 мес, диагностирован остеохондрит II степени, периостит, эпифизарная гумма фаланги II пальца кисти и фалангит, возникающий то на одном, то на другом пальце.
Поражение внутренних органов при РВС характеризуется инфильтративно-продуктивным процессом, изредка - гуммозными образованиями. Сифилитические изменения в 100% случаев обнаруживаются в печени и селезенке, в 94% - в сосудах, в 85% - в надпочечниках; часто поражаются поджелудочная железа, почки и вилочковая железа [5]. У большинства наших больных специфические изменения кожи и слизистых при рождении отсутствовали, а клиника характеризовалась общим тяжелым состоянием и полиорганной патологией, вследствие чего 23 (30,3%) ребенка в первые часы жизни были переведены в реанимационное отделение. Тяжесть состояния у них была обусловлена нарастающей дыхательной недостаточностью и синдромом дыхательных расстройств (СДР), а также поражением ЦНС. На ИВЛ сроком от 1 до 86 сут находились 19 (25,0%) детей.
Со стороны периферической крови у детей с РВС чаще определялся лейкоцитоз, гипохромная анемия, повышение СОЭ, тромбоцитопения, замедление свертываемости крови [1]. Анемия, являясь довольно частым симптомом, в нашем исследовании наблюдалась у 42 (55,3%) больных детей.
У 24 (17,9%) инфицированных выявлена тромбоцитопения, что послужило основанием для переливания тромбоконцентрата трети наблюдаемых пациентов.
Поражение почек характеризуется очаговым или диффузным интерстициальным нефритом.
У таких больных отмечается нарушение общего состояния, бледность кожного покрова, пастозность и отечность тканей. В моче выявляется протеинурия, гематурия и цилиндрурия [1]. Среди наблюдаемых нами детей патология почек обнаружена в 25 (32,8%) случаях, а у 2 детей являлась единственным симптомом заболевания.
Поражение головного мозга на ранних стадиях его формирования приводит к задержке его развития, микрогирии, склерозу и порэнцефалии. Особенно страдают мозговые оболочки и сосуды, что проявляется специфическим эндартериитом, их облитерацией, с последующим размягчением окружающих тканей. На стенках сосудов и в оболочках мозга образуются множественные гуммы, развиваются эндо- и периартерииты, что проявляется выраженной сосудисто-воспалительной реакцией с формированием специфического гуммозного базального менингита или менингоэнцефалита. Возможно развитие внутренней гидроцефалии [1]. У наблюдаемых нами больных с РВС поражение ЦНС клинически характеризовалось вялостью ребенка, срыгиванием, монотонным криком, судорожным синдромом, очаговой симптоматикой. В спинномозговой жидкости определялся лимфоцитарный цитоз и повышенное содержание белка. У 5 (6,6%) обследуемых детей был диагностирован специфический менингит, у 4 (5,3%) - менингоэнцефалит, из них в 2 случаях - с исходом в гидроцефалию (рис. 8, 9). Рисунок 8. Гидроцефальный синдром у новорожденного с РВС. Рисунок 9. Гидроцефальный синдром у ребенка 2,5 мес с РВС. У 17 (22,3%) больных выявлены положительные серологические реакции в ликворе при отсутствии выраженного цитоза и умеренного увеличения белка. По данным И.А. Горланова и соавт. (2009 г.), это позволяет диагностировать у них латентный менингит, который и был выставлен нами [1].
Заболевания сердца при РВС встречаются редко. Однако, по данным Е.А. Дегтяревой и соавт. (2010 г.), при обследовании 216 детей, рожденных больными сифилисом женщинами, установлено достоверное увеличение частоты случаев врожденных пороков сердца (ВПС) и малых сердечных аномалий. Среди наблюдаемых нами детей в 12 (8,0%) случаях диагностированы ВПС, а в 11 (7,3%) - малые сердечные аномалии.
Из органов чувств у детей грудного возраста чаще поражается глазное дно. При рождении может отмечаться хориоретинит и поражение зрительного нерва [1]. Осмотр окулиста не выявил патологии у обследованных нами детей.
Тяжелое течение РВС более характерно для недоношенных детей - обычно у них имеются клинические проявления с первых дней жизни, что приводит к большей частоте летальных исходов. Причина смерти - присоединение вторичной инфекции. Летальный исход мы наблюдали у 3 (3,9%) детей с РВС манифестным, которые поступали в 1-е сутки жизни в отделение реанимации с явными клиническими признаками заболевания, недоношенностью II-III степени. Причинами их гибели стали СДР и развитие сепсиса.
Сложность диагностики манифестного РВС обусловлена многообразием клинических проявлений, которые не всегда являются патогномоничными, что требует дифференциации с другими ВУИ. Отмечается, и это подтверждается нашими исследованиями, что в настоящее время поражения кожи и слизистых наблюдаются реже, а поражения костей - чаще. При постановке диагноза РВС нами использовались реакция микропреципитации, ИФА на IgM и IgG раздельно, реакции пассивной гемагглютинации как в качественных, так и количественных вариантах. В тяжелых диагностических случаях применялась постановка реакции иммунофлюоресценции (РИФ абс ). Определение специфического IgM не всегда является информативным методом. Однако, несмотря на существующие проблемы, необходимо раннее установление диагноза РВС для своевременного проведения оптимального лечения.
Суточная доза бензилпенициллина натриевой соли составляет 100 тыс. ЕД/кг массы тела детям в возрасте до 6 мес, 75 тыс. ЕД/кг - от 6 мес до 1 года, 50 тыс. ЕД/кг массы тела внутримышечно детям старше года. Бензилпенициллина новокаиновая соль назначается из расчета 50 тыс. ЕД/кг массы тела в сутки внутримышечно. При терапии манифестных форм заболевания натриевая соль бензилпенициллина делится на 6 равных разовых доз, новокаиновая соль - на 2 дозы. Курс пенициллинотерапии при манифестном РВС составляет 20 сут, при наличии специфической патологии ликвора - 28 сут.
Специфическую терапию при необходимости сочетали с неспецифической: назначением ангио- и гепатопротекторов, эубиотиков, по жизненным показаниям - переливанием компонентов крови. Одновременно проводилась терапия сопутствующей патологии. Эффективность лечения оценивалась по купированию клинических проявлений, нормализации лабораторных показателей, снижению позитивности серологических реакций, улучшению физического и психомоторного состояния ребенка.
Наработанный нами клинический опыт полностью согласуется с наблюдениями И.А. Горланова и соавт. (2009) и О.В. Панкратова (2007) и показывает, что перечисленные позитивные факты начинают отмечаться к концу 3-й или началу 4-й недели терапии [1].
Необходимо помнить, что проблема РВС требует одновременного внимания и настороженности акушеров, педиатров, неонатологов, инфекционистов и врачей других специальностей.
Читайте также:

