Синдром дауна сыпной тиф артрит
Обновлено: 23.04.2024
Обзор основных проблем костно-мышечной системы людей с синдромом Дауна адресован в первую очередь врачам различных специальностей, участвующим в наблюдении и лечении пациентов с данной нозологией. Автор акцентирует внимание на необходимости тщательного обследования для предупреждения возможных рисков при занятиях спортом.
Источник:
Автор:
Правообладатель:
Синдром Дауна — самая распространенная генетическая аномалия с частотой встречаемости 1 на 660 новорожденных [1]. Помимо характерных фенотипических признаков у пациентов наблюдают ряд проблем со стороны многих органов и систем: сердечно-сосудистой, нервной, пищеварительной, эндокринной, опорно-двигательной [2]. Повышение качества медицинской помощи привело к увеличению средней продолжительности жизни пациентов, многие из них хотят заниматься спортом хотя бы на любительском уровне, поэтому врачам любых специальностей, участвующим в наблюдении и лечении пациентов данной нозологической группы, необходимо иметь представление о проблемах их костно-мышечной системы.
Значимость проблемы определяется сравнительно высоким риском развития неврологических нарушений, связанных с компрессией спинного мозга, в процессе занятий контактными видами спорта и проведения медицинских манипуляций (интубация трахеи) [26]. В литературе описан случай внезапного развития клиники тетрапареза с нарушением функции тазовых органов у ребенка 13 лет с синдромом Дауна после проведения инстилляции глазных капель [27]. Симптоматический вариант нестабильности наблюдают у 1-2% пациентов [24]. Об актуальности данной патологии свидетельствует тот факт, что еще в 1984 году Американская Академия Педиатрии разработала рекомендации по проведению обследования детей с синдромом Дауна, желающих принимать участие в контактных видах спорта [28]. В 1983 году Специализированный Комитет Олимпийских Игр ввел протокол обследования спортсменов с синдромом Дауна перед участием в соревнованиях, включающий выполнение функциональных рентгенограмм шейного отдела в боковой проекции [29].
Клиническими проявлениями симптоматической формы атланто-аксиальной нестабильности являются: чувство дискомфорта и болей в шейном отделе позвоночника, внезапно развившаяся кривошея, нарушения походки и функции тазовых органов, снижение ручной умелости, спастичность мышц нижних конечностей, гиперрефлексия. Возникновение данной симптоматики диктует необходимость проведения инструментального обследования пациента. Рентгенологическими признаками наличия патологии являются: увеличение атланто-дентального интервала (ADI) более 5 мм, базиллярно-дентального расстояния более 12 мм, значения индекса Power более 1.0 (передняя атланто-окципитальная нестабильность), либо менее 0.55 (задняя атланто-окципитальная нестабильность) [12, 30, 31] (Рис.1). Также для атланто-окципитальной нестабильности характерно увеличение амплитуды переднезадней трансляции черепа, оцениваемой по методу Weisel et al., более 2 мм. – данная методика считается более точной, чем метод Power [32, 33] (Рис.1).
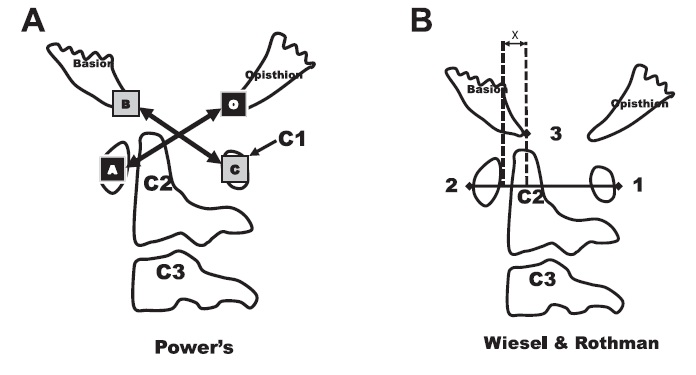
Рисунок 1. (A) Индекс Power. Вычисление проводят по формуле: ВС/АО. Значение > 1.0 свидетельствует о наличии атланто-окципитальной нестабильности. (B) Метод Wiesel и Rothman. Проводят измерение величины Х на функциональных рентгенограммах. Нормальное значение < 1.0 мм.
О возможном наличии компрессии спинного мозга свидетельствуют: увеличение атланто-дентального интервала более 10 мм, уменьшение размера резервного пространства для спинного мозга (SAC) менее 13 мм и нарушение “правила трех Still”[1] – в таких случаях показано проведение магнитно-резонансной томографии для определения истинной величины стеноза и состояния спинного мозга 35. Проведение компьютерной томографии позволяет верифицировать виды дисплазии краниоцервикальной зоны: различные варианты ассимиляции атланта, зубовидную кость, гипо- и аплазию зубовидного отростка, - а также дифференцировать врожденные состояния от последствий травмы этой области, что иногда бывает довольно затруднительным [37].
Одной из причин развития нестабильности принято считать повышенную эластичность поперечной связки атланта (lig. transversum) [38], связанную с дисплазией соединительной ткани, обусловленной аномальным строением коллагена вследствие наличия трех копий гена COL6A1 и COL6A2. В некоторых случаях разрыва/острой декомпенсации этой связки сохранившиеся крыловидные связки (lig. alaria) остаются основными удерживающими структурами и ограничивают переднюю трансляцию атланта, и тогда клинические проявления ограничены дискомфортом или болями, умеренными проявлениями миелопатии. Разрыв крыловидных связок ведет к полной дестабилизации сегмента С1-С2 и, как следствие, риску развития компрессии спинного мозга, сопровождающейся тяжелыми неврологическими нарушениями [39]. Доказано, что даже незначительная травма или инфекционный процесс носоглоточной области и среднего уха может привести к развитию ААН [40, 41]. Аномалии развития костных структур, которые у людей с синдромом Дауна наблюдаются несколько чаще, чем в других группах пациентов: гипоплазия мыщелков затылочной кости, ассимиляция атланта, зубовидная кость, гипо- и аплазия зубовидного отростка, - также могут служить причиной развития нестабильности [24, 42]. Исследование, в котором проведено сравнение данных компьютерной томографии, свидетельствует о том, что размер пространства для спинного мозга у пациентов с синдромом Дауна меньше, чем в популяции (505 mm2 и 602 mm2, соответственно), потому, даже минимальная сублюксация может приводить к развитию симптомов. Наличие гипоплазии С1 у пациентов данной группы может служить причиной развития стеноза позвоночного канала даже при незначительном увеличении атланто-дентального интервала (около 6 мм) [43, 44]. Известно, что подобные аномалии развития выявляют при проведении патологоанатомического исследования новорожденных с подтвержденным диагнозом синдрома Дауна [45]. Отличительной особенностью в таких случаях является возможное развитие не только передне-задней, но и боковой нестабильности. С этим фактом связана сравнительно большая тяжесть и частота неврологических проявлений и, как следствие, более агрессивный подход в проведении хирургического лечения пациентов данной группы.
На данный момент необходимость профилактического проведения стабилизирующих операций при наличии асимптоматической формы краниоцервикальной нестабильности не признана [46]. Большинство существующих длительных наблюдений свидетельствуют о том, что по мере взросления происходит спонтанная стабилизация сегмента С1-С2 [Alvarez N, 2004 неопубликованные данные]. Стоит отметить, что в ряде случаев отмечают ухудшение имеющейся ситуации, а также развитие симптоматической формы нестабильности у лиц, ранее не имевших клинических или рентгенологических ее признаков [47]. Критерии перехода симптоматической формы в асимптоматическую и наоборот - отсутствуют. Показаниями к проведению различных вариантов хирургического вмешательства, включающих в себя стабилизацию различной протяженности и проведение как передней, так и задней декомпрессии спинного мозга, являются: наличие неврологических проявлений, обусловленных компрессией спинного мозга; наличие рентгенологических признаков явной механической ААН (увеличение атланто-дентального интервала более 10 мм) [28], уменьшение резервного пространства для спинного мозга менее 13 мм, нарушение “правила трех Still”; некоторые нестабильные формы дисплазии краниоцервикальной зоны (зубовидная кость), атланто-окципитальная нестабильность, базиллярная импрессия [24]. При отсутствии клинических проявлений и наличии только такого рентгенологического признака ААН, как увеличение атланто-дентального интервала в пределах от 5 до 10 мм, показано исключение участия ребенка в контактных видах спорта, осторожное проведение медицинских манипуляций, регулярное проведение рентгенологического обследования (1 раз в год).

Многие авторы сообщают о довольно высокой частоте (до 70% - 100%) [48, 49] развития осложнений при проведении хирургического лечения: отсутствие формирования костного блока (до 50%) [50], дестабилизация металлоконструкции, неврологические нарушения [51], летальный исход [48 52, 53]. Кроме того, лишь у малого количества пациентов (около 20%) наблюдают регресс неврологического дефицита [48].
Помимо краниовертебрального перехода существует опасность развития миелопатии на уровне средне- и нижне-шейного отделов позвоночника, обусловленной дегенеративно-дистрофическими изменениями (снижение высоты межтелового пространства, рост остеофитов, дестабилизация сегментов) [54, 55]. Особенностью является их появление у пациентов молодого возраста (старше 20 лет) [56]. Maclachlan с соавторами (1993) обнаружили что у пациентов с синдромом Дауна наиболее часто поражены именно С2-С6 сегменты, при этом С5+/- С6 сегменты — более всего [57]. Данные Fidone (1986) свидетельствуют о том, что дегенеративно-дистрофические изменения шейного отдела позвоночника обнаруживаются у половины пациентов в возрасте от 30 до 40 лет и у 100% пациентов старше 40 лет [58]. Эти процессы обуславливают развитие вторичного стеноза позвоночного канала и, как следствие, неврологической симптоматики. Поэтому, в отличие от пациентов детского возраста, у лиц старше 20 лет при наличии клинических проявлений миелопатии (нарушение походки/функции тазовых органов, спастичность мышц нижних конечностей) следует, в том числе, исключать дегенеративно-дистрофическое поражение сегментов шейного отдела [59].
Частота встречаемости сколиоза у пациентов с синдромом Дауна составляет 7-9% [8, 9]. Сравнительно большая частота, возможно, объясняется тем, что нередко заболевание является ятрогенным вследствие проведения стерно- и торактомии при выполнении оперативных вмешательств на сердце 10. Тактика лечения не отличается от таковой при ведении других пациентов с идиопатическим сколиозом: наблюдение при наличии деформации до 25 градусов, корсетотерапия при наличии деформации от 25 до 40 градусов и оперативное лечение при наличии деформации величиной более 45 градусов[2].
Хирургическое лечение состоит в проведении коррекции и стабилизации деформации различными видами спинальных металлоконструкций, но связано с несколько большей частотой развития осложнений как в раннем (пневмония, длительное заживление ран, инфекционные осложнения), так и в позднем (дестабилизация металлоконструкции, формирование псевдоартроза) послеоперационных периодах. Проведение консервативного лечения с применением корсета может быть затруднительным вследствие отказа пациентов соблюдать жесткий режим его ношения и потому, как правило, неэффективно [9]. Таким образом, поддержание физической активности, контроль массы тела и, по возможности, занятия лечебной физкультурой по программам, разработанным для пациентов со сколиотической болезнью, являются приоритетными направлениями.
Спондилолиз и спондилолистез. Точная частота встречаемости у пациентов с синдромом Дауна неизвестна, хотя некоторые авторы предполагают, что она должна быть выше, чем в общей популяции, ввиду повышенной эластичности связочного аппарата и большей частоты пороков развития костных структур у этих пациентов [12]. Данные Hansdorfer с соавторами подтверждают это предположение: в их исследовании частота встречаемости спондилолиза и спондилолистеза составила 18.7% и 32.7%, соответственно [13]. Наличие жалоб на боли в поясничном отделе позвоночника, в мышцах-сгибателях голени, уплощение поясничного лордоза, нарушение походки, функции тазовых органов могут являться симптомами заболевания. Тактика лечения заключается в проведении наблюдения и выполнении упражнений лечебной физкультуры при стабильных формах спондилолистеза и хирургической стабилизации при большой степени смещения (III-IV по Meirding), прогрессирующих формах или в случае безуспешности проведения консервативного лечения [14].


Патология стоп в виде мобильной плано-вальгусной деформации стопы, деформации первого или пятого лучей, как правило, не вызывает у пациентов трудностей [21, 67]. Необходим лишь правильный подбор обуви для предотвращения хронической травматизации мягких тканей стопы. Иногда у пациентов в возрасте от 2 до 5 лет наблюдают дислокацию сухожилий мышц малоберцовой группы: последние смещаются на переднюю поверхность голеностопного сустава - данное состояние не влияет на ходьбу и не приносит пациентам дискомфорт [69]. Профилактическое применение ортопедической обуви, ортезов для стоп (стелек) у детей с синдромом Дауна не приводит к улучшению формы стопы, но мешает ее нормальному функционированию и развитию. Потому акцент следует делать на занятиях спортом и контроле массы тела [70].
Протокол обследования и ведения пациента с синдромом Дауна при подозрении на наличие патологии краниовертебральной зоны.
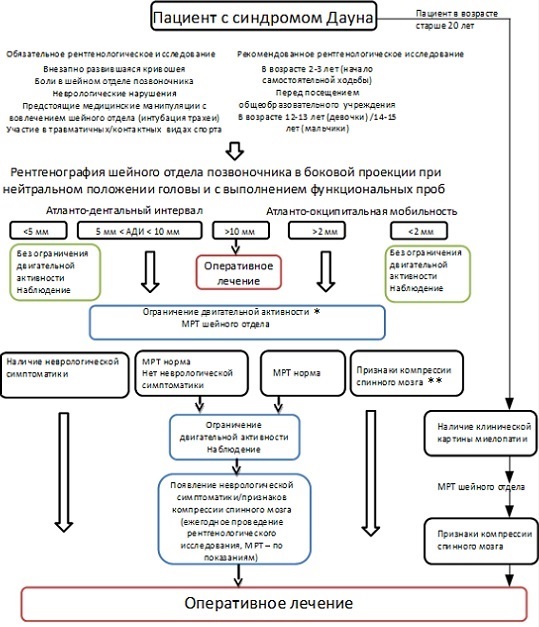
Рисунок 2. Протокол обследования и ведения пациента с синдромом Дауна при подозрении на наличие патологии краниовертебральной зоны.
* Исключение участия в контактных видах спорта, осторожное проведение манипуляций с шейным отделом.
** Отсутствие компрессии спинного мозга, миеломаляции, ликвородинамических нарушений.
Литература:
[1] Правило трех Still: на рентгенограмме в боковой проекции расстояние между задней поверхностью передней дуги первого шейного позвонка и передней поверхностью его задней дуги делят на три равные части. В норме треть этого расстояния занимает зубовидный отросток второго шейного позвонка, треть – спинной мозг, треть отводится на разервное пространство. При наличии нестабильности между первым и вторым шейными позвонками это правило нарушено.
Эпидемический сыпной тиф (Синонимы: вшивый сыпной тиф, военный тиф, голодный тиф, европейский тиф, тюремная лихорадка, лагерная лихорадка; epidemic typhus fever, louse-born typhus, jail fever, famine fever, war fever-англ., Flecktyphus, Flec-kfieber - нем.; typhus epidemique, typhus exanthematique, typhus historique - франц.; tifus exantematico, dermotypho - ucn.) - острая инфекционная болезнь, характеризуется циклическим течением, лихорадкой, розеолезно-петехиальной экзантемой, поражением нервной и сердечно-сосудистой систем, возможностью сохранения риккетсий в организме реконвалесцента в течение многих лет.
Что провоцирует / Причины Эпидемического сыпного тифа:
Возбудителями эпидемического сыпного тифа являются R. prowazekii, распространенная во всех странах мира, и R. canada, циркуляция которой наблюдается в Северной Америке. Риккетсия Провачека несколько крупнее других риккетсий, грамотрицательная, имеет два антигена: поверхностно расположенный видонеспецифический (общий с риккетсиями Музера) термостабильный, растворимый антиген липоидополисахаридно-протеиновой природы, под ним располагается видоспецифический нерастворимый термолабильный белково-полисахаридный антигенный комплекс. Риккетсий Провачека быстро гибнут во влажной среде, но длительно сохраняются в фекалиях вшей и в высушенном состоянии. Хорошо переносят низкие температуры, гибнут при прогревании до 58°С за 30 мин, до 100°С - за 30 с. Погибают под действием обычно применяемых дезсредств (лизол, фенол, формалин). Высоко чувствительны к тетрациклинам.
Патогенез (что происходит?) во время Эпидемического сыпного тифа:
Воротами инфекции являются мелкие повреждения кожи (чаще расчесы), уже через 5-15 мин риккетсий проникают в кровь. Размножение риккетсий происходит внутриклеточно в эндотелии сосудов. Это приводит к набуханию и десквамации эндотелиальных клеток. Попавшие в ток крови клетки разрушаются, высвобождающиеся при этом риккетсий поражают новые эндотелиальные клетки. Наиболее бурно процесс размножения риккетсий происходит в последние дни инкубационного периода и в первые дни лихорадки. Основной формой поражения сосудов является бородавчатый эндокардит. Процесс может захватывать всю толщину сосудистой стенки с сегментарным или круговым некрозом стенки сосуда, что может привести к закупорке сосуда образующимся тромбом. Так возникают своеобразные сыпнотифозные гранулемы (узелки Попова). При тяжелом течении болезни преобладают некротические изменения, при легком - пролиферативные. Изменения сосудов особенно выражены в центральной нервной системе, что дало основание И. В. Давыдовскому считать, что каждый сыпной тиф является негнойным менингоэнцефалитом. С поражением сосудов связаны не только клинические изменения со стороны центральной нервной системы, но и изменения кожи (гиперемия, экзантема), слизистых оболочек, тромбоэмболические осложнения и др. После перенесенного сыпного тифа остается довольно прочный и длительный иммунитет. У части реконвалесцентов это нестерильный иммунитет, так как риккетсий Провачека могут десятилетиями сохраняться в организме реконвалесцентов и при ослаблении защитных сил организма обусловливать отдаленные рецидивы в виде болезни Брилля.
Симптомы Эпидемического сыпного тифа:
Ранним признаком является и энантема, которая очень характерна и имеет важное значение для ранней диагностики. Она описана Н. К. Розенбергом в 1920 г. На слизистой оболочке мягкого неба и язычка, обычно у его основания, а также на передних дужках можно заметить небольшие петехии (до 0,5 мм в диаметре), число их чаще 5-6, а иногда и больше. При внимательном осмотре энантему Розенберга можно выявить у 90% больных сыпным тифом. Появляется она за 1-2 дня до появления кожных высыпаний. Как и пятна Киари-Авцына, она сохраняется до 7-9-го дня болезни. Следует отметить, что при развитии тромбогеморрагического синдрома сходные высыпания могут появиться и при других инфекционных болезнях.
При выраженной интоксикации у больных сыпным тифом может наблюдаться своеобразная окраска кожи ладоней и стоп, она характеризуется оранжевым оттенком, это не желтушность кожи, тем более что отсутствует субиктеричность склер и слизистых оболочек (где, как известно, желтушность проявляется раньше). Доцент кафедры инфекционных болезней И. Ф. Филатов (1946) доказал, что такая окраска обусловлена нарушением каротинового обмена (каротиновая ксантохромия).
Существенных изменений органов дыхания у больных сыпным тифом обычно не выявляется, нет воспалительных изменений верхних дыхательных путей (краснота слизистой оболочки глотки обусловлена не воспалением, а инъекцией кровеносных сосудов). У некоторых больных отмечается учащение дыхания (за счет возбуждения дыхательного центра). Появление пневмонии является осложнением. Изменения органов кровообращения отмечаются у большинства больных. Это проявляется в тахикардии, снижении АД, приглушении тонов сердца, изменениях ЭКГ, может развиться картина инфекционно-токсического шока. Поражение эндотелия обусловливает развитие тромбофлебитов, иногда тромбы образуются и в артериях, в периоде реконвалесценции возникает угроза тромбоэмболии легочной артерии.
Длительность течения болезни (если не применялись антибиотики) зависела от тяжести, при легких формах сыпного тифа лихорадка продолжалась 7-10 дней, выздоровление наступало довольно быстро, осложнений, как правило, не было. При среднетяжелых формах лихорадка достигала высоких цифр (до 39-40 °С) и длилась в течение 12-14 дней, экзантема характеризовалась преобладанием петехиальных элементов. Возможно развитие осложнений, однако заболевание, как правило, заканчивалось выздоровлением. При тяжелом и очень тяжелом течении сыпного тифа наблюдалась высокая лихорадка (до 41-42°С), резко выраженные изменения центральной нервной системы, тахикардия (до 140 уд/мин и более), снижение АД до 70 мм рт. ст. и ниже. Сыпь имеет геморрагический характер, наряду с петехиями могут появляться и более крупные кровоизлияния и выраженные проявления тромбогеморрагического синдрома (носовые кровотечения и др.). Наблюдались и стертые
формы сыпного тифа, но они чаще оставались нераспознанными. Приведенная симптоматика характерна для классического сыпного тифа. При назначении антибиотиков болезнь купируется в течение 1-2 сук.
Осложнения. Риккетсии Провачека паразитируют в эндотелии сосудов, в связи с этим могут возникать различные осложнения - тромбофлебиты, эндартерииты, тромбоэмболия легочных артерий, кровоизлияние в мозг, миокардиты. Преимущественная локализация в центральной нервной системе приводит к осложнениям в виде психоза, полирадикулоневрита. Присоединение вторичной бактериальной инфекции может обусловить присоединение пневмоний, отита, паротита, гломерулонефрита и др. При антибиотикотерапии, когда очень быстро проходят все проявления болезни, и даже при легких формах болезни почти единственной причиной гибели больных являются тромбоэмболии легочной артерии, как правило, это происходило уже в периоде выздоровления, при нормальной температуре тела, нередко осложнение провоцировалось расширением двигательной активности реконвалесцента.
Диагностика Эпидемического сыпного тифа:
Диагноз спорадических случаев в начальный период болезни (до появления типичной экзантемы) очень труден. Серологические реакции становятся положительными также лишь с 4-7-го дня от начала болезни. Во время эпидемических вспышек диагноз облегчается эпидемиологическими данными (сведения о заболеваемости, наличии завшивленности, контакт с больными сыпным тифом и др.). При появлении экзантемы (т. е. с 4-6-го дня болезни) клинический диагноз уже возможен. Сроки появления и характер сыпи, гиперемия лица, энантема Розенберга, пятна Киари-Авцына, изменения со стороны нервной системы - все это позволяет дифференцировать в первую очередь от брюшного тифа (постепенное начало, заторможенность больных, изменения со стороны органов пищеварения, более позднее появление экзантемы в виде розеоло-папулезной мономорфной сыпи, отсутствие петехий и др.). Необходимо дифференцировать и от других инфекционных болезней, протекающих с экзантемой, в частности, с другими риккетсиозами (эндемический сыпной тиф, клещевой риккетсиоз Северной Азии и др.). Некоторое дифференциально-диагностическое значение имеет картина крови. При сыпном тифе характерным является умеренный нейтрофильный лейкоцитоз с палочкоядерным сдвигом, эозинопения и лимфопения, умеренное повышение СОЭ.
Для подтверждения диагноза используют различные серологические реакции. Сохранила некоторое значение реакция Вейля-Феликса - реакция агглютинации с протеем OXig, особенно при нарастании титра антител в ходе болезни. Чаще используют РСК с риккетсиозным антигеном (приготовленным из риккетсий Провачека), диагностическим титром считается 1:160 и выше, а также нарастание титра антител. Используют и другие серологические реакции (реакция микроагглютинации, гемагглютинации и др.). В меморандуме совещания ВОЗ по риккетсиозам (1993) в качестве рекомендуемой диагностической процедуры рекомендована непрямая реакция иммунофлюоресценции. В острую фазу болезни (и периода реконвалесценции) антитела связаны с IgM, что используется для отличия от антител в результате ранее перенесенной болезни. Антитела начинают выявляться в сыворотке крови с 4-7-го дня от начала болезни, максимального титра достигают через 4-6 нед от начала заболевания, затем титры медленно снижаются. После перенесенного сыпного тифа риккетсий Провачека в течение многих лет сохраняются в организме реконвалесцента, это обусловливает длительное сохранение антител (связаны с IgG также в течение многих лет, хотя и в невысоких титрах). В последнее время с диагностическими целями используют пробную терапию антибиотиками тетрациклиновой группы. Если при назначении тетрациклина (в обычных терапевтических дозах) через 24-48 ч не наступает нормализация температуры тела, то это позволяет исключить сыпной тиф (если лихорадка не связана с каким-либо осложнением).
Лечение Эпидемического сыпного тифа:
Основным этиотропным препаратом в настоящее время являются антибиотики тетрациклиновой группы, при непереносимости их эффективным оказывается и левомицетин (хлорамфеникол). Чаще назначается тетрациклин внутрь по 20-30 мг/кг или для взрослых по 0,3-0,4 г 4 раза в день. Курс лечения продолжается 4-5 дней. Реже назначают левомицетин по 0,5-0,75 г 4 раза в сутки в течение 4-5 дней. При тяжелых формах первые 1-2 дня можно назначать левомицетина сукцинат натрия внутривенно или внутримышечно по 0,5-1 г 2-3 раза в сутки, после нормализации температуры тела переходят на пероральное применение препарата. Если на фоне антибиотикотерапии присоединяется осложнение, обусловленное наслоением вторичной бактериальной инфекции (например, пневмонии), то с учетом этиологии осложнения дополнительно назначают соответствующий химиопрепарат.
Этиотропная антибиотикотерапия оказывает очень быстрый эффект и поэтому многие методы патогенетической терапии (вакцинотерапия, разработанная профессором П. А. Алисовым, длительная оксигенотерапия, обоснованная В. М. Леоновым, и др.) в настоящее время имеют лишь историческое значение. Из патогенетических препаратов обязательным является назначение достаточной дозы витаминов, особенно аскорбиновой кислоты и Р-витаминные препараты, которые обладают сосудоукрепляющим действием. Для предупреждения тромбоэмболических осложнений, особенно в группах риска (к ним прежде всего относятся лица пожилого возраста), необходимо назначение антикоагулянтов. Назначение их необходимо и для предупреждения развития тромбогеморрагического синдрома. Наиболее эффективным препаратом для этой цели является гепарин, который следует назначать сразу же после установления диагноза сыпного тифа и продолжать его прием в течение 3-5 дней.
Гепарин (Нерагтит), синонимы: Heparin sodim, Гепарин ВС, Гепароид. Выпускается в виде раствора во флаконах по 25 000 ЕД (5 мл). Следует учитывать, что тетрациклины в какой-то степени ослабляют действие гепарина. Вводят внутривенно в первые 2 дня по 40 000-50 000 ЕД/сут. Препарат лучше вводить капельно с раствором глюкозы или разделить дозу на 6 равных частей. С 3-го дня дозу уменьшают до 20 000- 30 000 ЕД/сут. При уже возникшей эмболии суточную дозу в первый день можно увеличить до 80 000-100000 ЕД. Препарат вводят под контролем свертывающей системы крови.
Прогноз. До введения в практику антибиотиков прогноз был серьезным, многие больные умирали. В настоящее время при лечении больных тетрациклинами (или левомицетином) прогноз благоприятный даже при тяжелом течении болезни. Летальные исходы наблюдались очень редко (менее 1%), а после введения в практику антикоагулянтов летальных исходов не наблюдается.
Профилактика Эпидемического сыпного тифа:
Для профилактики сыпного тифа большое значение имеет борьба со вшивостью, ранняя диагностика, изоляция и госпитализация больных сыпным тифом, необходима тщательная санитарная обработка больных в приемном покое стационара и дезинсекция одежды больного. Для специфической профилактики использовалась инактивированная формалином вакцина, содержащая убитые риккетсии Провачека. Вакцины использовались во время повышенной заболеваемости и были эффективными. В настоящее время при наличии активных инсектицидов, эффективных методов этиотропной терапии и низкой заболеваемости значение противосыпнотифозной вакцинации значительно снизилось.
К каким докторам следует обращаться если у Вас Эпидемический сыпной тиф:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Эпидемического сыпного тифа, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Эндемический сыпной тиф — типичная зоонозная инфекция (передается от животных человеку), которая вызывает заболевание с доброкачественным течением, розеолезно-папулезной сыпью и лихорадкой.
Инфекция хранится в организме крыс и мышей, распространяется этими грызунами, а также блохами и клещами. Человек заражается в основном алиментарным путем (через еду и воду, которыми питается) – в случае если продукты заражены экскрементами грызунов. Существует угроза заражения при втирании к пораженную кожу и слизистые оболочки фекалий инфицированных блох и клещей или вдыхании воздуха со взвешенными фекалиями эктопаразитов. До сих пор не известно, есть ли риск заражения эндемическим сыпным тифом через укусы зараженных блох и клещей.
Заболевание фиксируется в виде отдельных случаев в эндемичных очагах. На территории России к такими очагам принадлежат Дальний Восток, бассейны Черного и Каспийского морей, а также Средняя Азия.
Что провоцирует / Причины Эндемического сыпного тифа у детей:
Возбудителями эндемического сыпного тифа у детей являются риккетсии, которые были открыты исследователем R. Mooser в 1928 г. Они сходны с риккетсиями Провацека по своим морфологическим свойствам (составу). У них есть общий термостабильный антиген, потому данные риккетсии дают перекрестные реакции с сыворотками больных сыпным тифом. Заболеваемость крысиным сыпным тифом спорадическая (в виде разрозненных случаев, в отличие от эпидемических вспышек).
Патогенез (что происходит?) во время Эндемического сыпного тифа у детей:
Патогенез и патоморфология практически аналогичны с эпидемическим сыпным тифом. В основе патогенеза лежит деструктивно-пролиферативный тромбоваскулит, чаще всего артериол и прекапилляров. Но эти изменения менее выражены и их проявления не такие длительные, чем при эпидемическом сыпном тифе у детей.
Симптомы Эндемического сыпного тифа у детей:
Инфекция похожа на легкий вариант эпидемического сыпного тифа. От 5 до 15 дней длится инкубационный период (от заражения до начала заболевания). Начало болезни характеризуется повышением температуры у ребенка, головными болями, легким познабливанием, артралгиями. Максимум температуры фиксируют на 4-5 сутки после начала заболевания. Температура держится повышенной на протяжении 3-5 дней, затем начинается снижение.
Есть вероятность ремитирующей лихорадки – с суточными значительными повышениями и понижениями температуры тела (но при этом она не приходит в норму). Но чаще всего температура тела постоянна, в период нормализации начинаются колебания.
На 4-5 сутки после начала эндемического (блошиного) тифа у детей появляется сыпь. При этом лихорадка достигает максимума. Сыпь проявляется на животе, груди, а затем на руках и ногах. Изначально сыпь имеет розеолезный характер, затем превращается в папулезную, с единичными петсхиями. Сыпь может локализироваться на теле на протяжении 10 дней.
В пик высыпаний возникают такие симптомы как наклонность к брадикардии, гипотония, общая слабость, головокружение. Статус тифозус практически не возникает. Редко увеличены печень и селезенка. Анализ крови показывает лейкопению в первые дни болезни, а потом лейкоцитоз с лимфоцитозом.

Формы эндемического крысиного тифа:
- легкая,
- среднетяжелая,
- тяжелая.
Причем у детей встречаются в основном легкие и среднетяжелые формы. Болезнь протекает благоприятно, без осложнений. Но иногда (довольно редко) бывает пневмония, отит, тромбофлебит.
Диагностика Эндемического сыпного тифа у детей:
Для диагноза необходимы эпидемиологические, клинические и лабораторные данные. На основании клинических данных дифференцировать болезнь с легкими формами эпидемического сыпного тифа практически невозможно. Значение для постановки диагноза имеет нарастание титра антител в РСК с антигеном из риккетсии Музера.
В затрудненных случаях диагностики проводят биопробу с целью выявления скротального феномена Нейля-Музера при экспериментальном заражении свинок-самцов.
Лечение Эндемического сыпного тифа у детей:
Лечение схоже по принципам и методам с лечением эпидемического сыпного тифа у детей. Применяют антибиотики тетрациклиновой группы или левомицетин на протяжении 4-5 суток. Нет необходимости в приеме гепарина, потому что при эндемическом сыпном тифе у детей нет тромбоэмболических осложнений.
Этиотропное лечение заключается в назначении антибиотиков тетрациклиновой группы, как было сказано выше. В частых случаях назначают прием тетрациклина внутрь по 20-30 мг/кг 4 раза в день. В более редких случаях применяют левомицетин по 0,5-0,75 г 4 раза в сутки (курс составляет 4-5 дней).
В тяжелых случаях можно назначать левомицетина сукцинат натрия внутривенно или внутримышечно по 0,5-1 г 2-3 раза в сутки на протяжении первых 1-2 дней. Когда температура тела приходит в норму, препарат принимают перорально. Если во время приема антибиотиков начинаются осложнения из-за бактериальной флоры, то с учетом характера осложнения назначают дополнительно соответствующий химиопрепарат.
Профилактика Эндемического сыпного тифа у детей:
Профилактические меры заключаются в уничтожении крыс и мышей, предупреждении их проникновения в квартиры, дома, дачи, изоляции пищевых продуктов от грызунов. Для активной иммунизации взрослых предложена убитая вакцина из риккетсии Музера. У детей же вакцина не применяется.
К каким докторам следует обращаться если у Вас Эндемический сыпной тиф у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Эндемического сыпного тифа у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Нейтрофилы представляют собой разновидность лейкоцитов, составляя около половины от их общей массы. Задача этих клеток – поддержание работоспособности нашего иммунитета. При попадании в организм патогенных микроорганизмов нейтрофилы их обнаруживают, после чего поглощают, переваривают и умирают – этот процесс называется фагоцитозом.
Синонимы: нейтрофильные гранулоциты, NEUT, нейтрофильные сегментоядерные гранулоциты, полиморфонуклеарные нейтрофилы
Различают шесть видов нейтрофилов в зависимости от стадии их созревания. К незрелым видам относятся миелобласты, промиелоциты, миелоциты, метамиелоциты и палочкоядерные клетки. Конечный этап развития – сегментоядерные нейтрофилы (зрелые клетки с образовавшимся ядром, разделенным на несколько сегментов).
Даже на стадиях своего начального развития нейтрофилы способны противостоять инфекции, хотя зрелые сегментоядерные клетки справляются с этой задачей значительно эффективнее.
В анализах крови людей, страдающих тяжелыми инфекционными заболеваниями, можно обнаружить незрелые формы нейтрофилов. Это объясняется тем, что в борьбе с патогенными микроорганизмами сегментоядерные клетки гибнут слишком быстро, а потому организм вынужден задействовать не до конца созревшие клетки. А вот в крови здорового человека обнаруживаются преимущественно зрелые нейтрофилы, поскольку они хорошо справляются со своей задачей практически без помощи своих юных собратьев.
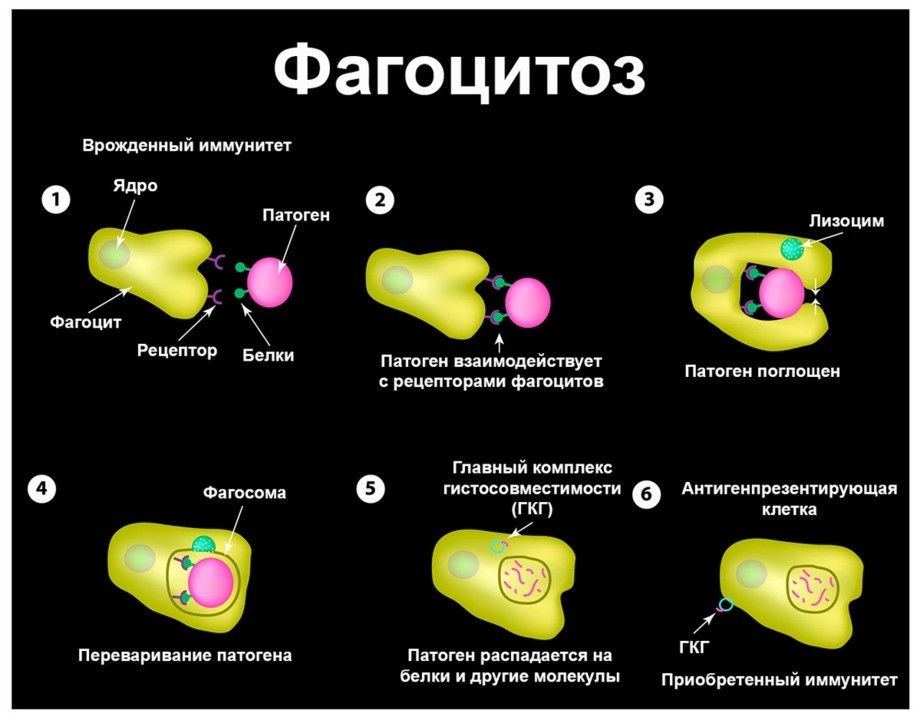
Рисунок 1. Фагоцитоз. Изображение: mikrostoker / Depositphotos
Анализ крови на нейтрофилы
Для определения уровня содержания нейтрофилов используют общий анализ крови. Для обозначения нейтрофилов на бланке анализа используют латинское сокращение NEUT, которое может выражаться как в абсолютном (содержание клеток на литр крови, например 0,04—0,3 × 10 9 ), так и в процентном значении. Для общего анализа, как правило, используется капиллярная кровь. Забор биоматериала осуществляется из пальца после прокола скарификатором. Иногда забор крови проводится из вены – многое зависит от методов, которые использует лаборатория.
Показания к анализу
Общий анализ крови – самое распространенное гематологическое исследование, поэтому спектр показаний для его назначения широк. Нейтрофилы представляют собой разновидность лейкоцитов, основная задача которых – уничтожение патогенных микроорганизмов. Поэтому главная цель анализа на содержание нейтрофилов – выявление потенциально опасных состояний, сопровождающихся инфекционно-воспалительными процессами. Иными словами, анализ крови на нейтрофилы может быть информативен как при простудных заболеваниях, так и при болезнях почек или печени.
Подготовка к анализу
Исследование проводится с утра натощак, поскольку прием пищи вызывает рост числа нейтрофилов в крови. Ужин накануне анализа допускается не позднее восьми часов вечера. За 2 суток до исследования пациенту следует соблюдать следующие правила подготовки:
- отказаться от употребления алкоголя;
- ограничить употребление острой, жареной и жирной пищи;
- избегать тяжелых физнагрузок и нервных стрессов.
Утром накануне исследования нельзя курить. Допускается прием чистой негазированной воды.

Рисунок 2. Подготовка к сдаче крови для анализа.
Нормы содержания нейтрофилов в крови
Количество нейтрофилов в крови составляет примерно 40-70% от всей лейкоцитарной массы как у мужчин, так и у женщин. При исследовании специалисты в первую очередь обращают внимание на содержание нейтрофилов средней и полной стадий созревания, то есть палочкоядерных и сегментоядерных форм. Молодые клетки представляют интерес при подозрении на развитие распространения воспалительных процессов. В таблице приведена лейкоцитарная формула, где отражено в числе прочего и количество нейтрофилов.
| Показатель | × 10х9/л | Доля в процентах от числа лейкоцитов | |
| Нейтрофилы | сегментоядерные | 2.0 – 5.5 | 40 - 70 |
| палочкоядерные | 0.4 – 0.3 | 1 - 5 | |
| Базофилы | В пределах 0.062 | В пределах 1.0 | |
| Эозинофилы | 0.02 – 0.3 | 0.5 - 5 | |
| Лимфоциты | 1.0 – 3.2 | 17 - 38 | |
| Моноциты | 0.07 – 0.5 | 3 - 12 | |
У детей первого года жизни количество палочкоядерных нейтрофилов может достигать пяти, затем максимальное значение ограничивается четырьмя, как и у взрослых. Наименьшее количество сегментоядерных нейтрофилов наблюдается у детей 4-5 лет (35-55%). У других возрастных групп оно варьируется в пределах 40-70%.
Причины повышения нейтрофилов в крови
Повышенный уровень нейтрофилов может свидетельствовать о большом количестве заболеваний и травм. Очень часто причиной повышения нейтрофилов в крови становятся инфекционные процессы бактериального происхождения, которые могут быть как очаговыми, так и генерализованными (распространившиеся по всему организму).
Причины повышения уровня нейтрофилов в крови:
- инфекции верхних дыхательных путей (ларингит, фарингит, ангина);
- пневмония;
- заболевания почек;
- болезни сердечно-сосудистой системы;
- местные гнойно-воспалительные очаги (абсцессы, нарывы);
- вирусные заболевания (корь, паротит, ветрянка, краснуха и т.д.);
- онкологические заболевания;
- прием гормональных препаратов;
- инфекции бактериального происхождения (дизентерия, туберкулез, холера, сибирская язва и т.д.);
- отравления токсическими веществами;
- процессы омертвения тканей (гангрена, инфаркт миокарда, крупные ожоги);
- травмы крупных органов;
- переломы;
- повреждения кожных покровов (порезы, ссадины и т.д.);
- подагра;
- сепсис (заражение крови).
Употребление в пищу консервированных продуктов тоже может стать причиной повышения нейтрофилов. Это касается тех продуктов, в которых уже не осталось живых бактерий, однако сохранились токсические продукты их жизнедеятельности.
Причины пониженного уровня нейтрофилов в крови
Снижение уровня нейтрофилов в крови называют нейтропенией. Причиной этого явления могут быть заболевания различной природы, а также прием различных препаратов.
Причины снижения уровня нейтрофилов:
- инфекционные заболевания (вирусные гепатиты, сыпной тиф, грипп, мононуклеоз и т.д.);
- аутоиммунные заболевания (ревматоидный артрит, системные васкулиты, болезнь Крона и т.д.);
- лучевая болезнь;
- болезни крови (лейкозы, гемолитические и дизэритропоэтические анемии).
Отдельно следует упомянуть лекарственные препараты: их прием также может стать причиной нейтропении. Это очень обширная группа медикаментов, в которую входят:
- НПВС (нестероидные противовоспалительные средства: анальгин, амидопирин);
- антибактериальные препараты (цефалоспорины, пенициллины);
- препараты для снижения сахара (хлорпропамид);
- тиреостатические средства (пропилтиоурацил, мерказолил);
- противомалярийные препараты синтетического происхождения (гидроксихлорохин);
- сульфаниламиды (сульфапиразон; сульфасалазин);
- цитостатики (хлорамбуцил, метотрексат);
- противовирусные средства (ганцикловир, зидовудин).
Последствия отклонения нейтрофилов от нормы
Изменение уровня нейтрофилов в крови – сигнал организма о наличии воспалительных заболеваний, травм или отравлений. Поэтому необходимо точно определить причину повышения или понижения нейтрофилов, чтобы вовремя начать лечение или устранить провоцирующий фактор. Если это не сделать вовремя, последствия могут быть самыми тяжелыми (вплоть до летального исхода). Наибольшую опасность в числе возможных причин представляют инфекционные заболевания бактериальной природы, а также процессы местного нагноения и некротизации (омертвения) тканей.
Как уменьшить количество нейтрофилов в крови
Для снижения количества нейтрофилов в крови необходимо воздействовать на причину этого явления, поскольку каких-то обособленных способов его устранения не существует. Если повышение уровня нейтрофилов вызвано кратковременным стрессом или повышенной физической нагрузкой, то специфической коррекции не требуется.
При стойком нейтрофилезе в зависимости от заболевания, послужившего причиной его возникновения, используются следующие методы лечения:
- противомикробная терапия – при инфекциях используют антибиотики (амоксициллин, цефиксим);
- антиагрегантная терапия – при инфаркте и склонности к тромбам назначается ацетилсалициловая кислота, алтеплаза;
- противовоспалительная терапия – для снижения воспалительных явлений, провоцирующих нейтрофилез, применяют глюкокортикостероиды (преднизолон);
- химиотерапия – направлена на борьбу со злокачественными образованиями (цитостатики, антиметаболиты).
При наличии местного очага воспаления может применяться хирургическое лечение. Например, оно актуально при аппендиците или абсцессах. В меню следует ограничить количество мясных продуктов, консервированных и копченых. Рацион должен быть насыщен овощами и фруктами.
Как увеличить количество нейтрофилов в крови
Для коррекции нейтропении необходимо выявить ее причину. Если снижение уровня нейтрофилов вызвано приемом медикаментозных препаратов, следует в первую очередь соотнести возможные риски падения уровня нейтрофилов с важностью терапевтического эффекта применяемых лекарств. В крайнем случае препарат могут заменить на аналог, не влияющий на уровень нейтрофилов в крови. Основные заболевания, ставшие причиной нейтропении, лечат при помощи антибиотиков, противовоспалительных и противовирусных препаратов.
Рекомендуется употреблять следующие продукты:
- любые мясные блюда (важно, чтобы все они были хорошо обработаны термически);
- яйца вкрутую;
- пастеризованное молоко;
- сыр (кроме сортов с плесенью);
- картофель;
- рис;
- макаронные изделия;
- фрукты и овощи;
- алкоголь только по согласованию с врачом.
Тщательная термическая обработка мяса и яиц необходима для того, чтобы исключить возможность попадания в организм бактерий и микробов, которые активно размножаются в плохо прожаренных или недоваренных белковых блюдах.
Заключение
Отклонение уровня содержания нейтрофилов в крови от нормы может быть вызвано целым рядом заболеваний, травм, а также приемом медикаментов. Поэтому нет смысла поднимать или снижать их уровень искусственно: необходимо выявить и устранить причину, повлиявшую на результаты анализов. При своевременно начатом лечении и выполнении всех рекомендаций врача уровень нейтрофилов в крови нормализуется.
В этой статье мы собрали самые важные вопросы, которые задают будущие родители о тех исследованиях, которые они уже прошли или только собираются пройти, ожидая ребенка.
Автор:
Возможно, вы только что узнали о своей беременности. Врач говорит, что скоро нужно будет пройти какой-то скрининг, а еще давным-давно вы читали статью о том, что на свете есть особые дети, и вот именно сейчас в сердце закралась тревога.
А может быть, вы уже сделали скрининг, и врач говорит, что у малыша, скорее всего, синдром Дауна. Что делать дальше? Какие еще исследования пройти?
Кто бы вы ни были, эта статья – для вас. Надеемся, она поможет вам сориентироваться в вопросах пренатальной диагностики и даст понимание, куда двигаться дальше.
Что такое пренатальная диагностика?
Во время беременности каждой женщине предлагают пройти комплексную диагностику. С ее помощью можно определить, могут ли у будущего малыша быть проблемы со здоровьем или генетические отклонения, в том числе синдром Дауна. Эти исследования дают информацию, которая помогает семье принять взвешенное решение о судьбе своего будущего ребенка.
Очень важно вовремя встать на учет по беременности, для того чтобы не пропустить важные исследования, так как все они проводятся на определенных сроках беременности.
Скрининговые тесты помогают определить группу будущих мам, у которых есть высокая вероятность развития хромосомных отклонений у плода, – в этом случае назначаются дополнительные подтверждающие исследования.
Одновременно с этим анализы выявляют те беременности, для которых повышенной угрозы нет. В этом случае их результаты отрицательные, и необходимости в дополнительных исследованиях (кроме скринингов, проводимых 1 раз в триместр) – нет.
Первый скрининг при беременности проводят между 11 и 13 неделями. Исследование включает в себя УЗИ и анализ крови.
Второй скрининг при беременности проводят на сроке 18–20 недель. В него включены те же два этапа – УЗИ и анализ крови, однако последний сдается только в том случае, если женщина не делала первый скрининг.
Третий скрининг при беременности проводят на 30–34 неделе. Основа третьего скрининга – УЗИ, основная цель которого – определить стратегию родов.
По результатам скринингов в случае необходимости могут назначаться дополнительные исследования.
Как понять, возможен ли у будущего ребенка синдром Дауна?
Есть несколько методов пренатальной диагностики, которые могут дать ответ, родится малыш с синдромом Дауна или нет. Они бывают неинвазивными и инвазивными. Анализ крови и УЗИ – это неинвазивные методы, т.к. их проведение не требует особого вмешательства в организм матери. Никакого риска для будущего ребенка они не несут. Но их результатам далеко не всегда можно доверять. Если вам по результатам УЗИ сказали, что у малыша возможен синдром Дауна, – не воспринимайте это как окончательный диагноз. Это лишь сигнал, что желательно провести дополнительные инвазивные исследования. Их смысл – получить для исследования клетки самого плода. Врачи-генетики, рассматривая эти клетки в микроскоп, смогут увидеть в них лишнюю хромосому и тогда уже поставить точный диагноз – есть ли у будущего малыша синдром Дауна или нет.
Как получить клетки эмбриона? Они есть в околоплодных водах. Чтобы их исследовать, нужно сделать прокол оболочки околоплодного пузыря. Такая медицинская процедура, к сожалению, бывает довольно дискомфортна для мамы, а кроме того, она может быть опасной и для малыша, ведь в результате ее проведения возрастает вероятность выкидыша.
Дальше мы подробнее ответим на вопросы о каждом методе пренатальной диагностики.
Что оценивает врач в процессе первого скрининга, чтобы не пропустить синдром Дауна?
Кроме УЗИ плода, скрининг включает в себя и анализ крови матери. Врач обращает внимание на значения белков материнской сыворотки. При этом он также учитывает такие факторы, как возраст матери (чем она старше, тем риск больше) и историю беременностей (если таковые уже были). Результаты УЗИ и анализа крови врач анализирует комплексно – так результаты будут точнее.
Если первый скрининг показал, что повышен риск рождения ребенка с синдромом Дауна, – что делать дальше?
Может оказаться, что беременная женщина по результатам скрининга попадает в так называемую группу риска. Это сигнал, что желательно провести дальнейшие исследования, чтобы точно установить диагноз. На данном этапе важно, какую позицию занимает консультирующий врач. Именно он должен объяснить женщине и ее семье ситуацию и риски, правильно сориентировать и помочь выбрать тактику дальнейших действий. Кто-то из беременных этой группы предпочитает оставить всё как есть, не проводить дополнительных исследований и ожидать рождения малыша, а кто-то соглашается на инвазивную процедуру.
Что такое инвазивная процедура? Это опасно?
Инвазивная процедура – это метод, позволяющий с высокой степенью точности ответить на вопрос: есть у малыша синдром Дауна или нет. Инвазивные тесты позволяют практически в 99 % случаев выявить хромосомные аномалии у плода.
Существует несколько инвазивных процедур, из которых самые распространенные – биопсия ворсин хориона и амниоцентез. Подробно о каждом из них вы можете прочитать по ссылкам ниже, а здесь мы обозначим их сущность вкратце.
Для проведения амниоцентеза из матки женщины берется для исследования образец околоплодной жидкости. Зачем это делается? Дело в том, что в этой жидкости находятся клетки эмбриона, т.е. врач через микроскоп видит клетки будущего ребенка и может определить, есть ли в них дополнительная хромосома, которая говорит о наличии синдрома Дауна.
Биопсия ворсин хориона (БВХ) – это анализ эмбриональной ткани (хориона). Процедура похожа на амниоцентез и тоже предполагает прокол стенки матки. В отличие от амниоцентеза, биопсию хориона проводят несколько раньше по срокам.
Решение о том, делать ли инвазивные исследования, могут принять только сами будущие родители, т.к. эти процедуры сопровождаются риском выкидыша.
Если этот анализ дает такой точный результат, почему его не делают всем?
Основная причина в том, что НИПТ – довольно дорогостоящий анализ. Кроме того, одни лаборатории имеют необходимое для него оборудование (сложное и очень дорогостоящее), а другие выступают как посредники, которые отсылают биоматериал для проведения анализа за границу.
К тому же НИПТ является скрининговым методом, и в случае выявления высокого риска хромосомной патологии у плода всё равно потребуется проведение уточняющей инвазивной диагностики.
Если я сделаю НИПТ, какие возможны варианты действий дальше?
Ситуации возможны разные.
Если у женщины отрицательный результат по НИПТ, это говорит о низких рисках с вероятностью до 97 %, но не исключает синдром Дауна полностью. Поскольку НИПТ – это неинвазивный тест (для него не используют ни биопсию ворсин хориона, ни амниоцентез), то, несмотря на статистическую точность, следует иметь в виду, что это всё-таки расчетные, а не объективные данные.
Если по предыдущим неинвазивным скринингам риск наличия синдрома Дауна выше, чем 1:100, НИПТ не показан, поскольку в этом случае также не стоит надеяться на расчетные данные. Велика вероятность ошибки: возможны не только ложноотрицательные, но и ложноположительные результаты, что повлечет за собой опасность избавиться от здорового плода.
Еще одна сложность при использовании НИПТ заключается в следующем: если тест проводился после 12 недель беременности и показывает положительный результат – это не будет считаться основанием для перывания беременности. В таком случае для принятия решения всё-таки придется сделать инвазивный тест.
С другой стороны, результаты НИПТ достаточно точные, и в тех случаях, когда предыдущие неинвазивные тесты показывают риск ниже, чем 1:100, женщина для собственного спокойствия может пройти это исследование.
Можно ли отказаться от всех скринингов и исследований?
Да, можно. Будущей маме лишь рекомендуется сделать скрининг – обязанности у нее нет. Врач не может заставить вас делать те или иные тесты и анализы.
Зачем мне заранее знать, будет ли у моего ребенка синдром Дауна или нет?
Все решения, которые касаются судьбы будущего ребенка, принимают исключительно его родители. Ни ваш гинеколог, ни генетик, ни родственники – никто не имеет права склонять вас к тому или иному решению. Но при этом семье очень важно владеть достоверной информацией. Зная, что у будущего малыша, вероятнее всего, синдром Дауна, родители могут поступить по-разному. Кто-то принимает решение о прерывании беременности. Кто-то старается узнать побольше о синдроме, чтобы подготовиться к рождению особого малыша и сразу оказать ему необходимую помощь – и медицинскую, если это нужно, и педагогическую. Кто-то ищет и находит семьи, в которых растут дети с синдромом Дауна, знакомится с ними, общается, заранее занимается поиском профильных организаций и получает там полезную информацию и поддержку. В таком случае рождение особого ребенка не становится для семьи неожиданным ударом, а остается запланированным и таким же долгожданным событием, как рождение любого ребенка, – просто уже с учетом его особенности. Знание о диагнозе малыша помогает будущим родителям перестать жить в пассивной тревоге и отчаянии: ведь когда ты знаешь, чего ожидать, ты можешь начать действовать.
У кого больше всего вероятность родить ребенка с синдромом Дауна?
Ребенок с синдромом Дауна может появиться в любой семье. В данном случае не имеют значения ни социальное положение родителей, ни их состояние здоровья, ни экономическое благополучие, ни национальность, ни место проживания, ни что-либо другое. Единственное, что считается фактором риска для рождения ребенка с синдромом Дауна, – это возраст матери. Чем старше женщина, тем выше вероятность, что у нее может появиться ребенок с синдромом Дауна. Поэтому женщинам старше 35 лет настоятельно рекомендуется проходить пренатальную диагностику. Впрочем, не стоит забывать о том, что дети с синдромом Дауна рождаются у женщин любого возраста.
Можно ли еще до наступления беременности узнать, есть ли вероятность генетических нарушений у будущего ребенка?
В подавляющем большинстве случаев синдром Дауна – это генетическая случайность, но бывают случаи сбалансированной хромосомной перестройки (транслокация, инверсия) или мозаичный кариотип (наличие клеточного клона с аномальным числом хромосом) у кого-либо из родителей. Их поможет обнаружить генетическое исследование
Врач предлагает мне сделать аборт, потому что у малыша синдром Дауна. Он прав?
Читайте также:

