Синдром эндогенной интоксикации у новорожденного
Обновлено: 24.04.2024
Эндотоксины представляют собой естественные продукты, которые образуются в результате жизнедеятельности организма. В норме одни обезвреживаются при помощи различных реакций и выводятся из организма естественным путем. Кроме того, эндотоксины могут вырабатывать некоторые грамположительные и грамотрицательные бактерий. При нарушении естественных защитных механизмов, либо при возникновении определенных заболеваний, уровень эндотоксинов повышается, что неблагоприятно сказывается на работе всего организма. Современное оборудование и методики позволяют произвести удаление вредных продуктов и устранить, тем самым, негативные последствия.
Классификация эндотоксинов
Привести к развитию синдрома эндогенной интоксикации могут несколько групп веществ. К ним относятся:
- Бактериальные эндотоксины.
- Продукты нормального обмена веществ в высокой концентрации.
- Активированные ферменты, которые способны повреждать ткани.
- Медиаторы воспаления.
- Продукты перекисного окисления.
- Среднемолекулярные вещества различной природы.
- Ингредиенты нежизнеспособных тканей.
Таким образом, выделяют ряд состояний, при которых возможно поражение организма эндотоксинами. К ним относятся: все виды шока, ожоговая болезнь, тиреотоксикоз, перитонит и др.
Симптомы синдрома эндогенной интоксикации
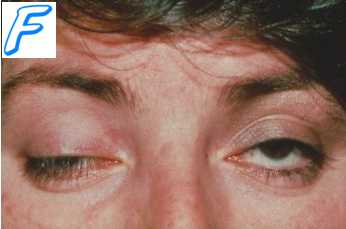
Одним из главных проявлений эндогенной интоксикации является угнетение сознания разной степени выраженности. Вместе с этим, могут наблюдаться и другие симптомы:
- Слабость.
- Головная боль.
- Миалгия.
- Сухость слизистых.
- Тошнота и рвота.
- Тахикардия.
- Гипо- или гипертермия.
- Тахи- или брадипоноэ.
Помимо этого, при повышенной концентрации токсических веществ появляются нарушения микроциркуляции, изменяются реологические свойства крови, снижается сосудистый тонус. Действие данных факторов может привести к развитию кардиодепрессии, респираторного дистресс-синдрома, гипоксии тканей и, как следствие, органной (сердечной, почечной) или полиорганной недостаточности.
Диагностика синдрома эндогенной интоксикации
Помимо анализа клинической картины, для диагностики данного синдрома врач обязательно назначает лабораторное обследование. К признакам эндогенной интоксикации относятся:
- Лейкоцитоз.
- Повышенные значения лейкоцитарного и ядерного индексов интоксикации (выше 1,5 и 0,3 соответственно).
- Пониженное содержание в крови общего белка.
- Высокий уровень билирубина, мочевины, креатинина сыворотки.
- Энзиомпатия (повышение АЛАТ, АСАТ, ЛДГ, кислой фосфатазы).
- Увеличение концентрации среднемолекулярных пептидов.
- Значение коэффициента нейтрофилы/лимфоциты выше 2.
В зависимости от величины данных показателей, выделяют 3 степени эндогенной интоксикации. Состояние пациента, которое соответствует третьей степени, является крайне тяжелым и имеет неблагоприятный прогноз.

Способы удаления эндотоксинов
Лечение происходит с применением методов, которые способствуют максимальному удалению токсических веществ из организма. Выделяются следующие механизмы детоксикации:
- Трансформация в печени. Осуществляется с помощью оксигенации крови, гемоперфузии через ксеноорганы и клеточные взвеси, фотомодификации крови.
- Сорбционный метод, в рамках которого используют множество методик: плазмо- и гемосорбция, лимфосорбция и др. Перспективной является современная технология селективной сорбции эндотоксина на картриджах для экстракорпоральной гемоперфузии.
- Элиминация эндотоксинов. Производится при проведении плазмафереза, форсированного диуреза, гемофильтрации, гемодиализа, обменного переливания крови и др.
Синдром эндогенной интоксикации. Клиника синдрома эндогенной интоксикации.
В настоящее время одной из наиболее сложных проблем интенсивной терапии является синдром эндогенной интоксикации (СЭИ), сопровождающий значительное количество патологических состояний (шок, перитонит, панкреатит и др.), которые по мере своего развития могут приводить к летальному исходу.
Прогрессирование эндотоксикоза обусловлено накоплением в крови различных по происхождению, химической структуре и биологическому воздействию веществ, именуемых эндотоксинами. Эндотоксины способствуют развитию острой почечно-печеночной недостаточности, сердечно-сосудистой недостаточности, острого респираторного дистресс-синдрома, приводя в конечном итоге к появлению крайне тяжелого состояния - синдрома мультиорганной дисфункции.
Эндогенная интоксикация - клинический синдром, возникающий при различных по этиологии патологических состояниях, обусловленных накоплением в тканях и биологических жидкостях организма продуктов нарушенного обмена веществ, метаболитов, деструктивных клеточных и тканевых структур, разрушенных белковых молекул, pi сопровождающийся функциональными и морфологическими поражениями органов и систем организма.
Выделяют три основных звена, которые определяют тяжесть состояния больных и выраженность клинической симптоматики: токсемия, нарушение микроциркуляции, угнетение функций собственных детоксицирующих и защитных систем организма.
Основным звеном патогенеза синдрома эндогенной интоксикации является токсемия. К сожалению, четкая дифференциация токсических веществ эндогенного происхождения практически невозможна. Однако в каждом конкретном случае можно выделить "первичные" и "вторичные" эндотоксины. Так, при ожогах, синдроме длительного раздавливания, облитерирующих сосудистых заболеваниях "первичными" являются продукты белковой деградации, "вторичными" - продукты естественного метаболизма, накопление которых в организме является следствием угнетения функций естественной детоксикации и экскреции.
Эндотоксемия, нарушая тонус периферических сосудов, реологию крови, кинетические и механические свойства форменных элементов крови, приводит к тканевой гипоксии, которая является одним из важных звеньев патогенеза СЭИ, течение которого усугубляется снижением функции органов естественной детоксикации и экскреции. Токсины блокируют места связывания молекул альбумина, что ведет к снижению эффективности проводимого медикаментозного лечения, поскольку этот белок является транспортным агентом для многих фармакологических препаратов.
Клиника синдрома эндогенной интоксикации.
Сопоставление экспериментальных и клинических исследований позволило выявить следующие стадии развития синдрома эндогенной интоксикации.
I стадия синдрома эндогенной интоксикации. Реактивно-токсическая возникает в ответ на формирование первичного деструктивного очага или травматического повреждения. Лабораторными признаками этой стадии являются повышение в крови уровней молекул средней массы (МСМ), продуктов перекисного окисления липидов (ДК и МДА), возрастание ЛИИ.
II стадия синдрома эндогенной интоксикации - стадия выраженной токсемии развивается после прорыва гастогематического барьера, когда в циркулирующую кровь попадают эндотоксины, образовавшиеся в первичном очаге интоксикации, с последующим распространением и накоплением в организме. В зависимости от состояния организма, его резистентности и исходного уровня детоксицирующих и иммунных систем выделяют компенсированную и декомпенсированную стадии выраженной токсемии.
III стадия синдрома эндогенной интоксикации - мультиорганной дисфункции (СМОД) наблюдается при дальнейшем прогрессировашш патологического процесса как следствие тяжелого повреждения эндотоксинами различных органов и систем с развитием их функциональной декомпенсацш!. Клинически эта стадия Проявляется нарушением сознания, гипоксией, выраженной сердечной Недостаточностью, олигурией, паралитической непроходимостью кишечника. В крови определяется высокая концентрация креатинина, мочевины, билирубина.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Этиология синдрома эндогенной интоксикации. СЭИ встречается при гнойно-воспалительных заболеваниях (перитонит, холецистит, панкреатит и др.), тяжелых травмах (краш-синдром), некоторых заболеваниях (сахарный диабет, тиреотоксический зоб), различных отравлениях и др.
Патогенез синдрома эндогенной интоксикации. Что может объединять данные нозологические формы, весьма далекие по этиологии? На определенном этапе заболевания, при стечении неблагоприятных факторов, это будет: 1. Токсемия, 2. Тканевая гипоксия и 3. Угнетение функции собственных детоксицируюших и защитных систем организма.
Основным звеном данного патологического каскада является токсемия (В. А. Остапенко, 1994).

Токсемия
Токсемию вызывает избыточное накопление в организме эндотоксинов. С. А. Симбирцев и Н. А. Беляков (1994) классифицируют эндотоксины по следующим группам:
• продукты естественного обмена в высоких концентрациях;
• активированные ферменты, способные повреждать ткани;
• медиаторы воспаления и другие биологически активные вещества (БАВ);
• класс среднемолекулярных веществ различной природы;
• перекисные продукты;
• неоднородные по составу ингредиенты нежизнеспособных тканей;
• агрессивные компоненты комплемента;
• бактериальные токсины (экзо- и эндотоксины).
Эндотоксины вызывают деструкцию белков и липидов клеток, блокируют синтетические и окислительные процессы. Особо следует акцентировать внимание на биологически активных веществах (БАВ) и средних молекулах (СМ).
Существуют четкие корреляции между концентрацией в крови и тканях продуктов калликреин-кининового каскада, биогенных аминов и степенью структурных поражений при многих острых процессах. Во всех случаях увеличение активности медиаторов воспаления сочетается с усилением тяжести поражений органов и систем (С. А. Симбирцев, Н. А. Беляков, 1994).
Эндотоксины оказывают прямое и опосредованное воздействие на структуру клеток, сами клетки, системы и органы (дистантное действие).
По действию на уровне клеточных структур эндотоксины можно классифицировать следующим образом (С. А. Симбирцев, Н. А. Беляков (1994):
• обладающие цитолитическим эффектом;
• активаторы лизосомальных ферментов;
• блокаторы митохондриальной энергетики;
• инициаторы свободнорадикальных процессов;
• ингибиторы рибосомального синтеза;
• способные к воздействию на различные клеточные образования.
Дистантное действие эндотоксинов выражается поражением системы микроциркуляции, которое наблюдается как в виде изолированных вне- и внутрисосудистых расстройств, так и комбинированных изменений. К внесосудистым изменениям относят нарушение регуляции тонуса периферических сосудов, среди внутрисосудистых изменений основное место отводят нарушениям реологического состояния крови, нарушениям транскапиллярного и трансмембранного обмена.
На уровне межорганных и межсистемных влияний (дистантное повреждение) действие эндотоксинов преломляется следующим образом (С. А. Симбирцев, Н. А. Беляков (1994):
• активаторы комплемента и белых клеток крови;
• активаторы калликреин-кининовой системы;
• активаторы коагуляции и фибринолизиса;
• вещества, изменяющие тонус гладкой мускулатуры;
• индукторы агрегации;
• воздействующие на проницаемость сосудистой стенки.
Это разделение на группы носит элемент условности, поскольку нет четкой границы между особенностями действия эндотоксинов, когда одни и те же вещества запускают каскадные реакции и повреждающий эффект тканевых структур осуществляется синерги-ческим влиянием с одномоментным включением защитных механизмов.
Заключение. Развитие процесса интоксикации можно представить как поступление эндотоксинов из мест образования (очаги воспаления, иммунная система, печень как источник синтеза патологических белков) в кровоток. Через кровь они попадают в органы фиксации и биотрансформации (печень, иммунная система, легкие), органы выделения патологических субстанций (печень, почки, ЖКТ, легкие, кожа), а также в органы и ткани депонирования патологических субстанций (жировая, нервная, костная ткань, органы эндокринной системы, лимфоидная ткань). При различных патологических состояниях, когда количество естественных продуктов жизнедеятельности организма, появившихся в больших количествах в биологических средах, а также заведомо агрессивные компоненты превышают возможности их биотрансформации, развивается СЭИ (К. Я. Гуревич, А. Л. Костюченко, 1994).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

1. Власов А.П. Роль нарушений липидного гомеостаза в патогенезе перитонита / А.П. Власов, В.А. Трофимов, Р.З. Аширов. – Саранск: Изд-во Мордов. ун-та, 2000. – 208 с.
2. Гриц Е.С. Синдром эндогенной интоксикации при беременности (патогенетические механизмы и лабораторная диагностика) / Е.С. Гриц, В.Н. Сидоренко, А.Г. Давыдовский // Репродуктивное здоровье в Белоруссии. – 2009. – № 4. – С. 37–51.
4. Дворянский С.А. Фетоплацентарная недостаточность (клиника, диагностика, лечение, исход) / С.А. Дворянский, Э.М. Иутинский. – Киров, 2009. – 105 с.
5. Карпищенко А.И. Медицинские лабораторные технологии и диагностика: справочник. – СПб.: Интермедина, 1998. – Т. 2. – 350 с.
6. Кильдюшов А.Н. Оптимизация комплексной терапии гестоза: автореф. дис. … д-ра мед. наук. – М., 2004. – 34 с.
7. Клементе Х.М. Использование показателей перекисного окисления липидов и антиоксидантной защиты для прогнозирования и диагностики хронической фетоплацентарной недостаточности // Российский вестник акушера-гинеколога. – 2009.– № 6. – С. 6–9.
8. Коколина В.Ф. Фетоплацентарная недостаточность (патогенез, диагностика, терапия, профилактика): руководство для врачей. / В.Ф. Коколина, А.В. Картелишев, О.А. Васильева – М.: ИД Медпрактика, 2006. – 224 с.
9. Колясова О.Е. Перекисное окисление липидов и методы определения продуктов липопероксидации в биологических средах / О.Е. Колясов А.А. Маркин, Т.Н. Федорова // Лаб. дело. – 1984. – С. 540–545.
10. Кореновский Ю.В. Антиоксидантные энзимы в амниотической жидкости при перинатальной гипоксии новорожденных./ Ю.В. Кореновский, Е.В. Горбенко, Н.И. Фадеева, Б.Я. Варшавский // Мать и дитя: материалы VII Всеросс. научн. форума. – М., 2005. – С. 106.
11. Пешев Л.П. Синдром дизадаптации при угрожающем аборте: автореф. дис. … д-ра мед. наук. – М., 1998. – 36 с.
12. Прокопенко В.М. Эндогенная интоксикация в плаценте при преждевременных родах. // Журнал акушерства и женских болезней. – 2011. – Т. LX. № 1. – С. 56–59.
13. Сидорова И.С. Клинико-диагностические аспекты фетоплацентарной недостаточности. / И.С. Сидорова, И.О. Макаров. – М.: МИА, 2005. – 296 с.
15. Шабалов Н.П. Основы перинатологии / под ред. Н.П. Шабалова, Ю.В. Цвелева. – М.: МЕДпресс-информ, 2004. – 576 с.
Цель исследования: изучение роли эндогенной интоксикации в патогенезе развития дисфункций плаценты у женщин с угрожающим абортом, при пиелонефрите и вазомоторных расстройствах артериального давления.
Материал и методы исследования
В сроки беременности 6-21 неделя были обследованы 50 женщин с физиологической гестацией, 86 беременных с угрожающим абортом из которых у 54, диагностирована плацентарная недостаточность (ПН), 75 беременных с пиелонефритом (у 38 - ПН), 85 пациенток с артериальной гипертензией (у 32 - ПН), 75 беременных с артериальной гипотонией (у 36 - ПН) и 50 женщин с ПН без соматической патологии.
Результаты исследования и их обсуждение
У женщин с физиологическим течением беременности ОКА составила 57,70 ± 4,61 %, ЭКА - 40,00 ± 2,60 %, РСА - 0,69 ± 0,09 усл. ед., ИТ - 0,44 ± 0,025 усл. ед.
В отличие от них, у беременных с угрожающим прерыванием беременности показатели эндогенной интоксикации в основном не были статистически достоверны в сравнении с группой здоровых женщин, за исключением ОКА, которая оказалась ниже у женщин с угрожающим абортом на 15,6 % (Р ≤ 0,05), а при присоединении плацентарной недостаточности - на 25,2 % (Р ≤ 0,05). При этом отмечена тенденция к повышению РСА у женщин с плацентарной недостаточностью и тенденция к снижению индекса токсичности в этой группе. Полученные результаты указывали на сохранение детоксикационных свойств альбумина при изучаемой патологии, несмотря на уменьшение его концентрации в крови.
У беременных с патологией почек эффективная концентрация альбумина была снижена в группе пациенток только с пиелонефритом и в группе с дисфункцией плаценты на фоне изучаемой патологии почти на 1/4. Уменьшение ЭКА возникало параллельно с изменениями ОКА, которая была снижена у беременных только с пиелонефритом на 24,0 % (Р ≤ 0,01), а в группе с развивающейся дисфункцией плаценты - на 29,0 % (Р ≤ 0,01). Так как изменения ОКА и ЭКА при данной патологии оказались однонаправленными, расчетный показатель - РСА, зависящий от них, достоверно не отличался от нормативных значений. ИТ оказался выше нормы на 15,0 % (Р ≤ 0,05) у беременных с пиелонефритом в обеих подгруппах.
Оценка детоксикационных свойств альбумина позволила выявить снижение общей концентрации альбумина в группе беременных с артериальной гипертензией (АГ) и плацентарной недостаточностью на 12,4 % (Р ≤ 0,05), тогда как в группе только с артериальной гипертонией ОКА практически соответствовала нормативным показателям. Эффективная концентрация альбумина снижалась при артериальной гипертензии на 10,5 % (Р > 0,05), а в случае осложнения беременности дисфункцией плаценты на 22,7 % (Р ≤ 0,05) по сравнению с физиологической беременностью. РСА оказался ниже нормального показателя на 11,2 % при АГ и на 7,8 % при АГ с ДП (Р > 0,05), при этом индекс токсичности возрастал на 27,9 и 22,8 % (Р ≤ 0,01) соответственно.
Функциональная способность альбумина, как показателя эндогенной интоксикации, не изменялась у беременных с артериальной гипотонией. Проведенный нами анализ не выявил статистически значимых различий между показателями ОКА, ЭКА и РСА в группе беременных только с артериальной гипотонией. А индекс токсичности оказался даже ниже, чем при физиологической гестации, на 22,2 % (Р ≤ 0,05). Формирование дисфункции плаценты у беременных с гипотонией происходило на фоне повышения уровня эндогенной интоксикации. Изменения ОКА и ЭКА были направлены в сторону снижения на 9,9 % (Р ≤ 0,05) и на 24,3 % (Р ≤ 0,05) соответственно. При этом отмечено снижение РСА, хотя и недостоверное, а ИТ был выше нормы на 30,2 % (Р ≤ 0,05).
Изучение физико-химических свойств альбумина у беременных с плацентарной недостаточностью без соматической патологии выявило снижение ЭКА на 25,8 % (Р ≤ 0,05), а ОКА на 11,6 % (Р ≤ 0,05) по сравнению с нормативными показателями. Однако, резерв связывания альбумина обнаруживал лишь тенденцию к снижению, практически оставаясь на уровне, соответствующем, нормальной гестации. Статистически достоверным оказалось повышение индекса токсичности в группе беременных с развивающейся дисфункцией плаценты без сопутствующей экстрагенитальной патологии на 1/3.
Для изучения уровня эндотоксикоза было проведено определение МДА плазмы и эритроцитов - вторичных продуктов ПОЛ и одного из ферментов антиоксидантной защиты - каталазы плазмы. При нормально развивающейся беременности МДА плазмы составил 4,71 ± 0,75 мкмоль/л, МДА эритроцитов - 36,08 ± 0,93 мкмоль/л, каталаза плазмы - 2239,72 ± 125,9 нмоль/мин/л.
Содержание МДА плазмы увеличивалось почти в 2 раза при угрожающем аборте как с дисфункцией плаценты, так и без нее, а значение МДА эритроцитов оставалось стабильным на уровне нормального показателя во всех группах. В обеих группах беременных с угрожающим абортом было отмечено возрастание активности каталазы плазмы на 17,0 % (Р ≤ 0,05), что было расценено нами как приспособительный механизм, защищающий плодное яйцо в условиях гипоксии на фоне ухудшения гемодинамики в матке на стороне имплантации.
У пациенток с пиелонефритом происходило повышение МДА плазмы на 110,6 % (Р ≤ 0,01), а МДА эритроцитов на 12,2 % (Р ≤ 0,05). В группе женщин, беременность которых осложнилась плацентарной недостаточностью, уровень МДА оказался еще выше: в плазме на 139,1 % (Р ≤ 0,01), а в эритроцитах - на 18,3 % (Р ≤ 0,05) относительно нормативных показателей. При этом активность каталазы плазмы практически не отличалась от показателя в контрольной группе, обнаруживая лишь небольшую тенденцию к снижению.
Активация перекисного окисления липидов у беременных с артериальной гипертензией появлялась повышением концентрации малонового диальдегида в плазме на 26,8 % (Р ≤ 0,01), а в эритроцитах - на 14,3 % (Р ≤ 0,05). Развитие плацентарной недостаточности у пациенток с АГ сопровождалось более высоким ростом уровня МДА плазмы - на 42,5 % (Р ≤ 0,01), при менее значительном повышении МДА эритроцитов - на 8,8 % (Р ≤ 0,05). Эндогенная интоксикация у этой категории обследованных беременных развивалась на фоне снижения активности каталазы плазмы относительно нормативных показателей на 15,5 % (Р ≤ 0,05) у беременных с артериальной гипертензией и на 29,0 % (Р ≤ 0,05) при развитии плацентарной недостаточности у женщин с изучаемой экстрагенитальной патологией.
Полученные данные свидетельствовали также о повышении у беременных с артериальной гипотонией содержания вторичных продуктов липопероксидации. Причем уровень МДА плазмы оказался повышенным в обеих подгруппах беременных с изучаемой патологией на одну треть, а концентрация МДА эритроцитов достоверно увеличивалась на 13,3 % (Р ≤ 0,05). Указанные сдвиги перекисного окисления липидов не сопровождались изменениями активности каталазы плазмы.
При дисфункции плаценты без других осложнений беременности и сопутствующих соматических заболеваний показатели эндотоксикоза были повышены за счет гидрофобного звена. Плацентарная недостаточность развивалась на фоне увеличения МДА плазмы на 28,2 % (Р ≤ 0,05) и МДА эритроцитов - на 10,4 % (Р ≤ 0,05). Активизация ПОЛ происходила на фоне некоторого снижения активности каталазы плазмы на 8,9 % (Р > 0,05).
На основании полученных результатов можно сделать вывод, что одним из ведущих патогенетических механизмов развития плацентарной недостаточности у беременных с экстрагенитальной патологией является синдром эндогенной интоксикации, приводящий к ухудшению стабильности клеточных мембран и нарушению их функционального состояния, степень выраженности которого определялась на основании снижения общей и эффективной концентрации альбумина и накопления МДА в плазме и на мембранах эритроцитов.
Читайте также:

