Синдром гийена барре при вич
Обновлено: 18.04.2024
Синдром Гийена-Барре (СГБ, Guillain-Barré syndrome) – острое поражение периферической нервной системы дизиммунной природы, характеризующееся быстро прогрессирующей мышечной слабостью с формированием вялых параличей и/или парестезии конечностей (монофазная иммуноопосредованная нейропатия).
Классификация
G61.0 – Синдром Гийена-Барре
• Острая краниальная полинейропатия
1) острая воспалительная демиелинизирующая полинейропатия (классическая форма синдрома Гийена-Барре),
5) острая панавтономная нейропатия (острый панавтономный синдром Гийена-Барре, острая пандизавтономия),
Этиология и патогенез
Этиологические факторы синдрома Гийена-Барре окончательно не изучены, что позволяет именовать болезнь идиопатической полинейропатией. Имеются основания рассматривать целый ряд патогенных микроорганизмов в качестве этиологически значимых, поскольку инфицирование ими зачастую (в 66% случаев) предшествует развитию СГБ. В их числе фигурируют следующие: цитомегаловирус, вирус Epstein-Barr, Haemophilus influenzae тип b, Mycoplasma pneumoniae, Campylobacter jejuni и многие другие возбудители инфекционных болезней и процессов.
При этом Campylobacter jejuni является причинно-значимым инфекционным агентом у трети пациентов, а молекулярная мимикрия между ганглиозидами и липосахаридами (эпитопы GM1, GM1b, GD1a, GQ1b, GalNAc-GD1a) данного микроорганизма способствует выработке антиганглиозидных антител. Высокие титры антиганглиозидных антител классов IgM, IgG и IgA, вступающие в реакции с эпитопами аксоплазматического отдела аксонов и миелиновой оболочки, обнаруживаются в сыворотке крови у 40% больных с СГБ.
Не исключается этиологическая роль некоторых видов профилактической иммунизации (противополиомиелитной, антирабической, противодифтерийной, противогриппозной и др.) в развитии СГБ. Риск развития болезни после противогриппозной вакцинации (H1N1) составляет порядка 1-2 случая на 1 миллион привитых.
В ходе генетических исследований выявлена связь между антигенами HLA-54, HLA-CW1, HLA-DQB*3 и СГБ. Обнаружена положительная корреляция между острой воспалительной демиелинизирующей полинейропатией и аллелем DQB1*0603 с уникальным эпитопом DQβED, а также отрицательная корреляции – с аллелями AQB1*0503, DQB1*0601, DQB1*0602 и DQB1*0603, характеризуемыми эпитопом RDP. Считается, что класс HLA является определяющим при различных вариантах СГБ, а сама болезнь представляет комплексное генетическое нарушение, на исход которого оказывают влияние генетические факторы и окружение.
K.H. Chang и соавт. (2012) описали 256 генов и 18 генных сетей, достоверно ассоциированных с СГБ; среди них наиболее частыми генами оказались FOS, PTGS2, HMGB2 и MMP9.
Болезнь вызывается аномальным Т-клеточным ответом, индуцированным инфекционным процессом. Возникает воспалительная нейропатия с перекрестной реактивностью между антителами к инфекционным агентам и антителами к нейроантигенам, поскольку липоолигосахариды в клеточной стенке бактерий напоминают ганглиозиды, а антиганглиозидные антитела формируются в ответ острые инфекции.
Таким образом, СГБ рассматривается, как приобретенная иммуноопосредованная нейропатия, развивающаяся вследствие аберрантной иммунной реакции на предшествующее иммуноактивирующее событие (перенесение вирусной инфекции, вакцинация и т.д.). Иммунопатологические реакции приводят к аутоиммунному повреждению тканей, ассоциированному с механизмами молекулярной мимикрии, участием суперантигенов и стимуляцией цитокинов.
Обнаружение дезоксирибонуклеиновой кислоты (ДНК) Campylobacter jejuni в миеломоноцитарных клетках позволяет предполагать представление нейритогенных антигенов Т-клеткам комплексом HLA класса II.
Начальным этапом в иммунопатогенезе болезни является представление антигена наивным Т-клеткам с их последующей активацией, циркуляцией по кровотоку и привязыванием к венулярному эндотелию периферических нервов. Затем Т-клетки пересекают гематоэнцефалический барьер, мигрируют через эндотелиальный слой в периваскулярную область и направляются в эндоневрий, задействуя механизмы молекул адгезии (селектины, лейкоцитарные интегрины и их контрарецепторы). Заключительным этапом в патогенезе СГБ является вхождение Т-клеток и аутоантител в эндоневрий вместе с макрофагами, где при помощи антительных и Т-клеточных механизмов идентифицируются аутоантигены на аксональных или шванновских клетках. Описываемый процесс приводит к выраженному повреждению тканей, чему способствует акивный фагоцитоз клеток моноцитарно-макрофагальной линии.
При классической форме СГБ (острая воспалительная демиелинизирующая полинейропатия) происходит поражение волокон двигательных и чувствительных нейронов. При этом основными структурами, подвергающимися патологическому воздействию, являются преимущественно корни мотонейронов и смежные проксимальные сплетения. Характерен феномен выраженной сегментарной воспалительной демиелинизации, сопровождающейся очаговой и диффузной инфильтрацией Т-лимфоидными и моноцитарно-макрофагальными клетками на всех уровнях периферической нервной системы. Воспалительные клетки аккумулируются вокруг мелких сосудов эндоневрия/эпиневрия. Комплемент-опосредованное связывание антител с эпитопами, расположенных на поверхностной мембране шванновских клеток, предшествует Т-клеточной инфильтрации. Клинические проявления болезни являются прямым следствием нарушения сальтаторной проводимости по миелинизированным волокнам (возникает блок проведения).
Точные механизмы патогенеза синдрома Миллера-Фишера окончательно не изучены, но известно, что болезнь ассоциирована c повышенными титрами антиганглиозидных антител (преимущественно к GQ1b), как и стволовой энцефалит Бикерстаффа [1, 2, 9, 10, 20, 21].
Эпидемиология
Синдром Гийена-Барре – редкий вид острой демиелинизирующей патологии периферической нервной системы, встречающейся с частотой 1,0-1,9 случая на 100 тысяч населения у взрослых и 0,34-1,34 на 100 000 населения у детей.
Острая воспалительная демиелинизирующая полинейропатия (ОВДП) встречается в 77-78%, на долю аксональных вариантов синдрома Гийена-Барре (острая моторно-аксональная нейропатия - ОМАН, острая моторно-сенсорная аксональная нейропатия - ОМСАН) в странах Запада приходятся 3-5%, а в Азии и Латинской Америке – 30-50%.
На долю синдрома Миллера-Фишера, острой панавтономной нейропатии, стволового энцефалита Бикерстаффа и других форм СГБ приходится не более 2% и более точных данных в доступной литературе не представлено [1, 2, 5, 10, 20].
Клиническая картина
Cимптомы, течение
Классическими проявлениями болезни считаются прогрессирующий (восходящий) паралич мышц конечностей и дыхательной мускулатуры, что сопровождается расстройствами чувствительности по полинейропатическому типу; впоследствии у пациентов возникают вегетативно-трофические нарушения. Характерно внезапное появление неврологической симптоматики: болевой синдром (до 80%) и парестезии (20%); типичны атаксия, парезы мышц конечностей и параличи черепных нервов.
Поражение симпатической нервной системы проявляется различными вегетативными нарушениями (гипертензия, постуральная гипотензия, профузное потоотделение, нарушения терморегуляции и т.д.). Паралич дыхательной мускулатуры является типичным и тяжелым осложнением острой воспалительной демиелинизирующей полинейропатии, требующим проведения ИВЛ и/или трахеостомии у взрослых, в то время как у детей наблюдается примерно в 3% случаев.
Клиническая картина практически не отличима от ОВДП, за исключением того, что не отмечается поражения сенсорных волокон периферических нервов. В большинстве случаев заболевание протекает более тяжело, чаще пациентам требуется ИВЛ, чаще формируется остаточный моторный дефицит.
Клинические проявления этого варианта СГБ практически неотличимы от симптомов острой воспалительной демиелинизирующей полинейропатии (мышечная слабость и сенсорный дефицит), но заболевание протекает более тяжело, а прогноз является гораздо более серьезным.
Отличительными чертами этого варианта болезни является наличие клинической триады в виде сочетания наружной офтальмоплегии (главный признак), атаксии и арефлексии, появляющееся в пределах первой недели после начала заболевания. Наиболее ранними симптомами синдрома Миллера-Фишера служат диплопия, иногда может наблюдаться двухсторонний парез лицевого нерва. Встречаются параличи/парезы лицевого нерва и бульбарные расстройства. По достижении максимальной выраженности, описываемые симптомы обычно сохраняются на протяжении 1-2 недель, иногда до 4-х недель, после чего отмечается постепенное восстановление неврологических функций (обычно оно бывает полным или практически полным).
Характерным также является: отсутствие мышечной слабости в конечностях; отсутствие нарушения сознания или признаков вовлечения кортико-спинального тракта; повышение белка в ЦСЖ при цитозе менее 50 мононуклеарных клеток; нормальные результаты по данным электромионейрографии (ЭНМГ) или изолированное поражение чувствительных нервов.
Частыми симптомами болезни являются нарушения потоотделения, отсутствие слезообразования, фотофобия, тошнота, дисфагия, сухость слизистых оболочек носа и ротовой полости, сухость и отслойка кожи, а также нарушения дефекации (запоры, диарея). В числе ранних неспецифических проявлений заболевания фигурируют головная боль, летаргия, усталость, сниженная мотивация (к принятию инициативных решений), а также признаки вегетативных нарушений (ортостатическое головокружение, размытость зрения, сухость глаз, нарушения мочеиспускания). Крайне редко эта форма СГБ наблюдается у детей. В дебюте заболевания наиболее часты симптомы в виде нарушений, ассоциированных с ортостатической непереносимостью, а также расстройства со стороны желудочно-кишечного тракта и нарушение функции потовых желез (судомоторная дисфункция). Могут отмечаться парасимпатические расстройства (боли в животе, рвота, запор, илеус, задержка мочи, расширение и ареактивность зрачков, потеря аккомодации). Крайне редко эта форма СГБ наблюдается у детей.
Характеризуется острым, внезапным дебютом в виде офтальмоплегии, атаксии, нарушения сознания, гиперрефлексии и наличия симптома Бабинского. Течение болезни монофазное или реже ремиттирующее-рецидивирующее. Крайне редко эта форма СГБ наблюдается у детей.
Характеризуется изолированной слабостью в лицевых, ротоглоточных, шейных мышцах, а также в мускулатуре верхних конечностей (без вовлечения нижних конечностей). Крайне редко эта форма СГБ наблюдается у детей.
Проявляется вовлечением в патологический процесс только черепных нервов. Крайне редко эта форма СГБ наблюдается у детей [1, 2, 5, 10, 20, 21]
В большинстве случаев течение болезни монофазное. В течении болезни принято выделять 3 стадии (периода): 1) период прогрессирования (не более 4-х недель), 2) период стойкой симптоматики (не более 4-х недель), 3) период восстановления (до 1 года).
В разграничении разных форм СГМ ведущим является электронейромиографическое исследование (ЭНМГ), по результатам которого выявляется демиелинизирующий или аксональных тип поражения периферических нервов. При СГБ в периоде прогрессирования невозможно прогнозировать течение заболевания, поэтому все пациенты с подозрением на СГБ в периоде прогрессирования должны быть госпитализированы, так как возможно дальнейшее нарастание тяжести парезов с развитием дыхательных и сердечно-сосудистых нарушений. В периоде прогрессирования необходимо проводить мониторинг неврологических нарушений (степени парезов, нарушения глотания, изменения тембра голоса), артериального давления, частоты сердечных сокращений, частоты дыхания, электрокардиографии (ЭКГ) и ЖЕЛ.
Что такое синдром Гийена — Барре? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуйков А. В., невролога со стажем в 21 год.
Над статьей доктора Жуйков А. В. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Гийена — Барре (ГБС) — острое аутоиммунное заболевание, которое охватывает группу острых нарушений периферической нервной системы. Характеризуется мышечной слабостью, а также болью и ползанием мурашек в начале болезни из-за поражения чувствительных волокон. Каждый вариант нарушений характеризуется особенностями патофизиологии и клинического распределения слабости в конечностях и черепных нервах.
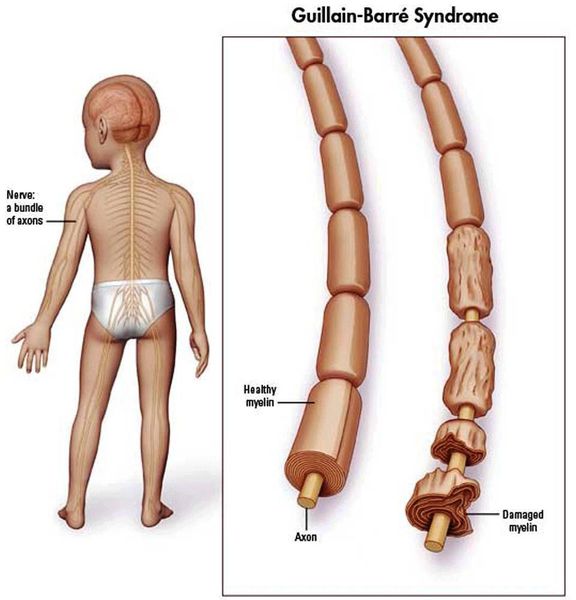
Распространённость синдрома Гийена — Барре
Синдром Гийена — Барре встречается в 1–2 случаях на 100 000 населения в год. [10]
Причины синдрома Гийена — Барре
Точная причина синдрома Гийена — Барре неизвестна. Но у 70% пациентов с ГБС наблюдались предшествующие инфекционные заболевания: респираторные, желудочно-кишечные инфекции, вирус Зика. Также синдром Гийена — Барре может развиться после заражения коронавирусом. [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Гийена — Барре
Симптомы ОРВИ или расстройства желудочно-кишечного тракта отмечаются у 2/3 пациентов. Первыми симптомами ГБС являются парестезии пальцев конечностей, за которыми следует прогрессирующая слабость мышц нижних конечностей и нарушения походки. Болезнь прогрессирует в течение нескольких часов или дней, возникает слабость верхних конечностей и развиваются паралич черепных нервов. Параличи обычно симметричны и носят, конечно, периферический характер. У половины пациентов боль может быть первоначальной жалобой, что затрудняет диагноз. Атаксия и боль чаще встречаются у детей, чем у взрослых. Задержка мочи наблюдается у 10%-15% больных. Поражение вегетативных нервов проявляются головокружениями, гипертонией, чрезмерным потоотделением и тахикардией.
При объективном обследовании выявляется восходящая мышечная слабость, а также арефлексия. Сухожильные рефлексы нижних конечностей отсутствуют, но рефлексы верхней конечности могут вызываться. Мышечная слабость может задействовать и респираторные мышцы. Поражение черепных нервов отмечается в 35-50%, вегетативная нестабильность в 26%-50%, атаксия — в 23%, дизестезия — в 20% случаев. [1]
Наиболее распространенными признаками вегетативной дисфункции являются синусовая тахикардия или брадикардия и артериальная гипертония. У пациентов с тяжелой вегетативной дисфункцией наблюдаются изменения периферического вазомоторного тонуса с гипотензией и лабильностью артериального давления.
Нечастые варианты клинического течения болезни включают лихорадку в начале неврологических симптомов, тяжелую сенсорную недостаточность с болью (миалгии и артралгии, менингизм, корешковая боль), дисфункции сфинктеров.
Возможность ГБС должна рассматриваться у любого пациента с быстрым развитием острой нервно-мышечной слабости. На ранней стадии ГБС следует отличать от других заболеваний с прогрессирующей симметричной мышечной слабостью, включая поперечный миелит и миелопатию, острую токсическую или дифтеритическую полиневропатию, порфирию, миастению и нарушения электролитного обмена (например, гипокалиемия).
Патогенез синдрома Гийена — Барре
Нейрофизиологические процессы, лежащие в основе ГБС, подразделяются на несколько подтипов. Наиболее распространенные подтипы включают:
- острую воспалительную демиелинизирующую полирадикулопатию;
- острую двигательную аксональную невропатию;
- острую моторную и сенсорную аксональную нейропатию;
- синдром Миллера-Фишера, как вариант ГБС, характеризуется триадой признаков: офтальмоплегия, атаксия и арефлексия.
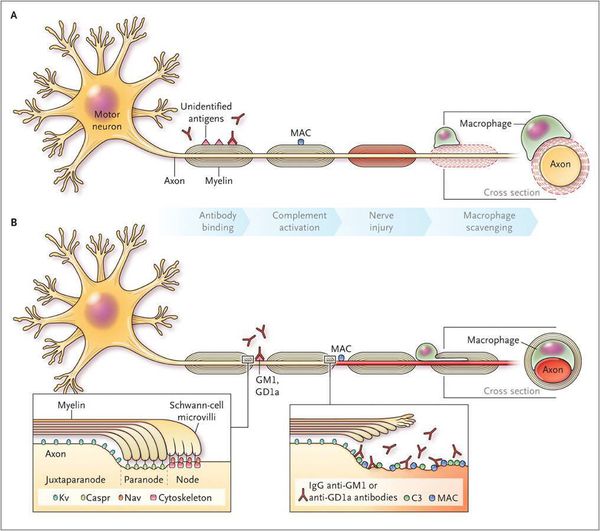
Считается, что ГБС развивается вследствие выработки антител против белка инфекционного агента, которые перекрестно реагируют с ганглиозидами нервных волокон человека. Аутоантитела связываются с миелиновыми антигенами и активируют комплемент, с формированием мембранно-атакующего комплекса на внешней поверхности клеток Шванна. Повреждение оболочек нервных стволов приводит к нарушениям проводимости и мышечной слабости (на поздней стадии может происходить и аксональная дегенерация). Демиелинизирующее поражение наблюдается по всей длине периферического нерва, включая нервные корешки.
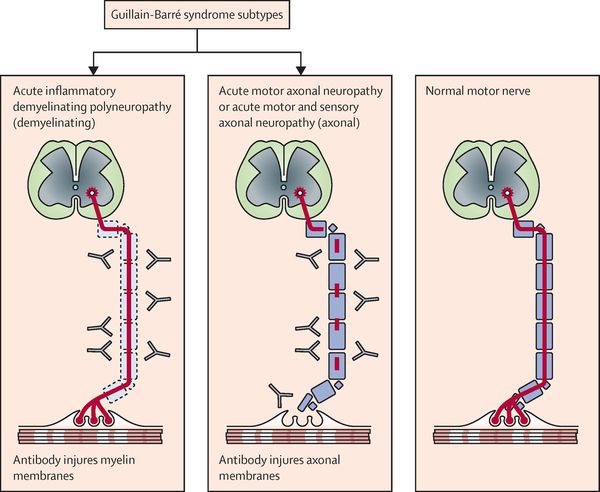
Поражаются все типы нервов, в том числе вегетативные, моторные и сенсорные волокна. Вовлечение двигательных нервов происходит значительно чаще, чем сенсорных.
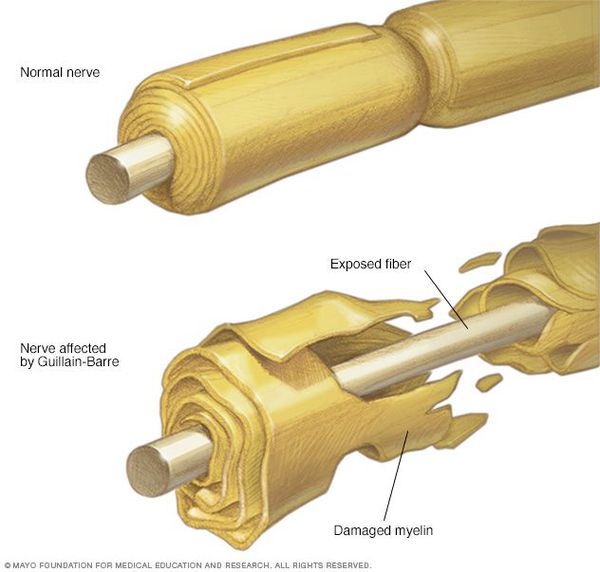
Классификация и стадии развития синдрома Гийена — Барре
В Международной классификации болезней (МКБ-10) синдром Гийена — Барре кодируется как G61.0.
Основные виды синдрома Гийена — Барре:
- Острая воспалительная демиелинизирующая полирадикулоневропатия (ОВДП) — самая распространённая форма в Северной Америке и Европе. Основным признаком ОВДП является мышечная слабость, которая сперва возникает в нижней части тела, а затем распространяется вверх.
- Синдром Миллера Фишера — проявляется параличом глаз и неустойчивостью походки. Эта форма более распространена в Азии.
- Острая моторная аксональная невропатия (ОМАН) и острая моторно-сенсорная аксональная невропатия (ОМСАН) — чаще встречаются в Китае, Японии и Мексике. [8]
Осложнения синдрома Гийена — Барре
Пациенты с ГБС подвержены риску опасных для жизни респираторных осложнений и вегетативных нарушений.
Показания для перевода в отделение интенсивной терапии включают:
- быстрое прогрессирование моторной слабости с поражением респираторных мышц;
- вентиляционную дыхательную недостаточность;
- пневмонию;
- бульбарные расстройства;
- тяжелую вегетативную недостаточность.
Осложнения проводимого лечения, требующие интенсивной терапии, включают перегрузку жидкостью, анафилаксию на введение внутривенного иммуноглобулина или гемодинамические нарушения при проведении плазмафереза.
У 15%-25% детей с ГБС развивается декомпенсированная дыхательная недостаточность, которая требует механической вентиляции легких. [2] Респираторные нарушения чаще встречается у детей с быстрым прогрессированием заболевания, слабостью верхних конечностей, вегетативной дисфункцией и поражениями черепных нервов. Интубация трахеи может потребоваться у больных для защиты дыхательных путей, проведения механической вентиляции легких. При ГБС быстрое прогрессирование, двусторонний паралич лицевого нерва и вегетативная дисфункция предопределяют повышенную вероятность интубации. Необходимо планирование ранней интубации для минимизации риска осложнений и необходимости проведения экстренной интубации.
Вегетативная дисфункция повышает риск эндотрахеальной интубации. С другой стороны, дисавтономия может увеличить риск гемодинамических реакций на препараты, используемые для индукции анестезии во время интубации.
Признаки, указывающие на необходимость механической вентиляции легких: [4]
- вентиляционная дыхательная недостаточность;
- увеличение потребности в кислороде для поддержания SpO2 выше 92%;
- признаки альвеолярной гиповентиляции (PCO2 выше 50 мм. рт. ст.);
- быстрое снижение жизненной емкости на 50% по сравнению с исходным уровнем;
- невозможность кашля
Вегетативная дисфункция является основным фактором смертности при ГБС. Фатальный сердечно-сосудистый коллапс из-за вегетативной дисфункции наблюдается у 2%-10% тяжелобольных пациентов. [3] Мониторинг частоты сердечных сокращений, артериального давления и электрокардиограммы следует продолжать до тех пор, пока пациенты нуждаются в респираторной поддержке. Чрескожная кардиостимуляция может потребоваться при выраженной брадикардии. Гипотония корректируется восполнением объема циркулирующей крови (ОЦК), и, если пациент невосприимчив к восполнению ОЦК, применяются α-агонисты, такие как норадреналин, мезатон, адреналин.
При нестабильной гемодинамике непрерывная регистрация артериального и центрального венозного давления должна проводиться для контроля объема инфузионной терапии.
Артериальная гипертензия может возникать, но это осложнение не требует специального лечения, если оно не осложняется отеком легких, энцефалопатией или субарахноидальным кровоизлиянием.
Диагностика синдрома Гийена — Барре
Сбор жалоб и анамнеза
На приёме врач в первую очередь обратит внимание на скорость распространения паралича и нарушение дыхания. Если эти признаки выражены, больному может потребоваться экстренная помощь.
Как правило, пациенты с синдромом Гийена — Барре жалуются на нарушение походки, онемение и зябкость ног, а затем и рук. Нередко пациенты рассказывают, что недавно перенесли ОРВИ.
Осмотр
Объективный неврологический осмотр — это основа диагностики при синдроме Гийена — Барре. Врач оценивает рефлексы, координацию движений, походку, чувствительность и мышечную силу.
Лабораторная диагностика
Основным видом лабораторной диагностики при синдроме Гийена — Барре является исследование спинномозговой жидкости, которую получают с помощью люмбальной пункции.
Инструментальная диагностика
ЭНМГ (Электронейромиография) — единственный инструментальный метод диагностики, позволяющий подтвердить диагноз ГБС и уточнить характер патологических изменений (демиелинизирующий или аксональный) и их распространенность. [3]
Игольчатая электромиография характеризуется наличием признаков текущего денервационно-реиннервационного процесса при полинейропатии. Исследуют дистальные мышцы верхних и нижних конечностей (например, переднюю большеберцовую мышцу, общий разгибатель пальцев), а при необходимости и проксимальные мышцы (например, четырёхглавую мышцу бедра).
ЭНМГ-исследование у больных с ГБС зависит от клинических проявлений:
- при дистальных парезах исследуются длинные нервы на руках и ногах: не менее четырех двигательных и четырех чувствительных (двигательные и чувствительные порции срединного и локтевого нервов; малоберцовый, большеберцовый, поверхностный малоберцовый и икроножный нервы с одной стороны).
Оценка основных ЭНМГ- параметров:
Первые признаки денервационного процесса появляются через две-три недели после начала заболевания, признаки реиннервационного процесса — через месяц.
Дифференциальная диагностика
Синдром Гийена — Барре следует отличать от следующих заболеваний:
-
и клещевого энцефалита (чувствительность не нарушена, поражены преимущественно черепные нервы); (отягощённый эпидемиологический анамнез, например посещение эндемичных стран); (чувствительность не нарушена, рефлексы снижены незначительно);
- обменно-метаболических полиневропатий (течение хроническое).
Лечение синдрома Гийена — Барре
Показания для госпитализации
Практически во всех случаях требуется госпитализация. Экстренная госпитализация необходима пациентам с нарушениями дыхания — в таких случаях лечение проводят в условиях реанимации.
Общие принципы лечения синдрома Гийена — Барре
Лечение острой демиелинизирующей полирадикулоневропатии комплексное. Основа — плазмаферез, иммуноглобулины и кортикостероиды. В ряде случаев требуется искусственная вентиляция лёгких, коррекция нарушений кровообращения, профилактика инфекционных и тромбоэмболических осложнений. Обязательным условием успешного лечения является уход.
Общее поддерживающее лечение и уход
Пациенты, требующие интенсивной терапии, требуют тщательного общего ухода. Запор наблюдается более чем в 50% случаев пациентов с ГБС в результате динамической непроходимости кишечника. Может потребоваться искусственное питание.
Медикаментозное лечение и плазмаферез
В лечении ГБС предпринимаются различные виды иммуномодулирующей терапии. [1] [2]
Внутривенный иммуноглобулин назначают в виде ежедневной инфузии (в дозе 0,4 гр/кг/день) в течение 5 дней в первые 2 недели болезни. Второй курс иммуноглобулина может потребоваться 5%-10% пациентов, при отрицательной динамике после первоначального улучшения. Механизм действия внутривенного иммуноглобулина, вероятно, многофакторный и, как полагают, включает модуляцию активации комплемента, нейтрализацию идиотипических антител, подавление воспалительных медиаторов (цитокины, хемокины).
Побочные эффекты иммуноглобулина включают головную боль, миалгию и артралгию, гриппоподобные симптомы, лихорадку. У пациентов с дефицитом IgA может развиться анафилаксия после первого курса внутривенного иммуноглобулина.
Плазмаферез способствует удалению антител, вовлеченных в патогенез ГБС. В течение каждого сеанса 40-50 мл/кг плазмы заменяют смесью 0,9% раствора хлорида натрия и альбумина. Проведение плазмафереза приводит к сокращению времени выздоровления и снижению потребности в искусственной вентиляции. Эти преимущества очевидны, если плазмаферез проводится в течение первых двух недель после начала болезни. Осложнения, связанные с плазмаферезом, включают гематому в области венопункции, пневмоторакс после катетеризации подключичной вены и сепсис. Плазмаферез противопоказан пациентам с тяжелой гемодинамической нестабильностью, кровотечением и сепсисом. Комбинация плазмафереза и иммуноглобулина не показала клинических преимуществ.
Симптоматическое лечение синдрома Гийена — Барре:
- при боли применяют парацетамол;
- катадолон и трамадол применяют при выраженном болевом синдроме;
- при нейропатической боли эффективны карбамазепин и габапентин.
Оперативное лечение
При тяжёлом течении может потребоваться длительная респираторная поддержка и наложение трахеостомы. Если пациент находится на искусственном питании, то накладывают гастростому.
Прогноз. Профилактика
ГБС остается серьезным заболеванием, несмотря на улучшение результатов лечения. По сравнению со взрослыми, у детей чаще отмечается более благоприятное течение заболевания, с полным, а не частичным выздоровлением. Причинами неблагоприятного исхода при ГБС являются дыхательная недостаточность, осложнения искусственной вентиляции легких (пневмония, сепсис, острый респираторный дистресс-синдром и тромбоэмболические осложнения), остановка сердца, вторичная по отношению к дисавтономии.
Восстановление обычно начинается через две-четыре недели после прекращения прогрессирования симптомов. Среднее время от начала заболевания до полного выздоровления составляет 60 дней. Данные относительно долгосрочного исхода ГБС ограничены. 75% - 80% пациентов полностью выздоравливают. Около 20% пациентов не могут ходить через полгода.
Младшая возрастная группа (менее 9 лет), быстрое прогрессирование и максимальная мышечная слабость, потребность в искусственной вентиляции легких являются важными предикторами длительного двигательного дефицита. [4]
Что такое полинейропатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Богданова Е. П., функционального диагноста со стажем в 10 лет.
Над статьей доктора Богданова Е. П. работали литературный редактор Вера Васина , научный редактор Наталья Пахтусова и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Полинейропатия (Polyneuropathy) — это группа заболеваний периферической нервной системы, при которых повреждаются периферические нервные волокна, входящие в состав различных нервов. Полинейропатия может быть вызвана множеством причин, но проявляется общими симптомами: слабостью в руках и ногах, онемением, покалыванием и жжением в кистях и стопах.

Полиневропатия и полинейропатия — это разные варианты написания одного и того же термина.
Как часто встречается полинейропатия
Полинейропатией страдает около 2,4 % населения, заболевание чаще встречается среди пожилых людей [6] .
Причины полинейропатии
Выделяют первичные и вторичные полинейропатии. Первичные полинейропатии — это наследственные формы, которые могут сочетаться с поражением других органов и отделов нервной системы. К наследственным полинейропатиям относятся транстиретиновая семейная амилоидная полинейропатия, болезнь Фабри, порфирийная полинейропатия, болезнь Рефсума.
Вторичные полинейропатии встречаются гораздо чаще. В зависимости от причинного фактора их можно разделить на несколько видов:
- Инфекционные и инфекционно-аллергические (с известным и неизвестным возбудителем, аллергические). В эту группу входит синдром Гийена — Барре.
- Токсические: медикаментозные, при хронических бытовых и производственных интоксикациях (ртутью, свинцом, литием), при токсикоинфекциях (ботулизм, дифтерия, столбняк), алкогольные. Медикаментозные полинейропатии могут развиться при приёме Амиодарона, Колхицина, Хлоракина, Хлорамфеникола, Дапсона, Дисульфирама, Этамбутола, Этионамида, Глутетимида, статинов, Изониазида, Гидралазина, Фенитоина, Никотинамида, препаратов золота. Чаще всего полинейропатия развивается при длительном применении больших доз этих лекарств. Также к ней может привести приём нуклеозидов — препаратов для лечения ВИЧ-инфекции. Полинейропатия может возникать на фоне химиотерапии — примерно через месяц после начала применения Цисплатина, если доза превышает 400 мг/м 2 ; при терапии Винкристином и Винбластином — нередко в первые два месяца лечения, если суммарная доза препаратов превышает 30–50 мг [8] . В редких случаях полинейропатию вызывает Интерферон-альфа, используемый при гепатите С и опухолях.
- При воздействии физических факторов: холода, вибрации, радиации, хронических компрессиях (из-за утолщения оболочек вокруг нерва при системных болезнях соединительной ткани) и т. д.
- Сосудистые: при системных заболеваниях соединительной ткани, специфических и неспецифических васкулитах, атеросклерозе.
- Метаболические: при болезнях обмена веществ, дефиците витаминов (алиментарные), эндокринных заболеваниях (например, при сахарном диабете), болезнях печени и почек. Полинейропатия может быть первым проявлением сахарного диабета, чаще всего 2-го типа.
- Паранеопластические (при злокачественных новообразованиях).
Около 20–30 % аксональных полинейропатий, т. е. возникших из-за повреждения длинных отростков нервов, являются идиопатическими: их причину не удаётся выявить, несмотря на полную диагностику [7] . Иногда поиск причины полинейропатии может затянуться на месяцы. Это связано с многообразием провоцирующих факторов и трудностями при сборе анамнеза: пациенты не всегда честно рассказывают о вредных привычках и часто не знают, чем болели родственники.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы полинейропатии
Клиническая картина полинейропатий типична и проявляется следующими симптомами:
- Двигательные нарушения. При заболевании развиваются периферические парезы — снижается мышечная сила и тонус, атрофируются мышцы, угнетаются или исчезают рефлексы. Постепенно слабеют и уменьшаются в размерах мышцы рук и ног, чаще в стопах, голенях и кистях. Пациенты быстро устают при ходьбе, подъёме по лестнице и занятиях спортом, не могут встать на носки и пятки, взять и удержать тяжёлые предметы, чувствуют неловкость в руках, отмечают шаткость при ходьбе.
- Чувствительные нарушения. Страдают глубокие (суставно-мышечное чувство, вибрационная чувствительность) и поверхностные виды чувствительности (чаще — болевая чувствительность). Чувствительные нарушения проявляются следующими симптомами:
- Снижается или исчезает чувствительность к боли и температуре, преимущественно в стопах, голенях и кистях. Немеют руки и ноги, пациенты не различают горячую и холодную воду, могут поранить ногу, наступить на что-то острое и не заметить этого, так как не чувствуют боли.
- Нейропатическая боль — пациенты описывают болевые ощущения по-разному: колющие, кинжальные, жгучие, ноющие, как от удара электрическим током. Боль может сочетаться с нарушением болевой и температурной чувствительности, аллодинией (боль возникает из-за прикосновения к коже) и гипералгезией (слабый раздражитель вызывает сильную боль). Нейропатическая боль часто начинается со стоп, но пациент, как правило, не может указать точно, где болит, и лишь примерно показывает область боли. Боль может быть постоянной или периодической, возникать самопроизвольно или в ответ на прикосновение.
- Из-за нарушения глубоких видов чувствительности развивается сенситивная атаксия: пациент неустойчив, вынужден при ходьбе всегда смотреть под ноги, так как не чувствует поверхность под ногами. К глубоким видам чувствительности относится ощущение вибрации и суставно-мышечное чувство — понимание положения своего тела в пространстве. При ходьбе по твёрдой поверхности у больного возникает ощущение мягкого ковра под ногами. Особенно сложно передвигаться в темноте, когда невозможно смотреть под ноги. В таких случаях пациенты часто падают.
- Трофические нарушения. Истончается кожа и изменяется её окраска, утолщаются ногтевые пластины. Эти изменения связаны с тем, что периферические нервы не только обеспечивают движения мышц, но и питают мышцы и кожу.
При поражении периферических отделов вегетативной нервной системы нарушается работа внутренних органов. Эти нарушения сопровождаются следующими симптомами:
- ортостатическая гипотензия — давление снижается при перемене положения тела, например когда человек сидел или лежал, а потом резко встал ; в покое;
- ригидный пульс, т. е. исчезновение его физиологической нерегулярности;
- пониженное потоотделение;
- нарушение тонуса мочевого пузыря и недержание мочи;
- запоры и диарея; [3][6] .
Патогенез полинейропатии
Периферической называют ту часть нервной системы, которая не входит в центральную нервную систему, т. е. нервы за пределами головного и спинного мозга.

Периферическую нервную систему образуют длинные отростки нервных клеток, тела которых залегают в спинном мозге, стволе головного мозга, спинномозговых и вегетативных узлах. Эти длинные отростки называют аксонами. Аксоны получают питание из тела нервных клеток [11] .
Выделяют два типа нервных волокон: тонкие ( безмиелиновые ) и толстые ( миелиновые ). Миелин окружает аксон прерывистой электроизолирующей оболочкой, благодаря чему возбуждение передаётся быстрее. Этому способствуют перехваты Ранвье — периодические участки, не покрытые миелином.

Полинейропатии делят на два основных класса:
- аксонопатии, или аксональные полинейропатии, — повреждён непосредственно сам аксон;
- миелинопатии, или демиелинизирующие полинейропатии, — поражена миелиновая оболочка аксона.
Зачастую при поражении миелиновой оболочки позже повреждается и сам аксон, а при первичном повреждении аксона со временем разрушается и миелиновая оболочка.
Классификация и стадии развития полинейропатии
Формы полинейропатии в зависимости от причины:
- инфекционные и инфекционно-аллергические;
- токсические;
- от воздействия физических факторов;
- метаболические;
- паранеопластические.
По течению полинейропатии могут быть:
- острыми — развиваются от нескольких дней до четырёх недель;
- подострыми — симптомы усиливаются в течение 4–8 недель;
- хроническими — развиваются в течение нескольких месяцев или лет.
По патоморфологическим признакам выделяют аксонопатии и миелинопатии.
По преобладанию симптомов выделяют:
- сенсомоторные полинейропатии (в равной степени присутствуют чувствительные и двигательные нарушения);
- преимущественно моторные;
- преимущественно сенсорные;
- преимущественно вегетативно-трофические (с нарушением работы внутренних органов).
В чистом виде они встречаются редко, чаще развивается сочетанное поражение двух или трёх видов нервных волокон [6] .
Осложнения полинейропатии
К ослож нениям полинейропатии можно отнести атрофию мышц и утрату движений в конечностях, тревожные и депрессивные расстройства из-за боли при сенсорных полинейропатиях.
Также на фоне полинейропатии могут возникать ожоги, повреждения кожи из-за нарушения чувствительности и частые падения, которые приводят к травмам [15] .
Диагностика полинейропатии
Сбор анамнеза
При диагностике полинейропатии важно выяснить, на что жалуется пациент, какой образ жизни он ведёт и какими болезнями страдают его близкие родственники.
На приёме доктор спрашивает:
- о наличии хронических и онкологических болезней, а также уточняет, проводилась ли химиотерапия;
- о вредных привычках и профессиональных факторах, например работе с тяжёлыми металлами и фосфорорганическими соединениями;
- о схожих симптомах у родственников, например слабости и онемении в ногах и руках, — эти нарушения могут указывать на наследственную полинейропатию.
Нужно обязательно рассказать доктору о вредных привычках, в том числе о злоупотреблении алкоголем, а также о том, что предшествовало развитию полинейропатии, например инфекция, боль в животе, голодание и т. д.
Неврологический осмотр
Доктор осматривает кожу, ощупывает мышцы, измеряет окружность рук и ног, оценивает сухожильные, надкостничные рефлексы и чувствительность.
Сухожильные рефлексы проверяют с помощью лёгкого удара неврологическим молоточком по сухожилию мышцы:
- при ударе по ахиллову сухожилию стопа сгибается в области подошвы;
- при ударе по сухожилию четырёхглавой мышцы бедра разгибается голень (проверка коленного рефлекса);
- при ударе по шиловидному отростку лучевой кости рука сгибается в локте и поворачивается кисть (проверка надкостничного рефлекса).
Если рефлексы выпадают, описанные движения не происходят.
Чтобы оценить походку, силу мышц рук и ног, доктор просит пациента встать на носки и пятки, сесть на корточки и встать, лёжа потянуть стопы на себя и от себя, согнуть и разогнуть ноги в коленях, сжать кулаки, согнуть и разогнуть руки в локтях и т. д.
Нарушение разных видов чувствительности определяют различными методами:
- для оценки температурной чувствительности к коже прикасаются пробирками с тёплой и холодной водой;
- болевую чувствительность проверяют с помощью лёгкого покалывания заострённой деревянной палочкой;
- вибрационную чувствительность исследуют с помощью камертона;
- при оценке суставно-мышечного чувства пациент закрывает глаза, доктор шевелит пальцами его рук и ног, пациент описывает свои ощущения.
Определить интенсивность боли можно с помощью специальных шкал, например DN4 и визуальной аналоговой шкалы (ВАШ). Принцип ВАШ состоит в том, что пациенту предлагают оценить силу боли по 10-балльной шкале, где 0 — это отсутствие боли, а 10 — самая сильная боль, какую он испытывал в жизни. С помощью этой шкалы можно оценить эффективность лечения, сравнив интенсивность боли до него и после.
Лабораторная диагностика
Лабораторная диагностика позволяет установить причину полинейропатии.
К основным лабораторным методам относятся:
- Общий анализ крови, определение концентрации витамина В12, анализ крови и мочи на содержание тяжёлых металлов, проба Уотсона — Шварца (специфическое исследование мочи при подозрении на порфирию).
- Биохимический анализ крови (глюкоза, гликированный гемоглобин, показатели работы печени, почек).
- Исследование антител к ганглиозидам — информативный метод при моторной мультифокальной и хронической воспалительной демиелинизирующей полинейропатии, синдроме Гийена — Барре и других аутоиммунных невропатиях. Однако повышенный титр антител к GM1-ганглиозидам выявляют у 5 % здоровых людей, зачастую у пожилых пациентов [6] .
- Антитела к ассоциированному с миелином гликопротеину (анти-MAG антитела) — определяются при парапротеинемической полинейропатии и ряде других аутоиммунных полинейропатий.
- Исследование спинномозговой жидкости — проводится при подозрении на демиелинизирующие полинейропатии. Повышенное содержание белка в ликворе может указывать на синдром Гийена — Барре, хроническую воспалительную демиелинизирующую полинейропатию. Реже небольшое повышение встречается при диабетической полинейропатии. Избыток клеток в ликворе может указывать на полинейропатию при ВИЧ-инфекции и болезни Лайма[8] .
- Молекулярно-генетический анализ — назначают при подозрении на наследственные мотосенсорные полинейропатии [6] . При анализе берут кровь из вены и отправляют в лабораторию.
Инструментальная диагностика
- Стимуляционная электронейромиография (ЭНМГ) — основной метод диагностики полинейропатии, при котором определяется скорость проведения импульса по двигательным и чувствительным нервам. Позволяет подтвердить полинейропатию, определить её тип (аксонопатия или миелинопатия).
- Игольчатая электромиография с оценкой состояния мышц рук и ног — проводится, если результаты стимуляционной ЭНМГ сомнительны: например, пограничные между нормой и патологией, или требуется дифференциальная диагностика между полинейропатией и поражением мышц (миопатией) [1][2][6] .
- Ультразвуковое исследование нервов (УЗИ) — позволяет определить, на каком именно участке повреждены нервы.
- Биопсия нервов — при полинейропатии проводится редко, целесообразна при подозрении на васкулит и амилоидную полинейропатию. Чаще всего для биопсии выбирают икроножный нерв [6] .

Лечение полинейропатии
Чтобы вылечить полинейропатию, нужно выявить и устранить причину болезни, а также подавить механизмы её развития.
Методы лечения полинейропатии зависят от основного заболевания:
- при сахарном диабете — подбирают диету и терапию, которая снижает уровень глюкозы;
- при дефиците витаминов — дают рекомендации по питанию и назначают витамины;
- при аутоиммунных воспалительных полинейропатиях — применяют плазмаферез и внутривенно вводят иммуноглобулин [14] .
Чтобы уменьшить нейропатическую боль, применяют:
- медикаментозное лечение — антидепрессанты и антиконвульсанты (препараты для лечения эпилепсии);
- немедикаментозное лечение — психотерапия, методы с биологической обратной связью.
Нестероидные противовоспалительные препараты (НПВС) при нейропатической боли неэффективны [6] [8] .
В терапии диабетической полинейропатии широко применяют препараты тиоктовой кислоты — антиоксиданта, защищающего клетки от повреждения [13] .
Помимо медикаментозного лечения, проводится физическая реабилитация: лечебная физкультура, массаж, методы с биологической обратной связью, физиотерапия (электромиостимуляция) и т. п.
Эффективного лечения наследственных полинейропатий пока не существует [6] . При болезни Рефсума основной метод лечения — это диетотерапия, также может применяться плазмаферез . Пациенту нужно ограничить поступление фитановой кислоты, есть меньше зелёных овощей, говядины, рыбы (тунца, пикши и трески).
Прогноз. Профилактика
Прогноз зависит от течения основного заболевания и своевременного и правильного лечения. Также влияет тип полинейропатии: при миелинопатиях прогноз благоприятнее, чем при аксонопатиях [8] .
Наследственные полинейропатии, как правило, неуклонно прогрессируют, но благодаря их медленному развитию пациенты адаптируются и обслуживают себя самостоятельно до поздних стадий болезни.
Прогноз токсических полинейропатий относительно благоприятный при прекращении интоксикации, например если пациент откажется от алкоголя.
При диабетической полинейропатии с адекватной терапией прогноз тоже относительно благоприятный. Без лечения заболевание прогрессирует, а невропатическая боль снижает качество жизни: пациенты не могут нормально спать и работать [6] [8] .
Профилактика полинейропатии
Профилактика заключается в своевременной диагностике и лечении соматических заболеваний, нарушений обмена веществ, а также отказе от алкоголя. Пациентам с хроническими заболеваниями необходимо регулярно посещать лечащего врача и выполнять его рекомендации. При подозрении на полинейропатию доктор направит больного на электронейромиографию [5] [7] .
Людям, занятым на вредном производстве, необходимо регулярно посещать профпатолога. Обычно такие консультации входят в ежегодный профилактический медицинский осмотр.
Пациентам, чьи родственники страдают наследственными формами полинейропатии, желательно обратиться к медицинскому генетику, чтобы определить свой риск развития болезни.
В мае 2021 года пациентка И. обратилась на станцию скорой медицинской помощи г. Владимира с жалобами на слабость и онемение ног и рук.
Жалобы
Женщина рассказала, что из-за слабости в мышцах не может нормально стоять, ходить и удерживать предметы в руках, например мобильный телефон или стакан воды. Также у пациентки дрожали руки и ноги и кружилась голова.
На фоне выраженной слабости повысилось артериальное давление (АД): при нормальном рабочем АД 120–130/70 мм рт. ст. в последние 2–3 дня до обращения АД держалось на уровне 170–180/100 мм рт. ст. и плохо снижалось на фоне приёма Капотена (Каптоприла) и Моксонидина.
Анамнез
В середине мая 2021 года у пациентки поднялась температура тела до 39 °C, появился небольшой сухой кашель и одышка. В течение 5 дней женщина принимала нестероидные противовоспалительные средства (НПВС) и Арбидол, но температура не падала ниже 38,5 °C, при этом кашель сохранялся и нарастала одышка.
Анализ на коронавирусную инфекцию оказался положительным. Степень насыщения крови кислородом (сатурация) была в пределах 93–94 % при норме в 95–98 %. На основании этих результатов больную направили на лечение в ковидный госпиталь.
Там проводилась противовирусная терапия Фавипиравиром, инъекциями кортикостероидов, жаропонижающими препаратами и антибиотиками. На фоне лечения температура тела нормализовалась, перестала беспокоить одышка. Сатурация поднялась до 97 %.
Через несколько дней после выписки температуры тела снова поднялась до 38,7 °C. На фоне приёма НПВС снижалась до нормальной.
Спустя пять дней температура нормализовалась, состояние оставалось удовлетворительным, жалоб не было.
Через полторы недели после выписки (т. е. через 5 дней после нормализации температуры) пациентка заметила покалывание в ногах и руках. На следующий день после появления этих симптомов онемели ноги, в них появилась слабость. Вечером из-за сильной слабости женщина не смогла встать с кровати.
В этот же день к пациентке приезжал невролог из частной клиники. Врач зафиксировал парез (снижение мышечной силы) рук и ног. Пациентке рекомендована госпитализация в неврологическое отделение, однако из-за сохраняющегося положительного анализа на коронавирусную инфекцию женщину снова направили в ковидный госпиталь.
Хронические заболевания: постинфарктный кардиосклероз (инфаркт миокарда неизвестной давности), жёлчнокаменная болезнь (ЖКБ). Хронический альвеолит (воспаление лёгочных пузырьков — альвеол).
Из-за депрессии в течение последних 20 лет по рекомендации психотерапевта женщина постоянно принимает на ночь по 200 мг Сероквеля (Кветиапина).
Обследование
- При поступлении сознание пациентки ясное. Нарушений речи и ориентации в месте, времени, личности нет, речь не изменена. Нистагма (быстрых, колебательных движений глаз) нет.
- Снижена двигательная активность рук и ног: пациентка не может ходить и одеваться без посторонней помощи.
- В правой руке и ноге нарушена чувствительность.
- Состояние кожи: цвет бледно-розовый, влажность нормальная, синюшность отсутствует.
- Температура тела 36,7 °C.
- Состояние органов дыхания: сатурация 95 %, дыхание самостоятельное, ритм регулярный, частота дыхательных движений (ЧДД) 19 в минуту, при выслушивании дыхание жёсткое.
- Состояние сердечно-сосудистой системы: артериальное давление 190/100 мм рт. ст.
- Живот мягкий, безболезненный, стул и мочеиспускание контролирует.
Пациентке провели лабораторную и инструментальную диагностику. Также женщину консультировали невролог и инфекционист.
- В общем анализе крови был повышенный уровень лейкоцитов и ускорение скорости оседания эритроцитов (СОЭ). Это указывало на инфекционно-воспалительный процесс.
- В биохимическом анализе крови отмечалось повышение С-реактивного белка.
Инфекционист сделал заключение о перенесённой коронавирусной инфекции, невролог диагностировал синдром Гийена — Барре как осложнение инфекции.
Диагноз
- D43.0 Парасагиттальная менингиома средней трети верхнего сагиттального синуса.
- U07.1 Коронавирусная инфекция, реконвалесцент (выздоровление).
- I25.1 Ишемическая болезнь сердца (ИБС). напряжения, функциональный класс 2 (загрудинные боли возникают при обычной ходьбе, когда человек проходит больше 200 метров).
- Постинфарктный и атеросклеротический кардиосклероз.
- Хроническая сердечная недостаточность, функциональный класс 2 (незначительное ограничение физической активности: в покое симптомы отсутствуют, привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением).
- Недостаточность кровообращения IIА (умеренные признаки недостаточности кровообращения в покое только в одном из отделов сердечно-сосудистой системы).
Лечение
28 и 30 мая пациентке сделали плазмообмен (плазмоферез). Суть процедуры в том, что у пациента берут жидкую часть крови (плазму), очищают её от токсинов, цитокинов и обломков повреждённых клеток с помощью специального аппарата с фильтрами и возвращают больному. Процедура протекала без осложнений.
Медикаментозное лечение было направлено на восстановление нервной и сердечно-сосудистой систем, в том числе на снижение артериального давления. Пациентке назначили:
-
500 мг — подъязычно, 2 раза в сутки (утром и вечером). 4000 анти-ХА МЕ — подкожно, 2 раза в сутки (утром и вечером), для профилактики тромбоза, который может развиваться после коронавирусной инфекции. 100 мг — внутрь, 1 раз в сутки (вечером), для профилактики тромбоза. 20 мг — внутрь, 1 раз в сутки (вечером). 40 мг — внутрь, 1 раз в сутки (вечером), для снижения холестерина. Препарат входит в рекомендации по лечению коронавирусной инфекции как снижающий вирусную нагрузку. 500 мл — внутривенно капельно, 1 раз в сутки (утром) в течение 6 дней, для выведения токсинов из организма.
- Дабигатрана этексилат 110 мг — внутрь, 2 раза в сутки (утром и вечером), постоянно. Назначен в последние дни госпитализации для дальнейшей профилактики тромбоэмболических осложнений.
Также пациентка занималась лечебной физкультурой, которая рекомендована при заболеваниях верхних дыхательных путей.
На фоне терапии у пациентки улучшилась чувствительность, увеличилась сила мышц в руках и ногах, появились живые симметричные сухожильные рефлексы. Лабораторные данные указывали на снижение воспалительного процесса.
За время стационарного лечения состояние пациентки улучшилось: после проведённого плазмофереза увеличилась сила в руках и ногах, повысилась способность переносить физические нагрузки. Больная может себя обслуживать, свободно самостоятельно ходит, одевается и ест. Состояние органов дыхания и сердечно-сосудистой системы не ухудшилось.
Реабилитационный потенциал удовлетворительный, т. е. пациентка может полностью восстановиться. Прогноз благоприятный: все функции нервной системы восстановятся через 3–4 недели.
Пациентка нуждается в дальнейшей реабилитации. Необходимо провести 2–3 курса сосудистого лечения с применением таких препаратов, как Мексидол, Цераксон (Цитиколин), Церебролизин и другими, с перерывами в 1–2 месяца. Также пациентке рекомендована лечебная физкультура, массаж, физиотерапия, желательно в условиях специализированного санаторно-курортного учреждения. Противопоказаний для реабилитационного восстановительного лечения нет.
Заключение
Синдром Гийена — Барре — это острое аутоиммунное поражение периферической нервной системы, которое проявляется слабостью мышц и нарушением чувствительности. Он является частой причиной острых параличей. Без лечения синдром может привести к летальному исходу. Поэтому люди с этим заболеванием должны находиться под наблюдением врача и проходить специализированное лечение.
Уже известно, что коронавирусная инфекция может вызвать различные неврологические осложнения: искажение чувства вкуса, потерю обоняния, снижение слуха и др. Поэтому наиболее вероятно, что в этом случае именно подтверждённый вирус SARS-CoV-2 запустил начало аутоиммунного процесса. Врачи разных стран сообщают, что проблема развития синдрома Гийена — Барре на фоне перенесённой коронавирусной инфекции очень актуальна.
У пациентки болезнь заподозрили на основании симптомов и данных анамнеза. Диагноз установили по международным критериям Всемирной организации здравоохранения от 1993 года и критериям Брайтона. Правильно и своевременно установленный диагноз позволил провести эффективное лечение.
Читайте также:

