Синдром инфекционных осложнений что это
Обновлено: 24.04.2024
Инфекции с осложнением в виде энцефалита у ребенка
а) Микоплазменный энцефалит. Микоплазма, хотя и не является вирусом, также нуждается в механизме репликации клетки-хозяина. Энцефалит микоплазменной этиологии иногда может иметь острое начало одновременно с респираторными симптомами или чаще в виде вторичного явления с атипичным иммунным ответом на инфекцию в ЦНС (Abramovitz с соавт., 1987). В одном из исследований были представлены плохие продолжительные неврологические последствия у пациентов с микоплазменным энцефалитом (Koskiniemi et al., 1991). Диагноз ставится при выделении ДНК из ликвора и/или серологическим методом определения продукции IgM, IgG и IgA к микоплазме в крови и/или СМЖ (Bencina et al., 2000).
Несмотря на то, что макролидные антибиотики эффективны против микоплазменного агента и должны использоваться при острой системной инфекции, в отдельных случаях трудно установить, является ли энцефалит первичным или иммунной реакцией. Однако проникновение макролидов в ЦНС недостаточно, и эффективность в преодолении гематоэнцефалического барьера не определена.
б) Респираторные вирусные инфекции:
1. Гриппозный энцефалит (грипп А и В). Несмотря на то, что у большинства новорожденных и детей, зараженных вирусом гриппа, развивается легкая респираторная инфекция, могут встречаться более тяжелые проявления болезни, включая неврологические симптомы (Wang et al., 2003; Maricich et al., 2004). Неврологическое поражение часто стойкое с серьезными последствиями или смертельным исходом, и включает острый энцефалит, синдром Рейе, острую некротическую энцефалопатию и миелит, а также аутоиммунные состояния типа синдрома Гийена-Барре. Вирусологическая диагностика основана на выделении вируса или определении антигенов в носоглоточном секрете, а так же на выявлении РНК в ликворе с помощью ПЦР или сероконверсией (Studahl, 2003).
Первоначально о повышенном уровне заболеваемости грипп-ассоциированным энцефалитом/энцефалопатией было заявлено у японских детей. В одном исследовании у 89 детей со средним возрастом 3,8 лет, ни один из которых не получал аспирин, заболевание отмечалось в течение восьми сезонов гриппа (1994-2002 гг.) (Togashi et al., 2004). После короткого респираторного продромального периода у большинства пациентов быстро развилось коматозное состояние с (или без) судорогами; 37% умерли, 19% имели неврологические последствия. В образцах плазмы и ликвора у двоих пациентов, которые умерли от молниеносного течения болезни, отмечалось значительное повышение уровня интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α).
При посмертном исследовании одного летального случая выявлен вазогенный отек мозга с генерализованной васкулопатией, подтверждая повреждение эндотелия сосудов, вероятно, за счет высокой активности цитокинов. Другие исследования показали повышенный уровень системных и ликворных цитокинов при гриппозном энцефалите (ИЛ-6 и ФНО-а), так же как увеличение цитохрома С, свидетельствующего о вторичной смерти клеток путем апоптоза в результате гиперцитокинемии (Hosoya et al., 2005, Nunoi et al., 2005). Наиболее высокий уровень отмечен у пациентов с летальным исходом.
2. Энцефалит птичьего гриппа. На сегодняшний день птичий грипп A (H5N1) возникает у небольшой группы лиц, обычно там, где имеется контакт с больными птицами (de Jong et al., 2006). Как и при тяжелой респираторной инфекции, возможно сочетанное поражение многих органов с комой, в большинстве случаев с летальным исходом.
3. Аденовирусный энцефалит. Чаще встречается у детей, обычно проявляясь в виде легкой простудной или гастроинтестинальной болезни. К более тяжелым осложнениям относятся дыхательная недостаточность, энцефалопатия и хронические последствия, включая облитерирующий бронхиолит и продолжительное повреждение ЦНС (Chuang et al., 2003). Аденовирус может быть причиной асептического менингита, однако некоторые штаммы, такие как аденовирус 7 типа, часто вызывают менингоэнцефалит с более тяжелым течением. Другие неврологические синдромы, связанные с аденовирусом — миелит, подострый очаговый аденовирусный энцефалит и Рейе-подобный синдром (Straussberg et al., 2001).
У детей с ослабленным иммунитетом аденовирус может быть причиной полиорганной недостаточности с энцефалитом, печеночной коагулопатией и смертью. Диагноз выставляется на основе изоляции вируса или определения антигенов в носоглоточном секрете или стуле, так же как определение ДНК методом ПЦР в спинномозговой жидкости.
Редкие проявления энцефалопатии возникали при ротавирусных гастроэнтеритах, но, вероятно, это не связано с проникновением вирусов в ткани ЦНС (Nakagomi и Nakagomi, 2005). Энцефалитные проявления с припадками и расстройствами сознания могут быть осложнением других невирусных диарейных заболеваний, включая энтеритные инфекции Shigella (Mulligan et al., 1992) и C. jejuni (Nasralla et al., 1993).
г) Постинфекционные энцефалиты. Постинфекционные энцефалиты, вероятно, самый распространенный тип острых энцефалитов в европейских странах. Поскольку ни в одном из этих случаев не обнаруживают вирус, они скорей всего не являются результатом прямого вирусного вторжения в ЦНС, а вероятно возникают благодаря ответу иммунной системы на инфекционный агент в тканях хозяина посредством механизмов, обсуждаемых в отдельной статье на сайте при остром диссеминированном энцефаломиелите (ADEM).
Большинство случаев постинфекционного энцефалита являются осложнением заболеваний, сопровождающихся экзантематозной сыпью. Однако многие случаи возникают вследствие недиагностированных инфекционных заболеваний. Частота постинфекционных энцефалитов оценивается приблизительно, так как во многих случаях не доступны данные патогенеза и механизма острой энцефалитной картины. Так, при свинке менингит возникает очень часто, но доказательства перивенозного энцефалита представлены лишь в некоторых случаях (Johnson, 1982а). В ряде случаев болезнь, предшествующая началу энцефалита, не диагностируется и не идентифицируется ни один вирус, даже ретроспективно. Диагноз вирусной инфекции основывается на клинических проявлениях и течении продромального периода.
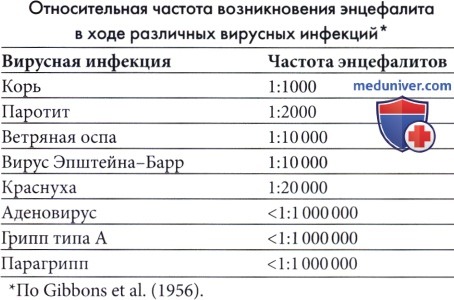
Корь — наиболее частая причина экзантематозной сыпи; таким образом, заболеваемость энцефалитом будет зависеть от заболеваемости корью и уровня иммунизации против кори среди населения. Острый коревой энцефалит начинается через 6-8 дней после первых высыпаний и встречается в 1 из 1000 случаев (Johnson et al, 1984). Несмотря на вариабельность интенсивности, заболевание часто протекает тяжело, со смертельными исходами в 10% случаев и частыми осложнениями, включая припадки, двигательные нарушения и умственную отсталость. Трудности в обучении и поведенческие расстройства характерны для детей с очевидным полным выздоровлением. Описаны редкие случаи постинфекционного энцефалита вследствие вакцинации против кори, но их частота значительно меньше, чем энцефалиты, связанные с диким вирусом кори (Landrigan и Witte, 1973). Постинфекционный энцефалит, ассоциированный с пятой болезнью (парвовирус В19) и внезапной сыпью (HHV-6 и 7) встречается очень редко.
В странах с вакцинацией против кори, свинки и краснухи, rubella (коревая краснуха) в настоящее время является редким заболеванием и случаи острого краснушного энцефаломиелита, следовательно, крайне редки. Постинфекционный краснушный энцефалит — тяжелое заболевание со смертностью примерно в 20% случаев, возникающее в 1 из 5000 острых случаев краснухи. Может развиваться одновременно с сыпью или даже через неделю или позже.
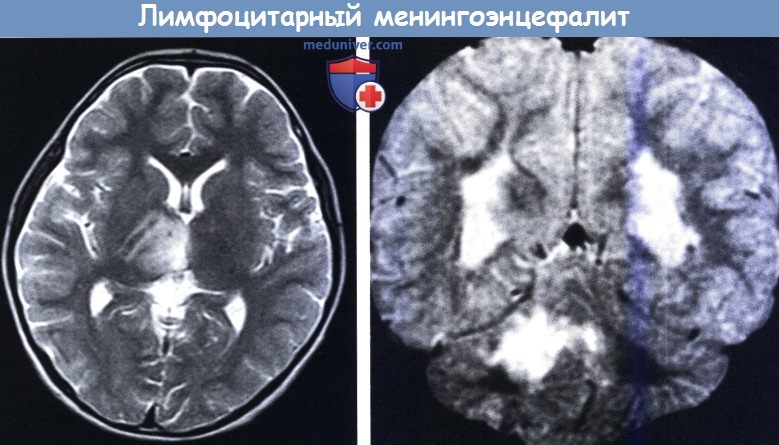
MPT (слева): патологический сигнал от правого таламуса и среднего мозга, вызванный параинфекционным лимфоцитарным менингоэнцефалитом.
12-последовательность (справа): более обширная зона интенсивного сигнала от правого полушария мозжечка и двусторонний интенсивный сигнал от супратенториального белого вещества полушарий (четырехлетняя девочка с мозжечковой атаксией с внезапным началом,
продолжающейся несколько недель, с легким ступором, который исчез через несколько дней).
1. Патология. Патогенез постинфекционного энцефалита имеет отличительные черты. Представлен множественными очагами перивенозной демиелинизации. Осевые цилиндры обычно лучше сохраняются, чем миелин. Определяются лейкоцитарные муфты вокруг вен и венул из мононуклеарных клеток, в демиелинизированных участках видны клетки микроглии и макрофаги.
2. Клинические проявления. Клинические проявления те же, что и при уже описанных типах энцефаломиелита. В большинстве случаев имеется внезапное начало с расстройствами сознания и припадками. Эти симптомы появляются в среднем через шесть дней (до 21 дня) после появления инфекции верхних дыхательных путей или экзантемы, в большинстве случаев у детей в возрасте старше двух лет. Могут быть представлены различные неврологические проявления, включая гемипарез, экстрапирамидные симптомы, атаксию, лицевые параличи, нистагм и поражение черепных нервов (Kennard и Swash, 1981; Marks et al, 1988). Результаты нейровизуализации могут быть отрицательными, а при МРТ обычно выявляются участки повышения сигнала преимущественно в белом веществе полушарий и иногда с вовлечением мозжечка. Характерны вовлечение зрительного бугра и базальных ганглиев. Течение заболевания варьирует от случая к случаю и зависит от причинных факторов. Уровень смертности низкий. Три четверти случаев протекают быстро, с выздоровлением в течение двух недель.
Другим вариантом постинфекционного энцефалита является острый геморрагический лейкоэнцефалит. Это фульминантное заболевание, которое характеризуется быстрой прогрессией очаговых неврологических симптомов и признаков, особенно гемиплегии, сопровождающейся беспокойством, комой и лихорадкой. Ликвор при этом ксантохромный в 20% случаев и показывает полиморфноядерный плеоцитоз. В периферической крови часто представлен выраженный лейкоцитоз. Возможно бифазное течение. Демиелинизирующие повреждения имеют геморрагический характер из-за некротизирующего ангиита венул и капилляров. В постановке диагноза может помочь КТ и МРТ, указывая на наличие больших гиподенсных участках иногда с геморрагическим компонентом (Watson et al., 1984, Huang et al., 1988). При некоторых случаях острого геморрагического лейкоэнцефалита удавалось выделить ДНК и РНК герпесвирусов, но до сих пор неясно, вовлекаются ли эти вирусы в патологический процесс (An et al., 2002).
Лечение постинфекционного энцефалита в основном такое же, как при всех острых энцефалитных заболеваниях. Значение стероидной терапии остается неясным, несмотря на весьма впечатляющее немедленное действие в отдельных случаях (Pasternak et al, 1980). В некоторых случаях применяли внутривенное введение иммуноглобулинов (Kleiman и Brunquell, 1995).
д) Энцефалит ствола мозга и мозжечка. При рентгенографии в случаях острого диссеминированного энцефалита может выявляться вовлечение ствола мозга. Ограниченное вовлечение ствола мозга не характерно и может встречаться при первичных энцефалитах (Kaplan и Koveleski, 1978; North et al., 1993; Duarte et al., 1994) и реже, при постинфекционных типах.
Среди клинических проявлений выделяют лихорадку, системные симптомы и асептический менингит вместе с симптомами и признаками дисфункции ствола головного мозга. Заметно поражение глазодвигательных нервов и нижней лицевой пары, что может сопровождаться заторможенностью и признаками вовлечения длинных нервных путей, что приводит к пирамидальным и мозжечковым проявлениям. Участие черепных нервов и атаксия могут имитировать синдром Миллера-Фишера, который некоторыми авторами рассматривается в качестве формы энцефалита ствола мозга. МРТ может продемонстрировать повышенный сигнал в ножках мозга, в мосте, мозжечке и продолговатом мозге (Ormerod et al., 1986, Hosoda et al., 1987) и энцефалит следует отличать от опухоли ствола мозга, абсцесса или других нейрохирургических проблем. Всегда следует помнить о возможности ромбэнцефалита, вызванного L. monocytogenes, при эффективности антибиотикотерапии (Frith et al., 1987).
е) Острый очаговый энцефалит. Острый очаговый энцефалит, поражающий ограниченный участок при инфекции коксаки-вирусом А9 (Roden et al., 1975) и ЕСНО-вирусом 25 (Peters et al., 1979), может привести к острой гемиплегии или гемихорее. Лакунарные повреждения в центральном сером веществе или внутренней капсуле могут быть результатом сосудистых инфарктов или очаговых церебритов.
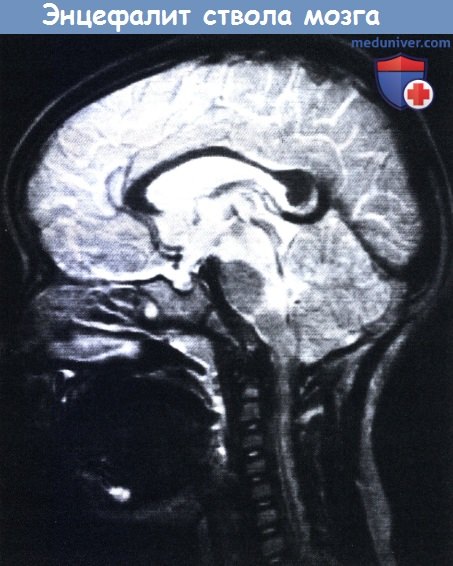
Энцефалит ствола мозга у четырехлетней девочки с клиникой ступора и множественными параличами черепных нервов.
При МРТ выявлено усиление сигнала от ножек мозга и дорсальной части моста.
При повторной МРТ через два месяца патологических изменений не обнаружено.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Менингит: причины появления, симптомы, диагностика и способы лечения.
Определение
Менингит – это инфекционное воспаление мозговых оболочек головного и спинного мозга, сопровождающееся интоксикацией, лихорадкой, синдромом повышенного внутричерепного давления, менингеальным синдромом, а также воспалительными изменениями ликвора (спинномозговой жидкости).
Мозговые оболочки - это соединительнотканные пленчатые образования, покрывающие головной и спинной мозг. Различают твердую мозговую оболочку, паутинную и мягкую.
Твердая оболочка головного мозга имеет плотную консистенцию и толщину 0,2-1 мм, местами она срастается с костями черепа. Паутинная оболочка — тонкая, полупрозрачная, не имеющая сосудов соединительнотканная пластинка, которая окружает головной и спинной мозг. Мягкая оболочка — тонкая соединительнотканная пластинка, непосредственно прилежащая к головному мозгу, соответствует его рельефу и проникает во все его углубления. В ее толще располагается сосудистая сеть головного мозга.
Причины появления менингита
Мозговые оболочки могут вовлекаться в воспалительный процесс первично и вторично. Менингит, возникший без предшествующей общей инфекции или заболевания какого-то другого органа, называется первичным. Вторичный менингит развивается как осложнение уже имеющегося инфекционного процесса. К вторичным относятся туберкулезный, стафилококковый, пневмококковый менингит. К первичным – менингококковый, первичный паротитный, энтеровирусные менингиты и другие.
Гнойное воспаление мозговых оболочек может быть вызвано различной бактериальной флорой (менингококками, пневмококками, реже - другими возбудителями). Причина серозных менингитов - вирусы, бактерии, грибы.
По прогнозу наиболее опасен туберкулезный менингит, который возникает при условии наличия в организме туберкулезного поражения. Развитие заболевания проходит в два этапа. На первом этапе возбудитель с током крови поражает сосудистые сплетения желудочков мозга с образованием в них специфической гранулемы. На втором – наблюдается воспаление паутинной и мягкой оболочек (как правило, поражаются оболочки основания головного мозга), которое вызывает острый менингиальный синдром.
Процесс развития менингококкового менингита также состоит из нескольких этапов:
- попадание возбудителя на слизистую оболочку носоглотки;
- попадание менингококка в кровь;
- проникновение возбудителя через гематоликворный барьер, раздражение рецепторов мягкой мозговой оболочки токсичными факторами и воспаление.
Течение инфекционного процесса зависит от патогенных свойств возбудителя (способности вызывать заболевание) и состояния иммунной системы человека.
Предшествующие вирусные заболевания, резкая смена климата, переохлаждение, стресс, сопутствующие заболевания, терапия, подавляющая иммунитет, - могут иметь существенное значение для возникновения и течения менингита.
Классификация заболевания
По типу возбудителя:
- Вирусный менингит (гриппозный, парагриппозный, аденовирусный, герпетический, арбовирусный (клещевой), паротитный, энтеровирусные ЕСНО и Коксаки).
- Бактериальный менингит (менингококковый, туберкулезный, пневмококковый, стафилококковый, стрептококковый, сифилитический, бруцеллезный, лептоспирозный).
- Грибковый (криптококковый, кандидозный и др.).
- Протозойный (токсоплазмозный, малярийный).
- Смешанный.
- Первичный.
- Вторичный.
- Острый.
- Подострый.
- Молниеносный.
- Хронический.
- Легкая.
- Среднетяжелая.
- Тяжелая.
- Генерализованный.
- Ограниченный.
- Осложненный.
- Неосложненный.
- менингеальный синдром – проявляется ригидностью (повышенным тонусом) затылочных мышц и длинных мышц спины, гиперстезией (повышенной чувствительностью) органов чувств, головной болью, рвотой, изменениями со стороны спинномозговой жидкости;
- общемозговой синдром – проявляется сонливостью, нарушением сознания, тошнотой, рвотой, головокружением, психомоторным возбуждением, галлюцинациями;
- астеновегетативный синдром – проявляется слабостью, снижением трудоспособности;
- судорожный синдром;
- общеинфекционный синдром - проявляется ознобом, повышением температуры.
Пневмококковый менингит, как правило, наблюдается у детей раннего возраста на фоне имеющегося пневмококкового процесса (пневмонии, синусита).
При стрептококковом менингите на первый план выступает гепатолиенальный синдром (увеличение печени и селезенки), почечная недостаточность, надпочечниковая недостаточность, петехиальная сыпь (кровоизлияния, вследствие повреждения капилляров, в результате чего, кровь, растекаясь под кожей, образует округлые пятна, размер которых не превышает 2 мм).
Гнойные менингиты, вызванные синегнойной палочкой, грибами встречаются редко. Диагноз устанавливается только после дополнительных лабораторных исследований.
Для серозного туберкулезного менингита характерно постепенное начало, хотя в редких случаях он может манифестировать остро. В дебюте заболевания больные жалуются на утомляемость, слабость, раздражительность, нарушение сна. Температура обычно не выше 38℃, отмечается непостоянная умеренная головная боль. На 5-6-й день болезни температура становится выше 38℃, усиливается головная боль, появляется тошнота, рвота, сонливость. Быстро развивается бессознательное состояние. Могут наблюдаться расходящееся косоглазие, низкое положение верхнего века по отношению к глазному яблоку, расширение зрачка.
Клинические проявления поражения мозговых оболочек могут развиваться еще до увеличения слюнных желез.
Для энтеровирусного менингита характерна двух- и трехволновая лихорадка с интервалами между волнами 1-2 и более дней. Почти всегда наблюдаются и другие проявления энтеровирусной инфекции (мышечные боли, кожная сыпь, герпангина).
Для диагностики коревого и краснушного менингитов большое значение имеет указание на контакт с больным этими заболеваниями, а также типичные клинические симптомы кори или краснухи.
Диагностика менингита
-
клинический анализ крови с определением концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоформула и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лейкоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Лейкозы – большая группа заболеваний кроветворной системы. Кроветворение (гемопоэз) – это многоэтапный процесс образования форменных элементов крови в специализированных органах кроветворения. К форменным элементам крови относятся лейкоциты (белые кровяные тельца), которые участвуют во врожденном и приобретенном иммунитете, эритроциты (красные кровяные тельца), которые осуществляют транспорт кислорода и углекислого газа, и тромбоциты, обеспечивающие свертываемость крови.
Главный орган, где располагаются полипотентные стволовые клетки, - костный мозг, который как раз и поражается при лейкозах.
В результате повреждения (мутации) в генетическом материале полипотентной стволовой клетки-предшественницы нарушается процесс созревания клеток. При остром лейкозе возникает большое количество незрелых (бластных) клеток, из которых образуется опухоль, разрастается в костном мозге, замещает нормальные ростки кроветворения и имеет тенденцию к метастазированию – распространению с током крови или лимфы в здоровые органы. При хронических лейкозах заболевание течет годами, происходит частичная задержка созревания клеток и опухоль образуется из созревающих и зрелых клеток.
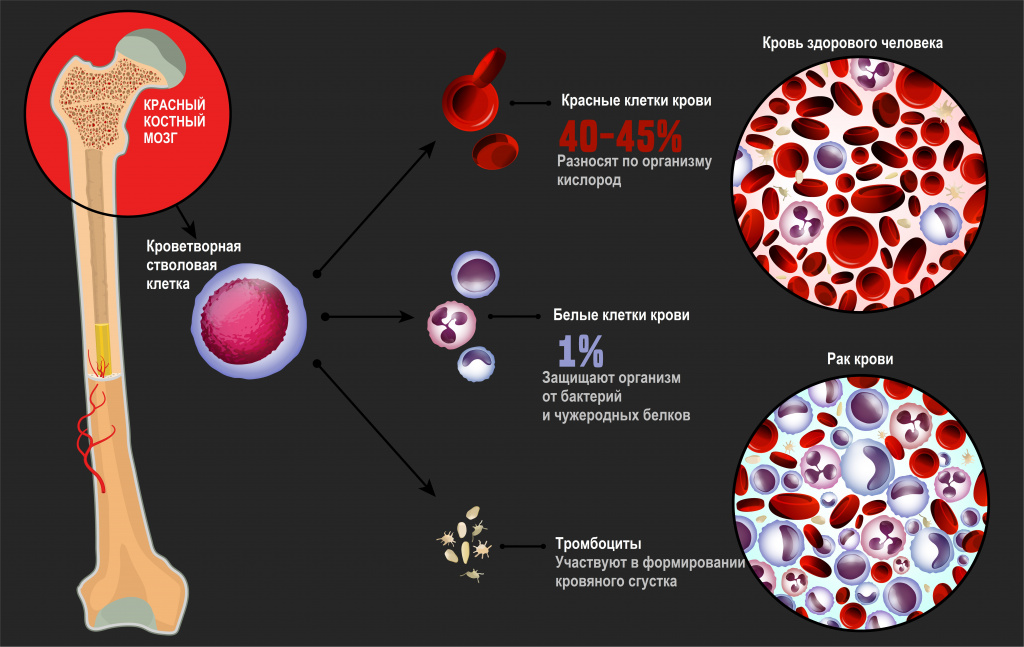
Причины возникновения лейкозов
К факторам риска развития лейкоза относятся:
- ионизирующая радиация: лучевая терапия по поводу других опухолей, облучение на рабочем месте, ультрафиолетовое излучение;
- воздействие на организм химических канцерогенных веществ;
- некоторые вирусы: HTLV (Т-лимфотропный вирус человека);
- бытовые факторы: добавки в пищевые продукты, курение, плохая экологическая обстановка;
- наследственная предрасположенность к раковым заболеваниям.
Лейкозы подразделяют на острые и хронические, а по типу поражения ростка кроветворения - на лимфоидные и миелоидные. Острый лейкоз никогда не переходит в хронический, а хронический не может стать острым (но его развитие может перейти в стадию бластного криза).
В зависимости от преобладания тех или иных опухолевых клеток выделяют бластные, цитарные и недифференцированные лейкозы.
Острый лимфобластный лейкоз (ОЛЛ) диагностируется у лиц любого возраста, начиная с младенческого и заканчивая пожилым, однако пик заболеваемости приходятся на детский возраст (60% пациентов с ОЛЛ моложе 20 лет). Острый лимфобластный лейкоз – самая распространенная опухоль кроветворной ткани у детей, которая составляет 30% всех злокачественных опухолей детского возраста. Заболеваемость ОЛЛ у пациентов пожилого возраста неуклонно возрастает: так, ежегодная частота ОЛЛ увеличивается с 0,39 случая на 100 тыс. населения в возрасте 35–39 лет, до 2,1 случая на 100 тыс. населения в возрасте ≥85 лет. Кроме того, приблизительно 30% ОЛЛ диагностируются в возрасте ≥60 лет.
Острым миелоидным лейкозом (ОМЛ) страдает в среднем 3-5 человек на 100 тыс. населения в год. Заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12–13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет.
Хронический лимфобластный лейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых, в то время как у детей этот вид опухоли не регистрируется. В европейских странах его частота составляет 4 случая на 100 тыс. населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30 случаев на 100 тыс. в год.
Хронический миелолейкоз (ХМЛ) – редкое заболевание: 0,7 на 100 тыс. взрослого населения, пик заболеваемости приходится на 50-59 лет, однако до 33% больных ОМЛ - люди моложе 40 лет.
Симптомы лейкозов
Острый лейкоз в большинстве случаев дебютирует резко - внезапно повышается температура, появляются озноб, боль в горле, в суставах, отмечается резко выраженная слабость. Реже острый лейкоз может проявиться кровотечением. Иногда острый лейкоз начинается с постепенного ухудшения состояния больного, появления невыраженной боли в суставах и костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания. У многих больных увеличиваются лимфоузлы и селезенка.
При хроническом лейкозе на начальной стадии, которая длится от года до трех лет, пациенты могут ни на что не жаловаться. Иногда беспокоят слабость, потливость, частые простудные заболевания, могут отмечаться тупые, ноющие боли в костях.
При подавлении эритроидного ростка, дающего красные кровяные тельца, возникает анемия и гемическая гипоксия (снижение количества кислорода в крови). При этом пациенты отмечают слабость, утомляемость, бледность кожных покровов.
При поражении мегакариоцитарного ростка падает количество тромбоцитов, поэтому возникает кровоточивость десен, слизистой оболочки носа, пищеварительного тракта, образуются синяки, кровоизлияния в различные органы. При прогрессировании лейкоза могут развиваться массивные кровотечения в результате ДВС синдрома (синдрома диссеминированного внутрисосудистого свертывания).
В результате недостатка лейкоцитов и снижения иммунитета развиваются инфекционные осложнения различной степени тяжести, что чаще всего проявляется лихорадкой.
Могут возникать язвенно-некротическая ангина, перитонзиллярные абсцессы, некротический гингивит, стоматит, пиодермия, параректальные абсцессы, пневмония, пиелонефрит. Существует значимый риск тяжелого течения инфекционных осложнений вплоть до развития сепсиса.
С током крови и лимфы опухолевые клетки попадают в здоровые органы, нарушают их структуру и функцию - наиболее подвержены метастатическим процессам печень, селезенка, лимфатические узлы, но метастазы могут поражать и кожу, и мозговые оболочки, и почки, и легкие.
Основные причины летальности у пациентов с лейкозом связаны с тем, что осложнения могут спровоцировать развитие сепсиса, полиорганную недостаточность, кровоизлияния в различные органы. Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев.
Диагностика лейкозов
Диагностика лейкозов основывается на оценке морфологических особенностей клеток костного мозга и периферической крови. Поэтому всем пациентам с подозрением на лейкоз назначают общий анализ крови с подсчетом лейкоцитарной формулы и определением числа тромбоцитов.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли рекомендовано выполнение общетерапевтического биохимического анализа крови: АСТ, АЛТ, общий билирубин, глюкоза, мочевина, креатинин, общий белок, ЛДГ, магний, натрий, калий, кальций.
Аланинаминотрансфераза − внутриклеточный фермент, участвующий в метаболизме аминокислот. Тест используют в диагностике поражений печени, сердечной и скелетных мышц. Синонимы: Глутамат-пируват-трансаминаза; Глутамат-пируват-трансаминаза в сыворотке; СГПТ. Alanine aminotransferase; S.
Синонимы: Глутамино-щавелевоуксусная трансаминаза; Глутамат-оксалоацетат-трансаминаза сыворотки крови (СГОТ); L-аспартат 2-оксоглутарат аминотрансфераза; ГЩТ. Aspartateaminotransferase; Serum Glutamicoxaloacetic Transaminase; SGOT; GOT. Краткая характеристика определяемого вещества АсАТ .
Синонимы: Общий билирубин крови; Общий билирубин сыворотки. Totalbilirubin; TBIL. Краткая характеристика определяемого вещества Билирубин общий Билирубин – пигмент коричневато-желтого цвета, основное количество которого образуется в результате метаболизма гемовой части гемоглобина при дест.
Материал для исследования Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазмы от клеток, пробу берут в специальную пробирку, содержащую ингибитор гликолиза (флюорид натрия). Синони.
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины. Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea. Краткая характеристика аналита Мочевина Мочевина является основным азотсодержащим продуктом катаболизма белков и аминокислот в организме человека. .
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat. Краткая характеристика определяемого вещества Креатинин Креатинин – низкомолекулярное азотсодержащее вещество, продукт метаболизма креа.
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок. Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР. Краткая характеристика определяемого вещества Общий белок Сыворотка крови (плазма крови, лишенная фибриногена) содержит множество белков, выполняющих разнообразны.
Синонимы: Анализ крови на ЛДГ; Лактатдегидрогеназа; L-лактат; НАД+Оксидоредуктаза; Дегидрогеназа молочной кислоты. Lactate dehydrogenase, Total; Lactic dehydrogenase; LDH; LD. Краткая характеристика определяемого вещества Лактатдегидрогеназа ЛДГ – цитоплазматический.
Синонимы: Анализ крови на магний; Общий магний; Ионы магния. Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium. Краткая характеристика определяемого аналита Магний Магний, как и калий, содержится преимущественно внутри клеток. 1/3-1/2 всего магния организма .
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl. Краткая характеристика определяемых веществ (Калий, Натрий, Хлор) Калий (К+) Основной внутриклеточный катион. Кал.
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в организме. Синонимы: Анализ крови на общий кальций; Общий кальций в сыворотке. Total blood calcium; Total calcium; Bl.
Для определения вероятности развития тяжелых коагуляционных нарушений (как геморрагических, так и тромботических) рекомендовано исследование свертывающей системы крови.
С целью исключения поражения почек выполняют общий анализ мочи.
Диагностику хронического лейкоза проводят с помощью иммунофенотипического исследования лимфоцитов крови (ИФТ) методом проточной цитометрии.
Рекомендовано проведение стернальной пункции (пункции грудины) для получения цитологического препарата костного мозга и цитологическое и цитохимическое исследование мазка с целью уточнения диагноза и определения прогноза.
В ряде случаев показана биопсия опухолевого образования или лимфатического узла (или другого метастатического очага) и патологоанатомическое исследование полученного биопсийного материала.
Кроме того, врач может рекомендовать проведение иммунофенотипирования гемопоэтических клеток-предшественниц в костном мозге, цитогенетическое исследование аспирата костного мозга, молекулярно-генетические исследования мутаций в генах и др.
Из инструментальных методов диагностики проводятся:
-
эхокардиография для оценки функционального состояния сердечной мышцы;
Исследование, позволяющее оценить функциональные и органические изменения сердца, его сократимость, а также состояние клапанного аппарата.
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Лечение лейкозов
Лечение лейкозов проводится в стационаре. Медикаментозное воздействие на опухоль специальными препаратами, губительно действующими на быстро делящиеся клетки, называется химиотерапией. При лечении острых лейкозов химиотерапию проводят в несколько этапов: индукция ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия и профилактика нейролейкемии (метастазирования опухолевых лейкозных клеток в головной и спинной мозг).
Период индукции ремиссии - это начальный этап, цель которого максимально уменьшить опухолевую массу и достичь ремиссии. Обычно для этого требуется 1-2 курса химиотерапии. Далее идет консолидация достигнутого эффекта - наиболее агрессивный и высокодозный этап лечения, задачей которого является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. Этот этап также занимает 1-2 курса. За ним следует противорецидивное или поддерживающее лечение. При некоторых вариантах острых лейкозов требуется профилактика или, при необходимости, лечение нейролейкемии.
Для разных видов лейкозов у разных возрастных групп профессиональными сообществами разработаны схемы химиотерапии.
При лечении ХМЛ основными препаратами выбора являются ингибиторы тирозинкиназы, применяемые в непрерывном режиме – ежедневно, длительно, постоянно. Перерывы в приеме могут способствовать снижению эффективности терапии и прогрессированию заболевания. В случае неэффективности терапии может быть проведена трансплантацию гемопоэтических стволовых клеток или костного мозга.
В терапии ХЛЛ цели и схемы терапии химиотерапии определены возрастом пациента, числом и тяжестью сопутствующих заболеваний. Разработаны протоколы лечения для разных пациентов, в том числе схемы моно- и полихимиотерапии. Для профилактики инфекционных осложнений применяют внутривенное введение иммуноглобулина, рекомендована вакцинация от гриппа и пневмококковой инфекции.
Помимо химиотерапии пациенту может потребоваться трансфузионная терапия: переливание эритроцитарной массы, тромбоцитарной массы, изотонических растворов.
При присоединении инфекций показана антибиотикотерапия. На фоне лечения могут возникать тромботические осложнения, что требует антикоагулянтной терапии. Пациентам высокого риска в связи с вероятностью рецидива лейкоза применяют трансплантацию гемопоэтических стволовых клеток.
Профилактика лейкозов
Так как причины возникновения лейкозов не установлены, методов специфической профилактики до сих пор не существует.
Однако доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет.
Ряд исследователей предполагают, что около 20% случаев ОМЛ являются следствием курения.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Инфекционные осложнения. Эпидемиология нозокомиальных инфекций
Инфекционные осложнения, развивающиеся в разный срок после операций, травм и ранений, составляют значительное число и имеют важное общемедицинское значение.
По данным зарубежных исследований, средняя частота нозокомиального инфицирования (НКИ) в лечебных учреждениях составляет 5-10%, а в ОРИТ достигает 25-49%.
Исследования, выполненные специалистами ЦНИИ эпидемиологии, показали, что в Российской Федерации ежегодное количество случаев нозокомиальной инфекции (НКИ) достигает 2,5 млн. Присоединение инфекционных осложнений к основному заболеванию увеличивает в среднем на 6-8 дней продолжительность пребывания пациента в стационаре, приводит к неоправданным экономическим затратам.

Хирургическая нозокомиальная инфекция (НКИ) увеличивала койко-день в США в среднем на 7,4 дня, в лечебных учреждениях России — на 6-10 дней, в отдельных стационарах (травматология, кардиохирургия) — до 38 дней.
Как известно, нозокомиальные инфекции (НКИ) могут быть вызваны широким кругом микроорганизмов: бактериями, вирусами, плесневыми и дрожжевыми грибами, простейшими. Число потенциальных возбудителей НКИ с каждым годом растет за счет условно-патогенных бактерий, а также микроорганизмов, которых раньше считали сапрофитами.
Нозокомиальные инфекции (НКИ) чаще всего вызываются госпитальными штаммами условно-патогенных грамположительных и грамотрицательных бактерий, отличающихся но своим биологическим характеристикам от негоспитальных штаммов и обладающих множественной лекарственной резистентностью, более высокой устойчивостью к факторам окружающей среды. Долевое участие различных микроорганизмов в развитии инфекции определяется рядом факторов, в первую очередь локализацией патологического процесса, профилем стационара, уровнем развития лабораторной службы. Вместе с тем спектр микроорганизмов, вызывающих послеоперационные осложнения, постоянно меняется в каждой клинике.
Наличие микробных ассоциаций нередко маскирует истинное значение возбудителя НКИ, провоцирует на неправильные лечебные и профилактические действия. Выявление микст-возбудителей у пациентов с НКИ всегда должно быть предметом особого внимания госпитального эпидемиолога, чтобы принять адекватные меры против возможной контаминации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

