Синдром кастельмана без вич
Обновлено: 18.04.2024
Болезнь Кастлемана. Гиалиновый сосудистый, плазмоклеточные типы болезни Кастлемана.
Болезнь Кастлемана включает 3 типа:
• гиалиноаый сосудистый;
• плазмоклеточный вариант — локализованный;
• мультицентричная болезнь Кастлемана.
Возможно, из-за того, что фолликулы при плазмоклеточном варианте становятся со временем более гиалинизированными, может казаться, что есть некоторое перекрытие этих типов.
Гиалиновый сосудистый тип болезни Кастлемана.
Гиалиновый сосудистый тип болезни Кастлемана наиболее часто встречается у молодых людей. Чаще всего поражаются лимфатические узлы средостения, но возможно также поражение периферических лимфоузлов и различных внеузловых юн. Поражение обычно солитарное и не сопровождается системными проявлениями.
Гистологически при гиалиновом сосудистом типе определяются характерные фолликулы с широкой, состоящей из малых лимфоцитов мантийной зоной, которая часто напоминает концентрическую структуру наподобие слоев луковицы. В центрах фолликулов количество клеток уменьшено, они представлены главным образом эндотелиальными и дендритными ретикулярными клетками, в некоторых из них может выявляться ядерная атипия.
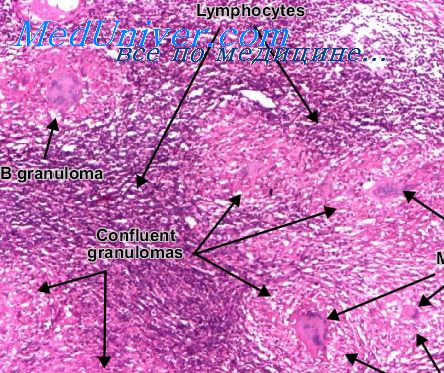
Межфолликулярные ткани построены, главным образом, из сети сосудов на толстом коллагеновом каркасе — признак, хорошо определяемый в срезах, окрашенных на ретикулин. Среди этих сосудов обнаруживаются рассеянные или расположенные группами малые лимфоциты, плазмоциты и плазмоцитоидные моноциты. Структура синусов обычно не идентифицируется.
Типичный гиалиновый сосудистый гип болезни с характерными проявлениями диагностируется легко. Трудности возникают, когда расположение гиалиновых сосудистых фолликулов (малое или большое их количество) напоминает изменения на поздних стадиях ВИЧ-инфекции. В этих случаях, в отличие от типичного гиалинового сосудистого типа болезни, обычно определяются некоторые резидуальные элементы синусов, большое количество плазмоцитов и исчезновение межфолликулярной сосудистой сети.
Гиалиновый сосудистый тип болезни Кастлемана является доброкачественным пролиферативным процессом, который обычно лечится путем локальной резекции. Редко он ассоциируется с дендритно-клеточной саркомой.
Плазмоклеточный тип болезни Кастлемана.
Плазмоклеточный (локализованный) вариант болезни Кастлемана встречается в различных возрастных группах. Наиболее часто он проявляется в форме абдоминальной лимфаденопатии с поражением одного или группы узлов. Медиастинальная или периферическая лимфаденопатия встречается намного реже, чем при сосудистом гиалиновом типе. У больных обычно отмечаются системные проявления и изменения лабораторных показателей: анемия, повышение уровня гюликлонального глобулина, увеличение СОЭ и возрастание количества плазмоцитов в костном мозге.
Хирургическое удаление пораженных узлов приводит к исчезновению этих симптомов и возвращению к норме лабораторных показателей.
Гистологически при плазмоклеточном (локализованном) варианте выявляется фолликулярная гиперплазия с сужением мантийной зоны, окруженной слоями зрелых плазмоцитов. Плотность расположения плазмоцитов часто затрудняет изучение структуры синуса, хотя синус можно идентифицировать по зонам. В большинстве случаев при плазмоклеточном (локализованном) варианте в плазмоцитах определяется экспрессия легкой цепи полипептинного Ig, более чем в 1/3 обнаруживается укорочение легкой цепи (обычно лямбда—светлая цепь).
Гистологически основная дифференциальная диагностика проводится с реактивными лимфаденопатиями, при которых выявляется значительный плазмоцитоз (как при ревматоидном артрите и сифилисе). Однако в таких лимфатических узлах структура синусов обычно остается более четкой, а интерфолликулярный инфильтрат состоит не только из плазмоцитов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром Кальмана – это наследственное заболевание, которое проявляется аносмией и гипогонадотропным гипогонадизмом. Причиной патологии выступают несколько видов мутаций в Х-хромосоме или аутосомах. Синдром проявляется недоразвитием первичных и вторичных половых признаков, нарушением способности различать запахи, задержкой психомоторного развития. Для постановки диагноза выполняются гормональные и генетические исследования, УЗИ органов малого таза у женщин и мошонки у мужчин, магнитно-резонансная томография. Лечение болезни Кальмана включает пожизненную заместительную терапию гормональными препаратами, хирургическую коррекцию сопутствующих пороков.
МКБ-10


Общие сведения

Причины
Патология имеет наследственное происхождение, возникает под действием точечных генных мутаций. Заболевание встречается в виде спорадических случаев либо как семейная форма. Передача мутантного гена происходит по аутосомно-доминантному, Х-сцепленному рецессивному типу наследования. В зависимости от характера изменений генетического материала в генетике выделяют 3 типичные формы болезни:
Патогенез
В основе заболевания лежит генетически обусловленный дефицит гонадотропин-рилизинг гормонов в гипоталамусе. Мутантные гены участвуют в миграции нейронов, отвечающих за синтез и выделение гормональных веществ, поэтому при ольфактогенитальной дисплазии этот процесс нарушается. В результате снижается выделение лютеинизирующего и фолликулостимулирующего гормонов гипофиза, развивается вторичный врожденный гипогонадизм.
Аносмия при синдроме Кальмана связана с внутриутробной гипоплазией или аплазией ольфакторных луковиц. Считается, что мутантные алели нарушают нормальное расположение нейронов в обонятельных структурах, вследствие чего изменяется способность к восприятию запахов. Пока не ясно, каким образом генетические аномалии влияют на появление других врожденных пороков, поэтому предполагается вовлечение дополнительных наследственных и экологических факторов.

Симптомы синдрома Кальмана
Клинические проявления заболевания отличаются вариабельностью, даже у членов одной семьи могут быть различные по тяжести формы ольфактогенитальной дисплазии. Типичные проявления болезни в основном отмечаются в пубертатном периоде, когда становится заметным отставание в половом развитии. У мальчиков формируется евнухоидизм, проявляющийся недоразвитием мошонки и яичек, малыми размерами пениса, отсутствием оволосения в гормонозависимых зонах.
Для женщин характерно недоразвитие половых признаков: отсутствие округлости молочных желез в пубертатном периоде, скудное оволосение тела, диспропорция фигуры и нарушения отложения жировой клетчатки. У девочек-подростков наблюдается первичная аменорея. Внутренние репродуктивные органы у женщин также гипоплазированы, матка и яичники имеют небольшие размеры, нарушается секреция эстрогенов и прогестерона.
Патологии обоняния варьируют от легкого снижения способности распознавать запахи до полной аносмии. До 13-14 лет пациенты с синдромом Кальмана по параметрам тела не отстают от сверстников, однако пубертатный скачок роста у них отсутствует, в дальнейшем темпы роста снижаются. Зачастую наблюдается задержка дифференцировки структур скелета, из-за чего костный возраст пациента будет меньше паспортного.
Осложнения
Около 5-10% больных синдромом Кальмана имеют сопутствующие пороки развития внутренних органов и скелета. Типичными осложнениями болезни считаются заячья губа, готическое небо, агенезия почки. К неврологическим последствиям ольфактогенитальной дисплазии относят билатеральную синкинезию, атаксию, умственную отсталость разной степени тяжести. В редких случаях клиническая картина дополняется пороками сердца.
Серьезную проблему для пациентов представляет нарушение полового созревания. Мужской гипогонадизм сопровождается микропенисом, снижением выработки тестостерона и уменьшением секреции спермы, что вызывает объективные и психологические затруднения при попытке сексуальных контактов. У женщин развивается первичное бесплодие, стойкое снижение либидо.
Диагностика
Обследование пациентов с подозрением на синдром Кальмана проводится врачом-эндокринологом с участием невролога, генетика и других специалистов, если это необходимо. При физикальном осмотре определяется формула полового развития, соответствие физических параметров тела возрасту пациента, наличие видимых признаков врожденных пороков. Диагностика ольфактогенитальной дисплазии сложна и включает следующие методы исследования:
- УЗИ половых органов. Женщинам проводится сонография малого таза, чтобы исследовать размеры матки и придатков, оценить степень гипоплазии яичников. Мужчинам выполняется УЗИ мошонки, которое определяет значительное уменьшение объема яичек при их однородной структуре и нормальной эхогенности.
- Ольфактометрия. Для оценки степени снижения обоняния проводится стандартная проба с набором пахучих веществ. Дополнительно выполняется риноскопия и рентгенография придаточных пазух носа для исключения риногенной причины аносмии.
- МРТ головного мозга. Выраженные структурные изменения головного мозга при синдроме Кальмана отсутствуют. Изредка определяется неоднородность структуры аденогипофиза, признаки гипоксической энцефалопатии и другие неспецифические неврологические знаки.
- Гормональный профиль. Определение уровня половых гормонов имеет диагностическую ценность в пубертатном периоде, когда в норме происходит половое созревание. У мальчиков определяется снижение уровня тестостерона, у девочек выявляется недостаток эстрогенов. Независимо от пола развивается стойкое снижение уровня рилизинг-гормонов гипоталамуса и гипофизарных гонадотропинов.
- Генетический анализ. Определение характерных мутаций является единственным 100% методом подтверждения диагноза синдрома Кальмана. На консультацию генетика направляются все больные с типичными клиническими проявлениями, чтобы дифференцировать ольфактогенитальный синдром от других форм врожденной патологии.
Дифференциальная диагностика
При выявлении гипогонадизма проводится дифференцировка между его первичной, вторичной и третичной формами, для чего необходимы функциональные пробы с гонадолиберином и кломифеном. В группе пациентов до 18 лет необходимо исключить конституциональную задержку полового созревания, которая может имитировать легкий вариант синдрома Кальмана. Дифференциальную диагностику аносмии проводит с опухолевыми и другими органическими поражениями ЦНС.

Лечение синдрома Кальмана
Консервативная терапия
Основной задачей лечения является стимуляции полового развития с помощью индивидуальных схем гормонотерапии. Терапия начинается в пубертатном периоде с возраста 13-13,5 лет и проводится пожизненно. Дополнительно назначаются препараты холекальциферола и витаминные комплексы, которые препятствуют развитию остеопороза. Аносмия у больных не подлежит коррекции ввиду отсутствия эффективных методов терапии.
Для лечения бесплодия у женщин используется хорионический гонадотропин в комбинации гонадолиберином или менотропином, которые назначаются в импульсном режиме в течение нескольких лет. В периоде подготовки к беременности используются гормональная стимуляция овуляции, при этом вероятность физиологического зачатия составляет более 70%. У мужчин проводится заместительная терапия гонадолиберинами и тестостероном.
Хирургическое лечение
У взрослых мужчин с синдромом Кальмана и микропенисом возможно проведение хирургической коррекции — лигаментотомии, которая направлена на удлинение полового члена и улучшение сексуальной функции. При наличии врожденных аномалий развития лица выполняется их пластическая коррекция в соответствующие сроки. Лечение пороков сердца проводится кардиохирургами согласно действующим протоколам.
Прогноз и профилактика
Качество жизни пациентов зависит от формы синдрома Кальмана и степени тяжести его проявлений. Легкие и субклинические варианты заболевания имеют благоприятный прогноз, при гормональной коррекции удается достичь нормального полового развития и репродуктивной функции. Менее оптимистичный прогноз при тяжелой ольфактогенитальной дисплазии в сочетании с другими врожденными пороками. Ввиду сложности этиопатогенеза меры профилактики пока не разработаны.
1. Синдром Кальмана у мальчика 17 лет/ А.В. Бурлуцкая, О.Г. Коробкина, А.В. Статова// Кубанский научный медицинский вестник. – 2020. – №1.
2. Аспекты диагностики и терапии синдрома Кальмана у мальчика (случай из практики) / О.А. Оганова/ Медицинский совет. – 2013. – №1.
3. Kallmann syndrome / Dodé, Catherine, and Jean-Pierre Hardelin // European Journal of Human Genetics. – 2009. – №2.
4. Случай ольфактогенитальной дисплазии (синдрома Каллмана) у женщины / М.Б. Бабарина, А.В. Секинаева, Е.Н. Гиниятуллина, Л.Я. Рожинская // Проблемы эндокринологии. – 2006. №1.
POEMS-синдром – это симптомокомплекс, который встречается у пациентов, страдающих онкологическими заболеваниями, прежде всего моноклональными гаммапатиями. Основные клинические симптомы представлены в первых буквах аббревиатуры в английской транскрипции: P – полинейропатия, O – органомегалия, E – эндокринопатия, M – наличие в крови М-протеина, S – изменения кожи. Диагноз устанавливается на основании клинико-лабораторного подтверждения основных компонентов синдрома. Лечение комплексное, включает цитостатики, иммуномодулирующие препараты, моноклональные антитела. Применяется лучевая терапия и трансплантация стволовых клеток.
МКБ-10

Общие сведения
POEMS-синдром (синдром Кроу-Фуказа, болезнь Такатцуки, японская системная болезнь) впервые был описан английским врачом Р. Кроу в 1956 году. Особенность патологии заключается в раннем дебютировании неврологической симптоматики, поэтому пациенты обычно обращаются к неврологам. Точные сведения о распространенности отсутствуют, по данным японских исследователей, встречаемость составляет 0,3 на 100 000. Чаще страдают люди в возрасте 40-60 лет. Гендерных различий не обнаружено. Нередко наблюдается сочетание с болезнью Кастлемана.

Причины POEMS-синдрома
Этиологический фактор остается неизвестным. В возникновении синдрома предполагалась роль длительной персистенции вирусов, а именно – хронической антигенной стимуляции герпесвируса 8 типа, однако убедительных данных в пользу этой теории не было получено. Имеется четкая связь с онкологическими заболеваниями (рак яичника, молочной железы).
В подавляющем большинстве случаев POEMS-синдром ассоциирован с онкогематологическими патологиями, особенно с парапротеинемиями – остеосклеротической миеломой, макроглобулинемией Вальденстрема, моноклональными гаммапатиями неясной этиологии. Поэтому некоторые авторы расценивают данную нозологию как проявление паранеопластического процесса.
Патогенез
Точные патофизиологические механизмы POEMS-синдрома еще недостаточно изучены. В ходе исследований была обнаружена корреляция таких медиаторов, как фактор роста эндотелия сосудов (VEGF), интерлейкин-6 и фактор некроза опухоли-альфа с активностью патологического процесса – выраженностью гепатоспленомегалии, генерализованного отечного синдрома и образованием кожных гемангиом.
Неврологическая симптоматика в виде полинейропатии объясняется отложением в периневрии и сосудах нервов иммунных комплексов, что вызывает высвобождение провоспалительных цитокинов, активацию моноцитарно-макрофагальной системы и проникновение через гемато-невральный барьер металлопротеиназ, разрушающих миелиновую оболочку нервных волокон.
Симптомы
Через несколько месяцев присоединяется мышечная слабость с постепенной атрофией, из-за чего нарушается походка. Затем аналогичные симптомы развиваются и на верхних конечностях. Дерматологические признаки POEMS-синдрома включают гиперпигментацию, напоминающую болезнь Аддисона, огрубение и потемнение волос, выраженную бледность ногтевых пластин, утолщение и уплотнение кожных покровов.
Изменения в эндокринной системе разнообразны, чаще всего проявляются гипогонадизмом. У мужчин выявляется эректильная дисфункция, снижение или отсутствие либидо, гинекомастия, у женщин отмечаются нарушения менструального цикла по типу олиго- или аменореи. Могут диагностироваться сахарный диабет, гипотиреоз, надпочечниковая недостаточность.
Примерно у половины больных наблюдаются ноющие или тупые боли, тяжесть в правом и левом подреберьях, обусловленные гепатоспленомегалией. Вследствие повышенной сосудистой проницаемости и протеинурии нередко встречается отечный синдром – асцит, гидроторакс, гидроперикард. За счет мышечной атрофии и истончения подкожной жировой клетчатки пациенты значительно теряют в весе.
Осложнения
POEMS-синдром характеризуется широким спектром неблагоприятных последствий. Наиболее частое осложнение – вялый тетрапарез за счет полинейропатии, вызывающий ограничение активных движений больного. Распространение патологического процесса на нервные волокна, иннервирующие дыхательную мускулатуру, может привести к остановке дыхания. Нередко поражается легочная ткань с развитием пневмофиброза и легочной гипертензии.
У 20% пациентов диагностируются артериальные тромбозы различной локализации. Поскольку для парапротеинемий характерны признаки остеолиза, у больных с POEMS-синдромом существует риск патологических переломов. За счет гипогонадизма возникает первичное бесплодие. При длительном течении заболевания развивается хроническая почечная недостаточность.
Диагностика
Существуют диагностические критерии POEMS-синдрома. Для постановки диагноза у больного должно быть как минимум три больших критерия и один малый.
К большим критериям относятся:
- Полинейропатия
- Моноклональная плазмоклеточная пролиферация
- Склеротические изменения костей
- Повышение VEGF
- Болезнь Кастлемана
Малыми критериями являются:
- Органомегалия
- Эндокринопатия
- Отечный синдром
- Кожные изменения
- Отек диска зрительного нерва
Больных курируют врачи-неврологи и гематологи. При осмотре обращают внимание на атрофию мышц верхних и нижних конечностей, цвет кожных покровов, лимфаденопатию (иногда генерализованную). Определяют признаки отечного синдрома – периферические отеки, положительный симптом флуктуации, притупление перкуторного звука и ослабление дыхательных шумов на нижней границе легких. Дополнительное лабораторно-инструментальное обследование направлено на диагностику компонентов синдрома:
- Лабораторные исследования. В общем анализе крови отмечается увеличение СОЭ, тромбоцитоз, иногда эритроцитоз и лейкоцитоз, в биохимическом анализе крови – гипоальбуминемия, гипергаммаглобулинемия. В анализе мочи выявляют протеинурию.
- Гормональные исследования. Часто удается обнаружить снижение концентрации половых гормонов – андрогенов, эстрогенов, ФСГ, ЛГ, реже – тироксина и ТТГ. При подозрении на надпочечниковую недостаточность проводится проба с АКТГ.
- Иммунохимические исследования. При электрофорезе сыворотки крови с иммунофиксацией высокий М-градиент и секреция парапротеина встречается только на поздних стадиях заболевания. В моче обнаруживается белок Бенс-Джонса. При иммуногистохимическом анализе выявляется экспрессия аномальных белков и опухолевых CD-маркеров.
- Инструментальные исследования. На УЗИ органов брюшной полости определяется увеличение печени и селезенки, выпот в брюшную полость, на эхокардиографии – выпот в перикардиальную полость. На рентгенографии органов грудной клетки – плевральный выпот, на рентгенографии черепа – остеолитические очаги. Электромиография показывает признаки демиелинизации и аксональной дегенерации (замедление, блок проведения нервного импульса).
- Гистологические исследования. Гистологическая картина пунктата костного мозга обычно включает неспецифические реактивные изменения – лимфоидную гиперплазию, скопления плазматических клеток, редко – лимфоплазмофитарную инфильтрацию. При биопсии нервов обнаруживается лимфоцитарная инфильтрация, отек периневрия.
Дифференциальную диагностику проводят с хроническими воспалительными демиелинизирующими полинейропатиями (синдром Гийена-Барре). Также следует отличать POEMS-синдром от множественной миеломы, амилоидоза, ангиофолликулярной гиперплазии лимфатических узлов, аутоиммунных полигландулярных синдромов.
Лечение POEMS-синдрома
Консервативная терапия
Все пациенты подлежат обязательной госпитализации в гематологическое отделение. Специфическое лечение не разработано. Терапия проводится по общим схемам в зависимости от наличия тех или иных компонентов заболевания. Существуют следующие консервативные методы лечения POEMS-синдрома:
- Химиотерапия. При поражении костного мозга применяются различные схемы высокодозной химиотерапии. Назначаются алкилирующие препараты (хлорамбуцил, циклофосфамид), цитостатики (мелфалан), противоопухолевые антибиотики (доксорубицин).
- Противовоспалительная терапия. Глюкокортикостероиды (преднизолон, дексаметазон) используют в составе комплексной химиотерапии, для патогенетической борьбы с полинейропатией (подавление воспаления) и уменьшения выраженности протеинурии.
- Иммуномодулирующая терапия. Такие лекарственные средства, как талидомид, левалиномид и моноклональные антитела эффективно снижают уровень VEGF и, как следствие, уменьшают активность патологического процесса.
- Заместительная гормональная терапия. При выявлении дефицита того или иного гормона назначается пожизненный прием гормональных лекарственных препаратов – L-тироксина, гидрокортизона, флудрокортизона, оральных контрацептивов и т. д.
- Устранение отечного синдрома. Для выведения избытка внесосудистой жидкости применяют петлевые (фуросемид, торасемид) и тиазидные (гидрохлортиазид) диуретики.
- Лучевая терапия. У больных, имеющих единичные остеосклеротические очаги, успешно используется локальная лучевая терапия.
Хирургическое лечение
Высокодозную химиотерапию нередко дополняют аутологичной трансплантацией костного мозга, то есть, пересадкой больному его собственных стволовых клеток. Данный способ позволяет избежать большого числа осложнений химиотерапии (тяжелой анемии, массивных кровотечений, присоединения тяжелых бактериальных, грибковых или вирусных инфекций) за счет более быстрого восстановления кроветворной функции костного мозга.
Экспериментальное лечение
До сих пор ведутся работы по поиску эффективного лекарственного препарата для лечения данного синдрома. Некоторые авторы сообщают, что у части больных на фоне применения тамоксифена и интерферона наблюдалась клинико-гематологическая регрессия заболевания – уменьшение выраженности полинейропатии и органомегалии, нормализация уровня провоспалительных цитокинов.
Прогноз и профилактика
POEMS-синдром является тяжелой патологией с хроническим течением и высоким процентом летальности. Средняя продолжительность жизни больных после постановки диагноза составляет 10-15 лет. Основными причинами смерти являются дыхательная недостаточность вследствие паралича дыхательной мускулатуры или пневмофиброза, инфекционные осложнения.
Эффективные методы первичной профилактики не разработаны. Существуют лишь рекомендации по снижению вероятности осложнений лечения опухолей, например, регулярный контроль клинического анализа крови во время курса химиотерапии. Следует максимально избегать применения лекарственных препаратов, в побочных эффектах которых имеется нейротоксичность (бортезомиб).
1. Японская системная болезнь (POEMS-синдром)/ Гордеев А.В., Мутовина З.Ю., Рыжко В.В. и др.// Терапевтический архив – 2006 - №12.
2. POEMS-синдром (описание наблюдения и обзор литературы)/ Клодзинский А.А., Рыжко В.В., Соркина О.М., Капланская И.Б., Семенова Е.А., Варламова Е.Ю., Алексанян М.Ж., Сатаева М.С.// Клиническая онкогематология — 2008 — Т.1, №2.
3. M protein, and skin changes: the POEMS syndrome. Report on two cases and a review of the literature/ Bardwick P.A., Zvaifler N.J., Gill G.N. Plasma cell dyscrasia with polyneuropathy, organomegaly, endocrinopathy// Medicine (Baltimore) — 1980 — №4.
4. POEMS syndrome: definitions and long-term outcome/ Dispenzieri A., Kyle R.A., Lacy M.Q. еt al// Blood — 2003 — V.101.
Болезнь Кастлемана – это лимфопролиферативное заболевание, которое поражает одну или несколько групп лимфатических узлов. Патология имеет невыясненную этиологию, среди факторов риска выделяют ВИЧ-инфекцию, аутоиммунные процессы, инфицирование герпесвирусами. Заболевание проявляется увеличением одного или нескольких лимфатических узлов, интоксикационным синдромом, диспепсическими и дизурическими явлениями. Для диагностики болезни Кастлемана проводится инструментальная визуализация (УЗИ, КТ, МРТ), биопсия лимфатических узлов. Лечение включает хирургическое удаление очагов гиперплазии, полихимиотерапию и иммунотерапию.
МКБ-10



Общие сведения
Необычные клинические проявления были впервые описаны американским патологом В. Кастлеманом в 1954 году. Спустя 2 года на основе полученных данных выделена нозологическая единица, которая получила название болезнь Кастлемана (БК), или ангиофолликулярная лимфоидная гиперплазия. В 1972 году установлены морфологические особенности заболевания и произведено его разделение на гистологические типы. Предполагаемая частота встречаемости – 1 случай на 100 тыс. населения, всего в литературе описано около 400 больных. У 70% пациентов симптоматика развивается в возрасте до 35 лет.

Причины
При изучении медицинских историй пациентов с БК установлен ряд ассоциированных патологий, которые повышают вероятность лимфопролиферативного синдрома. Болезнь Кастлемана сочетается с аутоиммунными процессами, множественной миеломой, POEMS-синдромом (11-24% случаев) и заболеваниями кожных покровов (13%). Независимым фактором риска называют ВИЧ-инфекцию, особенно ее терминальную стадию при уменьшении уровня CD4-лимфоцитов менее 200 клеток/мкл.
Патогенез
Ключевым звеном формирования болезни Кастлемана называют гиперпродукцию интерлейкина-6 (IL-6). Вещество участвует в иммунном ответе, процессах кроветворения и развитии острофазовой воспалительной реакции. Интерлейкин вырабатывается разными типами клеток в гиперплазированных лимфатических узлах. С его эффектами на лимфоциты и кровеносные сосуды связывают общие симптомы интоксикации, которые возникают при мультицентрической форме БК.
Такими же механизмами объясняется вирусная этиология заболевания. HHV-8 выделяет вирусный интерлейкин-6, который может напрямую связываться с клеточными рецепторами и вызывать ряд неопластических изменений. Вирус стимулирует выработку сосудистого эндотелиального фактора роста, который отвечает за увеличение проницаемости капилляров и повышенный неоангиогенез.
Классификация
По расположению очагов лимфатической гиперплазии разделяют локализованную и мультицентрическую формы. В зависимости от морфологии ранее выделяли два варианта болезни Кастлемана: гиалино-васкулярный (ГВВ) и плазмоклеточный (ПКВ). После уточнения причинных факторов заболевания была принята новая гистопатогенетическая классификация, согласно который признано существование 4-х варианта БК:

Симптомы болезни Кастлемана
Чаще всего заболевание поражает лимфатические узлы средостения. К типичным локализациям гиперплазии также относят шейные, подмышечные и забрюшинные лимфоузлы. Лимфатический узел имеет диаметр 1-25 см, чаще всего диагностируются опухоли размером 6-7 см. Кожа над ним не изменена, субъективные неприятные ощущения отсутствуют, поэтому пациенты редко обращаются к врачу на раннем этапе.
Мультицентрический и плазмоклеточный варианты патологии зачастую вызывают системные нарушения здоровья. У больных возникает субфебрильная лихорадка, повышенная потливость, мышечная слабость. Аппетит снижается, поэтому пациенты постепенно худеют. Гепатомегалия возникает у 63% людей с болезнью Кастлемана, в 33-79% случаев она сочетается с увеличением селезенки.
На поздних стадиях заболевания клинические проявления зависят от локализации гиперплазированной лимфатической ткани. Поражение узлов средостения сопровождается охриплостью голоса, затруднением дыхания и глотания, болями в грудной клетке. Разрастание внутрибрюшных лимфоузлов вызывает боли в животе, диспепсические расстройства, нарушения мочеиспускания.
Осложнения
Наиболее опасной признана мультицентрическая форма, которая зачастую сопровождается полиорганной недостаточностью – основной причиной гибели пациентов с синдромом Кастлемана. Ситуация ухудшается при сочетании болезни с саркомой Капоши и ВИЧ-инфекцией, на фоне которых присоединяются оппортунистические инфекции. Общая 5-летняя выживаемость находится на уровне 55%.
При локальных формах основной проблемой остается нарушение функции соседних органов. Поражение внутрибрюшных узлов чревато развитием механической кишечной непроходимости, нарушением поступления желчи в 12-перстную кишку. При поражении средостения возможна дыхательная недостаточность. При этом показатели выживаемости намного лучше: 94,5% пациентов живут дольше 5 лет после постановки диагноза.
Диагностика
При болезни Кастлемана требуется консультация врача-онкогематолога. Сначала проводится сбор жалоб и анамнеза, далее выполняется физикальный осмотр, Визуально и пальпаторно определяется лимфаденопатия, причем узлы могут быть разной плотности – от мягкой до каменисто твердой. В программу расширенной лабораторно-инструментальной диагностики входят следующие методы:
- УЗИ лимфатических узлов. Ультразвуковая диагностика назначается на первом этапе обследования, чтобы дифференцировать воспалительные и опухолевые процессы. С помощью сонографии удается изучить размеры, контуры и внутреннюю структуру лимфоузла.
- КТ и МРТ. Инструментальная визуализация используется для выявления лимфоидной гиперплазии, определения размеров и локализации пораженных лимфоузлов. На снимках опухолевая масса выглядит как гомогенное новообразование с четкими контурами и интенсивным накоплением контрастного вещества.
- Биопсия лимфоузлов. Для изучения гистологической структуры опухоли и верификации диагноза назначается эксцизионная биопсия, поскольку тонкоигольная пункционная биопсия недостаточно информативна. Уточнить диагноз позволяет иммуногистохимическое исследование образца ткани.
- Анализы крови. В гемограмме обнаруживают лейкоцитоз, тромбоцитоз, анемию и повышение СОЭ. Характерно возрастание уровня С-реактивного белка и других острофазовых показателей. В иммунограмме выявляют повышение интерлейкина-6, при мультицентрическом варианте определяют высокий уровень иммуноглобулином А, М G.
Дифференциальная диагностика
Для постановки диагноза болезни Кастлемана выполняется сложная дифференциальная диагностика между разными лимфопролиферативными патологиями. Необходимо исключить:
- ходжкинские и неходжкинские лимфомы;
- саркоидоз;
- гранулематоз Вегенера;
- гистиоцитоз Х.
При выраженном интоксикационном синдроме исключают реактивные иммунолимфопролиферативные процессы при вирусных, бактериальных и паразитарных инвазиях.

Лечение болезни Кастлемана
Консервативная терапия
Медикаментозное лечение – метод выбора при мультицентрических формах патологии Ситуация осложняется отсутствием единых клинических рекомендаций, поэтому методы терапии подбираются онкогематологами в индивидуальном порядке с учетом клинических особенностей каждого случая. На современном этапе развития медицины назначают такие группы препаратов:
- Цитостатики. Чтобы остановить клеточную пролиферацию, при используются препараты алкилирующего действия, противоопухолевые антибиотики антрациклинового ряда, полусинтетические производные подофиллотоксина.
- Моноклональные антитела. Наиболее изучена активность анти-CD20-антител (ритусуксимаб), которые обеспечивают стойкую ремиссию у 71% пациентов с тяжелыми формами синдрома Кастлемана. К новым направлениям терапии относят прием анти-IL-6-антител.
- Ингибиторы протеосом. Медикаменты снижают уровень интерлейкина 6 в плазме крови, тем самым уменьшая выраженность клинических симптомов и усиливая ответ на комбинированную терапию.
- Противовирусные лекарства. При доказанной корреляции болезни Кастлемана с инфицированием герпесвирусами назначаются этиотропные препараты. ВИЧ-положительным пациентам обязательно проводится антиретровирусная терапия по одной из стандартных схем.
Хирургическое лечение
При локализованных формах заболевания рекомендовано радикальное оперативное вмешательство – удаление пораженного лимфоузла с последующей гистоморфологической диагностикой. Наилучших результатов достигают при гиалино-васкулярном типе опухоли, которая не дает рецидивов. При мультицентрическом процессе хирургическое лечение назначается для удаления особо крупных очагов, которые вызывают компрессию соседних органов.
Прогноз и профилактика
У большинства пациентов с локализованными формами болезни Кастлемана удается достичь полного излечения. При мультицентрических вариантах прогноз менее благоприятный, особенно в группе больных со сниженным иммунным статусом. После лечения пациенты находятся под диспансерным наблюдением врача в течение 3 лет. Поскольку этиологические факторы заболевания точно не установлены, специфических профилактических мероприятий не разработано.
3. Болезнь Кастлемана (обзор литературы)/ А.Л. Меликян, Е.К. Егорова// Онкогематология. – 2016. – №2.
4. Клинико-морфологические особенности различных вариантов болезни Кастлемана/ А.Л. Меликян, Е.К. Егорова, А.М. Ковригина, И.Н. Суборцева// Терапевтический архив. – 2015. – №7.
POEMS (polyneuropathy, organomegaly, endocrinopathy, monoclonal gammopathy, and skin changes) – развитие синдрома при мультицентрическом варианте течения БК, характеризующегося полинейропатией, органомегалией, эндокринопатией, повышением моноклональной гамма фракции, кожными изменениями.
Блок COP – химиотерапия в состав которой входит циклофосфамид, винкристин, преднизолон.
Блок R-CHOP – химотерапия в состав которой входит моноклональное антитело к CD20 (ритуксимаб), циклофосфамид, доксорубицин, винкристин, преднизолон.
1. Краткая информация
1.1 Определение
Болезнь Кастлемана (БК, ангиофолликулярная узловая гиперплазия, ангиофолликулярная лимфоидная гиперплазия) - поликлональное лимфопролиферативное заболевание, которое может поражать отдельные лимфоузлы или располагаться мультицентрично и сопровождаться системными проявлениями воспаления [1,2].
1.2 Этиология и патогенез
Патогенез заболевания на сегодняшний день остается нерасшифрованным. Важную роль в развитии болезни играет избыточная продукция интерлейкина 6 (ИЛ6), который в опытах индуцировал у мышей развитие подобной лимфаденопатии. У пациентов с ВИЧ-инфекцией было показано, что вирус герпеса 8 типа (HHV8) экспрессирует вирусный белок, гомологичный ИЛ6, и вызывающий аналогичные человеческому ИЛ6 эффекты. Он индуцирует ангиогенез и гемопоэз с последующеими системными проявлениями и приводит к развитию мультицентрической болезни Кастлемана. Роль HHV8 у людей без иммунодефицита остается спорной. Повышенная продукция ИЛ6 приводит и к легочной артериальной гипертензии, которая встречается у пациентов с БК 1.
1.3 Эпидемиология
Распространенность заболевания не установлена; предположительно, частота заболевания 1 на 100 000 жителей. Локализованная форма встречается наиболее часто, в литературе содержится описание около 400 больных. Тип наследования не определен, убедительных данных за наследственный характер заболевания нет. БК встречается в любой возрастной группе, 70% больных моложе 35 лет, средний возраст 40 лет, одинаково часто отмечается у лиц обоего пола 3.
1.4 Кодирование по МКБ-10
Другие иммунодефициты (D84):
D84.8 – Первичный иммунодефицит уточненный.
Другие новообразования неопределенного или неизвестного характера лимфоидной, кроветворной и родственных им тканей (D47):
D47.7 – Другие уточненные новообразования неопределенного или неизвестного характера лимфоидной, кроветворной и родственной им тканей.
1.5 Классификация
По клинической картине:
По гистологической картине:
2. Диагностика
2.1 Жалобы и анамнез
Основным проявлением БК является гипертрофия лимфатических узлов различных локализация, на которую могут жаловаться пациенты или их родители. Часто увеличение лимфоузлов присутствует как единственная жалоба. Тем не менее, нередко имеются системные признаки заболевания, в виде астения, снижение массы веса тела, периодической лихорадки. Больных периодически беспокоят боли в грудной клетке или в органах брюшной полости. Могут быть нарушения чувствительности за счет нейропатии. Нередко заболевания протекает с обострениями и эпизодами относительного благополучия.
2.2 Физикальное обследование
При осмотре некоторые больные имеют признаки гипотрофии за счет резкой потери веса. Визуально и пальпаторно отмечается увеличение лимфоузлов различных групп, которые бывают любой консистенции — от очень мягкой до каменной твердости. Всегда обнаруживается массивная спленомегалия. В большинстве случаев также обнаруживаются гепатомегалия (70%), кашель и крепитирующие хрипы в легких (65%) и отеки за счет гипоальбуминемии (55%) [4,6-10].
2.3 Лабораторная диагностика
- Рекомендуется клинический анализ крови и СОЭ 10.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: В клиническом анализе крови нередко выявляется лейкоцитоз, анемия, тромбоцитоз, повышение СОЭ, значительно чаще при мультицентрическом варранте течения заболевания
- Рекомендуется определение в сыворотки крови уровня ИЛ6 10.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Уровень ИЛ6 повышается иногда при мультицентрическом варианте течения БК.
- Рекомендуется определение методом ПЦР HHV 7 и 8 типа 10.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: HHV 7 и 8 типа может служить причиной/триггером для развития БК.
- Рекомендуется определение в биохимическом анализе крови общего белка, альбумина, креатинина, мочевины, общего билирубина, прямого блирубина, АЛАТ, АСАТ, глюкоза, ЛДГ, щелочная фосфотаза, ГГТ 6.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
- Рекомендуется определение С-реактивного белка 7.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Уровень С-реактивного белка часто указывает на активность течения патологического процесса; чаще повышен при мультицентричеком варианте.
- Рекомендуется определение иммуноглобулинов A, M, G 8.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: повышение уровня иммуноглобулинов в крови чаще наблюдается при мультицентрическом варианте БК.
- Рекомендуется общий анализ мочи (микроскопическое исследование осадка мочи, белок, глюкоза, определение удельного веса (относительной плотности) мочи) 7.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
- Рекомендуется определение уровня гормонов в сыворотке крови (Т3,Т4, ТТГ, кортизол) 6.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Эндокринопатия входит в состав синдрома POEMS и развивается как осложнение при мультицентрическом варианте течения.
- Рекомендуется определение основных групп крови по системе АВ0, резус фактора 8.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
- Рекомендуется определение антигена НBsAg Hepatitis B virus, антител класса M, G (IgM, IgG) к Hepatitis C virus, антител класса M, G (IgM, IgG) к Human immunodeficiency virus HIV 1 6.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: БК чаще развивается у ВИЧ компроментированных пациентов.
- Рекомендуется определение антител класса M, G (IgM, IgG) к ННV8, HHV7, антител класса M, G (IgM, IgG) к Human immunodeficiency virus HIV 2 7.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
2.4 Инструментальная диагностика
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Рекомендуется измерение артериального давления на периферических артериях 8
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Рекомендуется бронхоскопия, торакоскопия, диагностическая лапароскопия 7.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
- Рекомендуется ультразвуковое исследование органов брюшной полости, почек, лимфоузлов 9.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Рекомендуется ультразвуковое исследование мягких тканей, матки и придатков, молочных желез, щитовидной железы 10.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2)
- Рекомендуется магнитно-резонансная томография костной ткани 6.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2)
- Рекомендуется регистрация электрокардиограммы, эхокардиография 7.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Рекомендуется магнитно-резонансная томография центральной нервной системы и головного мозга, органов малого таза 9.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Рекомендуется рентгенография пораженной части костного скелета 10.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2)
- Рекомендуется компьютерная томография шеи, органов грудной полости, органов малого таза, забрюшинного пространства 7.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Рекомендуется позитронно-эмиссионная томография 7.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
2.5 Иная диагностика
- Рекомендуется гистологическое исследование препарата костного мозга 8.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Коментарии: Исследование препаратов костного мозга проводится с целью дифференциальной диагностики.
- Рекомендуется гистологическое, иммуногистохимического исследование препарата лимфоузла, печени, легкого 8.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Биопсия лимфоузлов является основным методом постановки диагноза, а также отнесения заболевания к тому или иному гистологическому типу.
3. Лечение
3.1 Консервативное лечение
Консервативная терапия рекомендуется в качестве метода выбора при лечении пациентов с мультицентрическим вариантом течения болезни Кастлемана 5.
- Для терапии БК рекомендуется циклофосфамид . Доза 300-500мг/м2, внутривенно капельно. Режим введения индивидуальный.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарий: Противоопухолевое средство алкилирующего действия, оказывает также иммунодепрессивное действие. Является неактивной транспортной формой, распадающейся под действием фосфатаз с образованием активного компонента непосредственно в клетках опухоли, "атакует" нуклеофильные центры белковых молекул, нарушает синтез ДНК и РНК, блокирует митотическое деление.
- Для терапии БК рекомендуется винкристин. Доза 1,5мг. Режим введения индивидуальный.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: Противоопухолевое средство растительного происхождения, алкалоид из барвинка розового (Vinca rosea L.), блокирует метафазу митоза (связываясь с белком тубулином, приводит к разрыву митотического веретена).
- Для терапии БК рекомендуется доксорубицин. Доза 50мг. Режим введения индивидуальный.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: Противоопухолевый антибиотик антрациклинового ряда. Оказывает антимитотическое и антипролиферативное действие. Механизм действия заключается во взаимодействии с ДНК, образовании свободных радикалов и прямом воздействии на мембраны клеток с подавлением синтеза нуклеиновых кислот. Клетки чувствительны к Доксорубицину в S- и G2-фазах.
- Для терапии БК рекомендуется этопозид. Доза 100мг. Режим введения индивидуальный.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: Полусинтетическое производное подофиллотоксина, используемое в качестве противоопухолевого средства. Этопозид оказывает цитотоксическое действие за счет повреждения ДНК. Препарат блокирует митоз, вызывая гибель клеток в G2 фазе и поздней S-фазе митотического цикла. Высокие концентрации препарата вызывают лизис клеток в премитотической фазе.
- Для терапии БК рекомендуется винбластин. Доза 6мг. Режим введения индивидуальный.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: Противоопухолевое средство растительного происхождения, влияющее на метаболизм аминокислот. Механизм действия связан с денатурацией тубулина, что приводит к блокаде митоза. Подавляет деление клеток на стадии метафазы, приводит к атипичным митотическим процессам.
- Для терапии БК рекомендуется тоцилизумаб. Доза максимально 600мг. Режим введения каждые 2 недели или режим индивидуальный.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: Рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 (ИЛ-6) из подкласса иммуноглобулинов IgG1. Тоцилизумаб селективно связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6 (sIL-6R и mIL-6R). ИЛ-6 является многофункциональным цитокином, вырабатываемым различными типами клеток, участвующих в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции Ig, активация Т-клеток, стимуляция выработки белков острой фазы в печени и стимуляция гемопоэза.
- Для терапии БК рекомендуется бортезомиб в дозе 1,4мг/м2, режим введения индивидуальный.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: Обратимый высокоселективный ингибитор активности протеасомы 26S, присутствующей в ядре и цитозоле всех эукариотических клеток и катализирующей расщепление основных белков, участвующих в жизненном цикле клеток. Бортезомиб ингибирует химотрипси-ноподобное действие протеасомы, вызывает торможение протеолиза и приводит к апоптозу. Миеломные клетки (in vitro) в 1000 раз более восприимчивы к апоптозу, вызванному бортезомибом, чем нормальные клетки плазмы. Механизм разрушения клеток миеломы заключается в блокаде активации NF-kB, который в нормальных клетках NF-kB (существует как димер р50-р65) связан с ингибирующим белком LkB, удерживющим его в неактивной форме в цитозоли. Некоторые опухоли содержат активированные формы NF-kB. Протеасома катализирует протеолитическую генерацию подгруппы NF-kB р50 из неактивного предшественника р150 и разрушение ингибирующего белка LkB. Активированный NF-kB, проникая в ядро, влияет на выживаемость и пролиферацию клетки.
- Для терапии БК рекомендуется руксолитиниб. Доза 50 мг. Режим введения индивидуальный.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарий: Противоопухолевый препарат, является ингибитором протеинкиназы.
- В качестве средства сопутствующей терапии опухолей рекомендуется ондансетрон - противорвотное средство центрального действия, избирательный антагонист серотониновых рецепторов НТ3Используется главным образом для подавления тошноты и рвоты, возникающих вследствие химиотерапии. Он действует как на периферическую, так и на центральную нервную систему, снижая активность блуждающего нерва, что подавляет рвотный рефлекс, а также блокирует рецепторы триггерной зоны головного мозга, которая запускает этот рефлекс. Режим введения индивидуальный.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
- В качестве средств сопутствующей терапии опухолей рекомендуются гормоны и средства, влияющие на эндокринную систему.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: преднизолон подавляет функции лейкоцитов и тканевых макрофагов. Ограничивает миграцию лейкоцитов в область воспаления. Нарушает способность макрофагов к фагоцитозу, а также к образованию интерлейкина-1. Способствует стабилизации лизосомальных мембран, снижая тем самым концентрацию протеолитических ферментов в области воспаления. Уменьшает проницаемость капилляров, обусловленную высвобождением гистамина. Подавляет активность фибробластов и образование коллагена.
Ингибирует активность фосфолипазы А2, что приводит к подавлению синтеза простагландинов и лейкотриенов. Подавляет высвобождение ЦОГ (главным образом ЦОГ-2), что также способствует уменьшению выработки простагландинов.
Уменьшает число циркулирующих лимфоцитов (T- и B-клеток), моноцитов, эозинофилов и базофилов вследствие их перемещения из сосудистого русла в лимфоидную ткань; подавляет образование антител.
Преднизолон подавляет высвобождение гипофизом АКТГ и ?-липотропина, но не снижает уровень циркулирующего ?-эндорфина. Угнетает секрецию ТТГ и ФСГ. При непосредственной аппликации на сосуды оказывает вазоконстрикторный эффект. Преднизолон обладает выраженным дозозависимым действием на метаболизм углеводов, белков и жиров. Стимулирует глюконеогенез, способствует захвату аминокислот печенью и почками и повышает активность ферментов глюконеогенеза. В печени преднизолон усиливает депонирование гликогена, стимулируя активность гликогенсинтетазы и синтез глюкозы из продуктов белкового обмена. Повышение содержания глюкозы в крови активизирует выделение инсулина. Преднизолон подавляет захват глюкозы жировыми клетками, что приводит к активации липолиза. Однако вследствие увеличения секреции инсулина происходит стимуляция липогенеза, что способствует накоплению жира.
- В качестве средства сопутствующей терапии опухолей рекомендуется фуросемид.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: "петлевой" диуретик; вызывает быстро наступающий, сильный и кратковременный диурез. Обладает натрийуретическим и хлоруретическим эффектами, увеличивает выведение K+, Ca2+, Mg2+. Проникая в просвет почечного канальца в толстом сегменте восходящего колена петли Генле, блокирует реабсорбцию Na+ и Cl-. Вследствие увеличения выделения Na+ происходит вторичное (опосредованное осмотически связанной водой) усиленное выведение воды и увеличение секреции K+ в дистальной части почечного канальца. Одновременно увеличивается выведение Ca2+ и Mg2+.
- В качестве средств сопутствующей терапии опухолей рекомендуются:
Растворы, электролиты, средства коррекции кислотного равновесия, средства питания:
Читайте также:

