Синдромы при оки обезвоживание интоксикация
Обновлено: 19.04.2024
Авторы: Плоскирева А.А. 1, 2 , Горелов А.В. 2, 3
1 ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия
2 ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва, Россия
3 ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва
Острые кишечные инфекции (ОКИ) сохраняют свою значимость для клинической практики. Ведущими патогенетическими синдромами при ОКИ являются обезвоживание, дестабилизация системы микробиоценоза и снижение протективных свойств муцинового слоя слизистой оболочки кишки. В статье представлены основные подходы к оценке степени выраженности дегидратации и ее коррекции, показаны место пробиотиков в терапевтической тактике и критерии выбора штаммов. Наиболее оправданным в терапии синдрома дегидратации у детей является использование растворов со сниженной осмолярностью. Пробиотическая терапия должна начинаться в как можно более ранние сроки от начала заболевания и включать в себя рекомендованные международным сообществом штаммы пробиотиков. Цитомукопротективная терапия с использованием препарата желатина таннат (Адиарин ® ) показала свои эффективность и безопасность и может быть рекомендована в составе комплексной патогенетической терапии ОКИ у детей.
Ключевые слова: острые кишечные инфекции, диарея, дегидратация, пробиотик, цитомукопротективная терапия, желатина таннат, Адиарин ® .
A.A. Ploskireva 1 , A.V. Gorelov 1,2
1 Central Research Institute of Epidemiology, Moscow
2 Sechenov University, Moscow
Статья посвящена особенностям патогенетической терапии острых кишечных инфекций у детей. Наиболее оправданным в терапии синдрома дегидратации у детей является использование растворов со сниженной осмолярностью. Пробиотическая терапия должна начинаться в как можно более ранние сроки от начала заболевания и включать в себя рекомендованные международным сообществом штаммы пробиотиков.
Введение
Острые кишечные инфекции (ОКИ) — группа острых инфекционных заболеваний человека, характеризующихся поражением желудочно-кишечного тракта (ЖКТ), с развитием диареи как ведущего клинического симптома, эксикоза, интоксикации, абдоминального синдрома; с фекально-оральным механизмом заражения. Этиологическими факторами ОКИ являются патогенные бактерии (шигеллы, сальмонеллы и др.), вирусы (ротавирус, норовирус, аденовирус и др.), простейшие (амебы, криптоспоридии и др.) и грибковые инфекции (грибы рода Candida).
Ведущими патогенетическими звеньями при ОКИ
являются:
Обезвоживание (синдром дегидратации) — синдром, развивающийся на фоне рвоты и диареи и обусловленный потерей организмом жидкости и электролитов Na + , K + , Cl – .
Синдром дестабилизации системы микробиоценоза различных биотопов организма человека (дисбиоз) — клинико-лабораторный синдром нарушений функционирования и механизмов взаимодействия в иерархической экосистеме микрофлоры различных биотопов организма человека, проявляющийся развитием клинических симптомов и изменением количественных (смена доминирующего вида) и качественных (изменение состава, свойств) характеристик микрофлоры.
Снижение протективных свойств муцинового слоя слизистой оболочки кишки.
В этой связи патогенетическая терапия должна быть направлена на коррекцию данных изменений.
Терапия ОКИ
Синдром дегидратации
Синдром обезвоживания является ведущим патогенетическим синдромом при ОКИ у детей, играющим определяющую роль в тяжести заболевания и угрожающим развитием неблагоприятного исхода. Поэтому особую значимость для практического здравоохранения приобретают оперативность и правильность оценки степени дегидратации у ребенка, больного ОКИ [1].
Развитие синдрома дегидратации требует от врача принятия незамедлительных мер по возмещению потерь жидкости, солей и увеличению буферной емкости крови. Наиболее физиологичной и менее травматичной для ребенка терапевтической тактикой в педиатрической практике является проведение оральной регидратации [2], которую необходимо организовать в как можно более ранние сроки от момента заболевания ребенка и проводить двухэтапно:
1-й этап — восполнение водно-электролитных потерь, произошедших до момента обращения за медицинской помощью (назначение суммарного количества жидкости 50–80 мл/кг в течение 6 ч);
2-й этап — текущая регидратация, задачей которой является восполнение потерь жидкости и электролитов в ходе течения инфекционного процесса (назначение 80–100 мл/кг жидкости); длительность 2-го этапа — до момента выздоровления или появления показаний для парентеральной коррекции обезвоживания [3].
В настоящее время рекомендованными для оральной регидратации при ОКИ у детей являются растворы со сниженной осмолярностью (245 мОсм/л; 75 мэкв/л натрия и 75 мэкв/л глюкозы). Принципиальным отличием гипоосмолярных формул для оральной регидратации является то, что у предыдущих растворов осмолярность была выше по сравнению с плазмой крови, что не способствовало уменьшению объема каловых масс при диарее и могло приводить к развитию гипернатриемии. В 2001 г. Seokyung Hahn провел метаанализ 15 рандомизированных клинических исследований (РКИ), выполненных в различных странах мира, который показал, что применение растворов для оральной регидратации со сниженной осмолярностью оптимизирует всасывание воды и электролитов в кишечнике в большей степени, чем использование гиперосмолярных растворов, и является безопасным [4].
Применение гипоосмолярных формул входит в рекомендации международного уровня и основывается на многочисленных исследованиях, подтверждающих их безопасность и эффективность, в т. ч. у детей раннего возраста [5–8].
Проведение оральной регидратации наиболее целесообразно с использованием готовых форм растворов, что позволяет избежать ошибок в процессе приготовления растворов и обеспечить quantum satis в зависимости от конкретной клинической ситуации.
Синдром дестабилизации системы микробиоценоза
Применение пробиотических лекарственных средств при ОКИ не вызывает сомнения ввиду необходимости коррекции нарушений микробиоценоза ЖКТ, которые развиваются у большинства пациентов. Применение пробиотиков при ОКИ у детей не только является патогенетически обоснованным, но и относится к самому высокому уровню доказательности — А в соответствии с принципами доказательной медицины [8]. Проведенный в 2010 г. метаанализ, включающий в себя результаты 63 РКИ, показал, что использование пробиотиков достоверно сокращает сроки купирования диареи (в среднем на 24,76 ч) и частоту стула, при этом данные препараты характеризуются высоким профилем безопасности [10].
Помимо положительного влияния на систему микробиоценоза ЖКТ еще одним важным патогенетическим эффектом, позволяющим рекомендовать пробиотики при ОКИ, является их положительное влияние на муциновый слой слизистой оболочки ЖКТ. На фоне течения инфекционного процесса наблюдается изменение физических характеристик данного барьера — снижение вязкости за счет разрушения дисульфидных связей между цистеиновыми мостиками суперструктуры данного геля, что может приводить к транслокации микроорганизмов из просвета кишечника в ткани. Данные процессы развиваются под действием патогенных микроорганизмов, выделяющих ферменты, разрушающие слизь (нейраминидаза, гиалуронидаза, муциназа). Длительное, в т. ч. в постинфекционном периоде, изменение физических свойств муцинового слоя повышает риск развития воспалительных заболеваний кишечника [11]. Микроорганизмы, относящиеся к компонентам нормальной микрофлоры ЖКТ человека, а также продукты их обмена оказывают потенцирующее действие на состояние муцинового слоя посредством целого ряда механизмов, в т. ч. генетических [12, 13].
Современный подход к терапии пробиотиками подразумевает штамм-специфичный подход. Эффекты каждого конкретного штамма, применяемого при ОКИ, должны быть подтверждены в клинических исследованиях [14, 15]. Ошибочным является обобщение эффектов отдельных штаммов и приписывание их генетически обусловленных свойств всему роду, виду или в целом всем пробиотик-содержащим лекарственным средствам, биологически активным добавкам к пище или продукции пищевой промышленности.
Рабочей группой ESPGHAN в 2014 г. на основе анализа систематических обзоров и результатов РКИ опубликован меморандум, в котором к рекомендованным для применения при ОКИ у детей штаммам (несмотря на низкий уровень доказательной базы, по мнению экспертов) отнесены Lactobacillus GG, Saccharomyces boulardii, Lactobacillus reuteri штамм DSM 17938 (исходный штамм ATCC 55730), а также термически инактивированный штамм Lactobacillus acidophilus LB. Последний формально к пробиотикам как живым микроорганизмам отнесен быть не может, однако он показал свою эффективность при острых инфекционных гастроэнтеритах у детей [16].
Цитомукопротективная терапия

К числу новых патогенетических подходов к терапии ОКИ относится использование препаратов, обладающих цитомукопротективным действием. Одним из таких препаратов является желатина таннат (Адиарин ® ). В ФБУН ЦНИИ Эпидемиологии Роспотребнадзора было проведено исследование цитомукопротективных свойств желатина танната на примере биологической модели (мыши).
В исследовании было показано, что желатина таннат значительно уменьшает выраженность деструкции муцинового слоя, вызванной ОКИ, что свидетельствует о его цитомукопротективных свойствах. Так, анализ отпечатков слизистой оболочки кишки подопытных животных на стекле, выполненных на 7-е сут наблюдения, продемонстрировал наличие выраженной дестабилизации муцинового слоя на фоне вирусной ОКИ у животных опытной группы (рис. 1).
Как видно из рисунка 1, у интактных животных отпечаток является однородным, у животных группы вирусного контроля (LD70), которым не проводилось никаких лечебных мероприятий, отпечаток слизистой оболочки кишечника характеризуется деструкцией муцинового слоя, у животных экспериментальных групп, в терапии которых использовались желатина таннат и диоктаэдрический смектит, отпечатки слизистой оболочки демонстрируют сходные c данными интактных животных результаты (сохранение сплошного характера слизистого слоя), что свидетельствует о наличии цитомукопротективного действия у изучаемых лекарственных средств [17, 18].
Заключение
Таким образом, комплексная патогенетическая
терапия ОКИ у детей должна быть направлена на коррекцию синдромов обезвоживания и дестабилизации системы микробиоценоза, а также на оптимизацию протективных свойств муцинового слоя слизистой оболочки кишки. Наиболее оправданным в терапии синдрома дегидратации у детей является использование растворов со сниженной осмолярностью. Пробиотическая терапия должна начинаться в как можно более ранние сроки от начала заболевания и включать в себя рекомендованные международным сообществом штаммы пробиотиков. Цитомукопротективная терапия с использованием препарата желатина таннат показала эффективность и безопасность и может быть рекомендована в составе комплексной патогенетической терапии ОКИ у детей.
В статье изложены современные подходы к регидратационной терапии при острых кишечных инфекциях у детей, в том числе с использованием комплексных методов, направленных на коррекцию не только синдрома обезвоживания, но и микроэкологических нарушений, ассоци
The article covers modern approaches to fluid therapy in acute intestinal infections in children, including use of complex methods directed not only to correction of dehydration syndrome, but also micro-ecological disorders associated with infectious affection of the intestine.
Дегидратационный синдром является ведущим патогенетическим фактором при ОКИ у детей, обуславливая тяжесть заболевания. Поэтому особую значимость для практического здравоохранения приобретает оперативность и правильность оценки степени дегидратации у ребенка, больного ОКИ [9]. Фундаментальные исследования Н. В. Воротынцевой, В. В. Малеева, В. И. Покровского по оценке выраженности обезвоживания на основе оценки острой потери массы тела пациента сохраняют свою актуальность до настоящего времени: эксикозу I степени соответствует потеря до 5% массы тела, что составляет до 50 мл/кг жидкости, эксикозу II степени — потеря 6–10% массы тела (60–100 мл/кг), эксикозу III степени — потеря более 10% массы тела (110–150 мл/кг). Обезвоживание с потерей массы тела более 20% не совместимо с жизнью [10]. Однако применительно к педиатрической практике определение дефицита массы тела ребенка на фоне болезни не всегда возможно ввиду интенсивного роста детей, поэтому оценка степени дегидратации проводится на основе клинических данных. В этой связи в настоящее время широкое распространение получили рекомендации Европейского общества педиатров, гастроэнтерологов и диетологов (European Society for Paediatric Gastroenterology Hepatology and Nutrition, ESPGHAN) от 2014 г. [11]. Однако в них предусмотрена клиническая оценка только внешнего вида, состояния глазных яблок и слизистых оболочек, а также наличие у ребенка слез. Более полная клиническая шкала M. H. Gorelick дополнительно включает определение времени капиллярной реперфузии (в норме не более 2 секунд), снижение диуреза, основные гемодинамические показатели (частота и наполнение пульса) и показатели нарушения дыхания [12]. Существуют и другие шкалы клинической оценки выраженности обезвоживания. Однако значимость каждого из симптомов обезвоживания в клинической практике может быть не всегда достаточно высокой, особенно при эксикозе I степени, что делает их наиболее применимыми при эксикозе II степени (табл. 1).
При ОКИ у детей преобладает изотонический тип обезвоживания, характеризующийся пропорциональной потерей жидкости и электролитов, в первую очередь натрия. При этом не отмечается изменения осмотического давления воды во внутриклеточном и внеклеточном пространствах, что затрудняет его определение лабораторными методами [15].
Объективизация диагностики степени выраженности обезвоживания у детей возможна с применением алгоритма, включающего клинические (увеличение времени капиллярной реперфузии, определяемая клинически сухость слизистых оболочек), анамнестические (выраженность диареи и рвоты), инструментальные (оценка влажности кожных покровов) и лабораторные (дефицит буферных оснований сыворотки крови) данные [16].
Также одним из важных аспектов патогенеза, являющегося закономерным для ОКИ любой этиологии, является развитие нарушений микрофлоры желудочно-кишечного тракта (ЖКТ). Ранее было показано, что при дизентерии Зонне у 67,8–85,1% пациентов, при сальмонеллезе — у 95,1%, иерсиниозе — у 94,9%, ротавирусной инфекции — у 37,2–62,8% нарушения со стороны микрофлоры ЖКТ носят выраженный характер [17–19].
Дестабилизация микробиоценоза ЖКТ на фоне течения инфекционного процесса приводит к снижению колонизационной резистентности микрофлоры, повышению выраженности воспалительных реакций со стороны слизистой оболочки кишки и снижению темпов репаративных процессов в кишечнике, что приводит к усугублению интоксикационного синдрома за счет высвобождения токсинов не только патогенных возбудителей, но и представителей условно-патогенной микрофлоры (УПФ), доля которых при ОКИ возрастает [20].
Основные патогенетические аспекты ОКИ обосновывают и терапевтические подходы — регидратационную и пробиотическую терапию, от своевременности и адекватности назначения которых зависят длительность заболевания и его исходы [10].
При развитии дегидратации основным принципом ведения таких больных является быстрое возмещение потерь жидкости и солей, а также увеличение буферной емкости крови. Общепризнано, что в педиатрической практике следует отдавать предпочтение оральной регидратации, как менее травматичной и более физиологичной для ребенка [21]. Международная практика применения оральной регидратации при ОКИ получила широкое применение с 70-х годов XX века, а ее включение в стандарты ведения больных позволило сократить число случаев госпитализации на 50–60% и значительно, на 40–50%, снизить летальность детей [22]. Однако первые рекомендации, которые можно отнести к регидратационной терапии и включающие в себя назначение рисового отвара, кокосового сока и морковного супа, относятся к периоду более 2500 лет назад и принадлежат древнеиндийскому врачу Sushruta [23]. В 1874 г. во Франции доктором Luton было обосновано назначение дополнительной воды для лечения детей, больных ОКИ. Впервые раствор, в состав которого вошли глюкоза, натрий и хлор, предложил использовать доктор Robert A. Phillips, после открытия механизма потенцирования глюкозой всасывания в кишечнике ионов натрия и калия [23]. В нашей стране в 30–50-х годах XX века проводилась разработка методов регидратационной терапии ОКИ М. С. Масловым (1928, 1945, 1955), В. И. Моревым (1937), В. Е. Балабан (1937). Основные принципы оральной регидратации, состав растворов и методы организации помощи больным ОКИ в нашей стране были разработаны Центральным научно-исследовательским институтом эпидемиологии под руководством В. И. Покровского [10].
Общий терапевтический подход к оральной регидратации предусматривает раннее назначение регидратационных растворов и проводится в два этапа:
- 1-й этап — восполнение потерь, произошедших до момента обращения за медицинской помощью. Назначается суммарное количество жидкости 50–80 мл/кг в течение 6 ч;
- 2-й этап — поддерживающая регидратация, задачей которой является восполнение текущих потерь жидкости при ОКИ. В сутки назначается 80–100 мл/кг жидкости. Длительность второго этапа оральной регидратации продолжается до момента выздоровления или появления показаний для парентеральной коррекции обезвоживания [24].
Согласно действующим современным подходам, для проведения оральной регидратации рекомендовано использование готовых форм растворов, сбалансированных по электролитному составу и осмолярности (75 мэкв/л натрия и 75 мэкв/л глюкозы и осмолярностью 245 мосм/л), при этом значению осмолярности растворов, рекомендуемых для педиатрического применения, уделяется огромное значение.
Также было показано, что данный тип растворов уменьшает потребность в инфузионной терапии, снижает выраженность диарейного синдрома и рвоты и позволяет уменьшить объемы растворов при проводимой оральной регидратации, что является важным преимуществом для педиатрии [16].
Необходимо учитывать, что коррекция обезвоживания должна проводиться с использованием и бессолевых растворов, среди которых предпочтение следует отдать питьевой воде (не минеральной!), возможно использование пектинсодержащих отваров (яблочный компот без сахара, морковно-рисовый отвар). Соотношение глюкозосолевых растворов и питьевой воды должно быть 1:1 при водянистой диарее, 2:1 при выраженной рвоте, 1:2 при инвазивных диареях [24].
Тяжелые формы ОКИ, отсутствие эффекта от оральной регидратации или наличие обильной рвоты, отеков, развитие функциональной (острой) почечной недостаточности являются показаниями для проведения парентеральной регидратации, которая может быть осуществлена с использованием одного из современных отечественных растворов — 1,5% раствора меглюмина натрия сукцината, доказавшего свою эффективность в интенсивной терапии данных состояний [30].
Патогенетическое обоснование необходимости применения пробиотических лекарственных средств при ОКИ не вызывает сомнения как в отечественной, так и в зарубежной литературе. Пробиотическую терапию рекомендовано назначать в составе комплексной стартовой терапии вне зависимости от этиологии заболевания и в как можно более ранние сроки. Данные препараты показаны также всем пациентам в периоде реконвалесценции с целью восстановления параметров микробиоценоза. Их применение при ОКИ у детей является не только патогенетически обоснованным, но и относится к самому высокому уровню доказательности — А — в соответствии с принципами доказательной медицины [31]. Данный факт был подтвержден в 2010 г. результатами метаанализа, включившего в себя результаты 63 рандомизированных контролируемых клинических исследований. В нем было показано, что использование пробиотиков достоверно уменьшает продолжительность диареи в среднем на 24,76 часа и сокращает частоту стула, при этом данные препараты характеризуются высоким профилем безопасности [32].
Одним из патогенетических механизмов, позволяющих рекомендовать пробиотики при ОКИ, является их положительное влияние на муциновый слой слизистой оболочки ЖКТ. На фоне течения инфекционного процесса наблюдается изменение физических характеристик данного барьера — снижение вязкости за счет разрушения дисульфидных связей между цистеиновыми мостиками суперструктуры данного геля, что может приводить к транслокации микроорганизмов из просвета кишечника в ткани. Данные процессы развиваются под действием патогенных микроорганизмов, имеющих соответствующие факторы патогенности в виде ферментов, разрушающих слизь (нейраминидаза, гиалуронидаза, муциназа). Длительное, в том числе в постинфекционном периоде, изменение физических свойств муцинового слоя приводит к риску развития воспалительных заболеваний кишечника [33]. Микроорганизмы, относящиеся к компонентам нормальной микрофлоры ЖКТ человека, а также продукты их обмена оказывают потенцирующее действие на состояние муцинового слоя посредством целого ряда механизмов, в том числе генетических [34, 35].
Современный взгляд на терапию пробиотиками подразумевает штамм-специфичный подход, который включает в себя установление в клинических исследованиях терапевтических эффектов, характерных для определенных генетически сертифицированных штаммов и дальнейшее их использование с учетом штамм-специфичных свойств пробиотиков в различных клинических ситуациях [36, 37].
Применительно к острым кишечным инфекциям у детей рабочая группа ESPGHAN в 2014 г. на основе анализа опубликованных систематических обзоров и результатов рандомизированных клинических исследований, в том числе плацебо-контролируемых, опубликовала меморандум, в котором разделила все пробиотические штаммы на пробиотики с положительной рекомендацией, с отрицательной рекомендацией и пробиотики с недостаточными доказательствами их эффективности. К рекомендованным штаммам (несмотря на низкий уровень доказательной базы по мнению экспертов) для терапии ОКИ у детей были отнесены Lactobacillus GG, Saccharomyces boulardii, Lactobacillus reuteri штамм DSM 17938 (исходный штамм ATCC 55730), а также термически инактивированный штамм Lactobacillus acidophilus LB, который формально к пробиотикам как живым микроорганизмам с заданными полезными свойствами отнесен быть не может, однако он показал свою эффективность при острых инфекционных гастроэнтеритах [38].
Штамм Lactobacillus reuteri DSM 17938 устойчив к следующим антимикробным средствам (возможен совместный прием пробиотиков Lactobacillus reuteri Protectis с этими средствами): амоксициллин, ампициллин, Аугментин, диклоксациллин, оксациллин, пенициллин G, феноксиметилпенициллин, цефуроксим, цефалотин, ванкомицин, доксициклин, тетрациклин, фузидовая кислота, ципрофлоксацин, энрофлоксацин, налидиксовая кислота, метронидазол. Lactobacillus reuteri DSM 17938 чувствительны к цефотаксиму, неомицину, стрептомицину, кларитромицину, эритромицину, рокситромицину, клиндамицину, хлорамфениколу, рифампицину, имипенему, линезолиду, виргиниамицину.
При этом Lactobacillus reuteri DSM 17938 характеризуется хорошим профилем безопасности, что подтверждено Продовольственной и сельскохозяйственной организацией ООН (Food and Agriculture Оrganization of the United Nations, FAO) и ВОЗ в 2002 г.
Клиническая эффективность Lactobacillus reuteri DSM 17938 показана при функциональных коликах у детей первого года жизни, в составе комплексной эрадикационной терапии H. рylori-инфекции, профилактики антибиотик-ассоциированной диареи, при метаболическом синдроме, в терапии аллергических заболеваний. Эффективность данного штамма подтверждена в 163 клинических исследованиях у 14 000 пациентов, из которых 114 — рандомизированные, двойные/слепые или слепые плацебо-контролируемые исследования, 47 — открытые исследования, 56 исследований проводились среди 7300 детей 0–3 лет жизни.
Однако наиболее хорошо изучены клинические эффекты данного штамма при ОКИ, что послужило причиной включения его в рекомендации ESPGHAN. Так, в многоцентровом рандомизированном простом слепом клиническом исследовании, проведенном среди госпитализированных с острым гастроэнтеритом детей, получавших традиционную терапию с или без 1 × 10 8 КОЕ Lactobacillus reuteri DSM 17938 на протяжении 5 дней, было показано, что назначение данного пробиотического штамма сокращает продолжительность диареи через 24 и 48 ч (50% в основной группе против 5% в группе сравнения, p < 0,001) и 72 ч (69% против 11%, р < 0,001), позволяет уменьшить сроки госпитализации (4,31 ± 1,3 дня против 5,46 ± 1,77 дня, р < 0,001) и снизить вероятность развития затяжного характера диареи (17% в группе сравнения и ни одного пациента в основной группе) [40]. Аналогичные данные были получены и в других исследованиях [41, 42].
Учитывая вышеизложенное, можно заключить, что в настоящее время в РФ единственным низкоосмолярным глюкозосолевым регидратационным раствором, содержащим Lactobacillus reuteri DSM 17938, является БиоГая ОРС (биологически активная добавка). Данный раствор оказывает терапевтическое действие по двум основным патогенетическим направлениям — корригировать и обезвоживание, и нарушения микробиоценоза при ОКИ у детей. Важно подчеркнуть, что, помимо глюкозы, солей и пробиотика, БиоГая ОРС содержит цинк, оказывающий положительное влияние на всасывание воды, который также потенцирует процессы иммунологической защиты и участвует в процессах регенерации.
По составу и осмолярности комбинация солей БиоГая ОРС соответствует рекомендациям Европейского общества педиатров, гастроэнтерологов и диетологов, а также ВОЗ и ЮНИСЕФ по оральной регидратации при легкой и средней степенях обезвоживания (табл. 2).
Эффективность данной комбинации — Lactobacillus reuteri DSM 17938 и растворов для оральной регидратации — была подтверждена в проспективном плацебо-контролируемом исследовании, где было показано снижение на 84% доли детей с обезвоживанием на вторые сутки приема данной комбинации [43].
Таким образом, комбинированная терапия пробиотиком и низкоосмолярным раствором для оральной регидратации (БиоГая ОРС) у детей без возрастных ограничений является не только патогенетически обоснованной, доказавшей свою несомненную эффективность и безопасность в контролируемых клинических исследованиях, но и наиболее перспективным направлением в лечении острых диарей любой этиологии, значительно уменьшающим полипрагмазию.
Литература
А. А. Плоскирева 1 , кандидат медицинских наук
А. В. Горелов, доктор медицинских наук, профессор, член-корреспондент РАН








Современные методы лечения




Острая кишечная инфекция
Кишечные инфекции – одно из самых распространенных заболеваний в мире.
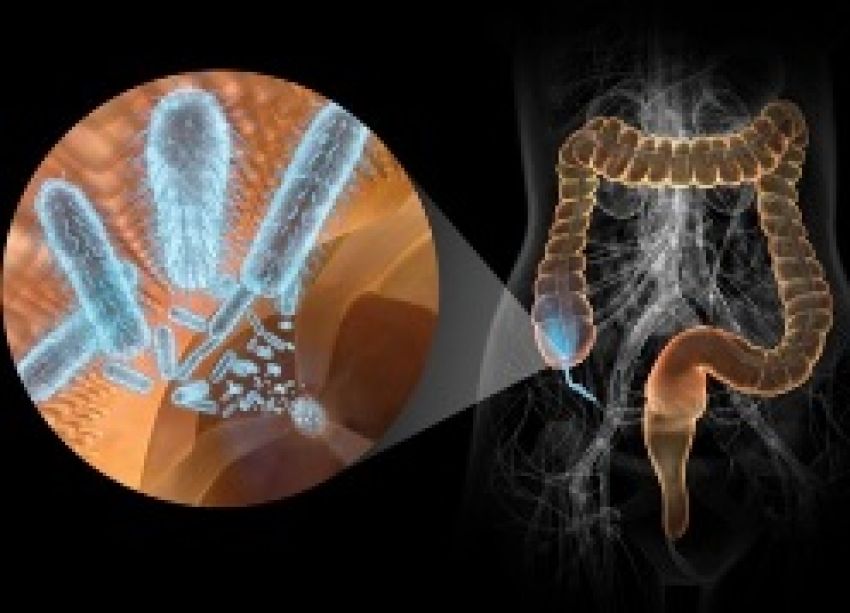
Острые кишечные инфекции (ОКИ) – группа острых инфекционных заболеваний человека, вызываемых различными инфекционными агентами (преимущественно бактериями), с алиментарным механизмом заражения, проявляющиеся лихорадкой и кишечным синдромом с возможным развитием обезвоживания и тяжелым течением в детской возрастной группе и у пожилых людей.
Заболеваемость кишечными инфекциями в мире, и в частности в России, достаточно высока. Ежегодно на планете заболевают более 500 млн. человек. Показатель заболеваемости в России доходит до 400 и более случаев на 100 тыс. населения.
Причины кишечных инфекций
Пищеварительный тракт состоит из ротовой полости, глотки, пищевода, желудка, тонкого кишечника (включающего 12-типерстную кишку, тощую кишку, подвздошную кишку), толстого кишечника. В слюне ротовой полости присутствует вещество – лизоцим, обладающее бактериостатическим действием. Это первый защитный барьер. Слизистая оболочка желудка имеет железы, вырабатывающиежелудочный сок (состоящий из соляной кислоты и пепсина). Соляная кислота является вторым барьером для патогенных микроорганизмов, который могут в нем погибнуть (однако это происходит не всегда). Слизистая тонкого кишечника покрыта многочисленными ворсинками, участвующими в пристеночном пищеварении, выполняющими защитную и транспортную функции. Кроме того, слизистая кишечника содержит секреторный иммуноглобулин – IgA, играющий роль в иммунитете организма человека.
Микрофлора, населяющая кишечник, делится на облигатную (обязательную для присутствия в кишечнике), к которой относятся бифидобактерии, лактобактерии, кишечные палочки, бактероиды, фузобактерии, пептококки. Облигатная флора составляет 95-98% от всех представителей. Функция облигатной флоры – защитная за счет конкурентного присутствия и участие в процессах пищеварения. Другая группа микроорганизмов, населяющих кишечник, называется факультативной (добавочной) флорой, к которой относятся стафилококки, грибы, условно-патогенные микроорганизмы (клебсиеллы, стрептококки, протей, синегнойная палочка, клостридии и другие). Добавочная флора также может участвовать в процессе пищеварения за счет выработки определенных ферментов, однако условно-патогенная при определенном росте может вызвать развитие кишечного синдрома. Вся остальная флора, попадающая извне, называется патогенной и вызывает острую кишечную инфекцию.
Какие возбудители могут явиться причиной острой кишечной инфекции?
Выделяют несколько видов кишечных инфекций в зависимости от этиологии:
- Кишечная инфекция бактериальная: cальмонеллез (Salmonellae enteritidis et spp.), дизентерия (Shigellae sonnae et spp.), иерсиниоз (Iersiniae spp.), эшерихиоз (Esherihiae coli энтероинвазивные штаммы), кампилобактериоз (энтерит, вызванный Campylobacter), острая кишечная инфекция, вызванная синегнойной палочкой (Pseudomonas aeruginosa), клостридиями (Clostridium), клебсиеллами (Klebsiellae), протеем (Proteus spp.), стафилококковое пищевое отравление (Staphilococcus spp.), брюшной тиф (Salmonellae typhi), холера (Vibrio cholerae), ботулизм (отравление ботулотоксином) и прочие.
- ОКИ вирусной этиологии (ротавирусы, вирусы группы Норфолк, энтеровирусы, коронавирусы, аденовирусы, реовирусы).
- Грибковые кишечные инфекции (чаще грибы рода Candida).
- Протозойные кишечные инфекции (лямблиоз, амебиаз).
Причины возникновения кишечных инфекций

Источник инфекции – больной клинически выраженной или стертой формой кишечной инфекции, а также носитель. Заразный период с момента возникновения первых симптомов болезни и весь период симптомов, а при вирусной инфекции – до 2х недель после выздоровления. Больные выделяют возбудителей в окружающую среду с испражнениями, рвотными массами, реже с мочой.
Механизм заражения – алиментарный (то есть через рот). Пути инфицирования – фекально-оральный (пищевой или водный), бытовой, а при некоторых вирусных инфекциях – воздушно-капельный. Большинство возбудителей острой кишечной инфекции высокоустойчивы во внешней среде, хорошо сохраняют свои патогенные свойства на холоде (в холодильнике, например). Факторы передачи – пищевые продукты (вода, молоко, яйца, торты, мясо в зависимости от вида кишечной инфекции), предметы обихода (посуда, полотенца, грязные руки, игрушки, дверные ручки), купание в открытых водоемах. Основное место в распространении инфекции отводится соблюдению или не соблюдению норм личной гигиены (мытье рук после туалета, ухода за больным, перед едой, дезинфекция предметов обихода, выделение личной посуды и полотенца заболевшему, сокращение контактов до минимума).
Восприимчивость к кишечным инфекциям всеобщая независимо от возраста и пола. Наиболее восприимчивы к кишечным патогенам – дети и лица преклонного возраста, лица с заболеваниями желудка и кишечника, люди, страдающие алкоголизмом.
Иммунитет после перенесенной инфекции нестойкий, строго типоспецифический.
Общие симптомы острых кишечных инфекций
Инкубационный период (с момента попадания возбудителя до появления первых признаков болезни) длится от 6 часов до 2х суток, реже дольше.
Для практически любой кишечной инфекции характерно развитие 2х основных синдромов, но в различной степени выраженности:
- Инфекционно-токсического синдрома (ИТС), который проявляется температурой от субфебрильных цифр (37? и выше) до фебрильной лихорадки (38° и выше). При некоторых инфекциях температуры нет совсем (например, холера), также отсутствие температуры или небольшой кратковременный подъем характерен для пищевого отравления (стафилококкового, например). Температура может сопровождаться симптомами интоксикации (слабость, головокружение, ломота в теле, подташнивание, иногда на фоне высокой температуры рвота). Часто инфекционно-токсический синдом является началом острой кишечной инфекции, длится от нескольких часов до суток, реже дольше.
- Кишечного синдрома. Проявления кишечного синдрома могут быть разными, но есть схожесть симптоматики. Этот синдром может проявляться в виде синдрома гастрита, гастроэнтерита, энтерита, гастроэнтероколита, энтероколита, колита.
Синдром гастрита характеризуется появлением болей в области желудка (эпигастрии), постоянной тошноты, рвоты после приема пищи и питья воды, причем ее может вызвать даже глоток жидкости. Рвота может быть многократной, приносящей недолговременное облегчение. Возможно разжижение стула и в течение короткого промежутка времени, иногда однократно.
Синдром гастроэнтерита сопровождается болями в животе в области желудка и околопупочной области, рвотой, появлением частого стула сначала кашицеобразного характера, а затем с водянистым компонентом. В зависимости от причины возникновения в стуле может меняться цвет (зеленоватый при сальмонеллезе, светло-коричневый при эшерихиозе, к примеру), а также появляться слизь, непереваренные остатки пищи.
Синдром энтерита характеризуется появлением только нарушений стула в виде частого водянистого стула. Частота зависит от вида возбудителя и степени инфицирующей дозы его, попавшей к конкретному больному.
Синдром гастроэнтероколита проявляется и рвотой, и частым жидким стулом, боли в животе становятся разлитого характера и практически постоянными, акты дефекации становятся болезненными, не приносящими облегчения, нередко примеси крови и слизи в стуле. Некоторые акты дефекации со скудным слизистым отделяемым.
Синдром энтероколита характеризуется только выраженным болевым синдромом по всему периметру живота, частым стулом вперемешку со скудным отделяемым.
Синдром колита проявляется боями в нижних отделах живота, преимущественно слева, акты дефекации болезненные, содержимое скудное с примесью слизи и крови, ложные позывы на стул, отсутствие облегчения в конце дефекации.
Такие синдромы как гастроэнтерит, гастроэнтероколит и энтероколит характерны для сальмонеллеза, энтероколит и колит – для дизентерии, эшерихиозы сопровождаются развитием гастроэнтерита, энтерит – ведущий синдром холеры, синдром гастрита может сопровождать пищевое отравление, однако это может быть и гастроэнтерит, вирусные кишечные инфекции протекают чаще в виде гастроэнтеритов.
Осложнения острых кишечных инфекций
- Дегидратация (обезвоживание) – патологическая потеря воды и солей неестественным путем (рвота, жидкий стул). Выделяют 4 степени обезвоженности у взрослых: - 1 степень (компенсированная) – потеря массы тела до 3% от исходной; 2 степень (переходная) – потеря массы тела 4-6% от исходной; 3 степень (субкомпенсированная) – 7-9% от исходной; 4 степень (декмпенчированная) – более 10% потери массы тела от исходной. Помимо снижения веса беспокоит сухость кожи и слизистых, жажда, снижение эластичности кожи, нарушения гемодинамики (учащение пульса, снижение АД).
- Одно из проявлений молниеносной дегидратации: дегидратационный шок с возможным летальным исходом. Имеет место глубокое обезвоживание и расстройства гемодинамики (критическое падение артериального давления).
- Инфекционно-токсический шок: возникает на фоне высокой температуры, чаще в начале болезни и сопровождается высокой токсинемией (высокой концентрацией токсинов бактерий в крови), серьезными нарушениями гемодинамики и возможным летальным исходом.
- Пневмония (воспаление легких).
- Острая почечная недостаточность.
Не секрет, что появление частого жидкого стула для большинства людей – не повод для обращения к врачу. Большинство стараются различными препаратами и методами остановить диарею и восстановить нарушенное состояние здоровья. Вместе с тем, простая (как кажется на первый взгляд) кишечная инфекция может обернуться серьезной проблемой с длительной потерей трудоспособности.
Симптомы, с которыми нужно обратиться к врачу незамедлительно:
- ранний детский возраст (до 3х лет) и дошкольный возраст ребенка;
- лица преклонного возраста (старше 65 лет);
- частый жидкий стул более 5 раз в сутки у взрослого;
- многократная рвота;
- высокая лихорадка с диареей и рвотой;
- кровь в стуле;
- схваткообразные боли в животе любой локализации;
- выраженная слабость и жажда;
- наличие хронических сопутствующих болезней.
Что нельзя категорически делать при подозрении на острую кишечную инфекцию:
Если появился частый жидкий стул, сопровождаемой болями в животе и температурой, то:
- Нельзя применять болеутоляющие лекарственные средства. В случае скрытых симптомов какой-либо хирургической патологии (холецистит, аппендицит, кишечная непроходимость и другие) снятие болевого синдрома может затруднить постановку диагноза и отложить оказание своевременной специализированной помощи.
- Нельзя самостоятельно применять закрепляющие средства (вяжущие) – такие как иммодиум или лоперамид, лопедиум и другие. При острой кишечной инфекции основная масса токсинов возбудителей концентрируется в кишечнике, и применение таких препаратов способствует их накоплению, что усугубит состояние пациента. Течение кишечной инфекции будет благоприятным при своевременном опорожнении содержимого кишечника вместе с токсинами патогенов.
- Нельзя делать самостоятельно клизмы, особенно с горячей водой.
- Нельзя применять греющие процедуры на живот (грелка с горячей водой, например), что безусловно способствует усилению воспалительного процесса, что усугубит состояние пациента.
- При наличии симптомов острой кишечной инфекции и подозрении на хирургическую патологию нельзя медлить и пытаться лечить подручными средствами (народные, гомеопатические и другие). Последствия промедления с обращением за медицинской помощью могут быть очень печальными.
Профилактика острой кишечной инфекции сводится к следующим мероприятиям:
Кишечная инфекция у детей – группа инфекционных заболеваний различной этиологии, протекающих с преимущественным поражением пищеварительного тракта, токсической реакцией и обезвоживанием организма. У детей кишечная инфекция проявляется повышением температуры тела, вялостью, отсутствием аппетита, болями в животе, рвотой, диареей. Диагностика кишечной инфекции у детей основана на клинико-лабораторных данных (анамнезе, симптоматике, выделении возбудителя в испражнениях, обнаружении специфических антител в крови). При кишечной инфекции у детей назначаются антимикробные препараты, бактериофаги, энтеросорбенты; в период лечения важно соблюдение диеты и проведение регидратации.
Общие сведения
Кишечная инфекция у детей – острые бактериальные и вирусные инфекционные заболевания, сопровождающиеся кишечным синдромом, интоксикацией и дегидратацией. В структуре инфекционной заболеваемости в педиатрии кишечные инфекции у детей занимают второе место после ОРВИ. Восприимчивость к кишечной инфекции у детей в 2,5-3 раза выше, чем у взрослых. Около половины случаев кишечной инфекции у детей приходится на ранний возраст (до 3 лет). Кишечная инфекция у ребенка раннего возраста протекает тяжелее, может сопровождаться гипотрофией, развитием дисбактериоза и ферментативной недостаточности, снижением иммунитета. Частое повторение эпизодов инфекции вызывает нарушение физического и нервно-психического развития детей.

Причины
Спектр возбудителей кишечных инфекций у детей крайне широк. Наиболее часто патогенами выступают грамотрицательные энтеробактерии (шигеллы, сальмонеллы, кампилобактеры, эшерихии, иерсинии) и условно-патогенная флора (клебсиеллы, клостридии, протей, стафилококки и др.). Кроме этого, встречаются кишечные инфекции, вызываемые вирусными возбудителями (ротавирусами, энтеровирусами, аденовирусами), простейшими (лямблиями, амебами, кокцидиями), грибами. Общими свойствами всех возбудителей, обусловливающих развитие клинических проявлений, являются энтеропатогенность, способность к синтезу эндо- и экзотоксинов.
Заражение детей кишечными инфекциями происходит посредством фекально-орального механизма алиментарным (через пищу), водным, контактно-бытовым путями (через посуду, грязные руки, игрушки, предметы обихода и т. д.). У ослабленных детей с низкой иммунологической реактивностью возможно эндогенное инфицирование условно-патогенными бактериями. Источником ОКИ может выступать носитель, больной со стертой или манифестной формой заболевания, домашние животные. В развитии кишечной инфекции у детей большую роль играет нарушение правил приготовления и хранения пищи, допуск на детские кухни лиц-носителей инфекции, больных тонзиллитом, фурункулезом, стрептодермией и пр.
Наиболее часто регистрируются спорадические случаи кишечной инфекции у детей, хотя при пищевом или водном пути инфицирования возможны групповые и даже эпидемические вспышки. Подъем заболеваемости некоторыми кишечными инфекциями у детей имеет сезонную зависимость: так, дизентерия чаще возникает летом и осенью, ротавирусная инфекция - зимой.
Распространенность кишечных инфекций среди детей обусловлена эпидемиологическими особенностями (высокой распространенностью и контагиозностью возбудителей, их высокой устойчивостью к факторам внешней среды), анатомо-физиологическими особенностями пищеварительной системы ребенка (низкой кислотностью желудочного сока), несовершенством защитных механизмов (низкой концентрацией IgA). Заболеваемости детей острой кишечной инфекцией способствует нарушение нормальной микробиоты кишечника, несоблюдение правил личной гигиены, плохие санитарно-гигиенические условия жизни.
Классификация
По клинико-этиологическому принципу среди кишечных инфекций, наиболее часто регистрируемых в детской популяции, выделяют шигеллез (дизентерию), сальмонеллез, коли-инфекцию (эшерихиозы), иерсиниоз, кампилобактериоз, криптоспоридиоз, ротавирусную инфекцию, стафилококковую кишечную инфекцию и др.
По тяжести и особенностям симптоматики течение кишечной инфекции у детей может быть типичным (легким, средней тяжести, тяжелым) и атипичным (стертым, гипертоксическим). Выраженность клиники оценивается по степени поражения ЖКТ, обезвоживания и интоксикации.
Характер местных проявлений при кишечной инфекции у детей зависит от поражения того или иного отдела ЖКТ, в связи с чем выделяют гастриты, энтериты, колиты, гастроэнтериты, гастроэнтероколиты, энтероколиты. Кроме локализованных форм, у грудных и ослабленных детей могут развиваться генерализованные формы инфекции с распространением возбудителя за пределы пищеварительного тракта.
В течении кишечной инфекции у детей выделяют острую (до 1,5 месяцев), затяжную (свыше 1,5 месяцев) и хроническую (свыше 5-6 месяцев) фазы.
Симптомы у детей
Дизентерия у детей
После непродолжительного инкубационного периода (1-7 суток) остро повышается температура (до 39-40° C), нарастает слабость и разбитость, снижается аппетит, возможна рвота. На фоне лихорадки отмечается головная боль, ознобы, иногда – бред, судороги, потеря сознания. Кишечная инфекция у детей сопровождается схваткообразными болями в животе с локализацией в левой подвздошной области, явлениями дистального колита (болезненностью и спазмом сигмовидной кишки, тенезмами с выпадением прямой кишки), симптомами сфинктерита. Частота дефекации может варьировать от 4-6 до 15-20 раз за сутки. При дизентерии стул жидкий, содержащий примеси мутной слизи и крови. При тяжелых формах дизентерии возможно развитие геморрагического синдрома, вплоть до кишечного кровотечения.
У детей раннего возраста при кишечной инфекции общая интоксикация преобладает над колитическим синдромом, чаще возникают нарушения гемодинамики, электролитного и белкового обмена. Наиболее легко у детей протекает кишечная инфекция, вызванная шигеллами Зоне; тяжелее - шигеллами Флекснера и Григорьеза-Шига.
Сальмонеллез у детей
Гриппоподобная (респираторная) форма кишечной инфекции встречается у 4-5% детей. При данной форме сальмонеллы обнаруживаются в посеве материала из зева. Ее течение характеризуется фебрильной температурой, головной болью, артралгией и миалгией, явлениями ринита, фарингита, конъюнктивита. Со стороны сердечно-сосудистой системы отмечаются тахикардия и артериальная гипотония.
На тифоподобную форму сальмонеллеза у детей приходится 2% клинических случаев. Она протекает с длительным периодом лихорадки (до 3-4-х недель), выраженной интоксикацией, нарушением функции сердечно-сосудистой системы (тахикардией, брадикардией).
Септическая форма кишечной инфекции обычно развивается у детей первых месяцев жизни, имеющих неблагоприятный преморбидный фон. На ее долю приходится около 2-3% случаев сальмонеллеза у детей. Заболевание протекает крайне тяжело, сопровождается септицемией или септикопиемией, нарушением всех видов обмена, развитием тяжелых осложнений (пневмонии, паренхиматозного гепатита, отоантрита, менингита, остеомиелита).
Эшерихиозы у детей
Данная группа кишечных инфекций у детей крайне обширна и включает коли-инфекци, вызываемые энтеропатогенными, энтеротоксигенными, энтероинвазивными, энтерогеморрагическими эшерихиями.
Кишечная инфекция у детей, вызванная эшерихиями, протекает с субфебрильной или фебрильной температурой, слабостью, вялостью, снижением аппетита, упорной рвотой или срыгиваниями, метеоризмом. Характерна водянистая диарея (обильный, брызжущий стул желтого цвета с примесью слизи), быстро приводящая к дегидратации и развитию эксикоза. При эшерихиозе, вызываемом энтерогеморрагическими эшерихиями, диарея носит кровавый характер.
Вследствие обезвоживания у ребенка возникает сухость кожи и слизистых оболочек, снижается тургор и эластичность тканей, западает большой родничок и глазные яблоки, снижается диурез по типу олигурии или анурии.
Ротавирусная инфекция у детей
Обычно протекает по типу острого гастроэнтерита или энтерита. Инкубационный период в среднем длится 1-3 дня. Все симптомы кишечной инфекции у детей разворачиваются в течение одних суток, при этом поражение ЖКТ сочетается с катаральными явлениями.
Респираторный синдром характеризуется гиперемией зева, ринитом, першением в горле, покашливанием. Одновременно с поражением носоглотки развиваются признаки гастроэнтерита: жидкий (водянистый, пенистый) стул с частотой дефекаций от 4-5 до 15 раз в сутки, рвотой, температурной реакцией, общей интоксикацией. Длительность течения кишечной инфекции у детей – 4-7 дней.
Стафилококковая кишечная инфекция у детей
Различают первичную стафилококковую кишечную инфекцию у детей, связанную с употреблением пищи, обсемененной стафилококком, и вторичную, обусловленную распространением возбудителя из других очагов.
Течение кишечной инфекции у детей характеризуется тяжелым эксикозом и токсикозом, рвотой, учащением стула до 10-15 раз в день. Стул жидкий, водянистый, зеленоватого цвета, с небольшой примесью слизи. При вторичной стафилококковой инфекции у детей кишечные симптомы развиваются на фоне ведущего заболевания: гнойного отита, пневмонии, стафилодермии, ангины и пр. В этом случае заболевание может принимать длительное волнообразное течение.
Диагностика
На основании осмотра, эпидемиологических и клинических данных педиатр (детский инфекционист) может лишь предположить вероятность кишечной инфекции у детей, однако этиологическая расшифровка возможна только на основании лабораторных данных.
Главную роль в подтверждении диагноза кишечной инфекции у детей играет бактериологическое исследование испражнений, которое следует проводить как можно ранее, до начала этиотропной терапии. При генерализованной форме кишечной инфекции у детей проводится посев крови на стерильность, бактериологическое исследование мочи, ликвора.
Определенную диагностическую ценность представляют серологические методы (РПГА, ИФА, РСК), позволяющие выявлять наличие Ат к возбудителю в крови больного с 5-х суток от начала болезни. Исследование копрограммы позволяет уточнить локализацию процесса в ЖКТ.
При кишечной инфекции у детей требуется исключить острый аппендицит, панкреатит, лактазную недостаточность, дискинезию желчевыводящих путей и др. патологию. С этой целью проводятся консультации детского хирурга и детского гастроэнтеролога.
Лечение кишечной инфекции у детей
Комплексное лечение кишечных инфекций у детей предполагает организацию лечебного питания; проведение оральной регидратации, этиотропной, патогенетической и симптоматической терапии.
Диета детей с кишечной инфекцией требует уменьшения объема питания, увеличения кратности кормлений, использования смесей, обогащенных защитными факторами, употребление протертой легкоусвояемой пищи. Важной составляющей терапии кишечных инфекций у детей является оральная регидратация глюкозо-солевыми растворами, обильное питье. Она проводится до прекращения потерь жидкости. При невозможности перорального питания и употребления жидкости назначается инфузионая терапия: внутривенно вводятся растворы глюкозы, Рингера, альбумина и др.
Этиотропная терапия кишечных инфекций у детей проводится антибиотиками и кишечными антисептиками (канамицин, гентамицин, полимиксин, фуразолидон, налидиксовая кислота), энтеросорбентами. Показан прием специфических бактериофагов и лактоглобулинов (сальмонеллезного, дизентерийного, колипротейного, клебсиеллезного и др.), а также иммуноглобулинов (антиротавирусного и др.). Патогенетическая терапия предполагает назначение ферментов, антигистаминных препаратов; симптоматическое лечение включает прием жаропонижающих, спазмолитиков. В период реконвалесценции необходима коррекция дисбактериоза, прием витаминов и адаптогенов.
Прогноз и профилактика
Раннее выявление и адекватная терапия обеспечивают полное выздоровление детей после кишечной инфекции. Иммунитет после ОКИ нестойкий. При тяжелых формах кишечной инфекции у детей возможно развитие гиповолемического шока, ДВС-синдрома, отека легких, острой почечной недостаточности, острой сердечной недостаточности, инфекционно-токсического шока.
В основе профилактики кишечных инфекций у детей – соблюдение санитарно-гигиенических норм: правильное хранение и термическая обработка продуктов, защита воды от загрязнения, изоляция больных, проведение дезинфекции игрушек и посуды в детских учреждениях, привитие детям навыков личной гигиены. При уходе за грудным ребенком мама не должна пренебрегать обработкой молочных желез перед кормлением, обработкой сосок и бутылочек, мытьем рук после пеленания и подмывания ребенка.
Дети, контактировавшие с больным кишечной инфекцией, подлежат бактериологическому обследованию и наблюдению в течение 7 дней.
Читайте также:

