Синяки под глазами из-за кишечной инфекции
Обновлено: 24.04.2024
В чем заключаются трудности диагностики гельминтозов? Какова терапия гельминтозов? На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов
В чем заключаются трудности диагностики гельминтозов?
Какова терапия гельминтозов?
На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов (болезни адаптации), постоянного стресса, повышения уровня образованности и культуры населения многие давно известные заболевания человека изменили свою клиническую картину. Некоторые симптомы практически перестали встречаться, другие, наоборот, стали выходить на первый план. Это относится и к заболеваниям, вызываемым гельминтами, в частности, круглыми паразитическими червями (нематодами). В умеренном поясе наиболее широко распространенные нематоды — аскарида и острицы.
Гельминты могут вызывать нарушения функции желудочно-кишечного тракта (ЖКТ), быть причиной аллергических (или псевдоаллергических) реакций или усугублять их, вызывать интоксикацию, а также быть фактором, ослабляющим иммунитет [2]. В настоящее время редко встречаются случаи массивной инвазии, когда диагностика не вызывает затруднений, а клубки гельминтов вызывают обтурации кишечника, — значительно чаще гельминты стали являться причиной развития аллергических проблем. При этом гельминтозы относятся к тем заболеваниям, которые трудно диагностировать в связи с объективными и субъективными трудностями (длительные периоды отсутствия яйцекладки, возможность отсутствия среди паразитирующих особей самок, вероятность технических ошибок). Поэтому важно знать клиническую картину данных заболеваний, чтобы иметь возможность назначать углубленное обследование или эффективную терапию по совокупности косвенных признаков, даже не имея прямых доказательств наличия гельминтоза.
С целью оценить клиническую картину при нематодозах проанализированы жалобы, анамнез и результаты осмотра 150 детей, у которых были обнаружены аскариды (116 детей), острицы (27 детей), аскариды и острицы (7 детей). Гельминты выявлены стандартными методами: обнаружение яиц аскарид в фекалиях методом мазка или яиц остриц в соскобе на энтеробиоз, а также визуальное обнаружение аскарид или остриц в фекалиях, рвотных массах или при оперативном или эндоскопическом вмешательстве в брюшной полости или в области прямой кишки [3].
Среди детей было 67 мальчиков, 83 девочки. Распределение по возрасту представлено в табл. 1. Преобладали дети младшего дошкольного возраста (от одного до трех лет), их количество составило 63%. Именно в этом возрасте — наибольшие эпидемиологические предпосылки появления нематодозов.
У 150 детей с доказанными инвазиями аскаридами и/или острицами отмечались следующие клинические проявления.
У 107 детей (71,3%) были аллергические проблемы: кожные высыпания, диатез, атопический дерматит, нейродермит — у 99 (66%), из них у 18 эти проблемы носили периодический характер, у двух детей, кроме кожных высыпаний, отмечались конъюнктивиты; у десяти (6,7%) отмечалась доказанная пищевая аллергия на какие-то продукты с высоким уровнем специфических IgE в сыворотке крови; у шести детей (4%) отмечался астматический компонент или был установлен диагноз бронхиальная астма.
Бруксизм (скрежетание зубами) — симптом, который часто связывается с глистными инвазиями, но фактически является неспецифическим признаком интоксикации центральной нервной системы и может сопровождать любые хронические интоксикации — отмечался у 25 детей (16,7%).
Нарушения ночного сна отмечались у 81 ребенка (54%): беспокойство к вечеру, затруднения засыпания — у 15 детей (10%); беспокойный ночной сон (вскрикивания, постанывания, метания во сне, пробуждения, плач, бессонница, кошмарные сновидения) — у 76 (50,7%). Некоторые родители старших детей затруднялись охарактеризовать ночной сон ребенка, т. к. ребенок спит в другой комнате. Проблемы с засыпанием и ночным сном — важный симптом глистных инвазий, т. к. известно, что кишечные нематоды (в том числе аскариды и острицы) часто активизируются именно ночью.
У 54 детей (36%) отмечались зуд и/или покраснения в области заднего прохода (анальная эскориация) — у 43 детей (28,7%); зуд — у 38 (25,3%); оба симптома — у 27 (18%). Анальная эскориация и зуд считаются симптомами энтеробиоза (острицы), но при этом из 54 детей, у которых отмечались данные симптомы, энтеробиоз был доказан у 17 детей (31,5% от числа детей с этими симптомами). У других 37 детей (68,5% от числа детей с данными симптомами) было доказано наличие аскаридоза, но ни визуально, ни в анализах не были обнаружены острицы. Это может свидетельствовать либо о том, что в данных случаях присутствовали острицы, которые не были диагностированы, т. е. гельминтоз был смешанным, либо о том, что анальная эскориация и зуд — симптомы, характерные не только для энтеробиоза, но и аскаридоза.
У 29 детей (19,3%) отмечались признаки общего ослабления иммунитета: часто или длительно болеющие дети (по общепринятой классификации Monto J. et al., 87) — 18 детей (12%); рецидивирующие стоматиты, гингивиты отмечались у 13 детей (8,7%); кариес зубов — у шести (4%); рецидивирующие гнойные заболевания кожи или слизистых — у трех (2%).
У 15 детей (10%) имелись результаты исследования иммунного статуса по крови: у 13 детей было снижено количество Т-клеток; у всех 15 детей было снижено количество Т-хелперов, причем у шести из них — существенно; у 12 детей было снижено хелперно-супрессорное соотношение; у семи детей отмечалось снижение уровня IgA (секреторный иммуноглобулин), в том числе у трех — существенное, у остальных же восьми детей уровень IgA в сыворотке крови был либо нормальным, либо повышенным; у шести детей отмечалось снижение количества лимфоцитов, в том числе у одного ребенка была выраженная лимфо- и нейтропения. Эти результаты подтверждают известные данные о том, что аскариды и острицы угнетающе влияют на функции иммунитета, а также что у людей с ослабленным иммунитетом большая вероятность появления гельминтоза [1].
У большинства детей отмечалось более одного симптома. Обобщенные данные по клинической картине представлены в табл. 2.
Терапия во всех случаях состояла из двух этапов: сначала — антигельминтная терапия, причем назначались два разных препарата (декарис и вермокс) с интервалом три — пять дней между ними, чтобы максимально охватить различные стадии жизни гельминтов; через некоторое время после антигельминтной терапии — препараты для микробиологической и функциональной коррекции. Соответственно оценивались результаты противоглистной терапии, результаты всего лечения, а также катамнез в течение шести месяцев после терапии. В большинстве случаев улучшение наступало быстро в процессе лечения. У 36 детей только после антигельминтной терапии существенно уменьшились или полностью исчезли аллергические проявления, у 39 детей после первого этапа терапии нормализовалась работа ЖКТ, у 41 ребенка сразу прекратились боли в животе, по остальным симптомам также наступало улучшение после противоглистных препаратов. Это подтверждает то, что симптомы были вызваны наличием гельминтов.
У 92 детей после всего лечения не было никаких жалоб; о 37 нет данных об изменениях состояния в процессе и после лечения; у 16 детей эффект был неполным, т. е. какие-то симптомы сохранялись и после окончания лечения; у четырех детей эффект от терапии оказался нестойким, поскольку возникли рецидивы после окончания лечения; у трех детей эффекта от терапии не было.
От состояния желудочно-кишечного тракта зависит не только характер пищеварения, но и внешний вид кожных покровов. Если кишечник функционирует некорректно, то происходит накопление токсических веществ, которые образовались в процессе переваривания пищи. Данный процесс чреват развитием аутоинтоксикации организма, которая в свою очередь влияет на внешний вид кожных покровов. Бесполезно прибегать к косметическим методам, если первопричиной неудовлетворительного состояния кожи является неудовлетворительное состояние желудочно-кишечного тракта.
Почему кишечник и кожа взаимосвязаны?
Организм человека представляют собой единую сложную систему, поэтому кожа и ЖКТ связаны. Если происходят структурно-функциональные изменения в пищеварительной системе, то человек может столкнуться с такими вероятными кожными проявлениями:
- сухость кожи и снижение её эластичности;
- прыщи и угревая сыпь (акне);
- кожная пигментация.
Сбой в работе желудочно-кишечного тракта может проявляться одним из перечисленных симптомов или их совокупностью. Если человек замечает неудовлетворительное состояние кожи, то ему рекомендована консультация не только дерматолога, но и гастроэнтеролога.
Какие заболевания кишечника приводят к ухудшению состояния кожи
Негативно отразится на состояние кожных покровов могут такие отклонения со стороны желудочно-кишечного тракта:
- синдром раздражённого кишечника;
- неспецифический язвенный колит;
- проктосигмоидит;
- хронические запоры;
- синдром мальабсорбции;
- хронический гастрит.
Кроме того, одной из наиболее распространенных причин появления проблем с кожей, является дисбактериоз. При нарушении баланса кишечной микрофлоры нарушается процесс всасывания питательных компонентов и витаминов, а также снижается иммунитет, что априори негативно отражается на состоянии кожных покровов. Послужить причиной развития кишечного дисбактериоза и других заболеваний кишечника, могут такие факторы, как нерациональное питание, злоупотребление алкоголем, преобладание в рационе однотипной пищи и продуктов, которые богаты простыми углеводами. Очень часто проблемы с кожей на фоне дисбактериоза кишечника возникают при прохождении антибиотикотерапии, так как эта группа препаратов не обладает избирательным воздействием, и уничтожает как отрицательную так и положительную микрофлору.
Как распознать проблемы с ЖКТ
Обнаружив у себя кожные дефекты, угревую сыпь, пигментные пятна и другие негативные изменения на коже, необходимо обратить внимание на наличие симптомов, которые указывают на сбой в работе желудочно-кишечного тракта. Во внимание берется набор таких клинических симптомов:
- дискомфорт и боль в правой или левой подвздошной области, а также вокруг пупка;
- повышенное газообразование в кишечнике (метеоризм);
- расстройства стула (чередование запоров и диареи);
- боль в подложечной области;
- отрыжка кислым;
- присутствие фрагментов слизи, гноя или крови в испражнениях.
Кишечник и зуд кожи также взаимосвязаны. Кроме ранее перечисленных кожных проблем, которые развиваются на фоне структурно-функциональных изменений в системе пищеварения, расстройства пищеварительной деятельности могут приводить к появлению симптомов местной аллергической реакции. К симптомам аллергической реакции можно отнести сыпь по типу крапивницы, покраснение кожных покровов, шелушение кожи, зуд, отёчность. Прием противоаллергических препаратов поможет снять только симптомы аллергии, но не решит проблему в полной мере, так как аллергические реакции, связанные с некорректной работой ЖКТ необходимо лечить комплексно.
Диагностика
Если возникли высыпания на коже, кишечник должен быть комплексно осбледован. Комплексная диагностика включает такие методы исследования:
- ультразвуковое исследование органов брюшной полости;
- копрограмма;
- лабораторный анализ на дисбактериоз;
- колоноскопия.
В качестве дополнительных методов обследования может быть назначен общий и биохимический анализ крови.
Лечение
Добиться эффекта оздоровления кожи можно только через здоровый кишечник. При заболеваниях кишечника, которые спровоцировали проблемы с кожей, могут быть назначены такие группы лекарственных медикаментов:
- Противовоспалительные препараты в форме таблеток, капсул и ректальных суппозиториев.
- Спазмолитики. Эта группа лекарственных средств является своего рода скорой помощью, к которой прибегают для снятия спазмов в кишечнике.
- Энтеросорбенты. Кишечные сорбенты назначаются для очищения кишечника от токсических компонентов и продуктов метаболизма.
- Пробиотики. Эта группа средств назначается при дисбактериозе и синдроме раздраженного кишечника для восстановления микрофлоры кишечника.
- Пребиотики. Назначаются чаще в комбинации с пробиотиками, так как представляют собой питательную среду для кишечных бактерий.
Улучшить состояние желудочно-кишечного тракта и соответственно кожных покровов помогает прием метапребиотика Стимбифид Плюс. Метапребиотик содержит фруктополисахариды, фруктоолигосахариды, а также лактат кальция. Каждый компонент по отдельности и все в комбинации создают максимально благоприятные условия для роста и размножения нормальной кишечной микрофлоры. Даже лучший пребиотик не создаст того эффекта стимуляции роста кишечных бактерий, который обеспечивает метапребиотик.
В отличие от пробиотиков, которые являются уязвимыми перед кислотной средой желудка и не в полном объеме попадают в кишечник, метапребиотик Стимбифид Плюс эффективно восстанавливает популяцию собственных бактерий в кишечнике человека. По мере восстановления нормального баланса кишечных бактерий будет улучшаться состояние кожи и произойдет ее общее оздоровление. Стимбифид Плюс может быть использован как при уже возникших дерматологических проблемах, так и для профилактики заболеваний кожных покровов. Чистый кишечник – здоровая кожа, и этот факт подтвержден как гастроэнтерологами, так и дерматологами.
Коронавирусная инфекция вызывает множество внелегочных проявлений, в том числе и поражение органов желудочно-кишечного тракта. В 2022 году коронавирус преимущественно представлен омикрон-штаммом, который имеет меньшую летальность, что увеличивает риск развития острых и хронических заболеваний пищеварительной системы. Кроме того, у детей признаки омикрона все чаще представлены именно рвотой и диареей (по данным НИИ эпидемиологии и микробиологии).
Клинические проявления
Кишечная форма коронавируса, вызванная омикрон-штаммом, может развиваться без поражения легких. Такое течение болезни особенно характерно для детей младшего возраста. У взрослых людей и детей старше трех лет желудочный коронавирус обычно сопровождается респираторными проявлениями (кашель, насморк, заложенность носа, першение в горле) и признаками интоксикации (лихорадка, озноб, слабость, головная боль).
Кишечная форма омикрона имеет такие симптомы:
- частый жидкий стул без примеси крови и слизи;
- отсутствие аппетита;
- тошнота;
- рвота желудочным содержимым;
- боль в животе.
У пациентов с тяжелыми симптомами омикрон-штамма кишечный ковид может спровоцировать такие осложнения:
- острое повреждение печени с повышением уровня трансаминаз;
- острый холецистит;
- острый панкреатит;
- кишечная непроходимость;
- мезентериальная ишемия.
Ковид в 2022 году преимущественно вызывает омикрон-штамм. Его течение считается более легким. За счет снижения доли больных с тяжелым поражением легких число осложнений со стороны пищеварительной системы увеличивается.
Влияние коронавируса на кишечник
В первые месяцы пандемии медики основное внимание уделяли поражению дыхательной системы при коронавирусе. В последнее время активно изучается влияние инфекции на состояние кишечника. Ученые понимают, что кишечный коронавирус вызывает две главные патологические реакции:
- поражение мелких сосудов кишечной стенки и других органов пищеварения, гибель клеток, выстилающих поверхность кишечника, воспалительная реакция;
- изменения кишечной микрофлоры, которые некоторыми учеными рассматриваются как надежный показатель тяжести инфекционного процесса при коронавирусе.
Изменения аппетита и симптомы поражения органов пищеварения при ковиде связаны с этими двумя патогенетическими механизмами.
Основные характеристики кишечной коронавирусной инфекции:
В начальной стадии одними из частых проявлений ковид-19 являются рвота и диарея. Их своевременное лечение замедляет передачу инфекции.
Инфекция меняет проницаемость кишечной стенки и нарушение функции выстилающих ее клеток – энтероцитов. При этом диарея может сопутствовать тяжелым нарушениям функции легких. Пациенты с жидким стулом чаще нуждаются в кислородной поддержке и интенсивной терапии, при этом антидиарейные препараты неэффективны. Также отмечаются задержки в диагностике коронавируса, если он проявляется не поражением легких, а затрагивает желудочно-кишечный тракт.
Желудочно-кишечные симптомы сопровождаются воспалением кишечной стенки. При этом страдает кишечная микрофлора, что приводит к активации иммунных клеток, высвобождению провоспалительных веществ и усилению системного воспаления в организме.
Доказано, что коронавирус может передаваться фекальным путем. Инфекция сохраняется в каловых массах дольше, чем в носовой слизи.
Первичное воспаление под действием вируса приводит к высвобождению провоспалительных цитокинов, которые могут вызывать дисбактериоз. В результате этого из микробных клеток высвобождаются дополнительные вещества, усиливающие системное воспаление. Развивается иммунная реакция, которая может быть еще опаснее, чем сами проявления ковида.
Доказано, что при коронавирусной инфекции в кишечнике увеличивается количество копробацилл, клостридий, бактероидов, стрептококков, морганелл и других патогенных микроорганизмов, причем такой дисбаланс сохраняется в течение долгого времени.
Развитие пандемии в 2022 году
По данным журнала Nature Medicine коронавирус до сих пор угрожает обществу. Основные причины этого следующие:
- неравный доступ населения к вакцинам, средствам лечения и диагностики инфекции;
- непоследовательная политика государств по сокращению передачи вируса, в том числе и по политическим причинам;
- недостаток инвестиций в научные исследования.
Ученые утверждают, что только путем вакцинации победить болезнь невозможно. Прививки призваны сократить число тяжелых случаев болезни, при этом возникают все новые штаммы, лучше приспособленные для передачи от человека к человеку. Поэтому вновь увеличивается роль неспецифической защиты – масок, соблюдения гигиены, улучшения вентиляции в закрытых помещениях и многих других.
Профилактика и лечение
Для профилактики тяжелого поражения пищеварительной системы и развития осложнений рекомендуется использовать препараты для укрепления нормальной кишечной микрофлоры, которая и обеспечивает активный иммунитет. Многие лекарства, содержащие живые бактерии, недостаточно эффективны, так как микробы разрушаются кислотой желудочного сока и не попадают в кишечник.
Помощь при кишечном коронавирусе включает также правильное питание, прием ферментных препаратов и других лекарств по назначению врача.
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых кли
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых клинических признаков болезни. В этот период происходит мобилизация защитных сил организма, направленных на компенсацию возможных нарушений, на уничтожение болезнетворных агентов и удаление их из организма. Продромальный период представляет собой временной интервал от первых симптомов заболевания до полного проявления. Период выраженных проявлений заболевания характеризуется полным развитием клинической картины. При различных инфекционных заболеваниях может страдать нервная система ребенка, что клинически проявляется синдромом нейротоксикоза. Нейротоксикоз — ответная неспецифическая реакция детского организма на воздействие вирусной, бактериальной или вирусно-бактериальной флоры, характеризующаяся преимущественным поражением центральной (ЦНС) и вегетативной нервной системы. С истощением функциональных возможностей органов и систем в результате перенесенного заболевания, особенно нервной системы при ее перенапряжении, а также вследствие аутоинтоксикации или экзогенного токсикоза связывают возникновение астенического синдрома. Это наиболее частое клиническое проявление периода реконвалесценции. Утомление в течение длительного времени, которое не компенсируется полным восстановлением, вызывает синдром перегрузки, следом за которым развивается состояние истощения. Субъективно ощущаемое чувство утомления — прежде всего сигнал о перегрузке центральных регуляторных систем, неудовлетворительном состоянии энергетических ресурсов организма и аутоинтоксикации продуктами метаболизма. Длительное утомление, приводящее к истощению, по сути своей является результатом стрессорного воздействия на организм, вызывающего нарушение функций регуляторных систем — вегетативной, эндокринной и иммунной. Если стрессорные факторы действуют в течение длительного времени, может развиться реакция организма, при которой возможны функциональные изменения в виде вегетативной дисфункции [1, 6]. Синдром вегетативной дисфункции (СВД) включает в себя проявление всех форм нарушения вегетативной регуляции. Наряду с соматическими проявлениями: головокружением, головными болями, сердцебиением, одышкой, жаждой, булимией, рвотой после еды, непереносимостью отдельных видов пищи, субфебрилитетом неясного происхождения, кожными высыпаниями и др., у пациентов с СВД выявляют эмоциональные расстройства разной степени выраженности в виде тревожности, нарушения сна, беспричинного плача, а также расстройства поведения, в частности, импульсивности, повышенной двигательной активности и возбудимости, дефицита внимания, что клинически определяется как астеновегетативный или психовегетативный синдром [Вейн А. М., 1981].
Интерес и сложность проблемы астеновегетативного синдрома заключается в том, что она является комплексной: медицинской, психологической и педагогической. Однако все специалисты сходятся в том, что такое состояние существует, его необходимо диагностировать и правильно корректировать.
Задачи исследования
Данное исследование посвящено изучению динамики состояния вегетативной нервной системы детей с астеновегетативным синдромом после перенесенных инфекционных заболеваний, а также оценке эффективности препарата Тенотен детский при названной патологии.
Тенотен детский содержит сверхмалые дозы антител к мозгоспецифическому белку S-100, создан по особой технологии специально для детского возраста, оказывает успокаивающее, нормализующее настроение и поведение действие, а также выраженное вегетостабилизирующий эффект [3, 5].
Критерии включения больных в исследование:
Критерии исключения больных из исследования:
Наличие декомпенсированных заболеваний или острых состояний, которые могут влиять на проведение исследования.
Применение вегетотропных и ноотропных препаратов в период исследования и в последние две недели перед исследованием.
Участие в других клинических исследованиях в течение четырех недель перед включением в данное исследование.
Материал исследования
Для исследования методом случайной выборки дети были распределены в две группы. В основной группе (30 человек) дети в периоде реконвалесценции наряду с симптоматической витаминотерапией получали Тенотен детский по 1 таблетке 3 раза в день в течение 4 недель в сочетании со стандартной терапией. В контрольную группу (20 человек) вошли дети, получавшие стандартную витаминотерапию и симптоматическую терапию за исключением препаратов, обладающих вегетотропной активностью.
Достоверных различий по половозрастным показателям между основной и контрольной группами детей не было.
По спектру перенесенных заболеваний, их тяжести, характеру осложнений выделенные группы детей также значительно не отличались. Спектр заболеваний включал вирусные и вирусно-бактериальные инфекции дыхательных путей (этиологически подтвержденные формы гриппа и другие респираторные вирусные инфекции, тяжелые формы бронхитов и пневмоний и др.), острые средние отиты, тяжелые и осложненные формы инфекционного мононуклеоза, висцеральные формы ветряной оспы, протекающие с нейротоксикозом и везикулезными высыпаниями на внутренних органах. Данные о заболеваниях приведены в таблице.
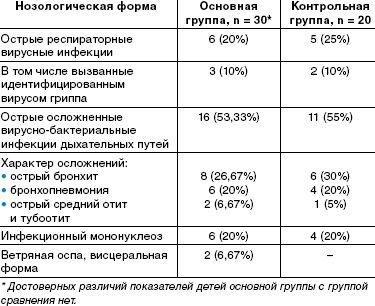
Диагностическое обследование включало в себя клиническую оценку проявлений вегетативной дисфункции, психологическое исследование, неврологическое обследование, электрокардиографию (ЭКГ).
Состояние вегетативной нервной системы определялось по исходному вегетативному тонусу, вегетативной реактивности и вегетативному обеспечению деятельности. Исходный вегетативный тонус, характеризующий направленность функционирования вегетативной нервной системы в состоянии покоя, оценивался по анализу субъективных жалоб и объективных параметров. Оценивалась степень выраженности психопатологических проявлений: утомляемость, тревожность, эмоциональная неустойчивость и др. (модифицированный опросник А. М. Вейна). Определялся внутрисистемный вегетативный тонус по индексу Кердо и межсистемный вегетативный тонус по коэффициенту Хильдебранта. Для оценки вегетативного обеспечения деятельности, отражающего в основном состояние автономной системы регуляции, проводилась клиноортостатическая проба (КОП). Функциональное состояние сердечно-сосудистой системы рассматривалось также на основании данных электрокардиографии.
Уровень внимания оценивался с использованием шкалы SNAP-IV, таблиц Шульте, по результатам модифицированного метода Пьерона–Рузерапо. Выявление расстройств кратковременной и долговременной памяти, косвенно отражающей выраженность астении, проводилось с помощью методики 10 слов и пиктограммы.
Для определения состояния эмоциональной сферы обследуемых (тревоги, депрессии) использовался ахроматический и цветовой тесты Люшера.
После окончания лечения всем детям было проведено повторное комплексное обследование для оценки эффективности терапии. Кроме того, родителям детей предлагалось оценить результаты лечения при помощи десятибалльной аналого-визуальной шкалы, где 0 — это очень плохая оценка, 10 — очень хорошая.
Результаты исследования
Перед началом исследования у всех обследуемых детей (без достоверных различий в обеих группах) с помощью опросника А. М. Вейна определялись умеренно выраженные психопатологические расстройства, в виде неустойчивости эмоционального фона (84%), повышенной тревожности (34%), утомляемости (38%), отвлекаемости (86%), нарушений сна (74%), снижения памяти, а также различные соматические проявления в виде периодических головных болей (52%), головокружения (24%), метеозависимости (12%), снижения аппетита (64%), диспептических нарушений в виде тошноты, рвоты, вздутия живота (44%).
Индекс Кердо позволил определить наличие внутрисистемной дистонии у детей, перенесших тяжелые инфекционные заболевания, он составил в среднем 32,89 ± 0,99 в обеих исследованных группах, что свидетельствовало о превалировании симпатических влияний на организм в покое.
Межсистемный вегетативный тонус, оцениваемый с помощью коэффициента Хильдебранта (средние значения составили 3,98 ± 0,03), имел, в основном, эйтонический характер.
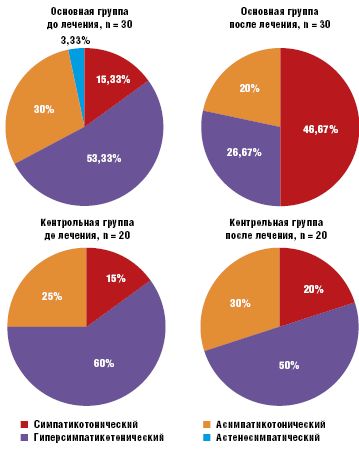
КОП, определяющая вегетативное обеспечение автономной системы регуляции, наряду с нормальным симпатикотоническим вариантом КОП, отражающим устойчивость гемодинамики в ортостазе (14% случаев), выявила и патологические варианты. Гиперсимпатикотонический вариант КОП, характеризующийся резким повышением систолического артериального давления (САД) и диастолического артериального давления (ДАД) и частоты сердечных сокращений (ЧСС) и обусловленный избыточным включением симпатико-адреналовой системы, встречался в преобладающем количестве случаев — у 58% детей. Асимпатикотонический вариант КОП, обусловленный недостаточным подключением симпатического отдела вегетативной нервной системы, при котором САД и ДАД не изменяются или падают, ЧСС остается нормальной или компенсаторно увеличивается, встречался у 28% детей с СВД. Астеносимпатический вариант КОП с падением САД и ДАД и резким увеличением ЧСС в первые минуты ортостаза, с последующей гиперсимпатикотонической реакцией был выявлен в 2% случаев.
Основными психопатологическими проявлениями СВД являлись невнимательность, гиперактивность, импульсивность. Их оценка производилась с помощью шкалы-опросника SNAP-IV (Swanson J., 1992). Показатель невнимательности в двух группах по этой шкале достоверно не отличался и составил в среднем 53,33% (норма (Swanson J., 1992) — 0,40–1,82), средний показатель гиперактивности — 1,96 ± 0,32 (норма (Swanson J., 1992) — 0,27–1,59) и импульсивности 2,13 ± 0,37 (норма (Swanson J., 1992) — 0,26–1,52) (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Выраженность астении косвенно отражается на интеллектуально-мнестических показателях, в частности на оперативной памяти: чем выше утомляемость ребенка в период после перенесенного инфекционного заболевания, тем больше страдает процесс запоминания. Оценка памяти у детей проводилась с помощью методики запоминания десяти слов. Регистрировались следующие показатели: 1) количество повторений, необходимых для воспроизведения 10 слов; 2) количество слов, воспроизведенных через 1 час.
В большинстве случаев обследуемым обеих групп (достоверных различий показателей детей основной группы с группой сравнения нет) для воспроизведения 10 слов требовалось 3 и более повторений, что свидетельствовало о снижении показателей механического запоминания. В то же время количество воспроизводимых слов через час после начала исследования значительно снизилось, что явилось признаком нарушения динамической памяти у детей с вегетативной дистонией.
В качестве методики для исследования опосредованного запоминания использовалась пиктограмма. Регистрировались следующие показатели: 1) количество воспроизведенных понятий; 2) динамика воспроизведенных понятий через 1 час.
Оценка результатов пиктограмм в целом показала, что у детей с СВД дистонией изображаемые образы часто не соответствовали реальным объектам, что впоследствии затрудняло их интерпретацию. Показатели по критерию адекватности (обоснованности связи между предложенным понятием и его пиктограммой) в среднем составили около 50%.
Проведенное по методике Люшера тестирование отразило статистически значимое отклонение преимущественно выбираемой обследуемыми цветовой гаммы от аутогенной нормы. В то же время величина вегетативного показателя не имела столь значимых различий по сравнению с возрастными нормами. Среднестатистические показатели тревожности и напряжения, определенные с помощью теста Люшера, также не имели значительных отклонений от стандартных показателей (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Таким образом, проведенное клиническое обследование детей, перенесших инфекционные заболевания, выявило наличие у них различной степени выраженности проявлений СВД. Безусловно, такие психовегетативные нарушения отражались на периоде реконвалесценции, ухудшали качество жизни и требовали их адекватной коррекции.
В качестве альтернативного препарата для коррекции проявлений СВД был использован Тенотен детский с успокаивающим и выраженным вегетостабилизирующим действием (Лобов М. А., 2008). Основная группа детей (30 человек) получала Тенотен в дозе 3 таблетки/сутки курсом 1 месяц в сочетании со стандартной витаминотерапией. Контрольная группа детей (20 человек) получала стандартную терапию с применением лекарственных средств, не обладающих психотропной и вегетотропной активностью. По окончании курса лечения были проведены повторные клинические исследования.
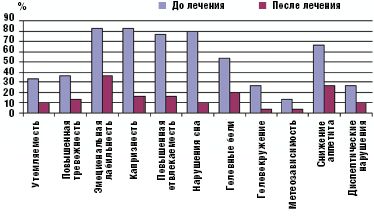
Прием препарата Тенотен детский в течение месяца обеспечил достоверное (в сравнении с контрольной группой) улучшение показателей психовегетативного статуса и снижение частоты соматоневрологических расстройств у детей, принимавших Тенотен детский, тогда как в контрольной группе детей эти показатели оставались практически на прежнем уровне (рис. 1, 2).
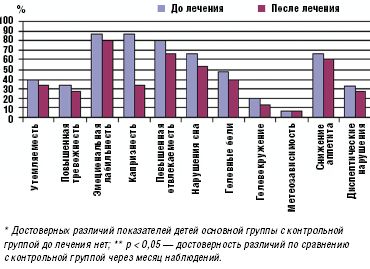
Улучшение показателей вегетативного тонуса отмечалось не только в его психоэмоциональной (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна), но и соматоневрологической (головные боли, головокружение, снижение аппетита, диспептические нарушения) составляющей. Полученные данные отражены на рис. 1.
Качественно изменились результаты КОП. У детей, принимавших Тенотен детский, отмечалась нормализация показателей вегетативного обеспечения (симпатикотонический вариант КОП) с 15,33% детей в начале терапии до 46,67% (p < 0,05), у остальных наметилась четкая тенденция к улучшению. В контрольной группе показатели КОП остались практически на прежнем уровне. Данные отражены на рис. 3.
Была выявлена положительная динамика в отношении патопсихологических проявлений. После курсового применения препарата уменьшение выраженности мнестических и поведенческих симптомов (невнимательность, гиперактивность, импульсивность) отмечалось в среднем у 85% детей. Все показатели шкалы SNAP-IV у детей основной группы после лечения Тенотеном достоверно снизились (p < 0,05). Показатели гиперактивности и невнимательности снизились до нормальных значений, абсолютные показатели импульсивности также значительно уменьшились в наблюдаемой группе.
По данным психометрического исследования у пациентов с СВД основной группы были выявлены достоверные положительные изменения при проведении тестов на память и внимание в сравнении с контрольной группой. Данные тестирования выявили отчетливое улучшение показателей механической и динамической памяти у 30% детей (p < 0,05), а также опосредованной памяти в тестах с пиктограммой — повышение показателя адекватности до 75% (p < 0,05).
Динамическая оценка результатов цветового теста Люшера выявила относительную стабилизацию психоэмоционального состояния у детей основной группы, что отразилось на предпочитаемой цветовой гамме и приближении ее к аутогенной норме (по коэффициенту суммарного отклонения от аутогенной нормы — p < 0,05). У детей контрольной группы определяемые показатели не имели статистически значимых изменений.
По окончании исследования родители оценили результаты лечения при помощи десятибалльной аналого-визуальной шкалы. В среднем успешность лечения в основной группе была оценена на 7–8 баллов, в контрольной — на 4–5 баллов.
Выводы
Проведенное исследование показало, что у детей, перенесших инфекционные заболевания, имеются в различной степени выраженные симптомы астеновегетативного синдрома (СВД) в виде психоэмоциональных (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна) и соматоневрологических (головные боли, головокружение, снижение аппетита, диспепсия) нарушений.
Астеновегетативные нарушения отрицательно влияют на процесс реконвалесценции у детей после перенесенных тяжелых инфекционных заболеваний, удлиняя этот период и ухудшая качество жизни пациентов.
Применение препарата Тенотен детский после перенесенных инфекционных заболеваний в дозе 1 таблетка 3 раза в день приводит к нормализации показателей вегетативного тонуса и обеспечения, уменьшает частоту соматоневрологических проявлений вегетативной дисфункции, что способствует более быстрому завершению периода восстановления.
Тенотен детский устраняет проявления астении, стабилизирует психоэмоциональное состояние детей: улучшает настроение, успокаивает, способствует снижению раздражительности и капризности, облегчает процессы обучения (запоминание, концентрацию внимания, усидчивость).
Препарат Тенотен детский безопасен у пациентов старшего дошкольного и младшего школьного возраста. Побочных эффектов во время применения препарата не было отмечено.
Доказанное успокаивающее, выраженное вегетотропное и антиастеническое действие препарата Тенотен детский позволяет рекомендовать его для применения у детей с различными проявлениями вегетососудистой дисфункции после перенесенных инфекционных заболеваний.
По вопросам литературы обращайтесь в редакцию.
Е. В. Михайлова, доктор медицинских наук, профессор
Т. Ильичева
Cаратовская областная детская инфекционная клиническая больница,
Саратовский государственный медицинский университет, Саратов
Читайте также:

