Системная красная волчанка химиотерапия
Обновлено: 24.04.2024
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
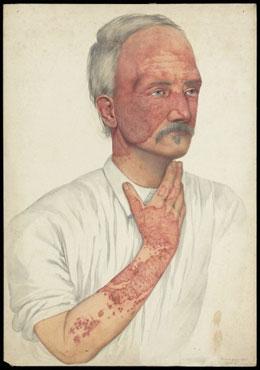
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди

Обзор
Автор
Редакторы

Эта Статья заслужила приз зрительских симпатий.
Однако есть заболевания, возможно, не столь смертельные, но куда сильнее бьющие по нам экономически. Это аутоиммунные заболевания, такие, как рассеянный склероз, системная красная волчанка или диабет 1-го типа. Если рак и инсульты чаще всего встречаются у пожилых людей, то аутоиммунные состояния обычно манифестируют (проявляются в виде симптомов) у молодых людей трудоспособного возраста и либо ложатся тяжким бременем на бюджет страны или больного (россияне, больные диабетом, если не получают инсулин от государства, тратят на поддержание собственной жизни от 1 до 5–6 тысяч рублей в месяц), либо, как в случае рассеянного склероза, просто ставят крест на карьере и жизни пациента.
Особенность аутоиммунных заболеваний состоит в том, что практически ни для одного из них мы за долгие годы исследований и экспериментов не научились достигать стойкой ремиссии. Текущие решения сводятся либо к поддерживающей терапии (как в случае с инсулинозависимым диабетом), либо к попыткам отсрочить терминальную стадию заболевания, на что нацелены препараты от рассеянного склероза. До недавнего времени ситуация выглядела довольно плачевно. Дополнительно усугубляет ее тот факт, что количество людей с аутоиммунными заболеваниями растет каждый год, и мы находимся на пороге настоящей эпидемии.
Однако там, где фармацевтическая отрасль терпит одну неудачу за другой, внезапно сама природа показала, куда смотреть исследователям и откуда брать по-настоящему работающее лекарство.
История вопроса
Чтобы понять, откуда возникла проблема с аутоиммунными заболеваниями, придется заглянуть далеко в прошлое.
Дело в изменившемся в ходе FET образе жизни человека. До этого мы жили небольшими группами, состоявшими не более чем из 50 особей, занимавшими довольно обширные пространства. К тому же мы постоянно меняли место жительства, нигде не оставались надолго. Культура гигиены была довольно низкой — зачем следить за чистотой убежища, если ты уже съел всех мамонтов вокруг и завтра надо искать новое место?
В ходе FET люди начали надолго оставаться на одном месте, формировать более крупные группы для защиты от набегов соплеменников. Скученность и загрязнение места обитания создали оптимальные условия для развития у нас инфекций. Начались эпидемии, которые были тем свирепее, чем больше был город и чем плотнее жили в нем люди.

Довольно долгое время, около 5000 лет, понадобилось человечеству, чтобы научиться справляться с инфекциями. Где-то раньше, где-то позже люди осознали важность гигиены для жизни и здоровья. Были эмпирически найдены лекарства от многих болезней. Можно сказать, весь прогресс медицины и человечества в целом происходил под постоянно довлеющим страхом новых эпидемий.

Рисунок 2. Обложка Le petit journal от 1 сентября 1912 года, посвященного эпидемии холеры в Индии и на Ближнем Востоке в начале 20-го века.
В настоящее время мы настолько чисты, насколько не были никогда в истории. Особенно хорошо это видно в развитых странах. Мы привыкли к тому, что во все дома подведена вода и всегда есть возможность принять ванную или душ. Мы пользуемся мылом, влажными салфетками, асептическими гелями. Мы даже моем наши дороги шампунем!
Казалось бы, ну чистые и чистые, что тут такого? При чем тут аутоиммунные заболевания? Оказывается, связь самая прямая.
Гигиеническая гипотеза
Этот переход стал возможен благодаря появлению антибиотиков и других высокоэффективных противопаразитических лекарств. В развитых странах он завершился к концу 20-го века. Если в середине века в Европе каждый третий житель был поражен гельминтами [1], то в настоящий момент обнаружение носителя этих паразитов скорее редкость. Россия в этом отношении практически не отстает от развитого мира благодаря нашим сильным гигиеническим традициям. Дополнительный вклад вносит городской образ жизни, централизованное снабжение очищенной водой, контроль качества пищи и так далее.

Рисунок 3. Обратное отношение между частотой инфекционных заболеваний и частотой иммунных расстройств с 1950 по 2000 годы. а — Изменение относительного количества заболевших различными инфекционными заболеваниями. б — Относительный рост заболеваемости аутоиммунными заболеваниями за тот же период.
Впоследствии многие исследователи показали то же самое на примере других аллергий и аутоиммунных реакций. К примеру, если детям из неблагополучных по гигиене регионов вроде Чили или Тайланда провести европейскую программу дегельминтизации, у них букетом высыпают аллергии [4].
Наверное, самым интересным примером тут является история с рассеянным склерозом [5–8]. Ученые решили посмотреть, что происходит, когда больной этим страшным заболеванием заражается гельминтами, и начали искать инфицированных червями пациентов с РС. Результаты были ошеломляющи. У пациентов, которые заражались определенными гельминтами (например, власоглавом Trichuris trichiura) течение заболевания практически останавливалось [6]. Во время инфекции у них на 95% снижалось количество новых бляшек в мозге (рис. 4). Результат, недостижимый ни одним современным методом терапии! Если же по каким-то причинам гельминтов требовалось удалить (например, развивалось острое воспалительное поражение кишечника), болезнь возобновлялась с той стадии, на которой остановилась при инфекции.

Рисунок 4. График появления новых бляшек в мозге (когортное исследование 2011 года). Круги — неинфицированные гельминтами пациенты, квадраты — инфицированные, треугольники — инфицированные, но вылеченные от гельминта (момент излечения показан черной стрелкой).
Иммунный ответ
Иммунная система призвана защищать организм от внутренних и внешних врагов. Внешними врагами являются вирусы, бактерии, простейшие и черви, которые постоянно попадают в наш организм и уничтожаются на дальних рубежах. Внутренними врагами являются раковые клетки, а также клетки, зараженные вирусами или внутриклеточными бактериями.
Когда паразит попадает в организм, первым делом его встречает врожденный иммунитет, клетки которого (макрофаги) есть во всех тканях. Антигеном в данном случае служат нехарактерные для нашего организма молекулы — клеточная стенка бактерий, двухцепочечная РНК некоторых вирусов, свободно плавающая в межклеточном пространстве наша ДНК и так далее. При обнаружении пришельцев, клетки врожденного иммунитета пытаются их уничтожить, параллельно выделяя провоспалительные молекулы (рис. 5). Воспаленная ткань блокирует выход паразита из места проникновения в остальной организм и привлекает новые клетки иммунитета к месту повреждения.

Рисунок 5. Фагоцит пожирает бактерии.
Если врожденному иммунитету не удается уничтожить захватчиков, в дело вступает адаптивный иммунитет. Происходит это отнюдь не сразу: активации адаптивного ответа предшествуют 3–4 дня подготовки в лимфоузлах (при этом лимфоузлы увеличиваются в размерах, что является признаком инфекционного заболевания). Начинается все с того, что некоторые из клеток врожденного иммунитета прибывают в лимфоузел, неся на себе антигены из места поражения. Антигенами в данном случае выступают короткие (от 8 до 20 аминокислот) пептиды из белков инфекционного агента и окружающих тканей. По сути, макрофаг (или специализированный активатор адаптивного иммунитета — дендритная клетка) просто захватывает из места воспаления образцы растворенных белков, ошмётков паразита и погибших клеток и приносит в лимфоузел.
В лимфоузле его встречают наивные (неактивированные) клетки адаптивного иммунитета — Т-лимфоциты. Каждый лимфоцит, выйдя из места своего формирования, несет на себе уникальный рецептор, который формируется путем направленного внесения мутаций в геном. Заранее неизвестно, может ли этот рецептор распознать какой-либо антиген, но его вариантов так много (по некоторым оценкам, у нас может быть до 10 48 разных типов этого рецептора, но большая часть их будет нефункциональна), что в течение нескольких часов в лимфоузле обнаруживается как минимум несколько клеток, способных распознать антигены паразита. Затем эти клетки делятся, активируются и отправляются в поврежденную ткань, где отыскивают свои антигены и уничтожают как самих захватчиков, так и зараженные клетки, если мы говорим о вирусе или внутриклеточной бактерии (рис. 6).

Рисунок 6. Т-лимфоциты (красные) убивают раковую клетку (синяя) своего же организма. После получения сигнала раковая клетка начинает распадаться на небольшие пузырьки, которые затем съедят клетки врожденного иммунитета.
Иммунологическая толерантность
Иммунная система — единственная из систем организма, в чью задачу входит уничтожение других живых существ — отдельных клеток или многоклеточных организмов. Причем наши собственные клетки тоже часто должны уничтожаться, если они заражены вирусом, бактерией или превратились в раковые. При этом необходимо избегать иммунного ответа на нормальные клетки. Если такой ответ развивается — возникает аутоиммунное заболевание.
Периферическая толерантность возникает, когда Т-лимфоцит распознает антиген в лимфоузлах, но никакого воспаления в месте, откуда этот антиген попал в лимфоузел, нет. Напротив, высока концентрация противовоспалительных молекул. Такой лимфоцит опять-таки или уничтожается, или превращается в регуляторный.
Паразиты и симбионты
Миллиарды лет эволюции крупные многоклеточные организмы были домом и едой для более мелких одноклеточных и многоклеточных. Человек тут не исключение — ведь мы являемся как хорошим источником пищи, так и отличным защитником для всего, что сумеет поселиться внутри нас или на нас.
Эволюция поделила этих сожителей на 2 большие группы — паразиты и симбионты. Паразиты делают ставку на быстрое размножение. У них есть возможность подавления врожденного иммунитета, а пока адаптивный активируется, они уже успевают размножиться за счет наших ресурсов и передать инфекцию дальше. Так действует, например, вирус гриппа или бактериальная пневмония.
Симбионты же научились подавлять как врожденный, так и адаптивный иммунитеты. Для этого им пришлось умерить свои аппетиты — если клетки организма постоянно повреждаются, то никакие уловки не смогут предотвратить активацию иммунитета. Потому они поселились на поверхностях нашего тела, прежде всего на поверхности ЖКТ, где они получают лишь часть нашей пищи, но не покушаются на сам организм.
Помимо этого, они научились подавлять воспаление, выделяя вещества, которые похожи на наши противовоспалительные молекулы. Макрофаги врожденного иммунитета, столкнувшись с такими бактериями, могут почувствовать антигены клеточной стенки, но не активируются, так как подавлены противовоспалительным фоном вокруг.
Третьим механизмом защиты стала антигенная мимикрия. Для адаптивного иммунитета основным антигеном являются пептиды из белков. И многие наши симбионты в ходе эволюции поменяли свой белковый состав так, чтобы в нем был максимум пептидов, похожих на наши. Таким образом они встают под защиту регуляторных лимфоцитов. Этот механизм характерен для всех видов наших сожителей — бактерий, червей (рис. 7), вирусов и так далее.

Рисунок 7. Власоглав — один из гельминтов, активно изучаемых в рамках гигиенической гипотезы.
В течение миллионов лет каждая особь нашего вида, рождаясь, сразу же вступала в контакт с симбионтами, населявшими кожу, слизистые и кишечники своих собратьев. Со временем организм научился извлекать выгоду из такого постоянного неустранимого сосуществования. В частности, способность бактерий и червей создавать сильный противовоспалительный фон в месте своего обитания стала за это время ключевым фактором создания периферической толерантности. Она распространилась как на антигены самих сожителей, так и на сопутствующие им — антигены пищи (в кишечнике), пыли и пыльцы (в легких) и собственного организма (те самые антигены, которые сожители развили в ходе антигенной мимикрии).
И снова гигиеническая гипотеза
Особенно сильно на риск развития таких заболеваний влияет первый год жизни. Если в этот период ребенок оказывается в деревне, проводит некоторое время в больших группах сверстников (в больнице или в детском саду) и вообще чаще встречается с инфекциями — риск развития аутоиммунных заболеваний серьезно снижается [11], [12].
Разумеется, не только микробиом (совокупность всех симбиотических микроорганизмов конкретного человека) [13] и гельминты влияют на риск развития аутоиммунных и аллергических реакций. Есть и генетическая предрасположенность, и условия, в которых человек впервые встречается с тем или иным внешним антигеном. Есть некоторые микроорганизмы, которые не защищают, а, напротив, провоцируют аутоиммунные заболевания. Например, стрептококк способен вызывать ревматизм, а некоторые стафилококки производят суперантиген, который неспецифически запускает все клоны Т-лимфоцитов с любым рецептором — это тоже может привести к аутоиммунным заболеваниям.
| Заболевание | Количество исследований | Общее количество пациентов | Результаты |
|---|---|---|---|
| Болезнь Крона | 6 | 543 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Неспецифический язвенный колит | 3 | 192 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Рассеянный склероз | 6 | 156 | Показана безопасность, статистически значимые улучшения у части пациентов. |
| Непереносимость глютена (целиакия) | 2 | 35 | Исследования только начались |
| Расстройства аутического спектра | 3 | 90 | Пилотное исследование показало эффективность, подтверждающие только начаты |
| Псориаз | 3 | 55 | Исследования только начались |
| Аллергия на арахис | 1 | 18 | Исследования только начались |
| Бронхиальная астма | 1 | 32 | Зафиксированы статистически недостоверные улучшения |
| Аллергический риноконъюнктивит | 2 | 130 | Эффективность не показана |
| Ревматоидный артрит | 1 | 50 | Исследование только началось |
Что же делать нам, простым смертным, пока ученые по кусочкам разбирают эту тайну и ищут решение? Начать стóит со снижения маниакального стремления к чистоте во всем. Я не предлагаю не мыть руки перед едой. Но довольно часто в последнее время мы перегибаем палку. Антибиотики при каждом чихе, асептические спиртосодержащие гели каждые 10 минут, антибактериальное мыло вместо обычного в ванной. Все эти меры способны спасти вас от эпидемии. Но каждодневное их применение, особенно детьми, способно нанести куда больший урон, чем грипп или пищевое отравление.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Читайте также:

