Системная красная волчанка и болезнь шегрена
Обновлено: 19.04.2024
Рассмотрены вопросы поражения легких при системной красной волчанке, ревматоидном артрите, системной склеродермии, полимиозите/дерматомиозите, синдроме Шегрена, смешанном заболевании соединительной ткани, гранулематозе Вегенера, синдроме Черджа–Стросса, с
Aspects of lungs lesion with exanthematous lupus erythematosus, rheumatoid arthritis, Addison’s keloid, polymyositis/dermatomyositis, Sj?gren’s sicca syndrome, mixed connective tissue disease, necrotizing respiratory granulomatosis, Churg–Strauss syndrome, Goodpasture’s syndrome and Bechterew’s disease have been analysed.
В основе поражения легких (ПЛ) при системных аутоиммунных заболеваниях (САЗ) лежат расстройства механизмов иммунорегуляции и гиперреактивность организма. Макрофаги и лимфоциты являются ключевыми клетками, участвующими в инициации и сохранении иммунного ответа в легких. Альвеолярные макрофаги — резиденты легочной ткани — поглощают чужеродные агенты, проникшие через слизистые поверхности легких и бронхов. Кроме того, эти клетки служат в качестве антигенпредставляющих клеток для Т-лимфоцитов. Относительно небольшое число лимфоцитов присутствуют в нормальной паренхиме легких. Однако после стимуляции соответствующим антигеном окружающей лимфоидной ткани лимфоциты мигрируют в легкие и принимают участие в воспалительной реакции.
Проведение специальных исследований, включавших компьютерную томографию высокого разрешения (КТВР) и биопсию легкого, выявило, что при САЗ встречаются различные гистологические формы поражения интерстиция легких (табл.).
Системная красная волчанка
Системная красная волчанка (СКВ) — системное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов.
Ревматоидный артрит
Ревматоидный артрит (РА) — системное аутоиммунное заболевание соединительной ткани с преимущественным поражением суставов по типу хронического прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями.
ПЛ при РА было впервые описано в 1948 г., когда Эллман и Болл установили диффузный фиброз легких у трех пациентов. Легочные проявления при РА включают поражение плевры, образование ревматоидных узелков в легких, ИПЛ, легочный васкулит, альвеолярные кровоизлияния, бронхообструктивные изменения. Почти у половины больных РА при вскрытии выявляется плеврит. Экссудативный плеврит может быть односторонним или двусторонним и сохраняться в течение многих месяцев. Наличие плеврального выпота вызывает нарушение легочной функции. Как правило, плевральная жидкость бывает экссудативной с низким содержанием глюкозы и низким уровнем комплемента. Чаще у пациентов с РА встречается сухой плеврит и является находкой при рентгенологическом исследовании.
Ревматоидные узелки (РУ), как единичные, так и множественные, могут быть обнаружены в легочной паренхиме больных РА. РУ легких у пациентов с РА были впервые описаны Каплан в 1953 г. РУ могут появиться до, во время или после начала РА. ИПЛ характеризуется хроническим воспалением стенок альвеол и скоплением больших мононуклеарных клеток в альвеолах. Довольно часто у больных РА встречается сочетание ИПЛ и подкожных ревматоидных узелков. Прогноз для пациентов с РА с ИПЛ неблагоприятен. Легочный васкулит является одним из редких легочных проявлений РА. Альвеолярные кровоизлияния, не часто встречающиеся у больных РА, приводят к кровохарканью и анемии. У пациентов с РА отмечается высокая частота поражения бронхов. ПЛ может быть результатом токсического воздействия препаратов, используемых в терапии РА. Для того чтобы обеспечить оптимальный эффект от лечения, врач всегда должен учитывать возможную легочную патологию при оценке состояния пациентов с РА [1–3].
Системная склеродермия
Системная склеродермия (ССД) — диффузное заболевание соединительной ткани с прогрессирующим фиброзом, распространенными вазоспастическими нарушениями и характерными изменениями кожи, опорно-двигательного аппарата и внутренних органов. Среди висцеральных проявлений ССД ПЛ занимает важное место.
Плеврит при ССД наблюдается реже, чем при РА и СКВ. В то же время у больных ССД значительно выше частота ИПЛ, при этом морфологическое исследование показывает выраженный фиброз интерстициальной ткани и утолщение межальвеолярных перегородок. Исследование функции внешнего дыхания (ФВД) демонстрирует снижение диффузионной способности легких (ДСЛ) даже при отсутствии каких-либо клинических симптомов и рентгенологических изменений.
У пациентов с ССД выявляется рестриктивный тип нарушения вентиляции легких. У большинства больных ССД с ЛФ наблюдается гистологическая картина обычной интерстициальной пневмонии (ОИП), однако во многих случаях встречается гистопатологический тип неспецифической интерстициальной пневмонии (НИП).
Развитие ЛФ инициируется микрососудистыми изменениями, которые приводят к повреждению эндотелиальных клеток и поражению альвеолярного эпителия. Это приводит к активации каскада свертывания (рис.).
Экспрессия аутоантител является предиктором поражения внутренних органов, в частности ПЛ. Наличие антител к Scl-70 (антисклеродермальные антитела с молекулярной массой 70 кДа, антитела к топоизомеразе I) в значительной степени является фактором риска развития ИПЛ, в то время как антицентромерные антитела (АЦА) говорят о низкой вероятности развития рентгенологических признаков ЛФ.
У пациентов с ССД встречается легочная гипертензия (ЛГ). ЛГ может быть изолированной, возникшей вследствие поражения сосудов, или вторичной — при поражении паренхимы легких или левых отделов сердца. ЛГ развивается у 5–7% больных, чаще на поздних стадиях лимитированной формы ССД. Предиктор ЛГ — изолированное уменьшение ДСЛ. Более редко встречаются аспирационная пневмония, причиной которой является дисфункция пищевода, а также спонтанный пневмоторакс, лекарственный пневмонит [1–3, 6–8].
Полимиозит/дерматомиозит
Полимиозит/дерматомиозит (ПМ/ДМ) — группа хронических диффузных заболеваний поперечнополосатой мускулатуры, основным проявлением которых выступает мышечная слабость.
Около 40% пациентов с ПМ/ДМ имеют патологию легочной системы. Одной из причин этого является поражение мышц. Поражение межреберных мышц и высокое стояние диафрагмы приводят к уменьшению экскурсии грудной клетки и появлению вентиляционных нарушений по рестриктивному типу. В отличие от других САЗ, ПЛ при ПМ/ДМ не затрагивает в первую очередь дыхательные пути или плевру. Наиболее распространенной патологией является аспирационная пневмония, которая возникает по причине слабости мышц глотки и верхней трети пищевода.
Болезнь Шегрена
Болезнь Шегрена (БШ) — системное аутоиммунное заболевание неизвестной этиологии, характеризуется поражением секретирующих эпителиальных желез, с вовлечением преимущественно слюнных и слезных желез (ксеростомия, ксерофтальмия).
Поражение экзокринных желез верхних дыхательных путей часто приводит к сухости носовых ходов и бронхов. Наиболее распространенным проявлением ПЛ, связанным с БШ, является лимфоцитарный пневмонит, поражающий нижние доли. У пациентов с БШ может развиться плеврит (с или без выпота), ИПЛ с очагами лимфоидной инфильтрации. При развитии неходжкинских лимфом метастатические поражения легких встречаются часто, реже наблюдают формирование MALT-ткани (mucosal-associated lymphoid tissue) с развитием первичной MALT-лимфомы [1–3, 12, 13].
Смешанное заболевание соединительной ткани
Смешанное заболевание соединительной ткани (синдром Шарпа) (CЗСТ) — аутоиммунное заболевание, характеризующееся наличием отдельных признаков СКВ, ССД, РА, ПМ/ДМ в сочетании с высоким титром антител к экстрагируемому ядерному антигену — U1-RNP.
ИПЛ и ЛГ довольно часто встречаются у больных с СЗСТ, при этом нередко имеют субклиническое течение. Обследование пациентов с СЗСТ показало повышение уровня иммунных комплексов (ИК) и увеличение потребления комплемента. ИК-опосредованное повреждение альвеолярно-капиллярной мембраны и легочной ткани может играть важную роль в патогенезе ИПЛ при СЗСТ. При исследовании показателей функции внешнего дыхания больные с СЗСТ демонстрируют снижение диффузионной способности легких (ДСЛ) и рестриктивный тип нарушения вентиляции. Прогноз ИПЛ у пациентов с СЗСТ более благоприятный, чем при РА и ССД. ЛГ является основной причиной смерти больных с СЗСТ [1–3, 14, 15].
Гранулематоз Вегенера
Гранулематоз Вегенера (ГВ) — системный некротический васкулит мелких вен и артерий с образованием гранулем в сосудистых стенках и окружающих тканях дыхательных путей, почек и других органов.
ПЛ развивается у большинства пациентов с ГВ. Клинические проявления ПЛ при ГВ разнообразны, начиная от бессимптомных узелков в легких и кончая фульминантным альвеолярным кровотечением. ГВ может сопровождаться образованием опухолевидных инфильтратов с неровными краями, которые могут распадаться и образовывать полости. Плеврит, легочное кровотечение и увеличение лимфатических узлов средостения встречаются редко. Поражение трахеальных или бронхиальных стенок обычно проявляется гранулематозным утолщением слизистой оболочки или подслизистого слоя, при этом возникает обструктивный тип нарушения вентиляции легких. Частое осложнение — коллапс бронхов и постобструктивная пневмония. Инфильтраты, которые могут увеличиваться и уменьшаться, первоначально часто неправильно диагностируются как пневмония. Примерно в 20% случаев развивается прогрессирующая легочная недостаточность, связанная с ЛФ, пневмонией или пневмонитом, индуцированным циклофосфамидом. ДСЛ, как правило, уменьшена, но при развитии диффузных альвеолярных геморрагий наблюдают ее рост. Описаны случаи развития бронхоплевральных свищей [1–3].
Синдром Чарджа–Стросса
Синдром Чарджа–Строса (СЧС) — эозинофильное, гранулематозное воспаление респираторного тракта и некротизирующий васкулит, поражающий мелкие и средние сосуды, часто сочетающийся с астмой и эозинофилией.
Легкие — это наиболее поражаемый орган при данном синдроме; более 90% пациентов с синдромом СЧС в анамнезе имеют астму. При рентгенологическом исследовании легких выявляются очаги консолидации, распределяющиеся по периферии, которые часто бывают преходящими. Могут появляться узелки, при распаде не образующие полости. Другие менее распространенные проявления ПЛ включают утолщение междольковой перегородки и утолщение бронхиальной стенки. Плевральные выпоты образуются редко.
Существуют три фазы развития СЧС: продромальная фаза, которая характеризуется наличием аллергических заболеваний (как правило, астма или аллергический ринит), может продолжаться от нескольких месяцев до многих лет; эозинофилия/фаза инфильтрации тканей, в которой может наблюдаться удивительно высокая периферическая эозинофилия, а также инфильтрация эозинофилами тканей легких, желудочно-кишечного тракта и других органов; васкулитная фаза, в которой некротический васкулит поражает широкий спектр органов — сердце, легкие, периферические нервы и кожу. Диагноз приходится верифицировать с другими васкулитами, в первую очередь ГВ [1–3].
Синдром Гудпасчера
Синдром Гудпасчера (СГ) (геморрагический легочно-почечный синдром) — прогрессирующее аутоиммунное заболевание легких и почек, характеризующееся образованием антител к базальным мембранам капилляров клубочков почек и альвеол и проявляющееся сочетанием легочных и почечных геморрагий.
Патоморфологически в легких наблюдается картина венулитов, артериолитов, капилляритов с выраженными явлениями деструкции и пролиферации; поражение капилляров наблюдается преимущественно в межальвеолярных перегородках, развивается альвеолит с геморрагическим экссудатом в альвеолах.
В большинстве случаев ПЛ и почек происходит одновременно. Клинические проявления ПЛ включают в себя кашель, одышку и кровохарканье, которое может появляться на несколько месяцев раньше признаков поражения почек. В развитии альвеолита при СГ огромное значение имеет активация альвеолярных макрофагов. В активированном состоянии они выделяют около 40 цитокинов. Цитокины I группы (хемотаксины, лейкотриены, интерлейкин-8) усиливают поступление полиморфноядерных лейкоцитов в легкие. Цитокины II группы (факторы роста — тромбоцитарный, макрофагальный) способствуют перемещению в легкие фибробластов. Альвеолярные макрофаги продуцируют также активные формы кислорода, протеазы, повреждающие легочную ткань.
Исследование жидкости бронхоальвеолярного лаважа (ЖБАЛ) не является диагностическим при СГ, но может использоваться для подтверждения наличия диффузной альвеолярной геморрагии у пациентов с гломерулонефритом и легочными инфильтратами, но без кровохарканья. ЖБАЛ, которая остается геморрагической после многократных промываний, позволяет подтвердить диффузный геморрагический синдром, особенно при сопутствующем снижении гематокрита.
Гистологическое и иммунологическое исследование биоптатов легочной ткани при СГ характеризуется признаками геморрагического альвеолита, гемосидероза и интерстициального фиброза, а также линейных отложений иммуноглобулина G (IgG) и С3-компонента комплемента на базальных мембранах легочных альвеол.
Рентгено-компьютерное исследование легких при СГ демонстрирует наличие легочных инфильтратов в прикорневой области с распространением на нижние и средние отделы легких. Исследование легочных тестов выявляет рестриктивный тип нарушения вентиляции легких (снижение жизненной емкости легких — ЖЕЛ), но по мере прогрессирования заболевания присоединяются обструктивные изменения (снижение объема форсированного выдоха за 1 сек — ОФВ1, индекса Тиффно) [1–3].
Болезнь Бехтерева (анкилозирующий спондилит)
Болезнь Бехтерева (ББ, анкилозирующий спондилит, АС) — хроническое системное заболевание, характеризующееся воспалительным поражением суставов позвоночника, околопозвоночных тканей и крестцово-подвздошных сочленений с анкилозированием межпозвоночных суставов и развитием кальцификации спинальных связок.
ПЛ у больных АС встречается в 50–85% случаев и обусловлено анкилозирующим процессом в грудном отделе позвоночника, снижением дыхательной экскурсий грудной клетки, утомлением и слабостью дыхательных мышц. У больных АС чаще всего развивается эмфизема легких, затем ИПЛ, хроническая обструктивная болезнь легких (ХОБЛ), апикальный фиброз, бронхоэктазия и поражение плевры. Апикальный пневмофиброз, который встречается нечасто (3–4%), требует проведения дифференциальной диагностики с туберкулезными изменениями. Фиброз верхней доли легкого обычно протекает бессимптомно, но может вызывать кашель, отделение мокроты и одышку.
При АС чаще встречается рестриктивный тип нарушения вентиляции легких. У больных АС с хронической обструктивной болезнью легких (ХОБЛ) исследование ФВД демонстрирует обструктивные вентиляционные изменения [1, 16, 17].
Заключение
Таким образом, при САЗ могут наблюдаться различные типы легочной патологии. Развитие ПЛ обусловлено особенностями патофизиологических характеристик основного заболевания. Основные легочные проявления САЗ включают заболевания плевры, ИПЛ, поражение бронхиального дерева. При РА и СКВ чаще, чем при других САЗ, встречается поражение плевры. ИПЛ в настоящее время все больше признается как самое частое и серьезное проявление САЗ. ПЛ у больных с САЗ оказывает существенное негативное воздействие на качество жизни (КЖ): у больных снижаются показатели КЖ, характеризующие физический, психоэмоциональный статус и социальную активность.
ПЛ при САЗ имеет большое значение в формировании облика заболевания, при этом во многом определяет его тяжесть и прогноз. Наряду с базисной терапией САЗ, ПЛ необходимо рассматривать как важную мишень для терапевтического воздействия.
Литература
- Ревматология, национальное руководство. Под ред. Е. Л. Насонова, В. А. Насоновой. М.: ГЭОТАР-Медиа, 2008.
- Castelino F. V., Varga J. Interstitial lung disease in connective tissue diseases: evolving concepts of pathogenesis and management // Arthritis Research & Therapy. 2010; 12: 213.
- Bouros D., Pneumatikos I., Tzouvelekis A. Pleural involvement in systemic autoimmune disorders // Respiration. 2008; 75: 361–371.
- Kriegel M. A., Van Beek C., Mostaghimi A. et al. Sterile empyematous pleural effusion in a patient with systemic lupus erythematosus: a diagnostic challenge // Lupus. 2009; 18: 581–585.
- Pego-Reigosa J. M., Medeiros D. A., Osenberg D. A. Respiratory manifestations of systemic lupus erythematosus: old and new concepts // Best Pract Res Clin Rheumatol. 2009; 23: 460–480.
- Varda J., Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder // J Clin Invest. 2007; 117: 557–567.
- Yanaba K., Hasegawa M., Takehara K. et al. Comparative study of serum surfactant protein-D and KL-6 concentrations in patients with systemic sclerosis as markers for monitoring the activity of pulmonary fibrosis // J Rheumatol. 2004; 31: 1112–1120.
- McNearney T. A., Revelle J. D., Fischbach M. et al. Pulmonary involvement in systemic sclerosis: associations with genetic, serologic, sociodemographic, and behavioral factors // Arthritis Rheum. 2007; 57: 318–326.
- Tillie-Leblond I., Wislez M., Valeyre D. et al. Interstitial lung disease and anti-Jo-1 antibodies: difference between acute and gradual onset // Thorax. 2008; 63: 53–59.
- Chen I. J., Jan Wu Y. J., Lin C. W. et al. Interstitial lung disease in polymyositis and dermatomyositis // Clin Rheumatol. 2009; 28: 639–646.
- Fujisawa T., Suda T., Nakamura Y. et al. Differences in clinical features and prognosis of interstitial lung diseases between polymyositis and dermatomyositis // J Rheumatol. 2005; 32: 58–64.
- Ito I., Nagai S., Kitaichi M. et al. Pulmonary manifestations of primary Sjögren’s syndrome: a clinical, radiologic, and pathologic study // Am J Respir Crit Care Med. 2005; 171: 632–638.
- Parambil J. G., Myers J. L., Lindell R. M. et al. Interstitial lung disease in primary Sjögren’s syndrome // Chest. 2006; 130: 1489–1495.
- Bodolay E., Szekanecz Z., Devenyi K. et al. Evaluation of interstitial lung disease in mixed connective tissue disease (MCTD) // Rheumatol. 2005; 44: 656–661.
- Kinder B. W., Shariat C., Collard H. R. et al. Undifferentiated connective tissue disease-associated interstitial lung disease: changes in lung function // Lung 2010; 188: 143–149
- Quismorio F. P. Jr. Pulmonary involvement in ankylosing spondylitis // Curr Opin Pulm Med. 2006; 12: 342–345.
- Lee C. C., Lee S. H., Chang I. J. et al. Spontaneous pneumothorax associated with ankylosis spondylitis // Rheumatol. 2005; 44: 1538–1541.
Д. В. Бестаев 1 , кандидат медицинских наук
Е. Л. Насонов, доктор медицинских наук, профессор, академик РАН
Скидки для друзей из социальных сетей!
Эта акция - для наших друзей в "Одноклассниках", "ВКонтакте", "Яндекс.Дзене", YouTube и Telegram! Если вы являетесь другом или подписчиком стр.
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Мы в Telegram и "Одноклассниках"
У женщин болезнь Шёгрена встречается намного чаще, чем у мужчин (в 9 из 10 случаев), причем, как правило, это касается женщин после менопаузы. Однако в целом заболевание поражает людей любого пола и возраста. Общемировой статистики нет, но в развитых странах, включая Россию, заболеваемость оценивается в миллионах, болезнь Шёгрена - одно из самых распространённых ревматических заболеваний.
При болезни Шёгрена иммунитет человека воспринимает клетки собственного организма как чужие и начинает их медленно и планомерно уничтожать. Клетки иммунной системы попадают в ткани желез внешней секреции (слезные, слюнные, бартолиниевы железы влагалища), поражают их, и те начинают выделять меньше соответствующего секрета (слюны, слез и т.д.).
Кроме того, болезнь нередко затрагивает и иные органы, провоцируя артралгии, боли в суставах, мышцах (полимиозит), одышку и т.д.
Есть также синдром Шёгрена (вторичное воспаление слюнных и слезных желез), который сопутствует ревматоидному артриту, диффузным болезням соединительной ткани, заболеваниям желчевыводящей системы и другим аутоиммунным заболеваниям.

Диагностика болезни Шёгрена

Причины развития
Другим фактором появления заболевания является генетическая предрасположенность. Иногда, если эта болезнь есть у матери, то она может быть выявлена и у дочери. Изменения в гормональном фоне женщины тоже могут спровоцировать болезнь.
Синдром Шёгрена обычно развивается на фоне других системных заболеваний (напр., при ревматоидном артрите и системной красной волчанке).
Клиническая картина болезни Шёгрена
Все симптомы болезни Шёгрена можно условно разделить на железистые и внежелезистые.
Железистые симптомы болезни Шёгрена
Железистые симптомы болезни проявляются в снижении выработки секретов желез.
Второй постоянный признак болезни Шёгрена - воспаление слюнных желез, которое переходит в хроническую форму. Больной жалуется на сухость во рту и увеличение слюнных желез. В начале болезни отмечается небольшая или непостоянная сухость во рту, которая появляется только в результате волнения или физической нагрузки. Затем сухость во рту становится постоянной, слизистая оболочка и язык чрезмерно сохнут, приобретают ярко розовый цвет и часто воспаляются, быстро прогрессирует зубной кариес.
Поздняя стадия болезни характеризуется сильной сухостью во рту, человеку становится очень сложно разговаривать, проглатывать твердую пищу, не запивая ее водой. На губах появляются трещины. Может появиться хронический атрофический гастрит с недостаточностью секреции, которая сопровождается отрыжкой, тошнотой, снижением аппетита. У каждого третьего больного на поздней стадии отмечается увеличение околоушных желез.
Наблюдается поражение желчных путей (холецистит), печени (гепатит), поджелудочной железы (панкреатит).
На поздней стадии заболевания становится очень сухой носоглотка, в носу образуются сухие корочки, может развиться отит и снижение слуха. Из-за сухости в гортани появляется осиплость голоса.
Появляются вторичные инфекции: часто рецидивирующие синуситы, трахеобронхиты, пневмонии. У каждой третьей больной наблюдается воспаление половых органов. Слизистая оболочка красная, воспаленная.
Эта акция - для наших друзей в "Одноклассниках", "ВКонтакте", "Яндекс.Дзене", YouTube и Telegram! Если вы являетесь другом или подписчиком стр.
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Какие заболевания лечит ревматолог?
Мы в Telegram и "Одноклассниках"
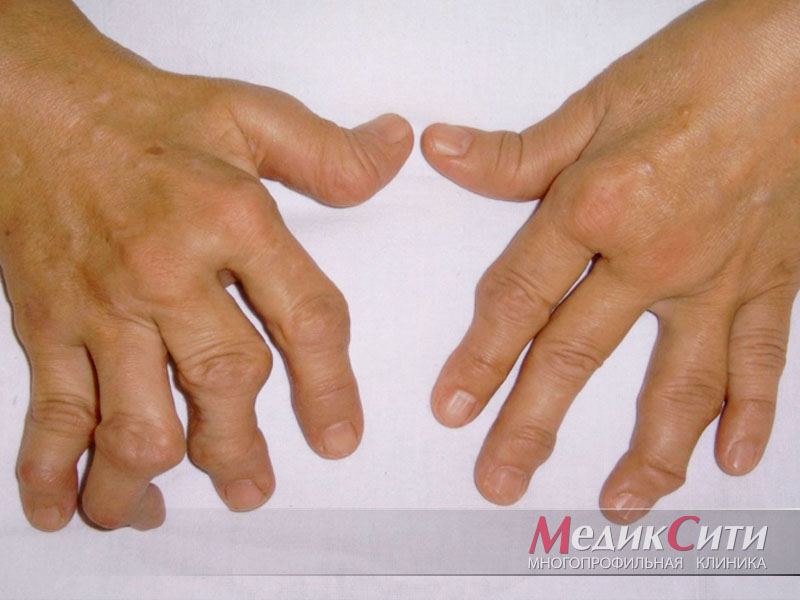
Красная волчанка – одно из самых сложных системных заболеваний, при котором иммунная система начинает атаковать собственные клетки организма. При красной волчанке поражаются в первую очередь кожа, суставы, клетки крови и почки, но могут поражаться многие другие органы.
Красную волчанку нередко сопровождают кожный васкулит, артрит, нефрит, панкардит (воспаление тканей сердца), плеврит и другие нарушения.
Свое название болезнь получила благодаря внешнему сходству высыпаний на лице со следами от укусов волка. Заболевание не заразно.
Существует 2 формы красной волчанки: дискоидная красная волчанка (хроническое заболевание, поражающее кожу) и системная красная волчанка (СКВ) – системное аутоиммунное заболевание, приводящее к воспалению многих внутренних органов.
Можно сказать, что красная волчанка - заболевание больше женское, чем мужское. 90% заболевших красной волчанкой – это женщины детородного возраста от 20 до 45 лет. Заболевание очень распространено среди жительниц Азии и коренного населения Америки, у афроамериканок.

Диагностика и лечение красной волчанки
История болезни системной красной волчанки
Через 45 лет венгерский врач–дерматолог Мориц Капоши (Kaposhi) , отметил, что красная волчанка приводит не только к поражению кожи, но и к воспалению внутренних органов.
Затем в 1890 году английский врач Уильям Ослер (Osler) сделал важное наблюдение о том, что иногда СКВ может протекать и без кожных проявлений.
В 1948 году были обнаружены так называемые Le-клетки - специфические клетки красной волчанки, а еще через 6 лет были открыты антитела, направленные на клетки собственного организма. Это открытие легло в основу создания чувствительных тестов для диагностики СКВ.
Причины системной красной волчанки
Точная причина, по которой одни люди заболевают системной красной волчанкой, а другие нет, неизвестна. Но ученые предполагают, что это заболевание имеет генетическую предрасположенность. Например, нередки случаи, когда красной волчанкой заболевали члены одной семьи.
Спусковым крючком к началу болезни могут стать несколько факторов:
- прием некоторых лекарственных средств: антибиотиков, сульфаниламидов, вакцин;
- изменение соотношения уровня гормонов (андрогенов и эстрогенов);
- длительное пребывание на солнце;
- переохлаждение организма; ;
- длительный стресс.
Кроме того, есть предположение, что заболевание может быть спровоцировано вирусной инфекцией.
Симптомы системной красной волчанки
Если дискоидная красная волчанка поражает в основном кожу, то системная красная волчанка - более серьезное, системное заболевание, приводящее к воспалению не только кожи, но и многих внутренних органов.
Американская коллегия ревматологов разработала систему критериев для диагностики СКВ. Выявление у пациента хотя бы 4 из 11 признаков говорит о, том, что это системное заболевание - красная волчанка.
Вот эти симптомы:
- появление сыпи красного цвета (в форме бабочки) на носу и щеках, покраснение в зоне декольте и на тыльной стороне кисти руки;
- возникновение чешуек дисковидной формы на лице, волосистой части головы, на груди;
- повышенная чувствительность кожи к солнечному воздействию;
- появление язв в ротоглотке;
- болезненность и припухлость в суставах, скованность движений;
- поражение серозной оболочки легких, сердца, брюшины; ;
- нарушение функций центральной нервной системы (беспричинные судороги, подавленность и др.);
- гематологические нарушения (уменьшение количества клеток крови);
- иммунологические нарушения (возможно появление вторичных инфекций);
- образование антиядерных антител (действие иммунной системы против клеток своего организма).
Помимо этих симптомов системной красной волчанки, у больных могут также наблюдаться лихорадка, выпадение волос, вплоть до полного облысения, мышечные боли, снижение или повышение аппетита, возможны тошнота, рвота, диарея и другие признаки.
Иногда заболевание красной волчанкой может начаться с синдрома Рейно, когда у человека в результате переохлаждения или стресса начинает резко белеть и неметь пальцы рук, ушные раковины, кончик носа.
Каждый пятнадцатый человек, заболевший системной красной волчанкой, имеет признаки синдрома Шегрена (сухость глаз, рта). У женщин возможна сухость влагалища.
При дальнейшем развитии болезни будут чередоваться периоды обострения и ремиссии, а тем временем в воспалительный процесс вовлекается все большее количество органов и систем организма.
Скидки для друзей из социальных сетей!
Эта акция - для наших друзей в "Одноклассниках", "ВКонтакте", "Яндекс.Дзене", YouTube и Telegram! Если вы являетесь другом или подписчиком стр.
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Какие заболевания лечит ревматолог?
Мы в Telegram и "Одноклассниках"
Подагра: диагностика и лечение
"Men's Health", медицинский блог (август 2016г.)
Если ваши суставы опухают и болят по ночам, врач-ревматолог предложит вам проверить ревматологический профиль. Это обследование поможет поставить точный диагноз, проследить динамику заболевания и назначить правильное лечение.
При подозрении на ревматическую болезнь используют следующие исследования:
- анализ крови на уровень мочевой кислоты;
- анализ крови на антинуклеарные антитела;
- исследование крови на ревматоидный фактор;
- исследование крови на АЦЦП (антитела к циклическому цитруллин-содержащему пептиду);
- анализ крови на С-реактивный белок.
Анализ крови на уровень мочевой кислоты
Мочевая кислота – это окончательный продукт распада пуринов. Ежедневно человек получает пурины вместе с продуктами питания, преимущественно с мясными продуктами. Затем с помощью определенных ферментов, пурины перерабатываются с образованием мочевой кислоты.
В нормальных физиологических количествах мочевая кислота нужна организму, она связывает свободные радикалы и защищает здоровые клетки от окисления. Кроме того, она так же, как и кофеин, стимулирует клетки головного мозга. Однако повышенное содержание мочевой кислоты имеет вредные последствия, в частности может приводить к подагре и некоторым другим заболеваниям.
Исследование уровня мочевой кислоты дает возможность диагностировать нарушение обмена мочевой кислоты и связанные с этим заболевания.


Когда нужно провести обследование:
- при впервые возникшей атаке острого артрита в суставах нижних конечностей, возникшей без очевидных причин;
- при рецидивирующих атаках острого артрита в суставах нижних конечностей;
- если у вас в роду есть родственники страдающие подагрой;
- при сахарном диабете, метаболическом синдроме;
- при мочекаменной болезни;
- после проведения химиотерапии и/или лучевой терапии злокачественных опухолей (и особенно лейкозов);
- при почечной недостаточности (почки выводят мочевую кислоту);
- в рамках общего ревматологического обследования, необходимого для выяснения причины воспаления сустава;
- при продолжительном голодании, посте;
- при склонности к чрезмерному употреблению спиртных напитков.
Уровень мочевой кислоты
Уровень мочевой кислоты определяют в крови и в моче.
Мочевая кислота в крови называется урекемия, в моче – урикозурия. Повышенное содержание мочевой кислоты – гиперурикемия, пониженный уровень мочевой кислоты – гипоурикемия. Патологическое значение имеет только гиперурикемия и гиперурикозурия.
Концентрация мочевой кислоты в крови зависит от следующих факторов:
- количества пуринов, поступающих в организм с едой;
- синтеза пуринов клетками организма;
- образования пуринов вследствие распада клеток организма из-за болезни;
- функции почек, выводящих мочевую кислоту вместе с мочой.
В обычном состоянии наш организм поддерживает уровень мочевой кислоты в норме. Увеличение ее концентрации так или иначе связано с обменными нарушениями.
Нормы содержания мочевой кислоты в крови
У мужчин и женщин может наблюдаться различная концентрация мочевой кислоты в крови. Норма может зависеть не только от пола, но и возраста человека:
- у новорожденных и детей до 15 лет – 140-340 мкмоль/л;
- у мужчин до 65 лет – 220-420 мкмоль/л;
- у женщин до 65 лет – 40- 340 мкмоль/л;
- у женщин старше 65 лет – до 500 мкмоль/л.
Если превышение нормы происходит в течение длительного времени, то кристаллы соли мочевой кислоты (ураты) откладываются в суставах и тканях, вызывая различные болезни.
Гиперурикемия имеет свои признаки, но может протекать и бессимптомно.
Причины повышения содержания мочевой кислоты:
- прием некоторых лекарственных препаратов, например мочегонных;
- беременность;
- интенсивные нагрузки у спортсменов и людей, занимающихся тяжелым физическим трудом;
- длительное голодание или употребление продуктов, содержащих большое количество пуринов;
- некоторые болезни (например, эндокринные), последствия химиотерапии и облучения;
- нарушенный обмен мочевой кислоты в организме из-за дефицита некоторых ферментов;
- недостаточное выделение мочевой кислоты почками.
Как снизить концентрацию мочевой кислоты
Те, кто болен подагрой, знают, сколько неприятностей может доставить повышенная концентрация мочевой кислоты. Лечение этого недуга должно быть комплексным и обязательно включать прием препаратов, снижающих концентрацию мочевой кислоты в крови (ингибиторы ксантиноксидазы). Рекомендуется употребление большего количества жидкости и снижение потребления продуктов богатых пуринами.
Важно также постепенно избавиться от лишнего веса, поскольку ожирение обычно ассоциируется с повышением мочевой кислоты. Диета должна быть составлена так, чтобы количество продуктов, богатых пуринами было ограничено (красное мясо, печень, морепродукты, бобовые). Очень важно отказаться от алкоголя. Необходимо ограничить употребление винограда, томатов, репы, редьки, баклажанов, щавеля – они повышают уровень мочевой кислоты в крови. Зато арбуз, наоборот, выводит мочевую кислоту из организма. Полезно употреблять продукты, ощелачивающие мочу (лимон, щелочные минеральные воды).
Антинуклеарные антитела (АНА)
С помощью АНА теста можно определить наличие в крови антинуклеарных антител (антител к ядерным антигенам).
АНА – это группа специфических аутоантител, которые производит иммунная система нашего организма в случае аутоиммунных нарушений. Антитела оказывают повреждающее действие на клетки организма. При этом человек испытывает различные болезненные симптомы, например боль в мышцах и суставах, общую слабость и др.
Обнаружение в сыворотке крови антител принадлежащих к группе АНА (например, антител к двуспиральной ДНК) помогает выявить аутоимунное заболевание, контролировать течение болезни и эффективность его лечения.
Исследование крови на АЦЦП

Анализ крови на С-реактивный белок

Исследование крови на АЦЦП
Когда необходим анализ крови на антинуклеарные антитела
Выявление антинуклеарных антител может быть признаком следующих аутоиммунных заболеваний:
-
; ; ;
- смешанное заболевание соединительной ткани; ; ; ;
- аутоиммунный гепатит
Как выполняется тест на антинуклеарные антитела
Кровь на антинуклеарные антитела берется из вены на локтевом сгибе, натощак. Перед исследованием можно не придерживаться никакой диеты.
В некоторых случаях, для того чтобы дифференцировать различные аутоиммунные заболевания, могут потребоваться дополнительные уточняющие тесты на аутоантитела из группы антинуклеарных антител, так называемый иммуноблот АНА.
Что обозначают данные теста
Антинуклеарные антитела (другое название - антинуклеарный фактор) указывают на наличие какого-то аутоиммунного нарушения, однако не указывают точно на болезнь, вызвавшую его, поскольку тест на АНА является скрининговым исследованием. Цель любого скрининга – выявить людей с повышенным риском того или иного заболевания.
У здорового человека с нормальным иммунитетом антинуклеарных антител в крови быть не должно или их уровень не должен превышать установленные референсные значения.
Нормальное значение АНА подразумевает титр антител, не превышающий значение 1: 160. Ниже этого значения анализ считается отрицательным.
Положительный анализ на антинуклеарные антитела (1:320 и более) указывает на повышение антинуклеарных антител, и наличие у человека заболевания аутоиммунной природы.
В настоящее время для выявления антинуклеарных антитела используются две методики: непрямую реакцию иммунофлюоресценции с использованием так называемой клеточной линии Нер2 и иммуноферментный анализ. Оба теста дополняют друг друга, в связи с чем их рекомендуют выполнять одновременно.
Можно выделить следующие виды антинуклеарных тел АНА в реакции непрямой иммунофлюоресненции:
- гомогенная окраска - может быть при любом аутоиммунном заболевании;
- пятнистая или крапчатая окраска может быть при системной красной волчанки, склеродермии, синдроме Шегрена, ревматоидном артрите, полимиозите и смешанном заболевании соединительной ткани;
- периферическая окраска – характерна для системной красной волчанки;
При положительном анализе на антинуклеарные антитела необходимо провести иммуноблот антинуклеарных антител для уточнения типа аутоиммунного заболевания и постановки диагноза.
Ревматоидный фактор
Исследование крови на ревматоидный фактор направлено на выявление специфических антител класса IgM к антителам класса IgG.
Лабораторный тест на ревматоидный фактор является скрининговым исследованием, направленным на выявление аутоиммунных нарушений. Главная задача исследования на ревматоидный фактор – выявление ревматоидного артрита, болезни и синдрома Шегрена и ряда других аутоиммунных болезней.
Анализ на ревматоидный фактор может потребоваться при следующих симптомах:
- боли и отечность в суставах;
- ограничение подвижности в суставах;
- чувство сухости в глазах и во рту;
- кожные высыпания по типу кровоизлияний;
- слабость, упадок сил.

Нормы ревматоидного фактора в крови
Теоретически в здоровом организме ревматоидного фактора быть не должно. Но все же в крови у некоторых даже здоровых людей этот фактор присутствует в небольшом титре. В зависимости от лаборатории верхняя граница нормы ревматодного фактора варьирует от 10 до 25 международных единиц (МЕ) на 1 миллилитр крови.
Ревматоидный фактор одинаковый у женщин и мужчин. У людей пожилого возраста показатель ревматоидного фактора будет несколько выше.
Ревматоидный фактор у ребенка должен составлять в норме 12,5 МЕ на миллилитр.
Анализ на ревматоидный фактор используется для диагностики следующих заболеваний:
-
;
- системные аутоиммунные заболевания;
- риоглобулинемия.
Другие причины повышения ревматоидного фактора
Дополнительные причины повышения ревматоидного фактора могут быть следующими:
- сифилис;
- краснуха;
- инфекционный мононуклеоз;
- малярия;
- туберкулез; ; ;
- лейкемия; ;
- сепсис
Если причина повышенного ревматоидного фактора – инфекционные заболевания, например, инфекционный мононуклеоз, то титр ревматоидного фактора обычно меньше, чем при ревматоидном артрите.
Тем не менее, анализ на ревматоидный фактор прежде всего помогает распознать ревматоидный артрит. Однако следует подчеркнуть, что ставить диагноз лишь на его основании нельзя. Поскольку ревматоидный фактор может быть повышенным при многих других патологических состояниях аутоиммунной и не аутоиммунной природы. Кроме этого, примерно у 30% больных ревматоидным артритом анализ крови на ревматоидный фактор может оказаться отрицательным (серонегативный вариант ревматоидного артрита).
Анализ крови на ревматоидный фактор проводят утром натощак (с последнего приема пищи должно пройти от 8 до 12 часов).
Анализ крови на АЦЦП заключается в определении титра антител к циклическому цитруллинированному пептиду и является одним из точных методов для подтверждения диагноза ревматоидного артрита. С его помощью болезнь можно обнаружить за несколько лет до возникновения симптомов.
Что показывает анализ АЦЦП
Цитруллин – это аминокислота, которая является продуктом биохимической трансформации другой аминокислоты – аргинина. У здорового человека цитруллин не принимает участия в синтезе белка и полностью выводится из организма.
АЦЦП – это специфический маркер ревматоидного артрита, своеобразный предвестник заболевания на ранней стадии, обладающий высокой специфичностью.
Антитела к циклическому цитруллинированному пептиду обнаруживаются задолго до первых клинических признаков ревматоидного артрита и остаются в течение всей болезни.
Методика анализа и его значение
Выявление АЦЦП при ревматоидном артрите может указывать на более агрессивную, так называемую эрозивную форму заболевания, которая ассоциируется с более быстрым разрешением суставов и развитием характерных суставных деформаций.
Если результат анализа на АЦЦП оказывается положительным, то прогноз ревматоидного АЦЦП артрита считается менее благоприятным.
Болезнь Шегрена (БШ) — хроническое медленно прогрессирующее аутоиммунное заболевание, связанное с выработкой аутоантител к компонентам ядра клеток и характеризующееся В-клеточной гиперреактивностью. Заболевание проявляется преимущественно поражением экзокринных желез и рядом симптомов со стороны других органов и систем. Наличие резистентных форм БШ с системными проявлениями при неэффективности стандартной терапии глюкокортикостероидами и базисной противовоспалительной терапии является показанием к началу проведения генно-инженерной биологической терапии (ГИБТ). При БШ основной перспективной мишенью является В-клетка, так как ей отводится важная роль в патогенезе данного заболевания. Наличие у пациента обширной коморбидной патологии не является противопоказанием для проведения анти-В-клеточной терапии. В статье представлен клинический случай развития БШ у женщины 68 лет и опыт применения ГИБТ в процессе лечения. В результате терапии ритуксимабом отмечена выраженная положительная клиническая динамика в виде уменьшения сухости слизистых оболочек полости рта и глаз, повышения толерантности к физической нагрузке, купирования боли в животе и одышки. По результатам лабораторных исследований также отмечена положительная динамика в виде снижения острофазовой и иммунологической активности заболевания.
S.M. Kirov Military Medical Academy, St. Petersburg, Russian Federation
Keywords: Sjogren’s syndrome, autoimmune disorder, engineered biological therapy, anti-B-cell therapy, dryness, xerostomia, xerophthalmia, rituximab.
Введение
Появление генно-инженерных биологических препаратов открыло перед ревматологами широкие возможности в лечении аутоиммунных заболеваний. Стремительное развитие биотехнологий привело к тому, что в настоящее время ежегодно появляются все новые и новые молекулы для так называемой биологической терапии. Молекулы эти способны таргетно блокировать определенные медиаторы воспаления (антицитокиновая терапия) или иммунокомпетентные клетки, например CD20-лимфоциты (анти-В-клеточная терапия).
Коллектив нашей клиники также имеет разносторонний опыт применения ритуксимаба как при РА, так и при АНЦА-васкулитах (гранулематоз с полиангиитом
и эозинофильный гранулематоз с полиангиитом), СКВ, ССД. В настоящей статье мы хотели бы уделить особое внимание применению препарата при БШ и описать собственное наблюдение пациентки, успешно получающей терапию ритуксимабом по поводу этого заболевания в течение 2 лет.
Болезнь Шегрена
БШ — хроническое медленно прогрессирующее аутоиммунное заболевание, связанное с выработкой аутоантител к компонентам ядра клеток, характеризующееся В-клеточной гиперреактивностью, проявляющееся преимущественно поражением экзокринных желез (слюнных, слезных), а также поражением со стороны других органов и систем. Распространенность БШ варьирует от 0,1% до 3,3% в общей популяции и от 2,8% до 4,8% среди лиц старше 50 лет. Женщины заболевают в 10–25 раз чаще, чем мужчины. Заболевание дебютирует в возрасте 20–50 лет [1].
Большинство исследователей рассматривают БШ как следствие иммунопатологических реакций на вирусные антигены. Выделение вирусных частиц из пораженной ткани слюнных желез, наличие антивирусных антител в крови при БШ, выявление феномена молекулярной мимикрии между вирусами и аутоантигенами позволяют предполагать возможное участие вирусов в развитии данного заболевания. Обсуждают этиологическую роль вирусов, обладающих сиалотропным (цитомегаловирус, вирус Эпштейна — Барр, вирус герпеса 6-го типа) и лимфотропным (ВИЧ, Т-лимфотропный вирус человека 1-го типа) действием. Тем не менее прямых доказательств вирусной этиологии заболевания не существует [1–5].
Для БШ характерен аутоиммунный генез развития заболевания. Основные аутоиммунные феномены включают очаговую лимфоплазмоцитарную инфильтрацию эпителиальных желез и поликлональную В-клеточную активацию с образованием органоспецифических и/или неспецифических аутоантител, поликлональных и моноклональных иммуноглобулинов, преимущественно IgM [1–5]. Хотя Т-лимфоциты изначально считались ключевыми клетками в развитии аутоиммунного процесса, сейчас имеются доказательства того, что B-клетки играют не меньшую роль. Наличие, а иногда и преобладание CD4+ Т-клеток в инфильтратах слюнных железах подчеркивает их потенциальный вклад в патогенез БШ. Повышенное содержание этих клеток ассоциируется с более высокой степенью воспаления в секретирующих эпителиальных структурах. В-лимфоциты при БШ являются адаптивными иммунными клетками и отвечают за секрецию антител и антигенную презентацию [2–5].
Одним из ключевых факторов в этом процессе является В-клеточный активирующий фактор (B-cell activating factor, BAFF) — цитокин, который способствует пролиферации и созреванию В-клеток и в первую очередь индуцируется интерферонами (рис. 1). Высказываются предположения, что некоторые вирусы (например, вирус Эпштейна — Барр) активируют toll-подобные рецепторы (toll-like receptor, TLR), приводящие к гиперпродукции интерферона. Отмечено, что у пациентов с БШ уровень BAFF в крови и слюнных железах значительно повышен, что коррелирует с высокой иммунологической активностью заболевания и с более высоким риском развития В-клеточной лимфомы [2–5]. С учетом вышеизложенного BAFF может быть потенциальной мишенью для терапии БШ. Первые результаты исследований по анти-BAFF-терапии (белимумаб) показали значительное снижение активности заболевания через 1 год от начала терапии, оцениваемое по индексу The EULAR Sjögren’s syndrome disease activity index (ESSDAI) [3].
Системные (экстрагландулярные) проявления наблюдаются примерно у 70% пациентов с БШ. Экстранодальная MALT-лимфома среди таких проявлений встречается наиболее часто. Она может трансформироваться в высокоагрессивную крупноклеточную лимфому, способную стать непосредственной причиной смерти пациента [1–5]. К факторам риска развития лимфом относятся такие клинические симптомы, как одностороннее увеличение слюнных желез, лимфаденопатия, спленомегалия, васкулит кожи, криоглобулинемия и развитие гломерулонефрита [1–5].
Поражение суставов при БШ преимущественно проявляется симметричной, интермиттирующей, неэрозивной артропатией [2]. Артрит встречается реже. В основном в патологический процесс вовлекаются проксимальные межфаланговые (35%), пястно-фаланговые (35%) и лучезапястные суставы (30%) [1–5]. Синдром Рейно нередко выявляют в дебюте БШ, он протекает относительно доброкачественно у большинства больных. Поражение легких в виде интерстициального пневмонита, альвеолярного легочного фиброза, лимфоидной инфильтрации легких с формированием фокусов инфильтрации — самые характерные изменения при БШ (20%). По сравнению с СКВ реже развиваются экссудативные плевриты и перикардиты. Бактериальные, вирусные и грибковые пневмонии нередко осложняют течение интерстициального поражения легких [1–5]. Поражение почек у больных БШ включает в себя широкий спектр проявлений, из которых наиболее распространенным является интерстициальный нефрит [2]. Последовательный скрининг функции почек имеет важное значение, так как почечная недостаточность (СКФ аутоиммунными заболеваниями щитовидной железы (10%), аутоиммунным хроническим активным гепатитом (2%) и первичным билиарным циррозом печени (5%).
Диагноз БШ базируется на классификационных критериях SICCA (Sjogren’s International Collaborative Clinical Alliance, 2012):
1. Наличие анти-SSA/Ro- и/или SSB/La-антиядерных антител, или позитивные ревматоидный фактор (РФ) и антинуклеарный фактор (АНФ).
2. В биоптате малых слюнных желез наличие очаговой лимфоцитарной инфильтрации (≥1 фокуса в 4 мм2).
3. Наличие сухого кератоконъюнктивита — ≥3 баллов по шкале окраски глазного эпителия флюоресцеином и лиссаминовым зеленым (следует исключить антиглаукомные глазные капли, угнетающие продукцию внутриглазной жидкости, операции на роговице и блефаропластику).
Заболевание может быть классифицировано как синдром Шегрена при соответствии двум из трех критериев при исключении облучения головы и шеи, инфицирования вирусом гепатита С, ВИЧ-инфекции, саркоидоза, амилоидоза, IgG4-связанного заболевания, РА, СКВ, ССД и других аутоиммунных заболеваний [4].
Ритуксимаб — препарат, представляющий собой химерные моноклональные антитела к маркеру В-лимфоцитов CD20 + , разработан для терапии неходжкинских лимфом, а в настоящее время активно используется в лечении многих аутоиммунных заболеваний. CD20+ экспрессируется на мембране В-лимфоцитов, начиная с пре-В-лимфоцитов и до зрелых В-клеток. Данный маркер отсутствует на плазмоцитах и стволовых клетках, что определяет отсутствие выраженного снижения уровня иммуноглобулинов и низкую частоту оппортунистических инфекций при его применении. Эта молекула обратимо взаимодействует с СD20-рецепторами на поверхности В-лимфоцита, ингибируя его активность и подавляя способность к выработке антител [14–17].
Клиническое наблюдение
Нами представлено клиническое наблюдение пациентки с БШ. Основная цель демонстрации — показать эффективность использования генно-инженерной анти-В-
клеточной терапии у пациентки с высокой острофазовой и иммунологической активностью заболевания и обширной коморбидной патологией.
Диагноз БШ был установлен в 2010 г. С сентября 2010 г. пациентка получала ГКС, с декабря 2010 г. — азатиоприн (дозы препаратов не помнит). В апреле 2011 г. была госпитализирована в клинику факультетской терапии для оценки эффективности лечения и его коррекции в связи с появившимися осложнениями от приема ГКС.
Основной диагноз: болезнь Шегрена. Хроническое течение с поражением глаз (ксерофтальмия), кожи и слизистых (ксеростомия).
Осложнения: остеопороз смешанного генеза (сенильный, глюкокортикостероидный, вторичный на фоне хронического аутоиммунного заболевания). Ятрогенный синдром Иценко — Кушинга.
Фоновый: гипертоническая болезнь 2-й степени, II стадии, риск 4. Ишемическая болезнь сердца. Стенокардия напряжения II ФК. Атеросклероз аорты и коронарных артерий. Атеросклеротический кардиосклероз с нарушением ритма по типу частой желудочковой экстрасистолии. Стеноз аортального клапана 2-й степени. ХСН II ФК.
Сопутствующий: полиостеоартроз с преимущественным поражением коленных, тазобедренных и мелких суставов кистей. Хронический паренхиматозный панкреатит с внешнесекреторной недостаточностью легкой степени. Жировой гепатоз 2-й степени с умеренным нарушением функции печени. Ожирение 3-й степени, алиментарно-конституциональное, фаза стабилизации. Нарушенная толерантность к глюкозе. Аутоиммунный тиреоидит. Эутиреоз. Дисциркуляторная энцефалопатия 2-й степени, смешанного генеза, преимущественно в вертебробазилярном бассейне, в виде рассеянной неврологической симптоматики. Синдром беспокойных ног. Астеноневротический синдром. Варикозная болезнь. Варикозное расширение подкожных вен правой нижней конечности. Хроническая венозная недостаточность 1-й степени. Консолидированный перелом наружной лодыжки правой голени с наличием фиксирующих металлоконструкций. Хронический субатрофический ринофарингит. Единственная правая почка. Нефрэктомия в 2007 г. по поводу новообразования левой почки. Хроническая болезнь почек С3б. Образование мочевого пузыря (полип).
Диагноз был поставлен на основании диагностических критериев заболевания (SICCA 2012 г.), а также ряда выполненных лабораторных и инструментальных исследований, в т. ч. УЗИ слюнных желез (диффузное, неоднородное изменение структуры слюнных желез, характерное для БШ) [18].
Проводимое лечение включало лечебно-охранительный режим, стол № 9, метипред 4 мг/сут и азатиоприн 100 мг/сут, гастропротекторы, ферменты, гипотензивные и сахароснижающие препараты, дезагреганты, венотоники. Проводилась также инфузионная метаболическая нейро-, гепато- и кардиотропная терапия. На фоне терапии была отмечена положительная динамика: стабилизировались показатели гемодинамики, достигнута компенсация углеводного обмена, повышена толерантность к физической нагрузке, улучшилось общее состояние. В октябре 2016 г. проводилось очередное стационарное лечение в клинике факультетской терапии, которое включало экстракорпоральную гемокоррекцию (3 сеанса плазмафереза). Также была скорректирована базисная терапия (метипред 4 мг/сут, азатиоприн 150 мг/сут). С ноября 2016 г. начала беспокоить боль в левой половине живота. Пациентка получала лечение в клинике военно-полевой хирургии Военно-медицинской академии по поводу дивертикулярной болезни толстого кишечника. Несмотря на проводимое лечение, сохранялась высокая иммунологическая активность заболевания (АНФ в титре 1:10000–1:20000), а также клинические проявления болезни в виде нарастающей сухости глаз, полости рта, кожных покровов. Присоединились осложнения проводимой глюкокортикоидной терапии в виде развития остеопороза с компрессионным переломом грудных позвонков, низкоэнергетического перелома левой лодыжки. Также следует отметить наличие обширного коморбидного фона у пациентки, что не позволяло интенсифицировать проводимую терапию.
Лабораторно у пациентки наблюдались следующие изменения:
Клинический анализ крови 07.10.2017: эритроциты — 4,11×10 12 /л, гемоглобин — 132 г/л, тромбоциты — 380×10 9 /л, СОЭ — 34 мм/ч, лейкоциты — 5,09×10 9 /л, эозинофилы — 0%, базофилы — 1%, п/я — 1%, с/я — 49%, лимфоциты — 40%, моноциты — 9%, СРБ — 15,88 мг/л. Коагулограмма: протромбин — 120%, фибриноген — 5,72 г/л, МНО — 0,90. Иммунологическое исследование крови: IgM — 0,94 г/л, IgG — 16,32 г/л, IgA — 1,88 г/л, циркулирующие иммунные комплексы — 13 ед., АНФ титр >1:10000. Иммуноблот антинуклеарных антител: Ro-52 +++, CENT B +++. Развернутая иммунограмма 16.11.2017. Анализ субпопуляций В-клеток свидетельствует об увеличении относительного/абсолютного содержания общих В-лимфоцитов, активированных В-клеток, В-клеток памяти, В-2-клеток и В-1-клеток, связанных с продукцией аутоантител. Выявлены признаки снижения основных субпопуляций Т-клеток (в большей степени Т-хелперов), характеризующиеся снижением относительного/абсолютного количества общих Т-клеток, активированных CD25 + Т-клеток, активированных HLA-DR+-Т-лимфоцитов и значительным дисбалансом в содержании основных субпопуляций Т-клеток. Наряду с этим отмечается повышение относительного и абсолютного количества NK-клеток, экспрессирующих α-цепь антигена CD8 и обладающих способностью многократно выполнять свою цитолитическую функцию.
В связи с прогрессированием заболевания на фоне проводимой комбинированной базисной цитостатической и глюкокортикоидной терапии, в частности нарастанием клинической симптоматики, высокой иммунологической активностью заболевания (по данным развернутой иммунограммы и иммуноблота антинуклеарных антител), в апреле 2018 г. принято решение об инициации ГИБТ с применением ритуксимаба. Выполнено введение препарата в дозе 1000 мг с интервалом в 2 нед. В дальнейшем повторные введения препарата продолжались через 6 мес. с интервалом 2 нед. (1-й год терапии). Со 2-го года лечения в связи с положительным клиническим эффектом было принято решение о редукции дозы до 1000 мг однократно 1 раз в 6 мес. В результате терапии ритуксимабом у пациентки отмечена выраженная положительная клиническая динамика в виде значительного уменьшения сухости слизистых оболочек полости рта и глаз, также повысилась толерантность к физической нагрузке, купированы боли в животе и одышка. Лабораторно также отмечена положительная динамика в виде снижения острофазовой и иммунологической активности заболевания.
Клинический анализ крови 07.02.2019: эритроциты — 4,5×10 12 /л, гемоглобин — 140 г/л, тромбоциты — 220×10 9 /л, СОЭ — 13 мм/ч, лейкоциты — 5,09×10 9 /л, эозинофилы — 2%, базофилы — 1%, п/я — 1%, с/я — 59%, лимфоциты — 30%, моноциты — 7%, СРБ — 5,6 мг/л. Коагулограмма: протромбин — 110%, фибриноген — 3,75 г/л. Иммунологическое исследование крови: АНФ титр >1:1000. Иммуноблот антинуклеарных антител: Ro-52+, CENT B+.
Заключение
Данный клинический случай демонстрирует, что диагностика БШ достаточно сложна и требует проведения специальных исследований. При наличии у пациентов обширной коморбидной патологии проведение и интенсификация терапии стандартными БПВП и ГКС может сопровождаться развитием ятрогенных осложнений. Применение ритуксимаба у пациентов с БШ при отсутствии эффекта от стандартной базисной терапии в сочетании с ГКС может приводить к снижению клинических проявлений и иммунологической активности заболевания, тем самым препятствовать прогрессированию болезни, развитию тяжелых органных изменений. Наличие у пациента обширной коморбидной патологии не является противопоказанием для проведения анти-В-клеточной терапии, в частности терапии ритуксимабом.
Читайте также:

