Системная красная волчанка в пожилом возрасте
Обновлено: 25.04.2024
– Что собой представляет системная красная волчанка (СКВ)? Как часто встречается заболевание? Какой прогноз заболевания на современном этапе?
– СКВ относится к системным болезням соединительной ткани и считается одним из наиболее тяжелых заболеваний этой группы. В основе СКВ лежит гиперпродукция аутоантител и иммунных комплексов, которые вызывают иммуновоспалительное повреждение внутренних органов. Характерный признак заболевания – полиорганная симптоматика, наиболее неблагоприятным с прогностической точки зрения является поражение почек и ЦНС. Другой особенностью является волнообразность течения с нередким развитием обострений даже на фоне терапии и вовлечением ранее интактных органов. Заболевание не является редким, как считалось ранее, по данным различных авторов, распространенность СКВ варьирует от 5 до 250 случаев на 100 тыс. населения. СКВ – женская патология, около 90% всех заболевших составляют пациенты женского пола с пиком дебюта в детородный период – в возрасте от 20 до 40 лет. Заболевание может встречаться в детском и пожилом возрасте, при этом явного, типичного для классической картины, преобладания больных женщин уже не наблюдается. Имеются расовые и этнические различия: чаще по сравнению с кавказоидами болеют лица африканского происхождения, уроженцы Азии, коренные жители Америки и Австралии; наиболее тяжело СКВ протекает у афроамериканцев, пуэрториканцев и китайцев. Уровень образования, социальное положение больного и ряд других экономических факторов также могут оказывать влияние на исходы болезни. На современном этапе благодаря совершенствованию методов диагностики и лечения прогноз больных СКВ значительно улучшился – еще полвека назад в первые 5 лет заболевания (особенно при поражении жизненно важных органов) погибал каждый второй пациент, а в настоящее время 10-летняя выживаемость при СКВ может достигать 80–90%.
– Вы упоминали, что СКВ у мужчин встречается достаточно редко. С чем это связано? Каковы особенности заболевания у мужчин?
– Действительно, мужчины страдают СКВ достаточно редко – удельный вес больных мужского пола составляет 4–20%. В среднем среди больных СКВ соотношение женщин к мужчинам приближается к 6:1, а в постпубертатном периоде достигает 10:1. Одной из основных причин, определяющих подобные гендерные различия, считается влияние половых гормонов. Андрогены обладают определенной иммуносупрессорной активностью, тогда как эстрогены, напротив, стимулируют иммунные реакции. Хорошо известно, что у женщин по сравнению с мужчинами повышена частота различных аутоиммунных заболеваний, в том числе и СКВ. На патогенетическое участие половых гормонов при СКВ указывают и такие факты, как связь обострений с беременностью и родами, неблагоприятное влияние оральных контрацептивов, снижение активности СКВ после овариоэктомии и более мягкое течение болезни в постменопаузе, высокая ассоциация СКВ и синдрома Клайнфельтера (дополнительная Х-хромосома) у мужчин. У больных СКВ обоих полов обнаружены сниженные сывороточные уровни тестостерона и дигидротестостерона, повышенные уровни пролактина, фолликулостимулирующего и лютеинизирующего гормонов и нарушение метаболизма эстрогенов. Вышеперечисленные факты указывают на тесную связь патогенеза СКВ с дисбалансом половых гормонов.
СКВ – хроническое заболевание, и по мере увеличения длительности страдания возрастает частота сопутствующей патологии. Во-первых, для СКВ свойственна высокая частота сердечно-сосудистых заболеваний, прежде всего раннее развитие атеросклероза. Эпидемиологические исследования подтвердили существенное возрастание риска развития сердечно-сосудистой патологии у больных СКВ под влиянием как традиционных, так и связанных с болезнью факторов риска. По данным проспективных исследований, примерно у 10% больных СКВ наблюдаются клинические проявления атеросклероза: стенокардия, инфаркт миокарда, поражение мозговых или периферических артерий. Субклинические формы заболевания (наличие бессимптомных атеросклеротических бляшек) регистрируются у 35–40% больных.
Не теряет своей актуальности и проблема присоединения инфекционных осложнений, в первую очередь бактериальных. Сама болезнь, а также применение иммуносупрессантов предрасполагает к развитию инфекций. Кроме того, хорошо известно, что инфекционные осложнения в популяции чаще встречаются у мужчин. Таким образом, врачам следует с особым вниманием относиться к диагностике и профилактике сопутствующих заболеваний как у всех больных СКВ, так и у мужчин в особенности.
Не исключается влияние экзогенных факторов на течение заболевания. В последние годы получены многочисленные (хотя и неоднозначные) данные о взаимосвязи между курением, употреблением алкоголя и активностью СКВ. Более частое курение и употребление алкоголя больными мужского пола также могут способствовать более тяжелому течению заболевания. Кроме того, мужчины чаще заняты тяжелым физическим трудом, имеют меньшую приверженность лечению, что также имеет значение.
Что касается клинической картины, то за весь период заболевания наиболее частыми симптомами СКВ у мужчин были поражение почек, ЦНС, суставной синдром (имеющий некоторые особенности – высокую частоту поражения суставов нижних конечностей и сакроилеита), редко встречался вторичный синдром Шегрена. Достоверный АФС был верифицирован у каждого четвертого больного мужского пола. У мужчин с АФС выявлены более высокая частота сетчатого ливедо, легочной гипертензии, поражения клапанного аппарата сердца и хронических язв ног. У большинства больных (72%) клинические проявления АФС развивались на фоне картины СКВ, однако у 23% мужчин (как правило, в молодом возрасте) заболевание дебютировало исключительно симптомами АФС. Данные пациенты наблюдались врачами других специальностей, в связи с чем появление симптомов СКВ зачастую игнорировалось, что приводило к поздней диагностике основного заболевания.
Мы также детально проанализировали выживаемость больных, поскольку мужской пол признан прогностически неблагоприятным фактором исхода заболевания. К сожалению, за период наблюдения в исследуемой группе произошло 25 смертей. Летальность у мужчин составила 1,9 на 100 пациенто-лет, что приближается к соответствующим показателям у больных СКВ обоего пола в 70–80-х годах прошлого столетия. Средний возраст мужчин с СКВ на момент смерти составлял 25 лет, что гораздо ниже не только общей продолжительности жизни населения России, но и показателей, полученных при анализе причин смерти у больных СКВ (преимущественно женщин), наблюдавшихся в Институте ревматологии и умерших за период с 1958 по 1997 год. В нашем исследовании развитие летальных исходов у мужчин с СКВ ассоциировалось с поражением почек в дебюте и в период течения заболевания, а также с наличием гематологических осложнений (анемии и тромбоцитопении). Показатели выживаемости были хуже у больных с дебютом болезни в молодом возрасте, острым течением заболевания и высокой активностью на момент установления диагноза.
– Каковы современные подходы к терапии больных СКВ и мужчин в частности?
– Современная тактика лечения больных СКВ включает подавление активности патологического процесса, профилактику обострений, раннее выявление и коррекцию сопутствующей патологии, улучшение качества жизни.
Основными лекарственными препаратами продолжают оставаться глюкокортикоиды, однако в схемы применения этих препаратов внесены некоторые изменения: реже стали назначаться высокие (более 1 мг/кг/сут преднизолона) дозы, даже при развитии угрожающих для жизни проявлений. Стероидсберегающее и дополнительное иммуносупрессивное действие в настоящий момент достигается за счет комбинированного применения цитотоксических препаратов (хорошо известных циклофосфамида и азатиоприна; все больше стали использоваться селективные иммуносупрессанты (например, микофенолата мофетил), особенно на основании результатов рандомизированных клинических исследований об одинаковой эффективности этих средств при лучшей переносимости в случае длительного назначения. Все шире стала применяться практика назначения аминохинолиновых препаратов с момента установления диагноза и в течение очень длительного периода (практически пожизненно). Накапливается опыт успешного применения генно-инженерных биологических препаратов, оказывающих влияние на патогенетические В-клетки (ритуксимаб, белимумаб) как с целью воздействия на активные процессы, так и для профилактики рецидивов. Кроме того, больным СКВ в зависимости от наличия и тяжести сопутствующей патологии, а также для профилактики осложнений назначаются симптоматические средства – гипотензивные, гиполипидемические, антиостеопоретические и др. Наряду с комплексом лекарственных средств огромное значение имеют мониторинг больных по разработанным стандартам, преемственность стационарного и амбулаторного этапов лечения, социальная реабилитация больных и т. д.
– Спасибо Вам за интервью!
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Системная красная волчанка (поражение кожи, суставов, почек, центральной нервной системы)
Журнал: Клиническая дерматология и венерология. 2011;9(6): 23‑26
Лалаева А.М., Пирятинская А.Б., Грибанова Т.В., Смирнова О.Н., Белова Е.А., Нечаева О.С. Системная красная волчанка (поражение кожи, суставов, почек, центральной нервной системы). Клиническая дерматология и венерология. 2011;9(6):23‑26.
Lalaeva AM, Piriatinskaia AB, Gribanova TV, Smirnova ON, Belova EA, Nechaeva OS. Systemic lupus erythematosus affecting the skin, joints, kidneys, and central nervous system. Klinicheskaya Dermatologiya i Venerologiya. 2011;9(6):23‑26. (In Russ.).
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Представлено клиническое описание (результаты собственного наблюдения) больной системной красной волчанкой с поражением кожи, почек, центральной нервной системы. Наличие мультисистемных поражений с кожными проявлениями или без них нередко представляют сложность в своевременной постановке диагноза.
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Системная красная волчанка (СКВ) — аутоиммунное заболевание с преимущественным поражением соединительной ткани и сосудов [1]. Одной из важных причин его развития считают генетическую предрасположенность, нейроэндокринные нарушения, у женщин связанные с родами, абортом, гормональными дисфункциями, наступлением менопаузы, развитием аутоиммунного тиреоидита и др. Важную роль играют экзогенные факторы: механические повреждения кожи, ультрафиолетовое излучение, низкие и высокие температуры, бактериальные и вирусные инфекции, применение лекарственных препаратов (чаще антибиотиков, сульфаниламидов) [2]. Аутоиммунные нарушения возникают вследствие активации В-лимфоцитов, что приводит к образованию аутоантител, направленных против различных нуклеопротеиновых антигенов соединительной ткани. При лабораторном исследовании биоптатов кожи крупногранулярный тип свечения ядра свидетельствует о присутствии антинуклеарных антител, направленных против рибонуклеиновых антигенов (Sm, RNP, SS-A, SS-B и др.), а цитоплазматический — о присутствии антинуклеарных антител, направленных против антигенов цитоплазмы, рибосом и митохондрий. Наличие антинуклеарного фактора (АНФ) [2] и антител к экстрагируемому нуклеарному антигену в сыворотке крови (ENA-скрининг) связано с присутствием антинуклеарных антител к рибонуклеиновым антигенам, что также является подтверждением системного характера заболевания. Таким образом, выявленные положительные результаты АНФ и ЕNA у пациента могут свидетельствовать о наличии СКВ. Основным серологическим маркером системного поражения, и в частности почек, являются антитела (IgG) к двуспиральной ДНК, определяемые методом иммуноферментного анализа (ИФА)[3]. Несмотря на результаты многочисленных исследований, этиология данного заболевания не выяснена.
Приводим результаты нашего наблюдения.
Больная Ф., 23 лет, госпитализирована в клинику дерматовенерологии Санкт-Петербургской ГМА им. И.И. Мечникова 22.04.10 с неясным диагнозом. При поступлении пациентка жаловалась на общую слабость, увеличение температуры тела, которая в вечернее время варьировала от 37,5 до 38,2 °С, озноб, лихорадку, боли в суставах кистей и стоп, поясничной области, потливость, потерю трудоспособности, аппетита, нарастающие в течение последних 6 мес, а также высыпания на коже лица, груди. В последний месяц к существующим симптомам присоединился болезненный надсадный кашель. Обращалась в медицинские центры Санкт-Петербурга на коммерческой основе с жалобами на болезненный кашель, повышение температуры тела до 39—40 °С,боли в пояснице.
Электрокардиограмма (ЭКГ) от 6.03.10: выявлены нарушение процессов реполяризации в области задней стенки и гипертрофия левого желудочка. В анализе крови от 08.04.10 все показатели в норме, лишь СОЭ составила 27 мм/ч. Общийанализ мочи от 08.04.10: лейкоциты – 3—4 в поле зрения (п/зр), эритроциты — 3—5 в п/зр. Ультразвуковое исследование (УЗИ) брюшной полости от 31.03.10: выявлены признаки гепатоза. Результаты исследования гормонов щитовидной железы от 09.04.10: тиреотропный гормон — 4,27 мкМЕ/мл, тироксин свободный — 1,06 нг/мл. Врачами центра диагностирован острый бронхит, по поводу которого больная получала офлоксацин в течение 10 дней по 400 мг 2 раза в сутки, канефрон — по 2 таблетки 3 раза в день. На фоне лечения появились высыпания пятен на лице, груди, которые вначале были ярко-розового цвета, затем приобрели застойно-синюшную окраску и четкие границы с тенденцией к периферическому росту и слиянию.
В анализе крови от 23.04.10: гемоглобин – 117 г/л, эритроциты — 4,3×10 12 /л, лейкоциты — 5,04×10 9 /л, лимфоциты — 1,08×10 9 /л, базофилы — 0,02×10 9 /л, эозинофилы — 0,15×10 9 /л, палочкоядерные — 2%, сегментоядерные — 69%, моноциты — 5%, СОЭ — 57 мм/ч. Анализ мочи от 23.04.10: лейкоциты — 6–8 в п/зр, эритроциты — 4–6 в п/зр, эпителий — 3—4 в п/зр, белок — 0,260 г/л, сахар — 0, ацетон — 0. Биохимический анализ крови: общий белок — 63 г/л, аланинаминотрансфераза — 24 ЕД/л, аспартатаминотрансфераза — 34 ЕД/л, креатинин — 75 мкмоль/л, мочевина — 4,9 мкмоль/л, С-реактивный белок (СРБ) — 7,31 мг/л. Флюорография от 23.04.10: органы грудной полости без патологии. Скрининг болезней соединительной ткани от 27.04.10: АНФ — 1:5120, крупногранулярный тип свечения ядра, цитоплазматический тип свечения – 1/1280. Обнаруженные антитела к экстрагируемому нуклеарному антигену (ENA-скрининг) и антитела к двуспиральной ДНК IgG методом ИФА — 423,36 МЕ/мл. Консультациягинеколога: выявлена эрозия шейки матки. Неоднократно в клинике осматривалась терапевтом, который диагностировал у пациентки наличие артериальной гипертензии.
В течение всего пребывания в клинике общее состояние пациентки оценивалось как средней тяжести. Она постоянно предъявляла жалобы на общую слабость, потливость, ознобы. Поставлен диагноз: СКВ. Результаты скрининга болезней соединительной ткани подтвердили наличие СКВ. Для лечения пациентка переведена во 2-е ревматологическое отделение СПб ГУЗ Клиническая ревматологическая больница №25, в которой находилась с 04.05.10 по 20.05.10.
ЭКГ: синусовая брадикардия, частота сердечных сокращений — 56 в минуту. В остальном — без существенных изменений. УЗИ брюшной полости: умеренная гепатомегалия за счет левой доли.
УЗДГ брахиоцефальных артерий и артерий основания мозга: на экстракраниальном уровне спектрограммы каротидного бассейна определяется избыточный кровоток с высокой периферической скоростью; асимметрия кровотока по ВСА с выраженным спектральным окном; в вертебробазилярном бассейне кровоток по позвоночным артериям в норме. На интракраниальном уровне — выраженная асимметрия кровотока по СМА, ОА кровоток в норме; венозный отток затруднен в передней черепной ямке; цереброваскулярная реактивность снижена. Индекс ЦВР справа — 1,1, слева — 1,2. Заключение: ангиодистония в рамках церебральной ангиопатии на фоне СКВ.
В клинических анализах крови отмечались колебания гемоглобина (104—116 г/л), эритроцитов (3,86—4,37×10 12 ), лейкоцитов (9,60—18,1×10 9 /л), тромбоциты в норме, палочкоядерные — 1%, сегментоядерные — 74—86%, эозинофилы — 1—4%, лимфоциты — 9—16%, моноциты — 3—5%, СОЭ — 10—23 мм/ч. В анализах мочи: удельный вес — 1005—1015, рН 6—7, плоский эпителий — 5—7 в п/зр, лейкоциты — 12—15 в п/зр, эритроциты — 20—30 в п/зр. В биохимических анализах патологии не отмечено.
Иммунологическое исследование: РФ — 57,7 МЕ/мл, СРБ — менее 60 мг/л, ЦИК — 0,067, АНФ — 1/2048, свечение — красное, диффузное, комплемент С3—0,37—0,47, С4—0,05. IgG — 9,7 v/ml, IgM — 8,5 v/ml, антитела к ДНК — 297, Le-клетки — 15 в п/зр. Протеинограмма: общий белок — 60 г/л, альбумины — 43,32 г/л, глобулины — 56,68 г/л, α1 — 3,5%, α2 — 9,84%, β — 9,9%, γ — 33,44%, А/Г — 0,76.
Заключение невропатолога: церебральная васкулопатия в рамках СКА; хроническая ишемия мозга, дисциркуляторная энцефалопатия с когнитивными нарушениями.
Получала следующее лечение: курантил, престариум, тенокс, преднизолон 40 мг/сут, конкор, гипотиазид, омез, кальций D3, гептрал внутривенно капельно, солумедрол по 500 мг внутривенно капельно №3, циклофосфан 1000 мг внутривенно капельно однократно, затем — 200 мг внутривенно капельно, актовегин внутривенно капельно №5.
Выписана из стационара с диагнозом: СКВ с поражением кожи, суставов, РЭС почек, центральной нервной системы. Осложнения: дисциркуляторная энцефалопатия. Сопутствующие заболевания: аутоиммунный тиреоидит, гипотиреоз, эрозия шейки матки.
Рекомендации: дальнейший прием преднизолона в дозе 40 мг вместе с 20 мг омеза утром, циклофосфан по 200 мг внутривенно капельно 3 раза в неделю, чередовать прием гепатопротекторов по 2 нед каждого месяца: эссенциале, гепабене, карсил, гептрал; продолжить прием витамина D3 и препаратов кальция, миокальцита, панангина, сосудистых и гипотензивных препаратов. При болях в суставах — церебрекс, мовалис, найз, местно — фастум-гель, крем долгит, хондроксид. Рекомендован контроль крови, мочи 1 раз в 10 дней, уровня трансаминаз и билирубина — 1 раз в месяц. Коррекция лечения должна проводиться ревматологом под контролем анализов.
После лечения общее состояние пациентки значительно улучшились, нормализовалась температура тела, значительно уменьшилась общая слабость, боли в суставах, снизилось артериальное давление. Проявления на коже стали бледнее, но полностью не разрешились. Представленное наблюдение демонстрирует сложность распознавания данного заболевания, достаточно быстрое и бурное развитие симптомов СКВ с поражением кожи, суставов, ретикуло-эндотелиальной системы, почек и центральной нервной системы.
Российский государственный медицинский университет
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения
Диссеминированная красная волчанка в пожилом возрасте
Журнал: Клиническая дерматология и венерология. 2016;15(5): 21‑24
В пожилом возрасте могут наблюдаться различные формы красной волчанки. Дебют заболевания у лиц старше 50 лет происходит в 3—18% случаев. Фоточувствительность и высыпания в скуловых областях у пожилых пациентов менее выражены. Oчень важна дифференциальная диагностика. Интегументные формы красной волчанки следует дифференцировать с солнечной стойкой эритемой, розацеа, синдромом Сенир—Ашера, центробежной кольцевидной эритемой Дарье, узелковым хондродерматитом ушной раковины, бугорковым сифилидом, атрофическим красным плоским лишаем, различными поражениями с локализацией на волосистой части головы, эритемой Гаммела. Описан случай диссеминированной красной волчанки у пациентки 74 лет. Клинический диагноз подтвержден гистологически, а также был получен положительный результат при определении аутоантител класса IgG.
Российский государственный медицинский университет
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения
Дебют системной красной волчанки у лиц старше 50 лет происходит в 3—18% случаев. Позднее начало заболевания приводит к значительным изменениям клинической картины, течения патологического процесса, терапевтического эффекта проводимого лечения, прогноза [1]. Среди пожилых пациентов с красной волчанкой преобладание женщин менее выражено, чем в других возрастных группах [2]. Результаты исследования, проведенного в Канаде, показали, что позднее начало красной волчанки гораздо чаще наблюдается у лиц европейского происхождения, в то время как у пациентов азиатского и африканского происхождения преобладает раннее начало заболевания [3]. Нередко отмечается позднее установление диагноза. В старшей возрастной группе отмечается более частое, по сравнению с молодыми пациентами, поражение легких и серозиты, в то время как сыпь в скуловой области, фоточувствительность, артрит, нефропатия у пожилых пациентов наблюдаются реже [1]. В целом у молодых пациентов выявлялось большее число диагностических критериев Американского колледжа ревматологии. Например, несмотря на увеличение антинуклеарных антител, сходное для молодых и пожилых пациентов, у молодых лиц чаще выявлялись анти-Sm антитела, рибонуклеопротеин, гипокомплементемия. Кроме того, у молодых больных чаще диагностировали нефрит, поражение кожи, цитопению [3]. Тяжелые проявления красной волчанки у пожилых пациентов наблюдаются реже, причина смерти чаще обусловлена инфекциями, сердечно-сосудистыми заболеваниями, злокачественными новообразованиями [1—3]. В некоторых случаях интеркуррентные заболевания также приобретают необычное течение. Так, описано развитие бластомы легких у 62-летнего пациента с дискоидной красной волчанкой. Как правило, бластома легких развивается в более молодом возрасте в отличие от немелкоклеточной карциномы легких [4].
С другой стороны, отмечено, что, несмотря на более доброкачественное течение красной волчанки, прогноз у пожилых пациентов всегда хуже, что обусловлено высокой частотой сопутствующих заболеваний, поражений различных органов в связи с возрастом и более длительным воздействием классических факторов риска сосудистых поражений у пожилых пациентов [3, 5, 6]. Необходимо учитывать и снижение терапевтического эффекта лекарственных препаратов в старших возрастных группах. Описано развитие асцита, вызванного люпус-перитонитом у 77-летней женщины. Назначение глюкокортикоидов было неэффективно. Несмотря на некоторое улучшение таких лабораторных показателей, как иммунологические маркеры в сыворотке крови, титры анти-ДНК антител, содержание иммунных комплексов в перитонеальной жидкости оставалось повышенным. Предполагается, что отсутствие эффекта терапии может быть связано с нарушением сосудистой циркуляции на фоне иммунологических изменений [7].
Клиническая картина интегументных форм красной волчанки также может значительно изменяться с возрастом, что предопределяет особую роль дифференциальной диагностики у пожилых пациентов. Совершенствование лабораторных методов диагностики красной волчанки существенно повышает ее качество, но наибольшие трудности вызывают клинические проявления [8].
Если отмечается фотосенсибилизация пациента, следует проводить дифференциальный диагноз с солнечной стойкой эритемой. Заболевание чаще отмечается у женщин 20—30 лет, поражает открытые участки кожного покрова. На поверхности очагов выявляют шелушение, мелкопапулезные высыпания, геморрагии и корочки [9].
При розацеа ведущими являются ангионевротические расстройства. Стойкая эритема обнаруживается на коже шеи, лба и носа. В зависимости от стадии заболевания на отечном гиперемированном фоне выявляются папулы, пустулы, телеангиэктазии, узлы [10]. Фолликулярный гиперкератоз, рубцовая атрофия отсутствуют [11].
Кожные поражения при различных формах красной волчанки имеют определенное сходство с синдромом Сенир—Ашера. В обоих случаях характерна локализация на лице, поражение в виде бабочки, эритематозно-сквамозные высыпания. Наибольшие трудности может вызывать изолированная локализация очага на волосистой части головы с развитием алопеции и рубцовой атрофии, но в отличие от красной волчанки при себорейной пузырчатке очаги поражения формируются вследствие образования быстро лопающихся дряблых плоских пузырей. Течение заболевания не зависит от периодов наибольшей инсоляции. При распространенной форме себорейной пузырчатки отсутствуют капилляриты. При красной волчанке симптом Никольского отрицательный [12].
Клиническая картина центробежной кольцевидной эритемы Дарье характеризуется появлением нешелушащихся желтовато-розовых отечных пятен, которые быстро превращаются в приподнятые плоские кольцевидные элементы со склонностью к эксцентрическому росту. Фолликулярный гиперкератоз, рубцовая атрофия отсутствуют [9].
При узелковом хондродерматите ушной раковины появляется плотный узелок полушаровидной формы, диаметром до 0,5 см цвета здоровой кожи или слегка синюшно-красноватого, покрытый плотноприлегающими чешуйками, после слияния которых может выявляться поверхностное изъязвление. Фолликулярный гиперкератоз, рубцовая атрофия, зависимость от инсоляции отсутствуют [9].
Бугорковый сифилид начинает развиваться в сетчатом слое дермы, не вызывая заметных изменений на поверхности кожи. Постепенно бугорок увеличивается в диаметре, выступает над поверхностью кожи, субъективные ощущения отсутствуют. Характерно образование рубца или рубцовой атрофии. В то время как при красной волчанке первичным морфологическим элементом является пятно, характерен фолликулярный гиперкератоз, зависимость от инсоляции [9].
При атрофическом красном плоском лишае развиваются атрофические изменения на месте регрессирующих узелковых элементов, чаще кольцевидные. Фолликулярный гиперкератоз, рубцовая атрофия, зависимость от периодов инсоляции отсутствуют [8].
Различные поражения на волосистой части головы (пиодермия, себорейный дерматит, фолликулит Гофмана и др.) также отличаются отсутствием зависимости от периодов инсоляции [8].
Гирляндообразная мигрирующая эритема Гаммела характеризуется множественными гирляндо-образными очагами, сопровождающимися отеком и зудом. Эритема Гаммела является паранеопластическим дерматозом — чаще у пациентов диагностируют аденокарциному молочной железы, хотя описаны и случаи сочетания эритемы Гаммела с раком желудка, лимфогранулематозом, болезнью Рустицкого—Каллера, опухолями мозга, половых органов, дыхательных путей [12, 13]. Описаны случаи заболевания у пациентов без онкологической патологии [14, 15].
Представляем собственное наблюдение.
Пациентка К., 74 лет, направлена на стационарное лечение с предположительным диагнозом: эритема Гаммела?
Сопутствующие заболевания. Ишемическая болезнь сердца. Стенокардия напряжения II функционального класса. Недостаточность кровообращения I степени. Гипертоническая болезнь II степени (АГ II, риск высокий), цереброваскулярная болезнь. Хроническая ишемия головного мозга. Язвенная болезнь желудка, вне обострения. Гастроэзофагеальная рефлюксная болезнь. Катаральный эзофагит. Постхолецистэктомический синдром (холецистэктомия в 2012 г.) Хронический панкреатит, вне обострения. Хронический колит. Дивертикулез толстого кишечника. Полип ректосигмоидального отдела. Кисты обеих почек. Очаговые образования обеих долей щитовидной железы. Варикозная болезнь нижних конечностей.
При поступлении пациентка предъявляла жалобы на высыпания на коже лица, шеи, туловища, верхних и нижних конечностей, сопровождающиеся умеренным зудом, усиливающимся в вечерние часы.
При поступлении на коже лица, ушных раковин, туловища, верхних и нижних конечностей визуализировались распространенные полиморфные высыпания островоспалительного характера, которые были представлены умеренно отечными очагами пятнистой эритемы с кольцевидными крупнофестончатыми очагами, с шелушащимся периферическим краем, местами серпигинозного характера, склонными к слиянию. На поверхности элементов имелись точечные и линейные экскориации, эрозивные дефекты диаметром 0,2—0,3 см (рис. 1, 2, 3).

Рис. 1. Очаги поражения на лице, ушной раковине, груди.

Рис.2.Очагипоражения на груди, животе, бедрах.

Рис. 3. Очаги поражения на спине.
Показатели общего анализа крови, мочи, биохимического анализа крови — в пределах нормы (включая уровень глюкозы — 6,3 ммоль/л).
Гликемический профиль: 8.00 — 6,2 ммоль/л, 11.30 — 7,1 ммоль/л.
Повторно гликемический профиль: 8.00 — 6,1 ммоль/л, 11.30 — 7,5 ммоль/л.
Патоморфологическое исследование биоптатов кожи: гистологические изменения соответствуют диагнозу: подострая красная волчанка.
Исследование на определение аутоантител к антигенам ядерным (суммарные антитела dsDNA, к гистонам, Sm, RNP/Sm, SS-A (Ro), SS-B (La), Scl-70, Jo-1, U1-NP-B): результат 120,3 усл. ед. — положительный.
К антигенам ядерным (суммарные антитела Sm, RNP/Sm, SS-A (Ro), SS-B (La), Scl-70, Jo-1): результат 54,8 — положительный.
LE клетки не обнаружены.
Данные инструментальных методов исследования
ЭКГ: ритм синусовый, частота сердечных сокращений — 60 ударов в минуту, горизонтальное положение электрической оси сердца. Умеренные изменения нижней стенки левого желудочка.
ЭГДС: дуоденит. Гастрит смешанного характера с очагами метаплазии. Дуодено-гастральный рефлюкс.
Ультразвуковое исследование щитовидной железы: эхографические признаки диффузных изменений паренхимы щитовидной железы, узловые включения справа.
Ультразвуковое исследование молочных желез: эхографические признаки фиброзно-жировой инволюции молочных желез.
Ультразвуковое исследование брюшной полости и почек: эхографические признаки стеатогепатоза. Диффузные изменения поджелудочной железы. Кисты обеих почек, микролиты обеих почек.
Консультация терапевта: ишемическая болезнь сердца. Стенокардия напряжения II функционального класса. Недостаточность кровообращения I степени. Гипертоническая болезнь II степени (АГ II, риск высокий), цереброваскулярная болезнь. Хроническая ишемия головного мозга. Язвенная болезнь желудка, вне обострения. Гастроэзофагеальная рефлюксная болезнь. Катаральный эзофагит. Постхолецистэктомический синдром (холецистэктомия в 2012 г.) Хронический панкреатит, вне обострения. Хронический колит. Дивертикулез толстого кишечника. Полип ректосигмоидального отдела. Кисты обеих почек. Очаговые образования обеих долей щитовидной железы. Варикозная болезнь нижних конечностей.
Консультация эндокринолога: многоузловой зоб, эутиреоз. Дисгликемия.
Повторная консультация эндокринолога: сахарный диабет 2-го типа, впервые выявленный. Многоузловой зоб. Эутиреоз.
Таким образом, в представленном нами наблюдении дебют красной волчанки отмечен в 72-летнем возрасте. Диагноз на протяжении предшествующих 2 лет не был поставлен, что могло быть в значительной степени связано с широко распространенным мнением о преимущественном дебюте болезней соединительной ткани у молодых лиц. При обследовании пациентов старше 60 лет существенная часть исследований бывает направлена на онкопоиск, о чем свидетельствует предположительный диагноз: эритема Гаммела? Приведенное нами наблюдение свидетельствует о возможности дебюта красной волчанки у пожилых лиц.
Ключевые слова: системная красная волчанка с поздним началом, перикардит, плеврит, серозит, синдром Роуэлла, эфферентная терапия, плазмаферез.
D.S. Aganov, M.M. Toporkov, I.S. Svintsitskaya, E.N. Tsygan, D.I. Sopova
S.M. Kirov Military Medical Academy, St. Petersburg, Russian Federation
Systemic lupus erythematosus (SLE) is a chronic autoimmune inflammatory disorder with a wide range of clinical and laboratory manifestations which occurs predominantly in young women. The most common age of onset is 20–30 years. However, SLE occasionally occurs after the age of 50 years. The clinical signs of SLE are different from those of a typical disease. As a result, a separate form, SLE in the elderly, was identified. SLE in the elderly often manifests as weight loss, fever, myalgia, arthralgia, pulmonary lesions, serositis, cardiovascular, hemolytic, and hematological disorders. The clinical course of late-onset SLE is usually favorable compared to classic SLE. However, poor survival is reported in these patients compared to early-onset SLE. The causes of death in late-onset SLE are infectious and vascular complications, the adverse effects of hormonal and cytostatic therapies, hematological and comorbid disorders. The authors describe a 67-year-old man with late-ons et SLE. A set of tests verified the diagnosis. Efferent treatment was recommended.
Keywords: late-onset SLE, pericarditis, pleuritis, serositis, Rowell syndrome, efferent therapy, plasmapheresis.
Введение
Системная красная волчанка (СКВ) — системное аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся образованием широкого спектра органонеспецифических аутоантител к различным компонентам ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов [1].
Характерной особенностью СКВ является многообразие клинических проявлений и вариантов течения заболевания. Принято считать СКВ болезнью молодых женщин, так как она наиболее часто развивается у женщин репродуктивного возраста, хотя может быть выявлена в любом возрасте [2]. В последние десятилетия приводятся данные о развитии СКВ в возрасте после 50 лет (так называемая СКВ с поздним началом). По данным литературы, на этот возрастной период приходится от 2% до 20% всех случаев СКВ [3–5]. Более поздний возраст начала СКВ ассоциирован со скрытым, нередко атипичным дебютом и течением болезни, с отсутствием характерных высыпаний в форме бабочки, фотосенсибилизации, феномена Рейно, поражения почек [4, 6], что во многом затрудняет верификацию диагноза и является причиной несвоевременной диагностики СКВ, особенно при неосведомленности врачей в отношении особенностей данного заболевания у лиц пожилого возраста.
Во многих работах подчеркивается, что тяжесть СКВ уменьшается с возрастом [3, 4, 8–11]. Так, в исследовании Ho et al. [11] при СКВ с поздним началом у пациентов наблюдалось более легкое течение болезни с незначительным числом серьезных рецидивов. Aljohani et al. [8] наблюдали при СКВ пожилых снижение распространенности нефрита до 9,3% случаев по сравнению с 21,9% при раннем начале заболевания.
В то же время пациенты пожилого и старческого возраста имеют ряд общесоматических заболеваний, что сказывается негативно на прогнозе и переносимости лечения. Кроме того, необходим тщательный анализ получаемой пациентами терапии с целью выявления лекарственных препаратов, которые потенциально могут приводить к развитию лекарственной СКВ. К таким препаратам относятся β-блокаторы, прокаинамид, гидралазин, изониазид, метилдопа, карбамазепин, сульфаниламиды, D-пеницилламин, интерферон-α и моноклональные антитела к ФНО-α [12].
Несмотря на благоприятное течение СКВ с дебютом в пожилом возрасте, у этого контингента больных отмечается более низкая выживаемость, чем при заболевании с ранним началом. Причиной смерти у больных с СКВ в пожилом возрасте являются инфекционные и сосудистые осложнения, нежелательные эффекты гормональной и цитостатической терапии, онкогематологические и коморбидные заболевания.
Таким образом, поздний возраст начала СКВ оказывает сильное модифицирующее влияние на клиническую картину, течение заболевания, ответ на лечение и прогноз. В данной статье мы приводим случай дебюта СКВ у мужчины пожилого возраста.
Клиническое наблюдение
Пациент К., 67 лет, считает себя больным с июня 2018 г., когда на фоне полного благополучия появилась субфебрильная лихорадка. Амбулаторно наблюдался у терапевта по месту жительства. С июля 2018 г. отметил присоединение артралгий в мелких суставах кистей с дальнейшим вовлечением лучезапястных, локтевых, плечевых суставов, повышение температуры до 38 ° C. Пациент самостоятельно принимал нестероидные противовоспалительные препараты (НПВП), однако они были неэффективны.
Проходил стационарное обследование и лечение в терапевтическом стационаре в период с 04.07.2018 по 23.07.2018 с предварительным диагнозом: недифференцированный артрит. При поступлении отметили артриты проксимальных межфаланговых суставов II–III–IV обеих кистей, отеки голеней до нижней трети, субфебрильная лихорадка. Аускультативно дыхание было жестким, выслушивались единичные сухие хрипы на форсированном выдохе в нижних отделах легких. Лабораторно отмечалось повышение скорости оседания эритроцитов (СОЭ) до 25 мм/ч, С-реактивного белка (СРБ) — до 65 мг/мл. Проводилась инфузионно-метаболическая терапия. С 5-го дня госпитализации у пациента отмечались нарастание интенсивности суставного синдрома, присоединение болей в грудной клетке при дыхании, подъем температуры до 39 ° C. Данных за острую сердечно-сосудистую патологию не обнаружили. По результатам рентгенографии органов грудной клетки (ОГК) была выявлена инфильтрация в S8 правого легкого, назначена антибактериальная терапия (моксифлоксацин 400 мг/сут). В связи с отсутствием положительной динамики на 4-е сут антибактериальной терапии выполнена компьютерная томография (КТ) ОГК, выявлены очаги инфильтрации S5, 8, 9, 10 левого легкого, двусторонний гидроторакс (справа 15 мм, слева 8 мм), наличие жидкости в перикарде (11 мм). По данным ЭКГ, в динамике появились признаки субэпикардиального повреждения миокарда в заднебоковом отделе стенки левого желудочка. Повышения кардиоспецифических ферментов не наблюдалось. Значительно повысилась острофазовая активность заболевания: СОЭ увеличилась до 50 мм/ч, уровень СРБ — до 211 мг/мл. Выполнены фиброгастродуоденоскопия, фиброколоноскопия, КТ органов брюшной полости и малого таза, исследование крови на онкомаркеры, исключены онкологические, эндокринные заболевания, туберкулез, гемобластозы.
23.07.2018 пациент был переведен в клинику факультетской терапии Военно-медицинской академии с целью верификации диагноза. При поступлении состояние средней степени тяжести в связи с наличием у пациента синдрома интоксикации (похудание на 11 кг за 1 мес., лихорадка до 38,8 ° C), суставного синдрома воспалительного характера (артриты мелких суставов кистей, лучезапястных суставов, артралгии локтевых, плечевых суставов с гипотрофией мышц кистей, верхних конечностей), поражения легких (дыхание жесткое, ослабленное в базальных отделах; частота дыхания 23 в минуту, сатурация — 96%), признаков венозной недостаточности и недостаточности кровообращения (НК) (варикозно-расширенные вены нижних конечностей, отеки до средней трети голеней). Отмечалось повышение СОЭ до 23 мм/ч, уровня СРБ — до 94 мг/мл. Прокальцитониновый тест от 24.07.2018 — 1,26 нг/мл. При посеве крови и мочи роста микроорганизмов не выявлено. Результаты общего анализа мочи — в пределах референсных значений. По данным повторной КТ ОГК от 23.07.2018 зарегистрировали нарастание объема жидкости в плевральной полости (до 20 мм слева, до 15 мм справа) и полости перикарда (до 18 мм); уменьшение объема инфильтрации легких. На ЭКГ — синусовая тахикардия 114/мин. Диффузные изменения процессов реполяризации передней перегородки, верхушки, боковой стенки. На Эхо-КГ: приклапанная аортальная регургитация, митральная и трикуспидальная регургитация 1-й степени. Локальных признаков нарушений сократимости не выявлено. Снижение глобальной систолической функции до 49%, замедленная релаксация миокарда левого желудочка (на фоне тахикардии). Расхождение листков перикарда за задней стенкой левого желудочка — 12 мм, за правым предсердием — 10 мм.
В течение первых 2 сут пациент был консультирован инфекционистом, пульмонологом, кардиохирургом, торакальным хирургом, фтизиатром, специалистом по гнойным инфекциям, сепсису. Выставлен диагноз: Нозокомиальная полисегментарная пневмония S5, S8, S9, S10 левого легкого, тяжелое течение. Криптогенный сепсис от 23.07.2018, оценка степени тяжести пневмонии по шкале SMART-COP — 2 балла, дыхательная недостаточность (ДН) 2-й степени. Пациенту была назначена антибактериальная терапия (дорипрекс, метронидазол, ванкомицин), продолжена инфузионно-метаболическая терапия, НПВП. Несмотря на проводимую терапию, в течение последующих 4 сут положительной динамики не отмечалось. Сохранялись фебрильная лихорадка и суставной синдром, высокая лабораторная активность (СОЭ — до 50 мм/ч, СРБ — до 120 мг/мл), повышение активности печеночных трансаминаз (АЛТ — 124,2 ЕД/л; АСТ — 126,5 ЕД/л). Было выполнено исследование крови на маркеры диффузных болезней соединительной ткани, выявлено повышение АНФ до 1:10000 (мелкогранулярный тип свечения), АТ к двуспиральной ДНК — 58 МЕ/мл, иммуноблот АНА (Sm, SS-A, Ro-52, SS-B, Scl-70, PM-Scl, Jo-1, PCNA, dsDNA, AMA-M2, нуклеосомы, гистоны, AMA-M2) — отрицательно.
С учетом наличия у пациента 4 критериев (серозит, артрит, иммунологические нарушения: повышение АНА и АТ к двуспиральной ДНК) из 11 критериев СКВ Американского колледжа ревматологии (American College of Rheumatology, ACR), а также с учетом индекса повреждения, разработанного Международной организацией сотрудничества клиник системной красной волчанки (Systemic Lupus Erythematosus International Collaborating Clinics, SLICC) в 2012 г., равного 5 баллам, пациенту был поставлен диагноз: Системная красная волчанка. В плане медикаментозной терапии пациенту выполнялась пульс-терапия метилпреднизолоном в дозе 500–1000–1000 мг в/в капельно в течение 3 дней. Назначены преднизолон 40 мг/сут (0,5 мг/кг/сут), азатиоприн 50 мг/сут, плаквенил 400 мг/сут. На фоне проводимой терапии по данным КТ ОГК от 30.07.2018 в динамике инфильтративные изменения обоих легких разрешились, уменьшился объем жидкости в плевральных полостях: слева до 12 мм и справа до 12,5 мм и в полости перикарда до 3 мм. В связи с сохраняющимся отеком правой голени пациент консультирован сосудистым хирургом, выполнено УЗДГ сосудов нижних конечностей, выявлен флеботромбоз левой подколенной, малой подкожной вен в стадии частичной реканализации. ХВН 3-й степени. Выполнена КТ ангиография ОГК, выявлены признаки массивной двусторонней ТЭЛА с сохраненным пристеночным кровотоком. Таким образом, с учетом полученных данных выставлен окончательный диагноз.
Основной: Системная красная волчанка, острое течение, высокая активность (индекс SELENA-SLEDAI (Safety of Estrogens in Lupus Erythematosus National Assessment Systemic Lupus Erythematosus Disease Activity Index) — 11 баллов) с поражением легких (пульмонит, двусторонний плеврит), сердца (перикардит, миокардиодистрофия), суставов (артрит, артралгии), мышц (миалгии), лихорадка, иммунологические нарушения (АНФ 1:10000, АТ к двуспиральной ДНК 78 МЕ/мл).
Осложнения: Вероятный антифосфолипидный синдром: флеботромбоз левой подколенной, малой подкожной вен в стадии частичной реканализации. ХВН 3-й степени. Тромбоэмболия легочных артерий, сегментарных А1, А2, А3, А4, А5, А6, А8, А9, А10 справа, А4, А5, А8, А9, А10 слева. Нозокомиальная полисегментарная пневмония S5, S8, S9, S10 левого легкого, тяжелое течение. SMART-COP 3 балла. ДН 1-й степени. Криптогенный сепсис от 23.07.2018 (купирован 01.08.2018).
С учетом положительной динамики по данным КТ ОГК на фоне проводимой антибактериальной и глюкокортикостероидной терапии пневмоническая инфильтрация расценена как сочетание инфекции с пульмонитом при дебюте СКВ. Отсутствие антител к фосфолипидам, вероятно, может быть обусловлено как проводимой терапией, так и развитием тромбоза.
Общая длительность стационарного периода составила 24 дня. Пациент выписан в удовлетворительном состоянии с рекомендациями приема на амбулаторном этапе азатиоприна 50 мг/сут (при нормализации печеночных показателей увеличение дозы до 100 мг), плаквенила 400 мг/сут, преднизолона 40 мг/сут, с постепенным снижением дозировки под наблюдением ревматолога по месту жительства.
С 23.12.2018 пациент на фоне снижения дозы преднизолона стал отмечать появление единичных папул в зоне декольте с тенденцией к прогрессированию, сопровождающихся умеренным зудом. Прием антигистаминных препаратов не сопровождался положительной динамикой. При выполнении ОАМ, клинического и биохимического анализов крови от 18.01.2019 все показатели — в пределах нормальных значений.
С 23.01.2019 пациент поступил на очередное стационарное обследование и лечение в клинику факультетской терапии. При осмотре в первую очередь обращали на себя внимание пятна красно-бурого цвета, папулы и крупнопластинчатое шелушение в области лица, волосистой части головы, туловища, спины, плеч, наружной поверхности предплечий, тыльной поверхности кистей, бедер, голеней. Пациент был консультирован дерматологом, с целью верификации диагноза выполнена биопсия кожи. При иммунологическом обследовании: АНФ от 15.01.2019 — 1:2560 (мелкогранулярный тип свечения), АТ к двуспиральной ДНК — 60 МЕ/мл, иммуноблот АНА (Sm, SS-A, Ro-52, SS-B, Scl-70, PM-Scl, Jo-1, PCNA, dsDNA, AMA-M2, нуклеосомы, гистоны) — отрицательно. ОАМ в пределах нормы. В гемограмме регистрировалась лейкопения до 3,0×10 9 /л, повышение СОЭ — 35 мм/ч. Констатировано умеренное обострение СКВ (рецидив кожного синдрома, лейкопения, индекс SELENA-SLEDAI — 3 балла). С учетом вышеизложенного пациенту было выполнено 3 операции каскадной плазмофильтрации с целью иммунокоррекции, детоксикации и повышения чувствительности к пульс-терапии метилпреднизолоном в суммарной дозе 3,0 г. На фоне проводимой терапии был достигнут регресс кожного синдрома. По результатам биопсии кожи было установлено, что гистологические изменения более всего соответствуют синдрому Роуэлла, для которого характерны клинические проявления красной волчанки и многоформной экссудативной эритемы.
В результате проведенного дообследования выставлен окончательный диагноз: Системная красная волчанка, рецидивирующе-ремиттирующее течение, умеренное обострение, низкой активности (индекс SELENA-SLEDAI — 3 балла) с поражением кожи (многоформная экссудативная эритема, капилляриты), легких (пневмофиброз, эмфизема), сердца (миокардиодистрофия), с гемолитическими нарушениями (лейкопения), иммунологическими нарушениями (АНФ 1:2560). ДН 0. НК 0. Вероятный антифосфолипидный синдром.
Заключение
Нами был продемонстрирован нетипичный дебют СКВ у мужчины пожилого возраста с развитием пульмонита, полисерозита, синдрома интоксикации с последующим присоединением суставного, мышечного, кожного синдромов, иммунологических и гематологических нарушений. Диагностический поиск проводился с использованием всех доступных лабораторных и инструментальных методов обследования, привлечением специалистов разного профиля для верификации диагноза. Показаны эффективность сочетания пульс-терапии метилпреднизолоном с каскадной плазмофильтрацией, что позволяет не только достичь клинико-лабораторной ремиссии заболевания, но и минимизировать дозу поддерживающей глюкокортикостероидной терапии [13], а также необходимость динамического наблюдения ревматологом за пациентом на амбулаторном этапе с целью оценки динамики заболевания, переносимости, эффективности и своевременной коррекции базисной терапии.
Сведения об авторах:
Аганов Дмитрий Сергеевич — к.м.н., старший ординатор клиники факультетской терапии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, литера Ж; ORCID iD 0000-0002-5082-9322.
Топорков Михаил Михайлович — к.м.н., преподаватель кафедры факультетской терапии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, литера Ж; ORCID iD 0000-0002-7417-7509.
Свинцицкая Ирина Сергеевна — к.м.н., старший преподаватель кафедры факультетской терапии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, литера Ж; ORCID iD 0000-0002-1317-8276.
Цыган Екатерина Николаевна — к.м.н., доцент кафедры факультетской терапии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, литера Ж; ORCID iD 0000-0001-8323-4926.
Сопова Дарья Игоревна — курсант VI курса IV факультета Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, литера Ж; ORCID iD 0000-0002-0823-6435.
About the authors:
Dmitriy S. Aganov — Cand. of Sci. (Med.), senior resident of the Clinics of Faculty Therapy, S.M. Kirov Military Medical Academy, 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-5082-9322.
Mikhail M. Toporkov — Cand. of Sci. (Med.), lecturer of the Department of Faculty Therapy, S.M. Kirov Military Medical Academy, 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-7417-7509.
Irina S. Svintsitskaya — Cand. of Sci. (Med.), senior lecturer of the Department of Faculty Therapy, S.M. Kirov Military Medical Academy, 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-1317-8276.
Ekaterina N. Tsygan — Cand. of Sci. (Med.), associate professor of the Department of Faculty Therapy, S.M. Kirov Military Medical Academy, 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-8323-4926.
Dar’ya I. Sopova — student of the 6 th course of the 4 th faculty, S.M. Kirov Military Medical Academy, 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-0823-6435.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
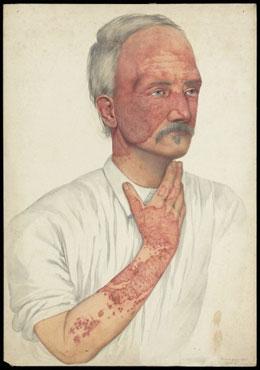
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

