Сколиоз эхинококкоз синдром клайнфельтера
Обновлено: 24.04.2024
Синдром Клайнфельтера - хромосомная патология, обусловленная наличием в мужском кариотипе одной или нескольких дополнительных женских половых хромосом. Синдром Клайнфельтера характеризуется первичным гипогонадизмом, маленькими размерами тестикул, бесплодием, гинекомастией, неглубоким снижением интеллекта. Решающая роль в диагностике синдрома Клайнфельтера принадлежит кариотипированию; также проводится анализ фенотипических признаков, определение полового хроматина, экскреции фолликулостимулирующего гормона с мочой, спермограмма и пр. Лечение при синдроме Клайнфельтера включает гормональную терапию, возможно - оперативную коррекцию гинекомастии, однако полное излечение синдрома невозможно.

Общие сведения
Синдром Клайнфельтера – дисомия или полисомия по женской половой хромосоме, при которой у лиц мужского пола имеется не менее двух Х-хромосом и одна Y-хромосома. Синдром Клайнфельтера встречается с частотой 1 случай на 850-1000 новорожденных мальчиков. Среди детей, страдающих олигофренией, распространенность синдрома Клайнфельтера составляет 1–2%. Синдром получил название по фамилии американского врача Гарри Клайнфельтера, впервые описавшего его в 1942 г. Кариотип таких больных с дополнительной Х-хромосомой был определен в 1959 г. Поскольку ведущим клиническим проявлением синдрома Клайнфельтера является первичный гипогонадизм, ведением таких пациентов занимаются специалисты в области эндокринологии и андрологии.

Причины синдрома Клайнфельтера
Как и в случае синдрома Дауна, хромосомная аберрация при синдроме Клайнфельтера связана с нерасхождением хромосом (в последнем случае – половых) в процессе мейоза либо нарушением деления зиготы. При этом значительно чаще (в 60%) мальчики с синдром Клайнфельтера получают лишнюю материнскую Х-хромосому, чем отцовскую.
Среди возможных причин подобного рода хромосомных аномалий называются вирусные инфекции, поздняя беременность, неполноценность регуляторных механизмов материнской и отцовской иммунной системы.
При наличии лишней X-хромосомы развивается аплазия эпителия яичек, их последующая гиалинизация и атрофия, что во взрослом возрасте сопровождается азооспермией и эндокринным бесплодием. Среди причин мужского бесплодия синдром Клайнфельтера составляет 10%, о чем всегда должны помнить специалисты в области репродуктивной медицины.
Наиболее частым цитогенетическим типом является полный вариант синдрома Клайнфельтера с кариотипом 47,ХХY. Реже встречается мозаицизм (46XY/47XXY; 46XX/47XXY), еще реже – полисомия 48,XXXY; 48,XXYY; 49,XXXXY и т. д. При мозаичном варианте (около 10% случаев) часть клеток имеет нормальный кариотип, поэтому мужчины с синдром Клайнфельтера могут иметь нормально развитые и функционирующие половые железы и сохранные репродуктивные способности.
Симптомы синдрома Клайнфельтера
Ребенок с синдромом Клайнфельтера рождается с нормальными росто-весовыми показателями, правильной дифференцировкой наружных гениталий, обычными размерами тестикул. В раннем возрасте у мальчиков с синдромом Клайнфельтера может отмечаться частая заболеваемость ОРВИ, бронхитом, пневмониями. Такие дети обычно отстают в моторном развитии (позднее начинают держать головку, сидеть, стоять, ходить), имеют задержку речевого развития. Уже в возрасте 5-8 лет мальчики с синдромом Клайнфельтера отличаются высоким ростом, диспропорциональным телосложением (длинными конечностями, высокой талией). В допубертатном возрасте может обнаруживаться одно или двусторонний крипторхизм.
Умственная отсталость умеренной степени, трудности установления контакта со сверстниками, нарушения поведения отмечаются у половины больных синдромом Клайнфельтера.
Отчетливые внешние признаки, свидетельствующие о наличии у ребенка синдрома Клайнфельтера, проявляются в препубертатном и пубертатном периодах развития. К ним относятся евнухоидный тип телосложения, позднее появление вторичных половых признаков, гипоплазия яичек, малый половой член, гинекомастия. В постпубертатном периоде онтогенеза наблюдается инволюция тестикул, сопровождающаяся потерей фертильности. При осмотре подростка с синдромом Клайнфельтера выявляется отсутствие или скудный рост волос на лице и в подмышечных впадинах, оволосение на лобке по женскому типу. У большинства больных присутствуют редкие поллюции, эрекция, сохранно половое влечение, однако из-за выраженного андрогенного дефицита в среднем к 30 годам происходит снижение либидо и развивается импотенция.
Синдрому Клайнфельтера часто сопутствуют аномалии скелета (деформации грудной клетки, остеопороз), нарушения прикуса, врожденные пороки сердца и др. Характерно преобладание ваготонических реакций: брадикардии, акроцианоза, потливости ладоней и стоп. Со стороны органа зрения нередко отмечается нистагм, астигматизм, птоз века.
Больные с синдромом Клайнфельтера предрасположены к развитию сопутствующих заболеваний: эпилепсии, рака молочной железы, сахарного диабета, ХОБЛ, желчнокаменной болезни, варикозного расширения вен, ожирения, гипертонической болезни, ИБС, ревматоидного артрита, острого миелоидного лейкоза. Могут отмечаться психические заболевания - маниакально-депрессивный психоз, шизофрения и др. Есть данные, подтверждающие склонность больных с синдромом Клайнфельтера к алкоголизму, наркомании и гомосексуализму.
Диагностика синдрома Клайнфельтера
Как и другие хромосомные аномалии, синдром Клайнфельтера у плода может быть обнаружен еще на этапе беременности при проведении инвазивной пренатальной диагностики (амниоцетеза, биопсии хориона или кордоцентеза с последующим анализом кариотипа или КФ-ПЦР).
Постнатальная диагностика синдрома Клайнфельтера проводится эндокринологами, андрологами и генетиками. При исследовании полового хроматина в клетках слизистой оболочки полости рта присутствуют тельца Бара, что является маркером синдрома Клайнфельтера. Другими характерными признаками служат особые изменения кожного рисунка на пальцах. Тем не менее, окончательный диагноз хромосомной аномалии может быть установлен только после исследования кариотипа.
УЗИ мошонки выявляет уменьшение объема яичек. При исследовании андрогенного профиля уровень тестостерона в крови больных синдромом Клайнфельтера понижен, однако при этом отмечается повышение уровня фолликулостимулирующего и лютеинизирующего гормонов. При анализе спермограммы выявляется олиго- или азооспермия. Морфологическое исследование материала, полученного путем биопсии яичек, выявляет гиалиноз семенных канальцев, гиперплазию клеток Лейдига, уменьшение числа клеток Сертоли, отсутствие сперматогенеза.
В течение жизни мужчины с синдромом Клайнфельтера могут обращаться к андрологу, сексологу, эндокринологу с проблемами бесплодия, импотенции, гинекомастии, остеопороза и др., однако нередко основное заболевание так и остается нераспознанным.
Лечение синдрома Клайнфельтера
Полностью излечиться от синдрома Клайнфельтера не представляется возможным. Тем не мене, все больные нуждаются в проведении симптоматической и патогенетической терапии. В детском возрасте необходима профилактика инфекционных заболеваний, закаливание, занятия ЛФК, коррекция нарушений речи с помощью логопеда.
С подросткового возраста пациентам с синдромом Клайнфельтера назначается пожизненная заместительная терапия половыми гормонами (внутримышечные инъекции тестостерон-пропионата, сустанона-250; сублингвальный прием метилтестостерона и др.). Ранняя и адекватная гормонотерапия препятствует атрофии яичек, способствует повышению полового влечения, развитию вторичных половых признаков. При резко выраженном увеличении молочных желез проводится операция по коррекции гинекомастии.
С целью повышения трудоспособности и социальной адаптации, предупреждения психопатизации личности и ее асоциальной направленности показана психотерапия.
Прогноз и профилактика синдрома Клайнфельтера
Пациенты с синдромом Клайнфельтера имеют нормальную продолжительность жизни, однако склонность к развитию хронических заболеваний может стать риск-фактором ранней смертности. Большинство больных с синдромом Клайнфельтера бесплодны; единственно возможным вариантом рождения детей в семьях, где партнер болен, является использование донорской спермы. Тем не менее, при мозаичной форме синдрома Клайнфельтера мужчины могут стать отцами самостоятельно или воспользовавшись вспомогательными репродуктивными технологиями (ЭКО).
Для оценки вероятности рождения ребенка с синдромом Клайнфельтера в процессе ведения беременности женщинам предлагается прохождение пренатального скрининга. Однако даже в случае получения положительных данных за наличие синдрома Клайнфельтера у плода настаивание на прерывании беременности со стороны акушера-гинеколога является недопустимым. Решение вопроса о целесообразности пролонгирования беременности должно приниматься родителями. При нормальном кариотипе родителей риск повторного появления ребенка с такой же хромосомной аномалией составляет не более 1%.
Диспансерное наблюдение больных с синдромом Клайнфельтера осуществляется эндокринологом.
Трисомия по Х-хромосоме (синдром трипло-Х) — это распространенный вариант анеуплоидии у женщин, при котором в кариотипе присутствует дополнительная женская половая хромосома. Состояние может проявляться ранним наступлением менархе, задержкой нервно-психического развития, эмоциональной лабильностью. При этом у большинства женщин синдром протекает бессимптомно, зачастую патология вовсе не диагностируется. Обследование включает кариотипирование, осмотр невропатолога. Лечение трисомии Х-хромосомы не требуется, для предупреждения и коррекции осложнений показано регулярное расширенное диспансерное наблюдение.
МКБ-10

Общие сведения
Такой вариант хромосомной аномалии встречается довольно часто — в среднем у 1 из 1000 женщин. Генетическое нарушение диагностируется приблизительно в 10% случаев, поскольку большинство пациенток не имеют никаких отклонений в состоянии здоровья, не обращаются за медицинской помощью. Однако иногда при трисомии Х-хромосомы наблюдаются неврологические нарушения, проблемы с репродуктивной системой, что обуславливает большую актуальность проблемы в современной генетике, необходимость выявления женщин из групп риска и их диспансеризации.

Причины
Развитие синдрома трисомии связано с нерасхождением Х-хромосомы на этапе образования половых клеток. Чаще девочки получают дополнительную хроматиду от матери, если при оплодотворении используется яйцеклетка, содержащая сразу 2 женские половые хромосомы. При слиянии генетических материалов матери и отца в момент зачатия формируется зигота, которая имеет 3 Х-хромосомы и в последующем дает начало всем клеткам организма будущего ребенка. Предрасполагающие факторы аномалии пока не установлены.
В большинстве случаев наблюдается полная форма трисомии с наличием дополнительной хромосомы во всех клетках тела женщины. Реже встречаются мозаичные варианты, когда в организме одновременно существуют 2 типа клеток — нормальные с диплоидным набором хромосом 46, ХХ и анеуплоидные с формулой 47, ХХХ. Признаки трисомии также присутствуют при мозаичной форме синдрома Шерешевского-Тернера, когда присутствуют клетки с 45, Х и 47, ХХХ.
Патогенез
Наличие в кариотипе одной дополнительной Х-хромосомы обычно не представляет особой опасности, что объясняется особенностями функционирования генетического материала у женщин. В норме при наборе 46, ХХ одна из половых хромосом имеет гетерохроматиновую структуру, образует тельце Барра и является неактивной. При трисомии по женской половой хромосоме формируется 2 тельца Барра, которые не участвуют в функционировании клетки, практически не влияют на молекулярные процессы.
Симптомы
Девочки с генетическим синдромом трисомии Х рождаются доношенными со средним весом около 3000 г, уменьшенным обхватом головы. Изредка у новорожденных отмечаются снижение мышечного тонуса, незначительная задержка становления психомоторных функций. В возрасте 1-5 лет могут беспокоить гипермобильность суставов, мышечная гипотония, что мешает нормальному становлению крупной и мелкой моторики.
Изредка наблюдаются психологические нарушения в виде перепадов настроения, вспышек гнева, эмоциональной лабильности. Для клинически выраженной трисомии Х-хромосомы также характерны более ранние сроки полового созревания, преждевременное наступление менструаций. Эти изменения не сказываются на фертильности женщин, риск бесплодия и патологий беременности у них соответствует таковому в популяции.
Осложнения
Самым опасным последствием утроенной Х-хромосомы является задержка умственного развития. Часть девочек с такой генетической аномалией позже начинают говорить, испытывают трудности с чтением, отстают от сверстников по уровню знаний по школьным предметам. Также у пациенток возможны проблемы при общении с ровесниками, плохие коммуникативные навыки, однако зачастую по мере взросления эти проблемы исчезают.
Большое значение в возникновении осложнений имеет своевременность диагностики и проведения реабилитационных мероприятий. Согласно информации ВОЗ, из девочек, у которых хромосомная аномалия диагностирована вскоре после рождения, только 14% сталкивались с проблемами при обучении, тогда как при более поздней диагностике доля таких детей составляет 30-50%. В среднем около 25-30% девочек по итогам школьного обучения имеют оценки ниже среднестатистических.
Диагностика
При стандартном педиатрическом или терапевтическом осмотре не определяются никакие специфические признаки трисомии Х-хромосомы. Чтобы заподозрить диагноз, необходимо тщательно собрать информацию о течении беременности и родов, темпах физического и психического развития девочки в первые годы жизни. В рамках комплексной диагностики трисомии применяются следующие методы исследования:
- Кариотипирование. Изучение хромосомного набора — единственно возможный метод подтверждения диагноза. Такое исследование обнаруживает признаки трисомии, позволяет разграничить полные и мозаичные формы анеуплоидии.
- Неврологический осмотр. Для раннего выявления нарушений когнитивной сферы проводится проверка речи, коммуникативных навыков, комплексное исследование уровня моторного развития, тест на социальные функции. По показаниям назначается консультация психолога, психиатра.
- Пренатальная диагностика. Во время беременности женщины с подтвержденным утроением Х-хромосомы целесообразно изучить кариотип плода, чтобы подтвердить или исключить наличие дополнительной хромосомы у ребенка. Это выполняется методом амниоцентеза, кордоцентеза.
Лечение трисомии по Х-хромосоме
При отсутствии у пациентки каких-либо проявлений синдрома нет необходимости в назначении терапии. Вопрос о целесообразности медицинского наблюдения таких женщин остается дискутабельным, хотя большинство специалистов советуют им регулярно проходить расширенные медицинские осмотры для исключения осложнений синдрома трисомии. Голландский ученый Мартен Оттер и американский педиатр Николь Тарталья предложили следующую программу диспансерного наблюдения:
- В грудном возрасте — стандартные профилактические осмотры у педиатра и других специалистов согласно графику.
- В дошкольном периоде — УЗИ почек, ЭЭГ, проверка уровня интеллектуального развития, при необходимости — логопедическая коррекция.
- В младшем и среднем школьном возрасте — исследование функций органов чувств, расширенные тесты на уровень социально-психологических навыков, рекомендации по дополнительным занятиям с репетиторами, коррекционными педагогами (при наличии показаний).
- В старшем школьном возрасте — помимо стандартных медосмотров, обеспечивается профессиональная ориентация с учетом возможных особенностей умственного развития.
- Во взрослом возрасте — при отсутствии отклонений специальные осмотры не требуются.
Прогноз и профилактика
Большинство женщин с диагнозом трисомии половой хромосомы ведут полноценную жизнь, реализуют свою репродуктивную функцию и могут не знать о существовании генетической проблемы. Прогноз в целом благоприятный. Синдром не вызывает жизнеугрожающих осложнений, не сокращает продолжительность жизни. Учитывая отсутствие значимых провоцирующих факторов, первичная профилактика заболевания невозможна.
2. Инактивация Х-хромосомы и патология человека/ Е.Н. Толмачева, А.А. Кашеварова, И.Н. Лебедев// Медицинская генетика. — 2009. — №8.
3. Случай пренатальной диагностики трисомии по Х-хромосоме/ О.Л. Галкина / Пренатальная диагностика. — 2008. — №7 (4).
Синдром Коккейна – генетическое заболевание нейродегенеративного характера, причины которого лежат в нарушении процессов репарации (восстановления после повреждений) ДНК. Симптомами этой патологии являются выраженная умственная отсталость, недостаточность физического развития, нарушения зрения и слуха, фотосенсибилизация кожи к солнечному свету. Диагностика синдрома Коккейна производится на основании данных настоящего статуса пациента, осмотра кожных покровов и глаз больного, молекулярно-генетических исследований. Специфического лечения заболевания не существует, применяют поддерживающую и симптоматическую терапию, защищают кожные покровы и глаза больного от воздействия ультрафиолетового излучения.
Общие сведения
Синдром Коккейна (болезнь Нилл-Дингуолл) – тяжелая наследственная патология, характеризующаяся нарушением развития центральной нервной системы, органов зрения, кожных покровов. Впервые это состояние было описано в 1936 году английским врачом Э. Коккейном, затем он наблюдал еще одного больного в 1946 году. В 1950 году М. Дингуолл и К. Нилл была описана семейная (у двух братьев) форма заболевания, но эти исследовательницы указали на приоритет Коккейна в изучении данного состояния. На сегодняшний день известно, что синдром Коккейна является редким генетическим заболеванием, относящимся к группе патологий, обусловленных нарушением процессов репарации ДНК. Эта патология с равной долей вероятности поражает как мальчиков, так и девочек, средняя продолжительность жизни больных составляет 10-20 лет. Имеется несколько разновидностей синдрома Коккейна, которые вызваны мутациями различных генов и отличаются между собой клиническим течением заболевания. Встречаемость данной патологии по причине ее редкости в настоящее время неизвестна.

Причины и классификация синдрома Коккейна
Синдром Коккейна является одним из многих наследственных заболеваний, причина которых лежит в нарушении процессов репарации ДНК. В условиях здорового организма разнообразные дефекты генетического материала, возникающие в процессе репликации или под воздействием повреждающих факторов (свободных радикалов, ультрафиолетового и ионизирующего излучений), устраняются многочисленными защитными системами. При этой патологии из-за генетических мутаций определенных генов происходит затруднение этих процессов, в результате чего возникают различные пороки развития. Однако многие аспекты патогенеза синдрома Коккейна в настоящее время остаются слабо изученными и неясными. Например, нет общепринятого объяснения, почему при этом заболевании сильнее всего страдает нервная система. Также непонятно, почему нарушения процессов репарации ДНК в данном случае не сопровождаются высоким риском развития онкологических заболеваний.
Выявлено несколько генетических разновидностей синдрома Коккейна – по различным данным, количество типов этой патологии составляет от 3 до 5. Такая неопределенность обусловлена тем фактом, что 4 и 5 типы ассоциированы с пигментной ксеродермой – дерматологическим заболеванием, в основе которого также лежат нарушения восстановления молекул ДНК. И если одни врачи-генетики относят их к типу XP-CS (ксеродерма-синдром Коккейна), то другие специалисты считают эти варианты патологии осложненным вариантом пигментной ксеродермы. Отдельные разновидности заболевания отличаются друг от друга этиологией (генами, в которых произошли мутации) и особенностями клинического течения, но все они имеют аутосомно-рецессивный характер наследования:
1. Синдром Коккейна тип 1 – исторически описанный первым и самый известный (классический) вариант заболевания, обусловленный мутацией ген ERCC8. Он располагается на 5 хромосоме и кодирует последовательность одноименного белка, связывающегося с рядом ферментов, которые принимают участие в репарации ДНК (протеины CSB, р44).
2. Синдром Коккейна тип 2 – наиболее распространенная форма заболевания, протекающая тяжелее, нежели классический вариант. Причиной этой разновидности патологии являются мутации гена ERCC6, расположенного на 10 хромосоме и кодирующего белок CSB (протеин синдрома Коккейна В). Этот протеин играет центральную роль в процессах репарации ДНК, в частности, нарушения при первом типе заболевания опосредованно связаны именно с ним.
3. Синдром Коккейна тип 3 – редкий и недостаточно изученный вариант этой патологии. Ген, мутации которого приводят к ее развитию, на сегодняшний день не определен.
4. Синдром Коккейна тип 4 (по другой классификации – пигментная ксеродерма D) – вызывается мутациями гена ERCC2, локализованного на 19 хромосоме. Продуктом его экспрессии является сигнальный белок XPD, обеспечивающий взаимосвязь между отдельными компонентами системы репарации ДНК.
5. Синдром Коккейна тип 5 (пигментная ксеродерма G) – обусловлен дефектом гена ERCC5, который располагается на 13 хромосоме и кодирует фермент эндонуклеазу, производящую разрез однонитевой молекулы ДНК вблизи участка ее повреждения. Выяснено, это этот процесс особенно активно участвует в процессе репарации дефектов ДНК, вызванных воздействием ультрафиолетового излучения.
Несмотря на генетическую гетерогенность синдрома Коккейна, патогенез этого заболевания (по крайней мере, по его известным этапам) не имеет особенных отличий у различных форм данной патологии. Неврологические нарушения предположительно обусловлены недостаточным развитием глиальных клеток и, как следствие, пониженной миелинизацией нервных волокон. В пользу этой теории говорит наличие лейкодистрофии и атрофии зрительного и слухового нервов при синдроме Коккейна. Кожа и глаза человека часто подвергаются воздействию ультрафиолетовых лучей, входящих в состав солнечного света, поэтому клетки роговицы, хрусталика, кожных покровов часто повреждаются. При отсутствии нормально работающих механизмов репарации ДНК эти повреждения не устраняются, что приводит к развитию характерных проявлений синдрома Коккейна – помутнению роговицы, катаракте, дряблой и имеющей старческий вид коже.
Симптомы синдрома Коккейна
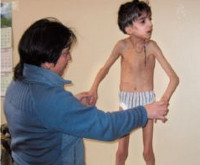
Проявления синдрома Коккейна могут обнаруживаться в разном возрасте в зависимости от формы заболевания. Большинство разновидностей патологии не проявляют себя при рождении и регистрируются в первые 2-3 года жизни, но тип 2 является врожденным. В остальном (за исключением средней продолжительности жизни) различные варианты не отличаются по своим проявлениям. Первым симптомом синдрома Коккейна является характерный внешний вид больных – в ряде случаев определяется умеренная микроцефалия, тонкий нос, заостренный подбородок, увеличенный размер ушных раковин. Все это придает лицу больного старческое выражение. Отставание ребенка в физическом и интеллектуальном развитии от сверстников при синдроме Коккейна также ярко выражено, развивается карликовость с диспропорциональными длинными конечностями. Возникают контрактуры суставов и атрофия подкожной жировой клетчатки, поэтому больные выглядят худощавыми.
Состояние кожи пациентов с синдромом Коккейна зависит от того, насколько часто она подвергается воздействию ультрафиолетовых лучей без защитных средств. Сразу после инсоляции возникает ожог кожи, иногда с образованием волдырей, в дальнейшем определяется гиперпигментация, телеангиэктазии, дряблость и старческий вид кожных покровов. Дерматологические проявления особенно сильно выражены при 4 и 5 типах синдрома Коккейна. Распространенными симптомами этого заболевания являются нейросенсорная тугоухость, помутнение хрусталика и роговицы, отслойка сетчатки или атрофия зрительного нерва, что ведет к развитию слепоты. У больных синдромом Коккейна легко развивается артериальная гипертензия и атеросклероз, что, в свою очередь, приводит к многочисленным вторичным поражениям различных органов, главным образом сердца и почек. Продолжительность жизни при большинстве форм заболевания составляет не более 12 лет, крайне редко больные доживают до 20. Наиболее тяжелый 2 тип синдрома Коккейна чаще всего приводит к летальному исходу в возрасте до 7 лет.
Диагностика и лечение синдрома Коккейна
Диагностика синдрома Коккейна основывается на результатах общего осмотра больного, компьютерной и магнитно-резонансной томографии головы, молекулярно-генетического анализа, а также ряда специфических тестов (биопсия икроножного нерва, определение активности репарации ДНК и уровня гормонов тимуса). При осмотре выявляют характерный внешний вид, атрофические изменения кожи, диспропорциональную карликовость, признаки умственной отсталости. Также указывать на наличие синдрома Коккейна могут патологии зрения (ювенильная катаракта, слепота), тугоухость, контрактуры суставов, судорожные припадки и другие неврологические нарушения.
Магнитно-резонансная томография при синдроме Коккейна обнаруживает лейкодистрофию (нарушение структуры белого вещества), практически всегда определяются кальцинаты в различных структурах головного мозга. Гистологическое изучение тканей икроножного нерва выявляет пороки миелинизации нервных волокон. У больных синдромом Коккейна наблюдается снижение уровня гормонов тимуса, повышение артериального давления и атеросклероз сосудов различных органов. Специфический тест на определение активности процессов репарации ДНК указывает на наличие дефектов в этой системе. Окончательно подтвердить диагноз может молекулярно-генетическая диагностика методом прямого секвенирования ассоциированных с заболеванием генов. При помощи этого метода современной генетики возможна также пренатальная диагностика синдрома Коккейна.
Специфического лечения синдрома Коккейна на сегодняшний момент не существует, все терапевтические мероприятия сводятся к поддерживающим и паллиативным процедурам. Улучшить зрение в случае катаракты или помутнения роговицы возможно при помощи хирургического вмешательства. Физиотерапия и лечебная гимнастика позволяют снизить выраженность контрактур суставов. При синдроме Коккейна необходимо использовать солнцезащитные очки и специальные крема, задерживающие ультрафиолетовое излучение при каждом выходе на улицу – это позволит уменьшить выраженность нарушений. Артериальная гипертензия и атеросклероз лечатся традиционными гипотензивными и антисклеротическими препаратами, для улучшения работы нервной системы назначают ноотропные средства.
Прогноз и профилактика синдрома Коккейна
Прогноз синдрома Коккейна неблагоприятный, так как патологические нарушения при этом заболевании неуклонно прогрессируют, приводя к смерти больного в возрасте от 5 до 15 лет, иногда несколько ранее или позднее. Поддерживающая терапия и паллиативные мероприятия способны несколько улучшить качество жизни пациента, но неспособны затормозить развитие патологии. Основная причина летального исхода при синдроме Коккейна – атеросклероз и гипертензия с сопутствующими вторичными нарушениями (инсульты, инфаркты, сердечная или почечная недостаточность). Больные с этой патологией требуют тщательного ухода по причине умственной отсталости и других проявлений заболевания. Профилактика синдрома Коккейна производится путем медико-генетического консультирования родителей перед зачатием ребенка и пренатальной диагностики этого заболевания. Профилактические меры особенно оправданы в тех случаях, когда у родственников были случаи рождения детей с этой патологией.

Задание 27 № 1891
1. Чем вызывается синдром Клайнфельтера?
2. Каковы проявления синдрома Клайнфельтера?
3. Какова тактика лечения больных с синдромом Клайнфельтера?
Синдром Клайнфельтера
Синдромом Клайнфельтера называется генетическое заболевание, вызываемое нарушением числа половых хромосом у детей мужского пола.
Клиническая картина синдрома описана в 1942 году в работах Гарри Клайнфельтера и Фуллера Олбрайта. Генетической особенностью этого синдрома является разнообразие цитогенетических вариантов и их сочетаний. Обнаружено несколько типов полисомии по хромосомам X и Y у лиц мужского пола: XXY, XYY, XXXY, XYYY, XXYY, XXXXY и XXXYY. Наиболее
распространён синдром Клайнфельтера с удвоением Х-хромосомы (XXY). Общая частота его колеблется в пределах 1 на 500−700 новорождённых мальчиков.
Нарушение числа хромосом обусловлено их нерасхождением либо при делении мейоза на ранней стадии развития зародышевых клеток, либо при митотическом делении клеток на начальных этапах развития эмбриона. Преобладает патология мейоза; в 2/3 случаев нерасхождение имеет место при материнском овогенезе и в 1/3 − при отцовском сперматогенезе. Фактором риска возникновения синдрома Клайнфельтера является, по-видимому, возраст матери; связь с возрастом отца не установлена. В отличие от многих других анеуплоидий синдром Клайнфельтера не ассоциирован с повышенным риском выкидыша и не является летальным фактором.
Синдром Клайнфельтера обычно клинически проявляется лишь после полового созревания и поэтому диагностируется относительно поздно. До начала полового развития удаётся отметить только отдельные физические признаки: непропорционально длинные ноги, высокая талия, высокий рост.
К началу полового созревания формируются характерные пропорции тела: больные часто оказываются выше сверстников, ноги заметно длиннее туловища. Кроме того, некоторые дети с данным синдромом могут испытывать трудности в учёбе и в выражении своих мыслей. У пациентов с синдромом Клайнфельтера, как правило, снижен интеллект и познавательные способности. Большинством исследователей-психологов пациенты с синдромом Клайнфельтера описываются как скромные, тихие, более чувствительные по сравнению со сверстниками. Все эти эффекты связаны с недоразвитием гонад и, таким образом, снижением продукции мужского полового гормона тестостерона.
Ранее больные с синдромом Клайнфельтера считались бесплодными, однако при современном уровне развития технологии экстракорпорального оплодотворения (искусственного зачатия) появилась возможность получать здоровое потомство от таких больных. Другие клинические проявления купируются постоянной замещающей терапией препаратами тестостерона.
1. Синдром Клайнфельтера вызывается неправильным количеством половых хромосом
нерасхождением Х-хромосом при мейозе
недостаточным уровнем тестостерона из-за неправильного количества половых хромосом.
2. Непропорционально длинные ноги, высокая талия, сниженный интеллект, бесплодие, низкий уровень тестостерона. Достаточно перечислить любые три симптома из выше перечисленных.
Ускоренная подготовка к ЕГЭ с репетиторами Учи.Дома. Записывайтесь на бесплатное занятие!

-->

Задания Д22 C2 № 22077
Почему синдром Клайнфельтера (ХХY) встречается у мальчиков? В результате чего может возникнуть эта аномалия? Какой метод изучения позволит диагностировать синдром?
1) У человека главным фактором, влияющим на определение пола, является наличие У-хромосомы. Если она есть, организм имеет мужской пол. Даже если в геноме имеются три или четыре Х-хромосомы, но, кроме того, хотя бы одна Y-хромосома, то из такой зиготы развивается мужчина.
2) Геномная мутация. Патология, как правило, возникает в результате нарушения расхождения хромосом на ранних стадиях формирования яйцеклеток и сперматозоидов.
Относится к генетическим заболеваниям, не передающимся по наследству, поскольку больные, за редким исключением, абсолютно бесплодны.
3) Диагностируется — цитогенетический анализ (изучения кариотипа)
Биохимические исследования — лабораторный анализ крови для определения уровня мужских половых гормонов
Синдром Клайнфельтера – генетическое заболевание, характеризующееся наличием дополнительной женской половой хромосомы Х (одной или нескольких) в мужском кариотипе ХУ, и проявляющееся, в первую очередь, эндокринными нарушениями по типу первичного мужского гипогонадизма (недостаточности образования половых гормонов непосредственно в мужских половых железах – яичках).
По медицинской традиции синдром получил свое название в честь автора, в 1942 году впервые описавшего клиническую картину патологии.
Кариотип при синдроме Клайнфельтера Как известно, генетический набор человека насчитывает 46 хромосом, из которых 22 пары называются соматическими, а 23-я – половая, несущая гены, определяющие в дальнейшем принадлежность индивида к мужскому или женскому полу.
Женщины имеют пару половых хромосом ХХ, а мужчины – ХУ. Особенностью синдрома Клайнфельтера является обязательное наличие мужской У хромосомы, поэтому, несмотря на дополнительные Х хромосомы, пациенты всегда являются мужчинами.
Синдром Клайнфельтера является одним из наиболее распространенных генетических заболеваний. Около 0,2% мужского населения Земли страдает этой патологией. Кроме того, синдром Клайнфельтера – третья по распространенности эндокринная патология у мужчин (после сахарного диабета и гиперфункции щитовидной железы).
Синдром Клайнфельтера относится к генетическим заболеваниям, не передающимся по наследству, поскольку больные, за редким исключением, абсолютно бесплодны. Патология, как правило, возникает в результате нарушения расхождения хромосом на ранних стадиях формирования яйцеклеток и сперматозоидов.
При этом синдром Клайнфельтера, возникающий в результате нарушения образования женских половых клеток, встречается в три раза чаще.
Причины нерасхождения половых хромосом, и нарушения деления клеток на самых ранних стадиях эмбриогенеза до сих пор малоизученны.
Клинические признаки классического синдрома Клайнфельтера проявляются, как правило, только в подростковом периоде. Есть симптомы, которые позволяют заподозрить наличие синдрома Клайнфельтера в препубертатный период. Мальчики с данной патологией отличаются высоким ростом, причем наиболее значительная прибавка приходится на период 5-8 лет. Также обращают на себя внимание диспропорции в строении тела: длинные конечности и высокая талия.
При подозрении на синдром Клайнфельтера проводят лабораторный анализ крови для определения уровня мужских половых гормонов. Необходима дифференциальная диагностика с другими заболеваниями, протекающими с проявлениями андрогенной недостаточности.
Точный диагноз синдрома Клайнфельтера ставят на основании изучения кариотипа (набора хромосом).
Читайте также:

