Сколько лежат в реанимации с сепсисом
Обновлено: 22.04.2024
Мониторинг жизненно важных функций при сепсисе. Поддержание адекватного газообмена при сепсисе.
Больные с тяжелым сепсисом или септическим шоком должны быть транспортированы в ОРИТ, так как они нуждаются не только в проведении интенсивной терапии, но и динамическом мониторинге нарушенных витальных функций. Объем мониторинга зависит от возможностей ЛПУ и, как правило, включает неинвазивное определение систолического, диастолического, среднего артериального давления, ЧСС, пульса, частоты дыхания, сатурации крови, температуры тела.
Обеспечение надежного сосудистого доступа, достигаемое катетеризацией подключичной вены, непременно должно сопровождаться оценкой ЦВД, забором крови для посева на гемокультуру и лабораторных исследован™, включающих определение уровней гемоглобина, эритроцитов, лейкоцитов с подсчетом ЛИИ, гематокрита, общего белка и его фракций, глюкозы, трансаминаз, билирубина, азотемии. Обязательным являются также исследования состояния гомеостаза (коагуло-грамма), кислотно-основного равновесия, оценка уровня содержания электролитов в крови.
Мониторинг показателей центральной гемодинамики достигается выполнением интегральной реографии тела по М. И. Тищенко или катетеризацией легочной артерии катетером Свана-Ганца, что позволяет у больного с септическим шоком в динамике оценивать ударный объем и расчетным путем определять сердечный выброс (СВ), сердечньш индекс (СИ), общее периферическое сопротивление сосудов (ОПСС) и другие показатели, давление заклинивания легочных капилляров (ДЗЛК), О ЦК, оксигенацию смешанной венозной крови (Sv02).
Контроль темпа диуреза осуществляется путем установки в мочевом пузыре катетера Фолея.
Поддержание адекватного газообмена
Адекватная и своевременная респираторная поддержка - один из основополагающих компонентов терапии сепсиса и септического шока, позволяющий наряду с поддержанием кислородного транспорта и снижением работы дыхания, уменьшить скорость реакции цитокинового каскада.
Проведение оксигенотерапии требует тщательной санации трахеобронхиального дерева и обеспечения проходимости дыхательных путей. Если после эвакуации мокроты из трахеобронхиального дерева и устранения бронхообструкции признаки ОДН сохраняются, то это указывает на паренхиматозный характер ОДН и диктует необходимость дополнительных лечебных мероприятий.
Оксигенотерапия начинается с ингаляции увлажненного кислорода через носовые катетеры или лицевую маску, что позволяет довести Fi02 до 0,4-0,6.
Ингаляция 100% кислорода может осуществляться только непродолжительное время, так как высокие концентрации кислорода за счет токсического действия способствуют развитию респираторного дистресс-синдрома.
Нарушение сознания у больного, выраженное тахипноэ (более 40 в минуту) с участием вспомогательной мускулатуры, патологические ритмы дыхания являются показанием для интубации трахеи и перевода больного на управляемую ИВЛ. Клинические показания к переводу на ИВЛ должны быть дополнены инструментальными, к которым относятся рост Р(А-а)02 выше 350 мм рт. ст., уменьшение Ра02 ниже 70 мм рт. ст., снижение отношения Pa02/Fi02 менее 180 мм рт. ст., увеличение РаС02 более 50 мм рт. ст., полученные на фоне ингаляции 100% кислорода.
Следует обратить внимание на важность инструментальных показаний к ИВЛ у больных с септическим шоком, так как респираторная поддержка должна начинаться как можно раньше, до клинических проявлений нарушения равновесия между состоянием легочного газообмена и компенсаторными возможностями /организма, нарушение которых ведет к значительному ухудшению транспорта и потребления кислорода.
ИВЛ у больных септическим шоком проводится в режиме PEEP до 5-7 см H2О, Vt = 6,0-7,5 мл/кг и частотой дыхания до 16 в минуту. В случае развития респираторного дистресс-синдрома ИВЛ осуществляется в режиме "защиты легких": Vt = 4-6 мл/кг, PEEP - 10-15 см Н2О, Ppeak -менее 35 см Н2О, FiO2 менее 0,65, частота дыхания - 18 в минуту с тем, чтобы поддерживать РаС>2 на уровне не менее 80 мм рт. ст. и Sp02 не менее 90% Синхронизация больного с респиратором достигается внутривенным введением оксибутарата натрия в дозе 100-120 мг/кг.
Нормализацию кислородного потока в организме больного необходимо сочетать со снижением повреждающего Действия тканевой гипоксии. С этой целью используются антигипоксанты, которые либо снижают потребление кислорода, либо улучшают его утилизацию. Дозировки антигипоксантов представлены в таблице.
На адекватность респираторной поддержки у больных с септическим шоком указывает стабилизация пороговых значений кислородного потока в организме: SpO2 не менее 90%, доставка кислорода на уровне 570-600 мл/мин, потребление кислорода на уровне 170— 180 мл/мин при среднем артериальном давлении более 70-75 мм рт. ст., а также энергетическая стабилизация клеток организма, оцениваемая по снижению уровней лактата (до 2,0 ммоль/л), глюкозы (5,5-7,0 ммоль/л) и пирувата (до 30-40 Ед/л).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В том же 2016 году в США было проведено исследование затратности медицинской помощи, оказываемой в интенсивном краткосрочном режиме. Среди состояний, требующих наиболее дорогостоящего неотложного ответа, сепсис оказался на первом месте (остеоартрит на втором, перинатальная патология на третьем, осложнения имплантации на четвертом, инфаркт миокарда на пятом).
В 2018 году было доказано, что внедрение новых протоколов интенсивной терапии сепсиса достоверно снижает летальность. Тем не менее, она остается высокой и оценивается на уровне 20-35%, а при септическом шоке (наиболее тяжелой, предельно выраженной форме сепсиса) варьирует в диапазоне 30-70%.
С 2015 года в Санкт-Петербурге активно работает мультидисциплинарное Общество специалистов по сепсису.
13 сентября отмечается Всемирный день борьбы с сепсисом.
Причины
Причиной сепсиса теоретически может быть любой микроорганизм, – будь то бактерия, вирус, грибок, простейшее, – способный вызывать у человека инфекционно-воспалительный процесс.
На практике чаще всего выявляются гноеродные стрептококки и стафилококки, менингококки, пневмококки, клебсиелла, кишечная палочка и др. Первичным очагом примерно в половине диагностированных случаев оказывается легочная инфекция, затем следуют кишечные и урогенитальные инфекции. Однако диагностировать определенный первичный очаг не удается, по меньшей мере, в каждом третьем случае.
Главными факторами риска выступают ослабленный иммунитет (в частности, именно поэтому высока частота постоперационных, послеродовых, посттравматических сепсисов, а также сепсисов у пожилых и новорожденных, больных ВИЧ/СПИД, онкопатологией, заболеваниями печени и почек).
В основе патогенеза лежат грубые нарушения тканевой микроциркуляции крови, запускающие каскад взаимопотенцирующих патологических процессов (орган за органом, система за системой начинают дисфункционировать и угрожают полным отказом), а также общая интоксикация продуктами жизнедеятельности возбудителя инфекции (экзо- и эндотоксинами). Тем и определяется клиническая картина сепсиса.
Симптоматика
В ряде случаев при выраженной почечной, печеночной, легочной, сердечной недостаточности на фоне сепсиса изменения в тканях становятся необратимыми и спасти больного не удается.
Диагностика
Лечение
Первоочередными направлениями интенсивной терапии при сепсисе и/или септическом шоке включают санацию первичного очага инфекции (в ряде случаев необходимо экстренное хирургическое вмешательство или ударные дозы мощных бактериостатиков); восстановление нормальной гемодинамики и, в частности, микроциркуляции, а также сердечной деятельности и дыхания; детоксикация; предотвращение тромбоза, геморрагий, дегидратации (обезвоживания); нормализация психического статуса, стабилизация общего состояния пациента.
Дальнейшие реабилитационные мероприятия разрабатываются в каждом случае индивидуально.
Респираторная поддержка при сепсисе - показания к ИВЛ
Дыхательные нарушения у больных сепсисом имеют сложный комплексный характер. По современным представлениям, спектр дыхательных нарушений при сепсисе является очень широким — от острого легочного повреждения (ОЛП) до острого респираторного дистресс-синдрома (ОРДС). ОЛП развивается примерно у 40 % больных сепсисом, ОРДС — у 25—42 %, причем частота возрастает при развитии артериальной гипотензии. В 1994 г. на согласительной евро-американской конференции по ОРДС было разработано унифицированное определение ОЛП и ОРДС.
Именно снижение величины дыхательного коэффициента положено в основу разделения респираторного дистресс-синдрома и острого легочного повреждения.
Эти критерии позволяют производить более точную эпидемиологическую оценку, несмотря на варьирование абсолютного количества случаев в пределах от 5 до 71 на 100 000 населения.
В 1988 г. была опубликована шкала легочных повреждений, которая позволяет не только разделить пациентов по тяжести повреждения, но и имеет прогностическое значение. Первоначальная оценка более 3,5 балла коррелировала с выживанием только 18 % пациентов, 2,5—3,5 — 30 %, 1,1— 2,4 - 59 %, а оценка ниже 1,1 балла — 66 %.
Критерии ОЛП и ОРДС
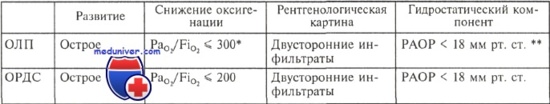
* PaО2/FiО2 — дыхательный коэффициент: отношение давления кислорода в артериальной крови к концентрации кислорода во вдыхаемом воздухе.
** РАОР —давление заклинивания в легочной артерии.
Дыхательная недостаточность является ведущим компонентом полиорганной дисфункции и недостаточности у больных сепсисом. Потребность в респираторной поддержке возникает у больных тяжелым сепсисом и септическим шоком. Сложность проблемы заключается в развитии тяжелого интерстициального отека и последующего повреждения легочной ткани, которые приводят к снижению эффективности переноса газов через альвеолярную мембрану легких.
Инсуфляция кислорода в дыхательные пути с помощью носовых катетеров или маски оказывает положительное влияние только на начальных стадиях острого легочного повреждения. Нарастание интерстициального отека легких приводит к тому, что обычно функционирующий объем альвеол оказывается недостаточным, и возникает необходимость в проведении ИВЛ с созданием положительного давления в дыхательных путях для увеличения объема участвующих в дыхании альвеол, однако создание высокого давления опасно развитием баротравмы легких.
Повышение содержания кислорода во вдыхаемом воздухе также имеет свои пределы из-за токсического действия кислорода на альвеолярную мембрану, нарушения синтеза сурфактанта (белок, поверхностно активное вещество, предупреждающее спадение альвеол) и возникновение других проблем. В тяжелых случаях респираторного дистресс-синдрома для обеспечения жизненнонеобходимых параметров вентиляции приходится прибегать к методам ИВЛ, которые находятся далеко за параметрами физиологического дыхания, требуют применения специального оборудования и тщательного многофакторного контроля.
Балльные шкалы острого легочного повреждения, респираторного дистресс-синдрома, степени легочного повреждения служат объективными показателями, на основании которых определяется тактика лечения и прогноз исхода заболевания у больных с наличием острой дыхательной недостаточности, развившейся в результате сепсиса. Рандомизированные исследования являются основой доказательной медицины. Однако проведение достаточных по репрезентативности рандомизированных исследований требует жесткой систематизации медицинских знаний. До получения данных рандомизированных исследований во многих областях медицины практические рекомендации могут содержать разделы, которые отражают мнение экспертов в определенной области, как правило, основанных на современных данных. Следование этим рекомендациям является хорошим тоном, но не обязательным с точки зрения доказательной медицины. Настоящий раздел содержит рекомендации по особенностям лечения острой дыхательной недостаточности больных сепсисом, основанные на данных нерандомизированных исследований.
Шкала легочного повреждения (общая сумма баллов делится на количество выявленных компонентов)
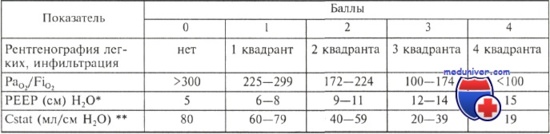
* PEEP — положительное давление в дыхательных путях в конце выдоха (произвольный параметр проведения ИВЛ).
** Cstat — растяжимость легочной ткани при определенных параметрах тестирования.
Адекватная респираторная поддержка улучшает оксигенацию и результаты лечения больных сепсисом
В некоторых случаях адекватная оксигенация (показатель сатурации О2 выше 90 %) может быть достигнута с помощью инсуфляции кислорода через назальную канюлю или лицевую маску. Эндотрахеальная интубация применяется для создания постоянного положительного давления в конце выдоха (PEEP), повышения среднего давления в дыхательных путях и снижения концентрации кислорода во вдыхаемом воздухе (FiО2
Целью респираторной терапии является достижение адекватной доставки кислорода в ткани, испытывающие гипоксию, в условиях нарушенной микроциркуляции.
При проведении ИВЛ изменением различных параметров можно добиваться различного давления на вдохе и достигать различных результатов лечения. Показатели измерения ок-сигенации методом пульоксиметрии (определение насыщения кислорода в крови с помощью специального датчика, надеваемого на ногтевое ложе пальцев рук) обычно хорошо коррелируют с насыщением артериальной крови кислородом.
Однако у 7 % пациентов такой корреляции не наблюдается из-за выраженной тахикардии, низкого сердечного индекса или высокого давления заклинивания легочной артерии (определяемого с помощью катетера Сван-Ганса, установленного в устье легочной артерии).
У таких больных необходимо проводить мониторинг оксигенации артериальной крови и поддерживать сатурацию на уровне 88—90 % (что соответствует насыщению артериальной крови кислородом на уровне 60 мм рт. ст.) с концентрацией кислорода во вдыхаемой смеси (FiО2) ниже 60 %.
Необходимо избегать применения неинвазивной вентиляции с положительным давлением у больных сепсисом
Метод неинвазивной вентиляции легких с положительным давлением заключается в применении специальной герметичной лицевой маски, позволяющей точно дозировать концентрацию кислорода во вдыхаемом воздухе и создавать положительное давление в дыхательных путях. Этот метод является эффективным у небольшой группы пациентов в сознании без увеличения бронхиальной секреции на ранних этапах развития дыхательной недостаточности (менее 72 ч), что редко бывает при ОЛП/ОРДС. Задержка дыхания с началом ИВЛ может быть причиной развития осложнений, поэтому применение этого метода не рекомендуется для больных сепсисом.
Интубация трахеи не влияет на исход лечения больных сепсисом, в то время как проведение ИВЛ достоверно улучшает результаты лечения больных с сепсисом и дыхательной недостаточностью. Показания к интубации трахеи и началу проведения ИВЛ у больных с сепсисом основаны на стандартных клинических признаках дыхательной недостаточности. Показанием для начала ИВЛ являются: тахипноэ (частота дыхания более 40 в минуту), включение в акт дыхания дополнительной мускулатуры, нарушение сознания, тяжелая гипоксемия, которая не может быть компенсирована инсуфляцией кислорода.
При ОЛП/ОРДС поддержание нормального уровня рН и содержания углекислоты в артериальной крови (Расо2) необязательно. Применение умеренной гиперкапнии позволяет снижать дыхательный объем у пациентов с ОЛП/ОРДС, которым проводится ИВЛ, что позволяет снизить высокое давление на воохе, риск баро-и волюмотравмы легких. Выбор параметров ИВЛ, который позволяет снизить дыхательный объем и объем минутной вентиляции для предотвращения чрезмерного растяжения альвеол и повреждения легочной ткани у больных сепсисом, приводит к повышению концентрации углекислоты в артериальной крови (Расо2). Безопасность и эффективность применения ИВЛ с гиперкапнией были показаны в серии некрупных исследований.
До настоящего времени допустимый верхний предел концентрации углекислоты в артериальной крови точно не определен. Накопление углекислоты приводит к пропорциональному снижению рН артериальной крови. Считается необходимым поддерживать параметры ИВЛ, которые бы обеспечивали адекватную оксигенацию крови и не способствовали снижению рН крови ниже 7,2. Применение таких параметров ИВЛ не сопровождалось развитием осложнений и приводило к снижению летальности больных сепсисом.
Применение низкого дыхательного объема улучшает результаты лечения ОЛП, а вентиляция с ограничением по давлению не способствует улучшению результатов лечения ОЛП. При применении ИВЛ у больных с ОЛП необходимо использовать небольшие дыхательные объемы (примерно 6 мл/кг идеальной массы тела) для поддержания плато давления в конце выдоха ниже 30 см Н2О. Крупные исследования по сравнению влияния разных дыхательных объемов на уровень инспираторного давления дали различные результаты, причем причина этих различий до настоящего времени непонятна. В недавнем крупном исследовании больных с ОЛП было показано, что общая летальность снизилась на 10 % в группе пациентов, которым проводилась ИВЛ с дыхательным объемом 6 мл/кг идеальной массы тела. Эта методика недавно была поддержана группой международных экспертов.
Применение ИВЛ в положении на животе позволяет улучшить газообмен пациентов с ОЛП, однако не доказано его положительного влияния на исходы лечения больных сепсисом. Применение ИВЛ в положении пациента на животе способствует дополнительному включению в дыхание задненижних отделов легких. Показанием к применению этого метода является тяжелый ОРДС с необходимостью применения высоких концентраций кислорода во вдыхаемой смеси (FiО2 > 60 %). Ограничением для его применения являются наличие противопоказаний и отсутствие опыта проведения ИВЛ в этом положении у персонала ОРИТ. В некрупных рандомизированных исследованиях были доказаны физиологические преимущества этого метода ИВЛ, заключавшиеся в повышении оксигенации крови у 65 % больных с ОЛП/ОРДС.
Улучшение газообмена наблюдалось даже спустя 18 ч после перекладывания пациента на спину. Однако ограниченное количество пациентов и отсутствие четких показаний, методики применения и оценки эффективности снижают его привлекательность.
Ингаляция оксида азота влияет на оксигенацию, но не влияет на результаты лечения больных с ОЛП/ОРДС. Оксид азота (NО) является физиологическим регулятором базального тонуса сосудов. Известно, что физиологическим ответом на гипоксию является спазм сосудов легких. Вдыхание оксида азота может оказывать мощное сосудорасширяющее действие на легочные сосуды и улучшать оксигенацию. Именно поэтому были проведены исследования, которые подтвердили, что ингаляция оксида азота улучшала оксигенацию и способствовала снижению отека легких у больных с ОЛП/ОРДС путем влияния на гидростатическое давление.
Однако улучшение оксигенации и снижение отека легких не приводило к достоверному снижению летальности, поэтому рекомендуется ограничить применение оксида азота у пациентов с тяжелой гипоксемией, представляющей угрозу для жизни, которая не может быть компенсирована применением обычных методов ИВЛ. До настоящего времени нет определенных рекомендаций по рациональному применению инфузионной терапии у больных ОЛП/ОРДС. Из-за отсутствия данных сравнительных исследований, посвященных инфузионной терапии, нет жестких правил применения кристаллоидных и коллоидных препаратов. У больных с ОЛП/ОРДС и синдромом высокой сосудистой проницаемости следует комбинировать применение кристаллоидных и коллоидных растворов во избежание избыточной гидратации легких. Коллоидные растворы рационально назначать пациентам с низким онкотическим давлением крови. Нет рекомендаций по оптимальному объему инфузионной терапии несмотря на то, что с момента открытия этого синдрома дискуссии в отношении инфузионной терапии были очень острыми. Имеются противоречивые мнения экспертов относительно пользы коллоидных и кристаллоидных растворов.
Считается, что для разрешения актуальных вопросов требуется более пристальное внимание специалистов и проведение крупных исследований в этой области.
Применение кортикостероидных гормонов не показано для профилактики и лечения ранней (экссудативной) фазы ОРДС. В отношении лечения поздней (фибропролиферативной) фазы ОРДС данных пока недостаточно. Не рекомендуется применять кортикостероидные гормоны пациентам с высоким риском или наличием критериев ОЛП/ОРДС. Не получено данных, подтверждающих пользу применения кортикостероидных гормонов для профилактики и раннего лечения ОРДС. Эффективность применения кортикостероидов в более поздней фазе ОРДС в настоящее время изучается.
Ежедневная тренировка спонтанного дыхания и следование протоколу отлучения пациентов от ИВЛ снижает продолжительность ИВЛ. Всем пациентам с приемлемым уровнем респираторной поддержки и стабильным состоянием рекомендуется ежедневно производить оценку возможности самостоятельного дыхания. Для выявления пациентов, способных к самостоятельному дыханию, необходимо проводить короткий скрининг и тренировать самостоятельное дыхание. Из процесса скрининга исключаются пациенты, нуждающиеся в проведении ИВЛ. Основными критериями, указывающими на возможность начала отлучения от ИВЛ, являются: снижение потребности в концентрации кислорода во вдыхаемом воздухе ниже 50 % (FiО2
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сепсис – жизнеугрожающее состояние, развивающееся в рамках реакции организма на инфекцию; только в США ежегодно регистрируется около 1.7 млн случаев. Сепсис может приводить к полиорганной недостаточности и характеризуется высоким уровнем летальности.
Несмотря на все усилия, за последние десятилетия не удалось разработать таргетированные (нацеленные, прицельные) средства купирования данного состояния. Новые перспективы открывает опубликованный в Journal of Leukocyte Biology отчет о результатах работы группы специалистов из Калифорнийского университета в Риверсайде. Коллектив возглавляли Мира Наир и Адам Годжик, сотрудники медицинского факультета.
Были идентифицированы молекулярные биомаркеры и пути, изучена динамика иммунных клеток и другие процессы, ассоциированные с сепсисом и могущие служить терапевтическими мишенями в предотвращении летальных исходов. В частности, изучались протеины CD52 и S100A9, задействованные в воспалительном процессе; при сепсисе их экспрессия резко увеличивается. Согласно полученным результатам, динамика этих биомаркеров на ранних стадиях развития сепсиса, – а именно, в первые шесть часов, – может служить прогностическим признаком выживаемости. Один из указанных белков, по словам Миры Наир, является молекулярным драйвером (движителем, индуктором) воспалительного процесса, другой служит антисептическим протектором. Отмечается также, что найдены молекулярные пути, обусловливающие определенное сходство между фатальным сепсисом и COVID-19. По мнению авторов, дальнейший анализ этих путей может принести данные, которые существенно усовершенствуют диагностику и лечение обоих заболеваний.
В частности, обнаружено сходство в процессах утраты тромбоцитами их функциональной состоятельности при сепсисе и коронавирусной болезни. Исследователи утверждают, что разработка способа восстановления функции тромбоцитов посредством таргетированного воздействия на главные регуляторы этих процессов позволит обеспечить выживаемость пациентов как при сепсисе, так и при COVID-19. Подчеркивается, что существующие на сегодняшний день системы клинической оценки недостаточно достоверны в прогностическом и терапевтическом аспектах, т.е., проще говоря, не позволяют быстро и точно оценить ситуацию, чтобы принять решение о наиболее эффективном ответе.
Благодаря применению высокотехнологичных методов исследовательской группе удалось проследить и изучить поведение каждого типа клеток в динамике развития сепсиса и тяжелого острого респираторного синдрома (SARS). Авторы подчеркивают, что глобальной проблемой здравоохранения остается не только коронавирусная пандемия, но и сепсис, поскольку в ряде стран до 30% всех внутрибольничных смертей обусловлены именно этим состоянием. Мультидисциплинарная группа с оптимизмом расценивает полученные результаты и в настоящее время продолжает интенсивно работать над созданием методологии купирования острых жизнеугрожающих состояний, близких по механизмам запуска и развития.
Дата публикации: 09 апр. 2019
Больница рассматривает введение набора мероприятий при поступлении пациента с сепсисом, которые необходимо выполнить в течение 1го часа. Вы являетесь заведующим отделением неотложной помощи небольшого стационара. В стационаре имеется небольшое отделение реанимации, а пациенты, которым требуется более сложное лечение переводятся в другой стационар.
Вы обсуждали со своими коллегами лечение сепсиса, так как недавно было опубликовано обновленное руководство по сепсису. Новое руководство рекомендует, что все пациенты с сепсисом должны получить набор вмешательств в течение 1го часа от поступления (так называемая связка 1го часа). Набор вмешательств включает замер уровня лактата, забор крови на посев до введения антибиотиков, введение антибиотиков широкого спектра действия, введение кристаллоидных растворов 30 мл/кг веса, применение вазопрессоров если сохраняется гипотензия несмотря на инфузионную терапию.
Вы уже применяете в вашем стационаре связку 3х часов. Вам известно, что оценка введенной обязательной связки 3х часов при сепсисе показало, что быстрое выполнение данной связки было связано с более низкой внутригоспитальной смертностью. После выхода обновленного руководства врачи отделения реанимации высказались за внедрение нового руководства и выполнение связки при сепсисе в течение 1го часа.
Однако другие сотрудники отделения реанимации высказывают опасения, что сужение 3х часовой связки мероприятий в 1 час приведет к задействованию большего количества сотрудников и отнимет этих сотрудников от других чувствительных ко времени пациентов с неотложными состояниями, и может негативно повлиять на исходы в отделении реанимации.
Администратор больницы зашел к вам, чтобы обсудить будет ли надлежащим внедрение связки в 1 час при оказании помощи пациентам с сепсисом. В особенности, руководство больницы спрашивает, как такое внедрение может повлиять на исходы пациентов и на качество лечения, а также на показатели работы отделения реанимации и всего стационара.
Какой подход вы бы порекомендовали для данного стационара:
1) Внедрить 1ну часовую связку при сепсисе.
2) Оставить 3х часовую связку при сепсисе.
На момент написания данного обзора ответили 938 врачей (смотрите результат на картинке). Опрос еще не закончен.
Читайте также:

