Сколько препаратов необходимо принимать чтобы лечение было успешным при вич
Обновлено: 18.04.2024
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
На сегодняшний день ВИЧ-инфекция неизлечима полностью. Но своевременная и грамотно подобранная высокоактивная антиретровирусная терапия (ВААРТ), успешно сдерживает прогрессирование заболевания и его переход в стадию СПИД. Прием терапии позволяет ВИЧ-инфицированному пациенту жить полноценной жизнью – учится, работать, создавать семью, заниматься любимым делом и даже иметь здоровых детей. При своевременном выявлении ВИЧ, на время приема терапии вирус в крови не обнаруживается, человек безопасен для окружающих, инфекция не влияет на продолжительность жизни.

Каждый год для борьбы с ВИЧ разрабатывают новые препараты.
Что такое антиретровирусная терапия?
Высокоактивная антиретровирусная терапия – это современный метод терапии ВИЧ-инфекции. Она подразумевает прием 3-4 препаратов, действие которых направлено на подавление вируса иммунодефицита. Проводимая терапия преследует сразу 3 жизненно важных цели.
- Вирусологическая – подавляет самовоспроизведение вирионов вируса в организме пациента.
- Иммунологическая – поддерживает стабильность иммунной системы для формирования адекватного иммунного ответа.
- Клиническая – тормозит развитие СПИДа и сопутствующих ему заболеваний, тем самым повышая качество жизни и увеличивая ее продолжительность.
Отказ от терапии неизбежно приводит к осложнениям и развитию СПИДа. Люди, живущие без терапии, сталкиваются с онкологическими патологиями и оппортунистическими инфекциями, вызывающими развитие туберкулеза, менингита, энцефалита, пневмонии и других заболеваний. Продолжительность жизни на стадии СПИД без лечения не превышает 6-9 месяцев.
Принцип действия терапии анти-ВИЧ
В основе ВААРТ лежит комбинация 3-4 препаратов, действие которых подавляет ВИЧ на всех стадиях развития, в том числе и его мутации. Проблема в том, что помимо способности создавать собственные копии (репликации), вирус иммунодефицита характеризуется высокой мутагенностью – он способен подстраиваться под любые неблагоприятные условия, продолжая создавать свои репликации и мутации.
Как принимать АРВТ?
Антиретровирусная терапия проводится с соблюдением следующих принципов.
- Лекарства принимаются в строго определенное время!
- Пропускать прием препаратов нельзя!
- Самостоятельно увеличивать или уменьшать дозу препарата недопустимо!
- Препараты, режим приема и дозу препарата назначает только врач!
В процессе лечения состав АРВТ может корректироваться, что позволяет добиться максимальной эффективности проводимого лечения.
Важно понимать, что вопросы по типу, “принимать ли мне сегодня лекарства или не принимать?”, в данном случае не уместны. Конечно, соблюдать столь строгий режим, по понятным причинам, по силу не каждому пациенту. Но жить с ВИЧ без терапии – это равносильно собственноручно подписанному смертному приговору, когда у человека есть выбор и возможности для спасения.
Где выписать лекарства от ВИЧ?
Лечением ВИЧ-инфекции занимается врач-инфекционист Свердловского областного центра профилактики и борьбы со СПИД. Главное помнить – самолечение не допустимо! При подозрении на ВИЧ и после подтверждения диагноза, лечением инфекции должен заниматься исключительно профильный специалист.
Большая часть лекарств от ВИЧ находятся в списке жизненно необходимых и важнейших лекарственных препаратов. Поэтому расходы на лечение пациентов оплачиваются государством – за счет федерального и регионального бюджета. Препараты выдаются ВИЧ-позитивным пациентам в Свердловском областном центре профилактике и борьбе со СПИДили в аптеках при наличии рецепта от лечащего врача. Для их получения, пациента в обязательном порядке ставят на диспансерный учет.
Какие лекарства лечат ВИЧ?
Для общего ознакомления перечислим классы лекарств, принцип их действия и препараты с помощью наглядной таблицы.
Нуклеозидные ингибиторы* обратной транскриптазы
Подавляют обратную транскриптазу - фермент ВИЧ, который отвечает за создание ДНК репликаций
Абакавир, Зальцитабин, Ламивудин, Ставудин и др.
Ненуклеозидные ингибиторы обратной транскриптазы
Воздействуют на обратную транскриптазу
Невирапин, Рилпивирин, Эфавиренз, Элсульфавирин и др.
Блокируют фермент-протеазу вируса, в результате чего образуются вирионы, не способные заражать новые клетки организма
Ампренавир, Индинавир, Нелфинавир, Ритонавир и др.
Блокируют фермент вируса, который участвует в процессе встраивания вирусной ДНК в геном клетки-мишени
Ралтегравир, Долутегравир, Элвитегравир.
Препятствуют проникновению вирионов ВИЧ в клетку-мишень
Блокируют последний этап проникновения вирионов ВИЧ в клетку-мишень
*Ингибиторы – вещества, подавляющие течение физиологических процессов.
Несмотря на важность и жизненную необходимость лечения, в некоторых случаях, пациенты могут не выдерживать график приема лекарств, что затрудняет проведение терапии и снижает ее эффективность. Поэтому сегодня специалисты активно разрабатывают новые схемы ВААРТ, предполагающие однократный прием препарата - 1 раз в сутки. Для однократного приема уже одобрены такие лекарства, как Атазанавир, Абакавир, Диданозин, Тенофовир, Ламивудин, Эмтрицитабин, Эфавиренз и другие самые современные антиретровирусные средства.
Популярные вопросы и проблемы ВААРТ
Можно ли заразиться, если партнер принимает терапию?
Грамотно проводимая ВААРТ угнетает активность вируса, поэтому риск заражения минимальный. Но только в том случае, если у ВИЧ-позитивного пациента зафиксированы низкие или неопределяемые показатели вирусной нагрузки на организм. Если же вирусная нагрузка высокая, то риск инфицирования возрастает.
Половые партнеры должны быть информированы о ВИЧ-статусе друг друга. Наличие сопутствующих инфекций, передающихся половым путем, а также гепатита, увеличивает вероятность передачи инфекции в 3-5 раз. Даже при условии, что уровень вирусной нагрузки снижается до 3500 копий РНК ВИЧ и ниже в 1 мл крови, все равно риск передачи инфекции сохраняется. Поэтому половым партнерам необходимо использовать презервативы при любой форме полового акта.
Можно ли пить алкоголь во время терапии?
Препараты антиретровирусной терапии не совместимы с алкоголем. Более того! Прием алкоголя угнетает функции и без того ослабленной иммунной системы, создает повышенную нагрузку на организм и усиливает токсическое влияние ингибиторов – принимаемые в ходе ВААРТ препараты.
Можно ли родить здорового ребенка, если принимать ВИЧ терапию?
Применение грамотной ВААРТ позволяет снизить риск передачи инфекции до 2% и ниже. Поэтому у новорожденных от ВИЧ-инфицированной матери есть все шансы не унаследовать заболевание. Подтвердить или опровергнуть ранний диагноз позволяет своевременная диагностика методом ПЦР (полимеразной цепной реакции). Для этого кровь малыша исследуют два раза - в возрасте 1-4 месяцев, и в возрасте старше 4 месяцев. Если оба раза результаты ПЦР отрицательные, то можно говорить о том, что ребенок родился здоровым.
Мне назначили ВААРТ, но мне от нее хуже, что делать?
Антиретровирусные препараты для лечения ВИЧ обладают побочным действием, собственно, как и любые лекарства. Часть побочных эффектов проявляется практически сразу. Например, у пациента повышается температура, появляются проблемы с желудочно-кишечным трактом, кожные высыпания, увеличивается уровень инсулина в крови. ВИЧ-позитивный пациент может заметно худеть или набирать вес. Возникающие побочные эффекты создают дополнительную нагрузку на организм. Чтобы избежать этого, необходимо регулярно проходить обследование и при необходимости корректировать схему проводимой ВААРТ. Именно корректировать, а не отказываться от лечения!
Можно ли заразиться ВИЧ, если принять терапию после вероятного заражения?
У моего полового партнера ВИЧ, нужно ли мне проходить терапию, чтобы не заразиться?
Проходить ВААРТ здоровому человеку с целью профилактики ВИЧ не нужно. Достаточно использовать презерватив во время каждого полового контакта в любой форме.
Важно знать! Продолжительность жизни ВИЧ-инфицированного пациента зависит не только от эффективности ВААРТ, но и общего состояние здоровья и иммунитета. Организм людей с крепким иммунитетом, которые не имеют в своем анамнезе хронических заболеваний и врожденных патологий, лучше противостоит развитию ВИЧ-инфекции. И наоборот, ослабленный организм не в состоянии бороться с вирусом. Поэтому помимо антиретровирусной терапии, всем ВИЧ-положительным пациентам рекомендован здоровый образ жизни и правильное питание. Они должны беречь себя от инфекционных и простудных заболеваний. Укреплять свой иммунитет и в обязательном порядке проходить регулярное обследование организма.
Все интересующие вопросы лучше задавать профильным специалистам Свердловского СПИД-центра или лечащему врачу по месту жительства.
Вирусная нагрузка – важный показатель состояния организма ВИЧ-положительного пациента. Она рассчитывается путем подсчета количества копий РНК ВИЧ (вирусных частиц) в 1 миллилитре плазмы крови. Полученные показатели указывают на степень тяжести вирусной инфекции. Благодаря им можно оценить эффективность проводимой ВААРТ, и прогнозировать дальнейшее развитие заболевания. Для создания более полной картины болезни, анализ на вирусную нагрузку проводится вместе с тестом на уровень CD4-лимфоцитов – антигены иммунной системы, отображающие ее состояние.
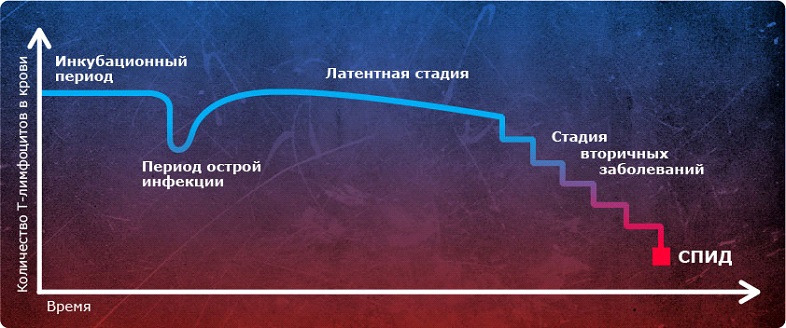
Без приёма терапии со временем снижается уровень СД4 клеток.
Как можно узнать уровень вирусной нагрузки на организм?
По сути, вирусная нагрузка отображает количество ВИЧ в крови. В то время как количество CD4 клеток демонстрирует состояние иммунной системы. Регулярный мониторинг этих двух показателей позволяет своевременно принимать решения – назначать ВААРТ и корректировать лечение, тем самым сдерживая прогрессирование ВИЧ-инфекции.
Анализ на вирусную нагрузку необходимо делать в следующих случаях.
- При подозрении на ВИЧ-инфекцию.
- При постановке диагноза ВИЧ.
- До начала антиретровирусной терапии – каждые 3-6-12 месяцев.
- Через 1 и 3 месяца после начала ВААРТ и далее каждые 3-4 месяца в ходе ее проведения.
Именно оценивая динамику вирусной нагрузки, лечащий инфекционист может сделать заключение об эффективности лечения и при необходимости корректировать ВААРТ.
Для определения вирусной нагрузки проводятся лабораторные исследования, с применением одного из нижеследующих методов.
- ПЦР (полимеразная цепная реакция) – обнаруживает вирус, начиная с 20 - 40 копий в 1 мл крови.
- Метод разветвленной ДНК – менее чувствительный и обнаруживает большое количество копий.
- NASBA (метод транскрипционной амплификации) – очень чувствительная методика, способная увеличивать белки вируса, для того чтобы определить его количество. Однако в России NASBA пока не получил широкое распространение.
Принципиальное различие методов и степень их чувствительности могут стать причиной недостоверного результата. Поэтому специалисты рекомендуют для определения вирусной нагрузки выбрать какой-нибудь один метод и использовать его на постоянной основе.
Расшифровка результатов исследований на ВИЧ
Полученные в ходе исследования вирусной нагрузки результаты расшифровываются следующим образом.
- До 10 000 копий вируса – низкая вирусная нагрузка.
- Свыше 100 000 копий – высокая вирусная нагрузка.
- 0 копий – вируса в организме нет, что считается нормой для здорового человека и указывает на необходимость повторного исследования для ВИЧ-инфицированных пациентов.
Неопределяемая вирусная нагрузка – минимальное количество копий, наличие которых невозможно зафиксировать с помощью выбранного метода исследования.
Таким образом, неопределяемая вирусная нагрузка – это показатель, к которому стремятся все ВИЧ-инфицированные пациенты. Такой результат указывает на то, что вирус в организме есть, но его количество ничтожно мало и на данный момент человеку ничего не угрожает. Одна при этом обязательно необходимо оценить общее состояние иммунной системы. Для этого нужно определить количество CD4+антигенов Т-лимфоцитов. Норма клеток и возможные отклонения приведены в нижеследующей таблице.
| Количество CD4 | Возможные действия пациента |
|---|---|
| 1500 – 500 кл/мл | норма |
| 500 - 350 кл/мл | необходимо начать ВААРТ |
| 200 кл/мл и ниже | проводят ВААРТ |
| Менее 100 кл/мл | проводят ВААРТ и симптоматическую терапию |
Оценивая показатели вирусной нагрузки и CD4 можно сделать достоверное заключение о состоянии здоровья пациента. Если зафиксирована низкая вирусная нагрузка, например, 4000 копий и показатели CD4 в норме, то ВААРТ эффективна. И наоборот – высокая вирусная нагрузка при снижении показателей CD4 свидетельствуют о низкой эффективности лечения.
Как уменьшить вирусную нагрузку?
Тест на вирусную нагрузку отражает степень тяжести ВИЧ-инфекции и состояние организма. Естественно, что столкнувшись с высокими показателями нагрузки, пациенты стремятся ее снизить. Нередко для этой цели они прибегают к альтернативным методам лечения. Но проблема в том, что единственный способ снизить вирусную нагрузку – это эффективная ВААРТ. Иммуностимуляторы, иммуномодуляторы, витаминные комплексы, отвары трав и прочие средства, не оказывают никакого влияния на развитие ВИЧ-инфекции. Снизить нагрузку можно только с помощью антиретровирусной терапии.
Преимущества неопределяемой низкой нагрузки
Низкая или неопределяемая вирусная нагрузка желательна по нескольким причинам.
- Минимальный риск прогрессирования инфекции.
- Минимальный риск развития резистентности к препаратам ВААРТ.
- Минимальный риск передачи инфекции во время незащищенного полового контакта.
- Максимальный шанс родить здорового ребенка (для женщин).

Антиретровирусная терапия (АРВТ) применяется у людей, живущих с ВИЧ, начиная с 90-х годов прошлого века. Стандартом лечения считается комбинация не менее трех действующих веществ, минимум два из которых отличаются механизмом своего действия. Но медицинская наука не стоит на месте - появляются новые классы препаратов, улучшена фармакокинетика, повышена эффективность терапии. Это позволило оптимизировать схемы лечения, облегчая и упрощая терапию.
Варианты облегчения терапии можно разделить на 3 группы:
1. Уменьшение числа принимаемых таблеток. Это возможно при применении режима лечения, когда два или три действующих вещества содержатся в одной таблетке.
2. Уменьшение частоты приема. Использование современных режимов препаратов, применяемых один раз в сутки. Кроме того, для пациентов становятся доступнее инъекционные препараты, требующие приема один раз в четыре недели.
3. Уменьшение числа таблеток за счет сокращения количества действующих веществ в схеме, без потери эффективности лечения.
Давайте разберемся, в каких случаях мы сможем использовать перечисленные варианты облегчения терапии.
Первый и второй варианты подходят каждому, если нет ограничений по конкретным препаратам (медицинских противопоказаний, ограничение по побочным эффектам, наличие мутаций резистентности). Новый режим будет таким же стандартным, но качество жизни существенно улучшится.
Уменьшение частоты до однократного приема в сутки возможно при применении лекарств с улучшенной фармакокинетикой, которая позволяет дольше сохранять эффективную концентрацию препарата в крови. Из плюсов можно отметить улучшение приверженности к лечению, снижение рисков пропуска приема АРВТ.
Третий вариант, который еще называют двойным режимом антиретровирусной терапии, подходит тем, кто уже получает успешное лечение (не менее полугода РНК ВИЧ неопределяемая, количество CD4-лимфоцитов превышает 350 клеток/мкл).
Исключение одного препарата из схемы стало возможным благодаря мощности оставшихся лекарств и их высокому барьеру для выработки мутаций резистентности. Проведены крупные клинические исследования эффективности двойных режимов АРВТ и накоплен большой опыт их практического применения.
Критерием выбора таких схем стала доказанная эффективность и безопасность двойного режима при исключении третьего препарата с его побочными эффектами.
Для облегченных режимов АРВТ с приемом один раз в сутки подходят сочетания ламивудина (3TC) с долутегравиром (DTG), либо с ламивудина с бустированным ингибитором протеазы(ИП/r). Если допустимо применение препаратов дважды в сутки, то возможно сочетание в схеме ингибиторов протеазы с ралтегравиром.
Можно ли начинать лечение сразу с двойного режима терапии?
Старт АРВТ у наивных пациентов с двойных режимов официально рекомендован пока только американскими и европейскими специалистами в области ВИЧ-инфекции, да и то с рядом уточнений:
стандартный тройной режим терапии не может быть использован или не является оптимальным для конкретного пациента;
некоторые двойные режимы не могут использоваться при вирусной нагрузке более 100, в ряде случаев более 500 тысяч копий в мл., а также при отсутствии результата теста на лекарственную устойчивость ВИЧ к препаратам;
есть определенные ограничения у пациентов с ко-инфекцией вирусного гепатита В, ;
часть схем не назначается при количестве CD4-лимфоцитов не менее 200 клеток/мкл.
На практике же облегченная терапия назначается и в других странах, включая Россию.
При применении двойных режимов следует учитывать ряд аспектов:
Насколько опасны пропуски очередного приема лекарств?
Может ли повлиять облегчение терапии на развитие лекарственной устойчивости вируса?
Разобрать все ключевые особенности облегченного режима АРВТ при ВИЧ-инфекции помогут специалисты H-Clinic.
Для правильного и безопасного приема облегченных режимов терапии ВИЧ-инфекции рекомендуется обсудить все нюансы ее применения с опытным инфекционистом.
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Данила Сергеевич Коннов
1. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Developed by the panel on clinical practices for treatment of HIV infection convened by the Department of Health and Human Services (DHHS). AIDS info. August 20, 2020.
2. EACS Guidelines Version 10.1 October 2020
3. Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2020 Recommendations of the International Antiviral Society-USA Panel /JAMA, 2020, Oct 27;324(16):1651-1669. DOI: 10.1001/jama.2020.17025
4. . WHO Interim Guidelines. Updated recommendations on first-line and second-line antiretroviral regimens and post-exposure prophylaxis and recommendations on early infant diagnosis of HIV, July 2019
5. Покровский В.В., Юрин О.Г., Кравченко А.В. и соавт. Рекомендации по лечению ВИЧ-инфекции и связанных с ней заболеваний, химиопрофилактике заражения ВИЧ // Эпидемиология и инфекционные болезни. Актуальные вопросы.- 2020.-№4
6. Cohen C., Andrade-Villanueva J., Clotet B. et al. Rilpivirine versus efavirenz with two backgroundnucleoside or nucleotide reverse transcriptase inhibitors in treatment-naive adults infected with HIV-1 (THRIVE): a phase 3, randomised, non-inferiority trial/Lancet, 2011, 378.- P.229–237, DOI: 10.1016/S0140-6736(11)60983-5
7. Molina J-M., Cahn P., Grinsztejn B. et al. Rilpivirine versus efavirenz with tenofovir and emtricitabine in treatment-naive adults infected with HIV-1 (ECHO): a phase 3 randomised double-blind active-controlled trial /Lancet, 2011, 378.- P.238–246, DOI: 10.1016/S0140-6736(11)60936-7
10. Kumar P., Johnson M., Molina J. et al. Giuliano Rizzardini Switching to Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate (DOR/3TC/TDF) Maintains HIV-1 Virologic Suppression Through Week 144 in the DRIVE-SHIFT Trial /J. Acquir Immune Defic Syndr, 2021, DOI: 10.1097/QAI.0000000000002642
12. Cahn P., Madero J.S., Arribas J.R. et al. Durable Efficacy of Dolutegravir Plus Lamivudine in Antiretroviral Treatment-Naive Adults With HIV-1 Infection: 96-Week Results From the GEMINI-1 and GEMINI-2 Randomized Clinical Trials /J. Acquir Immune Defic Syndr, 2020, DOI: 10.1097/QAI.0000000000002275
Читайте также:

