Сочетанная герпесвирусная инфекция у ребенка
Обновлено: 22.04.2024
Ташкентский медицинский педиатрический институт
Первый МГМУ им. И.М. Сеченова
Ташкентский медицинский педиатрический институт
Герпесвирусная инфекция у детей
Журнал: Клиническая дерматология и венерология. 2012;10(6): 10‑15
Сиразитдинова В.Ф., Дмитриев Г.А., Маннанов А.М. Герпесвирусная инфекция у детей. Клиническая дерматология и венерология. 2012;10(6):10‑15.
Sirazitdinova VF, Dmitriev GA, Mannanov AM. Herpesvirus infection in children. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(6):10‑15. (In Russ.).
Ташкентский медицинский педиатрический институт
Представлены эпидемиология, этиология, патогенез, клиническая картина, лабораторные методы и основные принципы лечения герпетической инфекции у детей.
Ташкентский медицинский педиатрический институт
Первый МГМУ им. И.М. Сеченова
Ташкентский медицинский педиатрический институт
В настоящее время в педиатрии проблема инфицирования пациентов вирусом простого герпеса (ВПГ) стоит весьма остро. Это связано с недостаточной изученностью эпидемиологической ситуации, особенностями иммунопатогенеза, клинических проявлений заболевания, терапии, и, главное, профилактики обострений герпетической инфекции у детей. Накапливается все больше данных в пользу роли вирусов, хламидий, микоплазм и других патогенных и условно-патогенных микроорганизмов в качестве пускового механизма формирования бронхиальной астмы, а у больных гломерулонефритом часто выявляют персистирующую герпетическую инфекцию. Значимость этих возбудителей для детей определяется тем, что при высокой распространенности возможно бессимптомное носительство, что особенно критично для беременных, поскольку оно с высокой вероятностью может негативно отразиться на плоде. Семейный характер заболевания предопределяет широкий возрастной диапазон инфицирования вирусными штаммами, начиная с периода новорожденности до достижения пубертатного и юношеского возраста [1]. Установлено, что герпетическая инфекция, вызванная ВПГ 1-го типа (ВПГ-1), выявляется у 50—83% детей в возрасте до 10 лет [2]. Инфицирование ВПГ 2-го типа (ВПГ-2) чаще происходит при половых контактах с развитием генитального герпеса (ГГ). Пик волны приходится на 14—25 лет [3]. По некоторым оценкам Всемирной организации здравоохранения [4], заболеваемость ГГ увеличивается, опережая темпы прироста населения. Помимо географической и возрастной, выявлена социально-экономическая вариабельность обоих типов ВПГ при ГГ: ВПГ-1 чаще выявляется у женщин, страдающих рецидивирующим ГГ в возрасте 16-20 лет (55%), у пациентов с низким социально-экономическим статусом данный тип ВПГ регистрируется при рецидивирующем ГГ в 10% случаев, у пациентов средних социальных слоев — в 50% случаев.
ВПГ выделяется со всеми жидкостями организма, поэтому заражение, как правило, происходит при половом или очень тесном бытовом контакте. По некоторым данным [5], степень инфицирования в семье составляет 47—53%. Бытовые контакты (зараженные игрушки, посуда и другие предметы домашнего обихода, поцелуи родственников) также могут явиться источником передачи вируса [6]. Кроме того, опасность составляют многие ятрогенные вмешательства [7]. Выделяются две волны подъема заболеваемости: первая достигается к 4-летнему возрасту, вторая — к периоду половой зрелости [8]. В настоящее время простой герпес весьма часто наблюдается у детей 1—5 лет. Необходимо отметить возросшее число рецидивирующих форм простого герпеса, возникновение которых отмечается в возрасте 6—7 лет. Столь частое проявление первичного простого герпеса у детей и возникновение рецидивирующих форм инфекции в раннем возрасте, скорее всего, связаны с состоянием иммунодефицита, что является сложной проблемой в педиатрии при лечении не только герпесвирусной инфекции (ГВИ), но и других вирусных патологий. Результаты проведенных за последние 10 лет сероэпидемиологических исследований свидетельствуют о том, что к 15 годам серопозитивны около 85% детей, а в возрасте 30 лет и старше более 90% населения имеют антитела к ВПГ-1 или ВПГ-2. У 15-летних подростков антитела к ВПГ-1 выявляются в 75% случаев, к ВПГ-2 — в 11%. По другим данным [9], в развивающихся странах инфицированность 5-летних детей достигает 33%, а подростков приближается к 80%. В развитых странах люди со средним и высоким достатком инфицируются в более позднем возрасте.
Наибольшую опасность в плане распространения инфекции представляют больные, у которых рецидивирующая форма герпеса протекает в ассоциации с другими микроорганизмами урогенитального тракта (хламидии, уреаплазмы, микоплазмы, цитомегаловирус, вирус Эпштейна—Барр). Эрозивно-язвенные поражения кожи и слизистых оболочек половых органов облегчают передачу других инфекций, передаваемых половым путем (ИППП), в том числе вируса иммунодефицита человека (ВИЧ; так называемое явление эпидемиологического синергизма). Герпетическая инфекция как одна из наиболее распространенных причин язвенных поражений половых органов может активизировать ВИЧ, находящийся в стадии провируса, и таким образом является кофактором прогрессирования ВИЧ-инфекции и синдрома приобретенного иммунодефицита. Кроме того, ВПГ играет большую роль в этиологии таких заболеваний, как атопический дерматит [10].
В течение первых 1—3 нед развития герпеса у человека выявляются антитела, представленные IgM, которые, как правило, быстро исчезают. Вместе с тем у инфицированных новорожденных эти антитела могут обнаруживаться в течение 7 мес, а длительность сохранения антител класса М зависит от характера течения заболевания. Антитела класса А выявляются позднее и сохраняются недолго. При изучении особенностей клеточного иммунитета при рецидивирующем герпесе установлено, что лимфоциты некоторых больных в активной стадии заболевания непермиссивны для репродукции вируса при митогенной стимуляции. В этот же период понижена хемотаксическая активность полиморфно-ядерных лейкоцитов. В то же время кожный тест замедленной гиперчувствительности на герпетический антиген у больных рецидивирующим герпесом не подавлен [11]. Специфическая реакция бласттрансформации лейкоцитов (РБТЛ) периферической крови людей, у которых в анамнезе были заболевания, вызванные вирусами герпеса, наблюдалась при их инкубации с вирусспецифическими антигенами в течение 5 сут. При удлинении сроков инкубации культур отмечена неспецифическая бласттрансформация мононуклеаров серонегативных доноров.
Бласттрансформация в ответ на гомологичный антиген в период реконвалесценции выше, чем в активной стадии рецидива. Транзиторный дефицит в продукции лимфокинов выявлен непосредственно перед рецидивом или сразу после него, а во время ремиссии продукция этих медиаторов усиливается. Существует, по-видимому, определенная корреляция между пониженной РБТЛ, продукцией интерферона (ИФН) лимфоцитарными культурами и развитием рецидива герпеса, особенно у иммунодепрессивных больных.
В работах многих авторов отмечается, что инфицированные дети с одинаковым течением раннего неонатального периода и имевшие идентичный характер инфекции в дальнейшем могут иметь отсроченную патологию или развиваться как здоровые младенцы. Нередко (например, при интранатальном инфицировании ВПГ) клинические проявления в первые дни жизни отсутствуют, а симптомы инфекционного заболевания выявляются в процессе динамического наблюдения за новорожденным. После 6—8 мес, когда уменьшается уровень противовирусных антител, передаваемых трансплацентарно от матери, появляются первые признаки ГВИ. При длительном наблюдении установлено, что герпетическая инфекция формирует у детей первого полугодия жизни тяжелую патологию, нередко с поражением центральной нервной системы (ЦНС). При микстинфекции, характеризующейся сочетанием ВПГ с цитомегаловирусом, бактериальной инфекцией или грибковой инвазией, чаще отмечаются генерализация и более тяжелое течение инфекционного процесса, чем при моноинфекции. Установлено, что в 3—4 мес IgМ, антиген и ДНК ВПГ-2 в крови регистрируется значительно чаще, чем у новорожденных, что свидетельствует о более частом инфицировании в родах и постнатально. При наблюдении за новорожденными у всех детей установлены признаки ишемии головного мозга разной степени тяжести [13].
В силу высокого уровня детской заболеваемости инфекциями, входящими в так называемый TORCH-комплекс, включающий токсоплазмоз (ТО), краснуху (R), цитомегаловирус (C) и герпес (Н), были созданы методы диагностики на основе натуральных высокоочищенных антигенов возбудителей, обеспечивающие высокую чувствительность и специфичность анализа. Достоверная диагностика является важным этапом начала терапии первичного герпеса у ребенка. Однако довольно часто врачи назначают ребенку противогерпетическое лечение без проведения лабораторной диагностики, определения типоспецифических антигенов ВПГ (ВПГ-1 и ВПГ-2), отличающихся вирулентностью и патогенностью. Вместе с тем цитопатический эффект, являющийся результатом размножения вируса, морфологически и клинически практически неразличим при обоих типах инфекции. Важность лабораторной диагностики герпетической инфекции определяется трудностями клинической диагностики при полиморфизме симптомов и необходимостью своевременного назначения противовирусной терапии.
В настоящее время наиболее часто используют следующие лабораторные методы:
1) вирусологические методы обнаружения и идентификации ВПГ (выделение ВПГ в культуре клеток, включая типирование ВПГ-1 и ВПГ-2);
2) методы выявления антигенов ВПГ — иммуноферментный (ИФА) и иммунофлюоресцентный анализ;
3) полимеразную цепную реакцию (ПЦР), ДНК-гибридизацию;
4) цитоморфологические методы;
5) выявление антител с помощью ИФА;
6) методы исследования и оценки иммунного статуса.
В лабораторной диагностике инфицированности ВПГ-1 и ВПГ-2, а также при оценке восприимчивости к первичной инфекции и выявлении первичной и острой инфекции используют серологические методы. При обнаружении IgM и даже при наличии высоких значений IgG у беременных необходимо решать вопрос, что это: острая инфекция или реактивация? Также трудно определить время инфицирования, так как IgM при TORCH-инфекциях могут находиться в крови длительно (от 6 нед до 1—2 лет). При планировании беременности нередко обнаруживаются ВПГ IgM без клинических проявлений. Следует также учитывать возможность ложноположительных IgM (до 5%) [12].
Определение индекса авидности IgG не только решило бы проблему отличия первичной инфекции от реактивации (в первом случае — низкоавидные антитела, во втором — высокоавидные), но могло бы помочь врачу сориентироваться в сроках возникновения инфекции [13].
Для прямой детекции ВПГ-антигена разработано несколько типов классических микротитровальных планшет для ИФА. Применение вестерн-блоттинга позволило различать антительный ответ на ВПГ-1 и ВПГ-2 при герпетической инфекции, а также устанавливать раннюю сероконверсию.
Чувствительность метода ИФА по сравнению с выделением культуры, применяемой главным образом в научных целях, составляет 70—90%, а специфичность на фоне герпетической симптоматики — 94—100%. Однако чувствительность серологических методов при обследовании бессимптомных пациентов низкая [14]. Титр антител не всегда соответствует клиническим проявлениям инфекции: у бессимптомных носителей могут выявляться антитела в высоких титрах, так же как и у пациентов с выраженной симптоматикой титры антител могут оставаться низкими. Использование ИФА бывает полезным при исследовании парных сывороток, полученных с интервалом 7—10 сут. Так, 4-кратное нарастание антител к ВПГ IgG считается показателем первичной инфекции.
У детей в пользу диагностики персистирующих инфекций, в том числе герпетической, свидетельствуют отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных. Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях заболевания и основываться на результатах комплексных лабораторных и иммунологических исследований с оценкой в динамике (в 1, 3, 6 и 12 мес) [15]. Прямая детекция вирусных белков (ВПГ-1 и ВПГ-2) методом ДНК-гибридизации с использованием радио- или биотинмеченых проб не менее эффективна, чем другие иммунологические методы, но недостаточно чувствительна во время бессимптомной (довольно частой) реактивации урогенитального герпеса. В свою очередь применение выбранных ДНК-последовательностей методом ПЦР-анализа существенно повышает эффективность обследования пациентов с бессимптомной герпетической инфекцией.
Учитывая высокую диагностическую значимость метода ПЦР и наличие зависимости между летальностью у новорожденных и виремией, вызванной ВПГ-1 и ВПГ-2, рекомендуют использовать этот метод для лабораторного скрининга на генерализованную герпетическую инфекцию среди детей высокого риска.
Высокоэффективный культуральный метод диагностики ГВИ в силу экономических и организационных трудностей пока не нашел своего места в практической дерматологии и педиатрии.
Одной из важнейших задач современной дерматовенерологии является необходимость создания рациональной фармакотерапии вирусных заболеваний кожи. Ни один из известных противовирусных препаратов не способен полностью элиминировать вирус из организма и таким образом существенно влиять на латентное течение заболевания [16].
Лечение ГВИ должно быть комплексным, направленным на угнетение репликации ВПГ, повышение иммунореактивности организма с учетом стадии заболевания, частоты рецидивов. Пероральные антивирусные препараты назначают для купирования основных проявлений заболевания (так называемая эпизодическая терапия), а также для профилактики реактивации ВПГ и обострения заболевания (так называемая профилактическая терапия). Главными задачами эпизодической терапии являются сокращение продолжительности обострения, купирование болевого синдрома и ускорение заживления кожных герпетических высыпаний.
Существуют следующие подходы к противовирусной терапии:
— лечение первичного эпизода;
— эпизодическая противовирусная терапия (с целью купирования рецидивов);
— профилактическая (превентивная или супрессивная) терапия (непрерывное лечение на протяжении определенного времени для предупреждения рецидивов) [17].
Настоящим прорывом в области лечения ВПГ стало создание в 1974 г. в Великобритании ацикловира — первого синтетического ациклического аналога нуклеозида гуанозина. Многочисленный опыт применения этих препаратов подтверждает их исключительную роль при лечении пациентов с разными формами ГВИ, высокую степень эффективности при тяжелом течении, а также атипичных формах. На фоне высокой эффективности в отношении ВПГ-1 и -2 типов ациклические нуклеозиды имеют ряд преимуществ:
1) накапливаются только в тех клетках, где размножается вирус;
2) безопасны при длительном приеме;
3) не влияют на микрофлору кишечника, не вызывают дисбактериоз;
4) сочетаются со многими лекарственными препаратами;
5) не влияют на память и реакцию;
6) не дают тератогенный и мутагенный эффекты;
7) в значительной степени улучшают качество жизни.
При рецидивирующем герпесе лечение не всегда эффективно и следует учитывать стадию заболевания: при рецидиве рекомендуются ИФН, противовирусные химиопрепараты, коревой иммуноглобулин, левамизол, аскорбиновая кислота, дезоксирибонуклеаза, аппликации раствором сульфата цинка и другие, в межрецидивный период — герпетическая вакцина, полиомиелитная вакцина, пирогенал.
В настоящее время проблема лекарственной терапии ГВИ, особенно вызванных мутантными формами вирусов, является исключительно важной практической задачей. Один из путей ее решения — комбинированное лечение резистентных форм ВПГ-инфекции лекарственными средствами с разными механизмами противовирусной активности. Циклоферон является препаратом выбора при лечении герпетической болезни. Он может быть назначен совместно с ацикловиром или с виролексом. Целесообразным является проведение местной противовирусной терапии, поскольку созревание вирионов происходит и в кожном покрове, т.е. помимо системной терапии для получения положительного эффекта желательно использовать и местные лекарственные средства [20].
Таким образом, проблема ГВИ и сочетанных инфекций с учетом особенностей формирования патологического процесса у детей остается весьма актуальной в дерматологической и педиатрической практике, что требует применения комплекса современных клинико-лабораторных и терапевтических подходов, включая меры профилактики.
В статье рассматриваются некоторые аспекты этиопатогенеза герпесвирусных заболеваний у детей, современные подходы к лекарственной терапии и профилактике рецидивов.
This article discusses some aspects of the pathogenesis of herpes-associated diseases in children, modern approaches to drug therapy and relapse prevention.
В последние годы среди основных возбудителей вирусных инфекций у детей особое место занимают герпес-вирусы, что связано с их повсеместным распространением, широким разнообразием, полиорганностью поражения, многообразием клинических проявлений, а также высокой частотой хронического течения. Герпес-ассоциированные заболевания входят в число наиболее распространенных и плохо контролируемых инфекций человека. Это связано с тем, что герпес-вирусы могут длительно бессимптомно циркулировать в организме человека с нормальной иммунной системой, а при иммуносупрессии способствовать развитию тяжелых заболеваний, вплоть до угрожающих жизни генерализованных инфекций. Так, по данным Всемирной организации здравоохранения (World Health Organization, WHO), смертность от герпетической инфекции составляет около 16% и находится на втором месте после гепатита среди вирусных заболеваний [1].
.jpg)
Вирионы герпес-вирусов термолабильны — они инактивируются в течение 30 мин при температуре 50–52 °C, в течение 20 ч — при температуре 37,5 °C, но хорошо переносят лиофилизацию. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, на влажных медицинских материалах (вата и марля) — до их высыхания при комнатной температуре (до 6 ч). Уникальность герпес-вирусов заключается в том, что они способны непрерывно или циклично размножаться в инфицированных клетках тропных тканей (персистенция), а также пожизненно сохраняться в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных нервных ганглиев (латенция) и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов. Однако способность к персистенции и латенции у различных штаммов неодинаковая: наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна–Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами вирусов. Основной путь инфицирования — воздушно-капельный, при прямом контакте или через предметы обихода (общие посуда, полотенца, носовые платки и пр.). Отмечается также оральный, генитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции. ВПГ 1-го и 2-го типов, цитомегаловирус входят в число возбудителей TORCH-инфекций, способствуют развитию серьезных заболеваний новорожденных и детей младшего возраста. Вирусы простого герпеса, цитомегаловирус, вирус Эпштейна–Барр рассматриваются как индикаторы СПИДа в связи с их частым обнаружением при данном заболевании [3, 4]. С герпес-вирусами связывают развитие синдрома хронической усталости (Chronic fatigue syndrome — CFS) [5].
Клинически герпес-инфекция у детей может протекать в виде ветряной оспы (вирус варицелла зостер), инфекционного мононуклеоза (вирус Эпштейна–Барр), внезапной экзантемы (вирус герпеса человека 6-го и 7-го типов), афтозного стоматита (ВПГ 1-го или 2-го типа), мононуклеозоподобного синдрома (цитомегаловирус). У подростков и взрослых людей часто инфекция протекает бессимптомно, что объясняется как биологическими свойствами штаммов, так и индивидуальными особенностями иммунного ответа. Часто при снижении иммунореактивности организма герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому течению основного заболевания, развитию осложнений. Велика роль герпесвирусных инфекций, особенно цитомегаловирусной, в формировании младенческой смертности. Наибольшую угрозу для жизни и здоровья детей представляют герпетические нейроинфекции — летальность при них достигает 20%, а инвалидизация — 50%. Тяжело протекают офтальмогерпес (развитие катаракты или глаукомы — до 50%), генитальный герпес, генерализованная форма Эпштейна–Барр-вирусной инфекции (инфекционного мононуклеоза) [1, 6].
Герпесвирусная инфекция относится к трудноконтролируемым заболеваниям. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения данной патологии, средств, обеспечивающих полное излечение, не существует. Это обусловлено генотипическими особенностями возбудителя, формированием резистентности герпес-вирусов и молекулярной мимикрией.
Открытые с помощью методов молекулярной биологии механизмов репликации герпес-вирусов, а также изучение взаимодействия вируса с клеткой позволили создать целый ряд эффективных химиотерапевтических средств, обладающих противогерпетической активностью. Однако, эффективно купируя острые проявления инфекции, они не предотвращают рецидивирования, не всегда снижают частоту рецидивов.
Учитывая, что при герпес-ассоциированных инфекциях, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния, для повышения эффективности лечения в схемы терапии наряду с противовирусными препаратами приходится включать препараты, способствующие коррекции иммунного статуса больного. Все это диктует необходимость правильно подбирать лекарственное средство, его дозу и длительность приема, при необходимости использовать комбинацию различных препаратов, избегая при этом полипрагмазии. Определенную сложность терапии в детском возрасте вызывают возрастные ограничения для ряда лекарственных средств, наличие нежелательных лекарстввенных реакций (НЛР) и противопоказаний.
В настоящее время для лечения герпесвирусных заболеваний и профилактики рецидивов используют следующие группы препаратов (табл.).
При лечении герпес-инфекций следует придерживаться комплексного подхода. Длительность и интенсивность терапии определяются возрастом больного, клинической формой заболевания, тяжестью его течения, а также наличием осложнений и сопутствующей патологии. Лечебно-профилактические мероприятия следует разделять на несколько этапов.
- Острый период болезни (рецидив) — охранительный режим, лечебное питание, противовирусные препараты, интерфероны и их индукторы. По показаниям назначаются иммуноглобулины, антибактериальные препараты местного и системного действия, глюкокортикоиды, нейро- и ангиопротекторы, гепатопротекторы, кардиотропные препараты, ингибиторы протеаз. Симптоматическая терапия может включать жаропонижающие, отхаркивающие и муколитические препараты.
- Ремиссия, стихание основных клинических проявлений (иммуномодуляторы, адаптогены растительного происхождения, пре- и пробиотики, витамино-минеральные комплексы).
- Профилактика рецидивов (специфическая профилактика — вакцинация, санация хронических очагов инфекции, восстановление иммунного статуса и пр.).
Следует отметить, что сочетанное применение противовирусных препаратов и иммунобиологических средств имеет ряд преимуществ. Во-первых, комплексная терапия обеспечивает синергидный эффект. Во-вторых, позволяет снизить дозу противовирусного химиопрепарата, уменьшая вероятность развития НЛР, сокращая его токсическое воздействие на организм и снижая вероятность возникновения устойчивых штаммов герпес-вирусов. Кроме того, это значительно сокращает продолжительность острого периода болезни и сроки лечения.
Одним из препаратов, показавшим свою эффективность при лечении герпес-ассоциированных заболеваний у детей, является инозин пранобекс. Инозин пранобекс — это синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием. Препарат восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию иммуноглобулина G, интерферонов, интерлейкинов (ИЛ-1 и ИЛ-2), снижает образование провоспалительных цитокинов (ИЛ-4 и ИЛ-10), потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Механизм противовирусного действия препарата связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации, усилении подавленного вирусами синтеза мРНК лимфоцитов, что сопровождается угнетением биосинтеза вирусной РНК и трансляции вирусных белков.
Инозин пранобекс малотоксичен, хорошо переносится, в России рекомендован в виде таблеток детям с 3-летнего возраста (масса тела более 15 кг). За рубежом он доступен и в форме сиропа и не имеет возрастных ограничений. Препарат назначается по 50–100 мг/кг/сут внутрь в 3–4 приема в течение всего острого периода болезни (5–10 дней в зависимости от длительности вирусемии и выраженности синдрома интоксикации). В качестве поддерживающей терапии для восстановления иммунологических показателей возможно назначение препарата по иммуномодулирующей схеме (50 мг 2 раза в день в течение 14–28 дней). Доказана высокая эффективность курсовой терапии инозином пранобексом (50 мг/кг массы тела в сутки в 3–4 приема внутрь, три курса лечения по 10 дней с интервалом 10 дней) [7], комбинированной курсовой терапии с использованием инозина пранобекса и рекомбинантного интерферона α-2β (3 курса по 10 дней с интервалом 14 дней) у детей с микст-вирусными инфекциями [8].
Применение инозина пранобекса как препарата с иммунотропным и противовирусным действием на различных этапах лечебно-профилактических мероприятий позволяет избежать полипрагмазии, тем самым снизить медикаментозную нагрузку на организм и уменьшить риск нежелательных эффектов.
Литература
- Кускова Т. К., Белова Е. Г. Семейство герпес-вирусов на современном этапе // Лечащий Врач. 2004, № 5, с. 64–69.
- Hjalgrim H., Askling J., Rostgaard K. et al. Characteristics of Hodgkin’s lymphoma after infectious mononucleosis // N. Engl. J. Med. 2003; 349: 1324–1332.
- Никольский И. С., Юрченко В. Д., Никольская К. И. Характеристика активной хронической Эпштейна–Барр вирусной инфекции: клинико-иммунологический синдром // Современные инфекции. 2003, № 3, с. 60–62.
- Katz B. Z., Shiraishi Y., Mears C. J., Binns H. J., Taylor R. Chronic fatigue syndrome after infectious mononucleosis in adolescents // Pediatrics. 2009, Jul; 124 (1): 189–193.
- Lerner A. M., Begar S. N., Deeter R. G. IgM serum antibodies to Epstein-Barr virus are uniquely present in a subset of patients with the chronic fatigue syndrome // In Vivo. 2004, Mar-Apr; 18 (2): 101–106.
- Maakaroun N. R., Moanna A., Jacob J. T., Albrecht H. Viral infections associated with haemophagocytic syndrome // Rev. Med. Virol. 2010, Mar; 20 (2): 93–105.
- Симованьян Э. Н., Денисенко В. Б., Григорян А. В. Эффективность применения инозина пранобекс у часто болеющих детей с хронической Эпштейна-Барр вирусной инфекцией: результаты рандомизированного исследования // Вопросы современной педиатрии. 2011, Т. 10, № 2, С. 16–21.
- Нестерова И. В., Ковалева С. В., Чудилова Г. А., Ломтатидзе Л. В., Клещенко Е. И., Шинкарева О. Н. Динамика изменений фенотипа и функциональной активности нейтрофильных гранулоцитов у иммунокомпрометированных детей с повторными ОРВИ, ассоциированными с герпесвирусными инфекциями, на фоне комбинированной интерфероно- и иммунотерапии // Цитокины и воспаление. 2014, Т. 13, № 1, с. 113.
Т. А. Бокова, доктор медицинских наук, профессор
Резюме
Актуальность Эпштейна - Барр вирусной инфекции объясняется широкой циркуляцией вируса Эпштейна - Барр среди детского и взрослого населения, его тропностью к иммунокомпетентным клеткам с пожизненной персистенцией после первичного инфицирования и полиморфизмом клинических проявлений от субклинических форм, инфекционного мононуклеоза до формирования онкологических, аутоиммунных гематологических заболеваний. Персистенция Эпштейна -Барр вируса приводит к подавлению клеточного звена иммунитета, снижению продукции интерферонов и факторов неспецифической защиты, что способствует реактивации персистирующей инфекции, чаще всего без мононуклеозоподобного синдрома, и появлению атипичных мононуклеаров в крови с формированием лимфопролиферативного, интоксикационного, астеновегетативного синдромов, длительного субфебрилитета, что диктует необходимость применения иммунокоррегирующей терапии. В статье приведен клинический случай, в котором изложены описание и анализ течения хронической Эпштейна - Барр вирусной инфекции у ребенка дошкольного возраста (5 лет 8 мес.) с отягощенным преморбидным фоном. Эпизоды реактивации хронической персистирующей инфекции протекали под маской острой респираторной инфекции с лимфопролиферативным синдромом, гнойного тонзиллита, гнойного аденоидита. Терапия, включавшая антибиотики, препараты с противовирусной активностью коротким курсом, бактериальные лизаты, физиотерапию, имела временный и непродолжительный эффект. В силу отсутствия полного мононуклеозоподобного синдрома в клинике и атипичных мононуклеаров в гемограмме обследование на Эпштейна - Барр вирусную инфекцию не проводилось до пятилетнего возраста, в связи с чем она не была верифицирована, и, соответственно, ребенок не получал адекватной иммунотропной терапии. Только в 5 лет 8 мес. при очередном эпизоде активации хронической Эпштейна - Барр вирусной инфекции в состав комплексной терапии был включен меглюмина акридонацетат, на фоне которого была достигнута хорошая клинико-лабораторная динамика. Описанный клинический случай демонстрирует эффективность включения в состав комплексного лечения Эпштейна - Барр вирусной инфекции меглюмина акридонацетата, обладающего противовирусным, иммуномодулирующим и противовоспалительным действиями, что позволило получить достаточно быструю положительную клиническую динамику купирования интоксикационно-лихорадочного и лимфопролиферативного синдромов в острый период, а в дальнейшем - и астеновегетативного синдрома и достигнуть перехода активной хронической Эпштейна - Барр вирусной инфекции в латентную форму.
Ключевые слова: острая респираторная инфекция, гнойный тонзиллит, гнойный аденоидит, лимфопролиферативный синдром, меглюмина акридонацетат, иммунотропная терапия.
Chronic Epstein-Barr viral infection in children: a clinical case
Svetlana P. Kokoreva, Veronika B. Kotlova®, Oleg A. Razuvaev
Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia
Abstract
The urgency of Epstein-Barr virus infection is explained by wide circulation of Epstein-Barr virus among children and adults, its tropism to immunocompetent cells with lifelong persistence after primary infection and polymorphism of clinical manifestations from subclinical forms, infectious mononucleosis to formation of oncological, autoimmune hematological diseases. Persistence of Epstein - Barr virus leads to suppression of cellular immunity, decreased production of interferons and nonspecific protection factors, which contributes to reactivation of persistent infection, most often without mononucleosis-like syndrome, and the appearance of atypical mononuclears in blood with the formation of lymphoproliferative, intoxication, astheno-vegetative syndrome, long-term subfebrile condition, which dictates the need for immunocorrective therapy. This article presents a clinical case describing and analyzing the course of a chronic Epstein-Barr virus infection in a preschool child (5 years 8 months) with a pre-morbid background. Episodes of reactivation of chronic persistent infection occurred under the mask of acute respiratory infection with lymphoproliferative syndrome, purulent tonsillitis, purulent adenoiditis. Therapy, including antibiotics, short-course antiviral agents, bacterial lysates, and physiotherapy, had a temporary and short-lived effect. meglumine acridonacetate. The described clinical case demonstrates the effectiveness of the inclusion of meglumine acridonacetate, which has antiviral, immunomodulatory and anti-inflammatory effects, in the complex treatment of Epstein-Barr virus infection, This allowed to obtain fairly rapid positive clinical dynamics of relieving intoxication and febrile and lymphoproliferative syndromes in the acute period, and subsequently - astheno-vegetative syndrome and achieve the transition of active chronic Epstein - Barr virus infection into a latent form.
Keywords: acute respiratory infection, purulent tonsillitis, purulent adenoiditis, lymphoproliferative syndrome, meglumine acridonacetate, immunotropic therapy.
Введение
Сегодня Эпштейна - Барр вирусная инфекция (ЭБВИ) представляет собой междисциплинарную проблему и активно изучается не только инфекционистами, но и врачами других специальностей: педиатрами, оториноларингологами, ревматологами, гематологами, онкологами, неврологами, иммунологами. Это объясняется тем, что вирус Эпштейна - Барр (ВЭБ) является одним из наиболее распространенных возбудителей, выявляемых как в детском возрасте, так и среди взрослого населения. По данным различных исследователей, инфицированность ВЭБ составляет 17,7% в периоде новорожденности и возрастает до 90% и выше у лиц старших возрастных групп 2. Являясь оппортунистической инфекцией, она в большинстве случаев протекает бессимптомно. Особенностью манифестных форм ЭБВИ является полиморфизм клинических симптомов, начиная от инфекционного мононуклеоза до фульминантных тяжелейших форм, аутоиммунных и онкологических заболеваний, реализующихся спустя годы после диагностированной ЭБВИ. Доказано, что манифестация клинических проявлений развивается при первичном инфицировании и реактивации персистирующей инфекции 6.
В случае адекватного иммунологического ответа первичное инфицирование приводит к формированию латентной формы инфекции - персистирующей неактивной ЭВБИ. Приравниваясь к здоровому носительству, она является естественным завершением иммунологических изменений. При снижении иммунитета происходит реактивация инфекции с манифестными проявлениями -активация персистирующей инфекции. При тяжелом течении могут формироваться органные поражения: менингоэнцефалит, миокардит, гепатит, гломерулонефрит и другие с возможным летальным исходом 10.
Но чаще в клинической практике встречаются варианты повторной реактивации ЭБВИ с неспецифической симптоматикой, когда при отсутствии остро развившегося полного мононуклеозоподобного синдрома и появления атипичных мононуклеаров в периферической крови, характерных для инфекционного мононуклеоза, возникают утомляемость, слабость, артралгии, головная боль, снижение памяти и внимания, депрессия, субфебрилитет. При этом принято говорить о хронической инфекции, если симптоматика сохраняется в течение полугода. Дети с хронической ЭБВИ имеют, как правило, отягощенный преморбидный фон, страдают хроническим тонзиллитом, хроническим аденоидитом; у них формируются различные варианты лимфопролиферативного синдрома, умеренно выраженный интоксикационный синдром, астенизация, может быть субфебрилитет; у этой категории больных отмечаются частые рекуррентные заболевания, что объясняется иммуносупрессивным воздействием ВЭБ 13.
Изучение форм ЭБВИ стало быстро развиваться благодаря возможностям современной лабораторной диагностики, которая позволяет оценить время инфицирования и активность инфекционного процесса [15, 16]. Для острой первичной инфекции типично появление ДНК вируса в крови и иммуноглобулинов М к капсидному антигену (аVCAJgM) и (или) иммуноглобулинов к раннему ЕА-антигену (аЕАIgG), которые циркулируют с третьей недели инфицирования, а также низкоавидных иммуноглобулинов к капсидному антигену (аVCAIgG). Со временем низкоавидные аVCAIgG трансформируются в высокоавидные, сохраняясь пожизненно. Начиная со второго месяца с момента заражения появляются антитела к ядерному антигену (аEBNAIgG). У части пациентов они сохраняются всю жизнь, у части -элиминируются. Положительный результат исследования полимеразной цепной реакции (ПЦР) крови не позволяет судить о форме инфекции, так как может регистрироваться как при первичном инфицировании, так и при реактивации персистирующей инфекции. На фоне высокоавидных аVCAIgG и (или) аEBNAIgG при реактивации персистирующей инфекции появляются капсидные антитела класса М и (или) ранние антитела. Давность инфицирования вне обострения инфекционного процесса подтверждается обнаружением высокоавидных аVCAIgG и аEBNAIgG. Положительные результаты ПЦР слюны могут быть у 15-25% здоровых серопозитивных людей. Это происходит в силу пожизненной персистенции вируса в В-лимфоцитах, которые, находясь в лимфоидной ткани миндалин при латентной инфекции или ее активации, дают положительный результат исследования [17].
Иммунокорригирующая терапия Эпштейна - Барр вирусной инфекции
На сегодняшний день общепринятых принципов этиотропного лечения ЭБВИ не разработано, так как препараты с противовирусной активностью не позволяют элиминировать возбудитель из организма, и основой лечения является симптоматическая и патогенетическая терапия. Однако длительная персистенция ВЭБ, приводящая к угнетению клеточного иммунитета, факторов неспецифической защиты, интерферон-продуцирующей функции лейкоцитов, свидетельствует о необходимости использования иммунокорригирующих препаратов [18, 23-26].
В педиатрической практике хорошо зарекомендовали себя индукторы эндогенного интерферона, в частности меглюмина акридонацетат (Циклоферон®), которые имеют ряд преимуществ по сравнению с экзогенными интерферонами. При их назначении не вырабатываются аутоантитела на собственный интерферон, время выработки стимулированных эндогенных интерферонов контролируется макроорганизмом, что не приводит к его передозировке. Кроме того, индукторы эндогенного интерферона имеют высокую биодоступность 31. Циклоферон® является низкомолекулярным индуктором интерферона и, соответственно, оказывает противовирусное, иммуномодулирующее, противовоспалительное действия, стимулируя синтез а- и у-интерферона, что способствует усилению Т-клеточного иммунитета - нормализации субпопуляций СD3-лимфоцитов, СD4-лимфо-цитов, NK-клеток и иммунорегуляторного индекса. Прямое действие меглюмина акридонацетата реализуется через нарушение репликации вируса, блокирование вирусной ДНК или РНК, увеличение дефектных вирусных частиц и снижение вирус-индуцированного синтеза белка [32, 33]. Его клиническая эффективность доказана у детей при острой респираторной вирусной инфекции (ОРВИ) и гриппе, так как на ранней стадии инфицирования он подавляет репликацию вируса, стимулирует и поддерживает уровень всех видов интерферона. Из всех индукторов интерферона Циклоферон является самым быстрым, вызывая продукцию интерферона через 2-72 ч после введения, реализуя таким образом противовирусный и иммуномодулирующий эффекты уже через 2-3 ч после приема 35. Наибольшую эффективность у детей препарат имеет при низком интерфероновом статусе 38. Доказано прямое противовирусное действие Циклоферона с подавлением размножения вируса на стадии репликации и вирусного потомства, его способность индуцировать синтез эндогенного интерферона в отношении герпетических вирусов, и показана его клиническая эффективность у детей при различных герпесвирусных инфекциях, в том числе и ЭБВИ 41. В качестве примера успешного использования иммуно-тропной терапии при герпесвирусной инфекции приводим клинической случай течения и исхода хронической ЭБВИ у ребенка дошкольного возраста.
Anamnesis vitae: ребенок от третьей беременности (в семье есть двое детей 8 и 10 лет), протекавшей с угрозой прерывания (терапия дюфастоном) на фоне хронической фетоплацентарной недостаточности, третьих срочных родов путем кесарева сечения. Вес при рождении -3260 г, оценка по Апгар - 7-8 баллов. По поводу конъюгационной гипербилирубинемии была переведена на второй этап выхаживания. С рождения находилась на искусственном вскармливании в связи с гипогалактией у матери. До года наблюдалась неврологом по поводу перинатального поражения нервной системы, профилактические прививки с 12 мес. Из перенесенных заболеваний мама отмечала нетяжелые ОРИ в 1,5 года и острую кишечную инфекцию в 2 года 4 мес.
Предварительный диагноз - острая респираторновирусная инфекция, осложненная аденоидитом. Синусит (?).
Динамика и исходы. В гемограмме лейкоцитоза нет -9,5 х 10 9 /л, абсолютный лимфомоноцитоз (п4%, с28%, л56%, м12%), СОЭ - 18 мм/час. Биохимические тесты без патологических изменений, СРБ - 3 мг (норма - 0-10). При рентгенологическом исследовании придаточных пазух носа данных по синуситу не выявлено. Получен отрицательный результат ПЦР-исследования мазков из носоглотки (респираторный скрин). Лор-врачом диагностирован гнойный аденоидит. По данным ультразвукового исследования органов брюшной полости выявлялись умеренная гепатомегалия, мезентериальная лимфаденопатия.
Терапия в отделении включала антибиотики (цефтриаксон парентерально), Виферон-1 per rectum 2 раза в сутки, симптоматические средства, физиолечение. На фоне проводимого лечения в течение трех суток состояние ребенка оставалось без убедительной клинической динамики: продолжала лихорадить, сохранялись интоксикационный и лимфопролиферативный синдромы. На четвертый день пребывания в стационаре результаты лабораторного обследования: ПЦР+ крови на ВЭБ, аVCAJgM+ и аVCAIgG+ авидность 100%, аEAIgG–, аEBNAIgG+, что позволило диагностировать реактивацию хронической ЭБВИ. К лечению добавлен Циклоферон в таблетках по схеме на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23-е сутки. На третий день у девочки нормализовалась температура, восстановился аппетит, улучшилось самочувствие. Стал менее выраженным лимфопролиферативный синдром: носовое дыхание более свободное, уменьшился насморк. На 10-й день лечения ребенок жалоб не предъявлял. При объективном осмотре меньше выражены гипертрофия небных миндалин 1-й степени, шейная лимфаденопатия (размеры лимфоузлов уменьшились до 0,5 см), гепатомегалия 1,5 см. Выписана с клиническим улучшением с рекомендацией продолжить прием Циклоферона по схеме.
Клинический диагноз - хроническая Эпштейна - Барр вирусная инфекция, реактивация: лимфопролиферативный синдром, обострение хронического аденоидита, астеновегетативный синдром.
При объективном осмотре сохранялась умеренная гипертрофия небных миндалин, пальпировались мелкие, 0,3-0,5 см, безболезненные подчелюстные, передне-и заднешейные лимфоузлы, гепатомегалия отсутствовала, клинических проявлений астеновегетативного синдрома не отмечалось. Гемограмма соответствовала возрастной норме. В лабораторных тестах отсутствовали маркеры активной ЭБВИ: ПЦР крови - ДНК ВЭБ не обнаружено, аVCAJgM отрицательные, аEAIgG отрицательные, обнаружены аVCAIgG с авидностью 100% и аEBNAIgG.
Рисунок. Этапы формирования у пациентки хронической Эпштейна - Барр вирусной инфекции
Figure. Stages of chronic Epstein - Barr virus infection development in a patient
Заключение
Описанный клинический пример демонстрирует течение хронической ЭБВИ у больной в возрасте 5 лет 8 мес. с развитием лимфопролиферативного и астено-вегетативного синдромов. При реактивации хронической ЭБВИ, протекавшей с клиническими проявлениями ОРИ, гнойного тонзиллита, применялись антибиотики, препараты интерферона, глюкокортикостероиды интраназально, физиотерапия с временным эффектом. Назначение Циклоферона в составе комплексного лечения позволило получить достаточно быструю положительную клиническую динамику купирования интоксикационно-лихорадочного и лимфопролиферативного синдромов в острый период, а в дальнейшем -и астеновегетативного синдрома и достигнуть перехода активной хронической ЭБВИ в латентную форму, что подтверждается отсутствием маркеров активности хронической инфекции в течение года после использования Циклоферона.
Информация об авторах:
Кокорева Светлана Петровна, д.м.н., доцент, заведующая кафедрой инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Котлова Вероника Борисовна, к.м.н., доцент кафедры инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Разуваев Олег Александрович, к.м.н., доцент кафедры инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Information about the authors:
Svetlana P. Kokoreva, Dr. Sci. (Med.), Associate Professor, Head of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Veronika B. Kotlova, Cand. Sci. (Med.), Associate Professor of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Oleg A. Razuvaev, Cand. Sci. (Med.), Associate Professor of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Особенности течения и терапии респираторного микоплазмоза у детей в эпидемический сезон 2020-2021 гг.
Список литературы
References
Герпесвирусные инфекции - группа инфекционных заболеваний, которые вызываются вирусами из семейства Herpesviridae, могут протекать в виде локализованных, генерализованных, рецидивирующих форм болезни, имеют способность к персистированию (постоянному нахождению вируса) в организме человека.
Герпесвирусные инфекции (ГВИ) относятся к наиболее распространенным вирусным болезням человека. Инфицированность и заболеваемость ими каждый год возрастает. Во всех странах мира 60-90% населения инфицированы тем или иным герпесвирусом.
Этиология
Герпесвирусы в своем составе содержат двунитчатую ДНК, имеют глико-липопротеиновую оболочку. Размеры вирусных частиц от 120 до 220 нм.
На сегодня описано 8 типов герпесвирусов, которые выявлены у человека:
- два типа вируса простого герпеса (HSV-1, HSV-2),
- вирус ветряной оспы и опоясывающего герпеса (VZV или HHV-3),
- вирус Эпштейн-Барр (ЕBV или HHV-4),
- цитомегаловирус (CMV или HHV-5), HHV-6, HHV-7, HHV-8.
На основе биологических свойств вирусов сформированы 3 подсемейства герпесвирусов: (альфа-герпесвирусы, бетта-герпесвирусы и гамма-герпесвирусы). К a-герпесвирусам относятся HSV-1, HSV-2, VZV.
К бета-герпесвирусам относятся CMV, HHV-6, HHV-7. Они, как правило, медленно размножаются в клетках, вызывают увеличение пораженных клеток (цитомегалия), способны к персистенции, преимущественно в слюнных железах и почках, могут вызывать врожденные инфекции. К гамма-герпесвирусам относятся ЕBV и HHV-8.
Вирус простого герпеса 1 и 2 типов
Термин "герпетическая инфекция" (ГИ) обычно употребляется относительно заболеваний, которые вызываются HSV-1 и HSV-2. Источником HSV-инфекции являются больные люди различными формами заболевания, в том числе и латентной, а также вирусоносители.
HSV-1 передается воздушно-капельным и контактным путем. Попавший на кожу во время кашля, чихания вирус, находящийся в капельках слюны, выживает в течение часа. На влажных поверхностях (умывальник, ванна и прочее) он сохраняет жизнеспособность в течение 3-4 часов, что нередко является причиной вспышек заболеваний в детских дошкольных учреждениях. Заражение может осуществляться при поцелуях, а также через предметы обихода, которые инфицированы слюной больного или вирусоносителя. HSV-2 передается половым или вертикальным путем. При последнем инфицирование происходит во время родов (контакт с родовыми путями матери), трансплацентарно или через цервикальный канал в полости матки. В связи с тем, что при генерализации инфекции имеет место вирусемия, возможен также трансфузионный или парентеральный путь передачи HSV-2 инфекции. HSV-2 вызывает, как правило, генитальный и неонатальный герпес.
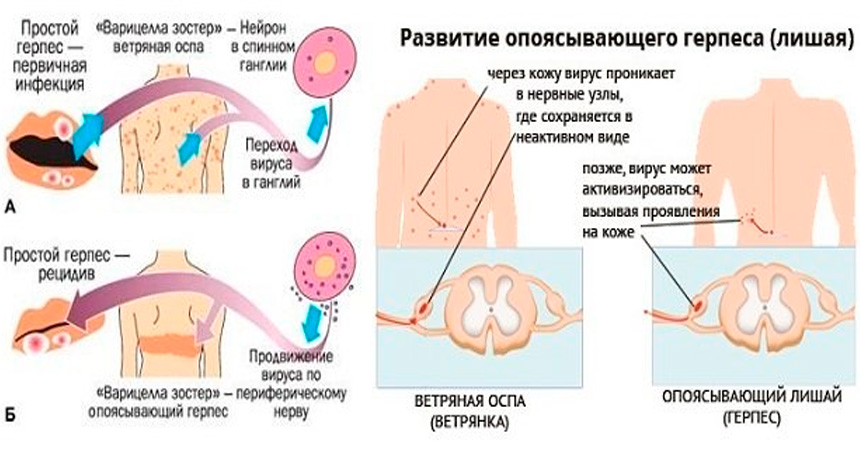
Наибольшая восприимчивость у детей к ГИ в возрасте от 5 месяцев до 3 лет. В зависимости от механизма заражения различают приобретенную и врожденную форму ГИ. Приобретенная ГИ может быть первичной и вторичной (рецидивирующая), локализованной и генерализованной. Также выделяют латентную форму ГИ.
Ни одна инфекция не имеет такого многообразия клинических проявлений, как герпесвирусная. Она может вызывать поражение глаз, нервной системы, внутренних органов, слизистой оболочки желудочно-кишечного тракта, полости рта, гениталий, может являться причиной онкологических заболеваний, имеет определенное значение в неонатальной патологии и возникновении гипертонии. Распространение вируса в организме происходит гематогенным, лимфогенным, нейрогенным путем.
Частота первичной герпесвирусной инфекции возрастает у детей после 6 месяцев жизни, когда полученные от матери антитела исчезают. Пик заболеваемости приходится на возраст 2—3 года. Нередко ГИ встречается и у новорожденных детей, по данным ряда авторов диагностируется у 8% новорожденных с общесоматической патологией и у 11% недоношенных детей.
По данным ВОЗ, заболевания, обусловленные вирусом простого герпеса (HSV), занимают второе место после гриппа среди причин смертности от вирусных инфекций. Решение проблемы диагностики и лечения герпесвирусной инфекции с проявлениями на слизистой оболочке полости рта — одна из важнейших задач практической медицины.
В последнее десятилетие во всем мире значение герпесвирусных заболеваний как проблемы общественного здравоохранения постоянно растет. Представители семейства герпесвирусов человека поражают до 95% населения мира.
К первичным формам ГИ относятся: инфекция новорожденных (генерализованный герпес, энцефалиты, герпес кожи и слизистых), энцефалиты, гингивостоматиты, герпетиформная экзема Капоши, первичный герпес кожи, глаз, герпетический панариций, кератиты. Первичная ГИ возникает вследствие первичного контакта человека с HSV. Как правило, это происходит в раннем детском возрасте (до 5 лет). У взрослых в возрасте 16-25 лет, которые не имеют противовирусного иммунитета, первичная ГИ чаще может быть обусловлена HSV-2. Латентно переносят заболевание 80-90% первично инфицированных детей, и только в 10-20% случаев наблюдаются клинические проявления болезни.
Вторичными, рецидивирующими формами ГИ является герпес кожи и слизистых оболочек, офтальмогерпес, герпес половых органов.
Эпштейн-Барр-вирусная инфекция
Инфекционное заболевание, которое вызывается вирусом Эпштейн-Барр (ЕBV) и характеризуется системным лимфопролиферативным процессом с доброкачественным или злокачественным течением.
ЕBV выделяется из организма больного или вирусоносителя с орофарингеальным секретом. Передача инфекции происходит воздушно-капельным путем через слюну, часто во время поцелуев матерью своего ребенка, поэтому иногда ЕBV-инфекцию называют "болезнью поцелуев". Дети нередко заражаются ЭБВ через игрушки, загрязненные слюной больного ребенка или вирусоносителя, при пользовании общей посудой, бельем. Возможен гемотрансфузионный путь передачи инфекции, а также половой. Описаны случаи вертикальной передачи ЕBV от матери к плоду, предполагают, что вирус может быть причиной внутриутробных аномалий развития. Контагиозность при ЕBV-инфекции умеренная, что, вероятно, связано с низкой концентрацией вируса в слюне. На активацию инфекции влияют факторы, снижающие общий и местный иммунитет. Возбудитель ЕBV-инфекции имеет тропизм к лимфоидно-ретикулярной системе. Вирус проникает в В-лимфоидные ткани ротоглотки, а затем распространяется по всей лимфатической системе организма. Происходит инфицирование циркулирующих В-лимфоцитов. ДНК-вируса проникает в ядра клеток, при этом белки вируса придают инфицированным В-лимфоцитам способность беспрерывно размножаться, вызывая так называемое "бессмертие" В-лимфоцитов. Этот процесс является характерным признаком всех форм ЕBV-инфекции.
ЕBV может вызывать: инфекционный мононуклеоз, лимфому Беркитта, назофарингеальную карциному, хроническую активную ЕBV-инфекцию, лейомиосаркому, лимфоидную интерстициальную пневмонию, "волосатую" лейкоплакию, неходжкинскую лимфому, врожденную ЕBV-инфекцию.
Варицелла-зостер-инфекция
Varicella-zoster вирус вызывает ветряную оспу и опоясывающий герпес. Источником инфекции при ветряной оспе может быть только человек, больной ветряной оспой или опоясывающим герпесом, включая последние 24-48 часов инкубационного периода. Реконвалесценты ветряной оспы остаются заразными на протяжении 3-5 дней после прекращения высыпаний на коже. Через третье лицо заболевание не передается. Возможно внутриутробное заражение ветряной оспой в случае заболевания беременной. Ветряная оспа может встречаться в любом возрасте, но в современных условиях максимальное количество больных приходится на детей в возрасте от 2 до 7 лет. Опоясывающий герпес развивается после первичного инфицирования вирусом Varicella-zoster, после перехода инфекции в латентную форму, при которой вирус локализуется в спинальных, тройничном, сакральном и других нервных ганглиях. Возможна эндогенная реактивация инфекции.
Цитомегаловирусная инфекция
Инфекционное заболевание, которое вызывается цитомегаловирусом (CMV) и характеризуется разнообразными клиническими формами (от бессимптомной до тяжелой генерализованной с поражением многих органов) и течением (острым или хроническим). Факторами передачи CMV могут быть практически все биологические субстраты и выделения человека, в которых содержится вирус: кровь, слюна, моча, ликвор, вагинальный секрет, сперма, амниотическая жидкость, грудное молоко. Потенциальным источником инфекции являются органы и ткани в трансплантологии, а также кровь и ее продукты в трансфузиологии. Пути передачи CMV-инфекции: воздушно-капельный, половой, вертикальный и парентеральный.
Различают врожденную и приобретенную формы CMV-инфекции. Врожденная CMV-инфекция. При антенатальном инфицировании плода заражение происходит преимущественно трансплацентарно. При интранатальном инфицировании CMV поступает в организм при аспирации инфицированных околоплодных вод или секретов родовых путей матери.
У детей более старшего возраста приобретенная CMV-инфекция в 99% случаев протекает в субклинической форме. Наиболее частым проявлением такой формы CMV-инфекции у детей в возрасте старше года является мононуклеозоподобный синдром. Как правило, наблюдается клиника острого респираторного заболевания в виде фарингита, ларингита, бронхита.
Инфекции, вызванные шестым, седьмым и восьмым типами герпесвирусов Герпесвирусы шестого типа (HHV-6) могут явиться причиной эритематозной и розеолезной сыпи (внезапная экзантема), поражений ЦНС и костного мозга у иммуноскомпроментированных детей. Герпесвирусы седьмого типа (HHV-7) вызывают экзантему новорожденных
Для диагностики герпетической инфекции ценным являются цитологический, иммунофлюоресцентный, серологический и ПЦР методы.
Вирусологическое исследование при герпетической инфекции выявляет комплементсвязывающие антитела к ВПГ-1 или -2 в крови матери, пуповинной крови плода и амниотической жидкости.
ПЦР-метод. Материалом для исследования на герпес являются кровь, мазки из глотки, содержимое пузырьков, язв, моча.
Важное значение имеет исследование специфических антител различных подклассов: IgM, IgG1-2, IgG3 и IgG4 к герпес-вирусам. Выявление в сыворотке крови детей специфических иммуноглобулинов М, IgG3, IgG1-2 в титре > 1:20, вирусного антигена и специфических иммунных комплексов с антигеном свидетельствует об остроте инфекционного процесса (активная фаза), а определение только специфических IgG4 расценивается как латентная фаза инфекции или носительство материнских антител.
Лечение
Герпетической инфекции проходит в 3 этапа:
- 1 этап – в активной стадии или при обострении хронического течения заболевания;
- 2 этап – пролонгированное лечение поддерживающими дозами в период ремиссии;
- 3 этап – выявление и санация хронических очагов инфекции, обследование членов семьи для выявления источника инфицирования.
Во всех случаях препараты, их комбинация и длительность подбираются индивидуально с учетом проявлений заболевания, особенности иммунной системы ребенка, возраста, течения заболевания.
Автор материала: врач-педиатр клиники на Родионовской Телицына Е. В.
Читайте также:

