Сочетанная инфекция что это такое
Обновлено: 11.05.2024
В последнее время все чаще стали появляться публикации, посвященные сочетанной патологии (коморбидности), характеризующейся совместным протеканием различных заболеваний [1–6]. В инфекционной патологии сочетанность различных инфекционных болезней также не является редким явлением. Речь идет о так называемых полиэтиологичных, смешанных, сочетанных, ассоциированных инфекциях, обусловленных воздействием двух и более возбудителей, относящихся к разным видам микроорганизмов. Первые наблюдения инфекций, обусловленных несколькими возбудителями, и микробных сочетаний принадлежали великому Л. Пастеру (1865). Именно он показал, что заразная болезнь шелковичных червей представляет собой 2 разные инфекции, обусловленные двумя различными микроорганизмами: первая – простейшими Nozema bombiels, вторая – грибами Botrydis bassiana. Оба эти возбудителя часто развиваются в том же шелковичном черве [7].
Сегодня уже очевидно, что современной инфекционной патологии проблема сочетанных инфекций занимает исключительно важное место. Высочайшая актуальность сочетанных инфекций подтверждается данными официальной регистрации в России пока только ВИЧ-инфекции и туберкулеза, начиная с 1999 г. (рис. 1). Рост заболеваемости сочетанной инфекцией ВИЧ + туберкулез в абсолютных цифрах в стране за 13 лет составил 127 раз! [9].
Пока еще сложно говорить о заболеваемости сочетанными инфекциями и их удельном весе в общей патологии человека, однако, судя по публикациям [2–7, 10–16], можно предполагать довольно большой их потенциал.
Изучив доступные источники информации, мы попытались представить современную структуру сочетанных инфекций (рис. 2). Наибольший удельный вес (68,7%)приходится на инфекции, вызванные двумя возбудителями; на долю инфекций, вызванных тремя возбудителями – 24,2%. Инфекции, обусловленные четырьмя и более возбудителями, встречались существенно реже, их доля составила 7,1%.
Тем не менее к настоящему времени накоплен значительный объем информации, касающийся инфекций у людей, вызванных несколькими инфекционными агентами, протекающих одновременно и влияющих на течение и исход заболевания. Авторы используют разнообразные термины для описания подобных состояний. Однако несмотря на длительную историю изучения, обилие используемых понятий и определений, единая классификация и общепринятая терминология в этой области до сих пор отсутствуют.
В структуре инфекционной патологии острые респираторные инфекции (ОРИ) до настоящего времени являются значимой проблемой, занимая ведущее место в структуре инфекционных и паразитарных болезней. В Российской Федерации ОРИ входят в перечень заболеваний, имеющих наибольшую экономическую значимость. На современном этапе чрезвычайно актуальна проблема сочетанного инфицирования. В статье представлены гипотезы, объясняющие роль дисбиоза, сопровождающегося увеличением числа патобионтов, в развитии воспаления и снижении целостности эпителия, способствующего проникновению вирусов в слизистую верхних дыхательных путей. Описаны три сценария взаимодействия респираторных возбудителей между собой, реализующихся в виде синергизма, антагонизма или индифферентности, которые определяют доминирующие клинические проявления и течение болезни при сочетанной инфекции. Более подробно освещены некоторые клинические особенности течения гриппозной инфекции и SARS-CoV-2-инфекции, выделены симптомы, характерные для обоих заболеваний, и симптомы, позволяющие провести дифференциальную диагностику. Обозначены проблемы лечения вирусных инфекций респираторного тракта, связанные, в частности, с необоснованно частым применением системных антибиотиков, обусловливающим ухудшение прогноза заболевания, повышение риска побочных явлений и рост числа антибиотикорезистентных штаммов микроорганизмов. Обосновано назначение препаратов, стимулирующих выработку интерферонов — ключевого звена противовирусной защиты.
Ключевые слова: респираторные инфекции, сочетанные инфекции, патобионты, грипп, SARS-CoV-2, терапия.
Для цитирования: Николаева С.В., Каннер Е.В., Каннер И.Д. и др. Респираторные инфекции сочетанной этиологии — особенности клинической картины, подходы к терапии. РМЖ. 2021;10:21-26.
Respiratory co-infections: clinical presentations, treatment approaches
S.V. Nikolaeva 1 , E.V. Kanner 1 , I.D. Kanner 2 , N.M, Lapkin 3 , A.V. Gorelov 1,4
1 Central Research Institute of Epidemiology of the Russian Federal Service
for Supervision of Consumer Rights Protection and Human Well-Being, Moscow
2 Lomonosov Moscow State University, Moscow
3 Yaroslavl State Medical University, Yaroslavl
4 I.M. Sechenov First Moscow State Medical University (Sechenov University), Moscow
Acute respiratory infections (ARIs) are still an important issue. They rank fifth among infectious and parasitic diseases. In Russia, ARIs are included in diseases with the highest economic relevance. Currently, co-infection is of particular importance. This paper addresses hypotheses that explain the role of dysbiosis (associated with the increased count of pathobionts) in the development of inflammation and reduction in epithelial integrity favoring viral invasion into upper airway mucosa. Three scenarios of the interaction of respiratory pathogens between each other (i.e., synergy, antagonism, or indifference), which account for predominant clinical presentations and disease course in co-infection, are described. The paper also discusses some clinical features of flu and SARS-CoV-2-infection and highlights symptoms typical for both disorders, allowing for differential diagnosis. Challenges in treating viral infections of the respiratory tract are accounted for by unreasonably freq uent use of systemic antibiotics that result in poor prognosis, increased risk of adverse reactions, and a growing number of antibiotic-resistant microbial strains. Finally, the use of medications stimulating the production of interferons, the critical element of antiviral defense, is substantiated.
Keywords: respiratory infections, co-infections, pathobionts, flu, SARS-CoV-2, therapy.
For citation: Nikolaeva S.V., Kanner E.V., Kanner I.D. et al. Respiratory co-infections: clinical presentations, treatment approaches. RMJ. 2021;10:21–26.
Введение
Эпидемиологическая ситуация и в мире, и в нашей стране по заболеваемости острыми респираторными инфекциями (ОРИ) остается на стабильно напряженной. В периоды пика заболеваемости ОРИ диагностируют у 30% населения планеты, а частота респираторных вирусных инфекций в разы превосходит частоту остальных инфекционных заболеваний. В рейтинге экономической значимости среди всех инфекционных болезней ОРИ занимают 1-е место, и эта ситуация сохраняется на протяжении последних 15 лет [1].
Этиологическая структура ОРИ в настоящее время характеризуется преобладанием вирусных агентов над бактериальными, при этом доминирующими возбудителями чаще всего являются риновирусная и гриппозная инфекции. Следует отметить, что в последние годы благодаря модернизации и широкому внедрению молекулярных методов верификации патогенов при ОРИ (таких как ПЦР) доля выявленных сочетанных инфекций возрастает. Накоплены фактические данные, подтверждающие, что инфицирование несколькими респираторными патогенами изменяет течение болезни, ее клинико-лабораторную картину, что затрудняет диагностический поиск и может приводить к развитию бактериальных осложнений и неблагоприятным исходам.
Способность респираторных вирусов вызывать последующие бактериальные коинфекции хорошо известна [2], однако современные данные свидетельствуют о том, что может происходить и обратное. Увеличение числа различных патобионтов в микробиоте верхних дыхательных путей (ВДП) может увеличить частоту и тяжесть вирусных инфекций ВДП [3, 4].
Роль патобионтов в развитии вирусных инфекций ВДП
Патобионты определяются как бактерии, которые обычно встречаются у здоровых людей, но при определенных условиях могут быть патогенными. S. pneumoniae, H. influenzae, S. aureus и M. catarrhalis были определены как бактерии-патобионты, и повышенное содержание одного или нескольких из этих микроорганизмов часто является признаком дисбиоза в ВДП [3]. Повышенная численность патобионтов часто приводит к снижению разнообразия микробиоты, что, согласно гипотезе, способствует снижению чувствительности эпителиального барьера и развитию более выраженного воспаления в ответ на триггеры окружающей среды, включая респираторные вирусы [5].
Ассоциацию бактериального дисбиоза и вирусных инфекций можно объяснить несколькими механизмами. Патобионты ВДП выделяют вещества, которые нарушают цилиарную функцию, снижая мукоцилиарный клиренс [4, 6]. Секретируемые бактериальные продукты (например, эластаза) также могут непосредственно воздействовать на белки плотного соединения (tight junction, TJ), снижая барьерную функцию эпителия [7, 8]. Кроме того, распознавание патобионтов через TLRs также может снижать экспрессию белков TJ [4, 9]. Показано, что некоторые патобионты повышают экспрессию вирусных рецепторных белков в эпителиальных клетках [4]. Эти механизмы представляют собой вероятные способы, с помощью которых присутствие или повышенная численность патобионтов может способствовать развитию вирусных инфекций, помимо способности вируса преодолевать врожденную иммунную защиту хозяина. В здоровых ВДП, где присутствует разнообразная микробиота, большее количество комменсальных микроорганизмов, связанных с молекулярными паттернами (MAMPs), способно прикрепляться к рецепторам распознавания паттернов (PRRs) эпителиальных и дендритных клеток, что обеспечивает поддержание целостности эпителия и низкую восприимчивость к вирусной инфекции. Дисбиоз в ВДП, в свою очередь, сопровождается увеличением количества патобионтов, взаимодействующих посредством MAMPs с PRRs эпителиальных и дендритных клеток, результатом чего является развитие воспаления и снижение целостности эпителия, способствующих проникновению вирусов в слизистую ВДП (рис. 1) [4].
![Рис. 1. Взаимодействие эпителия ВДП и вируса в норме (А) и при дисбиозе (B) [4]](https://www.rmj.ru/upload/medialibrary/414/21-1.jpg)
Варианты взаимодействия возбудителей при сочетанных инфекциях
активизация инфекционного процесса, вызванного всеми возбудителями; как правило, приводит к утяжелению клинического течения болезни, его затяжному течению, ухудшению прогноза болезни (синергизм);
преимущественная активизация одного из инфекционных процессов — может происходить под влиянием стимулирующего воздействия одного из возбудителей на другой или, напротив, в результате антагонизма, когда один из микроорганизмов оказывает угнетающее влияние;
активизации инфекционного процесса не происходит — из-за возникающего антагонизма между возбудителями сочетанных инфекций и угнетения их репродукции (например, одновременное заражение гриппом и парагриппом, гриппом и аденовирусной инфекцией приводит к развитию легких форм болезни);
каждая из сочетанных инфекций при своем развитии не оказывает друг на друга влияния и при оценке воздействия на организм их определяют как сумму моноинфекций — индифферентность (например, сочетание респираторно-синцитиального вируса и метапневмовируса не оказывает существенного влияния на течение болезни в сравнении с моноинфекциями) [12, 13].
С учетом вышеизложенного клиническая картина ОРИ сочетанной этиологии может иметь существенные отличия от проявлений каждой инфекции в отдельности: более тяжелое по сравнению с моноинфекциями течение болезни за счет синергизма взаимодействия инфекционных агентов, что приводит к увеличению частоты госпитализаций, в том числе в отделения интенсивной терапии, увеличению продолжительности госпитализации и длительности использования искусственной вентиляции легких [14–16]; отсутствие изменения клинической картины в сторону утяжеления (или, возможно, более легкое течение) — за счет антагонизма возбудителей [17, 18]; отсутствие взаимо-связи двух инфекционных патогенов (индифферентность), в результате болезнь течет как две отдельные инфекции [12]. Кроме того, клиническая картина одной инфекции, накладываясь на другую, может искажать клинические проявления болезни, так как возникают новые симптомы, не свойственные классическому течению каждой из инфекций в отдельности.
Особенности течения ОРИ, вызванных вирусом гриппа и SARS-CoV-2
У пациентов с гриппом симптомы, как правило, появляются внезапно, в течение 2–5 дней после инфицирования, и это может быть признаком, позволяющим отличить грипп от других вирусных инфекций респираторного тракта [20]. Наиболее важным симптомом у этих пациентов является лихорадка, которая наблюдается более чем у 90% из них, наряду с другими симптомами, такими как озноб, ломота в теле, боль в горле, заложенность носа, усталость, рвота, боль в животе и диарея [21, 22]. Исследования также показали, что у таких пациентов в ряде случаев могут возникать бактериальная пневмония, энцефалит, гемофагоцитарный синдром и миокардит. Симптомы заболевания обычно проходят в течение 5–8 дней, в то время как у маленьких детей, пожилых людей (в возрасте ≥65 лет) и пациентов с ослабленным иммунитетом течение заболевания может осложниться отеком легких, острым респираторным дистресс-синдромом (ОРДС) или закончиться летальным исходом.
Таким образом, к симптомам, характерным и для гриппа, и для COVID-19 можно отнести [19]:
повышенную температуру или ощущение лихорадки/озноба;
одышку или затрудненное дыхание;
насморк или заложенность носа;
боль в мышцах или боли в теле;
Симптомами, характерными для SARS-CoV-2-инфекции, являются:
непродуктивный сухой кашель;
изменение или потеря вкуса или запаха;
кожная сыпь или изменение цвета кожи пальцев рук.
Многочисленные исследования позволили установить иммунопатологические механизмы, реализующиеся при гриппе. Однако возможные механизмы при COVID-19 пока не вполне ясны. Результатом взаимодействия обоих вирусов с макроорганизмом являются такие патологические процессы, как лихорадка, воспаление, лимфопения, гиперкоагуляция, желудочно-кишечные расстройства, а наиболее тяжелыми последствиями — ОРДС, полиорганная недостаточность и смерть. Однако тяжесть этих симптомов может варьироваться при этих инфекционных заболеваниях (рис. 2).
![Рис. 2. Иммунопатологическое сходство вируса гриппа и SARS-CoV-2 [19]](https://www.rmj.ru/upload/medialibrary/46d/21-2.jpg)
Таким образом, в настоящее время известно, что механизмы, запускаемые разными вирусами, способны усиливать (что наблюдается чаще всего) или подавлять действие друг друга, при этом с более тяжелыми исходами может быть связано инфицирование определенными сочетаниями респираторных патогенов. Однако на практике зачастую сложно предсказать, по какому именно сценарию пойдет инфекционный процесс, так как это зависит не только от возбудителей и их сочетаний, но и от реакции макроорганизма на болезнь. В связи с этим основными задачами для практикующих врачей являются этиологическая диагностика респираторной инфекции и установление основного и сопутствующего диагноза — для определения тактики лечения при выявлении сочетанных форм инфекции.
Подходы к лечению вирусных инфекций ВДП
Глобальной проблемой последних лет является не-обоснованно частое применение системных антибиотиков (АБ) при вирусных инфекциях респираторного тракта. Так, в Австралии системные АБ назначаются в 4–9 раз чаще, чем это предписывают терапевтические рекомендации: в 11% случаев гриппа, в 85% случаев острого бронхита/бронхиолита, в 94% случаев острого фарингита или тонзиллита, в 89% случаев острого отита [30]. А частота назначения АБ в Сербии достигала 87–96% при ОРВИ, остром отите и остром тонзиллите [31]. В Греции за год хотя бы один курс системных АБ получили 45% детей, обратившихся за медицинской помощью по поводу острого среднего отита (27,3%), тонзиллофарингита (25,4%) и бронхита (17,8%). При фаринготонзиллитах, инфекциях мочевыводящих путей и кожи чаще всего назначали амоксициллин/клавуланат (30,5, 35,7 и 36,4% случаев соответственно), при остром среднем отите и пневмонии — амоксициллин (32,3% и 36,4% случаев соответственно), при бронхите — кларитромицин (27,7%) [32]. В России врачи назначали системные АБ при неосложненной ОРВИ в среднем в 59,6% случаев (в 8 из 18 городов, в которых проходило исследование, АБ назначали вообще в 100% случаев). Чаще всего назначали амоксициллин, амоксициллин/клавуланат и азитромицин (32,6, 26,7 и 18,6% назначений соответственно). Частота антибактериальной терапии при остром среднем отите, остром тонзиллофарингите, остром риносинусите и остром бронхите составила 81,9, 94,5, 95,5 и 96,0% соответственно [33]. Неадекватное назначение системных АБ (в том числе при ОРВИ) имеет негативные последствия в виде увеличения длительности терапии и ухудшения прогноза заболевания, повышения риска побочных явлений, а также появления антибиотикорезистентных штаммов микроорганизмов, что становится глобальной угрозой здоровью человека [34].
В связи с этим одним из важных вопросов, относящихся к терапии респираторных инфекций, является назначение иммунотропных препаратов, обладающих интерфероногенным действием, применение которых обосновано развитием транзиторного иммунодефицита. Симптоматическое лечение также является важным направлением терапии больных с ОРВИ и гриппом. С этой целью активно используются комбинированные лекарственные препараты, которые в большинстве своем обладают жаропонижающим, обезболивающим и антигистаминным действием, а также являются дополнительным источником витамина С. Среди подобных препаратов отдельное место занимает комбинированный препарат АнвиМакс ® . Помимо перечисленных свойств данный препарат обладает противовирусным, а также интерфероногенным действием, важность которого при лечении ОРВИ обсуждалась нами выше.
Заключение
Таким образом, выявленные особенности взаимодействия возбудителей респираторных инфекций сочетанной этиологии необходимо учитывать при проведении дифференциальной диагностики на этапе постановки диагноза и не исключать возможности наличия у пациента нескольких респираторных патогенов, что необходимо иметь в виду при последующем определении тактики его лечения. Несмотря на то, что в настоящее время в арсенале врачей имеется большое количество высокоэффективных средств, реально снизить заболеваемость ОРИ пока не удается.
Благодарность
На примере клинических наблюдений обсуждаются подходы к лечению смешанных инфекций у детей, в том числе роль инозина пранобекса, обладающего иммуномодулирующей и противовирусной активностью.
Смешанные инфекции (ассоциированные инфекции, сателлитные инфекции, микстинфекции) – это инфекции, развивающиеся в макроорганизме или (и) отдельных клетках эукариотов, прокариотов при сочетанном воздействии двух и более возбудителей, в том числе вирусов, бактерий, спирохет, микоплазм, риккетсий, хламидий, грибков и простейших. Первые описания смешанных инфекций и ассоциаций микроорганизмов принадлежат Л. Пастеру, установившему в 1865 году, что заразную болезнь шелковичных червей вызывают простейшие Nosema bombycis и грибки Botrytis bassiana. Над проблемой смешанных инфекций работал выдающийся ученый А.Ф. Быковский, который внес большой вклад в мировую науку. При непосредственном участии А.Ф.Быковского, биолога, профессора НИИ эпидемиологии и микробиологии им. Гамалеи, проводились исследования с использованием электронной микроскопии и была создана уникальная фотоколлекция вирусов, бактерий и простейших, патогенных для человека [1].
Развитие смешанных инфекций – это сложный процесс, в котором принимают участие не только два и более возбудителя, но и совокупность других факторов, таких как состояние микро- и макроорганизма и факторы внешней (окружающей) среды. Формы данных инфекций могут быть разными – острые, хронические персистентные, латентные, носительство, суперинфицирование и т.д. В работе А.Ф. Быковского были описаны следующие возможные исходы взаимодействия двух и более возбудителей в процессе смешанной инфекции: 1) независимое размножение; 2) экзальтация – усиление размножения одного или всех ассоциантов; 3) интерференция – подавление размножения одного или всех ассоциантов; 4) комплементация – специфи ческая зависимость размножения одного ассоцианта от другого. Комплементация особенно широко распространена в ассоциациях онкогенных вирусов [1].
В последние годы педиатрам и врачам других специальностей все чаще приходится встречаться со смешанными инфекциями у детей. В ситуации, когда врач имеет дело с несколькими инфекционными заболеваниями, которые находятся в разной по остроте форме, возникает вопрос: как лечить такое заболевание, с чего начать? Занимаясь данной проблемой довольно длительный период времени – более 40 лет, хочу заметить, что многие специалисты не предполагают, что ряд соматических заболеваний могут иметь инфекционное происхождение. К примеру: болезни сердца (эндомиокардиты, нарушения ритма), суставов (реактивные артриты), сосудов (болезнь Кавасаки, васкулиты) кишечника (болезнь Крона, язвенный колит и др.), многочисленные заболевания ЛОР-органов, верхних и нижних отделов дыхательных путей (бронхиты, бронхиальная астма), гематологические процессы (нейтропения, гемофагоцитарный синдром), воспалительные заболевания глаз (конъюнктивиты, хориоретиниты), врожденные инфекции, патология центральной нервной системы (внутрижелудочковые кровоизлияния), рассеянный склероз, эпилепсия, инсульт и др. [2,3] Данный список может быть, безусловно, продолжен. Другая сторона вопроса касается не только объема знаний того или иного специалиста относительно инфекционных болезней, а нередко отсутствие времени и желания исключать инфекцию. Этому обстоятельству способствуют и объективные трудности – это довольно узкие временные "рамки", в которых приходится работать специалисту, отсутствие времени на совместные консультации или консилиумы. Поэтому нередко больные с их родителями "ходят по кругу" от одного специалиста к другому, пока не получат адекватного лечения, или пока заболевание не перейдет в хроническую форму. Особенно это относится к часто болеющим детям.
Лечение смешанных инфекций представляет собой сложную проблему и требует привлечения различных специалистов. В последние годы уделяется большое внимание лечению заболеваний смешанной, вирусной, в том числе герпесвирусной этиологии. Приводим клинические наблюдения.
Виктория С., 5 лет. В октябре 2017 г. обратилась с мамой в консультативно-диагностический центр ГБУЗ "Морозовская ДГКБ" с жалобами на частые острые респираторные заболевания, сопровожавшиеся признаками бронхиальной обструкции. У родителей аллергический ринит. С осени 2016 г. наблюдается у аллерголога. Получала курсами флутиказон и монтелукаст. В марте 2017 г. была выявлена хламидийная инфекция, в связи с чем проводилось лечение кларитромицином. Контрольные анализы были отрицательными. В июне 2017 г. вновь заболела. Рекомендовано серологическое и микробиологическое обследование.
По результатам предварительного обследования выявлено обострение инфекции, вызванной вирусом Эпштейна-Барр – ЭБВ (IgG антитела к EBNA – 45,1; IgG антитела к VCA >750,0; IgM антитела к VCA – отрицательные, IgG антитела к раннему антигену – положительные, ПЦР слюны – ЭБВ положительный). Респираторно-синцитиальный (РС) вирус: IgG антитела – 3,0, IgM антитела – 1,7 (при коэффициенте позитивности – более 1,1). Другие герпесвирусы, хламидии и микоплазмы не выявлены. Посев из зева: S. viridans – 105 КОE/мл, S. aureus – 104 KOE/мл.
Диагноз по МКБ10 J20.9 – рецидивирующий обструктивный бронхит, обусловленный смешанной микрофлорой (ЭБВ + РС-вирус), дисбиоз ротоглотки.
Назначено лечение: инозин пранобекс (Гропри носин®, "Гедеон Рихтер") 10 дней (два курса), пиополивалентный бактериофаг 14 дней, Имунорикс 2 месяца, Бронхомунал 3 месяца. При обследовании в феврале 2018 г. отмечена положительная динамика. При ПЦР мазка из зева ЭБВ не выявлен. IgG антитела к раннему антигену ЭБВ и IgM антитела к РС-вирусу не определялись.
Этиология рецидивирующих заболеваний в настоящее время стала гораздо разнообразнее. В большинстве случаев, как у данной пациентки, приходится иметь дело со смешанными инфекциями. Формированию рецидивирующих бронхитов и других респираторных заболеваний способствуют как вирусы – в данном случае – РС-вирус, так и длительная персистенция ЭБВ инфекции (по данным лабораторных анализов, имеет место хроническое течение с обострением), которая, в свою очередь, приводит к повышенной сенсибилизации. В семьях у часто болеющих детей и их родителей, как показали предыдущие наши исследования, имеет место циркуляция практически одних и тех же возбудителей [4]. Поэтому возникает очень важная проблема обследования и лечения родителей.
Препаратов, которые бы одновременно воздействовали на респираторные и другие вирусы, в том числе вирусы герпеса, энтеровирусы, очень мало. На практике часто применяют препараты интерферонового ряда, которые в борьбе с вирусами действуют опосредованно через систему интерферона. В этой связи заслуживает внимания инозин пранобекс (Гроприносин®), который сочетает в себе свойства универсального иммуномодулятора c прямой противовирусной вктивностью в отношении широкого спектра ДНК- и РНК-вирусов. Основной фармакологической субстанцией Гропри носина® является производное пурина – инозин. Второй компонент – соль 4-ацетаминобензойной кислоты и N,-Nдиметиламино-2-пропанола, которая повышает проницаемость биомембран для инозиновой структуры. Механизм противовирусного действия препарата состоит как в прямом ингибировании вирусов, так и в усилении специфического и неспецифического противовирусного иммунитета. На протяжении более 8 лет у нас имеется как свой опыт применения Гропри носина® в педиатрической практике, так и опыт коллег из разных городов России и других стран. Чем же отличается инозин пранобекс от других препаратов? Данный препарат оказывает действие не только на вирусы гриппа А и В, но и другие вирусы респираторной группы, в том числе и РС-вирусы, герпесвирусы (цитомегаловирус, вирусы герпеса 1, 2 типа, ЭпштейнаБарр, ветряной оспы, герпеса 6 типа), полиовирусов, кори, вирусов папилломы человека, контагиозного моллюска. Рекомендуемая доза составляет 50 мг/кг/сут в 3-4 приема (при необходимости суточную дозу препарата увеличивают до 100 мг/кг). Продолжительность курса лечения – от 5 до 10 дней в зависимости от этиологии, сочетания с другими вирусами. При тяжелых вирусных инфекциях дозу подбирают индивидуально. Схемы лечения при разных инфекциях могут быть разными также и по продолжительности.
Отличительной особенностью препарата является высокая безопасность. Уровень его токсичности в несколько раз ниже, чем других средств. Гроприносин® можно принимать детям с 3 лет. Вероятность побочных эффектов очень низкая. Препарат противопоказан взрослым пациентам с подагрой, так как он может вызвать увеличение концентрации мочевой кислоты.
В настоящем примере у ребенка одновременно имелись два вируса, находившихся в активном состоянии – ЭБВ и РС-вирус. После лечения Гроприносином® с последующим поддерживающим курсом применения иммуномодулирующих препаратов достигнуты положительный клинический эффект и прекращение репликации вирусов. Существует необходимость обязательного контроля лабораторных анализов каждые 3 месяца до прекращения репликации вирусов.
Евгения Ш., 12 лет, обратилась в в консультативнодиагностический центр ГБУЗ "Морозовская ДГКБ" с мамой в конце ноября 2017 г. с жалобами на снижение остроты зрения. Осмотрена офтальмологом, который диагностировал левосторонний хориоретинит токсоплазменной этиологии. В возрасте 5 лет перенесла ветряную оспу, летом 2017 г. получала лечение по поводу лямблиоза и аскаридоза. При осмотре (22.11.2017) кожные покровы влажные, чистые. Зев разрыхлен, не гиперемирован, единичные шейные лимфатические узлы единичные размерами до 0,8 см, безболезненные, другие группы лимфатических узлов не пальпировались. Со стороны сердца и легких патологии не выявлено. Печень и селезенка не увеличены. В анализе крови 12,5 × 109/л лейкоцитов, 55% нейтрофилов. Принимая во внимание диагноз офтальмолога, следовало уточнить наличие токсоплазмоза, авидность антител к токсоплазме, а также исключить наличие внутриклеточных инфекций (хламидиоза и микоплазмоза) и герпесвирусных инфекций, которые также могли быть причиной поражения органа зрения. При первичном обследовании была выявлена смешанная инфекция: герпетическая (обострение инфекции, вызванной вирусом простого герпеса 1 типа, острая инфекция, вызванная вирусом простого герпеса 2 типа, персистенция ЭБВинфекции, антитела к вирусу ветряной оспы), острая микоплазменная инфекция, персистирующий токсоплазмоз (табл. 1).
| Возбудители | Положительно при референсных значениях | 22.11.17 | 13.02.18 |
|---|---|---|---|
| Токсоплазма | |||
| IgM, МЕ/мл | >30 | 563,7 | 354,7 |
| IgM, МЕ/мл | >1,0 | 0,4 | 0,3 |
| Вирус простого герпеса 1 | |||
| IgG, коэф. позитивности | >22,0 | 69,0 | 93,9 |
| IgM, коэф. позитивности | >1,1 | 1.3 | 0.3 |
| Вирус простого герпеса 2 | |||
| IgG, коэф. позитивности | >22,0 | 0,5 | 4,6 |
| IgM, коэф. позитивности | >1,1 | 1,2 | 1,2 |
| Вирус ветряной оспы | |||
| IgG, мМЕ/мл | >100,0 | 453,9 | 632,9 |
| IgM, мМЕ/мл | >1,1 | 0,4 | 0,4 |
| ЭБВ | |||
| IgG VCA, Ед/мл | >20,0 | 750,0 | 750,0 |
| IgM VCA, Ед/мл | >40,0 | 19,1 | 11,1 |
| Mycoplasma pneumoniae | |||
| IgG, коэф. позитивности | >1,1 | 0,42 | 0,42 |
| IgM, коэф. позитивности | >1,1 | 1,1 | 0,9 |
Было назначено лечение: спирамицин 1,5 млн МЕ два раза в день в течение 14 дней, инозин пранобекс (Гропри носин®) 2 курса в дозе по 1000 мг три раза в день по 10 дней, пробиотики. Состояние левого глаза и зрение значительно улучшились. Сохранялась активность инфекции, вызванной вирусом герпеса 2 типа, в связи с чем проведены третий курс лечения Гроприносином® в течение 10 дней и терапия меглюмина акридонацетатом. После лечения острых форм инфекции не выявлено, отмечена явная положительная динамика процесса и состояния ребенка. Девочка не болела за время наблюдения.
Таким образом, в данном случае предполагалась токсоплазменная этиология хориоретинита. Однако при обследовании была обнаружена смешанная острая герпесвирусная и микоплазменная инфекция, которая потребовала применения противовирусных, иммуномодулирующих препаратов и макролидного антибиотика. Нельзя не учитывать и пубертатный возраст ребенка. Пациентке потребовались консультации окулиста и инфекциониста и коррекции этиотропного лечения с положительным результатом.
Софья С., 5 лет поступила в 19-е отделение Морозовской больницы 11.03.2011. С марта 2010 г. наблюдалась в гематологическом центре по поводу нейтропении. В общем анализе крови от 11.03.2011 выявлен лейкоцитоз (34,2 × 109/л). При поступлении состояние средней тяжести, катаральные явления, температура тела 38,2°С. Кожные покровы бледно-розовые, чистые, на волосистой части головы гнейс, пальпируются периферические лимфатические узлы (подчелюстные – 1 см, передне- и заднешейные – до 0,5 см). Носовое дыхание умеренно затруднено, слизистое отделяемое. Кашель сухой, редкий. В легких жесткое дыхание, хрипов нет. Печень и селезенка выступают из-под реберной дуги на 2,5 см и 1,0 см, соответственно. Стул и мочеиспускание в норме. В анализе крови от 14.03.2011: эритроциты – 5,2 × 1012/л, тромбоциты – 156 × 109/л, лейкоциты – 39,8 × 109/л, сегментоядерные нейтрофилы – 2,0%, лимфоциты – 85,0%, моноциты 12,0%, СОЭ – 6 мм/ч. В биохимическом анализе патологических изменений не было, печеночные пробы, серомукоид, АСЛ-О в пределах возрастной нормы. Коагулограмма: умеренное замедление протромбинообразования по внутреннему пути свертывания. Содержание иммуноглобулинов (A, M, G, E) в пределах возрастной нормы. Анализы крови на ВИЧ, вирусы гепатита, сифилис отрицательные. Анализ мочи без патологии. Паразитарные и глистные инфекции не выявлены. Проба Манту отрицательная. Посевы на флору из зева роста не дали. При ультразвуковом исследовании органов брюшной полости выявлены признаки билиарной дискинезии, реактивный панкреатит, пиелоэктазия, парапанкреатический лимфатический узел. При рентгенографии органов грудной клетки усиление легочного рисунка. На рентгенограмме черепа выражен рисунок пальцевых вдавлений в лобной области. На ЭКГ патологии нет.
Антитела класса IgM к капсидному антигену ЭБВ – 1,37, IgG антитела к раннему антигену ЭБВ – 42,7, IgG антитела к ядерному антигену (EBNA) ЭБВ отрицательные. IgM антитела к цитомегаловирусу не определялись, IgG антитела – 100,6.
В иммунограмме от 30.03.2011 повышено абсолютное содержание моноцитов – 1398,00 в мкл (в норме до 800,00), снижено количество CD3+CD4+ (Т-хелперов) – 11% (в норме 35,00-51,00), активированы CD3+CD8+ (Т-цитотоксические лимфоциты) – 81,00% (22,0038,00), cнижено количество CD19+ (В-лимфоциты) – 3,00% (21,00-28,00).
На основании полученных данных сделан вывод, что у ребенка на фоне текущей герпесвирусной инфекции (острой ЭБВ-инфекции и персистирующей цитомегаловирусной инфекции) имеет место лейкемоидная реакция лимфоцитарного типа, абсолютная нейтропения. Установлены также тимомегалия, двусторонняя пиелоэктазия, вторичное иммунодефицитное состояние, комбинированный вариант. У матери ребенка, страдающей бронхиальной астмой и находившейся на 39-й неделе беременности, выявлена герпесвирусная инфекция (цитомегаловирус, вирус простого герпеса 1 типа). В стационаре получила курс лечения цефтриаксоном и инозином пранобексом (Гроприносин®) в течение 10 дней. Рекомендована гипоаллергенная диета, временное исключение из рациона (на 3 месяца) бананов, шоколада, а также пробиотики, ферментативные препараты (14 дней), Элькар 20% (1,5 мес), цетиризин по 5 капель два раза раза в день (10 дней).
В данном случае лейкемоидная реакция лимфоцитарного типа и абсолютная нейтропения были спровоцированы острой ЭБВ-инфекцией. В последние годы количество детей с нейтропенией, обусловленной течением какой-либо герпетической инфекции значительно возросло. У нас совместно с гематологическим центром ГБУЗ "Морозовская ДГКБ" имеется многолетний опыт лечения таких детей. Следует подчеркнуть, что за каждым ребенком необходимо дальнейшее наблюдение (в течение года) с динамическим контролем серологических анализов крови один раз в три месяца.
В целом представленные три случая с разной патологией (у часто болеющего ребенка, хориоретинитом, нейтропенией) объединяет совокупность нескольких вирусных и герпетических заболеваний, которые и явились основной причиной развития данной патологии. В этой связи целесообразен подбор этиотропных препаратов с комбинированным иммуномодулирующим и противовирусным действием. К таким препаратам относится инозин пранобекс, отличительной способностью которого является действие на большинство ДНК- и РНК-содержащих вирусов. Положительный эффект от лечения в данных конкретных случаях наблюдался при индивидуальном подходе и определении продолжительности курсов терапии с последующим динамическим наблюдением.
Информация только для специалистов в сфере медицины, фармации и здравоохранения!

Журнал "Медицинский совет" №1/2021
С.В. Николаева 1 , ORCID: 0000-0003-3880-8112
Ю.Н. Хлыповка 1 , ORCID: 0000-0003-4821-676X
А.В. Горелов 1,2 , ORCID: 0000-0001-9257-0171
Д.В. Усенко 1 , С.В. Шабалина 1
1 Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора; 111123, Россия, Москва, ул. Новогиреевская, д. 3а
2 Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
Острые респираторные инфекции занимают ведущие позиции в структуре инфекционной патологии у детей и являются одной из основных причин обращений к врачу. Чаще всего возбудителями острых респираторных инфекций являются вирусы. Все более значимой проблемой в последние годы становятся респираторные инфекции сочетанной этиологии, доля которых возрастает.
При сочетанных инфекциях клиническая диагностика затруднительна, что в очередной раз подчеркивает важность широкого внедрения высокочувствительных методов этиологической диагностики, в частности метода полимеразной цепной реакции. Данные о склонности к более тяжелому течению сочетанных инфекций по сравнению с моноинфекциями неоднозначны, что, по-видимому, зависит от конкретного возбудителя и уровня вирусной нагрузки. Еще одной актуальной проблемой острых респираторных инфекций у детей является частая регистрация сочетанной респираторно-вирусной и герпес-вирусной инфекций.
Клиническая картина острых инфекций респираторного тракта не отличается значительным разнообразием: лихорадка, симптомы интоксикации, кашель, заложенность носа, ринорея, боль/першение в горле и пр. Вместе с тем для ряда моноинфекций удается выявить патогномоничные симптомы, однако при сочетанных инфекциях такая клиническая диагностика представляет трудности, что позволяет говорить о важности этиологической диагностики, особенно метода полимеразной цепной реакции. Все вышеизложенное, а также возраст и клинические проявления во многом определяют рациональный подбор противовирусной терапии, одновременно эффективной в отношении как респираторных вирусов, так и герпес-вирусов. Одним из таких препаратов является Циклоферон ® , обладающий не только широким противовирусным спектром, но и высоким уровнем безопасности.
Включение препарата – индуктора интерферона в комплексную терапию ОРИ позволит уменьшить потребность в назначении других лекарственных средств, в т.ч. антибиотиков, и снизить медикаментозную нагрузку на организм.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Respiratory infections of combined etiology in the clinical practice of the pediatrician
Svetlana V. Nikolaeva 1 , ORCID: 0000-0003-3880-8112
Yuliya N. Khlypovka 1 , ORCID: 0000-0003-4821-676X
Aleksandr V. Gorelov 1,2 , ORCID: 0000-0001-9257-0171
Denis V. Usenko 1 , Svetlana V. Shabalina 1
1 Central Research Institute of Epidemiology of The Federal Service on Customers’ Rights Protection and Human Well-being Surveillance; 3a, Novogireevskaya St., Moscow, 111123, Russia
2 Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
Acute respiratory infections hold the leading position in the structure of infectious pathology in children and are one of the main reasons for visits to the doctor. Most often causative agents of acute respiratory infections are viruses. In recent years, respiratory infections of combined etiology are becoming an increasingly significant problem, the proportion of which is increasing. In co-infections, clinical diagnosis is difficult, which once again emphasizes the importance of the widespread introduction of highly sensitive etiological diagnostic methods, in particular polymerase chain reaction. Data on the tendency to a more severe course of co-infections compared to mono-infections are ambiguous, which seems to depend on the specific causative agent and the level of viral load. Another urgent problem of acute respiratory infections in children is the frequent registration of concomitant respiratory viral and herpes virus infections.
The clinical picture of acute respiratory tract infections is not very diverse: fever, intoxication symptoms, cough, nasal congestion, rhinorrhea, sore throat, etc. At the same time, pathognomonic symptoms can be identified in some monoinfections, but in coinfections such clinical diagnosis is difficult, suggesting the importance of etiological diagnosis, especially polymerase chain reaction (PCR).
All of the above, as well as age and clinical manifestations largely determine the rational selection of antiviral therapy simultaneously effective against both respiratory viruses and herpes viruses. One such drug is Cycloferon, which has not only a broad antiviral spectrum, but also a high level of safety.
Inclusion of an interferon inducer in the treatment of acute respiratory infections will reduce the need to prescribe other drugs, including antibiotics, and reduce the medication load on the body.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Острые респираторные инфекции (ОРИ) занимают ведущие позиции в структуре инфекционной патологии у детей и являются одной из основных причин обращений за медицинской помощью. Чаще всего возбудителями ОРИ являются вирусы, среди которых наибольшее значение имеют вирусы гриппа, респираторно-синцитиальный вирус, вирусы парагриппа, риновирусы, аденовирусы. Несколько лет назад были описаны ранее неизвестные серотипы коронавирусов (NL63, HKU, SARS-CoV, MERS-CoV), бокавирусы и метапневмовирус, а в конце 2019 г. был открыт новый коронавирус SARS-CoV-2, вызывающий болезнь COVID-19. Помимо вирусов, за развитие ОРИ ответственны и пневмотропные бактерии: Мycoplasma pneumoniae, Haemophilus influenzae, Streptococcus pneumoniae и др.
СОЧЕТАННЫЕ РЕСПИРАТОРНЫЕ ИНФЕКЦИИ
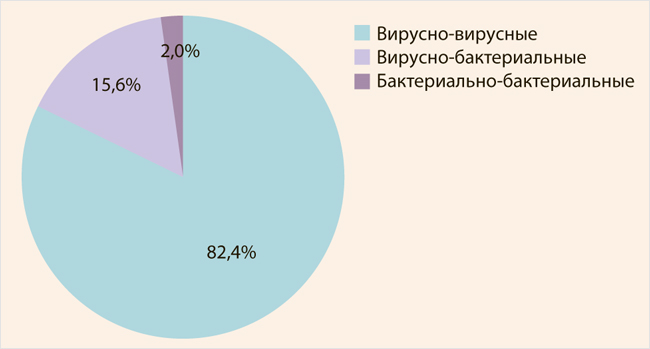
Трендом последних лет является увеличение значимости сочетанных респираторных инфекций. Согласно данным литературы, чаще всего возбудителями респираторных сочетанных инфекций, так же как и моноинфекций, являются вирусы, при этом широко распространены сочетания, как правило, двух респираторных патогенов. В нашем исследовании, проведенном в 2017–2019 гг. в профильном стационаре г. Москвы, для определения этиологии ОРИ было обследовано 2 388 детей в возрасте до 17 лет. Критериями постановки диагноза сочетанной инфекции были следующие: клинические проявления ОРИ и выявление двух и более инфекционных агентов в первые 72 ч от начала болезни. В результате проведенного анализа выявили, что доля сочетанных инфекций в структуре расшифрованных ОРИ составила 25,1%. В 98% случаев за их развитие были ответственны респираторные вирусы, и только у 2% детей регистрировались бактериальные ассоциации (рис.). В общей этиологической структуре сочетанных ОРИ лидирующие позиции занимала риновирусная инфекция, на долю которой приходится 41,5% случаев инфицирования среди всех вирусных ОРИ.
Рисунок. Этиологическая структура ОРИ у госпитализированных детей (%)
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина острых инфекций респираторного тракта не отличается значительным разнообразием: лихорадка, симптомы интоксикации, кашель, заложенность носа, ринорея, боль/першение в горле и пр. Вместе с тем для ряда моноинфекций удается выявить патогномоничные симптомы, например, для гриппа характерна выраженность интоксикации и гипертермия выше 39 ° С; для риновирусной инфекции – ринорея; для парагриппа – поражение, преимущественно гортани; для аденовирусной инфекции – выраженность и продолжительность катаральных проявлений в носоглотке. При сочетанных инфекциях подобная клиническая диагностика затруднительна, что в очередной раз подчеркивает важность широкого внедрения высокочувствительных методов этиологической диагностики (в частности, метода полимеразной цепной реакции – ПЦР). В свою очередь, трудности диагностики могут приводить к неоправданно частому назначению антибиотиков, что в последние годы представляет собой актуальную проблему, прежде всего из-за роста антибиотикорезистентности возбудителей инфекций.
Еще одной актуальной проблемой острых инфекций респираторного тракта у детей является частая регистрация сочетанной респираторно-вирусной и герпес-вирусной инфекций. Клиническая картина герпес-вирусных инфекций часто схожа с проявлениями ОРИ, однако особенности взаимодействия герпес-вирусов с клетками человека, длительное течение инфекционного процесса и, как следствие, изменение иммунологической реактивности организма диктуют необходимость назначения противовирусной терапии пациентам с клиническими проявлениями ОРИ и активными формами герпес-вирусных инфекций [18].
ПРОТИВОВИРУСНАЯ ТЕРАПИЯ
Все вышеизложенное, а также возраст и клинические проявления (тяжесть болезни, наличие осложнений и/или сопутствующих хронических соматических заболеваний) во многом определяют рациональный подбор противовирусной терапии. Необходимо отметить, что только у единичных препаратов есть доказанная эффективность в отношении как респираторных вирусов, так и герпес-вирусов. К таким препаратам можно отнести синтетический низкомолекулярный индуктор интерфероногенеза Циклоферон ® (меглюмина акридонацетат). Циклоферон ® является производным акридонуксусной кислоты, обладает широким спектром биологической активности: оказывает противовирусное, противовоспалительное, иммуномодулирующее действие. При введении в организм Циклоферон ® активирует Т-лимфоциты и NK-клетки, нормализует баланс между CD4+ и CD8+, снижает уровень В-лимфоцитов в периферической крови, но увеличивает синтез высокоаффинных антител, а также синтез и активность ИФН-α. Препарат повышает уровень ИФН в органах и тканях, содержащих лимфоидные элементы, активирует фагоцитоз, способствует повышению чувствительности нейтрофилов к другим иммунокорректорам и экспрессии антигенов. Он является индуктором синтеза мРНК для ИФН-γ, интерлейкинов 1, 2, 6, индуцирует смешанный (Th1/Th2) тип иммунного ответа. К преимуществам Циклоферона можно отнести низкую токсичность, быстрое проникновение в кровь, низкий уровень связывания с белками сыворотки, высокую биодоступность в органах, тканях, биологических жидкостях организма, отсутствие метаболического расщепления в печени и кумулирования в организме [19–21].
ЗАКЛЮЧЕНИЕ
Определение особенностей течения и клинических проявлений респираторных инфекций сочетанной этиологии в комплексе с современными возможностями лабораторной диагностики должно способствовать оптимизации тактики ведения пациента. Включение препарата – индуктора ИФН (Циклоферон ® ) в комплексную терапию ОРИ позволит уменьшить потребность в назначении других лекарственных средств, в т.ч. антибиотиков, и снизить медикаментозную нагрузку на организм.
1 О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2019 году: Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2020. 299 с.
Читайте также:

