Сонную болезнь и малярию вызывает
Обновлено: 08.05.2024
Африканский трипаносомоз человека, также известный как сонная болезнь, относится к трансмиссивным паразитарным заболеваниям. Его возбудителям являются паразитирующие простейшие, принадлежащие к роду трипаносом. Они передаются человеку при укусе мухи цеце (род Glossina), инфицированной от людей или животных, выступающих в роли хозяев этих патогенных для человека паразитов.
Муха цеце обитает только в Африке к югу от Сахары, и передавать болезнь могут лишь некоторые ее виды. По неизвестным на сегодняшний день причинам во многих районах ареала обитания мухи цеце случаи сонной болезни не отмечаются. Наиболее подвержены укусам мухи цеце и, следовательно, данной болезни жители эндемичных сельских районов, занимающиеся сельским хозяйством, рыболовством, животноводством и охотой. Случаи болезни могут отмечаться как на территории отдельных деревень, так и в целом регионе. В пределах отдельно взятого инфицированного района интенсивность распространения болезни может сильно варьироваться от одного сельского поселения к другому.
Формы африканского трипаносомоза человека
Африканский трипаносомоз человека имеет две формы в зависимости от вида возбудителя:
Существует еще одна форма трипаносомоза, которая встречается преимущественно в Латинской Америке. Она известна как американский трипаносомоз, или болезнь Шагаса. Возбудитель болезни Шагаса относится к другому подроду Trypanosoma, передается другими переносчиками и вызывает заболевание, клинические проявления которого отличаются от африканского трипаносомоза человека.
Трипаносомоз животных
Другие виды и подвиды паразитов рода Trypanosoma являются патогенными для животных и вызывают трипаносомоз у некоторых видов диких и домашних животных. Трипаносомоз крупного рогатого скота называют нагана. Трипаносомоз домашних животных, особенно крупного рогатого скота, серьезно подрывает экономическое развитие инфицированных сельских районов.
Животные могут быть носителями патогенных для человека паразитов, особенно T.b. rhodesiense, причем домашние и дикие животные являются важным резервуаром последнего. Животные могут быть также инфицированы T.b. gambiense и, вероятно, могут также выступать в качестве его резервуара, хотя и в меньшей степени. Тем не менее реальная роль животного резервуара в эпидемиологии гамбийской формы болезни до сих пор недостаточно изучена.
Крупные эпидемии
За последнее столетие в Африке произошло несколько эпидемий:
- эпидемия 1896-1906 гг., преимущественно затронувшая Уганду и бассейн реки Конго;
- эпидемия 1920 г., затронувшая ряд африканских стран; и
- последняя по времени эпидемия, начавшаяся в 1970 г. и продолжавшаяся до конца 1990-х гг.
В 1920 г. борьба с эпидемией велась силами передвижных бригад, которые выполняли скрининг миллионов людей, проживающих в районах высокого риска. К середине 1960-х гг. распространение болезни было взято под контроль, и на всем континенте регистрировалось менее 5 000 случаев заболевания. После такого успеха эпиднадзор был ослаблен, в связи с чем болезнь вернулась, и к 1970 г. в нескольких регионах ее вспышки разрослись до эпидемии. В 1990-е гг. и в начале XXI века благодаря усилиям ВОЗ, осуществлению национальных программ по борьбе с болезнью, двустороннему сотрудничеству и деятельности неправительственных организаций (НПО) тенденция к росту заболеваемости была остановлена.
Поскольку число новых случаев заболевания африканским трипаносомозом человека за период с 2000 по 2012 г. значительно сократилось в результате международных координированных усилий, в Дорожной карте ВОЗ по борьбе с забытыми тропическими болезнями была поставлена цель по его элиминации как проблемы общественного здравоохранения к 2020 г. и ликвидации передачи инфекции (сведение числа случаев к нулю) к 2030 г.
Бремя болезни
Сонная болезнь угрожает здоровью миллионов людей в 36 странах Африки к югу от Сахары. Многие из них проживают в отдаленных районах с ограниченным доступом к необходимой медицинской помощи, что затрудняет эпиднадзор и, следовательно, диагностику и лечение больных. Кроме того, важными факторами, способствующими передаче инфекции, являются перемещение населения, вооруженные конфликты и нищета.
Текущий ареал распространения заболевания
Показатели распространенности болезни варьируются между странами, а также между районами на территории отдельно взятой страны.
Механизм передачи и симптомы
Болезнь передается главным образом при укусе инфицированной мухи цеце, однако известны и другие механизмы передачи инфекции:
- передача инфекции от матери ребенку: трипаносомы могут проходить через плаценту и инфицировать плод;
- возможна механическая передача через других кровососущих насекомых, однако эпидемиологическая значимость этого пути передачи инфекции неизвестна;
- известны случаи случайного инфицирования персонала лабораторий в результате травмы зараженной иглой;
- есть сведения о передаче паразита половым путем.
На первой стадии инфекции трипаносомы размножаются в подкожных тканях, крови и лимфе. Эта стадия известна как гемолимфатическая фаза болезни, для которой характерны приступы лихорадки, головная боль, увеличение лимфоузлов, боль в суставах и зуд.
На второй стадии паразиты проходят гематоэнцефалический барьер и инфицируют центральную нервную систему. Эта стадия известна как неврологическая, или менингоэнцефалитическая. В целом на этой стадии появляются наиболее очевидные признаки и симптомы болезни: изменение поведения, спутанность сознания, сенсорные расстройства и нарушение координации движений. Важным клиническим признаком на этой стадии является нарушение цикла сна, которое и дало название этой болезни. Без лечения сонная болезнь считается смертельной, хотя известны случаи здорового носительства инфекции.
Ведение болезни: постановка диагноза
Ведение болезни осуществляется в три этапа:
- Скрининг на предмет выявления вероятной инфекции. Он включает серологическое исследование (возможно только в отношении T.b. gambiense) и проверку на наличие клинических признаков, в частности увеличения шейных лимфатических узлов.
- Поиск паразита в биологических жидкостях.
- Определение стадии болезни. Для этого выполняется клиническое обследование пациента и в некоторых случаях исследование спинномозговой жидкости, полученной путем люмбальной пункции.
Во избежание необходимости применения сложных и тяжелых методов лечения диагностика должна выполняться как можно раньше до развития неврологической стадии заболевания.
Ввиду длительного и бессимптомного течения первой стадии сонной болезни, вызванной T. b. gambiense, рекомендуется организация тщательного и активного скрининга групп риска с целью выявления пациентов на ранней стадии заболевания и ограничения дальнейшего распространения инфекции посредством их лечения, после которого они перестают выступать в качестве резервуара. Всесторонний скрининг населения требует серьезных финансовых вложений в кадровые и материальные ресурсы. В Африке, особенно в отдаленных районах с наибольшей распространенностью заболевания, этих ресурсов часто не хватает. В результате часть инфицированных умирает еще до постановки диагноза и получения лечения.
Лечение
Тип лечения зависит от формы и стадии заболевания. Раннее выявление болезни повышает шансы на успешное излечение. Ввиду того что паразит может сохранять жизнеспособность в течение длительного времени и вызывать рецидивы через много месяцев после окончания терапии, для оценки результатов лечения пациенты должны оставаться под наблюдением в течение периода продолжительностью до 24 месяцев, в рамках которого следует проводить клиническое обследование пациентов и выполнять лабораторные исследования физиологических жидкостей, в том числе в некоторых случаях спинномозговой жидкости, полученной путем люмбальной пункции.
Для успешного лечения болезни на второй стадии необходимо применение лекарственных препаратов, способных преодолевать гематоэнцефалический барьер и нейтрализовать паразита в центральной нервной системе.
Препараты для лечения болезни на первой стадии:
- Пентамидин: впервые получен в 1940 г., используется для лечения сонной болезни, вызванной T.b. gambiense, на первой стадии. Несмотря на наличие серьезных побочных эффектов, препарат в целом хорошо переносится.
- Сурамин: впервые получен в 1920 г., используется для лечения болезни, вызванной T.b. rhodesiense, на первой стадии. Препарат имеет ряд нежелательных побочных эффектов, включая нефротоксическое действие и аллергические реакции.
Препараты для лечения болезни на второй стадии:
Препараты для лечения заболевания на обеих стадиях:
Фексинидазол – пероральный препарат для лечения гамбийской формы африканского трипаносомоза человека. В 2019 г. препарат был включен в Перечень основных лекарственных средств ВОЗ и рекомендован в руководстве ВОЗ по лечению африканского трипаносомоза человека. Препарат показан в качестве терапии первой линии на первой и нетяжелой второй стадии заболевания. Он принимается в течение 10 дней через 30 минут после приема твердой пищи под наблюдением квалифицированного медицинского персонала. В настоящее время проводятся клинические испытания этого препарата для лечения родезийской формы трипаносомоза.
Частно-государственные партнерства
В 2000 и 2001 гг. ВОЗ учредила частно-государственное партнерство с компаниями Aventis Pharma (в настоящее время Sanofi) и Bayer HealthCare, в результате чего была создана программа по эпиднадзору и борьбе с данным заболеванием под руководством ВОЗ, в рамках которой эндемичным странам предоставляется поддержка в осуществлении противоэпидемических мероприятий и бесплатно поставляются лекарственные препараты.
Партнерство неоднократно продлевалось в 2006, 2011, 2016 и 2021 г. Успехи в сокращении числа случаев сонной болезни и появление реальной перспективы ее элиминации побудили ряд других партнеров из частного сектора поддержать инициативу ВОЗ по элиминации болезни как проблемы общественного здравоохранения и обеспечению ликвидации передачи инфекции к 2030 г.
Деятельность ВОЗ
ВОЗ оказывает содействие и техническую поддержку национальным программам по борьбе с сонной болезнью.
Для содействия разработке новых и недорогостоящих средств диагностики ВОЗ в 2009 г. создала банк образцов биоматериалов, которыми могут пользоваться исследователи. В банке, размещенном в Институте Пастера в Париже, хранятся образцы крови, сыворотки, спинномозговой жидкости, слюны и мочи, взятые у пациентов, инфицированных обеими формами болезни, а также образцы, взятые у неинфицированных людей из эндемичных районов.
В 2014 г. в целях активизации и поддержки усилий по элиминации болезни по инициативе ВОЗ была создана координационная сеть по африканскому трипаносомозу человека. В число партнеров этой сети вошли национальные программы по борьбе с сонной болезнью, организации, занимающиеся созданием новых лекарственных и диагностических средств, международные и неправительственные организации, а также организации-доноры.
Малярия — острое лихорадочное заболевание, вызываемое паразитами рода Plasmodium, которые передаются людям через укусы инфицированных самок комаров вида Anopheles. Существует пять видов паразитов, вызывающих малярию у человека, и два таких вида — P. falciparum и P. vivax — представляют собой наибольшую угрозу. P. falciparum является самым опасным для жизни малярийным паразитом, который больше всего распространен на африканском континенте. P. vivax — доминирующий малярийный паразит в большинстве стран за пределами Африки к югу от Сахары.
Первые симптомы малярии — лихорадка, головная боль и озноб — обычно появляются через 10–15 дней после укуса инфицированным комаром и могут быть слабовыраженными, что затрудняет выявление малярии. При отсутствии лечения малярия, вызванная P. falciparum, может в течение 24 часов развиться в тяжелую форму и привести к летальному исходу.
В 2020 г. риску малярии подвергалась почти половина населения в мире. Вероятность заражения малярией и развития тяжелой формы болезни значительно выше среди некоторых групп населения: младенцев, детей в возрасте до пяти лет, беременных женщин и лиц с ВИЧ/СПИДом, а также лиц с низким уровнем иммунитета, прибывающих в районы с интенсивной передачей малярии, в частности трудящихся-мигрантов, мобильных групп населения и лиц, совершающих поездки.
Бремя болезни
Согласно последнему изданию Всемирного доклада о малярии - на английском языке, в 2020 г. малярией во всем мире заболел 241 млн человек по сравнению с 227 млн в 2019 г. Количество умерших от малярии в 2020 г. оценивается на уровне 627 000 человек, что на 69 000 больше по сравнению с предыдущим годом. Около двух третей дополнительных случаев смерти (47 000) являются следствием перебоев, вызванных пандемией COVID-19, однако остальная треть смертей (22 000) отражает недавние корректировки применяемой ВОЗ методологии расчета смертности от малярии (без учета перебоев, вызванных распространением COVID-19).
Новая методология учета причин смерти применялась в отношении 32 стран Африки к югу от Сахары, на долю которых приходится примерно 93% всех случаев смерти от малярии в мире. Благодаря применению этой методологии было установлено, что с 2000 г. от малярии умерло гораздо больше африканских детей, чем предполагалось ранее.
На Африканский регион ВОЗ по-прежнему приходится непропорционально высокая доля глобального бремени малярии. В 2020 г. в этом Регионе произошли 95% всех случаев заболевания малярией и 96% случаев смерти от нее. На долю детей в возрасте до пяти лет пришлось 80% всех случаев смерти от малярии в Регионе.
Более половины всех случае смерти от малярии в мире произошло в четырех африканских странах: Нигерии (31,9%), Демократической Республике Конго (13,2%), Объединенной Республике Танзания (4,1%) и Мозамбике (3,8%).
Профилактика
За последние два десятилетия повышение доступности рекомендованных ВОЗ средств и стратегий профилактики малярии, в том числе эффективных мер по борьбе с переносчиками и профилактических противомалярийных препаратов, во многом способствовало уменьшению глобального бремени этой болезни.
Борьба с переносчиками
Борьба с переносчиками - на английском языке — обязательный компонент стратегий по борьбе с малярией и ее элиминации, это поскольку позволяет эффективно предупреждать заражение и уменьшать передачу болезни. Двумя основными способами борьбы с переносчиками являются применение обработанных инсектицидом противомоскитных сеток (ОИС) и распыление инсектицидов остаточного действия внутри помещений (РИОДВП).
Методы профилактической химиотерапии
Профилактическая химиотерапия - на английском языке — метод предупреждения инфицирования малярией и его последствий исключительно с помощью лекарственных средств или в сочетании с другими мерами. Она включает в себя химиопрофилактику, интермиттирующую профилактическую терапию младенцев (ИПТм) и беременных (ИПТб), сезонную химиопрофилактику малярии (СХПМ) и массовое назначение препаратов (МНП). Эти безопасные и экономически эффективные стратегии призваны дополнять собой текущую деятельность по борьбе с малярией, в том числе меры по борьбе с переносчиками, оперативной диагностике случаев с подозрением на малярию и лечению больных с подтвержденным диагнозом противомалярийными препаратами.
Вакцина
Начиная с октября 2021 г. ВОЗ рекомендует также широко использовать среди детей, проживающих в районах с умеренным и высоким уровнем передачи малярии, вызванной P. falciparum, противомалярийную вакцину RTS,S/AS01. Вакцина доказала свою способность значительно снижать заболеваемость малярией, в частности и смертельной тяжелой формой малярии, среди детей младшего возраста.
Ведение больных
Своевременная диагностика и лечение малярии помогают уменьшить тяжесть болезни и предотвратить смерть пациента, а также способствуют снижению интенсивности передачи малярии. ВОЗ рекомендует во всех случаях с подозрением на малярию подтверждать диагноз при помощи диагностического теста - на английском языке на выявление паразита (микроскопического исследования или диагностического экспресс-теста). Диагностический тест позволяет медицинским специалистам быстро отличить малярийную лихорадку от немалярийной, помогая правильно выбрать тактику лечения.
Наиболее эффективной из существующих схем лечения - на английском языке, особенно в случае малярии P. falciparum, является артемизинин-комбинированная терапия (АКТ). Основной задачей лечения является быстрое и полное удаление паразита, что позволяет избежать прогрессирования неосложненного случая в тяжелую форму, а также летального исхода.
Устойчивость к противомалярийным препаратам
Дополнительную информацию о работе ВОЗ по решению проблемы устойчивости к противомалярийным препаратам в подрегионе Большого Меконга можно найти на веб-странице программы по элиминации малярии в подрегионе Меконга - на английском языке. ВОЗ также разрабатывает стратегию по противодействию лекарственной устойчивости в Африке.
Элиминация
Элиминация малярии определяется как достигнутое в результате целенаправленных действий прерывание местной передачи конкретного вида малярийного паразита в пределах определенного географического района. Предотвращение возобновления передачи инфекции требует непрерывных усилий.
Эпиднадзор
Эпиднадзор за малярией предполагает непрерывный и систематический сбор, анализ и интерпретацию данных о малярии и использование таких данных в ходе планирования, реализации и оценки практических медико-санитарных мер. Совершенствование надзора за случаями заболевания малярией и смерти от нее помогает министерствам здравоохранения определять наиболее затронутые болезнью районы и группы населения и позволяет странам отслеживать меняющиеся тенденции заболеваемости. Надежные системы эпиднадзора за малярией также помогают странам разрабатывать эффективные меры по защите здоровья населения и оценивать результативность своих программ по борьбе с малярией.
Деятельность ВОЗ
Обновленная в 2021 г. Глобальная техническая стратегия ВОЗ по борьбе с малярией на 2016–2030 гг - на английском языке. устанавливает технические параметры работы во всех эндемичных по малярии странах. Она призвана направлять и обеспечивать поддержкой региональные и национальные программы в ходе их работы по противодействию малярии и достижению ее элиминации.
Эта стратегия ставит масштабные, но достижимые глобальные задачи, включая:
- сокращение к 2030 г. заболеваемости малярией не менее чем на 90%;
- сокращение к 2030 г. показателей смертности от малярии не менее чем на 90%;
- элиминацию малярии не менее чем в 35 странах к 2030 г.;
- предупреждение повторного появления малярии во всех свободных от малярии странах.
В соответствии со Стратегией Глобальная программа по борьбе с малярией - на английском языке обеспечивает координацию международных усилий ВОЗ по борьбе с малярией и достижению ее элиминации посредством:
Малярия – трансмиссивная протозойная инфекция, вызываемая патогенными простейшими рода Plasmodium и характеризующаяся приступообразным, рецидивирующим течением. Специфическими симптомами малярии служат повторные приступы лихорадки, гепатоспленомегалия, анемия. В течении лихорадочных приступов у больных малярией четко прослеживаются сменяющие друг друга стадии озноба, жара и пота. Диагноз малярии подтверждается при обнаружении малярийного плазмодия в мазке или толстой капле крови, а также результатами серологической диагностики. Для этиотропной терапии малярии используются специальные противопротозойные препараты (хинин и его аналоги).
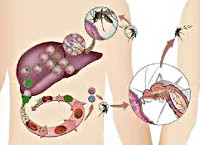
Общие сведения
Малярия (перемежающаяся лихорадка, болотная лихорадка) – группа паразитарных заболеваний человека, возбудителями которых выступают различные виды малярийного плазмодия, поражающего преимущественно эритроциты крови и ретикулоэндотелиальную систему. Малярия протекает с лихорадочными пароксизмами, гепатолиенальным и анемическим синдромом. Малярия широко распространена в странах Экваториальной Африки, Юго-Восточной Азии, Океании, Центральной и Южной Америки. Ежегодно в мире регистрируется 350-500 млн. новых инвазий и порядка 1,3-3 млн. летальных исходов от малярии. Высокая заболеваемость малярией в мире объясняется развитием резистентности плазмодиев к специфической терапии, а переносчиков протозойной инфекции – к действию инсектицидов. В связи с увеличением миграционных и туристических потоков завозные случаи малярии все чаще встречаются на территории Европы, в т. ч. в России.

Причины малярии
Малярию вызывают паразитические простейшие, принадлежащие к классу споровиков, роду Plasmodium (малярийные плазмодии). Заболевание человека вызывают 4 вида плазмодиев: P. Vivax (возбудитель трехдневной малярии), P. Malariae (возбудитель четырехдневной малярии), P.falciparum (возбудитель тропической малярии) и P. Ovale (возбудитель овале-малярии, сходной с трехдневной).
Малярийные плазмодии проходят сложный жизненный цикл, включающий бесполое развитие (шизогонию) в организме промежуточного хозяина - человека и половое развитие (спорогонию) в организме главного хозяина - самок комаров Anopheles. Инфицирование комаров происходит при укусах человека, больного малярией или паразитоносителя. При кровососании в желудок комара попадают мужские и женские половые клетки плазмодиев (микро-и макрогаметоциты); здесь происходит их оплодотворение с образованием зиготы, а затем ооцисты. В результате многократного деления ооциста превращается в инвазионные формы плазмодиев - спорозоиты, которые проникают в слюнные железы комара и могут там находиться в течение 2-х месяцев.
Инфицирование человека происходит при укусе инвазированной самкой комара, со слюной которой в кровь промежуточного хозяина проникают спорозоиты. В организме человека возбудитель малярии проходит тканевую и эритроцитарную фазы своего бесполого развития. Тканевая фаза (экзоэритроцитарная шизогония) протекает в гепатоцитах и тканевых макрофагах, где спорозоиты последовательно трансформируются в тканевые трофозоиты, шизонты и мерозоиты. По окончании этой фазы мерозоиты проникают в эритроциты крови, где протекает эритроцитарная фаза шизогонии. В клетках крови мерозоиты превращается в трофозоиты, а затем в шизонты, из которых в результате деления вновь образуются мерозоиты. В конце такого цикла эритроциты разрушаются, а высвободившиеся мерозоиты внедряются в новые эритроциты, где цикл превращений повторяется вновь. В результате 3-4-х эритроцитарных циклов, образуются гаметоциты – незрелые мужские и женские половые клетки, дальнейшее (половое) развитие которых протекает в организме самки комара Anopheles.
Учитывая особенности развития плазмодия, становится очевидным, что основным путем передачи малярии от человека человеку является трансмиссивный, реализуемый посредством укусов самками комара рода Anopheles. Вместе с тем, возможна трансплацентарная передача инфекции во время беременности, а также парентеральное заражение при переливании донорской крови, взятой от паразитоносителей. В эндемических очагах к малярии в большей степени восприимчивы дети и приезжие. Пик заболеваемости малярией совпадает с сезоном активности комаров и приходится на летне-осеннее время.
Пароксизмальный характер лихорадочных приступов при малярии связан с эритроцитарной фазой развития малярийного плазмодия. Развитие лихорадки совпадает с распадом эритроцитов, высвобождением в кровь мерозоитов и продуктов их обмена. Чужеродные для организма субстанции оказывают общетоксическое воздействие, вызывая пирогенную реакцию, а также гиперплазию лимфоидных и ретикулоэндотелиальных элементов печени и селезенки, приводя к увеличению этих органов. Гемолитическая анемия при малярии является следствием распада эритроцитов.
Симптомы малярии
В течении малярии выделяют инкубационный период, период первичных острых проявлений, вторичный латентный период и период рецидивов. Инкубационный период при трехдневной малярии и овале-малярии длится 1-3 недели, при четырехдневной - 2-5 недель, при тропической - около 2-х недель. Типичными клиническими синдромами для всех форм малярии служат лихорадочный, гепатолиенальный и анемический.
Через 1-2 часа фаза озноба сменяется жаром, что совпадает с повышением температуры тела до 40-41 °С. Возникают гиперемия, гипертермия, сухость кожи, инъекция склер, жажда, увеличение печени и селезенки. Может отмечаться возбуждение, бред, судороги, потеря сознания. На высоком уровне температура может удерживаться до 5-8 и более часов, после чего происходит профузное потоотделение, резкое снижение температуры тела до нормального уровня, что знаменует собой окончание приступа лихорадки при малярии. При трехдневной малярии приступы повторяются каждый 3-й день, при четырехдневной – каждый 4-й день и т. д. К 2-3-й неделе развивается гемолитическая анемия, появляется субиктеричность кожи и склер при нормальной окраске мочи и кала.
Своевременное лечение позволяет остановить развитие малярии после 1-2 приступов. Без специфической терапии продолжительность трехдневной малярии составляет около 2 лет, тропической - около 1 года, овале-малярии - 3-4 года. В этом случае после 10-14 пароксизмов инфекция переходит в латентную стадию, которая может длиться от нескольких недель до 1 года и дольше. Обычно через 2-3 месяца видимого благополучия развиваются ранние рецидивы малярии, которые протекают так же, как острые проявления болезни. Поздние рецидивы возникают через 5-9 месяцев - в этот период приступы имеют более легкое течение.
Осложнения малярии
Тяжелыми, порой жизнеугрожающими осложнениями малярии могут служить малярийная кома, малярийный алгид, разрыв селезенки, отек мозга, ОПН, ДВС-синдром, психические нарушения. Малярийной комой чаще всего осложняется течение тропической малярии. Развитие комы связано с нарушениями микроциркуляции головного мозга в результате образования паразитарных тромбов, состоящих из эритроцитов, зараженных шизонтами. В течении малярийной комы выделяют периоды сомноленции (сонливость, адинамия), сопора (резкая заторможенность, снижение рефлексов) и глубокой комы (отсутствие сознания и рефлексов). Летальный исход при возникновении данного осложнения наступает в 96-98% случаев.
Малярийный алгид сопровождается развитием коллаптоидного состояния с артериальной гипотонией, нитевидным пульсом, гипотермией, снижением сухожильных рефлексов, бледностью кожных покровов, холодным потом. Нередко возникают поносы и явления дегидратации. Признаки разрыва селезенки при малярии возникают спонтанно и включают в себя кинжальную боль в животе с иррадиацией в левое плечо и лопатку, резкую бледность, холодный пот, снижение АД, тахикардию, нитевидный пульс. По данным УЗИ выявляется свободная жидкость в брюшной полости. При отсутствии экстренного оперативного вмешательства быстро наступает смерть от острой кровопотери и гиповолемического шока.
Отек мозга развивается при злокачественной, молниеносной форме трехдневной малярии, чаще у детей-дошкольников и подростков. Возникает на высоте лихорадочного пароксизма и характеризуется сильной головной болью, судорогами с потерей сознания, выделением пены изо рта и скорой гибелью пациента. Развитие острой почечной недостаточности при малярии связано с массивным внутрисосудистым гемолизом эритроцитов, нарушением почечного кровообращения, интенсивной гемоглобинурией. Обычно является исходом гемоглобинурийной лихорадки. Специфическим осложнением тропической малярии выступают психические расстройства, включающие в себя психомоторное возбуждение, бред, галлюцинации и т. д.
Диагностика малярии
Фундамент клинической диагностики малярии составляет триада признаков: приступообразная интермиттирующая лихорадка, повторяющаяся каждые 48 или 72 часов, гепатоспленомегалия, гемолитическая анемия. Одновременно выясняется факт посещения больным эндемичных регионов, перенесенных гемотрансфузий и парентеральных вмешательств в течение последних 2-3-х месяцев.
Специфическим лабораторным методом диагностики малярии служит микроскопия толстой капли крови, позволяющая обнаружить наличие и количество паразитов. Качественную идентификацию вида плазмодия и стадию шизогонии проводят путем исследования на малярийный плазмодий мазка крови. Забор крови лучше производить на высоте лихорадочного приступа. Вспомогательную роль в выявлении малярии играют серологические методы – РИФ, РФА, РНГА. В плане дифференциальной диагностике наибольшее значение имеет исключение у лихорадящего больного бруцеллеза, возвратного тифа, лейшманиоза, сепсиса, туберкулеза, менингоэнцефалита, гемолитической желтухи, цирроза печени, лейкоза и др.
Лечение малярии
Больные с подозрением на малярию госпитализируются в инфекционный стационар с назначением строгого постельного режима, обильного питья, инфузионной терапии, общеукрепляющего и симптоматического лечения. При необходимости больным проводится гемосорбция и гемодиализ.
Первоначально для специфической химиотерапии малярии использовался хинин, выделенный из коры хинного дерева. В настоящее время создано большое количество синтетических препаратов, однако из-за быстрого развития резистентности паразитов к синтетическим лекарствам, хинин до сих пор не утратил своей актуальности. В зависимости от оказываемого действия противомалярийные препараты делятся на тканевые шизонтоциды, воздействующие на тканевые формы малярийного плазмодия (хиноцид, примахин) и гематоциды, воздействующие на эритоцитарные формы возбудителя (хлорохин, пириметамин, мепакрин, хинин и др.). Они назначаются в различных сочетаниях и по определенной схеме в зависимости от формы и тяжести течения малярии. Так, при трехдневной малярии обычно проводится 3-дневный курс лечения хлорохином, затем 10-дневный прием примахина или хиноцида для уничтожения тканевых форм паразита. Возможны и другие схемы противомалярийной терапии.
Прогноз и профилактика малярии
Своевременная и правильная терапия малярии приводит к быстрому купированию клинических проявлений. Летальные исходы при проведении лечения возникают примерно в 1% случаев, как правило, при осложненных формах тропической малярии.
Профилактика малярии проводится в двух направлениях: уничтожение комаров-переносчиков возбудителей и индивидуальная защита. Первое направление включает обработку территорий инсектицидами. Второе - использование средств индивидуальной защиты (кремов, лосьонов, противомоскитных сеток), проведение специфической химиопрофилактики лицам, совершающим поездки в районы, неблагополучные по малярии. С целью раннего выявления больных и паразитоносителей всем пациентам с лихорадкой неясного генеза должна проводиться микроскопия крови на малярию.
Сонная болезнь – протозооз, возбудителем которого выступают простейшие рода Trypanosoma, а переносчиками - кровососущие мухи цеце. Симптоматика сонной болезни характеризуется образованием на месте укуса первичного аффекта (трипаносомного шанкра), волнообразной лихорадкой, лимфаденитом, кожными высыпаниями, местными отеками, нарастающей сонливостью, параличами, психическими расстройствами, комой. Диагностика сонной болезни основана на обнаружении трипаносом в биологическом материале (пунктате шанкра, лимфоузлов, крови, спинномозговой жидкости). Терапия сонной болезни проводится препаратами пентамидин, сурамин, меларсопрол, эфлорнитин.
Общие сведения
Сонная болезнь (африканский трипаносомоз) – заболевание из группы трансмиссивных трипаносомозов, протекающее с лихорадкой, поражением лимфатической и центральной нервной системы. Выделяют 2 формы сонной болезни: гамбийский (западноафриканский) и родезийский (восточноафриканский) трипаносомозы, вызываемые различными видами возбудителей. Сонная болезнь является эндемичной для 36 стран тропической Африки, где водятся переносчики болезни - мухи цеце. Самые крупные эпидемии сонной болезни были зафиксированы в 1896-1906, 1920 и 1970 годах. Ежегодно на Африканском континенте регистрируется 7-10 тыс. новых случаев заболевания сонной болезнью. В наибольшей степени заболевание распространено среди сельских жителей занимающихся земледелием, животноводством, рыболовством или охотой. Кроме африканского трипаносомоза, опасность для человека представляет американский трипаносомоз (болезнь Шагаса).

Причины сонной болезни
Известны два морфологически идентичных вида возбудителя сонной болезни человека: Trypanosoma brucei gambiense, вызывающий гамбийскую форму и Trypanosoma brucei rhodesiense, вызывающий родезийскую форму африканского трипаносомоза. Паразиты имеют продолговато-веретенообразную, плоскую форму, длину 12-35 мкм и ширину 1,5-3,5 мкм. Оба вида трипаносом передаются через слюну во время укуса мухи цеце (Glossina palpalis), которая служит переносчиком заболевания и после заражения способна передавать трипаносомы в течение всей жизни. Для заражения человека сонной болезнью достаточно одного укуса инвазированной мухи, которая выделяет со слюной около 400 тыс. паразитов, в то время как минимальная инвазирующая доза составляет 300-400 трипаносом.
При кровососании инвазированных позвоночных животных или человека в организм насекомого попадают кровяные трипомастиготы, которые размножаются путем бинарного деления в просвете кишечника мухи цеце. К 3-4 дню трипомастиготные формы проникают в слюнные железы, где трансформируются в эпимастиготы. В слюнных железах эпимастиготные формы претерпевают многократное деление и сложные морфологические изменения, в результате чего превращаются в метациклические трипомастиготы, представляющие собой инвазионную стадию трипаносом. При повторном укусе вместе со слюной муха цеце вводит под кожу человека метациклические трипомастиготы, которые через несколько дней проникают в кровь и лимфу, разносятся по организму, превращаясь в кровяные трипомастиготы.
После укуса инфицированной мухи в месте входных ворот развивается местно-воспалительная реакция в виде болезненного зудящего шанкра и регионарный лимфаденит. Через 1-3 недели, после проникновения трипаносом в кровяную и лимфатическую систему развивается гемолимфатическая стадия сонной болезни. Поздняя (менингоэнцефалитическая) стадия африканского трипаносомоза обусловлена проникновением паразита в ЦНС. В ответ на инвазию иммунная система реагирует выработкой специфических антител класса IgM, позволяющих некоторое время сдерживать паразитемию. Однако высокая антигенная изменчивость трипаносом нарушает формирование специфического иммунитета, обусловливая непрерывное прогрессирование и возвратно-рецидивирующий характер сонной болезни.
Симптомы сонной болезни
Ранняя (гематолимфатическая) стадия сонной болезни длится около 1 года (иногда от нескольких месяцев до 5 лет). Примерно через неделю после укуса мухи цеце на коже образуется первичный аффект – трипанома, или трипаносомный шанкр, представляющий собой болезненный эритематозный узелок диаметром 1-2 см, напоминающий фурункул. Этот элемент чаще всего локализуется на голове или конечностях, нередко изъязвляется, однако через 2-3 недели обычно спонтанно заживает, оставляя после себя пигментированный рубец. Одновременно с образованием трипаносомного шанкра на туловище и конечностях появляются пятна розового или фиолетового цвета диаметром 5-7 см (трипаниды), а также отеки лица, кистей, стоп.
Дальнейшее развитие сонной болезни связано с выходом паразитов в кровь, что сопровождается возникновением лихорадки неправильного типа. Лихорадочные периоды с температурными пиками до 38,5-40°С чередуются с апирексическими периодами. Характерным признаком сонной болезни служит увеличение регионарных лимфоузлов, особенно заднешейных (симптом Уинтерботтома), которые становятся плотными и могут достигать размеров голубиного яйца. Течение гемолимфатической стадии сонной болезни характеризуется нарастающей слабостью и апатией, тахикардией, артралгиями, потерей массы тела, увеличением печени и селезенки. У 30% пациентов появляются уртикарные высыпания на коже, развивается отек век. Возможно поражение органа зрения в виде кератита, иридоциклита, кровоизлияния в радужку, помутнения или рубцевания роговицы.
Длительность гемолимфатической стадии сонной болезни может составлять несколько месяцев или лет, после чего заболевание переходит в позднюю (менингоэнцефалитическую, или терминальную) стадию. В этот период на первый план в клиническом течении выходят симптомы менингоэнцефалита и лептоменингита, обусловленные проникновением трипаносомы через гематоэнцефалический барьер и поражением головного мозга. Наиболее типичным проявлением африканского трипаносомоза служит нарастающая дневная сонливость, приводящая к тому, что пациент может уснуть, например, во время еды.
Прогрессирование сонной болезни сопровождается развитием атаксической походки, невнятной речи (дизартрии), саливации, тремора языка и конечностей. Больной становится безразличен к происходящему, заторможен, жалуется на головную боль. Отмечается нарушение психического статуса в виде депрессивных или маниакальных состояний. В позднем периоде сонной болезни присоединяются судороги, параличи, эпилептический статус, развивается кома.
Родезийская форма сонной болезни имеет более тяжелое и скоротечное развитие. Лихорадка и интоксикация выражены сильнее, быстрее наступает истощение, часто возникает поражение сердца (аритмия, миокардит). Гибель больного может наступить уже в течение первого года заболевания еще до перехода трипаносомоза в менингоэнцефалитическую стадию. Причиной смерти больных чаще всего служат интеркуррентные инфекции: малярия, дизентерия, пневмония и др.
Диагностика и лечение сонной болезни
Предварительная диагностика сонной болезни осуществляется на основании клинико-эпидемиологических данных, важнейшими из которых служат пребывание в эндемичных районах Африки, наличие длительной, рецидивирующей лихорадки, первичного аффекта, шейного лимфаденита, отеков, сонливости и др. Неопровержимым доказательством заражения африканским трипаносомозом служит обнаружение трипаносом при лабораторных исследованиях нативного и окрашенного по Романовскому-Гимзе биологического материала. С целью обнаружения паразита анализу может подвергаться пунктат трипаносомного шанкра, измененных лимфоузлов, кровь, цереброспинальная жидкость.
В ряде случаев для распознавания сонной болезни проводится биологическая проба с внутрибрюшинным введением крови или спинномозговой жидкости больного морским свинкам. Из иммунологических реакций применяются РИФ, ИФА. Гамбийскую форму сонной болезни следует дифференцировать с малярией, токсоплазмозом, лимфогранулематозом, туберкулезом, менингитом, энцефалитом и др.; родезийскую форму, кроме этого, – с брюшным тифом, септицемией.
Специфическая терапия сонной болезни наиболее эффективна в раннюю стадию, до развития церебральной симптоматики. При гамбийской форме сонной болезни на гемолимфатической стадии назначается сурамин, пентамидин или эфлорнитин; на менингоэнцефалитической стадии эффективен только эфлорнитин. В раннем периоде родезийской формы сонной болезни применяется сурамин; в позднем – меларсопрол. Дополнительно проводится дезинтоксикационная, гипосенсибилизирующая, симптоматическая терапия.
Прогноз и профилактика сонной болезни
Без лечения летальность от сонной болезни близка к 100%. В случае начала специфической терапии в раннюю стадию африканского трипаносомоза возможно полное выздоровление; при поздно начатом лечении прогноз значительно хуже. Кроме сроков начала лечения, на исход влияет форма сонной болезни: при родезийском варианте трипаносомоза прогноз всегда серьезнее.
В профилактике сонной болезни главную роль играет истребление мух цеце с помощью инсектицидных препаратов, вырубки кустарниковых зарослей близ населенных пунктов, использование средств индивидуальной защиты от укусов кровососущих насекомых в эндемичных районах Африки. В периоды эпидемических вспышек сонной болезни среди местных жителей и приезжих проводится массовая химиопрофилактика пентамидином. Иммунопрофилактика африканского трипаносомоза не разработана.
Сонный паралич — это нарушение процесса пробуждения или засыпания, характеризующееся тотальной мышечной атонией на фоне бодрствующего сознания. У большинства пациентов развивается в момент пробуждения, сопровождается временной невозможностью произвольных движений, чувством страха, угрожающими галлюцинациями. Диагностируется клинически. Дополнительно требуется консультация невролога, психиатра, проведение комплексного полисомнографического исследования. Лечение заключается в нормализации образа жизни, соблюдении режима сна, исключении перегрузок, применении различных методов, позволяющих расслабиться, успокоиться перед сном.
МКБ-10

Общие сведения
На протяжении веков люди связывали сонный паралич с происками демонов, колдунов, нечистой силы. С появлением сомнографических методов исследования удалось найти научное объяснение данному явлению. В рамках современной неврологии сонный паралич относится к группе парасомний, включающей ночные кошмары, сомнамбулизм, сонное опьянение, бруксизм, ночной энурез, связанные со сном нарушения пищевого поведения. Статистические данные свидетельствуют, что 6-7% населения в течение жизни переживали состояние сонного паралича. Среди пациентов с нарколепсией паралитическая парасомния встречается в 45-50% случаев. Возраст страдающих этим феноменом варьирует в пределах 12-30 лет.

Причины
В основе патологического состояния лежит расстройство последовательности наступления засыпания или пробуждения сознания и характеризующей фазу быстрого сна атонии скелетной мускулатуры. Причины развития точно не установлены. Предрасполагающими факторами считаются:
- Нарушения сна. Наличие инсомнии, нарколепсии повышает вероятность возникновения других патологических изменений в протекании и последовательности фаз сна. Подобным эффектом обладают хроническое недосыпание, постоянные изменения режима, частая смена часовых поясов.
- Психоэмоциональная перегрузка. Острые и хронические стрессы способны вызывать нарушения регуляции циклов сон-бодрствование. Пациенты, имеющие паралитическую парасомнию, отмечают учащение эпизодов паралича на фоне психического перенапряжения.
- Токсические воздействия на ЦНС. При наркомании, токсикомании, алкоголизме, никотиновой зависимости, долгосрочном приёме отдельных фармпрепаратов (транквилизаторов, антидепрессантов) поступающие в организм вещества оказывают вредоносное действие на головной мозг. Следствием может становиться сбой в функционировании систем, регулирующих сон и бодрствование.
- Сон на спине. Паралитическая парасомния возникает преимущественно у больных, спящих в положении лёжа на спине. Сон на боку протекает без эпизодов паралича. Причина подобной закономерности неясна.
- Наследственная детерминированность. Генетическая основа заболевания пока не изучена, однако известны случаи его возникновения в пределах одной семьи.
Патогенез
Физиологический сон начинается с медленной фазы (ФМС), которая сменяется быстрой (ФБС). Последняя отличается выраженным снижением тонуса скелетных мышц, исключая дыхательные. Ритм дыхания учащается, вдох становится короче. Мозговая активность повышается до уровня бодрствования. При паралитической парасомнии последовательность процессов нарушается, сознание человека просыпается раньше, чем восстанавливается мышечный тонус, возникает ощущение обездвиженности — сонный паралич. Появление паралича также возможно в момент засыпания, когда фаза быстрого сна наступает, а сознание ещё находится в бодрствующем состоянии.
Поскольку в ФБС происходит рефлекторная установка дыхания на частые короткие вдохи, попытки проснувшегося сделать глубокий вдох оканчиваются неудачей, что вызывает чувство сдавления в груди. Невозможность пошевелиться воспринимается головным мозгом как угрожающая жизни ситуация, происходит выброс большого количества нейромедиаторов, провоцирующих возникновение чувства страха, панику, галлюцинации. Вестибулярный аппарат активен, но из-за отсутствия движений не получает информации с периферии, что обуславливает необычные ощущения полёта в воздухе.
Классификация
Парасомния возникает в момент перехода из сонного состояния к бодрствованию и наоборот. В основу классификации положена принадлежность приступов к периоду засыпания либо пробуждения. В соответствии с данным критерием сонный паралич подразделяют на:
- Гипнопомпический — наблюдается в период просыпания. Встречается редко. Возникает вследствие наступления ФБС до полного погружения сознания в сонное состояние. Пациенты испытывают предшествующее засыпанию ощущение обездвиженности.
- Гипнагогический — появляется при переходе ко сну. Наблюдается в подавляющем большинстве случаев. Вызван сохранением всех физиологических особенностей ФБС при уже наступившем пробуждении сознания. Сопровождается яркой клинической картиной, тяжёлыми эмоциональными переживаниями.
Симптомы сонного паралича
Патологическое состояние подобно грубому парезу при инсульте. Пациент, неспособен совершать произвольные двигательные акты. Чувство обездвиженности мучительно, сопровождается паническим страхом, зрительными и слуховыми галлюцинациями. Больной видит тёмные фигуры, кошмары, слышит угрозы, шум, шаги, специфический писк, ощущает присутствие враждебных существ. Происходит нарушение ориентировки в пространстве, возникает иллюзия полёта, кружения, парения в воздухе, нахождения в движущемся лифте.
Возможно чувство ложных движений – иллюзия переворота на бок при осознании отсутствия двигательной способности. Типичны жалобы на ощущение сдавления грудной клетки, удушье, невозможность сделать вдох. Сонный паралич имеет приступообразное течение. Паралитический эпизод продолжается от нескольких секунд до 2-3 минут, в послеприступном периоде неврологическая симптоматика отсутствует. Частота приступов колеблется от одного эпизода до двух или трех пароксизмов за ночь. Приступы не представляют опасности для жизни, не сопровождаются реальной асфиксией и другими осложнениями.
Диагностика
Характерная симптоматика позволяет установить сонный паралич на основании клинической картины. Обследование проводится при повторном возникновении паралитических эпизодов, направлено на исключение неврологической и психиатрической патологии. Список диагностических процедур включает:
- Осмотр невролога. Неврологический статус без особенностей. Могут выявляться признаки эмоциональной лабильности, астении на фоне переутомления, имеющихся фоновых расстройств сна.
- Полисомнография. При наличии видеонаблюдения возможна фиксация паралитического эпизода: пациент неподвижен, глаза открыты, лицо выражает страх, кардиореспираторный мониторинг регистрирует типичные для ФБС изменения (тахикардию, тахипноэ с уменьшением объёма вдоха). Электроэнцефалография позволяет дифференцировать сонный паралич от ночных эпилептических пароксизмов.
- MSLT-тест. Исследование множественной латентности проводится при подозрении на нарколепсию. Диагноз подтверждает сокращение времени латентности, наличие более 2-х эпизодов засыпания.
- Консультация психиатра. Осуществляется методом беседы, наблюдения, психологического тестирования. Необходима для исключения сопутствующих психических расстройств.
Дифференциальная диагностика проводится с иными сомнологическими расстройствами, психическими заболеваниями, эпилепсией. Нарколепсия сопровождается пароксизмами гипнолепсии — непреодолимой дневной гиперсомнии. Сомнамбулизм является обратным сонному параличу состоянием, возникает на фоне отсутствия мышечной гипотонии в ФБС. В ходе сомнологического исследования синдром сонных апноэ исключается по данным дыхательного мониторинга, эпилепсия — по результатам ЭЭГ.
Лечение сонного паралича
В большинстве случаев терапия включает беседу с пациентом о причинах паралитических эпизодов, мероприятия по нормализации режима дня, психологической релаксации перед сном. Медикаментозное лечение назначается при наличии невротических расстройств и психических заболеваний. Предотвратить возникновение новых эпизодов паралича способно соблюдение следующих рекомендаций:
Важным моментом является осознание пациентом механизма возникновения парасомнических пароксизмов. Возможна помощь психолога. Психологические консультации включают освоение методик уменьшения эмоциональных переживаний, ускоренного выхода из приступа. Рекомендовано обучение методам релаксации, которые пациент впоследствии применяет самостоятельно.
Прогноз и профилактика
Сонный паралич характеризуется доброкачественным течением, самопроизвольным исчезновением симптоматики на фоне коррекции образа жизни. Рецидив заболевания, учащение приступов провоцируют стрессовые ситуации, несоблюдение режима, перегрузки. Профилактика направлена на исключение триггерных факторов: стрессов, чрезмерных нагрузок, депривации сна, постоянных изменений режима. Основными моментами первичной и вторичной профилактики являются здоровый образ жизни, спокойное доброжелательное принятие любых жизненных ситуаций, разумная профессиональная и учебная нагрузка, своевременное лечение имеющихся сомнологических расстройств.
1. Сонный паралич или синдром старой ведьмы/ Дурсунова А.И.// Международный журнал экспериментального образования. – 2014 - №6.
2. Феномен осознанных сновидений/ Котляров Е.Е., Ветвицкая С.М.// Международный студенческий научный вестник. – 2017 – №6.
3. Интроспективный анализ проявлений сонного паралича/ Жилов Д.А., Наливайко Т.В.// Актуальные вопросы современной психологии и педагогики. Сборник докладов XVI Международной научной конференции. - 2014.
4. Интроспективный анализ проявлений сонного паралича/ Жилов Д.А., Наливайко Т.В.// Актуальные вопросы современной психологии и педагогики. Сборник докладов XVI Международной научной конференции. - 2014.
Читайте также:

