Современное лечение гнойно септических заболеваний
Обновлено: 03.05.2024
Лечение при гнойной инфекции. Консервативное лечение гнойной инфекции
Лечение при гнойной инфекции должно быть комплексным и соответствовать стадии развития гнойного воспаления с учетом нормергического, гиперергического или гипоергического его проявления, а также биологических особенностей возбудителя. Независимо от стадии развития гнойно-инфекционного процесса комплекс лечебных мер должен включать:
- местные и общие антипатогенетические воздействия на больного животного, основанные на принципе охранительной терапии;
- противомикробные и антитоксические воздействия, направленные на подавление микробного фактора и удаление токсических продуктов из патологического очага и из организма;
- оперативное или консервативное удаление мертвых тканей, которое, так же как и дезинтоксикация организма, влияет на течение инфекционного процесса;
- меры симптоматического воздействия, направленные на улучшение функционального состояния того или иного жизненно важного органа;
- витаминотерапию и полноценное кормление при сбалансированном ощелачивающем рационе;
- дозированный моцион и более широкое применение физиотерапевтических процедур на стадии выздоровления.
В начальных стадиях развития гнойной инфекции (стадии воспалительного отека и клеточковой инфильтрации) целесообразна короткая блокада 0,25%-ным раствором новокаина в сочетании с гидрокортизоном и одним или двумя антибиотиками, например, с натриевой (калиевой) солью бензилпенициллина и стрептомицинсульфатом либо с мономицином или с канамицином, но эффективнее с гентамицином. Раствор вводят вокруг развивающегося инфекционного очага и по возможности под него. На инфицированный очаг накладывают спиртовысыхающие повязки или спиртовые согревающие компрессы, используя 70%-ный этиловый, ихтиоловый, камфорный спирт, и организуют другие тепловые процедуры.
На стадии воспалительного отека такое лечение предупреждает перераздражение нервных центров, нормализует воспалительную реакцию, трофику, повышает активность физиологической системы соединительной ткани, способствует фиксации, локализации и подавлению возбудителей. В результате этого начавшийся инфекционный процесс нередко обрывается и наступает выздоровление.
На стадии клеточной инфильтрации, как и на стадии абсцеди-рования, целесообразно дополнительно внутримышечно применять антибиотики широкого спектра действия. Особого внимания заслуживают внутривенные введения 0,25%-ного новокаина с соответствующим'антибиотиком или сульфаниламидом. Более эффективны внутриартериальные введения их в магистральную артерию, доставляющую с кровью введенный раствор непосредственно в инфекционный очаг (глубокая антисептика).
Некоторые авторы рекомендуют применять при этих стадиях и даже на стадии абсцедирования местную гипотермию. Но это допустимо лишь на стадии воспалительного отека и притом кратковременно в виде наложения резинового пузыря со снегом или толченым льдом на 10—15 мин, 2—3раза; с такими же перерывами либо на такой же срок накладывают охлаждающие повязки. Допустимо орошать зону инфицированного очага хлорэтилом через легкую бинтовую повязку или марлевую салфетку в течение 20—30 с при передвижении струи со скоростью 1—2 см в 1 с. Процедуру повторяют 2—3 раза с интервалом 1—1,5 ч. Местная гипотермия уменьшает боль, предупреждает чрезмерную проницаемость сосудов, снижает отек и внутритканевое давление. Однако при длительном применении она понижает фагоцитарную реакцию, способствует некротизации и активизации возбудителя. Поэтому мы рекомендуем применять ее осторожно и только на стадии отека при фурункулезе и быстропрогрессирующих воспалительных отеках (гиперергическое развитие острогнойного воспаления).
Описанный комплекс лечения на стадии клеточной инфильтрации нормализует в инфекционном очаге трофику, активирует физиологическую систему соединительной ткани, фагоцитоз и ферментолиз, обеспечивает формирование клеточного барьера, предупреждает генерализацию, снижает и даже подавляет активность возбудителя. Инфекционный процесс купируется и приобретает благоприятное течение.
На стадии абсцедирования целесообразны также короткая новокаиновая блокада, спиртовысыхающие повязки, внутривенные и внутриартериальные введения антибиотиков и сульфаниламидов на 0,25%-ном растворе новокаина, облучение лампами соллюкс, Минина, но недопустимо применять согревающие компрессы, особенно припарки, горячие ванны, парафиновые и озокеритовые аппликации. Использование их допустимо лишь на стадии клеточковой инфильтрации преимущественно при анергической воспалительной реакции. Такие тепловые процедуры, особенно при гиперергическом воспалении, усиливают отек и внутритканевое давление, в результате чего ухудшается кровообращение и лимфоотток, расширяется зона некроза, создаются условия для проникновения гноя и возбудителя в здоровые ткани или анатомические полости.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечение гнойных и септических осложнений ранений: устранение очага инфекции, антибиотикотерапия
Лечение любого гнойно-септического осложнения является комплексным и включает в себя следующие мероприятия:
1) Устранение первичного очага инфекции хирургическим путем. Хирургическое вмешательство прекращает дальнейшее поступление микроорганизмов. Это может быть ушивание дефекта стенки полого органа, его резекция или удаление. После этого следует санация очага гнойной инфекции, которая заключается в механическом удалении гнойного экссудата, пропитанных гноем некротических тканей из серозных полостей, средостения и забрюшинного пространства. Заключительным этапом хирургического метода лечения является полноценное дренирование гнойного очага.
Наиболее эффективным мы считаем метод активного дренирования с аспирацией и промыванием, принципы и детали которого изложены ниже, в разделах, посвященных специфическим осложнениям ранений.
2) Устранение расстройств внешнего дыхания достигается:
— обогащением кислородом вдыхаемой смеси;
— ИВЛ с положительным давлением в конце выдоха;
— постоянной санацией трахеобронхиального дерева.
Для предупреждения пневмонии применяют аэрозольные ингаляции с антибиотиками, парокислородные ингаляции, муколитики, вибромассаж груди (при отсутствии противопоказаний).
3) Коррекция расстройств системного кровообращения достигается:
— устранением дефицита объема внеклеточной жидкости (кристаллоиды, коллоиды, альбумин, кровь, по показаниям — вазопрессоры);
— снижением вязкости циркулирующей крови.
При проведении инфузионно-трансфузиониой терапии нельзя допускать возникновения легочной артериальной гипертензии.
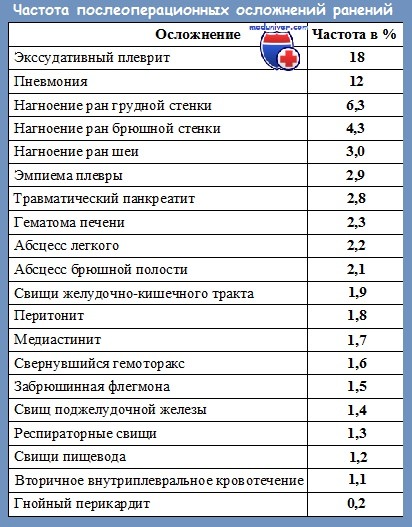
4) Антибактериальная терапия. На протяжении нескольких десятилетий при лечении гнойных осложнений применялась эскалационная (восходящая) методика антибактериальной терапии, когда при неэффективности препаратов первого ряда назначались более мощные антибиотики.
Так, в прошлом достаточно эффективным было применение амоксициллина или ампициллина с сульбактамом, цефалоспоринов второго поколения (цефуроксима, цефокситина), третьего (цефтриаксона, цефоперазона) или четвертого (цефенима) поколений, фторхинолонов (ципрофлоксацина, левофлоксацина).
Эти препараты обычно применяли в комбинации с аминогликозидами, ванкомицином и антиаэробными средствами (метронидазол, линкомицин, клиндамицин).
Такой подход был клинически и экономически оправдан в условиях низкого уровня резистентности микроорганизмов. Однако во второй половине 80-х и в 90-х годах XX в. отмечен повсеместный рост резистентности, обусловленный как неблагоприятными изменениями внешней среды обитания (экология, социальные условия, алкоголизм, наркомания), так и бесконтрольным употреблением антибиотиков.
В настоящее время устойчивость микроорганизмов объявлена угрозой для человечества в целом. В таких условиях для лечения гнойно-септических осложнений приходится применять деэскалационную методику, которая заключается в максимально раннем назначении массивных доз антибиотика, спектр действия которого максимально охватывает всех возможных возбудителей с последующим (при получении результатов микробиологического исследования) переходом па препараты более узкого спектра.
В этом плане наиболее эффективными в настоящее время являются антибиотики из группы карбоненемов. Несмотря на более чем 20-летнее использование, уровень устойчивости к ним клинически значимых возбудителей остается низким, возможно из-за их устойчивости к бета-лактамазам, выделяемым микроорганизмами для разрушения антибиотиков.
5) Интенсивное парентеральное и энтералъное питание. В первую очередь необходимо обеспечить введение аминокислот, вследствие их усиленного потребления для сохранения барьерной функции кишечника и клеток иммунной системы. Наиболее эффективными в этом смысле являются смеси для энтерального введения, содержащие омега-3 жирные кислоты, глютамин, аргинин, а также пектин.
6) Активные методы детоксикации. Среди методов экстракорпоральной детоксикации у пострадавших с множественными и сочетанными ранениями шеи, груди и живота, осложненными сепсисом, самым распространеным и хорошо изученным является плаз-маферез.
Положительный эффект плазмафереза основан на удалении высокомолекулярных белков острой фазы воспаления, а также нормализации реологических свойств крови. Метод позволяет быстро удалять из циркулирующей крови токсины (как водорастворимые, так и связанные с белками), свободный миоглобин, активированные компоненты свертывающей системы крови, С-реактивный белок, цитокины, комплемент, лизосомальные ферменты, аутоантитела, иммунные комплексы и просто обломки разрушенных клеток и клеток в состоянии апоптоза.
Метод существует в двух модификациях: прерывистый и непрерывный. Не останавливаясь на деталях этих модификаций, необходимо подчеркнуть, что у пострадавших в критическом состоянии используют непрерывную технологию, которая меньше оказывает отрицательное влияние на гемодинамику.
7) Торможение образования медиаторов воспалительной реакции. В настоящее время большие надежды возлагаются на восполнение дефицита селена — микроэлемента, входящего в состав фермента (глютатионпероксидазы), отвечающего за антиоксидантную систему защиты клеток. В частности, достаточное количество этого фермента обеспечивает преобразование свободных радикалов в спирты и таким образом сохраняет целость клеточной мембраны.
Препараты селена при лечении гнойно-септических осложнений применяются в виде пентагидрата селенита натрия. К сожалению, в настоящее время пока нет возможности четко определить закономерности в реакциях и взаимодействиях сотен различных медиаторов, а следовательно, и избирательную нейтрализацию активности циркулирующих в крови медиаторов, как воспалительных, так и противовоспалительных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение гнойных и септических осложнений ранений: иммунная терапия
Как известно, гнойно-септические процессы сопровождаются угнетением функциональной активности иммунокомпетентных клеток за счет иммуносупрессивного действия экзо- и эндотоксинов микроорганизмов, которое может усилиться под влиянием антибиотикотерапии. При этом уровень свободного эндотоксина увеличивается в плазме крови до 200 раз, вследствие его высвобождения из погибших бактерий, что, несмотря на уменьшение бактериемии, вносит свой вклад в усугубление симптомокомплекса гнойного процесса, провоцируя развитие генерализованной воспалительной реакции [Shenep J.L. et al., Talan D. A.].
Неэффективная терапия антибиотиками без учета спектра микрофлоры пострадавших и при несоблюдении оптимальных сроков ее проведения не только утяжеляет общее состояние больного и способствует формированию резистентных штаммов, но и увеличивает продолжительность лечения и его общую стоимость в среднем на 30%. По данным ВОЗ, летальность в группе больных с гнойно-септическими осложнениями значительно (в 10 и более раз) превышает летальность в группе больных с аналогичными исходными состояниями, но не имевших инфекционных осложнений.
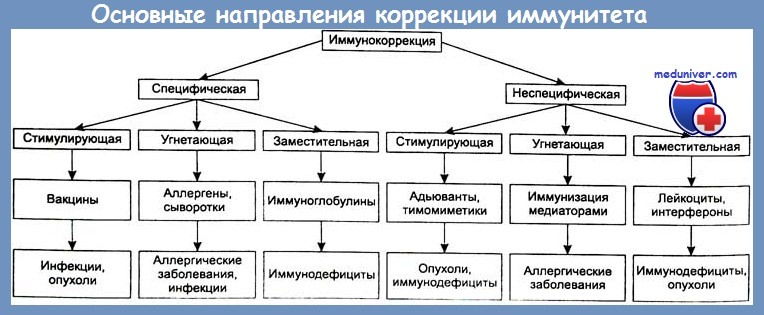
Важную роль в предотвращении генерализации местного гнойного осложнения играет адекватная иммунная терапия. Согласно современным представлениям, используются два вида воздействия на иммунный статус пострадавшего — стимулирующая и заместительная терапия.
Что касается применения иммуностимуляторов (иммуномодуляторов) при гнойно-септических осложнениях, то рядом серьезных исследований доказано, что не всегда их включение в комплекс лечения осложнений сопровождается заметным клиническим эффектом. Как справедливо отметили И. А. Ерюхин и соавт., включение иммунокорригирующих препаратов в комплексное лечение гнойно-септических осложнений хорошо обосновано теоретически, но не всегда имеет яркое клиническое подтверждение их эффективности, особенно при лечении сепсиса. Возможно, как считают авторы, это происходит потому, что учитывается тяжесть процесса, а не его причины. Кроме того, отсутствуют простые и теоретически обоснованные лабораторные и клинические методы исследований, позволяющие идентифицировать динамику воспалительного и иммунного ответа, в том числе -динамику системной воспалительной и противовоспалительной реакций [Bone R. С.].
Более эффективными являются иммуноглобулиновые препараты и иммунные антибактериальные плазмы, целесообразность применения которых обусловлена механизмами их действия, а также патогенезом иммунодефи-цитных состояний при тяжелой травме и гнойно-септических осложнениях [Румянцев А. Г. и др., Mitov I.G., Terziiski D.G., Zanetti G. et al., Talan D.A.].
Иммуноглобулин для внутривенного введения имеет ряд существенных преимуществ по сравнению с иммуноглобулинами для внутримышечного введения, так как позволяет в течение короткого времени создать в крови эффективные терапевтические концентрации антител при минимальном риске развития побочных действий. Первичным эффектом иммуноглобулинов является их способность к специфическому распознаванию чужеродных агентов и связывание с ними. Часто само связывание антителами антигенов ведет к выраженному защитному эффекту и не требует активного подключения механизмов неспецифической защиты, как это бывает в случаях нейтрализации токсинов антитоксическими иммуноглобулинами.
Высокоэффективны также и нейтрализующие антитела, которые распознают и нейтрализуют антигены возбудителей, обеспечивающих инвазивность, т. е. способствуют прекращению распространения инфекции. Следует отметить, что не всегда специфическое взаимодействие антител с антигеном приводит к выраженному защитному эффекту. В этих случаях подключаются вторичные неспецифические механизмы, которые, в свою очередь, также стимулируются антителами.
Эффективность иммунотерапии гнойно-воспалительных осложнений в зависимости от сроков её проведения
| Сроки проведения иммунотерапии от первых признаков гнойного осложнения (недели) | % хороших и отличных результатов санации ран и полостей | % хороших и отличных результатов нормализации иммунограммы | Длительность стационарного лечения (дни) |
| 1-я | 885 | 92 | 32+1,8 |
| 3-4-я | 48 | 58 | 49+3,4 |
Вторичные (неспецифические) эффекты иммуноглобулинов — это активизация неспецифических защитных процессов, направленных на нейтрализацию и выведение чужеродных антигенов. Одним из этих механизмов является взаимодействие одного из фрагментов молекулы иммуноглобулина (Fc-фрагмент) с компонентами системы комплемента. За счет активации комплемента происходит лизис комплекса антиген-антитело.
Имуноглобулипы не только связывают генетически чужеродные организму молекулы и клетки, но и выполняют эффекторные и иммуномодулирующие функции, обусловленные усилением физиологических последствий связывания антигена. Кроме того, иммуноглобулины способны регулировать активность Т- и В-лимфоцитов, макрофагов, многократно усиливать антигенспецифический ответ, опосредованный Т-лимфоцитами и комплементом [Климович В.Б., Imbach P. et al.].
Положительный результат от включения в комплексное лечение как стандартного донорского иммуноглобулина, так и обогащенного IgM — пентаглобина — зависит от дозы и сроков их применения. Лишь при условии нейтрализации бактериальных эндотоксинов в течение первых суток после тяжелой травмы или от начала септического процесса можно рассчитывать на уменьшение биологических последствий эндотоксемии.
Одним из препаратов заместительного действия, компенсирующего функциональную недостаточность нейтрофилов у пациентов с гнойно-воспалительными осложнениями, является лейкокоицентрат донорской крови. Приемлемой считается терапевтическая доза, включающая более 1010 клеток, предпочтительнее доза, близкая к 1011 клеток. Трансфузии меньшего количества лейкоцитов не сопровождаются выраженным клиническим эффектом [Hubel K.D.C. et al., Van Buzik J.-A.H., Weisdorf D. J., Ying-Wei Lin et al.].
Несмотря на определенные успехи клинического использования лейкоцитной массы при лечении септических больных, переливание гранулоцитов не вошло в широкую практику лечения инфицированных пациентов с лейкопенией или фагоцитарной недостаточностью. Это обусловлено прежде всего тем, что имеются трудности получения этого компонента крови и его хранения. Установлено, что гранулоциты начинают терять свои функциональные свойства уже через 6 ч после их выделения, поэтому перелиты они должны быть в течение 12 ч после заготовки.
Важным условием применения лейкоцитной массы является строгое соблюдение схемы введения: интервал между трапсфузиями не должен быть более 2 сут. В противном случае можно спровоцировать иммунизирующий эффект, сопровождающийся выработкой противолсйкоцитарных антител. В то же время введение лейкоцитов иммунокомпрометированным пациентам с Т-лимфопенией и относительной недостаточностью Т-хелперов не сопровождается образованием противолейкоцитарных антител.
Суммируя накопленный опыт применения иммунных препаратов в лечении гнойно-воспалительных осложнений в послеоперационном периоде у пострадавших с множественными и сочетанными ранениями груди, следует признать, что использование иммунотропных препаратов существенно улучшает результаты лечения. Наиболее высокая эффективность лечения гнойно-воспалительных осложнений отмечена при проведении иммунотерапии на фоне адекватной антибактериальной, инфузионной, трансфузионной терапии, направленной на улучшение микроциркуляции, уменьшение интоксикации и способствующей выведению иммунных комплексов.
Сравнительный анализ таких показателей, как продолжительность периода санации гнойного очага, улучшение состояния больного, длительность стационарного лечения и положительная динамика параметров иммунограм-мы, свидетельствует о необходимости применения иммунотропных препаратов в ранние сроки развития гнойных осложнений. В наших наблюдениях при таком подходе удалось существенно сократить период купирования гнойного процесса у 88% больных, в результате чего средняя продолжительность лечения больных этой группы составила 32±1,8 дней. Назначение иммунотропных препаратов позже 20-х суток от начала гнойно-воспалительного процесса сопровождалось улучшением состояния и ускорением процесса очищения гнойных полостей только у 48 % больных. Длительность стационарного лечения у этих пациентов была значительно большей и составила в среднем 49+3,4 дня.
Положительная динамика параметров иммунограммы и клинического анализа крови выявлена у 92% больных при назначении иммунотерапии в ранние сроки и у 58% больных — при её проведении в поздние сроки от начала гнойно-воспалительного осложнения.
Необходимо отметить, что не во всех случаях применения иммунопрепаратов в оптимальные сроки были отмечены положительные сдвиги иммунного гомеостаза. В трех наблюдениях после применения тактивина и в двух - - миелопида в составе комплексного лечения пострадавших с гнойными осложнениями вопреки ожидаемому эффекту было отмечено усиление дисбаланса клеточных звеньев иммунной системы со снижением числа Т- и В-клеток и более выраженное подавление кислородного метаболизма нейтрофилов, обеспечивающего бактерицидность в процессе фагоцитоза.
Как правило, отрицательная динамика параметров иммунограммы имелась при проведении иммунотерапии на фоне сохраняющегося гнойного очага, в том числе и при его неадекватном дренировании. В таких случаях иммуносупрессивное действие гнойной интоксикации превалировало над иммуностимулирующим влиянием использованных препаратов. У этих пациентов с помощью иммунотерапии удавалось лишь предупредить развитие фатальной иммунодепрессии при продолжающейся гнойной интоксикации. Отсутствие положительной динамики иммунограммы на фоне лечения является прогностически неблагоприятным признаком и свидетельствует о том, что характер гнойного процесса приобретает признаки хронического. Это заставляет хирурга совместно с клиническим иммунологом искать причины неблагоприятного развития событий, в первую очередь — исключая наличие недренированных очагов гнойной инфекции.
Таким образом, выбор иммунопрепаратов определяется направленностью и степенью изменения параметров отдельных звеньев иммунной системы. Лейкопения и снижение фагоцитарной активности нейтрофилов при наличии гнойного процесса диктуют необходимость применения препаратов, активирующих лейкопоэз и созревание лейкоцитов, а также проведение заместительной терапии донорской лейкоцитной массой. Если на ранней стадии развития гнойного процесса имеется лимфопения и снижение фагоцитарной активности нейтрофилов, показана комбинация тимических пептидов или миелопептидов с иммуноглобулином для внутримышечного введения. При сочетанной недостаточности фагоцитарного и лимфоцитарного звеньев иммунной системы на фоне сохраняющейся интоксикации и повышения уровня циркулирующих иммунных комплексов эффективно (помимо использования иммунокорригирующих препаратов) проведение лечебного плазмафереза.
Видео иммунограмма в норме и при патологии
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.

Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции - инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов - в 5 раз.

Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Послеродовые инфекции – группа заболеваний инфекционной этиологии, развивающихся в течение 6-ти недель после родов и непосредственно связанных с ними. Включают в себя локальные раневые инфекции, инфекции органов малого таза, генерализованные септические инфекции. В диагностике послеродовых инфекций первостепенное значение имеет время их развития и связь с родами, картина периферической крови, данные гинекологического осмотра, УЗИ, бактериологического исследования. Лечение послеродовых инфекций включает антибиотикотерапию, иммуностимулирующую и инфузионную терапию, экстракорпоральную детоксикацию, санацию первичного очага и др.
Общие сведения
Послеродовые (пуэрперальные) инфекции - гнойно-воспалительные заболевания, патогенетически обусловленные беременностью и родами. Включают в себя раневые инфекции (послеродовые язвы, эндометрит), инфекции, ограниченные полостью малого таза (метрит, параметрит, сальпингоофорит, пельвиоперитонит, метротромбофлебит и др.), разлитые инфекции (перитонит, прогрессирующий тромбофлебит) и генерализованные инфекции (септический шок, сепсис). Временные рамки, в течение которых могут развиваться данные осложнения - от момента выделения последа до окончания шестой недели послеродового периода. Пуэрперальные заболевания инфекционной этиологии встречаются у 2-10% родильниц. Септические осложнения играют ведущую роль в структуре материнской смертности, что ставит их в ряд приоритетных проблем акушерства и гинекологии.

Причины послеродовых инфекций
Этиологическая структура послеродовых инфекций весьма динамична и вариабельна. Из условно-патогенных микроорганизмов преобладают аэробные бактерии (энтерококки, кишечная палочка, стафилококки, стрептококки группы В, клебсиелла, протей), однако довольно часто встречаются и анаэробы (фузобактерии, бактероиды, пептострептококки, пептококки). Велика значимость специфических возбудителей - хламидий, микоплазм, грибов, гонококков, трихомонад. Особенностью послеродовых инфекций является их полиэтиологичность: более чем в 80% наблюдений высеваются микробные ассоциации, которые обладают большей патогенностью и устойчивостью к антибиотикотерапии.
Риск развития послеродовых инфекций существенно повышен у женщин с патологией беременности (анемия, токсикоз) и родов (раннее отхождение вод, слабая родовая деятельность, пролонгированные роды, кровотечение, задержка частей плаценты, лохиометра и др.), экстрагенитальной патологией (туберкулез, ожирение, сахарный диабет). Эндогенными факторами, предрасполагающими к микробному обсеменению родовых путей, могут служить вульвовагиниты, кольпиты, цервициты, пиелонефрит, тонзиллит, синуситы у родильницы. При инфицировании высоковирулентной флорой либо значительном снижении иммунных механизмов у родильницы инфекция может распространяться за пределы первичного очага гематогенным, лимфогенным, интраканаликулярным, периневральным путем.
Классификация послеродовых инфекций
На основании анатомо-топографического и клинического подхода выделяют 4 этапа прогрессирования послеродовой инфекции (авторы - С. В. Сазонова, А. В. Бартельс).
- 1-й этап – местная инфекция, не распространяющаяся за область раневой поверхности (послеродовая язва промежности, влагалища и стенки матки, нагноение швов, нагноение гематом, послеродовой эндометрит)
- 2-й этап – послеродовая инфекция, выходящая за границы раневой поверхности, но ограниченная полостью малого таза (метроэндометрит, аднексит, параметрит, метротромбофлебит, ограниченный тазовый тромбофлебит, пельвиоперитонит)
- 3-й этап – разлитая послеродовая инфекция (перитонит, прогрессирующий тромбофлебит)
- 4-й этап – генерализованная септическая инфекция (сепсис, инфекционно-токсический шок).
В качестве отдельной формы послеродовой инфекции выделяют лактационный мастит. Тяжесть инфекционных осложнений после родов зависит от вирулентности микрофлоры и реактивности макроорганизма, поэтому течение заболеваний варьирует от легких и стертых форм до тяжелых и летальных случаев.
Симптомы послеродовых инфекций
Послеродовая язва образуется в результате инфицирования ссадин, трещин и разрывов кожи промежности, слизистой влагалища и шейки матки. В клинической картине данного послеродового осложнения преобладают местные симптомы, общее состояние обычно не нарушается, температура не превышает субфебрильных цифр. Родильница жалуется на боли в области швов, иногда зуд и дизурические явления. При осмотре родовых путей обнаруживается язва с четкими границами, локальный отек и воспалительная гиперемия. На дне язвы определяется серовато-желтый налет, участки некроза, слизисто-гнойное отделяемое. Язвенный дефект легко кровоточит при контакте.
Послеродовой параметрит развивается на 10–12 день при переходе инфекции на параметрий - околоматочную клетчатку. Типичная клиника включает озноб, фебрильную лихорадку, которая длится 7-10 дней, интоксикацию. Родильницу беспокоят боли в подвздошной области на стороне воспаления, которые постепенно нарастают, иррадиируют в поясницу и крестец. Через несколько дней от начала послеродовой инфекции в области боковой поверхности матки пальпируется болезненный инфильтрат сначала мягковатой, а затем плотной консистенции, спаянный с маткой. Исходами послеродового параметрита может быть рассасывание инфильтрата или его нагноение с формированием абсцесса. Самопроизвольное вскрытие гнойника может произойти во влагалище, мочевой пузырь, матку, прямую кишку, брюшную полость.
Послеродовые тромбофлебиты могут затрагивать поверхностные и глубокие вены. В последнем случае возможно развитие метротромбофлебита, тромбофлебита вен нижних конечностей и вен таза. Обычно проявляются в течение 2-3 недель после родов. Клиническими предвестниками послеродовых осложнений данного типа служат длительная лихорадка; стойкое ступенеобразное учащение пульса; боли в ногах при движении и надавливании на мягкие ткани; отеки в области лодыжек, голени или бедра; цианоз нижних конечностей. На развитие метротромбофлебита указывает тахикардия до 100 уд./мин., субинволюция матки, длительные кровяные выделения, пальпация болезненных тяжей по боковым поверхностям матки. Тромбофлебит вен таза опасен развитием илеофеморального венозного тромбоза и тромбоэмболии легочной артерии.
Послеродовой пельвиоперитонит, или воспаление брюшины малого таза, развивается на 3-4 день после родов. Манифестация острая: температура тела быстро нарастает до 39-40°С, появляются резкие боли внизу живота. Может возникать рвота, метеоризм, болезненная дефекация. Передняя брюшная стенка напряжена, матка увеличена. Послеродовая инфекция разрешается рассасыванием инфильтрата в малом тазу или образованием абсцесса дугласова пространства.
Диагностика послеродовых инфекций
Факторами, указывающими на развитие послеродовых инфекций, служат признаки инфекционно-гнойного воспаления в области родовой раны или органов малого таза, а также общие септические реакции, возникшие в ранний период после родов (до 6-8 недель). Такие осложнения, как послеродовая язва, нагноение швов или гематомы диагностируются на основании визуального осмотра родовых путей. Заподозрить послеродовые инфекции органов малого таза гинекологу позволяет влагалищное исследование. В этих случаях обычно обнаруживается замедленное сокращение матки, ее болезненность, пастозность околоматочного пространства, инфильтраты в малом тазу, мутные зловонные выделения из половых путей.
Дополнительные данные получают при проведении гинекологического УЗИ. В случае подозрения на тромбофлебит показана допплерография органов малого таза, УЗДГ вен нижних конечностей. При послеродовом эндометрите информативна гистероскопия; при гнойном параметрите - пункция заднего свода влагалища. По показаниям применяют лучевые способы диагностики: флебографию, гистерографию, радиоизотопное исследование.
Для всех клинических форм послеродовой инфекции характерно изменение картины периферической крови: значительный лейкоцитоз с нейтрофильным сдвигом влево, резкое увеличение СОЭ. С целью идентификации инфекционных агентов производится бакпосев отделяемого половых путей и содержимого матки. Гистологическое исследование последа может указывать на признаки воспаления и, следовательно, высокую вероятность развития послеродовых инфекций. Важную роль в планировании терапии и оценке тяжести течения осложнений имеет исследование биохимии крови, КЩС, электролитов крови, коагулограммы.
Лечение послеродовых инфекций
Весь комплекс лечебных мероприятий при послеродовых инфекциях делится на местные и общие. Постельный режим и прикладывание льда к животу помогает остановить дальнейшее распространение инфекции из полости таза.
Локальные процедуры включают обработку ран антисептиками, перевязки, мазевые аппликации, снятие швов и раскрытие раны при ее нагноении, удаление некротизированных тканей, местное применение протеолитических ферментов. При послеродовом эндометрите может потребоваться проведение кюретажа или вакуум-аспирации полости матки (при задержке в ней плацентарной ткани и других патологических включений), расширение цервикального канала, аспирационно-промывное дренирование. При формировании абсцесса параметрия производится его вскрытие через влагалище или путем лапаротомии и дренирование околоматочной клетчатки.
Местные мероприятия при послеродовых инфекциях проводятся на фоне интенсивной общей терапии. В первую очередь, подбираются антибактериальные средства, активные в отношении всех выделенных возбудителей (пенициллины широкого спектра действия, цефалоспорины, аминогликозиды и другие), которые вводятся внутримышечно или внутривенно в сочетании в метронидазолом. На время лечения целесообразно прервать грудное вскармливание. С целью дезинтоксикации и устранения водно-солевого дисбаланса используются инфузии коллоидных, белковых, солевых растворов. Возможно проведение экстракорпоральной детоксикации: гемосорбции, лимфосорбции, плазмафереза.
При послеродовых инфекциях стафилококковой этиологии с целью повышения специфической иммунологической реактивности применяется антистафилококковый гамма-глобулин, стафилококковый анатоксин, антистафилококковая плазма. С целью профилактики тромбозов назначают антикоагулянты, тромболитики, антиагреганты под контролем коагулограммы. В комплексе медикаментозной терапии широко используются антигистаминные препараты, витамины, глюкокортикоиды. На этапе реабилитации назначают лазеротерапию, местное УФО, УВЧ-терапию, ультразвук, электростимуляцию матки, бальнеотерапию и другие методы физиотерапевтического воздействия.
В отдельных случаях может потребоваться хирургическая помощь – удаление матки (гистерэктомия) при ее гнойном расплавлении; тромбэктомия, эмболэктомия или флебэктомия - при тромбофлебитах.
Прогноз и профилактика
При раневых инфекциях и инфекциях, ограниченных областью малого таза, прогноз удовлетворительный. Своевременная и адекватная терапия позволяет остановить дальнейшее прогрессирование послеродовых инфекций. Однако в отдаленном периоде прогноз в отношении репродуктивной функции может быть вариабельным. Наиболее тяжелые последствия для здоровья и жизни родильницы влекут за собой разлитой перитонит, сепсис и септический шок.
Профилактика послеродовых инфекций обеспечивается строгим и неукоснительным соблюдением санитарно-гигиенического режима в родовспомогательных учреждениях, правил асептики и антисептики, личной гигиены персонала. Важное значение имеет санация эндогенной инфекции на этапе планирования беременности.
Читайте также:

