Современные аспекты диагностики сифилиса
Обновлено: 25.04.2024
Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения города Москвы
Лабораторная диагностика сифилиса. Современные подходы и перспективы. Часть I. Эпидемиология. Прямые методы диагностики
Журнал: Клиническая дерматология и венерология. 2021;20(6): 7‑18
АКТУАЛЬНОСТЬ
Сифилис представляет собой хроническую системную инфекцию, вызываемую бледной трепонемой (T. Pallidum). Несмотря на усилия органов здравоохранения по предотвращению распространения заболевания, сифилис продолжает регистрироваться во многих странах мира, в том числе в Российской Федерации, вызывая тяжелые последствия в виде висцерального сифилиса, врожденного сифилиса; заболевание нередко протекает скрыто, что определяет высокие требования к лабораторной диагностике.
ЦЕЛЬ СТАТЬИ
Осветить некоторые вопросы эпидемиологии сифилиса и прямые методы, применяемые для его диагностики.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Приведены современные данные о распространении сифилиса в Российской Федерации, а также в странах Европы и США, основанные на официальных статистических материалах. Большая часть обзора посвящена описанию прямых методов исследования, применяемых для диагностики сифилиса: темнопольной микроскопии, прямой иммунофлюоресценции, иммуногистохимии, методу гибридизации в тканях, полимеразной цепной реакции (ПЦР). Поскольку данные о применении ПЦР для диагностики сифилиса противоречивы, приведен ряд работ, более подробно отражающих различные аспекты использования этого метода. Освещены такие варианты ПЦР, как рутинная ПЦР, ПЦР с обратной транскриптазой, гнездовая, или вложенная, ПЦР, ПЦР в реальном времени, мультиплексная ПЦР. Даны примеры использования метода при исследовании разных биологических образцов (материал сифилидов, кровь, цереброспинальная жидкость, сперма и т.д.), его чувствительность и специфичность, перспективы использования. Статья является ориентиром для практических врачей разных специальностей, которые в процессе своей профессиональной деятельности сталкиваются с больными сифилисом, а также для научных работников, приводятся возможности лабораторной диагностики сифилиса прямыми методами, их достоинства и недостатки, перспективы использования.
Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения города Москвы
Московская медицинская академия им. И.М. Сеченова
Современные лабораторные методы и алгоритмы диагностики сифилиса
Журнал: Клиническая дерматология и венерология. 2015;14(6): 56‑61
Дано описание современных подходов к лабораторной диагностике сифилиса. Описаны прямые тесты (темнопольная микроскопия, прямая иммунофлюоресценция Treponema pallidum, полимеразная цепная реакция), позволяющие выявить самого возбудителя или его генетический материал. Приведены наиболее часто применяемые нетрепонемные и трепонемные тесты, используемые в серологической диагностике сифилиса; показания и ограничения к их применению. Дано описание двух современных алгоритмов, применяемых при серологическом обследовании больного с подозрением на сифилис: традиционного и реверсионного, описаны их достоинства и недостатки. Статья представляет интерес для практических врачей — дерматовенерологов, урологов, акушеров-гинекологов, врачей клинической лабораторной диагностики, в поле зрения которых могут оказаться больные манифестными и скрытыми формами сифилиса.
Московская медицинская академия им. И.М. Сеченова
Сифилис — системное инфекционное заболевание, вызываемое бледной трепонемой (Treponema pallidum, subspecies pallidum), остается общемировой проблемой здравоохранения.
В Москве в последние годы отмечена стойкая тенденция к снижению заболеваемости сифилисом. В 2013 г. уровень заболеваемости сифилисом составил 20,4 на 100 000 населения. Однако эпидемиологическая ситуация продолжает оставаться напряженной: в структуре сифилиса преобладают скрытые формы, растет число поздних форм инфекции, что диктует необходимость усиления эпидемиологического контроля над распространением заболевания и широкого применения врачами-дерматовенерологами современных высокочувствительных и специфичных методов лабораторной диагностики сифилиса [1].
Все лабораторные методы диагностики сифилиса подразделяются на прямые, позволяющие выявлять возбудителя или его генетический материал непосредственно в очагах поражения, и непрямые — для выявления антител к возбудителю сифилиса в сыворотке крови (серологическая диагностика).
При назначении пациенту лабораторного обследования по поводу сифилиса не следует забывать о том, что абсолютным критерием постановки диагноза является непосредственное выявление возбудителя заболевания — бледной трепонемы (T. pallidum) или его генетического материала [2].
T. pallidum в образцах, полученных из райц-серума сифилидов или инфицированных лимфоузлов при раннем сифилисе, можно обнаружить с помощью следующих прямых методов исследования:
• микроскопия в темном поле микроскопа, или темнопольная микроскопия (ТПМ);
• прямая иммунофлюоресценция (ПИФ) (для образцов из поражений в полости рта или из других очагов, где возможна контаминация трепонемами-комменсалами);
• полимеразная цепная реакция (ПЦР).
Наиболее убедительным доказательством инфицирования сифилисом является прямая визуализация T. pallidum в темном поле зрения [3].
Материалом для темнопольной микроскопии является серозное отделяемое с поверхности эрозии, язвы, мацерированной или экскориированной, эрозированной папулы или бляшки, иногда — содержимое пунктата лимфоузла. При исследовании в темном поле бледная спирохета выглядит в виде нежной подвижной спирали, слабо светящейся серебристым блеском. Исследование в темном поле микроскопа позволяет изучать T. pallidum в живом виде, а также дифференцировать ее от других трепонем как по морфологическим признакам, так и по характерным особенностям движения, что позволяет поставить диагноз даже без учета данных серологических тестов.
Вторым методом выявления возбудителя сифилиса в очагах поражения является метод ПИФ. В результате взаимодействия моноклональных антител анти-T. pallidum, меченных ФИТЦ, и бледной трепонемы, полученной из очагов поражения и помещенной на предметное стекло, при люминесцентной микроскопии наблюдается специфическое ярко-зеленое свечение. Метод удобен при исследовании материала, полученного со слизистой оболочки полости рта и прямой кишки, при биопсии или аутопсии. За счет использования видоспецифических моноклональных антител метод позволяет дифференцировать патогенную T. pallidum от трепонем-комменсалов [4]. В России данный метод не применяют ввиду отсутствия промышленного производства и сертификации соответствующих ингредиентов, в частности, моноклональных антител к патогенной бледной трепонеме, меченных ФИТЦ.
ПЦР позволяет обнаружить единственную молекулу ДНК возбудителя среди миллионов других молекул. Метод основан на принципе естественной репликации ДНК и заключается в размножении (амплификации) в пробирке определенных участков ДНК возбудителя в процессе повторяющихся температурных циклов. На каждом этапе вновь синтезированные молекулы копируются ферментом ДНК-полимеразой, благодаря чему происходит многократное удвоение специфических фрагментов ДНК [5].
Источниками обнаружения генетического материала возбудителя при постановке ПЦР у больных сифилисом могут являться: райц-серум (тканевая жидкость) генитальных язв, биопсийный материал кожных сифилидов, спинномозговая жидкость, амниотическая жидкость, плацента, периферическая кровь и семенная жидкость. Наиболее адекватным для исследования является райц-серум генитальных язв.
Чувствительность и специфичность метода ПЦР при исследовании райц-серума сифилидов при первичном сифилисе достигает 94,7—98,6%, при вторичном 80—98,6% и более выражена по сравнению с темнопольной микроскопией [6].
Широкое применение при обследовании на сифилис получили непрямые, серологические методы исследования, принцип которых заключается в выявлении в сыворотке или плазме крови или спинномозговой жидкости пациентов антител, ассоциированных с сифилитической инфекцией.
Первой серологической реакцией для диагностики сифилиса была реакция связывания комплемента, предложенная в 1906 г. Вассерманом, Нейсcером и Бруком [7]. Однако в настоящее время этот метод, ставший в свое время революционным и положивший начало серологической диагностике сифилиса, считается морально устаревшим: он длительно выполняется, субъективно интерпретируется, часто дает ложноотрицательные и ложноположительные результаты и не подлежит стандартизации.
Современные серологические тесты, применяемые для диагностики сифилиса, подразделяются на две большие группы: нетрепонемные (НТТ) и трепонемные (ТТ).
В НТТ на сифилис используется антиген нетрепонемного происхождения — кардиолипин-холестерол-лецитиновый комплекс [8, 9].
Основными видами НТТ, рекомендуемыми к применению на территории России, в настоящее время являются:
— РМП — реакция микропреципитации с плазмой и инактивированной сывороткой;
— RPR — тест быстрых плазменных реагинов (Rapid Plasma Reagins), или быстрый, или ускоренный плазмареагиновый тест;
— VDRL (Venereal Disease Research Laboratory) — тест исследовательской лаборатории венерических заболеваний.
Могут быть также использованы следующие их аналоги при условии, если тест-система имеет разрешение к медицинскому применению на территории Российской Федерации:
TRUST — тест с толуидиновым красным и непрогретой сывороткой (Toluidin Red Unheated Serum Test);
RST — тест на скрининг реагинов (Reagin Screen Test);
USR — тест на реагины с непрогретой сывороткой (Unheated Serum Reagins) [10, 11].
Показаниями к применению НТТ на сифилис являются:
• проведение скрининга населения на сифилис;
• контроль эффективности терапии (по титру антител в парных сыворотках, полученных до и после лечения);
• определение активности инфекции (по высоте титра антител).
НТТ просты в исполнении, недороги, не требуют специального оборудования и длительного времени; при этом реакции являются высоко чувствительными и специфичными.
Чувствительность РМП варьирует в зависимости от стадии заболевания: от 81% при первичном сифилисе до 94—99% при вторичном и скрытых формах сифилиса. Чувствительность зарубежных тестов варьирует от 59 до 100%, специфичность — от 93 до 99%.
После адекватного специфического лечения сифилиса содержание антител к возбудителю сифилиса, выявляемых в НТТ, постепенно снижается, тесты из резко положительных становятся слабоположительными, а затем отрицательными. В связи с этим НТТ используют для оценки эффективности лечения.
Ограничениями применения НТТ являются ранние стадии сифилиса (период инкубации, начало первичного периода), так как данные реакции становятся позитивными лишь спустя 2—3 нед после появления твердого шанкра, и поздние стадии (поздний скрытый и третичный сифилис, сифилис с поражением внутренних органов и нервной системы), так как лабильные преципитины первыми элиминируются из организма при длительном течении сифилитической инфекции. К числу недостатков НТТ следует отнести также субъективный визуальный учет, хотя в настоящее время разработаны системы для видеоцифровой регистрации результатов с их переводом в цифровые данные.
Следует иметь в виду, что антитела, определяемые в НТТ на сифилис, могут выявляться при ряде острых и хронических инфекционных и соматических заболеваний, которые сопровождаются гибелью клеток и разрушением тканей, что может стать причиной ложноположительных результатов НТТ, которые встречаются при скрининге населения на сифилис в 1—3% случаев [12].
В ТТ применяется антиген трепонемного происхождения — патогенная бледная трепонема, рекомбинантные белки, полученные генно-инженерным способом или пептиды, полученные путем искусственного химического синтеза.
Основными ТТ, рекомендуемыми к применению на территории России, в настоящее время являются:
ИФА — иммуноферментный анализ (ELISA — Enzymelynced immunosorbent assay, EIA – Enzyme immunoassay);
РПГА — реакция пассивной гемагглютинации (ТРНА, TPPA — Treponema pallidum hemagglutination assay, Treponema pallidum partiсle agglutination assay);
РИФ — реакция иммунофлюоресценции (FTA Fluorescent treponemal antibody);
ИХЛ — иммунохемилюминесценция (СLIA — Chemiluminescence Immunoassay);
Простые быстрые тесты у постели больного — ПБТ (РОС — point of care tests);
РИБТ (РИТ) — реакция иммобилизации бледных трепонем (TPI — Treponema pallidum immobilization test) [13, 14].
Показаниями к применению ТТ являются:
• подтверждение положительных результатов НТТ;
• дополнительное подтверждение в случае расхождения результатов скринингового ТТ и последующего НТТ;
• скрининг населения на сифилис (ИФА, РПГА, простые быстрые тесты).
К числу несомненных достоинств ТТ относится их высокая чувствительность и особенно специфичность, возможность подтверждения (верификация) результатов НТТ.
Часть ТТ (ИФА, ИХЛ, иммуноблоттинг) может быть автоматизирована и выполняться на анализаторах с получением объективного отчета в электронном виде. Для РПГА имеется возможность видеоцифровой регистрации результатов.
ТТ могут быть использованы для подтверждения клинического диагноза сифилиса на ранних стадиях инфекции, когда НТТ еще отрицательны, но есть клинические, эпидемиологические или анамнестические подозрения на сифилис. Однако чувствительность при первичном сифилисе этих тестов в совокупности недостаточна (76—86%) в основном за счет РИБТ, которая становится позитивной, начиная со второй половины первичного периода сифилиса.
Ранние стадии сифилиса (начало первичного периода сифилиса, период инкубации) могут быть диагностированы при использовании IgM-тестов, которые выявляют ранние трепонемоспецифические IgM, первыми появляющимися в организме больного сифилисом в ответ на внедрение возбудителя (варианты РИФ-абс IgM, ИФА-IgM, ИХЛ-IgM, IgM-иммуноблоттинга) [15—19].
Трепонемные методы хорошо выявляют вторичный и скрытый сифилис (чувствительность составляет 98—100%) [20].
ТТ могут быть использованы для установления ретроспективного диагноза сифилиса, а также для распознавания ложноположительных результатов НТТ.
С использованием ряда ТТ (ИФА, РПГА, ИХЛ, ПБТ) можно проводить скрининг отдельных категорий населения на сифилис (доноры, беременные, больные офтальмологических, психоневрологических, кардиологических стационаров, ВИЧ-инфицированные).
ТТ не могут быть использованы для контроля эффективности лечения, так как длительно остаются положительными после окончания лечения сифилиса (в особенности РИБТ, РПГА). Они сложнее в техническом отношении, чем НТТ, что несколько ограничивает их применение.
В настоящее время существуют два основных подхода к проведению скрининга и обследования больных на сифилис: первый подход характеризуется началом обследования с назначения НТТ, второй — когда обследование начинается с ТТ.

Рис. 1. Традиционный алгоритм серологического скрининга на сифилис (из лекции Фриго Н.В. на цикле усовершенствования врачей, РМАПО, 2012).
Контрольное обследование после лечения проводится с помощью РМП или ее модификации в полуколичественном варианте. По снижению ее титра судят об эффективности терапии
Заключительное обследование проводят не ранее чем через 1 год. Ставится та же специфическая реакция, что и при первичном обследовании. Наличие ее положительных результатов не является препятствием для снятия пациента с учета [13].
Традиционный алгоритм скрининга на сифилис имеет свои преимущества и недостатки. Несомненным преимуществом является то, что он выявляет активную инфекцию. Однако данный алгоритм дает высокий процент ложноположительных результатов, нуждается в подтверждении ТТ и может пропустить ранний первичный сифилис или пролеченную инфекцию.

Рис. 2. Реверсионный алгоритм серологического скрининга на сифилис (из лекции Фриго Н.В. на цикле усовершенствования врачей, РМАПО, 2012).
При положительном результате ТТ следует постановка НТТ с определением титра антител.
Если НТТ дает отрицательный результат, проводится дополнительное тестирование с использованием второго чувствительного и специфичного (подтверждающего) ТТ (например, РПГА).
При отрицательном результате дополнительного подтверждающего теста (РПГА–) делается вывод о том, что человек не болен сифилисом; при этом положительный результат скринингового ТТ (первый) расценивается как ложноположительный.
При положительном результате (РПГА+) делается вывод о том, что у человека имеется сифилис в настоящем или был перенесен в прошлом.
Можно привести ряд аргументов в пользу использования реверсионного алгоритма:
• возможность автоматизации ТТ;
• высокая производительность (до 180 тестов в час);
• отсутствие или сведение до минимума ручных манипуляций (безопасность персонала и высокое качество исследований);
• низкая себестоимость при больших объемах тестирования (поток);
• отсутствие ложнонегативных реакций и феномена прозоны (высокая чувствительность);
• возможность детекции IgM антител — потенциальная возможность диагностики раннего сифилиса.
Главным преимуществом реверсионного алгоритма является то, что он выявляет ранний или пролеченный сифилис, что может быть пропущено при традиционном скрининге. Вместе с тем он также имеет ряд недостатков: реверсионный алгоритм нуждается в постановке НТТ для подтверждения активной инфекции и контроля эффективности терапии, может давать ложноположительные результаты (из-за недостаточно высокой специфичности тестов), не позволяет дифференцировать активную и пролеченную инфекцию (и это его основной недостаток!).
Проблемы возникают чаще всего при наличии положительного результата ТТ и отрицательного результата НТТ. Тактика в этом случае должна быть следующей.
• При несовпадении результатов скринингового ТТ и НТТ (ТТ+, НТТ–) необходима постановка дополнительного подтверждающего ТТ.
• Подтверждающий Т.Т. должен иметь чувствительность не ниже, а специфичность — выше, чем скрининговый ТТ.
• В качестве дополнительного подтверждающего теста в этих случаях может быть рекомендована РПГА (РИФабс не рекомендуется ввиду более низкой аналитической чувствительности в сравнении с другими ТТ) [24].
• Результаты скрининга следует анализировать с учетом клинической картины заболевания и анамнестических данных пациентов (в частности, полноты и качества проведенного специфического лечения по поводу ранее перенесенного сифилиса).
Таким образом, приведенные данные свидетельствуют о том, что в распоряжении дерматовенерологов и врачей других специальностей в настоящее время имеется большой арсенал как прямых, так и непрямых лабораторных методов исследования для диагностики сифилиса. Рациональное использование имеющихся технологий и алгоритмов диагностики позволяет осуществлять эпидемиологический надзор и контроль над распространением сифилиса на территории города Москвы и других субъектов Российской Федерации.
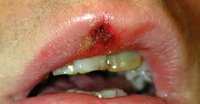
Первичный сифилис — первая стадия сифилиса, возникающая после заражения бледной трепонемой и начинающаяся с кожных проявлений в месте ее внедрения. Характеризуется появлением твердого шанкра (первичной сифиломы) на коже или слизистой с последующим развитием регионарного лимфангита и лимфаденита. При локализации элементов первичного сифилиса на коже полового члена возможно развитие баланопостита, фимоза, гангренизации и других осложнений. Диагноз первичного сифилиса устанавливается на основании анамнеза, обнаружения твердого шанкра и выявлении в его отделяемом бледных трепонем, положительных результатов серологических исследований, ПЦР-диагностики. Лечение осуществляется препаратами пенициллина.
Общие сведения
Современная венерология отмечает некоторые отличия в клинической картине первичного сифилиса по сравнению с теми его проявлениями, которые наблюдались ранее. Если раньше у 90% заболевших первичным сифилисом твердый шанкр носил одиночный характер, то сейчас возросло число случаев появления сразу 2-х и более шанкров. Отмечается существенное увеличение язвенных форм твердого шанкра и форм первичного сифилиса, осложненных пиодермией. Вырос удельный вес твердых шанкров, расположенных на слизистой рта и в области ануса.

Классификация первичного сифилиса
- Первичный серопозитивный сифилис — сопровождается положительными серологическими реакциями на сифилис.
- Первичный серонегативный сифилис — у пациента серологические исследования дают отрицательный результат.
- Скрытый первичный сифилис — протекает с отсутствием клинических проявлений заболевания, может быть серопозитивным и серонегативным. Эта форма сифилиса чаще наблюдается у пациентов, которые начали лечение на ранних стадиях, но не закончили его.
Симптомы первичного сифилиса
Клинические проявления первичного сифилиса возникают спустя 10-90 дней от момента заражения пациента. Место появления первичной сифиломы, называемой твердым шанкром, соответствует месту внедрения бледной трепонемы через кожные покровы или слизистую оболочку. Как правило, это половые органы: у мужчин чаще всего головка полового члена и крайняя плоть, у женщин — половые губы, слизистая влагалища и шейки матки. Последнее время при первичном сифилисе все чаще встречается экстрагенитальное (внеполовое) расположение шанкра: на коже и слизистой ануса, животе, бедрах, лобке, пальцах рук, слизистой губ, языка и ротовой полости.
Твердый шанкр первичного сифилиса представляет собой округлую мясисто-красную эрозию диаметром до 1 см. Приподнятые края эрозии придают ей блюдцеобразный вид, а скудное серозное отделяемое делает ее поверхность как бы лакированной. Свое название твердый шанкр получил благодаря плотному инфильтрату, лежащему в основании эрозии. Однако современные венерологи отмечают в своей практике случаи шанкров без выраженного уплотнения в основании. Обычно первичный сифилис протекает без субъективных ощущений, большинство пациентов отмечает лишь незначительную болезненность в области шанкра. Разрешение эрозивного шанкра происходит, не оставляя на коже или слизистой никаких следов. В тоже время при первичном сифилисе встречаются язвенные формы твердого шанкра с более выраженными краями и уплотнением основания. Их заживление происходит с образование рубца.
Первичный сифилис может протекать с появлением атипичных форм твердого шанкра, что встречается относительно редко. К атипичным формам относят: индуративный отек, шанкр-амигдалит и шанкр-панариций. Индуративный отек встречается в области мошонки, крайней плоти и больших половых губ. Его плотность настолько велика, что надавливание пальцем в месте отека не оставляет после себя углубления. Первичный сифилис в виде шанкра-амигдалита проявляется односторонним безболезненным увеличением и уплотнением миндалины, сопровождающимся ее окрашиванием в красно-медный цвет. Отсутствие выраженных воспалительных изменений, болезненности и температурной реакции позволяет отличить эту форму первичного сифилиса от ангины или обострения хронического тонзиллита.
Шанкр-панариций имеет место чаще всего при развитии первичного сифилиса у медицинских работников (гинекологи, урологи, стоматологи, лаборанты и пр.). Он характеризуется резкой болезненностью, уплотнением и вздутием концевой фаланги одного из пальцев руки. Предположить первичный сифилис в таких случаях помогает отсутствие выраженного покраснения и наличие плотной инфильтрации пораженной области. Заподозрить первичный сифилис при всех атипичных формах твердого шанкра можно по типичному для сифилиса выраженному увеличению регионарных лимфоузлов: паховых при индуративном отеке, шейных и поднижнечелюстных при шанкре-амигдалите, локтевых при шанкре-панариции.
Осложнения первичного сифилиса
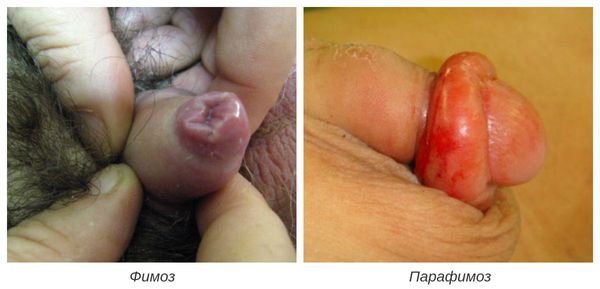
Наиболее часто первичный сифилис осложняется вторичной бактериальной или трихомонадной инфекцией с развитием баланита или баланопостита. Последний может приводить к сужению крайней плоти с возникновением фимоза. Если при этом твердый шанкр локализуется в венечной борозде, то его обследование становится невозможным, что затрудняет диагностику первичного сифилиса. Попытки пациента самостоятельно открыть головку могут привести к ее ущемлению и возникновению парафимоза.
Более редким осложнения первичного сифилиса является гангренизация, обусловленная фузоспириллезной инфекцией. При этом твердый шанкр покрывается черным струпом. Распространение процесса за пределы шанкра говорит о развитии фагеденизма.
Диагностика первичного сифилиса
С проявлениями первичного сифилиса в своей практике сталкивается не только врач-венеролог, но и андролог, уролог, гинеколог, дерматолог, отоларинголог, проктолог, стоматолог. Выявление твердого шанкра и наличия в анамнезе пациента сведений о половом контакте, который мог быть причиной заражения, является основным моментом на начальном этапе диагностики первичного сифилиса. Затем проводится исследование отделяемого шанкра для обнаружения бледной трепонемы. Вспомогательным методом является исследование на бледные трепонемы пунктата, взятого в ходе биопсии лимфатического узла. Серологические реакции (РИФ, РИБТ, RPR-тест) становятся положительными лишь спустя 3-4 недели от начала проявлений первичного сифилиса. Поэтому в ранний период первичного сифилиса применяется ПЦР-диагностика.
Дифференциальная диагностика первичного сифилиса проводится с генитальным герпесом, трихомониазом, гонореей, чесоткой, псориазом, баланопоститом, болезнью Кейра, эрозией шейки матки, раком вульвы и другими заболеваниями. При расположении твердого шанкра на губах первичный сифилис необходимо дифференцировать от хейлита и простого герпеса, при его локализации на слизистой рта — от стоматита, пузырчатки, язвенной формы милиарного туберкулеза, раковой язвы, поражений слизистой при красном плоском лишае, системной красной волчанке, лейкоплакии.
Лечение первичного сифилиса
Терапия первичного сифилиса проводится препаратами пенициллинового ряда. Осуществляют внутримышечное введение водорастворимого пенициллина каждые 3 часа, новокаиновой соли бензилпенициллина дважды в сутки или комбинированных препаратов бензилпенициллина по схеме. Дозы и длительность лечения зависят от формы первичного сифилиса. Важное значение имеет обследование и лечение половых партнеров больного.
У пациентов с аллергией на пенициллин лечение первичного сифилиса может проводиться доксициклином или тетрациклином. Некоторые исследования указывают на эффективность цефтриаксона в лечении первичного и вторичного сифилиса. Однако малое число таких наблюдений дает недостаточное количество информации для установления его оптимальных доз и наиболее целесообразной продолжительности лечения.
После проведенного лечения пациенты с серонегативным первичным сифилисом в течение года находятся на обязательном диспансерном наблюдении, а пациенты с серопозитивным первичным сифилисом — три года. Контроль излеченности осуществляется на протяжении всего периода диспансерного наблюдения путем проведения RPR-теста. Сохранение резко положительных результатов теста в течение года является показанием к дополнительному лечению.
Что такое баланопостит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ахмерова Надира Минисалимовича, уролога со стажем в 28 лет.
Над статьей доктора Ахмерова Надира Минисалимовича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Баланопостит — это воспаление крайней плоти и головки полового члена, чаще всего инфекционного характера. Проявляется покраснением, отёком, зудом и жжением поражённой области.
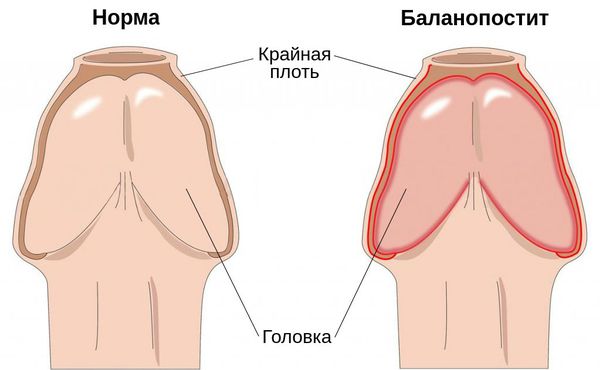
Заболевание является распространённым и встречается в любой возрастной группе. На его долю приходится 47 % случаев среди всех поражений кожи полового члена и 11 % случаев среди всех обращений в кабинеты уролога и венеролога [1] .
Причина болезни — инфекционные агенты, проникшие в кожу головки и крайней плоти. Причём инфекция может быть как банальной (стафилококки, стрептококки и др.), так и связанной с заболеваниями, передающимися половым путём.
Часто баланопостит возникает как осложнение основного заболевания (например уретрита или простатита ). Также он может являться индикатором наличия серьёзной эндокринной патологии (сахарного диабета) или приобретённого иммунодефицита, в том числе заболеваний, ассоциированных с ВИЧ-инфекцией ( наркомании и вирусного гепатита и др.).
Лёгкому проникновению инфекции и быстрому развитию воспаления способствуют определённые анатомические и физиологические особенности поражаемой области:
- относительно тонкий эпидермис (наружный слой кожи);
- выраженное кровоснабжение;
- рыхлость подлежащего соединительнотканного слоя;
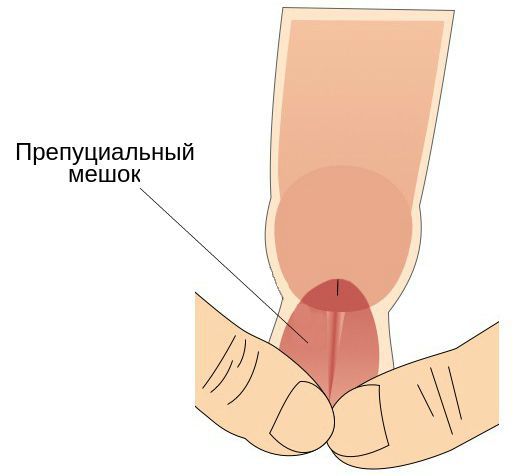
- наличие препуциального мешка, который содержит выделения смегмальных (сальных) желёз, необходимых для сохранения эластичности головки полового члена.
Также имеет значение недостаточная или избыточная гигиена половых органов, частые незащищённые половые контакты, наличие сопутствующих заболеваний (например атеросклероза или дерматитов) и работа в тяжёлых условиях (связанная с высокой температурой и загрязнениями) [2] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы баланопостита
Проявления баланопостита в целом не отличаются от воспалительных симптомов других локализаций. Чаще всего заболевание характеризуется триадой признаков воспаления : отёком, болью и покраснением. Однако вместо болевого синдрома при баланопостите обычно появляется зуд и жжение в поражённой области. На месте воспалительных очагов очень часто образуются эрозии (поверхностные раны), покрытые выделениями и налётом белого или жёлто-зелёного цвета [3] .
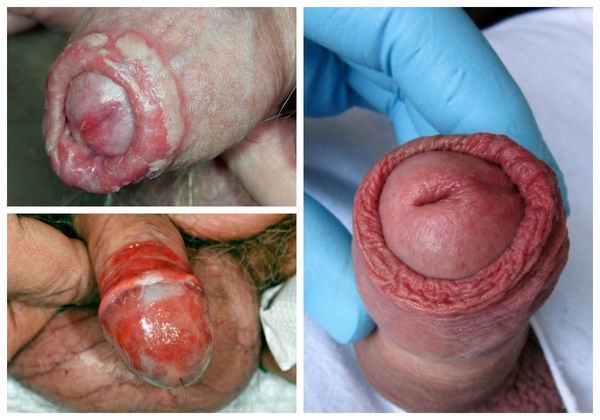
Один из важных диагностических признаков болезни — усиление симптомов во время и после полового акта . За счёт механического раздражения воспалённой кожи возникает покраснение, налёт или зуд. Также симптомы баланопостита могут усиливаться во время и после мочеиспускания.
Серьёзным симптомом выраженной воспалительной реакции является затруднённое и болезненное обнажение головки. Оно связано не только с самим воспалением, но и с осложнениями в виде воспалительных спаек и фимоза (сужения крайней плоти). Чаще всего спайки возникают у детей. Они образуются через несколько дней после начала заболевания и прогрессируют в случае позднего обращения к врачу.
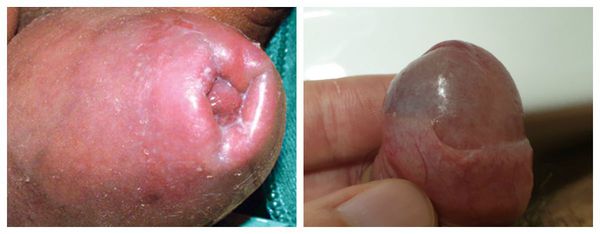
Патогенез баланопостита
Головка, внутренний листок крайней плоти и образуемый ими препуциальный мешок являются единым анатомическим образованием. В состоянии покоя у необрезанных мужчин головка находится внутри препуциального мешка, который защищает её от внешних травматических и температурных факторов [4] . Во внутреннем листке крайней плоти содержится большое количество сальных желёз. Секрет, который они вырабатывают, увлажняет и смазывает головку для её беспрепятственного обнажения при потребности. Во время эрекции за счёт увеличения полового члена и расправления крайней плоти головка обнажается, а препуциальный мешок исчезает.
Такие о собенности строения полового члена у необрезанных мужчин способствует развитию баланопостита [5] . Также к предрасполагающим факторам относятся суженное отверстие препуциального мешка и избыточная (удлинённая) крайняя плоть, которая даже при максимальной эрекции покрывает головку полностью или частично. Несмотря на отсутствие перечисленных факторов, у обрезанных мужчин также возникает баланопостит , хотя реже, чем у необрезанных.
Другим фактором, способствующим развитию болезни, является плохая гигиена. При этом в полости препуциального мешка скапливается так называемая смегма. Она является смесью выделений сальных желёз, лейкоцитов и слущенного эпителия. В норме смегма постоянно обновляется за счёт гигиены или регулярной половой жизни. При нарушении процессов обновления она скапливается и становится прекрасной средой для размножения микроорганизмов и развития воспаления окружающих тканей.
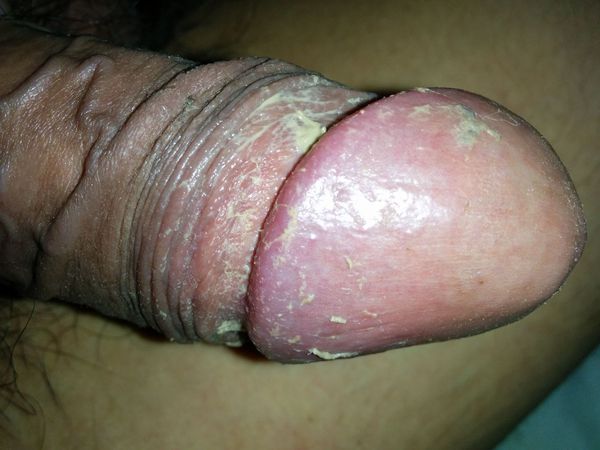
Процесс в оспаления в итоге приводит к нарушению функции полового члена. В начале болезни возникает покраснение, которое сопровождается зудом или жжением, в некоторых случаях — появлением налёта. Затем присоединяется отёк, возникает боль. В итоге заболевание приводит к невозможности вести половую жизнь, а при самом неблагоприятном развитии — к острой задержке мочеиспускания.
Классификация и стадии развития баланопостита
Классификаций баланопостита довольно много, так как исследованием этого заболевания занимаются врачи нескольких специальностей: урологи, андрологи, дерматовенерологи, хирурги и педиатры. Наиболее полно этиологическую и клиническую картину болезни отображает классификация, представленная Британской ассоциацией сексуального здоровья и ВИЧ (BASHH). Она рекомендована для практического применения в странах Европы [6] .
Согласно классификации BASHH, выделяют два типа баланопостита: инфекционный и неинфекционный . Инфекционный баланопостит, в зависимости от причинного фактора, разделяют на восемь подтипов:
- Candida albicans. Грибы этого рода являются частой причиной баланопостита ввиду их широкого распространения у женщин, нерационального применения антибиотиков и увеличения частоты вторичных иммунодефицитов . Обычно Candida albicans передаются половым путём. Но бывают случаи заражения, не связанные с сексуальной активностью: при сахарном диабете или после антибиотикотерапии [10][12] .
- Trichomonas vaginalis . Трихомонады являются простейшими микроорганизмами. Они паразитируют в половых органах как мужчин, так и женщин. Передаются половым путём [13] .
- Streptococcus (A, B). Стрептококки могут бессимптомно присутствовать в половой сфере, но при заболевании их концентрация резко увеличивается [15] .
- Anaerobes (бактероиды, фузобактерии, актиномицеты, клостридии). Обнаружение анаэробов на коже головки полового члена часто ассоциируется с хроническим неспецифическим уретритом и баланопоститом. Причём в основном развитие этих заболеваний связано не с одним видом возбудителей, а сразу с несколькими (т. е. с микст-инфекцией).
- Gardnerella vaginalis . Гарднереллёз довольно часто становится причиной воспалительных реакций половых органов. Распространённость G. vaginalis среди урологических больных в целом составляет 8 %, а при баланопостите, не обусловленном Candida — до 31 % [14] .
- Staphylococcus aureus . Наличие золотистого стафилококка часто не вызывает никаких симптомов, но в некоторых случаях может стать причиной болезни [16] .
- Treponema pallidum . При локализации первичного очага инфекции на головке или крайней плоти бледная трепонема вызывает баланопостит, но уже специфический — ассоциированный с сифилисом .
- Herpes simplex virus . Вирус простого герпеса 1-го и 2-го типа тоже может быть причиной воспаления [18] .
Неинфекционные баланопоститы делятся на два подтипа:
- обусловленные заболеваниями кожи — склеротическим лихеном, баланопоститом Зуна, красным плоским лишаём , контактным аллергическим дерматитом , псориазом и др.;
- обусловленные другими причинами — травмами, раздражением, несоблюдением гигиены и др.
Осложнения баланопостита
К осложнениям баланопостита относятся:
-
; ; ;
- некроз головки полового члена;
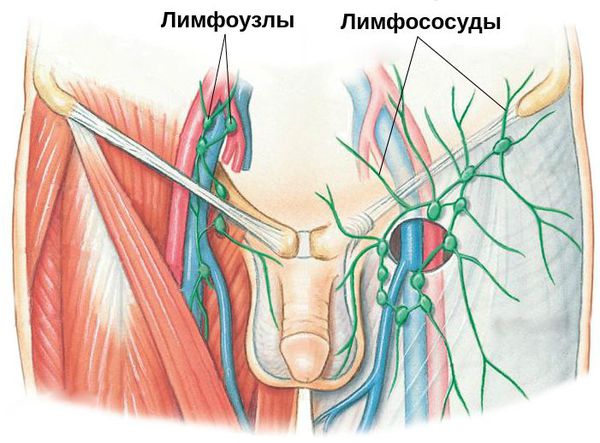
- паховый лимфангиит и лимфаденит.
Фимоз — кольцевидное сужение крайней плоти, препятствующее обнажению головки. Его развитие связано с образованием рубцовой ткани и потерей эластичности крайней плоти. Особенно часто он возникает при рецидивирующем или торпидном (вялотекущем, длительном) течении баланопостита, а также при его сочетании с системными заболеваниями (в частности с сахарным диабетом). В редких случаях при выраженном сужении крайней плоти возникает хроническая задержка мочеиспускания, требующая неотложного лечения.
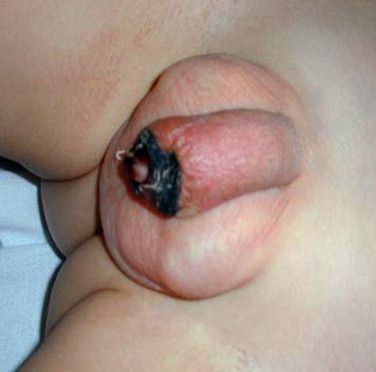
Некроз головки полового члена — р едкое, но грозное осложнение. Чаще всего связано с наличием анаэробной инфекции, в частности фузобактерий [17] . Молниеносное течение этого осложнения, так называемая гангрена Фурнье , может привести к гибели пациента. На начальной стадии гангрена Фурнье проявляется в виде обычного баланопостита. Её особенностью является быстрое распространение воспаления в виде покраснения, отёка и крепитации тканей (их потрескивания при нажатии), а также образование массивного некроза гениталий. Она возникает, как правило, на фоне выраженных иммунодефицитных состояний (в т. ч. хронического алкоголизма , ВИЧ-инфекции ) и сопровождается мощнейшей интоксикацией.
Стриктура уретры — сужение мочеиспускательного канала. Возникает при длительно протекающем баланопостите либо в связи с наличием специфического возбудителя, вызывающего активное деление клеток. Проявляется затруднённым мочеиспусканием и неполным опорожнением мочевого пузыря. Способствует развитию хронической инфекции мочевыводящих путей (циститу, пиелонефриту, гидронефрозу) и даже хронической почечной недостаточности.
Паховый лимфаденит и лимфангиит — воспаление паховых лимфатических узлов и сосудов. Данное осложнение свидетельствует о распространении инфекции за пределы поражённого органа. Как правило, оно требует коррекции проводимых лечебных мероприятий.
Диагностика баланопостита
Постановка первичного диагноза на основе жалоб, данных анамнеза и визуального осмотра обычно не вызывает затруднений. Самыми частыми симптомами баланопостита являются: покраснение и отёк головки и крайней плоти, зуд и жжение в месте поражения. Иногда отмечается боль, появление налёта или выделений на головке, болезненное мочеиспускание, затруднение или невозможность обнажения или вправления головки полового члена. Также могут присутствовать язвенные дефекты, болезненность и покраснение в проекции паховых лимфоузлов. В редких случаях отмечается ухудшение общего самочувствия, повышение температуры от 37,0-37,9 ℃ и выше с присоединением озноба.
Для выявления причинного фактора и состояний, способствующих развитию или рецидивированию заболевания, требуются дополнительные методы обследования [16] .
Основные :
- бактериологический анализ отделяемого из головки или крайней плоти на аэробную флору и грибы рода Candida (бакпосев);
- скрининговое исследование методом ПЦР (полимеразной цепной реакции) на инфекции, передаваемые половым путём;
- анализы крови и мочи на глюкозу для исключения или подтверждения сахарного диабета;
- клинический анализ крови;
- серологическая диагностика сифилиса — поиск антител к бледной трепонеме.
Дополнительные :
- консультация дерматолога для исключения дерматитов или аллергических заболеваний, сопровождающихся высыпаниями на головке полового члена;
- консультация эндокринолога при выявлении повышенного уровня глюкозы;
- биопсия кожи головки или крайней плоти в случае подозрения на злокачественный процесс или при торпидном течении заболевания.
Лечение баланопостита
Тактика лечения зависит от стадии развития процесса, наличия осложнений или сопутствующих заболеваний.
При неосложнённом баланопостите, который возник впервые, показана местная терапия в виде нанесения растворов или лечебных мазей на место поражения. Выбор лекарственного средства зависит от вида предполагаемого или подтверждённого возбудителя [9] [11] . Это могут быть антибактериальные, противогрибковые или противовирусные препараты.
В случае рецидива заболевания или выраженной воспалительной реакции, особенно при повышении температуры тела, показано назначение соответствующих лекарств в виде таблеток, капсул или инъекций. При этом необходимо учитывать результаты обследований по определению вида возбудителя. В случае выявления сахарного диабета обязательно назначение препаратов, снижающих уровень глюкозы в крови.
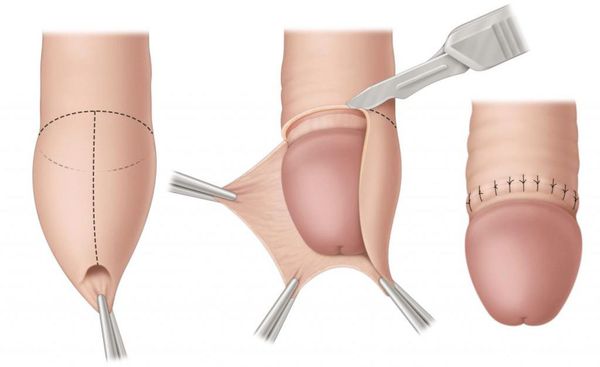
Некоторые осложнения баланопостита требуют операционного лечения. При развитии фимоза показана циркумцизия, или обрезание. При этом вмешательстве удаляется рубцово-изменённая крайняя плоть, после чего накладываются швы. В результате головка становится полностью обнажённой. Эту же операцию рекомендуют при большом количестве рецидивов. Эффективность циркумцизии доказана в ряде исследований [19] [20] [21] [22] .
В случае парафимоза проводится операция по рассечению ущемляющего кольца и вправлению головки.
Тактика лечения стриктуры уретры зависит от расположения и размеров стеноза. Для расширения уретры потребуется меатотомия — рассечение наружного отверстия мочеиспускательного канала с наложением швов. При большой протяжённости стриктуры показана пластика уретры.
Однако большинство осложнений и рецидивов заболевания удаётся избежать благодаря своевременному обращению к врачу и проведённому медикаментозному лечению.
Прогноз. Профилактика
Прогноз чаще всего благоприятный. В случае точного выяснения причины заболевания и вовремя начатой терапии наступает полное излечение. Однако при отсутствии лечения или наличии сопутствующей патологии (например сахарного диабета) не исключается появление осложнений, которые потребуют коррекции, в частности оперативного вмешательства. При развитии такого осложнения, как гангрена Фурнье, летальность составляет, по данным разных авторов, от 4 до 54 % [23] .
Профилактика баланопостита, как ни странно, начинается с младенчества. Она заключается в гигиене наружных половых органов. В первые годы жизни ребёнка она проводится родителями, затем прививается детям в виде соблюдения элементарных санитарно-гигиенических правил.
Также нужно уделять внимание вопросам раскрытия головки. Дело в том, что у младенцев кожа крайней плоти недостаточно растяжима, поэтому до 5-6-летнего возраста головка раскрывается не у всех мальчиков [8] . Данный физиологический фимоз не является заболеванием. Однако если в дальнейшем головка по-прежнему не раскрывается — это повод обратиться к врачу.
После начала половой жизни микрофлора половых органов может измениться. Любые новые бактерии, грибки и вирусы, проникающие в организм мужчины во время незащищённых половых актов, способствуют истощению его защитных сил и возникновению инфекции. Поэтому важным средством профилактики баланопостита, равно как и инфекций, передающихся половым путём, является использование презервативов.
Не менее важным средством профилактики баланопостита является соблюдение гигиенических правил у взрослых. Так называемая "болезнь грязных рук" возможна в любом возрасте. Чтобы избежать занесения инфекции, нужно не только мыть руки перед мочеиспусканием (особенно если приходится работать в антисанитарных условиях), но и регулярно принимать душ или ванну, тщательно промывая головку и крайнюю плоть.
Так как баланопостит является первым проявлением некоторых соматических заболеваний, необходимо не реже одного раза в год осуществлять контроль общего холестерина и глюкозы в крови для исключения скрытых микрососудистых нарушений.
Читайте также:

