Спорообразующий возбудитель анаэробной инфекции палочка тест ответ
Обновлено: 24.04.2024
Симптомы инфекции Clostridium difficile и ее лечение
Инфекция, вызываемая Clostridium difficile, в настоящее время является серьезной угрозой госпитальной среде, удлиняет время пребывания многих больных в стационаре, а также становится причиной смерти некоторых из них.
а) Причины и механизмы развития. Носительство С. difficile как коменсалов отмечается у 2-3% взрослых и достигает 10-20% у лиц пожилого возраста.
Заражение этим микроорганизмом происходит контактным путем через руки и другие загрязненные поверхности. С. difficile представляет собой анаэробную спорообразующую грамположительную палочку. Это очень жизнестойкая бактерия, которая резистентна ко многим дезинфицирующим средствам, включая спиртсодержащий гель, но гибнет при воздействии дезинфектантов, выделяющих хлор.
Последовательность событий, лежащих в основе заболевания, состоит в колонизации кишечника госпитализированного больного токсигенным штаммом С. difficile, который при назначении больному антибиотиков, нарушающих нормальное микробное равновесие, трансформируется из спор в вегетативные формы.
Последние, пролиферируя, вызывают клостридиальную бактериальную инфекцию. Патогенные штаммы С. difficile продуцируют энтеротоксин (токсин А) и цитотоксин (токсин В), которые связываются поверхностью клеток слизистой оболочки кишечника. Осложнения клостридиальной инфекции включают дегидратацию, нарушение электролитного баланса, развитие псевдомембранозного колита, перфорацию толстой кишки, токсический мегаколон, смерть.
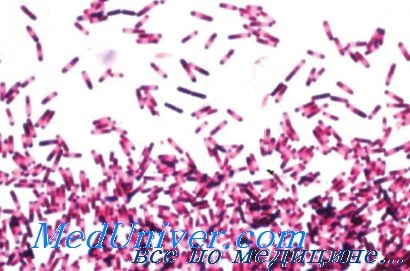
Возбудитель псевдомембранозного колита - Clostridium difficile
б) Факторы риска. Некоторые антибиотики, в частности антибиотики широкого спектра действия и клиндамицин, особенно склонны вызывать описанную последовательность событий.
Поэтому перечень предпочтительных для применения антибиотиков рекомендует микробиолог лечебного учреждения. а антибиотики, которые склонны вызывать клостридиальную инфекцию, назначают лишь при крайней необходимости.
Нередко больным до госпитализации назначают ингибиторы протонной помпы по поводу рефлюкс-эзофагита. Эти препараты способствуют росту С. difficile и потому являются серьезным фактором риска клостридиальной инфекции. Из других факторов риска следует отметить возраст больного старше 65 лет, лечение антибиотиками в последние 3 месяца до госпитализации, госпитализация в анамнезе, воспалительные заболевания кишечника, лечение цитотоксическими препаратами.
в) Симптомы и клиника. Критериями диагностики клостридиальной инфекции являются жидкий стул или токсический мегаколон и положительные результаты исследования кала на клостридиальный токсин иммуноферментным методом. При легкой форме инфекции отмечается лишь жидкий стул, но при среднетяжелой форме появляются также гипертермия, интенсивная боль в животе, кровотечение из нижних отделов ЖКТ и нейтрофилия.
Тяжелая форма характеризуется усугублением перечисленных симптомов. Диарея становится профузной, снижается уровень альбумина в сыворотке крови, повышается концентрация в ней лактата, нарушается функция почек.
г) Лечение инфекции Clostridium difficile. Важное значение имеют ранняя диагностика и своевременное лечение.
Инфекцию, вызванную Clostridium difficile, следует заподозрить при появлении у госпитализированного больного диареи, особенно если она повторилась более 3 раз в течение 24 ч. Больного следует перевести в изолированную палату в течение 4 ч и соблюдать меры, направленные на профилактику заражения и распространения инфекции (мытье рук после каждого контакта с больным, использование перчаток и фартука. Палату, где лежал больной, дезинфицируют раствором гипохлорита.
В течение 4 ч два образца кала больного направляют на микробиологическое исследование и анализ на энтеротоксин и консультируются с инфекционистом.
Лечение включает внутривенное возмещение потери жидкости. Назначают метронидазол или ванкомицин внутрь в течение 10 дней. При тяжелой форме инфекции препаратами выбора являются ванкомицин, назначаемый внутрь, и вводимый внутривенно метронидазол. Всем больным с подозрением на тяжелую форму клостридиальной инфекции следует незамедлительно выполнить рентгенологическое исследование брюшной полости и вызвать ответственного гастроэнтеролога, хирурга и микробиолога.
После консультации микробиолога ингибиторы протонной помпы и антибиотики следует отменить.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
По спектру активности антимикробные препараты делятся на: антибактериальные, антигрибковые и антипротозойные. Кроме того, все антимикробные средства делят на препараты узкого и широкого спектра действия.
К препаратам узкого спектра действия преимущественно на грамположительные микроорганизмы относятся, например, природные пенициллины, макролиды, линкомицин, фузидин, оксациллин, ванкомицин, цефалоспорины I поколения. К препаратам узкого спектра действия преимущественно на грамотрицательные палочки относятся полимиксины и монобактамы. К препаратам широкого спектра действия относятся тетрациклины, левомицетин, аминогликозиды, большинство полусинтетических пенициллинов, цефалоспорины начиная со 2 поколения, карбопенемы, фторхинолоны. Узкий спектр имеют антигрибковые препараты нистатин и леворин (только против кандиды), а широкий – клотримазол, миконазол, амфотерицин В.
По типу взаимодействия с микробной клеткой антимикробные препараты делятся на:
· бактерицидные – необратимо нарушают функции микробной клетки либо ее целостность, вызывая немедленную гибель микроорганизма, применяются при тяжелых инфекциях и у ослабленных больных,
· бактериостатические – обратимо блокируют репликацию или деление клетки, применяются при нетяжелых инфекциях у неослабленных больных.
По кислотоустойчивости антимикробные препараты классифицируются на:
· кислотоустойчивые – могут применяться перорально, например, феноксиметилпенициллин,
· кислотонеустойчивые – предназначены только для парентерального применения, например, бензилпенициллин.
В настоящее время используются следующие основные группы антимикробных препаратов для системного применения.
¨ Лактамные антибиотики
Лактамные антибиотики (табл. 9.2) из всех антимикробных препаратов наименее токсичны, так как, нарушая синтез клеточной стенки бактерий, не имеют мишени в организме человека. Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
¨ Антибиотики других групп
Антибиотики других групп (табл. 9.3) имеют различные механизмы действия. Бактериостатические препараты нарушают этапы синтеза белка на рибосомах, бактерицидные – нарушают либо целостность цитоплазматической мембраны, либо процесс синтеза ДНК и РНК. В любом случае они имеют мишень в организме человека, поэтому по сравнению с лактамными препаратами более токсичны, и должны использоваться только при невозможности применения последних.
¨ Синтетические антибактериальные препараты
Синтетические антибактериальные препараты (табл. 9.4) также имеют различные механизмы действия: ингибирование ДНК-гиразы, нарушение включения ПАБК в ДГФК и т.д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
¨ Побочные эффекты антимикробных препаратов,
их профилактика и лечение
Антимикробные препараты обладают целым рядом разнообразных побочных эффектов, некоторые из которых могут привести к тяжелым осложнениям и даже к летальному исходу.
Аллергические реакции
Аллергические реакции могут иметь место при применении любого антимикробного препарата. Могут развиться аллергический дерматит, бронхоспазм, ринит, артрит, отек Квинке, анафилактический шок, васкулит, нефрит, волчаночноподобный синдром. Чаще всего они наблюдаются при применении пенициллинов и сульфаниламидов. У некоторых пациентов развивается перекрестная аллергия на пенициллины и цефалоспорины. Зачастую отмечаются аллергии на ванкомицин и сульфаниламиды. Очень редко дают аллергические реакции аминогликозиды и левомицетин.
Профилактике способствует тщательный сбор аллергологического анамнеза. Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Раздражающее действие на путях введения
При пероральном применении раздражающее действие может выражаться в диспепсических явлениях, при внутривенном введении – в развитии флебитов. Тромбофлебиты чаще всего вызывают цефалоспорины и гликопептиды.
Суперинфекция, в том числе дисбактериоз
Вероятность дисбактериоза зависит от широты спектра действия препарата. Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Дисбактериоз требует отмены применявшегося препарата и длительного лечения эубиотиками после предварительной антимикробной терапии, которая проводится по результатам чувствительности микроорганизма, вызвавшего воспалительный процесс в кишечнике. Применяемые для лечения дисбактериоза антибиотики не должны оказывать влияния на нормальную кишечную аутофлору – бифидо- и лактобактерии. Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Нарушение толерантности к алкоголю - свойственно всем лактамным антибиотикам, метронидазолу, левомицетину. Проявляется появлением при одновременном употреблении алкоголя тошноты, рвоты, головокружения, тремора, потливости и падения артериального давления. Пациенты должны быть предупреждены о недопустимости приема алкоголя на весь период лечения антимикробным препаратом.
Органоспецифичные побочные эффекты для различных групп препаратов:
· Поражение системы крови и кроветворения – присущи левомицетину, реже линкосомидам, цефалоспоринам 1 поколения, сульфаниламидам, производным нитрофурана, фторхинолонам, гликопептидам. Проявляется апластической анемией, лейкопенией, тромбицитопенией. Необходима отмена препарата, в тяжелых случаях заместительная терапия. Геморрагический синдром может развиться при применении цефалоспоринов 2-3 поколения, нарушающих всасывание витамина К в кишечнике, антисинегнойных пенициллинов, нарушающих функции тромбоцитов, метронидазола, вытесняющего кумариновые антикоагулянты из связей с альбумином. Для лечения и профилактики используются препараты витамина К.
· Поражение печени – присущи тетрациклинам, которые блокируют ферментную систему гепатоцитов, а также оксациллину, азтреонаму, линкозаминам и сульфаниламидам. Холестаз и холестатический гепатит могут вызвать макролиды, цефтриаксон. Клиническими проявлениями служит повышение печеночных ферментов и билирубина в сыворотке крови. При необходимости применения гепатотоксических антимикробных средств более недели необходим лабораторный контроль перечисленных показателей. В случае повышения АСТ, АЛТ, билирубина, щелочной фосфатазы или глутамилтранспептидазы лечение должно быть продолжено препаратами других групп.
· Поражение костей и зубов характерны для тетрациклинов, растущих хрящей – для фторхинолонов.
· Поражение почек присуще аминогликозидам и полимиксинам, которые нарушают функции канальцев, сульфаниламидам, вызывающим кристаллурию, цефалоспоринам поколения, вызывающим альбуминурию, и ванкомицину. Предрасполагающими факторами являются старческий возраст, заболевания почек, гиповолемия и гипотензия. Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
· Миокардит – побочный эффект левомицетина.
· Диспепсия, не являющаяся следствием дисбактериоза, характерна при применении макролидов, которые обладают прокинетическими свойствами.
· Различные поражения ЦНС развиваются от многих антимикробных препаратов. Наблюдаются:
- психозы при лечении левомицетином,
- парезы и периферические параличи при применении аминогликозидов и полимиксинов за счет их курареподобного действия (поэтому их нельзя применять одновременно с миорелаксантами),
- головная боль и центральная рвота при использовании сульфаниламидов и нитрофуранов,
- судороги и галлюцинации при использовании аминопенициллинов и цефалоспоринов в высоких дозах, являющиеся результатом антагонизма этих препаратов с ГАМК,
- судороги при применении имипенема,
- возбуждение при использовании фторхинолонов,
- менингизм при лечении тетрациклинами из-за увеличения ими продукции ликвора,
- нарушения зрения при лечении азтреонамом и левомицетином,
- периферическая нейропатия при применении изониазида, метронидазола, левомицетина.
· Поражение слуха и вестибулярные расстройства – побочный эффект аминогликозидов, более свойственный 1 поколению. Так как данный эффект связан с накоплением препаратов, длительность их применения не должна превышать 7 дней. Дополнительными факторами риска являются старческий возраст, почечная недостаточность и одновременное применение петлевых диуретиков. Обратимые изменения слуха вызывает ванкомицин. При появлении жалоб на снижение слуха, головокружение, тошноту, неустойчивость при ходьбе необходима замена антибиотика на препараты других групп.
· Поражения кожи в виде дерматита характерны для левомицетина. Тетрациклины и фторхинолоны вызывают фотосенсибилизацию. При лечении этими препаратами не назначаются физиотерапевтические процедуры, и следует избегать нахождения на солнце.
· Гипофункцию щитовидной железы вызывают сульфаниламиды.
· Тератогенность присуща тетрациклинам, фторхинолонам, сульфаниламидам.
· Возможен паралич дыхательной мускулатуры при быстром внутривенном введении линкомицина и кардиодепрессия при быстром внутривенном введении тетрациклинов.
· Электролитные нарушения вызывают антисинегнойные пенициллины. Особо опасно развитие гипокалиемии при наличии заболеваний сердечно-сосудистой системы. При назначении данных препаратов необходим контроль ЭКГ и электролитов крови. При лечении используют инфузионно-корригирующую терапию и диуретики.
Микробиологическая диагностика
Эффективность микробиологической диагностики, абсолютно необходимой для рационального подбора антимикробной терапии, зависит от соблюдения правил забора, транспортировки и хранения исследуемого материала. Правила забора биологического материала включают:
- взятие материала из области, максимально приближенной к очагу инфекции,
- предотвращение контаминации другой микрофлорой.
Транспортировка материала должна с одной стороны обеспечить жизнеспособность бактерий, а с другой - предотвратить их размножение. Желательно, чтобы материал хранился до начала исследования при комнатной температуре и не более 2 часов. В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В не меньшей степени эффективность микробиологической диагностики зависит от грамотной интерпретации результатов. Считается, что выделение патогенных микроорганизмов даже в малых количествах всегда позволяет отнести их к истинным возбудителям заболевания. Условно патогенный микроорганизм считают возбудителем, если он выделяется из стерильных в норме сред организма или в большом количестве из сред, не характерных для его обитания. В противном случае он является представителем нормальной аутофлоры либо контаминирует исследуемый материал в процессе забора или исследования. Выделение малопатогенных бактерий из нехарактерных для их обитания областей в умеренных количествах свидетельствует о транслокации микроорганизмов, однако не позволяет отнести их к истинным возбудителям заболевания.
Гораздо сложнее бывает интерпретировать результаты микробиологического исследования при высевании нескольких видов микроорганизмов. В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В основе лабораторных тестов на выработку грамотрицательными микроорганизмами БЛРС лежит чувствительность БЛРС к ингибиторам бета-лактамаз, таким как клавулановая кислота, сульбактам и тазобактам. При этом, если микроорганизм семейства энтеробактерий оказывается резистентен к цефалоспоринам 3 поколения, а при добавлении к этим препаратам ингибиторов бета-лактамаз демонстрирует чувствительность, то данный штамм идентифицируется как БЛРС-продуцирующий.
Антибиотикотерапия должна быть направлена только на истинный возбудитель инфекции! Однако в большинстве стационаров микробиологические лаборатории не могут установить этиологию инфекции и чувствительность возбудителей к антимикробным препаратам в день поступления больного, поэтому неизбежным является первичное эмпирическое назначение антибиотиков. При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
Неспорообразующие анаэробы формируют основную массу нормальной микрофлоры организма человека. Например, в кишечнике их численность превосходит таковую всех остальных бактерий примерно в 103. Кроме того, анаэробы присутствуют на слизистой оболочке половых органов и ротоглотки, а также на поверхности кожи.
Анаэробный сепсис
Возбудители анаэробного сепсиса. Возбудитель тяжёлых анаэробных инфекций — Bacteroides fragilis. Наличие бета-лактамазы делает этот микроорганизм устойчивым к действию пенициллина. Кроме того, он вырабатывает протеазу, ДНКазу, гепариназу и нейраминидазу. Возбудитель обладает антифагоцитарной капсулой и угнетает процесс фагоцитоза факультативных микроорганизмов, что в свою очередь приводит к развитию микст-инфекций.
Чаще всего Bacteroides fragilis становится причиной инфекционных осложнений после хирургических вмешательств на органах брюшной полости и малого таза, а также входит в состав микрофлоры, выделяемой при абсцессах мозга, печени и лёгкого.
В ротовой полости обычно обнаруживают Prevotella melaninogenicus и фузобактерии. Они вызывают гингивит, абсцессы в полости рта, воспаление придаточных пазух носа, абсцессы мозга и лёгкого, некротизирующую пневмонию. Наряду с Borrelia vincentii они участвуют в развитии анаэробного целлюлита, ангины Симановского—Плаута-Венсана (язвенно-плёнчатая ангина) и некоторых язвенных заболеваний, например язвенно-некротического стоматита (ангины Людвига).
Peptococcus и Peptostreptococcus — анаэробные грамположигельные кокки, часто выделяемые из образцов тканей человека. Они обычно участвуют в развитии микст-инфекций (стоматологического сепсиса, абсцессов мозга и лёгкого, инфекции мягких тканей, раневых инфекций). Некротизирующий фасцит считают результатом микст-инфекции с участием анаэробных кокков, факультативных стрептококков и, возможно, Staphylococcus aureus. Заболевание быстро прогрессирует и приводит к септицемии и смерти больного.
В редких случаях причиной хронических абсцессов на фоне стоматологического сепсиса, абсцесса лёгкого, перфораций стенки кишечника и инфекций, вызванных длительным нахождением внутриматочных спиралей в полости матки, становятся актиномицетоподобные бактерии. Для их эрадикации назначают длительный курс лечения пенициллином.
Патогенез анаэробного сепсиса. Инфекции, вызванные анаэробными микроорганизмами, в большинстве случаев носят эндогенный характер. Они возникают при попадании представителей нормальной микрофлоры в стерильные среды организма (например, при перфорации толстой кишки). Условия, необходимые для роста анаэробов, могут возникнуть вследствие ишемии (при ущемлении грыжи). Кроме того, факультативные анаэробы самостоятельно создают себе необходимые условия посредством определённых реакций метаболизма (например, в глубоких язвах кожи, внутрибрюшных инфекциях).
При развитии анаэробной инфекции рост микроорганизмов стимулируют выделяемые ими протеолитические ферменты и токсичные продукты метаболизма. Кроме того, интоксикация организма факторами воспаления (например, активными формами кислорода) приводит к усилению повреждения тканей в очаге воспаления и способствует дальнейшему распространению инфекции. При отсутствии лечения анаэробный сепсис быстро прогрессирует, развивается септикопиемия и наступает смерть пациента.
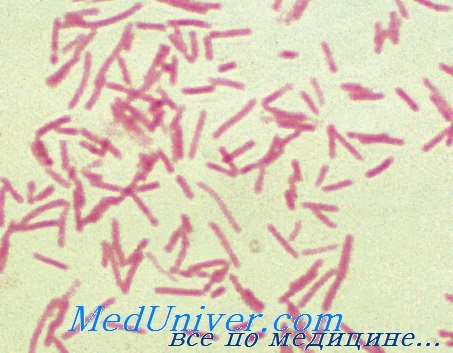
Причина анаэробного сепсиса - Bacteroides fragilis
Клиническая значимость анаэробного сепсиса
Генерализованный внутрибрюшной сепсис может стать следствием спонтанной перфорации стенки кишечника или повреждения её во время хирургической операции и приводит к формированию абсцесса (абдоминального, печёночного и др.).
В возникновении сепсиса половых путей у женщин ключевую роль играют неспорообразующие анаэробы. Заболевание вторично и развивается на фоне септического аборта, осложнений после кесарева сечения или вследствие разложения плодных оболочек и напрямую связано с воспалительными заболеваниями органов малого таза. Дисбаланс анаэробной микрофлоры влагалища может спровоцировать развитие неспецифического вагиноза.
Очень часто анаэробы участвуют в формировании полимикробного абсцесса печени, поражении желчевыводящих систем и развитии сепсиса.
Анаэробные инфекции могут возникать на фоне аспирационной пневмонии, связанной с обструкцией дыхательных путей инородным телом или карциномой. При этом часто отмечают образование абсцесса лёгкого.
Абсцесс мозга как осложнение гнойного синусита и хронического среднего отита может развиться вследствие анаэробной инфекции. Кроме того, возбудители могут размножаться в хронических кожных язвах нижних конечностей у пожилых пациентов. Fusobacterium ulcerans вызывают развитие менее распространённых тропических язв.
Лабораторная диагностика анаэробного сепсиса
Анаэробные бактерии достаточно требовательны к условиям культивирования. Кислород губителен для них. При невозможности быстрого посева исследуемого материала (сразу после отбора проб) его необходимо доставлять в лабораторию в специальных анаэробных контейнерах. Для анализа лучше отбирать пробы гноя (обычный мазок быстро высыхает). Посев материала осуществляют на обогащенные жидкие питательные среды (бульон Робертсона и др.) и среды, содержащие кровь, некоторые содержат антибиотики для подавления роста аэробных бактерий.
Чашки с посевами необходимо инкубировать в строгих анаэробных условиях.
Идентификация возбудителей основана на исследовании культуральных, биохимических и морфологических свойств (мазок окрашивают по Граму) возбудителя, а также на изучении продуктов его метаболизма с помощью газожидкостной хроматографии.
Чувствительность анаэробов к антибиотикам
Практически все анаэробы чувствительны к действию метронидазола, но в последнее время отмечают появление резистентных штаммов. Другие эффективные препараты — меропенем, пиперациллин + тазобактам, клиндамицин, хлорамфеникол, пенициллин и эритромицин. Важно отметить, что для эрадикации Bacteroides fragilis (микроорганизма, часто выделяемого при абдоминальном сепсисе) не используют пенициллин и эритромицин.
Лечение анаэробного сепсиса
Эффективность лечения анаэробных инфекций зависит от успешности проведения хирургической операции и назначения полноценной антимикробной терапии. Хирургическое вмешательство проводят для ушивания перфораций, резекции гангренозных грыж, иссечения некротических тканей при язвах, дренирования абсцесса и лечения сопутствующих заболеваний. В качестве антимикробного препарата чаще всего применяют метронидазол.
Профилактика анаэробного сепсиса. Тщательная подготовка к операции и назначение соответствующих антибиотиков (эффективных против анаэробов) помогают снизить риск возникновения анаэробных инфекций вследствие хирургического вмешательства.
Видео патофизиология сепсиса
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в раздел "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Классификация хирургической инфекции. Механизмы генерализации возбудителя инфекции
В зависимости от характера возбудителя и реакции организма различают:
- аэробную, или гнойную, хирургическую инфекцию, вызываемую микробами-аэробами (стафилококками, стрептококками, диплококками, кишечной и синегнойной палочками и др.);
- анаэробную газовую хирургическую инфекцию, которая вызывается анаэробами (бациллами газовой гангрены, злокачественного отека, расплавляющей ткани и токсического отека), а также анаэробную гнилостную хирургическую инфекцию, возбудителями которой являются анаэробы или факультативные анаэробы (вульгарный протей, спорообразующая бацилла, кишечная палочка и др.);
- общую, или генерализованную, хирургическую инфекцию, проявляющуюся в виде токсико-гнойно-резорбтивной лихорадки или в виде сепсиса;
- специфическую хирургическую инфекцию (столбняк, мыт, бруцеллез, туберкулез, некробактериоз, актиномикоз, ботриомикоз).
Кроме приведенных видов хирургической инфекции к хирургической патологии относят некоторые инвазионные заболевания — ценуроз, эхинококкоз, онхоцеркоз, телязиоз, филяриоз и др.
В зависимости от локализации выделяют гнойные заболевания:
- мягких тканей (кожа и подкожная клетчатка);
- костей и суставов;
- головного мозга и его оболочек;
- органов брюшной и грудной областей;
- отдельных органов и тканей (пальца, молочной или околоушной желез).

Механизмы, препятствующие генерализации возбудителя инфекции
Далеко не всегда микроорганизмы, попавшие в ткани, вызывают то или иное заболевание из группы острой гнойной инфекции. Важен характер ответной реакции организма, где можно выделить неспецифические и специфические механизмы защиты. К механизмам неспецифической защиты, препятствующим генерализации возбудителя инфекции, прежде всего относятся существующие в организме иммунобиологические и анатомические барьеры: неповрежденная, нормально функционирующая кожа (обладает бактерицидным свойством за счет веществ секрета потовых и сальных желез), слизистые оболочки пищевода, желудка, кишечника, органов дыхания; фасции, наружные оболочки органов; нормальная микрофлора, проявляющая антагонистическую активность по отношению к экзогенным микроорганизмам; гуморальные факторы неспецифической защиты (печеночный и лимфоцитарный барьеры, включая лимфатические сосуды и лимфатические узлы); гематоэнцефалический барьер, представленный оболочками мозга и нервных стволов; гематоофтальмический барьер, образуемый оболочками глаза; местный тканевый барьер, включающий межклеточное вещество (в первую очередь гиалуроновую кислоту), межтканевую жидкость, содержащую готовые иммунотела и ферменты; клеточные оболочки, которые, обладая избирательной способностью, в норме не пропускают внутрь клетки микроорганизмы и токсины; клеточные механизмы неспецифической защиты (фагоцитоз, т. е. способность клеток поглощать или разрушать микробные тела, и воспалительная реакция).
Кроме упомянутых барьеров в зоне повреждения и реактивного воспаления дополнительно формируется иммунобиологический барьер. Вначале он представлен воспалительным отеком, затем на границе здоровых и мертвых тканей формируется клеточный лейкоцитарно-гистиоцитарный барьер (вал). Позже он превращается в грануляционную ткань, через которую не проникают микробы и даже токсины.
Условия, способствующие развитию хирургической инфекции. Наибольшее значение имеют:
1) иммунобиологическая неполноценность кожи, слизистых оболочек; повреждения их, нормальных грануляций, других анатомических и иммунобиологических барьеров;
2) снижение иммуногенеза барьерной и защитной функции физиологической системы соединительной ткани;
3) нарушение нейрогуморальной регуляции и обмена;
4) гипо- и авитаминозы;
5) сенсибилизация организма;
6) алиментарное истощение;
7) тяжелые кровопотери;
8) дисбактериоз;
9) тяжелые травмы и интоксикации;
10) наличие в организме мертвых тканей и инородных предметов;
11) прекращение или задержка естественного выведения из организма шлаковых элементов, секретов и пр.;
12) задержка продуктов тканевого распада (экссудатов) в ранах и полостях.
Наряду с этим в развитии инфекционного процесса большое значение имеют массивность, вирулентность и патогенность микробного загрязнения и функциональное состояние вегетативного отдела центральной нервной системы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

