Средством специфической пассивной иммунотерапии сепсиса является
Обновлено: 24.04.2024
Резюме
Несмотря на многочисленные усилия проникнуть в суть воспалительных реакций, лежащих в основе патогенеза сепсиса, ряд клинических исследований по модулированию иммунного ответа с использованием антиэндотоксиновых антител, антител к фактору некроза опухоли-α (ФНО-α) и растворимых ФНО-рецепторов не смогли продемонстрировать клинические преимущества. Аналогичные результаты наблюдали при использовании гидрокортизона или интенсивном контроле уровня глюкозы путем постоянной инфузии инсулина.
Иммуномодулирующий эффект макролидов был продемонстрирован у больных хроническими легочными заболеваниями - диффузным панбронхиолитом и муковисцидозом. Благоприятные клинические исходы внебольничной пневмонии при лечении β-лактамными антибиотиками в комбинации с макролидами также объясняются иммуномодулирующим действием последних. Эффективность макролидов в отношении грамотрицательных микроорганизмов в экспериментальных моделях сепсиса послужила основанием для инициации клинического исследования иммуномодулирующего действия кларитромицина у 200 больных вентилятор-ассоциированной пневмонией и сепсисом.
Сепсис занимает 10-е место в списке ведущих причин смерти в США. Сепсис развивается у 11-12% больных отделений интенсивной терапии (ОИТ) с показателями смертности 48,4-55,2% (в ОИТ и госпитальной). Несмотря на своевременную постановку диагноза и раннее начало антибиотикотерапии, смертность у больных сепсисом по-прежнему высока. Очевидно, это объясняется вовлечением других механизмов, в частности избыточного иммунного ответа, которые приводят к развитию полиорганной недостаточности (ПОН) с неблагоприятным исходом для больного. Поэтому одним из ключевых направлений в лечении сепсиса является воздействие на иммунный ответ.
Индукторами септической реакции считаются определенные компоненты/метаболиты микробной клетки - эндотоксины (липополисахарид - ЛПС), липотейхоевая кислота, зимозан и бактериальная ДНК, которые активируют моноциты, прикрепляясь к толл-рецепторам клеточной стенки, и таким образом стимулируют внутриклеточные сигнальные пути. Это приводит к активации ядерного фактора NF-κΒ, генной экспрессии про- и противовоспалительных цитокинов, среди которых наиболее изученными являются ФНО-α и интерлейкины (ИЛ) - ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10. Гиперпродукция этих цитокинов может привести к развитию ПОН, синдрому диссеминированного внутрисосудистого свертывания и гипергликемии.
В эксперименте показано подавление кларитромицином высвобождения ИЛ-8 клеточной культурой человеческих моноцитов после их предварительной стимуляции клеточными лизатами P. aeruginosa и Escherichia coli благодаря ингибированию транскрипции ядерного фактора NF-κΒ и активатора протеина 1. Иммуномодулирующее действие макролидов при остром воспалении подтверждается данными ретроспективного анализа результатов лечения внебольничной пневмонии у 1518 больных в Испании: смертность 6,9% - при лечении комбинацией β-лактама и макролида, 13,3%- при лечении только β-лактамом. Анализ 409 случаев пневмонии, вызванной S.pneumoniae, показал снижение макролидами риска смерти в 2,5 раза, исключив влияние макролидов на исход за счет подавления атипичных патогенов. Эти данные подтвердились в ретроспективном анализе 2349 больных пневмонией.
Предпочтение кларитромицину отдано в силу того, что азитромицин не обеспечивает достаточные сывороточные концентрации, необходимые для подавления продукции провоспалительных цитокинов моноцитами. В экспериментальной модели сепсиса, вызванного полирезистентными штаммами P. aeruginosa, Klebsiella pneumoniae и E. coli (не относящимися к спектру активности кларитромицина), кларитромицин вводили внутривенно одновременно с инокуляцией бактерий либо уже после появления симптомов сепсиса (для максимального приближения к клиническим условиям). При отсутствии подавления роста бактерий кларитромицин в значительной мере ослабил воспалительную реакцию, что подтверждалось меньшей инфильтрацией тканей нейтрофилами и лимфоцитами, снижением сывороточной концентрации ФНО-α и сывороточного оксидантного стресса, а также повысил выживаемость. Максимальные сывороточные концентрации кларитромицина в этом исследовании варьировали в диапазоне 5-10 мкг/мл и достигались через 30 мин после введения.
Клиническая эффективность кларитромицина у больных сепсисом и вентилятор-ассоциированной пневмонией (ВАП)
Двести больных ВАП, осложненной нозокомиальным сепсисом, были рандомизированы в группы лечения кларитромицином и плацебо (100 пациентов в каждой группе), кларитромицин вводили в дозе 1 г/сут в виде внутривенной 1-часовой инфузии в течение 3 дней подряд с намерением достичь сывороточных концентраций 5-10 мкг/мл. Дополнительная антибактериальная терапия назначалась по усмотрению лечащего врача. В исследовании использовались международные критерии сепсиса, тяжелого сепсиса и септического шока.
Группы кларитромицина и плацебо были сопоставимы по возрасту, половой принадлежности, сопутствующим заболеваниям, тяжести сепсиса и степени органной недостаточности у пациентов, равно как и степени респираторной дисфункции (значению отношения парциального давления кислорода к фракции вдыхаемого кислорода -рО2/FiO2) и спектру используемых дополнительно иммуномодулирующих препаратов (низких доз гидрокортизона и инфузии инсулина для поддержания уровня глюкозы в пределах 80-110 мг/дл).
Этиологию сепсиса определяли посевом трахеобронхиального секрета с последующим бактериологическим исследованием до начала лечения кларитромицином, а затем на 5 и 10-е сутки. В группах плацебо и кларитромицина культуры грамотрицательных патогенов (10 5 КОЕ) выделены у 68 и 66% пациентов соответственно (разница статистически незначима), в том числе Acinetibacter baumannii (63,2%), P. aeruginosa (17,6%), K. pneumoniae (8,8%). Частота выделения указанных возбудителей в группе кларитромицина составила 54,5, 25,8 и 7,6% соответственно.
Для исключения влияния других антибактериальных препаратов на интерпретацию эффектов кларитромицина и клинических исходов среди выделенных патогенов определили пропорцию чувствительных микроорганизмов к одному или более используемым в группе антибиотикам. Таковых оказалось 62,5% в группе плацебо и 75,4% - в группе кларитромицина (р=0,44). Эрадикация патогена к 5-му дню была достигнута у 37,3% пациентов из группы плацебо и 42,6% пациентов из группы кларитромицина (р=0,31), а к 10-му дню - у 41,4 и 46,2% соответственно (р=0,82).
Обе группы сравнивали по следующим клиническим исходам/параметрам: резолюция ВАП, время до отключения от аппарата искусственной вентиляции легких (ИВЛ) (экстубации), риск смерти. Среднее время резолюции ВАП составило 15,5 сут в группе плацебо и 10,0 сут в группе кларитромицина (р=0,011). Средний период времени до экстубации составил 22,5 и 16,0 сут соответственно (р=0,047). Полученные данные согласовались с результатами оценки по шкале легочной инфекции CPIS (Clinical Pulmonary Infection Score): исходные значения составили 7,92 и 7,62 балла в группах плацебо и кларитромицина соответственно (р=0,29), на 5-е сутки - 6,10 и 5,23 балла, на 10-е - 5,88 и 5,09 (р=0,032).
Показатель выживаемости зависел от развития у пациентов септического шока в сочетании с ПОН -основной причины смерти. В группе плацебо относительный риск смерти ввиду указанных причин составил 19,0, а в группе кларитромицина он был снижен до 3,78 (р=0,043).
В целом, ПОН развилась у 22 пациентов, не имевших симптомов органной недостаточности на момент включения в исследование. Средний период времени до проявления симптомов органной недостаточности составил 3,38 сут в группе плацебо и 5,78 - в группе кларитромицина (р=0,006).
В группе кларитромицина не выявили риска развития каких-либо серьезных побочных эффектов в связи с введением препарата.
Полученные результаты могут послужить основанием для назначения кларитромицина внутривенно больным сепсисом и ВАП. Предлагаемые показания к применению кларитромицина: 1) ВАП - ввиду обеспечения кларитромицином более раннего разрешения пневмонии и более раннего отключения от ИВЛ; 2) септический шок с ПОН -ввиду существенного снижения риска смерти.
Могут рассматриваться разные гипотезы о механизме действия кларитромицина. Исходя из накопленных данных (у больных с хроническими воспалительными заболеваниями дыхательных путей и в модели экспериментального сепсиса), механизм действия кларитромицина включает модулирование иммунного ответа хозяина и инструмента общения бактерий - quоrum sensing, о чем свидетельствует пролонгирование кларитромицином промежутка времени до развития ПОН у септических больных.
Заключение
Сепсис и септический шок остаются одной из основных причин гибели больных в ОИТ. Попытки использовать ряд препаратов с разным механизмом действия с целью модулирования иммунного ответа хозяина практически не изменили показатели смертности у этой категории больных (см. рисунок).
Наблюдаемые в двойном слепом рандомизированном клиническом исследовании эффекты внутривенного лечения кларитромицином больных ВАП и сепсисом позволяют смотреть в будущее с оптимизмом. Необходимы дополнительные клинические исследования для четкого определения показаний к применению кларитромицина в качестве иммуномодулятора при сепсисе.
Иммунозаместительная терапия сепсиса - эффективность иммуноглобулина
Активация генерализованного воспаления способна приводить к развитию иммуносупрессии у больных тяжелым сепсисом. Супрессия иммунной системы может быть одним из проявлений защитных реакций организма, направленных на ограничение аутоповреждений, с другой стороны — приводить к недостаточности эрадикации возбудителей инфекции и создавать условия для развития нозокомиальных инфекций.
Обычно к препаратам, обладающим иммунокоррегирующим действием или носящим характер заместительной терапии, относят поливалентные иммуноглобулины (полиглобулины), интерфероны (а), колониестимулирующие факторы (фактор, стимулирующий рост гранулоцитов).
Иммуноглобулины для внутривенного введения при сепсисе. Препараты, содержащие повышенное количество иммуноглобулинов (гипериммунные сыворотки), применяются в медицинской практике более 100 лет. Особенно активно их использовали для лечения различных инфекционных заболеваний и сепсиса до внедрения в клиническую практику антибиотиков. Первые попытки выделения специфических иммуноглобулинов из гипериммунной сыворотки привели к резкому снижению активности препаратов, что было связано с технологическим несовершенством метода выделения иммуноглобулинов.
С середины 60-х годов XX в. вплоть до настоящего времени достаточно широко стали применять препараты, содержащие специфические IgG, сначала для внутримышечного, а затем и внутривенного введения.
Препараты, содержащие антитела определенной специфичности IgG, обычно готовят из крови доноров, предварительно иммунизированных определенным антигеном. Такие препараты обычно называются гипериммунными, т. е. содержащими высокую концентрацию специфических антител (против стафилококков, синегнойной палочки) или некоторых экзотоксинов (возбудителя столбняка, ботулизма). Механизм действия этих препаратов направлен на опсонизацию и активацию фагоцитоза определенных возбудителей инфекционных заболеваний или связывание и блокирование биологической активности экзотоксинов. Применение этих иммуноглобулинов ограничено связыванием только конкретных возбудителей или токсинов, что предполагает до их применения наличие достоверных данных, позволяющих диагностировать конкретную инфекцию.
При наличии яркой клинической картины инфекции, например столбняка или ботулизма, обоснованность применения специфического иммуноглобулина не вызывает сомнения и обладает высокой клинической эффективностью. Однако при бактериальных инфекциях, не имеющих клинических признаков, указывающих на наличие конкретного возбудителя, использование иммуноглобулиновых препаратов обычно обосновывается данными, указывающими на снижение количества IgG или выделения возбудителя из тех локусов, которые в норме должны быть стерильными (кровь, плевральная и брюшная полость, полость сустава и др.).
С середины 70-х годов XX в. были начаты исследования по созданию препаратов, содержащих иммуноглобулины различной специфичности и различных классов. В основе этого подхода лежала идея о необходимости возможно более раннего применения иммуноглобулинов до получения данных о концентрации иммуноглобулинов или микробиологических данных о возбудителе инфекции. Источником иммуноглобулинов является пул крови, полученной от тысяч доноров, который теоретически содержит широкий спектр иммуноглобулинов различной специфичности. Появление технологии стабилизации иммуноглобулинов классов М и А позволило сделать следующий шаг — повысить в препарате содержание не только IgG, но и IgM и IgA.
Насыщение иммуноглобулинами классов М и А привело к существенному расширению терапевтического действия препаратов. Одна молекула IgM теоретически способна связывать в 5 раз больше молекул антигенов, чем молекула IgG, следовательно, обладает способностью к более мощной активации фагоцитоза. Кроме того, за счет более высокой плотности рецепторов молекула IgM обладает способностью связывать антигены с менее высокой аффинностью и широкий спектр токсинов, в том числе липополисахаридов грамотрицательных бактерий. Роль IgA, кроме специфического связывания с антигенами, заключается в его способности связываться с активированными компонентами системы комплемента (С3а, С3в, С5а) и таким образом снижать активность генерализованного воспаления и, вероятно, степень аутоиммунного повреждения эндотелия сосудов мембранатакующим комплексом комплемента.
Итак, к настоящему времени имеется несколько типов иммуноглобулиновых препаратов: нормальные человеческие иммуноглобулины (содержат обычное количество иммуноглобулинов), специфические иммуноглобулины (содержащие повышенную концентрацию IgG, активных в отношении определенных возбудителей или токсинов) и насыщенные иммуноглобулиновые препараты (содержащие повышенную концентрацию иммуноглобулинов классов G, М и А). Последнюю группу еще называют полиглобулинами или полиглобулинами, насыщенными IgM.
В отношении роли иммуноглобулинов в лечении тяжелого сепсиса и септического шока имеются две точки зрения. Согласно первой, из всех иммуноглобулинов для внутривенного введения только полиглобулины, насыщенные IgM, рекомендуются для применения у больных тяжелым сепсисом и в ранней фазе септического шока, так как многочисленные сравнительные исследования и два метанализа исследований применения этих иммуноглобулинов указывают на снижение летальности у пациентов, получавших полиглобулины. Другая точка зрения отражает противоположное мнение — иммуноглобулины для внутривенного введения не должны использоваться для лечения тяжелого сепсиса у взрослых и детей, так как доказательная база их эффективности остается недостаточной.
В метанализах применения иммуноглобулинов для лечения сепсиса показано, что среди всех иммуноглобулинов эффективными в плане снижения летальности оказались только полиглобулины, насыщенные IgM. До настоящего времени единственным препаратом, отвечающим этим требованиям, является пентаглобин (Biotest). Если рассматривать доказательную базу, то с позиций современной медицины результаты метанализов считаются доказательствами высокого уровня. Следовательно, применение пентаглобина для лечения тяжелого сепсиса и ранней фазы септического шока является рациональным.
Результаты этих метанализов указывают на существенно более низкую эффективность иммуноглобулинов, содержащих только IgG, и отсутствие эффекта от применения моноклональных антител, направленных на связывание микробных токсинов (антител против липополисахарида) и медиаторов воспаления (антител к фактору некроза опухолей, растворимых антител к ИЛ-1) в лечении сепсиса и септического шока.
Гранулоцитколониестимулирующий фактор при сепсисе. Применение этого препарата у пациентов без нейтропении не рекомендуется. Несмотря на наличие результатов экспериментальных исследований по лечению абдоминального сепсиса, клинических исследований по лечению больных сепсисом без нейтропении недостаточно для рекомендаций по его клиническому использованию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Иммуноглобулины и иммуномодуляторы при сепсисе.
При септическом шоке происходит интенсивное потребление факторов клеточного и гуморального иммунитета с развитием вторичного иммунодефицита. С целью коррекции недостающего звена иммунной защиты показаны пассивная (заместительная) терапия иммуноглобулинами и введение иммуномодуляторов.
Пентаглобин (IgG и IgM), обладающий способностью связывать избыток эндотоксина в крови, образно называют "ловушкой для эндотоксина". В первые сутки развития септического шока пентаглобин вводится внутривенно по 5-8 мл/кг, затем двое суток по 4 мл/кг массы тела больного. Длительность инфузии пентаглобина должна составлять не мецее 12 часов.
Интраглобин (IgG) способствует элиминации циркулирующих иммунных комплексов, снижению образования аутоантител, активизирует Т-супрессорные клетки. Препарат вводится внутривенно в дозе 2~ 5 мл/кг на протяжении 2-3 суток.
Ронлейкин. Рекомбинантный интерлейкин-2 (ронлейкин) стимулирует пролиферацию Т-лимфоцитов, активирует их, в результате чего Т-лимфоциты становятся цитотоксическими, киллерными клетками. При этом спектр лизирующего действия клеток, активированных ронлейкином, расширяется, и они становятся способными к уничтожению патогенных микроорганизмов, Кроме того, препарат усиливает образование иммуноглобулинов В-клетками, активирует функции моноцитов и тканевых макрофагов.
Ронлейкин при септическом шоке вводится однократно внутривенно в дозе 1-2 млн. ME в сочетании с 4-8 мл 10% раствора альбумина (для стабилизации препарата), растворенным в 400 мл изотонического раствора хлорида натрия, со скоростью 80-120 мл/ч. Длительность инфузии составляет 4-5 часов.
Галавит - иммуномодулятор, влияющий на функционально-метаболическую активность макрофагов. Препарат обратимо (на 6-8 часов) ингибирует избыточный синтез факторов некроза опухоли, интерлейкина - 1, активных форм кислорода и других цитокинов. Нормализация функционального состояния макрофагов способствует восстановлению антиген-представляющей и регулирующей функции последних и восстановлению функции Т-лимфоцитов. Кроме того, галавит стимулирует нейтрофильные гранулоциты, усиливая фагоцитоз и повышая резистентность организма к инфекции.
Галавит вводится внутримышечно в дозе 200 мг, после чего препарат назначается по 100 мг 2-3 раза в сутки в течение 7 дней.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечение гнойных и септических осложнений ранений: иммунная терапия
Как известно, гнойно-септические процессы сопровождаются угнетением функциональной активности иммунокомпетентных клеток за счет иммуносупрессивного действия экзо- и эндотоксинов микроорганизмов, которое может усилиться под влиянием антибиотикотерапии. При этом уровень свободного эндотоксина увеличивается в плазме крови до 200 раз, вследствие его высвобождения из погибших бактерий, что, несмотря на уменьшение бактериемии, вносит свой вклад в усугубление симптомокомплекса гнойного процесса, провоцируя развитие генерализованной воспалительной реакции [Shenep J.L. et al., Talan D. A.].
Неэффективная терапия антибиотиками без учета спектра микрофлоры пострадавших и при несоблюдении оптимальных сроков ее проведения не только утяжеляет общее состояние больного и способствует формированию резистентных штаммов, но и увеличивает продолжительность лечения и его общую стоимость в среднем на 30%. По данным ВОЗ, летальность в группе больных с гнойно-септическими осложнениями значительно (в 10 и более раз) превышает летальность в группе больных с аналогичными исходными состояниями, но не имевших инфекционных осложнений.
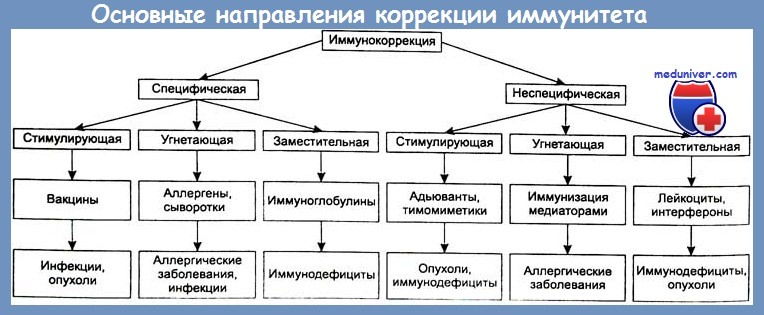
Важную роль в предотвращении генерализации местного гнойного осложнения играет адекватная иммунная терапия. Согласно современным представлениям, используются два вида воздействия на иммунный статус пострадавшего — стимулирующая и заместительная терапия.
Что касается применения иммуностимуляторов (иммуномодуляторов) при гнойно-септических осложнениях, то рядом серьезных исследований доказано, что не всегда их включение в комплекс лечения осложнений сопровождается заметным клиническим эффектом. Как справедливо отметили И. А. Ерюхин и соавт., включение иммунокорригирующих препаратов в комплексное лечение гнойно-септических осложнений хорошо обосновано теоретически, но не всегда имеет яркое клиническое подтверждение их эффективности, особенно при лечении сепсиса. Возможно, как считают авторы, это происходит потому, что учитывается тяжесть процесса, а не его причины. Кроме того, отсутствуют простые и теоретически обоснованные лабораторные и клинические методы исследований, позволяющие идентифицировать динамику воспалительного и иммунного ответа, в том числе -динамику системной воспалительной и противовоспалительной реакций [Bone R. С.].
Более эффективными являются иммуноглобулиновые препараты и иммунные антибактериальные плазмы, целесообразность применения которых обусловлена механизмами их действия, а также патогенезом иммунодефи-цитных состояний при тяжелой травме и гнойно-септических осложнениях [Румянцев А. Г. и др., Mitov I.G., Terziiski D.G., Zanetti G. et al., Talan D.A.].
Иммуноглобулин для внутривенного введения имеет ряд существенных преимуществ по сравнению с иммуноглобулинами для внутримышечного введения, так как позволяет в течение короткого времени создать в крови эффективные терапевтические концентрации антител при минимальном риске развития побочных действий. Первичным эффектом иммуноглобулинов является их способность к специфическому распознаванию чужеродных агентов и связывание с ними. Часто само связывание антителами антигенов ведет к выраженному защитному эффекту и не требует активного подключения механизмов неспецифической защиты, как это бывает в случаях нейтрализации токсинов антитоксическими иммуноглобулинами.
Высокоэффективны также и нейтрализующие антитела, которые распознают и нейтрализуют антигены возбудителей, обеспечивающих инвазивность, т. е. способствуют прекращению распространения инфекции. Следует отметить, что не всегда специфическое взаимодействие антител с антигеном приводит к выраженному защитному эффекту. В этих случаях подключаются вторичные неспецифические механизмы, которые, в свою очередь, также стимулируются антителами.
Эффективность иммунотерапии гнойно-воспалительных осложнений в зависимости от сроков её проведения
| Сроки проведения иммунотерапии от первых признаков гнойного осложнения (недели) | % хороших и отличных результатов санации ран и полостей | % хороших и отличных результатов нормализации иммунограммы | Длительность стационарного лечения (дни) |
| 1-я | 885 | 92 | 32+1,8 |
| 3-4-я | 48 | 58 | 49+3,4 |
Вторичные (неспецифические) эффекты иммуноглобулинов — это активизация неспецифических защитных процессов, направленных на нейтрализацию и выведение чужеродных антигенов. Одним из этих механизмов является взаимодействие одного из фрагментов молекулы иммуноглобулина (Fc-фрагмент) с компонентами системы комплемента. За счет активации комплемента происходит лизис комплекса антиген-антитело.
Имуноглобулипы не только связывают генетически чужеродные организму молекулы и клетки, но и выполняют эффекторные и иммуномодулирующие функции, обусловленные усилением физиологических последствий связывания антигена. Кроме того, иммуноглобулины способны регулировать активность Т- и В-лимфоцитов, макрофагов, многократно усиливать антигенспецифический ответ, опосредованный Т-лимфоцитами и комплементом [Климович В.Б., Imbach P. et al.].
Положительный результат от включения в комплексное лечение как стандартного донорского иммуноглобулина, так и обогащенного IgM — пентаглобина — зависит от дозы и сроков их применения. Лишь при условии нейтрализации бактериальных эндотоксинов в течение первых суток после тяжелой травмы или от начала септического процесса можно рассчитывать на уменьшение биологических последствий эндотоксемии.
Одним из препаратов заместительного действия, компенсирующего функциональную недостаточность нейтрофилов у пациентов с гнойно-воспалительными осложнениями, является лейкокоицентрат донорской крови. Приемлемой считается терапевтическая доза, включающая более 1010 клеток, предпочтительнее доза, близкая к 1011 клеток. Трансфузии меньшего количества лейкоцитов не сопровождаются выраженным клиническим эффектом [Hubel K.D.C. et al., Van Buzik J.-A.H., Weisdorf D. J., Ying-Wei Lin et al.].
Несмотря на определенные успехи клинического использования лейкоцитной массы при лечении септических больных, переливание гранулоцитов не вошло в широкую практику лечения инфицированных пациентов с лейкопенией или фагоцитарной недостаточностью. Это обусловлено прежде всего тем, что имеются трудности получения этого компонента крови и его хранения. Установлено, что гранулоциты начинают терять свои функциональные свойства уже через 6 ч после их выделения, поэтому перелиты они должны быть в течение 12 ч после заготовки.
Важным условием применения лейкоцитной массы является строгое соблюдение схемы введения: интервал между трапсфузиями не должен быть более 2 сут. В противном случае можно спровоцировать иммунизирующий эффект, сопровождающийся выработкой противолсйкоцитарных антител. В то же время введение лейкоцитов иммунокомпрометированным пациентам с Т-лимфопенией и относительной недостаточностью Т-хелперов не сопровождается образованием противолейкоцитарных антител.
Суммируя накопленный опыт применения иммунных препаратов в лечении гнойно-воспалительных осложнений в послеоперационном периоде у пострадавших с множественными и сочетанными ранениями груди, следует признать, что использование иммунотропных препаратов существенно улучшает результаты лечения. Наиболее высокая эффективность лечения гнойно-воспалительных осложнений отмечена при проведении иммунотерапии на фоне адекватной антибактериальной, инфузионной, трансфузионной терапии, направленной на улучшение микроциркуляции, уменьшение интоксикации и способствующей выведению иммунных комплексов.
Сравнительный анализ таких показателей, как продолжительность периода санации гнойного очага, улучшение состояния больного, длительность стационарного лечения и положительная динамика параметров иммунограм-мы, свидетельствует о необходимости применения иммунотропных препаратов в ранние сроки развития гнойных осложнений. В наших наблюдениях при таком подходе удалось существенно сократить период купирования гнойного процесса у 88% больных, в результате чего средняя продолжительность лечения больных этой группы составила 32±1,8 дней. Назначение иммунотропных препаратов позже 20-х суток от начала гнойно-воспалительного процесса сопровождалось улучшением состояния и ускорением процесса очищения гнойных полостей только у 48 % больных. Длительность стационарного лечения у этих пациентов была значительно большей и составила в среднем 49+3,4 дня.
Положительная динамика параметров иммунограммы и клинического анализа крови выявлена у 92% больных при назначении иммунотерапии в ранние сроки и у 58% больных — при её проведении в поздние сроки от начала гнойно-воспалительного осложнения.
Необходимо отметить, что не во всех случаях применения иммунопрепаратов в оптимальные сроки были отмечены положительные сдвиги иммунного гомеостаза. В трех наблюдениях после применения тактивина и в двух - - миелопида в составе комплексного лечения пострадавших с гнойными осложнениями вопреки ожидаемому эффекту было отмечено усиление дисбаланса клеточных звеньев иммунной системы со снижением числа Т- и В-клеток и более выраженное подавление кислородного метаболизма нейтрофилов, обеспечивающего бактерицидность в процессе фагоцитоза.
Как правило, отрицательная динамика параметров иммунограммы имелась при проведении иммунотерапии на фоне сохраняющегося гнойного очага, в том числе и при его неадекватном дренировании. В таких случаях иммуносупрессивное действие гнойной интоксикации превалировало над иммуностимулирующим влиянием использованных препаратов. У этих пациентов с помощью иммунотерапии удавалось лишь предупредить развитие фатальной иммунодепрессии при продолжающейся гнойной интоксикации. Отсутствие положительной динамики иммунограммы на фоне лечения является прогностически неблагоприятным признаком и свидетельствует о том, что характер гнойного процесса приобретает признаки хронического. Это заставляет хирурга совместно с клиническим иммунологом искать причины неблагоприятного развития событий, в первую очередь — исключая наличие недренированных очагов гнойной инфекции.
Таким образом, выбор иммунопрепаратов определяется направленностью и степенью изменения параметров отдельных звеньев иммунной системы. Лейкопения и снижение фагоцитарной активности нейтрофилов при наличии гнойного процесса диктуют необходимость применения препаратов, активирующих лейкопоэз и созревание лейкоцитов, а также проведение заместительной терапии донорской лейкоцитной массой. Если на ранней стадии развития гнойного процесса имеется лимфопения и снижение фагоцитарной активности нейтрофилов, показана комбинация тимических пептидов или миелопептидов с иммуноглобулином для внутримышечного введения. При сочетанной недостаточности фагоцитарного и лимфоцитарного звеньев иммунной системы на фоне сохраняющейся интоксикации и повышения уровня циркулирующих иммунных комплексов эффективно (помимо использования иммунокорригирующих препаратов) проведение лечебного плазмафереза.
Видео иммунограмма в норме и при патологии
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сепсис представляет собой заражение крови продуктами гнилостного распада, имеющего место в организме вследствие воспалительного неадекватного леченого процесса. По сути, сепсис - это воспаление, распространившееся на весь организм. Это системный ответ на обильное пребывание в крови бактерий, независимо от места их проникновения и скопления.
Это достаточно опасное для организма состояние, стремительно идущее к летальному исходу и потому требующее немедленной и адекватной терапии.
Вопреки постоянно совершенствующимся медицинским технологиям сепсис сегодня, как и много лет назад остается актуальной проблемой. Для лечения сепсиса используются новые поколения антибактериальных препаратов, однако и это не устраняет болезнь из рейтинга причин смерти в отделениях интенсивной терапии. Примечательно, что 18% из тех, по отношению к кому применялась интенсивная терапия лечения в условиях медицинского учреждения, сталкивались с развитием сепсиса, еще в 63% случаев он сопровождал внутрибольничные инфекции.
К инфекциям, распространение которых по организму рискует завершиться сепсисом, относят:
- бактерии
- стафилококк,
- стрептококк,
- пневмококк,
- синегнойная палочка,
- клебсиелла,
- кандида,
- герпес,
- токсоплазмоз.
Для того чтобы инфекционный процесс в организме перерос в сепсис необходимо сочетание трех обстоятельств:
- наличие возбудителя инфекции;
- отрицательное состояние первичного очага инфекции;
- соответственная реактивность организма.
Риск развития сепсиса обуславливается не столько свойствами инфекции, сколько ее концентрацией в первичном очаге, распространением отсюда вглубь организма и ток крови. Непоследнюю роль играет и резистентность организма, которая легко подавляется под воздействием неблагоприятных факторов. Среди последних:
- любые заболевания
- эндокринные и обменные, в частности сахарный диабет,
- онкологические,
- гематологические,
- иммунологические,
- низкое содержание белка,
- хронические гиповитаминозы,
Механизм развития сепсиса берет начало с того, что из первичного очага инфицирования через кровеносные или лимфатические сосуды происходит, соответсвенно, гематогенная или лимфогенная диссеминация инфекции. Следственно, происходит образование вторичных септических очагов, так называемых метастазов, из которых инфекция также распространяется в кровь. Каковой будет локализация метастазов, зависит от типа возбудителя. Гнойники могут образовываться в любых внутренних органах.
![сепсис]()
При сепсисе случаются органно-системные повреждения, чем продолжается механизм заболевания. Это случается в силу отсутствия контроля над распространением провоспалительных медиаторов из первичного очага инфекции. Затем происходит их активация под влиянием макрофагов, нейтрофилов, лимфоцитов и других клеток в любых органах и тканях; повторно выделяются те же провоспалительные медиаторы и повреждается эндотелий.
Разновидности сепсиса
Чаще всего сепсис случается после воспалительного процесса конкретной локализации. Однако не менее распространен и раневой сепсис. И тот, и другой развивается на фоне сниженной резистентности макроорганизма к распространяющейся патогенной микрофлоре и на фоне ослабленного иммунитета. Упадок защитных способностей организма вследствие воспаления, раны, операционного вмешательства или тяжелого заболевания нередко дополняется крупной кровопотерей и недостаточным питанием.
Частыми источниками септической инфекции медики называются нагноения при выше описанных условиях. Нечто подобное способно развиться и при местных гнойных заболеваниях как то фурункул, карбункул, флегмона.
Зависимо от первичного очага сепсиса и его происхождения различают:
- хирургический сепсис - вследствие нагноения в ране, локализированных гнойниках;
- акушерско-гинекологический сепсис - вследствие родов или абортов, случившихся в нестерильных условиях, когда микротрещины или разрывы в родовых путях становятся "входными воротами" для инфекции;
- урологический сепсис - вследствие гнойных процессов и отяжеленных воспалений в мочеполовых органах, что обычно сопровождается и застоем, инфицированием мочи;
- риногенный, тонзилогенный, отогенный сепсис - редкие формы заражения крови, которые берут начало с локализации инфекции в полости рта, носу, околоносовых пазухах, носоглотке, ухе; для того чтобы течение инфекции обрело столь тяжелую форму необходимым условием становится тромбофлебит кавернозного синуса или тромбоз вен клетчатки глазницы, тромбофлебит сигмовидного и каменистого синусов.
Кроме того, выделяют септичемическую и септикопиемическую разновидность сепсиса:
- септицемическая - не сопровождается образованием метастатических очагов гнойной инфекции, однако склонная к перерастанию в септикопиемическую;
- септикопиемическую - характеризуется образованием метастатических очагов гнойной инфекции, откуда происходит все более глубокое распространению инфекции.
Заражение крови может протекать в четырех формах:
- молниеносная - несколько суток;
- острая - 5-7 суток;
- подострая - менее 6 недель;
- хроническая - более 6 недель.
Симптомы сепсиса
Коварство заболевания заключается в риске его симптомов оказаться размытыми. Объясняется это тем, что в разгар первичного заболевания свойства возбудителей поддаются изменениям из-за массивной антибиотикотерапии, несколько угнетаются, однако не всегда сам возбудитель уничтожается. Такое латентное его пребывание в организме чревато дальнейшим распространением даже при относительно невысокой температуре тела. Хотя именно устоявшаяся лихорадка гектического типа считается отличительным признаком сепсиса при наличии предпосылок к тому, то есть выше перечисленных факторов. Кроме нее возможны:
- обильное потоотделение при снижении температуры тела,
- в соответствии со скачками температуры скачкообразным становится и пульс,
- ознобы и головная боль, общая слабость,
- рвота и понос,
- утрата аппетита,
- обезвоживание и стремительная утрата веса,
- землистый цвет кожных покровов (если нарушается функция печени, кожа желтеет), утрата ими эластичности и упругости;
- образование флегмон и абсцессов различной локализации.
Возможны изменения психоэмоционального статуса вплоть до грубых общемозговых расстройств - коматозное состояние. В последующем присоединяются воспалительные изменения со стороны внутренних органов: почек, эндокарда, печени, кишечника, селезенки.
При сепсисе наблюдается тахикардия (более 90 ударов в минуту) и тахипноэ (более 20 вдохов в минуту).
Диагностика сепсиса
Заподозрить сепсис стоит если при инфекционно-воспалительном заболевании, вследствие ранения или операционного вмешательства лихорадка держится более 5 дней, и скачки температуры становятся немотивированными. Лабораторные анализы крови показывают:
- лейкоцитоз;
- лейкопению;
- палочко-ядерный сдвиг влево;
- тромбоцитопению.
Положительные результаты бактериологического исследования крови - обнаружение гемокультуры. Для получения достоверного результата необходим 3-кратный забор крови в объеме 20-30 мл. с интервалами 1 ч. во время подъема температуры по возможности до начала антибиотикотерапии.
При диагностике на предмет наличия сепсиса важно различить:
- синдром системного воспалительного ответа - системная реакция организма на воздействие различных сильных раздражителей (инфекция, травма, операция и т.д.);
- сепсис - та же совокупность изменений, что и при ССВО, но дополнительно обнаруживаются патогенны в одной или нескольких тканях, признаки перитонита, пурпуры, пневмонии и пр.;
- отяжеленный сепсис - клиническая картина сепсиса дополняется гипотензией и гипоперфузией, нарушением функций отдельных органов, например, печени или почек;
- септический шок - тяжелая форма заражения формы, когда нарушение функций не удается восстановить даже интенсивной терапией и реанимирующими мероприятиями; отличается высокой летальностью.
Лечение сепсиса
Лечение сепсиса представляет собой комплекс процедур, которые проводятся преимущественно в условиях медицинского учреждения. Так называемая интенсивная терапия состоит из мер, нацеленных на санацию очага инфекции, и дополняется антибиотикотерапией, призванной устранить инфекцию в крови. Отмечается, что сохранение жизни больного и устранение органных дисфункций не будет возможным без назначения интенсивной терапии.
Этиотропное лечение сепсиса должно быть не просто своевременным, а максимально ранним. Изначально препараты назначаются в столь высоких дозировках, чтобы обеспечить достаточную концентрацию действующего вещества в зараженной крови, а также в очагах инфекции. Этиотропная терапия может быть эффективной лишь при условии выявления возбудителя, конкретной инфекции, а также его чувствительности к выбираемым антибиотикам. Верный выбор антибиотика лежит в основе качественного лечения сепсиса.
Этиотропная терапия длится вплоть до достижения устойчивой положительной динамики состояния пациента и исчезновения основных симптомов инфекции. Если этого не происходит в течение первой недели лечения, необходимо провести дополнительное обследование для выявления осложнений или очага инфекции другой локализации.
Если установить первичный очаг инфекции не удается, равно как и выявить тип возбудителя, как минимум необходимо определить условия возникновения сепсиса - вследствие пребывания пациента в клинических условиях и развития инфекции на фоне определенной болезни (госпитальная форма) или внебольничная.
Как показывает практика, внебольничный сепсис поддается лечению:
- нефалоспоринами 3-го и 4-го поколения,
- фторхинолонами - благодаря широкому спектру действия являются препаратами выбора при лечении инфекций неизвестной этиологии
Госпитальная форма сепсиса лечится:
- карбапенемами - препаратами с широким спектром действия, к которым внутрибольничные штаммы грамнегативных бактерий низкорезистентны.
Лечение разных форм сепсиса определяется его происхождением:
- при анаэробном сепсисе применяются метронидазол, линкомицин, клиндамицин;
- для лечения сепсиса, вызванного грамотрицательными бактериями, уместен препарат с моноклональными антителами против эндотоксина грамотрицательных бактерий;
- сепсис вследствие распространения грибковой инфекции лечится амфотерными оксидами и флуконазолом;
- при стафилококковом сепсисе эффективен противостафилококковый иммуноглобулин, а также внутривенное введение противостафилококковой плазмы;
- когда инфекционный процесс достиг уровня генерализированной септической болезни, назначают ацикловир, ганцикловир, фамцикловир.
Параллельно с этиотропными средствами целесообразно использование пассивной иммунотерапии, среди разнообразия которых предпочтение отдается иммуноглобулину, идеально подходящему для внутривенного введения.
Ведущую роль в лечении сепсиса любой локализации играет инфузионная терапия. Она относится к первичным мероприятиям поддержания гемодинамики и сердечного выброса. Основными задачами, которые стоят перед врачом и которые удается решить посредством инфузионной терапии, оказываются:
- восстановление адекватной тканевой перфузии,
- нормализация клеточного метаболизма,
- коррекция расстройств гомеостаза,
- снижение концентрации медиаторов септического каскада и токсических метаболитов.
Использование этого алгоритма действий способствует выживаемости при септическом шоке и тяжелом сепсисе. Объем инфузионной терапии рекомендуют поддерживать на таком уровне, чтобы давление заклинивания в легочных капиллярах не превышало коллоидно-онкотическое давление плазмы. Это позволяет исключить риск отека легких и увеличить сердечный выброс.
Инфузионная терапия - это составляющая общей целенаправленной интенсивной терапии сепсиса. Для инфузий применяют кристаллоидные и коллоидные инфузионные растворы. Отмечается, что адекватная коррекция венозного возврата и уровня перенапряжения требует вдвое, а порой и вчетверо большего введения кристаллоидов, нежели коллоидов. Инфузия кристаллоидов более связана с риском отека тканей, а их гемодинамический эффект менее продолжителен, чем у коллоидов. Вместе с тем кристаллоиды не влияют на коагуляционный потенциал и не вызывают анафилактических реакций. В связи с этим выбор того или иного раствора диктуется особенностями течения сепсиса в конкретном случае:
- степенью гиповолемии,
- фазой ДВС-синдрома,
- наличием периферических отеков,
- уровнем альбумина крови,
- тяжестью острого легочного повреждения.
При выраженном дефиците объема циркуляционной крови показаны плазмозаменители:
- декстраны,
- гидроксиэтилкрохмал - имеет потенциальное преимущество перед декстранами вследствие низкого риска утечки через мембрану и отсутствия клинически значимого влияния на гемостаз.
В ранние сроки в связи с наличием тромбогеморрагического синдрома назначают гепарин, введение которого проводят под контролем клинических проявлений и коагулограммы.
В случае развития тяжелой степени сепсиса проноз неблагоприятен, оправданным становится гемодиализ. Для профилактики стрессовых язв в пищеварительном канале обязательны ингибиторы протонной помпы или блокаторы гистаминорецепторов. Назначают также препараты, ингибирующие протеолиз.
Читайте также: