Стафилококк в молочном производстве
Обновлено: 24.04.2024
Стандарт распространяется на молоко и молочные продукты, закваски, бактериальные концентраты и препараты и устанавливает два метода определения Staphylococcus aureus в определенном объеме или навеске продукта - определение количества с предварительным обогащением; определение количества без предварительного обогащения.
ГОСТ 30347-97
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МОЛОКО И МОЛОЧНЫЕ ПРОДУКТЫ
МЕТОДЫ ОПРЕДЕЛЕНИЯ
STAPHYLOCOCCUS AUREUS
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ
ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
Минск
Предисловие
ВНЕСЕН Госстандартом Российской Федерации
2 ПРИНЯТ Межгосударственным советом по стандартизации,метрологии и сертификации(протокол № 11 от 25 апреля 1997 г.)
За принятие проголосовали:
Наименование национального органа по стандартизации
Главная государственная инспекция Туркменистана
3 Постановлением Государственного комитета Российской Федерациипо стандартизации, метрологии и сертификации от 25 сентября 1997 г. № 341межгосударственный стандарт ГОСТ 30347-97 введен в действие непосредственно вкачестве государственного стандарта Российской Федерации с 1 июля 1998 г. справом досрочного введения
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Июль 2000 г.
Содержание
МОЛОКО И МОЛОЧНЫЕ ПРОДУКТЫ
Методы определения Staphylococcus aureus
Milk and milk products. Methods for determination of staphylococcus aureus
Настоящий стандартраспространяется на молоко и молочные продукты, закваски, бактериальныеконцентраты и препараты и устанавливает два метода определения Staphylococcus aureus в определенном объеме илинавеске продукта - определение количества с предварительным обогащением;определение количества без предварительного обогащения.
Методопределения Staphylococcus aureus с предварительнымобогащением основан на высеве навески продукта и разведении его в жидкую селективнуюсреду, инкубировании посевов, учете положительных пробирок (колб), пересеве наплотные селективные среды с последующим подтверждением принадлежности выросшихколоний к Staphylococcus aureus .
Методопределения количества Staphylococcus aureus безпредварительного обогащения посевом на агаризованные селективные среды основанна высеве продукта или разведении его на поверхности плотной среды,инкубировании, подсчете типичных колоний Staphylococcus aureus споследующим подтверждением выросших колоний к Staphylococcus aureus поплазмокоагулирующей способности.
В настоящемстандарте использованы ссылки на следующие стандарты:
ГОСТ9225-84 Молоко и молочные продукты. Методы микробиологического анализа
ГОСТ10444.11-89 Продукты пищевые. Методы определения молочнокислыхмикроорганизмов
ГОСТ27583-88 Яйца куриные пищевые. Технические условия
3.1 Аппаратура,материалы, реактивы по ГОСТ9225 со следующими дополнениями:
сухая плазмакроличья, цитратная;
контрольныйштамм Staphylococcus aureus ;
калия теллурит[2],раствор с массовой концентрацией 10 г/дм 3 ;
глицин [1],раствор с массовой концентрацией 200 г/дм 3 ;
натрия пируват[8],раствор с массовой концентрацией 200 г/дм 3 ;
фуксин основной[5],спиртовой раствор с массовой концентрацией 50 г/дм 3 ;
яйца куриныепищевые по ГОСТ27583;
3.2 Питательные среды
3.2.1Гидролизованное и стерильное обезжиренное молоко по ГОСТ10444.11 (3.3.1 и 3.3.3).
3.2.3Желточную эмульсию готовят следующим образом.
Свежее куриноеяйцо моют водопроводной водой, затем протирают ваткой, смоченной в спирте, иобсушивают. Отделяют желток и вносят его в 100 см 3 стерильногораствора хлористого натрия по ГОСТ9225. Тщательно перемешивают. Приготовленная эмульсия может храниться притемпературе 0-5 °С не более 72 ч.
3.2.4 Солевой бульон*:
Состав: натрийхлористый ( NaCl ) - 7,5 г;
питательный сухой бульон -1,5 г;
или гидролизованное молоко -100 см 3 .
Приготовление:в 100 см 3 дистиллированной воды вносят 1,5 г сухого питательногобульона, кипятят 1-2 мин, фильтруют через ватный тампон, добавляют 7,5 г NaCl ,устанавливают рН (6,9 ± 0,1).
Разливают впробирки или колбы и стерилизуют при температуре (121 ± 1) °С в течение (10 ±1) мин.
Или к 100 см 3 гидролизованного молока добавляют 7,5 г NaCl , устанавливают рН (6,9 ±0,1), разливают и стерилизуют, как указано выше.
Состав: питательный агар***
для культивированиямикроорганизмов (на основе гидролизата кильки) [10]- 35 г
питательный агар II ***
(на основе гидролизатакормовых дрожжей) [10]- 24 г;
натрий хлористый ( NaCl ) -75 г;
эмульсия желточная - 50,0 см 3 ;
вода дистиллированная - 1 дм 3 .
Приготовление:в 1 дм 3 дистиллированной воды вносят 36 г питательного агара длякультивирования микроорганизмов или 24 г питательного агара сухого II ,добавляют 75 г хлористого натрия ( NaCl ), кипятят до полногорасплавления агара, фильтруют через ватный тампон, разливают во флаконы иликолбы и стерилизуют при температуре (121 ± 1) °С в течение (20 ± 1) мин. Послестерилизации охлаждают до температуры (45 ± 1) °С и добавляют 50 см 3 предварительно подготовленной желточной эмульсии. Смесь тщательно перемешиваюти разливают в чашки Петри. Чашки со средой хранят в холодильнике не более 5сут.
3.2.6 Молочно-солевой агар**
Состав: питательный агар*** для культивированиямикроорганизмов (на основе гидролизата кильки) [10]- 35 г
или питательныйагар II *** (на основе гидролизата кормовых дрожжей) [10]- 24,0 г; натрий хлористый ( NaCl ) - 75,0 г;
молокообезжиренное - 100 см 3 ;
водадистиллированная - 1 дм 3 .
Приготовление:среду готовят, указано в 3.2.5,но после охлаждения до температуры (45 ± 1) °С добавляют вместо желточнойэмульсии 100 см 3 стерильного обезжиренного молока. Смесь тщательноперемешивают и разливают в чашки Петри. Чашки со средой хранят в холодильникене более 5 сут.
3.2.7 Агар Байрд-Паркера * 4
дрожжевой экстракт [3]- 1,0 г;
* Допускается применениесолевого бульона [9],который готовится согласно указанию на этикетке.
** Допускается использоватьсолевой агар [9],который готовится согласно указанию на этикетке и к которому после стерилизациидобавляется желточная эмульсия или обезжиренное молоко.
*** При изменении заводом-изготовителемколичества вносимой среды на 1 дм дистиллированной воды, количество средывносится согласно указанию на этикетке.
* 4 Допускается использовать агар Байрд-Паркера [9].Среда готовится согласно указанию на этикетке.
мясной экстракт - 5,0 г;
литий хлористый, гексагидрат[4] -5,0 г;
вода дистиллированная - 1 дм 3 .
Раствор пирувата натрия:
пируват натрия [8]- 20,0 г;
вода дистиллированная - 100см 3 .
вода дистиллированная -100,0 см 3 .
3.2.7.1Приготовление основы среды: в 1 дм 3 дистиллированной воды вносят 10г триптона, 5 г мясного экстракта, 1 г дрожжевого экстракта, 5 г хлористоголития, 20 г агара.
При отсутствиимясного экстракта, триптона и дрожжевого экстракта вместо дистиллированной водыприменяют 1 дм 3 мясопептонного бульона или питательный агар длякультивирования микроорганизмов сухой или питательный агар сухой II [10].
Все компоненты,внесенные в 1 дм 3 дистиллированной воды (мясопептонный бульон),нагревают и перемешивают до полного растворения, охлаждают до температуры 50-60°С. Устанавливают рН (7,2 ± 0,1), разливают в колбы или бутылки по 90 см 3 и стерилизуют при температуре (121 ± 1) °С в течение (20 ± 1) мин.
Прииспользовании сухой среды в 1 дм 3 дистиллированной воды вносят 36 гпитательного агара для культивирования микроорганизмов или 24 г питательногоагара сухого II , добавляют 5 г хлористого лития. Нагревают до полногорастворения, охлаждают до температуры 50-60 °С, устанавливают рН (7,2 ± 0,1),разливают и стерилизуют, как указано выше.
Готовую основусреды хранят не более 30 сут при температуре (6 ± 2) °С.
3.2.7.2Перед использованием к 90 см 3 расплавленной основы среды добавляютасептически стерилизованные фильтрованием через мембранный фильтр растворы: 6,3см 3 раствора глицина, 5 см 3 раствора пирувата натрия; 1см 3 раствора теллурита калия; 5 см 3 желточной эмульсии.
Допускаетсярастворы глицина, пирувата натрия, теллурита калия и желточную эмульсиюготовить в асептических условиях на стерильной дистиллированной воде.
Послетщательного перемешивания приготовленную среду разливают в чашки Петри.
Чашки со средойможно хранить не более 48 ч.
4.1 Приготовление растворов и реактивов
4.1.1 Раствор плазмыкроличьей цитратной готовится согласно инструкции по применению плазмы,прилагаемой к упаковке.
4.1.2Растворы и реактивы для окраски препаратов готовят по ГОСТ9225.
4.1.3Приготовление реактивов для окраски по Грому
4.1.3.1 Приготовление реактива 1
В 100 см 3 этилового спирта растворяют 0,5 г кристаллического фиолетового [6].
4.1.3.2Приготовление реактива 2
К 96 см 3 спиртового раствора йодистого калия массовой концентрацией 5 г/дм 3 добавляют 2 см 3 спиртового раствора основного фуксина [5]массовой концентрацией 50 г/дм 3 и 2 см 3 спиртовогораствора йода массовой концентрацией 50 г/дм 3 .
Йодистый калийрастворяют в спирте на водяной бане при температуре (45 ± 5) °С при постоянномпомешивании.
4.2Отбор и подготовка проб по ГОСТ9225.
5.1 Метод определения количества Staphylococcus aureus спредварительны м обогащением
5.1.1 Подготовкаи проведение контроля
5.1.1.1 Изнавески продукта готовят ряд десятикратных разведений по ГОСТ9225 так, чтобы можно было определить наличие или отсутствие Staphylococcus aureus в определенной массе(объеме), указанной в нормативном документе на конкретный продукт.
5.1.1.2Навеску продукта или его разведения засевают по 1 см 3 в пробирки иликолбочки с солевым бульоном (3.2.4).
Соотношениемежду количеством высеваемого продукта или его эквивалентным разведением ипитательной средой 1 : 10.
Пробирки и колбочкис посевами выдерживают в термостате при температуре (37 ± 1) °С в течение 24 ч.
5.1.1.3Для подтверждения принадлежности микроорганизмов, выросших на солевом бульоне,к Staphylococcus aureus делают пересев петлей избульона для получения изолированных колоний на чашки Петри с подсушеннымисредами типа Байрд-Паркера (3.2.7),желточно-солевой агар или молочно-солевой агар (3.2.5; 3.2.6).
Чашки спосевами выдерживают в термостате при температуре (37 ± 1) °С в течение 24-48ч.
5.1.1.4После термостатирования посевы просматривают и отмечают рост характерныхколоний.
На желточно-солевомагаре колонии Staphylococcus aureus имеют форму плоских дисковдиаметром 2-4 мм белого, желтого, кремового, лимонного, золотистого цвета сровными краями; вокруг колоний образуется радужное кольцо и зона помутнениясреды.
Намолочно-солевом агаре колонии Staphylococcus aureus растутв виде непрозрачных круглых колоний, окрашенных от белого до оранжевого цвета,диаметром 2-4 мм, слегка выпуклых.
На средеБайрд-Паркера колонии Staphylococcus aureus растутв виде черных, блестящих, выпуклых колоний диаметром 1-1,5 мм, окруженных зонойпросветления среды шириной 1-3 мм.
5.1.1.5С каждой чашки Петри отбирают не менее пяти характерных колоний и пересеиваютна поверхность скошенного питательного агара, как указано в 3.2.5, но без добавления хлористогонатрия и желточной эмульсии.
Посевывыдерживают в термостате при температуре (37 ± 1) °С в течение 24 ч. У выросшихколоний определяют отношение к окраске по Граму и коагулированию плазмыкролика.
5.1.1.6Из пяти изолированных, характерных для Staphylococcus aureus колоний,делают препараты, окрашивают по Граму и микроскопируют.
Дляприготовления препарата на чистое и охлажденное после фламбирования предметноестекло наносят петлей каплю дистиллированной воды, в которую вносят петлейнебольшое количество агаровой культуры, не размешивая в воде. Затем вносятпетлей каплю реактива 1, приготовленного по 4.1.3.1. Смесь распределяют научастке примерно 1 см 2 , просушивают при температуре (20 ± 2) °С ификсируют, медленно пронося предметное стекло над пламенем горелки. На одномстекле можно готовить по шесть - восемь мазков, отделяя их один от другоголиниями, проведенными с лицевой стороны стекла.
Препаратополаскивают водой и тщательно просушивают фильтровальной бумагой.
Послепросушивания на препарат наносят с избытком реактив 2, приготовленный по4.1.3.2 так, чтобы жидкость покрыла всю поверхность стекла. Продолжительностьокрашивания 0,5 -1 мин. После окрашивания препарат быстро ополаскиваютпроточной водой, направляя струю под углом на стекло, помещенное вертикально.Препарат просушивают фильтровальной бумагой и просматривают под микроскопом с иммерсионнойсистемой. Микробы, красящиеся по Граму, будут темно-фиолетового цвета, некрасящиеся по Граму - красного цвета.
Стафилококкиокрашиваются по Граму положительно (темно-фиолетового цвета), имеютшарообразную форму и располагаются скоплениями, чаще всего напоминающимигроздья винограда.
5.1.1.7Постановка реакции плазмокоагуляции
В пробирку с0,5 см 3 разведенной кроличьей плазмы вносят петлю суточной агаровойкультуры. Внесенную культуру тщательно размешивают. Одну пробирку с плазмойоставляют незасеянной, а в другую засевают контрольный штамм Staphylococcus aureus (коагулазоположительныйстафилококк). Пробирки помещают в термостат и выдерживают при температуре (37 ±1) °С в течение 3-6 ч. Если через 6 ч коагуляции плазмы не произошло, тооставляют эти пробирки до 24 ч. Если через 24 ч плазма не свернулась, тоиспытуемую культуру стафилококка относят к коагулазоотрицательной.
При определениикоагулазной активности реакцию считают отрицательной в тех случаях, когда вплазме не образуются отдельные нити или сгустки, или в тех случаях, когда вплазме появились отдельные нити (реакцию плазмокоагуляции оценивают на одинплюс).
Реакцию считаютположительной, если:
+ + + -сгусток, имеющий небольшой отсек;
+ +- сгусток в виде взвешенного мешочка.
Все триварианта являются положительным результатом.
При полученииположительной реакции считают, что в посевах обнаружен Staphylococcus aureus .
5.1.2Обработка результатов контроля
Результатыоценивают по каждой пробе отдельно.
5.1.3Оформление результатов контроля
Морфологические,культуральные свойства и положительная реакция плазмокоагуляции свидетельствуюто присутствии коагулазоположительных стафилококков в засеянной массе продукта.
5.2 Метод определения количества Staphylococcus aureus безпредварительного обогащения
5.2.1Проведение контроля
5.2.1.11 см 3 жидкого продукта или его разведения (5.1.1) наносят наповерхность питательных сред (3.2.5 или 3.2.6 или 3.2.7) в 3 чашки Петри, тщательнорастирают шпателем по поверхности питательной среды. Посевы инкубируют притемпературе (37 ± 1) °С в течение 24-48 ч. Чашки Петри с посевами инкубируютдном вверх.
5.2.1.2После термостатирования подсчитывают количество характерных колоний на каждойчашке Петри (5.1.4). С каждой чашки Петри отбирают не менее пяти характерныхи/или подозрительных колоний Staphylococcus aureus ,а в случае роста менее пяти - все колонии характерные для Staphylococcus aureus и пересевают на поверхностьскошенного питательного агара, разлитого в пробирки, как указано в 3.2.5, но без добавленияхлористого натрия и желточной эмульсии. Пробирки с посевами выдерживают втермостате при температуре (37 ± 1) °С в течение 24 ч.
У выросшихкультур определяют отношение к окраске по Граму и коагулированию плазмы кроликав соответствии с требованиями 5.1.6 и 5.1.7.
5.2.2Обработка результатов контроля
Результатыоценивают по каждой пробе отдельно.
Если приизучении характерных колоний в 80 % случаев, то есть не менее чем в 4 из 5колоний подтвержден рост Staphylococcus aureus ,то считают, что все характерные колонии, выросшие на чашках Петри (5.1.7),принадлежат к Staphylococcus aureus . В остальных случаяхколичество Staphylococcus aureus определяют, исходя изпроцентного отношения подтвержденных колоний к общему количеству характерныхколоний, взятых для подтверждения.
5.2.3Оформление результатов контроля
Количествоколоний Staphylococcus aureus в 1 г или 1 см 3 Хпосле определения его в определенной навеске продукта вычисляют по формуле
где - количество колоний,выросших на всех чашках Петри в пределах одного разведения или засеянногообъема;
п - число десятикратныхразведений.
Подсчитываемколичество колоний Staphylococcus aureus , выросших на трех засеянныхчашках при посевах продукта или его разведений:
1 гили 1 см 3 продукта - 84 96 72
10 -1 разведение - 9 10 7
10 -1 разведение - 84 96 72
10 -2 разведение - 99 10 7
[1] ТУ 6-09-09-200-84 Глицин для медицинских целей
[2] ТУ 6-09-2060-77 Калий теллуристокислый водный
[3] ТУ 6-09-3462-73 Экстракт дрожжевой. Технические условия
[4] ТУ 6-09-3751-83 Литий хлорид 1-водный. Технические условия
[5] ТУ 6-09-3804-82 Фуксин основной для микробиологических целей.Технические условия
[6] ТУ 6-09-4119-75 Кристаллический фиолетовый. Технические условия
[7] ТУ 6-09-4510-77 Экстракт дрожжевой очищенный. Технические условия
[9] ТУ 10-02-02-789-176-94 Среды питательные сухие для определения Staphylococcus aureus . Технические условия
Ключевыеслова :питательные среды, коагулазоположительные стафилококки, характерные колонии,окраска по Граму, коагулирование плазмы
ГОСТ27583-88. На территории Российской Федерации действует ГОСТ Р 52121-2003. Яйцакуриные пищевые. Технические условия
4 Настоящий стандарт модифицирован по отношению к международным стандартам*:
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - Примечание изготовителя базы данных.
При этом дополнительные положения и требования, включенные в текст стандарта для учета потребностей национальной экономики указанных выше государств и особенностей межгосударственной стандартизации, выделены в тексте стандарта курсивом*.
* В бумажном оригинале обозначения и номера стандартов и нормативных документов в разделе "Предисловие" приводятся обычным шрифтом, остальные по тексту документа выделены курсивом. - Примечание изготовителя базы данных.
Наименование настоящего стандарта изменено относительно наименования указанных международных стандартов для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
Сравнение структуры настоящего стандарта со структурой указанных международных стандартов приведено в дополнительном приложении ДА.
Степень соответствия - модифицированная (MOD).
Стандарт подготовлен на основе применения ГОСТ Р 52815-2007
5 Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. N 1773-ст межгосударственный стандарт ГОСТ 31746-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2013 г.
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом информационном указателе "Национальные стандарты".
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемом информационном указателе "Национальные стандарты". В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе "Национальные стандарты"
ВНЕСЕНА поправка, опубликованная в ИУС N 6, 2019 год с учетом уточнения, опубликованного в ИУС 11-2019
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus (S. aureus) посевом: в жидкую селективную среду (с предварительным обогащением) и на (в) агаризованные селективно-диагностические среды.
Допускается использование хромогенных сред предварительного выявления количества коагулазоположительных стафилококков и Staphylococcus aureus в масложировой продукции.
Метод определения наиболее вероятного числа (НВЧ) коагулазоположительных стафилококков и S. aureus посевом в жидкую селективную среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см жидкого продукта менее 15 колониеобразующих единиц (КОЕ) коагулазоположительных стафилококков и S. aureus.
Метод определения количества коагулазоположительных стафилококков и S. aureus посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см жидкого продукта более 150 колониеобразующих единиц (КОЕ) коагулазоположительных стафилококков и S. aureus.
Метод определения количества коагулазоположительных стафилококков и S. aureus посевом в агаризованную селективно-диагностическую среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 150 или в 1 см жидкого продукта более 15 колониеобразующих единиц (КОЕ) коагулазоположительных стафилококков и S. aureus.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 450-77 Кальций хлористый технический. Технические условия
ГОСТ 5962-67 Спирт этиловый ректификованный. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов по указателю "Национальные стандарты", составленному по состоянию на 1 января текущего года, и по соответствующим информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 коагулазоположительные стафилококки: Грамположительные, каталазоположительные микроорганизмы, которые образуют типичные и/или атипичные колонии на (в) селективно-диагностической питательной среде, дающие положительную реакцию на коагулазу или специфичную для кроличьей плазмы реакцию на агаре с кроличьей плазмой и фибриногеном при определении по методам, приведенным в настоящем стандарте.
3.2 Staphylococcus aureus (S. aureus): Коагулазоположительные стафилококки, образующие ацетоин и ферментирующие мальтозу в аэробных условиях при определении этих биохимических тестов по методам, приведенным в настоящем стандарте.
3.3 выявление коагулазоположительных стафилококков и S. aureus: Определение присутствия или отсутствия коагулазоположительных стафилококков и S. aureus в определенной массе или объеме продукта по методам, приведенным в настоящем стандарте.
3.4 определение количества коагулазоположительных стафилококков и S. aureus: Количество коагулазоположительных стафилококков или S. aureus, содержащееся в 1 см или 1 г продукта и определенное по методам, приведенным в настоящем стандарте.
4 Методы выявления и определения количества коагулазоположительных стафилококков и S. aureus*
* Слова "S. aureus" в наименовании раздела 4 в бумажном оригинале выделены курсивом. - Примечание изготовителя базы данных.
4.1 Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus* с предварительным обогащением
* Слова "и S. aureus" в наименовании подраздела 4.1 в бумажном оригинале выделены курсивом. - Примечание изготовителя базы данных.
Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведений навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к коагулазоположительным стафилококкам и S. aureus.
При пересеве на агаризованную среду с кроличьей плазмой и бычьим фибриногеном выросшие типичные колонии без подтверждения по биохимическим признакам относят к коагулазоположительным стафилококкам.
4.1.1 Метод выявления коагулазоположительных стафилококков и S. aureus
4.1.1.1 Определенное количество жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции вносят в жидкую селективную питательную среду.
Крайне негативное влияние на развитие молочной индустрии оказывают заболевания животных, среди которых наибольшее значение имеет мастит коров, приводящий к недополучению большого количества молока и преждевременной выбраковке животных. Выделение значительного процента энтеротоксигенных стафилококков из проб маститного молока указывает на то, что вымя больных коров является резервуаром энтеротоксигенных культур, которые инфицируют новорожденных телят при скармливании им молока и молозива, а также вызывают пищевые отравления людей при употреблении ими молока и молочных продуктов.
Интоксикации стафилококковой природы характеризуются тем, что они развиваются в результате воздействия на организм энтеротоксинов, а не живых микробных клеток. Кипячение и стерилизация продуктов убивает стафилококки, но не разрушает токсины. Окончательная их инактивация наступает только после 2,5-3 ч кипячения. В этой связи, при выявлении причин пищевых отравлений необходимо определять как патогенные микроорганизмы, так и энтеротоксины.
Определение энтеротоксигенности изолированных культур стафилококков обязательно используется для их идентификации. Для эффективной оценки роли стафилококков в возникновении пищевых отравлений самого факта выделения культуры стафилококков, даже коагулозопозитивных, недостаточно, тем более что в пищевых продуктах, содержащих патогенные дозы энтеротоксина, жизнеспособные микробные клетки могут и не выявляться. В этой связи, в процессе биологической диагностики стафилококковых пищевых отравлений необходимо ставить две задачи: найти энтеротоксигенные стафилококки и выявить энтеротоксин. Оба патогена надо искать на всех стадиях получения и переработки молока, и тогда определение стафилококков позволит конкретно выяснить источник и механизм развития патологического процесса, а нахождение энтеротоксина в продукте и в материале от потерпевших – окончательно подтвердить диагноз пищевой стафилококковой интоксикации.
Иммуноферментный анализ – один наиболее перспективных и быстро развивающихся методов исследования биологически активных веществ. Технология иммуноферментного анализа постоянно совершенствуются, повышается чувствительность и специфичность тест-систем, подбираются наиболее удобные условия работы, сокращается число этапов проведения исследований, что уменьшает вероятность ошибки при выполнении анализа.
Результаты исследований
Для изучения уровня обсеменения молока золотистыми стафилококками на фермах и частных подворьях Московской, Вологодской и Смоленской областей были проведены микробиологические исследования 442 проб сборного молока и секрета вымени от лактирующих коров с различным состоянием вымени.

Таблица 1 Количество S. aureus и энтеротоксигенных штаммов золотистого стафилококка, выделенных из сборного молока и от лактирующих коров с различным состоянием вымени
При мониторинге S. aureus в хозяйствах трех областей (таблица 1) из молока и секрета вымени здоровых и больных маститом коров было выделено 168 штаммов (38%) золотистого стафилококка, которые проявляли ДНК-азную активность и коагулировали кроличью плазму, из них 8 (8,7%) штаммов из молока клинически здоровых животных, 128 (59,3%) – из молока коров, больных субклиническим маститом, в 2 раза меньше, 21 (28,8%) штамм – из секрета вымени коров с клинической формой мастита и 11 штаммов (18,0%) – из сборного молока, что в 3,2 раза ниже, чем из молока животных с субклинической формой воспаления.
Некоторые результаты анализа молока с помощью подложек RIDA®COUNT показаны на нижеприведенных рисунках 1-4.

Рисунок 1 Золотистый стафилококк (3 КОЕ)

Рисунок 2 Золотистый стафилококк (18 КОЕ)

Рисунок 3 Золотистый стафилококк (180 КОЕ)

Рисунок 4 Золотистый стафилококк (1800 КОЕ)
При определении энтеротоксигенности S.aureus показано, что в сборном молоке выявляется 36,4% энтеротоксигенных стафилококков, тогда как в молоке здоровых коров и секрете вымени больных клиническим маститом – 25,0 и 33,3%, соответственно. Наибольшее количество S. аureus, вырабатывающих энтеротоксины, выявлялось в молоке животных с субклинической формой мастита (42,2%), что коррелирует со значительным процентом обнаружения золотистых стафилококков при этой форме заболевания (таблица 1).
Проведены также исследования по определению типов энтеротоксинов, выявленных из культур золотистого стафилококка (см. диагр.).
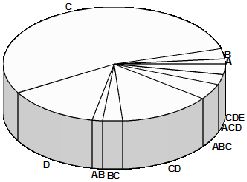
Диаграмма Типы стафилококковых энтеротоксинов, вырабатываемых энтеротоксигенными S. aureus, выделенными из сборного молока и секрета вымени лактирующих коров
Как видно из представленных на диаграмме данных, чаще всего выявлялись энтеротоксины типа С (53,8% от числа энтеротоксигенных стафилококков), причем количество распределялось приблизительно в равной пропорции между штаммами S. aureus, выделенными из сборного молока и секрета вымени коров с различным состоянием молочной железы; по 13,4% – типы D (были обнаружены только у клинически больных коров) и СD (чаще у здоровых коров – 50% от числа всех выделенных штаммов, вырабатывающих энтеротоксин тип СD). Что касается других типов энтеротоксинов, выявленных среди энтеротоксигенных стафилококков, то обнаруживались следующие: A, B, AB, BC, ABC, ACD и CDE – в количестве от 1,5 до 4,5%.
Заключение
Проведены исследования по выявлению энтеротоксигенных штаммов золотистого стафилококка в сборном молоке и молоке коров с различным состоянием молочной железы, определены типы энтеротоксинов и частота их обнаружения. В результате выявлено, что наиболее часто из секрета вымени коров, больных субклиническим и клиническим маститом выделялся золотистый стафилококк, образующий энтеротоксины типов С, D и CD.
Питание является одним из важнейших факторов, определяющих здоровье населения. Правильное питание способствует профилактике заболеваний, повышению работоспособности, создает условия для адекватной адаптации к окружающей среде. Одним из важнейших показателей, характеризующих качество и безопасность продовольственного сырья и продуктов питания, является контаминация их микроорганизмами. Учитывая особую значимость продуктов питания в возникновении острых кишечных инфекционных заболеваний и бактериальных пищевых отравлений, уделяется пристальное внимание мониторингу за микробиологической чистотой продовольственного сырья и пищевых продуктов. Ведущее место в санитарно-бактериологических исследованиях является выполнение исследований продовольственного сырья и пищевых продуктов. Стафилококки – одна из ведущих причин микробных пищевых отравлений. Стафилококки вызывают множество инфекций в организме человека, в том числе поверхностные и глубокие гнойные инфекции, интоксикации, инфекции мочевых путей. Важнейшим патогенным стафилококком является Золотистый стафилококк – Staphylococcus aureus – стойкий, высоковирулентный, легко приобретающий устойчивость к антимикробным препаратам возбудитель инфекции. Staphylococcus aureus является одним из важнейших возбудителей инфекций человека и вызывает более 100 нозологических форм заболеваний. Золотистый стафилококк может размножаться в продуктах питания. Чаще всего, в кондитерских изделиях и молочных продуктах, в мясных изделиях (полуфабрикаты и колбасы), в рыбе (слабосоленая, консервы). Сам микроорганизм не представляет угрозы для человека. Он быстро погибает в желудке под воздействием соляной кислоты. Но в процессе жизнедеятельности золотистый стафилококк выделяет энтеротоксин, который накапливается в продуктах питания. Попадая в желудочно-кишечный тракт, этот токсин вызывает симптомы пищевого отравления.

1. Билетова Н.В., Корнелаева Р.П., Кострикина Л.Г. и др. Под ред. Любашенко и С.Я. Санитарная микробиология. - М.: Пищевая промышленность, 2010 г.
2. Корнелаева Р.П., Степаненко П.П., Павлова Е.В., Санитарная микробиология сырья и продуктов животного происхождения. - М.: 2012 г.
4. ГОСТ 31746-2012. Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus.
5. Онищенко Г.Г., Абаев И.В., Дятлов И.А., Скрябин Ю.П. и соавт. Молекулярно- генетическая идентификация штамма Staphylococcus aureus — возбудителя пищевой токсикоинфекции при вспышке в Санкт-Петербурге в 2013 г. // Актуальные вопросы микробиологии. – 2014, № 9-10. – С. 33-34.
6. Пруссова В.Н., Кива М.С., Клименко В.В. Микробиологический мониторинг за пищевыми продуктами по обоснованию сроков годности и условий хранения // Здоровье. Медицинская экология. Наука. 2013. №2-3(52). С. 94-97.
7. Пруссова В.Н., Кива М.С. Микробиологический мониторинг за пищевыми продуктами // Здоровье. Медицинская экология. Наука. 2015. №4(62). С. 142-146.
Основными источниками обсеменения стафилококками пищевых продуктов являются люди и животные с гнойно-воспалительными процессами (абсцессы, фурункулы, гнойные раны и др.), а также носители этих микроорганизмов. Перенос стафилококков от людей на пищевые продукты может происходить воздушно-капельным путем, при непосредственном контакте людей с продуктами, оборудованием, в процессе убоя скота и разделки туш.
Чаще всего причиной стафилококковых токсикозов является употребление молока, мяса и мясных изделий, кондитерских изделий с заварным кремом и др., контаминированных патогенными стафилококками. Органолептические свойства продуктов, в которых размножаются стафилококки и накапливаются энтеротоксины, не изменяются [2].
Энтеротоксигенные стафилококки размножаются в пищевых продуктах даже при содержании в них около 40% влаги. Они могут развиваться в продуктах, содержащих от 7% до 12% хлорида натрия. Сахар угнетает развитие стафилококков при концентрациях 30–40%. Некоторые микроорганизмы (В. сеreus, дрожжи из рода Саndidа и др.) оказывают на стафилококки стимулирующий эффект (они усиливают образование энтеротоксина).
Энтеротоксин стафилококков обладает высокой термоустойчивостью. Инактивирование (разрушение) токсина происходит только через 2,5–3 часа кипячения. При автоклавировании (120°С) токсин разрушается через 20 мин. При благоприятных температурных условиях энтеропатогенные стафилококки быстро размножаются в продуктах и продуцируют токсин. Пищевые токсикозы, вызванные энтеропатогенными стафилококками, протекают в форме острого гастроэнтерита, сопровождающегося рвотой, реже диареей, головной болью. Инкубационный период очень короткий – от 30 мин до 6 ч. Длится заболевание один, реже – два, три дня [1].
Выявление и определение количества этих микроорганизмов в пищевых продуктах проводят в соответствии с ГОСТ 31746-2012. Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus.
Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus посевом: в жидкую селективную среду (с предварительным обогащением) и на (в) агаризованные селективно-диагностические среды [4].
Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведений навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к коагулазоположительным стафилококкам и S. aureus.
При пересеве на агаризованную среду с кроличьей плазмой и бычьим фибриногеном выросшие типичные колонии без подтверждения по биохимическим признакам относят к коагулазоположительным стафилококкам.
Определенное количество жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции вносят в жидкую селективную питательную среду [6].
Перед посевом анаэробные условия в среде создают кипячением при (100±1) °С в течение 15 мин, наслоением агара или парафина в каждую пробирку после посева, а также с помощью альтернативной процедуры - инкубирования пробирок в емкости или инкубаторе в анаэробных условиях.
Пробирки с посевами инкубируют при температуре 37 °С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков на Жиолитти-Кантони бульоне определяется по редукции теллурита калия, а на глюкозном или солевом бульоне - по помутнению среды [3].
Поверхность одной из агаризованных селективно-диагностических сред (Байрд-Паркер агара, молочно-солевого, яично-желточно-азидного, яично-желточно-солевого агара, агара с кроличьей плазмой и бычьим фибриногеном), инокулируют из предположительно положительных пробирок после 24 ч и все оставшееся пробирки после 48 ч.
Чашки Петри с посевами инкубируют при температуре 37°С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков определяется по редукции теллурита калия и яично-желточной реакции (лецитиназной активности) [7].
На агаре с кроличьей плазмой и бычьим фибриногеном после инкубирования присутствие коагулазоположительных стафилококков определяется по типичным колониям, показавшим специфичную реакцию (бычий фибриноген/кроличья плазма).
Подтверждение принадлежности типичных и (или) атипичных колоний к коагулазоположительным стафилококкам проводят по изучению отношения выявленных микроорганизмов к окраске по Граму, определению присутствия у них каталазы и коагулазы.
Подтверждение принадлежности коагулазоположительных стафилококков к S. aureus проводят по определению образования ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. Результаты выявления коагулазоположительных стафилококков и S. aureus выражают: "обнаружены" или "не обнаружены"[5].
Метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus. Навески продукта и (или) серию разведений навески продукта вносят в жидкую селективную питательную среду. Наиболее вероятное число коагулазоположительных стафилококков и S. aureus в 1 см или в 1 г продукта определяют для подтвержденных посевов, пользуясь НВЧ-таблицей по ГОСТ 26670.
Методы определения количества коагулазоположительных стафилококков и S. aureus посевом на (в) агаризованные селективно-диагностические среды основаны на высеве навески продукта и/или разведения навески продукта на (в) агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете типичных и (или) атипичных колоний, подтверждении по биохимическим признакам принадлежности выделенных колоний к коагулазоположительным стафилококкам и S. aureus [4].
Проводят посев определенного количества жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции на (в) агаризованную селективно-диагностическую питательную среду на две параллельные чашки Петри. Аналогично проводят посев десятикратных разведений испытуемого продукта. Посевы в чашках Петри инкубируют при температуре 37 °С в течение 24-48 ч.
При посеве в (на) агаризованную среду с кроличьей плазмой и бычьим фибриногеном определяют только типичные колонии и без подтверждения по биохимическим признакам их относят к коагулазоположительным стафилококкам.
При выявлении коагулазоположительных стафилококков в определенной навеске исследуемого продукта или его эквивалентном разведении с предварительным обогащением эту навеску или разведение вносят в одну из питательных сред [6,7].
Перед использованием Жиолитти-Кантони бульон прогревают кипячением при (100±1) °С в течение 15 мин для удаления воздуха. Охлаждают до 44 °С - 47 °С и с соблюдением правил асептики прибавляют раствор теллурита калия.
Соотношение между количеством высеваемого продукта или его разведением и питательной средой нормальной концентрации 1:10. При использовании среды двойной концентрации соотношение между количеством высеваемого продукта или его разведением и питательной средой 1:1 [3].
Если при последующем подтверждении принадлежности коагулазоположительных стафилококков к S. aureus не определяют наличие термостабильной нуклеазы и гемолитической активности, то допускается проводить посев в Жиолитти-Кантони бульон без прогрева перед посевом и без наслаивания голодного агара или парафина после посева.
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч. Если появилось почернение или черный осадок в Жиолитти-Кантони бульоне или помутнение в солевом или сахарном бульоне, то проводят подтверждение принадлежности выросших микроорганизмов к коагулазоположительным стафилококкам. Если почернения, черного осадка или помутнения нет, то посевы инкубируют еще (24±2) ч [2].
Для получения изолированных колоний стерильной петлей делают пересевы культур из каждого посева на поверхность чашки Петри с одной из агаризованных селективно-диагностических сред: Байрд-Паркер агара, Байрд-Паркер агара с кроличьей плазмой и бычьим фибриногеном, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара. Пересевы проводят также из пробирок, в которых нет видимых признаков роста.
Чашки Петри с пересевами инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч или (48±2) ч. После 24 ч инкубирования чашек Петри по отмечают на дне чашек присутствие типичных и атипичных для коагулазоположительных стафилококков колоний [1].
На Байрд-Паркер агаре после инкубирования в течение 24 ч коагулазоположительные стафилококки образуют типичные колонии черного или серого цвета, блестящие и выпуклые, окруженные прозрачной зоной, диаметр колоний около 1,0-1,5 мм и до 1,5-2,5 мм после инкубирования в течение 48 ч. После инкубирования в течение 24 ч непосредственно около колонии в прозрачной зоне может появиться опалесцирующее кольцо, окружающее колонию.
Принадлежность выявленных коагулазоположительных стафилококков к S. aureus проводят по определению их способности образовывать ацетоин и ферментировать мальтозу в аэробных условиях [5].
Определение образования ацетоина (реакция Фогес-Проскауера). Культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. После инкубирования посевов к 1 см отобранной культуральной жидкости прибавляют 0,6 см раствора - нафтола и 0,2 см раствора гидроокиси калия. Появление розового окрашивания через 15-60 мин указывает на положительную реакцию. S. aureus образует ацетоин.
Определение ферментации мальтозы в аэробных условиях. Способность ферментации мальтозы в аэробных условиях определяют с целью дифференциации S. aureus от других коагулазоположительных видов S. intermedius и S. hyicus. Для определения ферментации мальтозы в аэробных условиях культуры, подлежащие исследованию, высевают уколом петлей в среду Гисса с мальтозой. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. При ферментации мальтозы в аэробных условиях с образованием кислоты цвет среды Гисса изменяется. S. aureus ферментирует мальтозу в аэробных условиях [4].
Оценка результатов посевов в жидкие среды. При определении НВЧ коагулазоположительных стафилококков или S. aureus или при их выявлении в определенной навеске продукта посевы считают положительными (то есть коагулазоположительные стафилококки или S. aureus выявлены в испытуемой навеске продукта), если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении типичных и (или) атипичных колоний, выросших на этих средах, хотя бы в одной колонии будут обнаружены коагулазоположительные стафилококки или S. aureus [6].
Результаты выявления коагулазоположительных стафилококков или S. aureus записывают: обнаружены (не обнаружены) в 1 г (см3) продукта; масса или объем продукта, в котором выявляли коагулазоположительные стафилококки или S. aureus.
Читайте также:

