Стафилококк золотистый хронический эндометрит
Обновлено: 19.04.2024
Эндометрий – слизистая оболочка матки. Соответственно, эндометрит – воспаление слизистой оболочки матки, обычно вызванное попаданием инфекции. В норме матка очень хорошо защищена от проникновения патогенных микроорганизмов. Однако, инфицирование может произойти даже у здоровых женщин, особенно при инвазивных процедурах , таких как аборты, внутриматочные инсеминации и гистероскопии . Благодаря хорошей защите, хронический эндометрит – не такое частое заболевание, как считалось, например, в начале XXI века. Часто этот диагноз ставился здоровым женщинам при нахождении иммунных клеток на слизистой оболочке матки. Стоит помнить, что присутствие специализированных клеток-киллеров с маркерами CD56 и CD16 – это норма для здорового организма. Наличие плазматических клеток, обозначаемых кодом CD138, позволяет заподозрить хронический эндометрит. Окончательный же диагноз ставит врач-клиницист после рассмотрения всей клинической картины. Хронический эндометрит хорошо лечится до наступления беременности с помощью антибактериальной и противовоспалительной терапии.
Естественная защита матки от инфекции
Как уже было сказано, матка хорошо защищена от попадания инфекции. Защита эта многоуровневая и состоит из следующих элементов:
- Механическая защита от попадания частиц при сомкнутой половой щели.
- Кислая среда влагалища, возникающая благодаря нормальной микрофлоре человека и препятствующая росту потенциально опасных микроорганизмов.
- Густая слизь в просвете шейки матки, которая препятствует проникновению микроорганизмов в матку. Проницаемость слизи зависит от фазы цикла . Сама слизь обладает бактерицидными свойствами.
- Лимфоидная ткань слизистой оболочки матки.
- Отторжение функционального слоя слизистой оболочки матки при менструации.
Благодаря естественной защите, инфекция может попасть в полость матки здоровой женщины, только если нарушаются барьеры, например, при различных вмешательствах, таких как аборты, внутриматочные инсеминации и гистерскопии. И, конечно, если организм уже ослаблен или во время менопаузы , риск возникновения эндометрита резко повышается.
Причины развития хронического эндометрита
Эндометрит – воспалительный процесс, который вызван тем, что в слизистую оболочку матки попал некий патоген (бактериальный или вирусный). Это могут быть условно-патогенные микроорганизмы влагалища, например, Streptococcus spp., Escherichia coli, Enterococcus faecalis, Klebsiella pneumoniae, Staphylococcus spp., Corynebacterium и Mycoplasma/Ureaplasma spp. или изначально патогенные микроорганизмы, такие как Chlamydia trachomatis и Neisseria gonorrhoeae. Инфекция активирует клетки иммунной системы, которые и находят в эндометрии матки при диагностировании хронического эндометрита.
Иммунные клетки матки в норме и при патологии
Диагноз хронический эндометрит ставится после проведения биопсии эндометрия матки с последующим гистологическим исследованием . Однако, простого обнаружения лимфоидных элементов (клеток иммунной системы) в биопсии недостаточно для постановки диагноза.
Дело в том, что слизистая оболочка матки в норме содержит иммунные клетки различных субпопуляций , число которых зависит от дня цикла. Эти элементы играют огромную роль в процессе имплантации эмбриона. Так, в норме для слизистой оболочки матки характерно наличие специализированных клеток-киллеров, НК-клеток, с маркерами CD56 и CD16.
На поверхности иммунных клеток находятся различные специфические молекулы, которые позволяют их классифицировать. Эти молекулы обозначаются аббревиатурами, которые начинаются с английских букв CD (claster of determination). Дальше идет число. В зависимости от того, какие молекулы присутствуют на поверхности иммунной клетки, ее можно отнести к той или иной субпопуляции, например, лимфоцитов, или же к тому или иному функциональному состоянию.
При возникновении воспалительного процесса в матке обнаруживаются плазматические клетки, то есть высоко специализированные лимфоциты, которые являются конечной точкой развития В-лимфоцитов. Эти клетки синтезируют антитела. Маркером активности плазматических клеток, который не обнаруживается на других клетках в значимых количествах, является синдекан-1. Эта молекула относится к классу так называемых протеогликанов группы трансмембранного гепаринсульфата. По международной номенклатуре синдекан-1 обозначается кодом CD138.
Таким образом, простого обнаружения клеток иммунной системы в слизистой оболочке матки без типирования совершенно недостаточно для постановки диагноза хронический эндометрит. Такой подход привел в свое время (в начале 2000-х) к гипердиагностике этого заболевания, что, в свою очередь, приводило к ненужному лечению, ослабляя организм и задерживая момент наступления беременности.
HLA DR – это один из белков тканевой совместимости. Функция этого белка заключается в презентации антигена . Концентрация этих клеток не является маркером эндометрита.
Антигенпрезентирующими являются 3 вида клеток: В-лимфоциты, макрофаги и дендритные клетки. HLA-DR-положительные клетки присутствуют в норме в эндометрии и передают информацию иммунной системе, необходимую для образования клонов Т-регуляторных клеток, которые формируют иммунологическую толерантность к будущему эмбриону. Поэтому концентрация HLA-DR клеток зависит от частоты половых контактов женщины, общего количества спермы, поступающей во влагалище, времени последнего полового акта, особенностей иммунной системы и других факторов.
Особенно же специалисты нашей клиники предостерегают о диагнозе аутоиммунный эндометрит. Чаще всего при постановке такого диагноза врач-гистолог не располагает данными о наличии аутоиммунных маркеров или специфических антител. Мы считаем, что данных для подтверждения достоверности такого диагноза в клинической практике недостаточно.
Анализ нескольких факторов при постановке диагноза
Диагноз хронический эндометрит ставит врач-клиницист, а не врач-гистолог. При этом он должен учитывать несколько факторов.
Да, данные, полученные при биопсии эндометрия, очень важны, в частности, о наличии CD138 и CD56 клеток. Однако этого недостаточно. По результатам исследований, не менее, чем в 5% случаев у абсолютно здоровых женщин с нормальной фертильностью и без каких-либо признаков воспалительного процесса имеется наличие маркера CD138.
Поэтому при постановке диагноза учитываются все данные анамнеза:
- Наличие CD138 клеток в биопсии эндометрия матки.
- Концентрация этих клеток (чем выше количество, тем больше вероятность воспалительного процесса).
- Другие признаки воспалительного процесса внутри организма женщины: боль в области таза, наличие инфекций, дисбиоза, лейкоцитов и воспалительных процессов в маточных трубах или выскабливаний и абортов в анамнезе.
- Самый характерный признак – изменение характера выделений из половых путей, в частности, кровянистые атипические выделения. Для хронического эндометрита характерны мажущие выделения, они могут быть после менструации, в течение цикла, во вторую фазу цикла перед менструацией.
Помочь в постановке диагноза также может гистероскопия. При осмотре эндометрия обращают внимания на признаки воспаления, такие как гиперемия (чрезмерное снабжение кровью сосудов матки), белые пятна на фоне гиперемии (картина похожа на поверхность клубники), отек и микрополипы.
Все большую роль приобретает идентификация изначального патогенного микроорганизма. Микробиологическое исследование может не только помочь в диагностике, но и в выборе лечения.
Трансвагинальное УЗИ при постановке диагноза не считается специфичным. Обычно УЗИ участвует в диагностике хронического эндометрита только при наличии кист. Однако заподозрить это заболевание можно и по другим признакам, таким как локальные дефекты эндометрия, неравномерность толщины базального слоя эндометрия, его зазубренность или изрезанность, утолщение стенок матки или увеличение ее размеров и т.д. Признаки эндометрита, видимые на УЗИ, различаются в зависимости от вида и тяжести заболевания. Однако, как и говорилось раньше, однозначно поставить диагноз благодаря одному только УЗИ нельзя.
Эпидемиология
Из-за маленьких выборок и использования разных методов диагностики в различных исследованиях, ученые не могут прийти к единому мнению, насколько же распространен хронический эндометрит. Обычно приводят цифры от 8% до 72% для женщин репродуктивного возраста.
Влияние на здоровье женщины и репродуктивную функцию
Даже если на данный момент не ставится цель забеременеть, хронический эндометрит все равно нужно пролечить. Часто это заболевание сопровождается болью в области таза при менструации или во время полового акта, что ухудшает качество жизни. Могут появиться функциональные проблемы с кишечником или хроническая усталость. Хронические воспалительные процессы вредны для организма в целом. Пожалуйста, не игнорируйте поставленный диагноз или свои подозрения о наличии у вас хронического эндометрита. Наша клиника всегда готова предоставить вам помощь.
Лечение
Так как эндометрит обычно имеет бактериальную или вирусную этиологию, в первую очередь нужно убрать первопричину.
После подтверждения диагноза проводится курс антибактериальной и противовоспалительной терапии.
Согласно нашему клиническому опыту, эта терапия (обычно один курс антибиотиков) позволяет более чем в 70% случаев убрать активность воспалительного процесса. Если первый курс не сработал, то, как правило, у подавляющего большинства женщин срабатывает второй курс.
Хронический эндометрит – заболевание, которое зачастую сложно диагностировать. Но при правильной терапии до наступления беременности оно хорошо лечится и в будущем не препятствует наступлению беременности и рождению здорового ребенка.

Введение. Воспалительные заболевания органов малого таза (ВЗОМТ), в том числе хронический эндо метрит (ХЭ), являются фактором нарушения рецептивности эндометрия и неэффективных протоколов экстракорпорального оплодотворения (ЭКО). Роль микроорганизмов эндометрия в патогенезе хронического воспаления и ассоциированной с ним инфертильности до сих пор не определена.
Цель: определение таксономического профиля микробиоты эндометрия при ХЭ разной степени выраженности у пациенток с неэффективными попытками ЭКО в анамнезе.
Результаты. В эндометрии пациенток группы I значительно чаще, по сравнению с группами II и III, определялись Lactobacillus spp. (85,7 % против 50 и 46,6 % соответственно) и Eubacterium spp. (78,6 % против 25 и 35,6 % соответственно). В то же время в группах II и III значительно чаще, по сравнению с группой I, выявлялись бактерии семейства Enterobacteriaceae (50 и 64,4 % против 35,7 % соответственно) и Streptococcus spp. (55 и 56,2 % против 7,1 % соответственно). Количественное содержание лактобацилл и бактерий рода Eubacterium было также значительно выше в образцах эндометрия у женщин группы I, чем у женщин групп II и III, в то время как содержание энтеробактерий и стрептококков было значительно выше у женщин с ХЭ, чем у женщин без ХЭ.
Заключение. Преобладающей микрофлорой полости матки у женщин без ХЭ являются Lactobacillus spp. и Eubacterium spp. Развитие хронического воспаления ассоциировано с увеличением частоты и количественного содержания Streptococcus spp., Staphylococcus spp. и бактерий семейства Enterobacteriaceae.
Ключевые слова
Полный текст
Актуальность
Микрофлора человека представляет собой неотъемлемую часть его организма и имеет огромное значение для поддержания и регулирования оптимального уровня метаболических процессов [1]. Полноценное лечение заболеваний, связанных с нарушениями в составе микробиоты репродуктивной системы человека, невозможно без детального понимания взаимо отношений разных микроорганизмов между собой [2].
Длительный период времени вопрос о стерильности верхних отделов генитального тракта не ставился под сомнение [3, 4]. В последующих исследованиях были получены данные о составе микробиоты эндометрия гистерэкто мированной матки [5], при воспалительных заболеваниях органов малого таза (ВЗОМТ) и хроническом эндометрите (ХЭ) [6–8], бесплодии [9], повторных неудачах имплантации [10], неразвивающейся беременности [11], а также у условно здоровых пациенток [7, 10, 12].
Новое десятилетие меняет существующую парадигму, постулатом которой является идея о том, что полость матки стерильна. Эта точка зрения в последние годы пересматривается, и специалисты в области репродуктивной медицины активно исследуют видовой состав микроорганизмов, колонизирующих полость матки, и изучают их роль в нарушении гомеостаза этого органа [1].
До сих пор не определена роль микроорганизмов, выявленных в эндометрии, в генезе хронического воспаления и ассоциированной с ним инфертильности. Остается непонятным, оказывают ли выделенные в эндометрии микроорганизмы негативное влияние на имплантацию, или они обладают качествами комменсалов.
Целью нашего исследования явилось определение таксономического профиля микробиоты эндометрия при ХЭ разной степени активности и без хронического эндометрита у пациенток с неэффективными попытками ЭКО в анамнезе.
Материалы и методы исследования
Биопсию эндометрия осуществляли во вторую фазу менструального цикла (18–23-й день) модифицированным нами методом, который включал в себя несколько этапов:
1-й этап — обработка влагалища и влагалищной части шейки матки антисептическим раствором;
2-й этап — для исключения контаминации биоптата эндометрия микрофлорой влагалища и цервикального канала в последний под визуальным контролем вводили прозрачный проводник из поливинилхлоридного материала диаметром 3 мм;
3-й этап — через проводник атравматической аспирационной кюреткой Pipelle de Cornier (Франция) получали клинический материал из полости матки.
Биоптат эндометрия анализировали при помощи морфологического и микробиологического исследований.
В зависимости от выраженности морфологических изменений в эндометрии все пациентки, включенные в исследование, были разделены на три группы сравнения. Группу I составили пациентки, не имеющие признаков ХЭ (n = 14), группу II — пациентки, имеющие признаки слабовыраженного ХЭ (n = 20), группу III — пациентки с ХЭ умеренной и выраженной степенью тяжести (n = 73). В качестве основы для выделения групп пациенток была использована классификация степени выраженности хронического эндометрита путем подсчета иммунокомпетентных клеток при иммуногистохимическом исследовании, разработанная в НИИ АГиР им. Д.О. Отта (табл. 1) [28].
Таблица 1 / Table 1. Степень выраженности хронического эндометрита при иммуногистохимическом исследовании (количество иммунокомпетентных клеток)
The severity of chronic endometritis in immunohistochemical studies (the number of immunocompetent cells)
(кол-во клеток в п/зр)
CD8+ (цитотоксические Т-лимфоциты)
CD 20+ (В-лимфоциты)
CD 138+ (плазмоциты)
Результаты и обсуждение
Результаты микробиологического исследования были положительными в 100 % случаев. В группе без признаков ХЭ (группа I) наиболее часто обнаруживались (более 50 % случаев) Lactobacillus spp. (85,7 %) и Eubacterium spp. (78,6 %) (рис. 1). У пациенток со слабыми признаками ХЭ (группа II) рейтинг частот выявления микроорганизмов был иным: в 80 % случаев определялись Staphylococcus spp., в 55 % случаев — Streptococcus spp. (рис. 2). В группе III чаще других микроорганизмов выявлялись Staphylococcus spp. (67,1 %), бактерии семейства Enterobacteriaceae (64,4 %), Streptococcus spp. (56,2 %) (рис. 3).

Рис. 1. Рейтинг частоты выявления микроорганизмов в образцах эндометрия у женщин группы I

Рис. 2. Рейтинг частоты выявления микроорганизмов в образцах эндометрия у женщин группы II

Рис. 3. Рейтинг частоты выявления микроорганизмов в образцах эндометрия у женщин группы III
В эндометрии пациенток группы I достоверно чаще, по сравнению с группами II и III, определялись Lactobacillus spp. (85,7 % против 50 и 46,6 % соответственно) и Eubacterium spp. (78,6 % против 25 и 35,6 % соответственно) (табл. 2). В то же время в группах II и III значительно чаще, по сравнению с группой I, выявлялись бактерии семейства Enterobacteriaceae (50 и 64,4 % против 35,7 % соответственно) и Streptococcus spp. (55 и 56,2 % против 7,1 % соответственно). Кроме этого, A. vaginae определялся чаще у пациенток с хроническим эндо метритом, чем у пациенток без признаков воспалительной реакции в эндометрии. Однако различия не были достоверными (р > 0,05).
Таблица 2 / Table 2. Частота выявления микроорганизмов в образцах эндометрия
Frequency of detection of microorganisms in endometrial specimens
Группы обследованных пациенток
р-уровень значимости, точный критерий Фишера
Gardnerella vaginalis + Prevotella bivia + Porphyromonas spp.
Sneathia spp. + Leptotrichia spp. + Fusobacterium spp.
Megasphaera spp. + Veillonella spp. + Dialister spp.
Lachnobacterium spp. + Clostridium spp.
Mobiluncus spp. + Corynebacterium spp.
Ureaplasma (urealyticum + parvum)
Результаты анализа количественного содержания микроорганизмов в эндометрии женщин трех групп представлены в табл. 3. Содержание лактобацилл и бактерий рода Eubacterium было значительно выше в образцах эндометрия у женщин группы I, чем у женщин групп II и III, в то время как содержание энтеробактерий и стрептококков было значительно выше у женщин с ХЭ, чем у женщин без ХЭ.
Таблица 3 / Table 3. Концентрация выявленных в образцах эндометрия микроорганизмов (lg ГЭ/мл)
Concentration of microorganisms detected in endometrial samples (lg GE/ml)
Группы обследованных пациенток
р-уровень значимости, критерий Манна – Уитни
Gardnerella vaginalis + Prevotella bivia + Porphyromonas spp.
Sneathia spp. + Leptotrichia spp. + Fusobacterium spp.
Megasphaera spp. + Veillonella spp. + Dialister spp.
Lachnobacterium spp. + Clostridium spp.
Mobiluncus spp. + Corynebacterium spp.
Ureaplasma (urealyticum + parvum)
Результаты нашего исследования подтверждают тот факт, что полость матки не является стерильной. В этом плане они совпадают с данными C.L. Haggerty [24], E. Cicinelli [7, 10, 20, 29], J. Espinoza [30].
Высокая частота детекции Lactobacillus spp. отмечена в работах Н.А. Гомболевской и др. (2016) как у пациенток с гистологически подтвержденным ХЭ (38 %), так и в группе контроля (48 %) [31]. Зарубежные коллеги C. Mitchell et al. (2015) также сообщают о наличии L. iners (45 %) и L. crispatus (33 %) в эндометрии у па циенток, подвергшихся гистерэктомии [5]. Авторы предположили, что лактобациллы являются представителями нормальной вагинальной микрофлоры и могут контаминировать слизистую оболочку матки, не вызывая развития воспалительного процесса, то есть их наличие клинически незначимо.
I. Moreno et al. (2016) оценивали влияние микробиоты эндометрия на имплантацию. Было выявлено, что группа пациенток со снижением количества лактобацилл (менее 90 %) и преобла данием условно-патогенной микрофлоры (более 10 %) в эндометрии, по сравнению с группой с преобладанием лактобацилл (более 90 %), имела достоверно более низкую частоту имплантации (60,7 против 23,1 %, p = 0,02), наступления беременности (70,6 против 33,3 %, p = 0,03), прогрессирующей беременности (58,8 против 13,3 %, p = 0,02) и частоту родов (58,8 против 6,7 %, p = 0,002). Авторы проводили исследование pH полости матки и не обна ружили взаимосвязи между выделенными микро организмами и его значениями, а также его влияния на репродуктивные исходы [32].
Микробиота эндометрия при хроническом эндометрите характеризовалась значительным увеличением частоты выявления стрептококков (в 8 раз; до 56 %), стафилококков (в 1,5 раза; до 80 %) и энтеробактерий (в 1,5 раза; до 60 %). Данное изменение состава микробиоты сочеталось со снижением частоты выявления Lactobacillus spp. (до 50 %). Кроме того, количественное содержание энтеробактерий и стрептококков было значительно выше у женщин с ХЭ, чем у женщин без ХЭ.
Высокая частота обнаружения энтеробактерий, стрептококков и стафилококков у женщин с хроническим эндометритом была также показана в работе E. Cicinelli et al. (2008) при изучении этиопатогенной роли инфекционных агентов в развитии ХЭ [7]. Наиболее часто у женщин с ХЭ в эндометрии выявляли стрептококки (в 28 % случаев), за ними следовали E. faecalis (14 %), E. coli (11 %), уреаплазмы (10 %), стафилококки (5 %), хламидии (3 %), дрожжеподобные грибы (2 %). Важно отметить, что стрептококки, стафилококки и E. faecalis у этих женщин определяли значительно чаще в эндометрии, чем во влагалище, тогда как для других микроорганизмов значимых различий обнаружено не было (за исключением уреаплазм, которые значительно чаще выявлялись во влагалище, чем в эндометрии). В более поздней работе этих же авторов была подтверждена высокая частота выявления энтеробактерий, энтерококков, стрептококков и стафилококков в эндометрии женщин с ХЭ [10].
Если этиологическая значимость бактерий, ассоциированых с бактериальным вагинозом, в развитии ВЗОМТ достаточно убедительно документирована [6, 35–37], то данные о роли этих бактерий в индукции и поддержании хронического воспаления эндометрия при ХЭ очень ограниченны и противоречивы. Так, в работе E.P. Korn et al. (1995) 10 из 22 женщин с бактериальным вагинозом имели плазмоклеточный эндо метрит, в то время как в контрольной группе данное состояние было диагностировано только у одной из 19 женщин. Ассоциированные с бактериальным вагинозом бактерии были выявлены в эндометриальных образцах у 9 из 11 женщин с плазмоклеточным эндометритом и у 11 из 30 женщин без него. Все отмеченные различия были статистически значимы [38]. В противоположность этому W.W. Andrews et al. (2006), изучая ассоциацию бессимптомного бактериального вагиноза с микробной колонизацией эндометрия и плазмоклеточным эндометритом, показали, что при бактериальном вагинозе повышен риск колонизации эндометрия бактериями, ассоции рованными с бактериальным вагинозом, одна ко связь между бактериальным вагинозом и плазмоклеточным эндометритом отсутствовала [39].
Заключение
Микрофлора полости матки у женщин без ХЭ характеризуется доминированием Lactobacillus spp. и Eubacterium spp. Развитие хронического воспаления в эндометрии ассоциировано с увеличением частоты детекции и количественного содержания Streptococcus spp., Staphylococcus spp. и бактерий семейства Enterobacteriaceae.
Для цитирования: Буданов П.В., Новахова Ж.Д., Чурганова А.А. Альтернатива антибактериальной терапии в акушерстве и гинекологии. РМЖ. Мать и дитя. 2015;23(1):14.
Инфекционная патология женских половых органов является наиболее актуальной проблемой акушерства, гинекологии и перинатологии, т. к. именно с ней связаны воспалительные заболевания гениталий, привычное невынашивание беременности, бесплодие, хронические тазовые боли, внутриутробная инфекция плода и новорожденного [1–4].
Этиологическая структура воспалительных заболеваний половых органов женщины крайне разнообразна. Спектр возбудителей включает в себя десятки видов всех классов микроорганизмов — бактерии, вирусы, простейшие и грибы [5, 6]. Преобладают смешанные инфекции, в составе которых частота бактериальных агентов и их ассоциаций превышает 60%. При внутриутробной инфекции резко увеличивается частота осложнений беременности, ассоциированных с бактериальными поражениями. Преобладают потери беременности и плацентарная недостаточность [3, 7, 8]. Среди инфекционных причин антенатальной смертности смешанные инфекции составляют 75% [2, 3, 7].
В последнее время стало понятно, что без использования современных достижений фундаментальной и клинической микробиологии решить проблему инфекционной патологии практически невозможно. Успехи в области молекулярной и биохимической вирусологии связаны с раскрытием стратегии вирусного генома, выявлением особенностей биосинтеза облигатных для бактерий паразитов — бактериофагов. Тем не менее, проблема профилактики и лечения различных острых и хронических, персистирующих бактериальных инфекций, до сих пор далека от окончательного разрешения [4, 5].
Важными вопросами являются выбор метода контроля за эффективностью лечения, определение критериев бактериологической излеченности, безопасность терапии [2, 4, 6, 9]. Неадекватная оценка тяжести течения инфекционного процесса и неправильно разработанная стратегия терапии приводят к развитию аутоиммунной патологии и хронизации воспалительных заболеваний [9–11].
В структуре патологии, связанной с персистирующими, рецидивирующими инфекциями, глобальной проблемой являются нарушения иммунитета. В настоящее время более 1/3 всей патологии человека протекает в сочетании с клиническими признаками иммунной недостаточности, что определяет тяжесть клинических проявлений заболевания, развитие осложнений и ухудшение прогноза. Именно снижение локальной и общей резистентности организма приводит к длительно существующим заболеваниям.
Изменение парадигмы иммунитета беременности создает длительно существующее повышение риска манифестации и рецидивирования персистирующих инфекций у беременных и новорожденных [1–3, 7].
В настоящее время основой правильной врачебной деятельности является использование принципов доказательной медицины, основывающейся на знании сочетания доказанной эффективности лечебных воздействий и подтверждения их безопасности. Именно оценка соотношения предполагаемой пользы и прогнозируемого (ожидаемого) риска является краеугольным камнем качественной клинической практики [2, 4]. Особенно высокие требования к безопасности назначаемого медикаментозного лечения предъявляются в акушерстве и педиатрии.
Широкое распространение антибиотикотерапии в середине XX в. имело свои преимущества за счет универсальности воздействия антибиотиков (широкого спектра их действия), возможности проведения эмпирической терапии и отсутствия устойчивых штаммов микроорганизмов.
В настоящее время проблема антибиотикорезистентности имеет критическое значение для всех областей клинической медицины. Полимикробная этиология инфекционных заболеваний в акушерстве и гинекологии, селекция резистентных штаммов возбудителей приводят к резкому снижению эффективности антибактериальных препаратов первого ряда выбора. Существующие рекомендации для лечения воспалительных заболеваний включают уже и применение нескольких антибактериальных препаратов [12].
Антибактериальная терапия может явиться причиной развития дисбактериоза. В случае применения антибиотиков на фоне дисбактериоза может усиливаться степень его выраженности. Кроме того, антибиотики снижают колонизационную резистентность влагалища и кишечника, увеличивают проницаемость слизистой оболочки, способствуя тем самым проникновению микроорганизмов в кровяное русло, внутренние органы и развитию вторичного очага инфекции и аллергизации организма [12, 13].
Назначение бактериофагов можно без преувеличений назвать высокоспецифичной антибактериальной терапией. Исторически единственными лекарственными средствами, подавляющими рост бактерий, были антибактериальные вирусы — бактериофаги. Препараты бактериофагов имеют хорошие перспективы в качестве альтернативы химиотерапевтической антибактериальной терапии. В отличие от антибиотиков они обладают строгой селективностью действия, не подавляют нормальную микрофлору, стимулируют факторы специфического и неспецифического иммунитета, что особенно значимо при лечении хронических воспалительных заболеваний или бактерионосительства.
Характеристика и классификация
бактериофаги содержат поликлональные вирулентные бактериофаги широкого диапазона действия, активные и в отношении бактерий, устойчивых к антибиотикам [18]. Фаготерапия может успешно сочетаться с назначением антибиотиков [19].
Для приготовления препаратов бактериофагов используют вирулентные фаги, выделенные из окружающей среды и адаптированные к гомологичным возбудителям [20].
Достоинство поливалентных (монокомпонентных) препаратов заключается в строгой специфичности действия, поскольку они вызывают гибель только своего конкретного вида бактерий и в отличие от антибиотиков не влияют на нормальную микрофлору влагалища и кишечника больного. Использование бактериофагов показало хорошие результаты при лечении и профилактике кишечных инфекций, дисбактериозов, заболеваний при хирургической, педиатрической, гинекологической, ЛОР и офтальмологической патологии. Отечественными неонатологами показана высокая эффективность фаготерапии инфекций у детей раннего возраста.
Поликомпонентные препараты бактериофагов наиболее удобны в клинической практике врача , принимая во внимание постоянное существование смешанных бактериальных ассоциаций [11, 17, 22].
После определения чувствительности бактерий к конкретному фагу можно использовать монокомпонентные поливалентные бактериофаги. Разнообразие механизмов резистентности к антибиотикам обусловливает возможность комбинированного применения химиопрепарата с антибактериальной активностью в сочетании с бактериофагом (). Особенно эффективна такая комбинация для разрушения микробных биопленок.
Препараты бактериофагов могут назначаться для профилактики и лечения инфекционных заболеваний, нарушений микроценоза, а также для предотвращения колонизации слизистых оболочек женских половых органов бактериями. В условиях роста антибиотикорезистентности можно рассматривать бактериофаги как успешную альтернативу антибиотикам [14, 15, 17, 22].
Комбинированные препараты фагов имеют более высокую активность литического действия на бактериальную клетку за счет синергизма действия отдельных фагов и обеспечивают получение лечебного эффекта при инфекциях, вызванных ассоциациями микробов.
Существуют разнообразные лекарственные формы бактериофагов: жидкие, таблетированные, гели. Хранятся бактериофаги при температуре от 2 до 10°С в сухом темном месте в течение лет. Важным условием, обеспечивающим результативность лечения фаговыми препаратами, является определение чувствительности к ним возбудителя [21].
Механизм действия бактериофагов
Вирулентные бактериофаги, адсорбируясь на поверхности гомологичной микробной клетки, инъецируют свой генетический материал в ее цитоплазму, где интенсивно размножаются, используя структурные компоненты клетки, и разрушают ее. Далее зрелые фаговые частицы готовы к новому заражению, и литический процесс повторяется с новыми и новыми бактериальными клетками. Скорость инфицирования бактериальных клеток может достигать 1023 за 1 секунду [21].
Методика определения чувствительности микроорганизмов к бактериофагам
Определение фагочувствительности проводят на 1,5% агаре или агаре Хоттингера (для стафилококков и стрептококков в питательный агар добавляют 0,4% глюкозы). Дно чашки Петри с обратной стороны предварительно расчерчивают соответственно используемым фаговым препаратам.
Бактериальную суспензию суточной агаровой культуры (5 ед. по ОСО П) выделенного бактериального штамма равномерно распределяют по поверхности чашки Петри с хорошо подсушенной питательной средой. Излишек жидкости удаляют пастеровской пипеткой и подсушивают в зоне пламени горелки в течение 20–30 с.
На поверхность агара с впитавшейся культурой пастеровской пипеткой с тонко оттянутым концом наносят по 1 капле (0,03 мл) образца препарата бактериофагов. После подсыхания капель фагов чашки инкубируют в термостате при температуре 37°С в течение 18–20 ч, для бактерий рода Proteus — в течение 4–6 ч.
Учет и регистрация результатов проводятся по схеме:
+++ — полусливной лизис (незначительный рост культуры в зоне лизиса);
++ — наличие в месте нанесения капли фага более 50 колоний фага (пятна лизиса);
+ — от 20 до 50 колоний фага;
± — менее 20 колоний фага;
— полное отсутствие лизиса. Наличие зон лизиса ++++ и +++ свидетельствует о высокой чувствительности изучаемого штамма к фагу, ++ — умеренной, + — слабой чувствительности. Предпочтение должно быть отдано бактериофагам, вызывающим лизис с интенсивностью ++++ и +++ [17].
Безопасность
Являясь безвредным биологическим методом лечения, фаготерапия может применяться во время беременности, в периоде новорожденности и у детей раннего возраста.
В настоящее время в клинической медицине используют только литические формы бактериофагов, которые обладают бактерицидным действием и четким механизмом саморегуляции собственной популяционной активности.
Для получения положительных результатов использования бактериофагов необходимо предварительное исследование чувствительности к ним микроорганизмов. При использовании бактериофагов в крупных клиниках, больницах целесообразно включать их в состав производственных штаммов, на которых готовятся коммерческие препараты, госпитальные штаммы возбудителей заболеваний, характерных для данного стационара.
Результаты собственных исследований
Всего в исследование включили 136 женщин. С воспалительными заболеваниями органов малого таза (ВЗОМТ) были 73 пациентки, 32 из которых получали стандартную антибактериальную терапию в сочетании с пероральным приемом Секстафага®, 41 — только противомикробные препараты. Критериями исключения явились тяжелое и осложненное течение инфекции.
Больных с рецидивирующими нарушениями микроценоза влагалища (63) также разделили на две группы: 28 женщин получали только Секстафаг®, 35 — только метронидазол интравагинально. Критерием исключения служило обнаружение вульвовагинального кандидоза.
Внутри подгрупп не было достоверных отличий по возрасту и соматической патологии. Наблюдение за пациентами продолжали на протяжении 6 мес.
Пиобактериофаг поливалентный (Секстафаг®) обладает способностью специфически лизировать микроорганизмы (стафилококки, стрептококки, патогенные кишечные и синегнойные бактерии), Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae. Перорально препарат поливалентного бактериофага пациенты получали по 20,0 мл 2 р./сут на протяжении 10 дней. Пероральный прием предваряли приемом щелочной минеральной воды или раствором пищевой соды.
Интравагинально Секстафаг® вводили по 10,0 мл 2 р./сут на тампоне с экспозицией 60 мин на протяжении 10 дней.
В результате проведения исследования отмечено, что у больных ВЗОМТ, получавших комбинированную фагоантибиотикотерапию, продолжительность лечения сократилась в среднем до 5,8 cут, в то время как у пациентов только с антибиотиками продолжительность эффективного курса составила 8,7 сут.
Среди пациенток с рецидивирующими нарушениями микроценоза влагалища эффективность монотерапии в виде интравагинального введения полифага составила 85,7% (24 из 28). При назначении метронидазола интравагинально микробиологическая эффективность достигала 71,4% (25 из 35). Частота рецидивов бактериального вагиноза и неспецифического кольпита на протяжении 6 мес. наблюдения снизилась в 4,2 раза после применения поливалентного бактериофага.
Во время назначения препарата бактериофага не было отмечено аллергических реакций, немотивированного отказа от лечения. На фоне антибиотикотерапии только у одной пациентки развились диспептические явления, не потребовавшие дополнительного лечения и отказа от основной терапии.
Изолированно от проведения настоящего исследования выполнена оценка эффективности профилактического использования препарата с бактериофагами для профилактики рецидивирования вагинальных инфекций.
Принимая во внимание, что целевую когорту пациентов составили 32 женщины, демонстрируем предварительные результаты наблюдений, длившихся на протяжении не более 7 мес.
Антибактериальное средство Фагогин предназначено для профилактики вульвовагинальных инфекций и инфекционных заболеваний половых органов, а также является средством интимной гигиены. Использование средства Фагогин как средства профилактики особенно актуально у беременных для снижения риска манифестации и рецидивирования персистирующих инфекций.
Гель Фагогин вводился интравагинально по 5 мл 2–3 р./сут на протяжении 3–4 недель. Обязательной рекомендацией являлось использование геля Фагогин в качестве гигиенической процедуры после полового контакта.
После 3 нед. терапии у 87,5% пациенток жалобы купировались. Явления посткоитального цистита регрессировали у 8 (66,7%) женщин. Принципы клинических решений применения бактериофагов в гинекологии представлены на рисунке 1.
На данном этапе накопленных знаний фундаментальной и клинической микробиологии и вирусологии, имеющегося клинического опыта необходимо выделить доказанные преимущества фаготерапии:
- строгая специфичность: бактериофаги воздействуют только на чувствительные к ним бактерии, в то время как антибиотики поражают бактерии без специфичности, вызывая угнетение нормальной микрофлоры и формирование резистентности;
- быстродействие и глубокое проникновение в очаг инфекции: при пероральном приеме через 1 ч бактериофаги попадают в кровь, через 1–1,5 ч выявляются из бронхолегочного экссудата и с поверхности ожоговых ран, через 2 ч — из мочи, а также из ликвора больных с травмами;
- самовоспроизведение: ДНК бактериофага встраивается в хромосому бактерии, вследствие чего бактериальная клетка начинает продуцировать сотни бактериофагов, поражающих бактерии до их полного уничтожения;
- саморегуляция: в отсутствие бактерий, необходимых для размножения, бактериофаги быстро и полностью удаляются из организма;
- безопасность и отсутствие противопоказаний: препараты бактериофагов можно назначать беременным, кормящим матерям и детям любого возраста, включая недоношенных;
- полная совместимость с любыми лекарственными средствами: доказанная эффективность препаратов бактериофагов как при монотерапии, так и в комбинации с антибиотиками;
- стимуляция специфического и неспецифического иммунитета: фаготерапия особенно эффективна при лечении хронических воспалительных заболеваний на фоне иммунодепрессивных состояний;
- постоянная актуализация фаговых клонов: препараты бактериофагов соответствуют современной этиологической структуре возбудителей.
- монотерапия нарушений микроценоза влагалища;
- монотерапия или комбинация с антибиотиками при лечении ВЗОМТ, хронического эндометрита;
- профилактика и лечение инфекций во время беременности с экстрагенитальной локализацией первичного очага;
- профилактика и лечение внутриутробной инфекции;
- профилактика и лечение послеоперационных осложнений при гинекологических вмешательствах и кесаревом сечении.
Таким образом, в условиях формирования антимикробной резистентности, формирования устойчивых бактериальных пленок необходимость в новых альтернативных лечебных технологиях и антимикробных препаратах приобретает все большую значимость. Перспективы применения бактериофагов касаются не только антимикробной терапии, но и высокоточной диагностики, а также онкологии. Проведенное исследование показало, что поливалентный пиобактериофаг в виде монотерапии и сочетанной с антибиотиками терапии повышает эффективность лечения, уменьшает частоту рецидивов и обладает высокой комплаентностью.



Что такое эндометрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Делеске И. А., гинеколога со стажем в 9 лет.
Над статьей доктора Делеске И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Эндометрит — это воспаление внутреннего слоя матки (эндометрия), которое приводит к изменению его функций. Возникает в результате заражения этой области микробами, вирусами и грибковыми инфекциями.
Эндометрит — одно из наиболее распространенных гинекологических заболеваний. По данным зарубежных источников, распространенность эндометрита составляет 20% в популяции, отечественные авторы указывают до 60-70%, чаще всего болеют женщины репродуктивного возраста [9] [11] . Стабильный рост заболеваемости отмечается последние 20-30 лет [1] [10] . Часто встречается в сочетании с ранним началом половой жизни, отсутствием контрацепции, абортами, наличием хронических воспалительных заболеваний нижнего отдела репродуктивного тракта. [7] [8] .
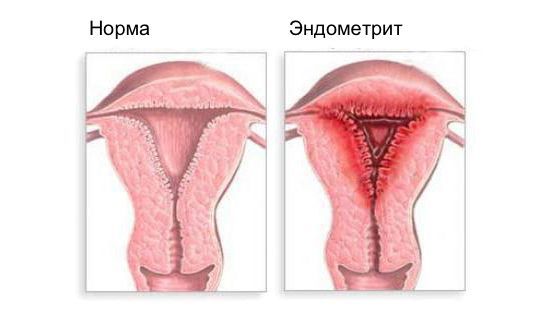
Эндометрит часто является причиной бесплодия, привычного невынашивания (два и более выкидыша в анамнезе), нарушения менструального цикла, осложнений беременности, родов и послеродового периода, неудачных попыток ЭКО, гиперпластических заболеваний эндометрия и сексуальных проблем [1] .
Чем эндометрит отличается от эндометриоза
Эндометриоз — это разрастание эндометриоидной ткани. Эндометриоз может поражать полость матки, её оболочки, маточные трубы, яичники, брюшину и области вне половых органов. Эндометритом же называют воспаление внутреннего слоя матки.
Причины эндометрита
В женском репродуктивном тракте присутствуют различные микроорганизмы, среди которых преобладают Lactobacillus spp. Эндометрит чаще ассоциирован с чрезмерным размножением бактерий Enterobacter, Enterococcus, Streptococcus, Staphylococcus, Ureaplasma, Mycoplasma.
Эндометрит вызывают также вирусные инфекционные агенты: вирус герпеса, цитомегаловирус, вирус папилломы человека, энтеровирусы и аденовирусы.
Возможен эндометрит специфической этиологии: гонорейный, туберкулезный, актиномикотический (грибковая инфекция) и неспецифический. [8] [7] [10] .
Риск развития эндометрита увеличивают:
- манипуляции в полости матки — аборты, выскабливания, метросальпингография (контрастное рентгенологическое исследование полости матки и проходимости фаллопиевых труб), введение внутриматочного контрацептива, инсеминация (введение спермы), ЭКО;
- заболевания мочевыделительной системы;
- операции на органах малого таза;
- послеродовые гнойно-воспалительные осложнения;
- другие гинекологические заболевания (хронический сальпингоофорит, цервицит, гиперплазия эндометрия, полип эндометрия);
- частая смена половых партнеров;
- незащищенные половые связи;
- предшествующие прерывания беременности;
- кесарево сечение до 28 недель гестации;
- длительный безводный период в родах;
- ручное отделение плаценты;
- инвазивные исследования для пренатальной диагностики;
- длительное ношение внутриматочного контрацептива.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы эндометрита
Воспаление может протекать в острой и хронической форме. Чаще всего симптомы эндометрита появляются на четвёртый день после инфицирования. При острой форме эндометрита отмечаются общие симптомы воспаления, такие как слабость, быстрая утомляемость, повышение температуры тела, изменения в общем анализе крови (сдвиг лейкоцитарной формулы влево и повышение СОЭ).
К локальным симптомам острого эндометрита можно отнести:
- периодические умеренные или острые тянущие боли внизу живота, иногда отдающие вниз спины и в пах;
- жидкие гноевидные выделения из половых путей с неприятным запахом (возможно с примесью крови);
- диспареуния (боль при половом акте).
При отсутствии правильного и своевременного лечения эндометрита в течении 10 дней возможен переход в хронический воспалительный процесс. При этом держится повышенная температура, появляются новые симптомы:
- нарушение менструального цикла, мажущие кровянистые выделения в середине цикла;
- привычное невынашивание беременности;
- серозно-гнойные выделения из половых путей;
- ноющие боли внизу живота;
- боль во время секса [3][5][8] .
Течение острого послеродового эндометрита более тяжёлое, проявляется в следующих симптомах:
Эндометрит при беременности
Эндометрит препятствует имплантации плодного яйца, из-за чего оно может отторгнуться полностью или возникнет нарушение процессов имплантации. В дальнейшем это может привести к выкидышу или замершей беременности.
Если воспалительный процесс усиливается, может развиться хориоамнионит — воспаление плаценты, которое приводит к разрыву плодных оболочек, излитию околоплодных вод и преждевременным родам.
Чтобы избежать возможных осложнений, женщинам с хроническим эндометритом при планировании беременности необходимо пройти комплексное лечение.
Патогенез эндометрита
На начальном этапе воспаления инфекционный агент (бактерии, вирусы или грибки) внедряется в слизистую оболочку матки. Начинается выработка медиаторов воспаления, которая приводит к нарушению микроциркуляции крови в его очаге. Миграция лейкоцитов в зону повреждения, активация нейтрафилов и макрофагов ведёт к активной выработке цитокинов и перекиси водорода, запуску перекисного окисления липидов с повреждением мембран клеток. В это время на фоне повышенной выработки цитокинов и факторов роста происходит деградация матрикса клеток. Нарушение микроциркуляции крови приводит к развитию локальной ишемии и гипоксии ткани, которые затем активируют процессы склерозирования. При длительной стимуляции иммунной системы происходит её истощение и появление аутоиммунных реакций.
В 95% случаев эндометрит является первичным — патогенные микроорганизмы попадают в полость матки восходящим путём, при половом контакте или гинекологических манипуляциях . В 5% случае эндометрит носит вторичный характер: инфекция попадает в эндометрий гематогенным путем, либо же лимфогенным или нисходящим путём (с верхних отделов репродуктивного тракта).
При длительности воспалительного процесса более 2 месяцев можно расценивать его как хронический процесс. Развиваются изменения в структуре и функции ткани, происходит нарушение пролиферации (деления клеток) и физиологической циклической трансформации эндометрия. В связи с этим возможно нарушение нормальной имплантации эмбриона при беременности.
Существует аутоиммунная теория патогенезе хронического эндометрита. Она говорит о том, что при длительном воздействии инфекционного агента на иммунную систему происходит вторичное повреждение эндометрия. При этом нарушается процесс апоптоза (запрограммированной гибели клетки) [11] .
Классификация и стадии развития эндометрита
Эндометрит можно разделить на острую и хроническую форму.
Острый эндометрит возникает при абортах, диагностических манипуляциях, выскабливании, развивается быстро, воспаление сопровождается острыми или ноющими болями и повышением температуры. Наиболее частый путь инфекции при нём — восходящий. Распространение инфекции из влагалища в верхние отделы репродуктивного тракта происходит при несостоятельности барьера шейки матки. Воспаление может локализоваться в эндометрии, а также переходить на миометрий. При несвоевременном и неполноценном лечении возможно развитие пельвиоперитонита (воспаление оболочки брюшины в области малого таза).
Отдельно выделяется острый послеродовый эндометрит — начинается на 2-4 сутки после родов, ему может предшествовать хориоамнионит (инфицирование оболочек плода и жидкости).
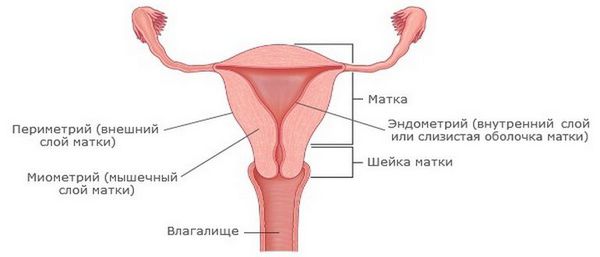
При хроническом эндометрите симптоматика сглажена. Характерны периодические обострения и рецидивы после переохлаждения и воспаления другой локализации урогенитального тракта.
По клиническим проявлениям эндометрит подразделяется на клиничеcки выраженную и субклиническую форму.
По характеру воспалительного процесса эндометрит можно разделить на:
- Катаральную форму (поражение поверхностных слоев слизистой оболочки матки и выделение слизистого экссудата).
- Катарально-гнойную форму.
- Гнойную форму.
- Некротическую форму.
- Гангренозную форму.
По морфологическим признакам:
- Атрофический эндометрит — наблюдается атрофия желез эндометрия, фиброз стромы, инфильтрация лимфоидными элементами;
- Кистозный эндометрит — сдавление протоков желез фиброзной тканью, образование кистозных элементов в эндометрии;
- Гипертрофический эндометрит — характеризуется гипертрофией желез эндометрия в результате хронического воспаления [5] .
Осложнения эндометрита
Осложнения у эндометрита могут быть достаточно серьёзными.
Метротромбофлебит (тромбоз тазовых вен) развивается через 2-3 недели от начала заболевания эндометритом. Пациентки отмечают общие симптомы воспаления, сохраняющуюся повышенную температуру тела, тянущие или острые боли внизу живота, выделения из половых путей [1] [2] .
Параметрит — воспаление околоматочной клетчатки. После внедрения инфекционного возбудителя в параметрий возможно образование диффузного воспалительного инфильтрата. При отсутствии лечения происходит нагноение и переход в хроническое течение. При переходе на всю клетчатку развивается пельвиоцеллюлит (воспаление клетчатчки малого таза) [2] [9] [10] .
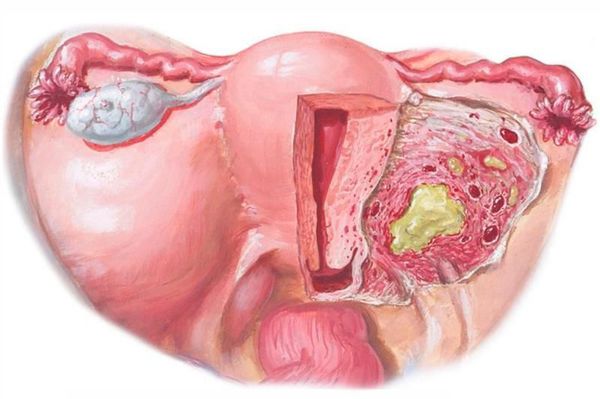
Пельвиоперитонит — воспаление выходит за пределы матки, в процесс вовлекаются листки брюшины. Пациентки отмечают резкое повышение температуры, симптомы интоксикации, тошноту, рвоту, интенсивные боли внизу живота (основная локализация ниже пупка), симптом раздражения брюшины ( резкое усиление боли в животе при быстром надавливании и снятии руки).
Сальпингоофорит — воспалительный процесс в маточных трубах и яичнике. Наиболее частые осложнения при несвоевременном лечении: пиовар (гнойное воспаление яичника) и туюоовар (формирование единого гнойного конгламерата из воспаленного яичника и маточной трубы). Все вышеперечисленные осложнения требуют оперативного лечения [2] [9] [10] .
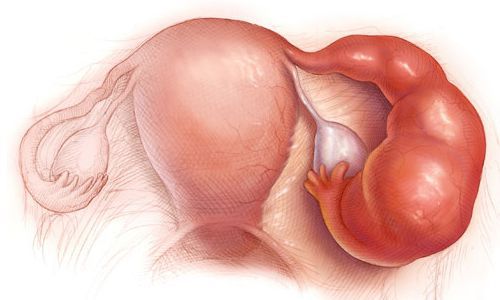
Другими осложнениями могут быть бесплодие, нарушение менструального цикла, выкидыши, внематочная беременность, спаечный процесс в малом тазу [1] [2] [3] .
В некоторых случаях возникает септический шок — угрожающее жизни осложнение, в условиях которого критически нарушается кровоснабжение тканей и клеточный метаболизм. Главные симптомы сепсиса — высокие показатели температуры тела, симптомы интоксикации, снижение давления и тахикардия, изменения в общих анализах крови, обильное потоотделение, спутанность сознания [8] [9] .
Диагностика эндометрита
Диагностика хронического эндометрита должна быть основана на комплексном подходе анализа жалоб пациентки, анамнеза, симптомов, результатов эхографических исследований, лабораторной диагностики, данных морфологического исследования эндометрия и иммунного статуса.
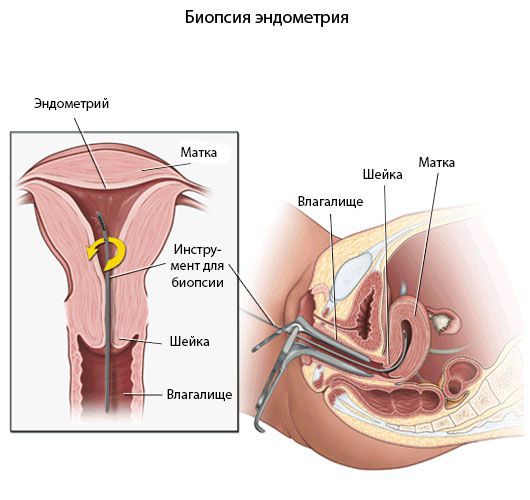
Пайпель-биопсия эндометрия
Хронический эндометрит диагностируют прежде всего с помощью морфологического исследования [8] .
Гистологический материал получают при выскабливании стенок полости матки под контролем гистероскопа или пайпель-биопсии. Пайпель-биопсия — это получение гистологического материала с помощью тонких канюль при аспирации (удалении) эндометрия. Данный метод имеет большую диагностическую ценность в амбулаторных условиях.
Критериями хронического эндометрита является наличие очаговых или диффузных лимфоидных инфильтратов, склероз стенок спиральных артерий, фиброз стромы и наличие плазматических клеток. При этом к абсолютным признакам хронического эндометрита относят плазматические клетки.
Микробиологическое исследование
Микробиологические посевы используются для выявления возбудителя воспалительного процесса.
Иммуногистохимическое исследование
Иммуногистохимическое исследование при эндометрите заключается в исследовании биоптата слизистой оболочки матки с целью определения мембранного белка, который является маркером плазматических клеток. Информативность гистологического исследования при этом возрастает до 85-90%, можно установить и иммунный характер повреждения эндометрия [5] [7] [8] .
УЗИ при эндометрите
При эхографии (УЗИ) хронический эндометрит определяют по:
- изменениям в структуре эндометрия;
- участкам повышенной эхогенности различной формы и величины в зоне М-Эхо;
- наличию сниженной эхогенности в эндометрии;
- наличию жидкости в полости матки;
- присутствию мелких кальцинатов 1-3 мм в эндометрии;
- участкам фиброза в эндометрии разной степени;
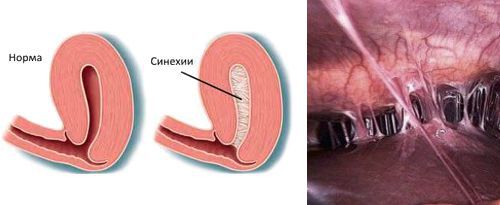
- наличию внутриматочных синехий.
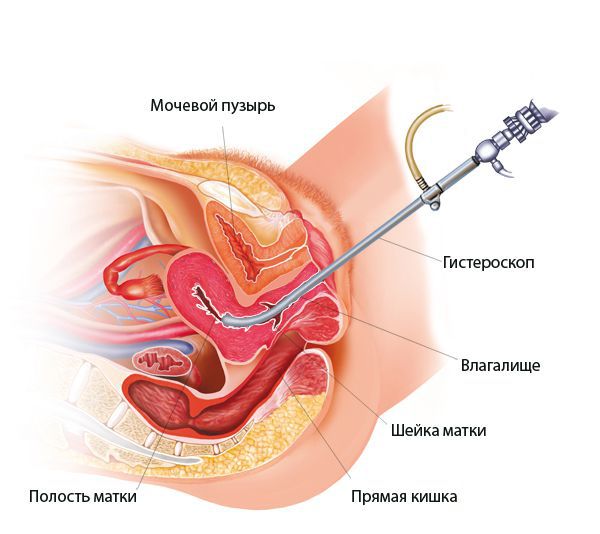
Гистероскопия при эндометрите
При гистероскопии определяются следующие признаки хронического эндометрита: гиперемия слизистой оболочки матки, неровномерная толщина эндометрия, полипообразные образования, кровоизлияния, очаговая гиперплазия эндометрия.
Лечение эндометрита
Лечение эндометрита на первом этапе заключается в устранении бактериального или грибкового возбудителя, а для эндометрита вирусной этиологии — снижении вирусной нагрузки [7] . Для этого проводят комплексное лечение, включающее в себя антибактериальную терапию, анаэробные средства, противовоспалительные и противовирусные лекарственные средства [5] [6] [8] .
Второй этап заключается в восстановлении рецептивности эндометрия и его функциональности. Успешное восстановление рецепторного аппарата эндометрия должно происходить без снижения пролиферации (размножения, разрастания) клеток. Устраняются последствия ишемии, склеротические процессы, восстановливается отток крови. Длительность и объёмы терапии зависят от тяжести воспалительного процесса и сопутствующей гинекологической патологии. После проведения основных этапов лечения необходим курс реабилитации (физио-терапевтическое лечение) [7] [8] [10] .
Иммуностимулирующую терапию применяют при комплексном лечении хронического эндометрита, если выявлена вирусная инфекция: вирус папилломы человека, герпеса, Эпштейна — Барр, цитомегаловирус.
Гормональную терапию используют для подготовки эндометрия, чаще всего перед ЭКО. Для применения гормональных препаратов необходимо гистологическое подтверждение патологии эндометрия.
Контрольные критерии эффективности терапии хронического эндометрита:
- допплерометрическое исследование сосудов матки с ЦДК во 2 фазу менструального цикла;
- определение ангиогенных факторов;
- клиническое улучшение.
Рекомендации по диагностике и лечении эффективны лишь у половины больных, а частота рецидивов остается на уровне 25 % [13] .
Прогноз. Профилактика
При своевременном и полноценном лечении прогноз благоприятный. Пациентки отмечают улучшение состояния в течении двух суток. При запоздалом лечении эндометрита возможно развитие септического шока.
Читайте также:

