Стафилококковая инфекция у детей клинические рекомендации
Обновлено: 18.04.2024
Для цитирования: Таточенко В.К. АНТИБАКТЕРИАЛЬНОЕ ЛЕЧЕНИЕ ОСТРЫХ БАКТЕРИАЛЬНЫХ ЗАБОЛЕВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ У ДЕТЕЙ. РМЖ. 1998;23:3.
При острых респираторно-вирусных инфекциях (ОРВИ) у детей антибактериальная терапия требуется всего в 6-8% случаев, сопровождающихся бактериальными осложнениями. В настоящей статье рассматриваются только поражения верхних дыхательных путей и некоторые виды бронхитов (вызванные микоплазмой и хламидиями), при которых показано назначение антибактериальных средств. К сожалению, частота назначения противомикробных препаратов у детей с ОРВИ существенно превышает эту цифру, достигая в поликлиниках 65 85% и в стационарах - 98%, причем антибактериальные средства в поликлинических условиях парентерально вводят более чем в 40%, а в стационарах - в 70% случаев [1,2]. При таком подходе на одного стационарного больного с неосложненной ОРВИ (ларингит, бронхит) приходится 39 инъекций, а на одного больного острой пневмонией - 74.
Очевидно, что при вирусной этиологии заболевания антибиотики, по меньшей мере, бесполезны, а, скорее всего, вредны из-за нарушения биоценоза дыхательных путей и их заселения несвойственной этому биотопу флорой, чаще кишечной [3]. Кроме того, всегда следует иметь в виду значительный риск аллергических реакций на антибиотики. Безусловно, эта ситуация нуждается в изменении, скорее всего, на основе выработки рациональных рекомендаций по антибактериальному лечению детей с острыми респираторными заболеваниями и их неукоснительного внедрения в практику.
Критерии диагностики бактериального осложнения ОРВИ
При наличии явного очага бактериального воспаления у ребенка с ОРВИ диагноз несложен, в качестве диагностических критериев можно использовать следующие.
Ангина. Гиперемия и отечность зева и миндалин, гнойные пробки или налеты.
Большая часть ангин у детей раннего возраста вызывается вирусами (адено-, энтеровирусы), но с возрастом повышается доля ангин, вызванных гемолитическим стрептококком группы А, которые чреваты иммунопатологическими изменениями, в частности ревматизмом.
Надежным критерием диагностики бактериального тонзиллита является выделение ( b -гемолитического стрептококка группы А из зева; это исследование, к сожалению, проводится в России далеко не везде. По клиническим данным фарингит этой этиологии достоверно диагностируется при скарлатине или сходной картине зева, в остальных случаях диагноз предположителен и требует бактериологического подтверждения. Основная цель антибактериальной терапии элиминация стрептококка для профилактики ревматизма, на клинические проявления фарингита это лечение оказывает влияние далеко не всегда (возможно вследствие сочетанной инфекции с участием вирусов).
Отит средний. Боли в ухе, высокая температура, часто симптомы интоксикации, выделения из уха. Диагноз ставится по клиническим данным, подтверждается при отоскопии. В этиологии отитов на первом месте стоит пневмококк, реже отит вызывает безкапсульная Haemophylus influenzae или Mora x ella catharralis. Стафилококк и синегнойная палочка вызывают отиты обычно у детей с дефектом иммунитета (недоношенность, тяжелое заболевание).
Синуит негнойный. Рентгенологические и эхографические признаки синуита (затемнение параназальных пазух) выявляются у 70% детей с респираторно-вирусной инфекцией; эти состояния не нуждаются в антибактериальном лечении [4]. Диагноз негнойного бактериального синуита ставится при сохранении этих изменений более 3 нед и наличии клинических проявлений в виде длительно сохраняющегося насморка, заложенности носа, неострых болевых ощущений в области пазух.
Основные возбудители - S. pneumoniae, Haemophylus influenzae, реже Staph. aureus (гнойный синуит!) или Moraxella catharralis.
Синуит гнойный. Обычно острейшее стафилококковое воспаление пазух характеризуется высокой температурой, интоксикацией, отеком щеки и периорбитальных тканей.
Лимфаденит. Увеличение и болезненность лимфатического узла (обычно тонзиллярного), часто с отеком окружающей клетчатки, при нагноении - с флюктуацией.
Этиология - стрептококковая, редко - стафилококковая.
Острый бронхит. Кашель, сухие и разнокалиберные влажные хрипы, при отсутствии инфильтративных или очаговых изменений в легочной ткани на рентгенограмме. Большинство острых бронхитов (85-95%) имеет вирусную этиологию, поэтому применение антибактериальных средств не требуется. Не оправдано и назначение этих препаратов в поздние сроки бронхита при усилении отхождения мокроты (нередко зеленоватой).
В 5- 15% случаев у детей дошкольного и школьного возраста, особенно в осенний период, наблюдаются бронхиты, обусловленные Mycoplasma pneumoniae, для них характерно обилие мелкопузырчатых хрипов и их асимметрия, а также наличие конъюнктивита (без обильного выпота).
Бронхит у детей в возрасте 0 - 5 месяцев может быть вызван Chlamidia trachomatis, у подростков - С. pneumoniae; их частота точно не известна, однако есть основания считать ее небольшой.
Бактериальный бронхит наблюдается у грудных детей с синдромом привычной аспирации пищи, обычно сопровождая аспирационную пневмонию. Бактериальный нисходящий трахеобронхит наблюдается как осложнение крупа (при интубации).
Эти данные показывают, что антибактериальное лечение острых бронхитов показано в небольшом проценте случаев, для расчета потребности можно предположить, что она необходима в 15% случаев.
Пневмония. Наличие дыхательных расстройств различной степени выраженности и характерных физикальных изменений (укорочение перкуторного звука, бронхиальное или ослабленное дыхание, мелкопузырчатые влажные хрипы над ограниченным участком грудной клетки). Рентгенологическое подтверждение базируется на выявлении очаговых или инфильтративных изменений на рентгенограмме. В данной статье проблема лечения пневмоний не рассматривается.
Подозрение на бактериальную инфекцию. Помимо заболеваний с явным бактериальным очагом по клиническим или параклиническим данным, в практике нередко встречаются случаи, при которых, несмотря на отсутствие явного очага (при доступной "глубине" обследования), исключить бактериальную инфекцию не представляется возможным.
В категорию больных ОРВИ с обоснованным подозрением на бактериальную инфекцию, в том числе пнев монию
Чувствительность пневмотропной флоры. Во многих странах мира за последнее десятилетие наблюдается рост устойчивости циркулирующих среди населения пневмококков к пенициллину, достигающая в юго-западных европейских странах 40 - 50% всех выделенных штаммов [5]: наши наблюдения показали отсутствие такой тенденции в Москве. В отношении этого возбудителя высокоактивны все пенициллины, макролиды линкомицин, цефалоспорины; практически неактивны аминогликозиды, а также тетрациклин.
На основании собственных 15-летних наблюдений мы можем сказать, что также на достаточно высоком уровне сохраняется и чувствительность Haemophylus influenzae (как капсульной, так и безкапсульной) к ампициллину и азитромицину, доксициклину и тетрациклину, аминогликозидам, цефалоспоринам 2 и 3-го поколений, рифампицину. В отношении этого возбудителя, однако, мы наблюдаем снижение чувствительности к пенициллину и цефалоспоринам 1-го поколения (цефалексину, цефазолину), эритромицину; многие штаммы этого возбудителя оказались малочувствительными к макролидам 2-го поколения и резистентным к линкомицину, оксациллину, олеандомицину.
Гемолитический стрептококк группы А сохраняет высокую чувствительность ко всем антибиотикам, кроме аминогликозидов. Тем не менее, применение многих препаратов дает нередко неудовлетворительные результаты, что связывают с инактивацией пенициллинов и других лактамовых препаратов лактамазой, выделяемой сопутствующей стрептококку флорой (гемофилюсом, моракселлой, стафилококками) [6]. Стрептококки других групп чувствительны к оксациллину, цефалоспоринам 2 - 3-го поколений, линкомицину и рифампицину, несколько меньше - к другим пенициллинам и макролидам.
Moraxella (Branchamella) catharhalis даже если и не вызывает воспалительный процесс, способна продуцировать лактамазу и ухудшать результаты лечения, например, стрептококкового фарингита пенициллинами.
Штаммы этого возбудителя высокочувствительны к макролидам, цефалоспоринам 2 - 3-го поколений, аминогликозидам и рифампицину, но резистентны к пенициллинам и линкомицину.
Внегоспитальные штаммы золотистого стафилококка в 1995 - 1996 гг. характеризовались довольно высоким процентом резистентности к цефалексину (43%), цефаклору (30%), цефтибутену (92%), оксациллину (28%)и небольшим (12- 15%)к эритромицину и олеандомицину.
У детей с повторными синуитами и отитами и у леченных ранее антибиотиками можно ожидать устойчивости флоры (особенно гемофильной палочки и моракселл) к антибиотикам, что необходимо учитывать при выборе стартовой терапии.
Антибактериальное лечение заболеваний дыхательных путей
Рекомендации по лечению бактериальных ОРЗ противомикробными средствами представлены в таблице.
Острый фаринготонзиллит. В лечении стрептококковых фаринготонзиллитов основная цель - стойкая элиминация стрептококка группы А, создающего риск развития ревматизма. Бактериологический контроль желателен не только через 10 дней лечения, но и через 4 - 6 нед, когда нередко наблюдаются бактериологические рецидивы.
С целью элиминации возбудителя применяется большинство антибиотиков, к которым этот возбудитель чувствителен (кроме аминогликозидов). Вопреки прежним рекомендациям о необходимости парентерального введения пенициллина у таких больных, доказан санирующий эффект оральных препаратов, в частности, пенициллина 50 мг/кг/сут, амоксициллина 40 мг/кг/сут или макролидов: олеандомицин 250 - 1000 мг/сут или эритромицин - 30 мг/кг/сут (но не более 1,5 г/сут). Длительность лечения - не менее 10 дней.
Антибнотики при бактериальных инфекциях верхних дыхательных путей
| Форма | Возбудитель | Стартовый препарат | Замена при неэффективности |
| Отит средний острый | S. pneumoniae, Н. influenzae, реже S. aureus | Внутрь феноксиметилпеницилин (ФМП), амоксициллин: эритромицин, другие макролиды | Внутрь ко-амоксиклав, цефалоспорин 2 - 3-го поколений внутрь, внутримышечно |
| Синуит острый негнойный | S. p neumoniae, Н. influenzae | Внутрь ФМП, амоксициллин: эритромицин, другие макролиды | Внутрь амоксицилин/клавуналат (АМЦ/КЛ), цефалоспорин 2 - 3-го поколений внутрь, внутримышечно |
| Синуит гнойный | S. aureus | Внутривенно оксациллин или цефазолин + гентамицин | Линкомицин или ванкомицин внутримышечно или внутривенно |
| Отит, синуит рецидивирующий, леченный антибиотиками | Устойчивые S. aureus, реже Moraxella catarrhalis H. Influenzae | Внутрь ко-амоксиклав, внутрь или внутримышечно цефалоспорин 2 - 3-го поколений | Внутримышечно оксациллин, внутримышечно цефалоспорин 1 - 3-го поколений + гентамицин |
| Тонзиллит острый | Str. pyogenes ( b -гемолитический, группы A | Внутрь ФМП, макролиды, цефалексин 10 дней, цефуроксим-аксетил, цефтибутен 5 дней | |
| Бронхит | Вирусы | Антибактериальное лечение не проводится | |
| Бронхит | M. pneumoniae | Эритромицин, другие макролиды | |
| Бронхит | Chlamidia spp. | Эритромицин, другие макролиды | Ко-тримоксазол |
Поскольку 10-дневный курс лечения при быстром улучшении состояния больного выдерживается далеко не всеми родителями, частота бактериологических рецидивов достаточна велика. Поиски возможностей более коротких курсов показали, что, например, 3- или 5-дневный курс азитромицина дает большую частоту рецидивов, чем 10-дневный курс феноксиметилпенициллина [7]. Опубликованы данные об успешном 5-дневном курсе лечения цефтибутеном 9 мг/кг/сут (не более 400 мг/сут) или цефуроксим-аксетилом 20 мг/кг/сут [8].
Поскольку клинически ангины с высевом и без высева стрептококка отличить невозможно, важно знать группы больных, у которых наличие стрептококка более вероятно. По данным ВОЗ [9], совпадающим с нашими, стрептококк чаще выделяется у детей с ангиной в возрасте старше 5 лет; чаще высевы оказываются положительными в весеннее время. Этими параметрами можно руководствоваться при решении вопроса о проведении антибактериального лечения тонзиллофарингитов, если бактериологическое обследование невозможно.
Средний отит. Выявление отита при ОРВИ служит основанием для назначения антибактериальной терапии оральными препаратами. В отношении и пневмококка, и гемофильной палочка активны: внутрь амоксициллин 20 - 50 мг/кг/сут, ампициллин 50 - 80 мг/кг/сут, эритромицин-основание 30 - 50 мг/кг/сут (не более 2 г/сут). В отношении, в основном, пневмококка активны: внутрь пенициллин 50 мг/кг, олеандомицин 250 - 1000 мг/сут, джосамицин 30 - 50 мг/кг/сут (не более 1000 мг/сут), рокситромицин 50 - 100 мг/сут, мидекамицин 30 - 50 мг/кг/сут (не более 1200 мг/сут).
Большинство авторов указывают на необходимость лечения отита в течение не менее 1 0 дней.
Мы убедились в высокой эффективности оральной антибактериальной терапии (пенициллин, ампициллин, амоксициллин, котримоксазол, макролиды).
При неэффективности этих средств, как и у детей, получавших до заболевания антибиотики, оправдано применение препаратов второго выбора - амоксицилин/клавуналат 50 мг/кг/сут, цефуроксим-аксетила 25 - 50 мг/кг/сут, цефаклора 20 мг/кг/сут, цефтибутена 9 мг/кг/сут или азитромицина 5 мг/кг/сут (3-5 дней). В тяжелых случаях парентерально вводят комбинацию гентамицина (6 мг/кг/сут) с ампициллином (100 мг/кг/сут) или цефамизином (100 мг/кгсут), а также цефалоспорины 3-го поколения. При рецидивирующих отитах следует руководствоваться результатами посева отделяемого из уха и обсудить необходимость хирургического лечения с ЛОР-врачем (аденотомия, шунтирование).
Негнойные синуиты. Лечение проводится с использованием такой же тактики, как и при отите; следует помнить, что антибиотики не влияют на клиническую картину и скорость обратного развития изменения в пазухах в остром периоде ОРВИ, так как они отражают чисто вирусное воспаление слизистой. Ставить вопрос о лечении синуита следует только на 3 - 4-й неделе ОРЗ при сохранении клинических и рентгенологических данных.
Гнойный синуит. Заболевание требует интенсивной терапии и часто хирургического вмешательства. При нем показано парентеральное введение оксациллина 150 мг/кг/сут или цефамизина 100 мг/кг/сут, лучше в комбинации с гентамицином 6 мг/кг/сут, также подавляющем рост стафилококка.
Бронхит острый. Поскольку в большинстве случаев этиология бронхитов (в том числе обструктивных у детей раннего возраста) - вирусная, их антибактериальное лечение не показано. Во время вирусного бронхита, как и при любом ОРВИ, происходит неинвазивное размножение пневмококка и гемофильной палочки (но не стафилококка) в мокроте, однако, как показали контролируемые испытания, проведение антибактериального лечения никак не отражается на течении заболевания.
Антибактериальное лечение показано при 2 формах бронхита. У дошкольников и школьников в период эпидемического подъема мико-плазменной инфекции бронхиты этой этиологии поддаются лечению макролидами [10]. Можно использовать эритромицин-основание 30 - 50 мг/кг/сут (но не более 2 г/сут) или олеандомицин 250 - 1000 мг/сут 5 дней. Их можно заменить другими макролидами рокситромицином 50 - 100 мг/сут, мидекамицином 30 - 50 мг/кг/сут (не более 1200 мг/сут) или джосамицином 30 - 50 мг/кг/сут (не более 1000 мг/сут).
При хламидийных бронхитах у детей первого полугодия жизни (перинатальное заражение) применяют макролиды в указанных дозах, а также ко-тримоксазол по 6 - 8 мг/кг/сут по триметоприму; такое лечение может ускорить выздоровление [11]. Для лечения хламидийных бронхитов у подростков используются те же препараты и дозы, что и для микоплазменных бронхитов.
Прогресс наших знаний о бактериальных респираторных заболеваниях и расширение спектра антибактериальных средств существенно улучшило их прогноз. Сейчас стоит задача как можно больше сузить показания к антибактериальному лечению и упростить его, сделать его целенаправленным и менее травмирующим, более безопасным и дешевым. Педиатры должны выработать систему самоконтроля, которая позволила бы сократить излишнее использование антибактериальных средств и уменьшила бы травматизацию и другие нежелательные проявления их применения.
1. Стекольщикова И.А. Диагностические подходы и терапевтическая тактика на разных этапах течения острых респираторных заболеваний у детей. - Дисс. канд. - М., 1993. - 197с.
2. Шохтобов X. Оптимизация ведения больных с острыми респираторными инфекциями на педиатрическом участке. - Дисс. канд. - М., 1990. - 130 с.
3. Таточенко В. К. (ред.) Острые пневмонии у детей. Изд. Чувашского университета, Чебоксары, 1994.
4. Толкачев А.М. Изменения в придаточных пазухах носа при острых респираторных заболеваниях у детей. Автореф. дисс. канд. - М., 1988. - 20 с.
5. Baquero F. Epidemiology of resistant pneumococcus in Spain, 1st European Pediatric Congress, Paris, 9-12 March 1994. An abstract.
6. Pichichero ME, Margolis PA. A comparison ofcephalosporins and penicillins in the treatment of group A beta-hemolytic streptococcal pharyngitis: a meta-analysis supporting the concept ofmicrobial copathogenicity. Pediatr Infect Dis J 199 1:10:275-81.
7. Reed М, Blumer J. Azithromycin: a critical review of the first azilide antibiotic and its role in pediatric practice. Pediatr Infect Dis 1997:16(11):1069-83.
8. Mehra S, Van Moerkerke М, Weick J, et al. Short-course therapy with ce furoxime axetilfor group A streptococcal tonsillopharyngitis in children. Pediatr Infect Dis 1998:17(6):452-7.
9. Acute respiratory infections in children: Case management in small hospitals in developing countries. A manual for doctors and other senior health workers. Document WHO/ARI/90.5. World Health Organization. Geneva.
10. Мохамад А. Респираторные формы микоплазменной инфекции у детей. Автореф. дисс. канд. - М., 1986. - 23 с.
11. Шамансурова Э.О. Респираторный хламидиоз у детей. Автореф. дисс. канд. М., 1988. - 21 с.

05 августа 2020 г. панелью экспертов опубликована статья "Лечение стафилококковой бактериемии (золотистый стафилококк) у новорожденных, детей и подростков".
- малый возраст (особенно менее 1-го месяца), социально-экономические факторы, и наличие центрального венозного катетера являются важными факторами риска в развитии стафилококковой бактериемии у детей. Коморбидные состояния также являются фактором риска в развитии стафилококковой бактериемии у детей и взрослых.
- Да, все эпизоды стафилококковой бактериемии у детей должны рассматриваться как клинически значимые.
- Осложненная стафилококковая бактериемия у детей может включать персистирующую бактериемию и/или лихорадку более 72 часов на таргетированной терапии, мультифокальные локализации инфекции, эндокардит, и комплексные местные болезни с вовлечением множественных прилегающих тканевых структур (например, тромбоз глубоких вен и кость).
Всем ли детям со стафилококковой бактериемией требуется консультация инфекциониста, ЭХОКГ, визуализация и повторные контрольные посевы крови?
- всем детям со стафилококковой бактериемией рекомендуется консультация инфекциониста. Трансторакальная ЭХОКГ рекомендуется у детей со стафилококковой бактериемией и с одним или более из следующего: 1) структурная патология сердца (включая пейсмейкеры), 2) устойчивая бактериемия (бактериемия ≥2 дней ), 3) устойчивая лихорадка (лихорадка ≥2 дней), 4) клинические признаки, предполагающие эндокардит.
- Учитывая , что персистирующая бактериемия является одним из критериев на выполнение ЭХОКГ и может повлиять на продолжительность лечения, рекомендуется забор контрольных посевов крови у всех детей со стафилококковой бактериемией.
- У детей с персистирующей бактериемией, когда нет возможности клинически определить локализацию источника, необходимо рассмотреть применение методов визуализации для выявления скрытого мышечно-скелетного источника.
Являются ли цефалоспорины, гликопептиды или более новые препараты эквивалентными антистафилококковым пенициллинам при бактериемии метициллин чувствительным золотистым стафилококком у детей?
- При бактериемии метициллин чувствительным золотистым стафилококком у детей, цефазолин скорее всего эквивалентен антистафилококковым пенициллинам.
- При бактериемии метициллин чувствительным золотистым стафилококком у детей, гликопептиды скорее всего уступают антистафилококковым пенициллинам. Поэтому, у детей со стафилококковой бактериемией с тяжелым течением болезни при неизвестной чувствительности, рекомендуется эмпирическая антибиотико-терапия, которая включает антистафилококковый пенициллин.
Какова оптимальная лечебная стратегия у детей с микробами, резистентными к бета-лактамам (метициллин резистентный золотистый стафилококк), и какова роль комбинированной терапии?
- Ванкомицин является рекомендуемой терапией первой линии у детей с бактериемией метициллин резистентным золотистым стафилококком или при реакции гиперчувствительности немедленного типа на бета-лактамы.
- Альтернативные варианты лечения включают даптомицин, линезолид и клиндамицин. Цефтаролин может быть рассмотрен как терапия спасения при стафилококковой бактериемии.
- Триметоприм-сульфаметоксазол и дополнительно рифампицин не рекомендуются рутинно для лечения стафилококковой бактериемии.
Имеются ли различия по длительности в/в терапии при стафилококковой бактериемии между детьми и взрослыми?
- На основании имеющихся на настоящее время доказательств и клинической практики, рекомендуется 7-14 дней в/в терапии для большинства детей со стафилококковой бактериемией и 14 дней у новорожденных, с более длительной терапией у детей с эндокардитом (4-6 недель).
- У детей со стафилококковой бактериемией в контексте костно-суставной инфекции обычно рекомендуется продолжительность лечения 4-6 недель, хотя пациенты могут быть переведены на пероральную терапию до истечения 7-ми дней, в зависимости от клинического ответа.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Для цитирования: Заплатников, Захарова И.Н., Коровина Н.А. Clostridium difficile-инфекция у детей. РМЖ. 2004;5:373.
Р ациональная антибиотикотерапия является одной из важнейших составляющих в лечении детей с различными инфекционно–воспалительными заболеваниями. Однако широкое и не всегда обоснованное применение антибиотиков в педиатрической практике нередко приводит к развитию разнообразных осложнений (аллергические и токсические реакции, дисбактериозы и др.) [8,12]. Особое место среди антибиотико–индуцированных осложнений занимают дисбактериозы кишечника, которые могут сопровождаться суперинфекцией и клинически значимой активацией условно–патогенных энтеробактерий с развитием колитов и энтероколитов. При этом В.Ф. Учайкин и А.А. Новокшенов (1999) подчеркивают, что до 20% всех антибиотико–ассоциированных диарей и 90–100% псевдомембранозных колитов обусловлено Clostridium difficile–инфекцией [9].
Clostridium difficile–инфекция (клостридиоз диффициле) – острая, антропонозная, анаэробная инфекция с энтеральным путем заражения, характеризующаяся различной степенью выраженности клинических проявлений – от бессимптомного бактерионосительства и легких диарей до тяжелых форм заболевания в виде псевдомембранозного колита.
Этиология. Возбудитель клостридиоза диффициле – Clostridium difficile – строго анаэробная, спорообразующая, грамположительная бацилла [7]. Вегетативные формы Clostridium difficile обладают способностью продуцировать экзотоксины, среди которых идентифицированы повреждающие кишечную стенку энтеротоксин (токсин А) и цитотоксин (токсин В) [7,11,16]. Установлено, что токсин А, стимулируя гуанилатциклазу, повышает секрецию жидкости в просвет кишечника и способствует развитию диареи. Токсин В обладает выраженным цитопатогенным действием. Предполагают, что ингибируя процессы синтеза белка в энтеро– и колоноцитах, токсин В нарушает функции их клеточных мембран. Это приводит к потере калия и развитию электролитных нарушений. Споры Clostridium difficile проявляют высокую устойчивость к факторам внешней среды и стандартным дезсредствам, а вегетативные формы резистентны к большинству антибиотиков (природные и полусинтетические пенициллины, ингибитор–защищенные пенициллины, цефалоспорины, линкозамиды и др.) [5,7,11,14].
Эпидемиология. Clostridium difficile часто обнаруживаются в окружающей среде и могут быть изолированы из почвы [7,9,12]. Основной механизм передачи инфекции – фекально–оральный. Источником инфекции является человек (чаще – пациенты, получающие антибиотики широкого спектра действия, и дети). Установлено, что частота контаминации кишечника Clostridium difficile у здоровых новорожденных и младенцев может составлять более 50%, тогда как у детей старше 2 лет, а также у здоровых взрослых уровень инфицированности не превышает 5% [3,9,12]. В то же время у взрослых, находящихся на лечении в различных стационарах, частота носительства Clostridium difficile значительно выше и может достигать 10–20% [4,5]. При этом отмечено, что трансмиссия вегетативных форм Clostridium difficile от инфицированных (дети, медицинский персонал, лица, осуществляющие уход за больными и сами пациенты) к здоровым лицам осуществляется через такие факторы передачи, как руки и предметы ухода. Кроме этого, установлена возможность широкого контаминирования Clostridium difficile различных внутригоспитальных объектов (постельные принадлежности, мебель, душевые, туалеты и др.) [3–6]. Бытовая передача Clostridium difficile с участием различных факторов создает серьезный риск развития внутрибольничной инфекции, особенно у пациентов, получающих массивную антибактериальную терапию. Контингентами риска по развитию тяжелых форм нозокомиальной Clostridium difficile–инфекции являются и дети раннего возраста (ослабленные), а также пациенты, длительно находящиеся в стационаре [3,9,12].
Установлено, что основным фактором риска по развитию тяжелых форм заболевания является антибиотикотерапия. При этом В.А. Малов и соавт. (1999) подчеркивают, что даже однократный прием антибиотика широкого спектра действия, независимо от дозы и способа введения, может привести к развитию диареи и псевдомембранозного колита, обусловленных Clostridium difficile [6]. К факторам риска также относят повторные очистительные клизмы, длительное использование назогастрального зонда, оперативные вмешательства на органах желудочно–кишечного тракта и продолжительное пребывание пациентов в стационаре [2–6,12]. В то же время установлено, что диарея и колит, обусловленные Clostridium difficile, могут развиваться не только в стационаре, но и в амбулаторных условиях при использовании антибиотиков широкого спектра действия, особенно у ослабленных пациентов и детей раннего возраста [15].
Патогенез и патоморфология. В основе патогенеза клинически манифестных форм Clostridium difficile–инфекции – антибиотико–ассоциированной диареи и псевдомембранозного колита – лежит снижение колонизационной резистентности кишечника. Под действием антибиотиков и других повреждающих факторов нарушается интестинальный микробный пейзаж. Значительное угнетение при этом анаэробной части нормальной микрофлоры кишечника сопровождается возникновением благоприятных условий для размножения Clostridium difficile и перехода её в токсинобразующую форму. При этом основными факторами патогенности Clostridium difficile являются токсины А и В, приводящие к повреждению стенки кишечника, в то время как непосредственно сам возбудитель не обладает инвазивными свойствами и не оказывает цитотоксического воздействия на слизистые кишечника [5,7,11,16].
При легких вариантах Clostridium difficile–ассоциированной диареи морфологическая картина характеризуется умеренной гиперемией и незначительным отеком слизистой кишечника, тогда как при тяжелых – отмечаются выраженные воспалительные изменения. При развитии наиболее тяжелой формы заболевания (псевдомембранозный колит) на фоне резко выраженных воспалительно–геморрагических изменений слизистой кишечника обнаруживают небольшие по размеру (чаще – до 2–5 мм, реже – до 20 мм и более в диаметре) возвышающиеся желтоватые бляшки, плотно связанные с подлежащими тканями. Бляшки образованы скоплением фибрина, муцина и клеток, участвующих в воспалении. Сливаясь, бляшки образуют псевдомембраны. В отдельных случаях слизистая может быть покрыта толстым слоем фибринозно–пленчатых наложений на значительном протяжении кишечника. Пленки, при расплавлении, могут отторгаться, обнажая изъязвленную поверхность кишечной стенки [1,2,9,17].
Значительное распространение (более 50%) асимптоматического бактерионосительства Clostridium difficile у новорожденных детей и младенцев и крайне низкая частота развития у них манифестных форм инфекции объясняется, по–видимому, особенностями строения клеточной мембраны кишечного эпителия. Предполагается, что у детей раннего возраста эпителиальные клетки слизистых оболочек кишечника не имеют рецепторов к токсинам Clostridium difficile. Вероятно, что в формировании транзиторной резистентности к данной инфекции имеет значение и наличие у детей первого полугодия жизни материнских антиклостридиальных антител, полученных трансплацентарно [5,6,9].
Clostridium difficile–ассоциированная диарея у детей часто характеризуется клиническими симптомами нетяжелого колита или энтероколита и обычно протекает без лихорадки и интоксикации. При этом возможно появление болей в животе, но чаще болезненность со стороны кишечника выявляется лишь при его пальпации. Отмечается легкое или умеренное учащение дефекации, как правило, не приводящее к выраженным водно–электролитным нарушениям [9,12].
Клинические проявления псевдомембранозного колита у детей обычно развиваются остро и характеризуются отказом от еды, лихорадкой, интоксикацией, диареей, срыгиванием, вздутием и болями в животе спастического характера (абдоминальные колики), болезненной пальпацией живота по ходу толстого кишечника [9,12]. Стул частый, в каловых массах – примесь слизи и крови (реже). Иногда бoльшая часть испражнений представлена густой белесоватой слизью и обрывками фибринозных наложений. В случаях резко выраженного учащения стула развивается эксикоз с нарушениями кровообращения, значительно реже отмечается коллапс без предшествующей диареи. Течение псевдомембранозного колита может осложниться кишечным кровотечением, перфорацией и развитием перитонита [6,9,12]. Поэтому для своевременного выявления этих грозных осложнений за пациентами с тяжелыми формами клостридиоза диффициле должно проводиться совместное наблюдение педиатра и хирурга.
Крайне тяжелые и летальные случаи Clostridium difficile–инфекции в большинстве случаев отмечаются у детей с выраженной нейтропенией на фоне лейкемии, у младенцев с болезнью Гиршпрунга и у пациентов с хроническими воспалительными заболеваниями кишечника (болезнь Крона, неспецифический язвенный колит) [12].
Описаны случаи рецидивирующего течения манифестных форм клостридиоза диффициле, при которых отмена этиотропной терапии или использование антибиотиков в последующие периоды жизни ребенка вновь сопровождались развитием колита. Причинами рецидивов при этом считают такие факторы, как неполная элиминация кишечника от Clostridium difficile и реинфекция [5,12].
Следует еще раз подчеркнуть, что хотя наиболее часто Clostridium difficile–ассоциированная диарея и псевдомембранозный колит возникают у детей, находящихся в стационаре и получающих антибиотики, но могут встречаться и у лиц, уже выписанных из больницы, или развиться спустя 1–2 недели после отмены антибактериальной терапии.
Нельзя забывать и о том, что в редких случаях клостридиоз диффициле возникает без предшествующей госпитализации, а использование антибиотиков в амбулаторных условиях также может сопровождаться развитием заболевания [12,15].
Следует отметить, что для этиологической расшифровки диареи у новорожденных и детей первых месяцев жизни выявление токсинов А и В не имеет диагностического значения. Это связано с транзиторной резистентностью детей данного возраста к токсинам Clostridium difficile, что и определяет минимальный риск развития у них манифестных форм заболевания [9].
При бактерионосительстве Clostridium difficile и легких вариантах антибиотико–ассоциированной диареи гемограмма, как правило, характеризуется нормальными показателями. При манифестных формах инфекции изменения в клиническом анализе крови носят неспецифический характер и характеризуются нейтрофильным лейкоцитозом, сдвигом лейкоцитарной формулы влево, а также ускорением СОЭ [6,9].
Лечение. Асимптоматическое бактерионосительство Clostridium difficile у здоровых детей не требует проведения терапевтических мероприятий.
При развитии манифестных форм инфекции, независимо от степени выраженности клинических проявлений, принципиальным положением является незамедлительная отмена используемых антибиотиков (табл. 1).
Вопрос о необходимости назначения этиотропной терапии в каждом конкретном случае должен решаться индивидуально с учетом возраста ребенка, тяжести заболевания и фоновых состояний. Так, при легких вариантах Clostridium difficile–ассоциированных диарей, развившихся у детей с благополучным преморбидным фоном, назначение этиотропного лечения не требуется. В то же время у детей раннего возраста, ослабленных, у пациентов с нейтропенией, тяжелыми хроническими заболеваниями и пороками развития (особенно ЖКТ) даже при легких формах инфекции назначение антиклостридиальных препаратов считается обоснованным. Абсолютными показаниями для этиотропной терапии являются тяжелые формы заболевания, продолжающаяся после отмены антибиотиков диарея, а также рецидив инфекции на фоне повторного приема антибиотиков (табл. 1).
Метронидазол для лечения Clostridium difficile–инфекции применяется в суточной дозе 30 мг/кг. Суточная доза вводится ребенку в 3–4 приема [12]. При этом метронидазол, в отличие от ванкомицина, может вводиться как перорально, так и парентерально – путем внутривенной инфузии. В тех случаях, когда у ребенка с клостридиозом диффициле выражены тошнота, срыгивания или рвота, стартовая этиотропная терапия должна начинаться с парентерального введения метронидазола. При купировании указанных симптомов и улучшении общего состояния целесообразно заменить внутривенное введение метронидазола на оральный его прием. При приеме внутрь препарат быстро и хорошо всасывается (биодоступность – 80–100%). Связывание с белками крови составляет 20%. При внутривенном введении достигаются высокие концентрации метронидазола во всех тканях организма [18]. Метаболизируясь в печени путем окисления и глюкуронизации, метронидазол экскретируется почками (до 80%) и кишечником (до 15%). Метронидазол замедляет метаболизм непрямых антикоагулянтов, что приводит к усилению их эффекта и может способствовать развитию геморрагических осложнений. Терапевтический эффект метронидазола могут уменьшить индукторы печеночного метаболизма (барбитураты, противосудорожные препараты, рифампицин). В то же время препараты, ингибирующие микросомальные ферменты гепатоцитов (циметидин), снижают метаболизм метронидазола, что может привести к повышению его содержания в организме [18].
Особое внимание необходимо обратить на то, что при пероральном введении этиотропных лекарственных средств недопустимо одновременно применять энтеросорбенты (холестирамин, активированный уголь и др.). Это объясняется возможным уменьшением терапевтического эффекта антибиотиков из–за их связывания с энтеросорбентами в просвете кишечника [6,12]. В целом использование энтеросорбентов может быть оправдано лишь при легких вариантах Clostridium difficile–ассоциированной диареи, когда нет показаний для назначения этиотропных лекарственных средств или в тех случаях тяжело протекающего заболевания, когда метронидазол вводится парентерально.
По показаниям при тяжелых формах клостридиоза диффициле проводится также по–синдромная терапия, направленная на нормализацию выявленных изменений гомеостаза (водно–электролитный дисбаланс, токсикоз, гемодинамические нарушения, геморрагический синдром и др.) [9]. При тяжелых вариантах инфекции обсуждается также возможность применения внутривенных иммуноглобулинов [6]. Обоснованием для этого явилось обнаружение антитоксинов А и В (антитела к экзотоксинам Clostridium difficile) в препаратах нормального человеческого иммуноглобулина для внутривенного введения. При этом В.А. Малов и соавт. (1999) подчеркивают, что включение внутривенных иммуноглобулинов в комплексную терапию тяжелых форм клостридиоза диффициле сопровождалось быстрым прекращением диареи, купированием болей в животе и нормализацией температуры тела.
Особо следует отметить, что при тяжелых формах Clostridium difficile–ассоциированной диареи и псевдомембранозном колите нельзя использовать препараты, уменьшающие моторику кишечника [12, 18].
После отмены антимикробных препаратов детям, перенесшим Clostridium difficile–инфекцию, для полной санации кишечника от спор возбудителя целесообразно провести курсовое лечение пробиотиками (бифидимбактерин и др.) [2,6,9].
Профилактика клостридиоза диффициле заключается в строгом соблюдении правил личной гигиены, а также в неукоснительном выполнении всех требований по соблюдению санитарно–противоэпидемического режима лечебных учреждений. Нельзя также недооценивать и такой фактор в профилактике Clostridium difficile–инфекции, как уменьшение частоты бесконтрольного и необоснованного использования антибиотиков. Таким образом, основными резервами снижения заболеваемости у детей клостридиозом диффициле являются улучшение санитарной культуры населения в целом и повышение профессионализма медицинских работников.
1. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. – М.: Триада–Х, 1998.
3. Клостридиозы. // Профилактика внутрибольничных инфекций. Руководство для врачей под ред. проф. Е.П.Ковалевой, проф. Н.А.Семиной. – М.: Рарогъ, 1993. – С. 55–59.
4. Ковалева Е.П., Семина Н.А., Семененко Т.А., Галкин В.В. Справочник госпитального эпидемиолога. – М.: Хризостом, 1999. – С. 136–139.
5. Малов В.А., Бондаренко В.М., Пак С.Г. Роль Clostridium difficile в патологии человека.//Журн.микробиол.–1996.–№1.–С.91–96.
6. Малов В. А., Пак С. Г., Беликов Д. В.// Лечащий врач. 1999. – 2–3.
7. Медицинская микробиология./ Под ред. В.И.Покровского, О.К.Поздеева. – М: ГЭОТАР МЕДИЦИНА, 1999.
8. Планельес Х.Х., Харитонова А.М. Побочные явления при антибиотикотерапии бактериальных инфекций. – М.: Медицина, 1976. – 430.
9. Учайкин В.Ф. Руководство по инфекционным заболеваниям у детей. – М.: Гэотар Медицина, 1998. – С. 492–494.
10. Фэкети Р. (Fekety R.), Дюпон Х.Л. (DuPont H.L.), Куперсток М. (Cooperstok M.) и др. Лечение колита, связанного с приемом антибиотиков. // Европейское руководство по клинической оценке противоинфекционных лекарственных средств/ Под ред. Т.Р.Бим (T.R.Beam) – Пер. с англ. под ред. академика РАМН А.Г.Чучалина и проф. Л.С.Страчунского. – Смоленск: Амипресс, 1996. – С. 302–306.
11. Bartlett J.G. Antibiotic–associated pseudomembranous colitis due to toxin producing clostridia. //N. Engl.J.Med. – 1978. – Vol.298. – P.531.
12. Clostridium difficile. // In Red Book: 2000. Report of the Committee on Infection Diseases. 25rd: American Academy of Pediatrics, 2000, P. 214–216.
13. Larson H.E., Prise A.B., Honour P. et al. Pseudomembranous colitis: present of clostridial toxin. // Lancet. – 1977. – P. 1312–1314.
14. Larson H.E., Prise A.B., Honour P. et al. Clostridium difficile and etiology pseudomembranous colitis. // Lancet. – 1978. – №1. – P. 1063–1066.
15. Mitchell D.K., Van R., Mason E.H. at al. Prospective study of toxigenic Clostridium difficilе children given amoxicillin/clavulanate for otitis media. // Pediatr. Inf. Dis. J. – 1996. – 15. – P. 514–519.
16. Mitchell T.J., Ketley J.M., Haslam S.C. et al. Effect of toxin A and B of Clostridium difficile on rabbit ileum and collon. // Gut. – 1986. – 27. – P. 78–85.
17. Prise A.B., Davies D.R.D. Pseudomembranous colitis. // J. Clin. Pathol. – 1977. –30. – P. 1–12.
18. The Pharmacological Basis of Therapeutics – Goodman &. Gilman’s. – 8th Ed.
Что такое сикоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Бровченко А. Б., дерматолога со стажем в 10 лет.
Над статьей доктора Бровченко А. Б. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
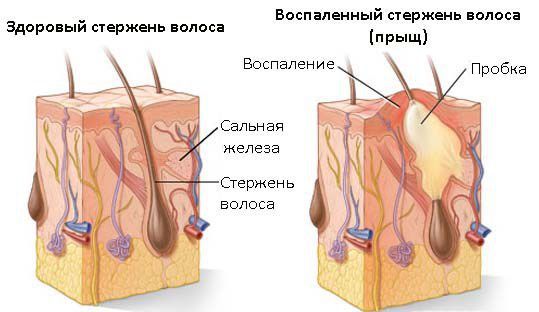
Сикоз — это инфекционное заболевание, хроническое рецидивирующее воспаление волосяных фолликулов. Относится к группе пиодермий — гнойно-воспалительных заболеваний кожи [1] . Возбудителем сикоза является патогенный микроорганизм стафилококк, проникающий в кожу через микроранки.
Фактором, способствующим проникновению стафилококка, является возникновение микропорезов и повреждений кожи при бритье. Поэтому довольно часто заболевание возникает на лице у мужчин.
У женщин и детей сикоз появляется из-за слизистого или гнойного отделяемого при ринитах и конъюнктивитах. Содержащийся в назальном или же конъюнктивальном отделяемом стафилококк, попадая в микроповреждения кожи, провоцирует развитие заболевания.
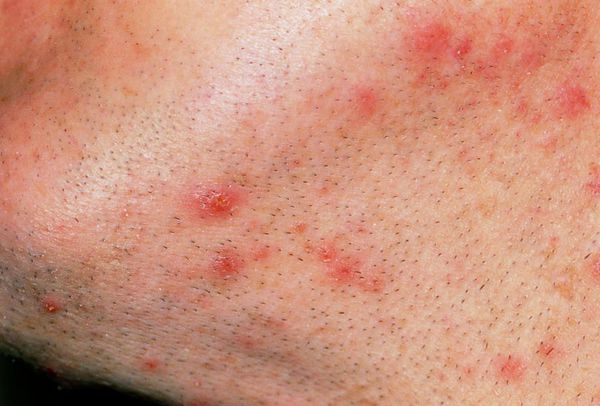
Предрасполагающими факторами для возникновения сикоза являются:
- наличие ринита, конъюнктивита, реже — тонзиллита;
- недостаточное увлажнение кожных покровов лица;
- использование во время бритья некачественных (затупленных, с элементами ржавчины) лезвий;
- наличие на коже вросших волосков (часто отмечается спустя 1-2 дня после бритья);
- выщипывание волосков из ноздрей, бровей недостаточно обработанными инструментами;
- наличие сопутствующих микозных (грибковых) поражений кожи;
- наличие на коже псориатических, аллергических высыпаний, очагов нейродермита и других дерматозов;
- функциональные расстройства эндокринной и нервной систем;
- частые стрессы и недосыпания;
- иммунодефицитные состояния организма [2][3] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сикоза
Начальными симптомами при возникновении сикоза является появление фолликулитов — воспалительных гиперемированных участков кожи в области волосяных фолликулов [3] . По мере размножения стафилококка и прогрессирования заболевания очаги воспаления сливаются между собой, вовлекая в патологический процесс всё большие участки кожи. Таким образом происходит формирование более крупных гиперемированных, отёчных и болезненных при пальпации участков сикоза.
К воспалению быстро присоединяются гнойные пустулы (прыщи). Далее происходит образование грязно-жёлтых, порой зеленоватых корок. Гнойные корки впоследствии отпадают, но из-за непрерывного протекания патологического процесса на их месте появляются новые участки воспаления и гнойных пустул. В результате процесс приобретает хронический, рецидивирующий характер [2] [3] .
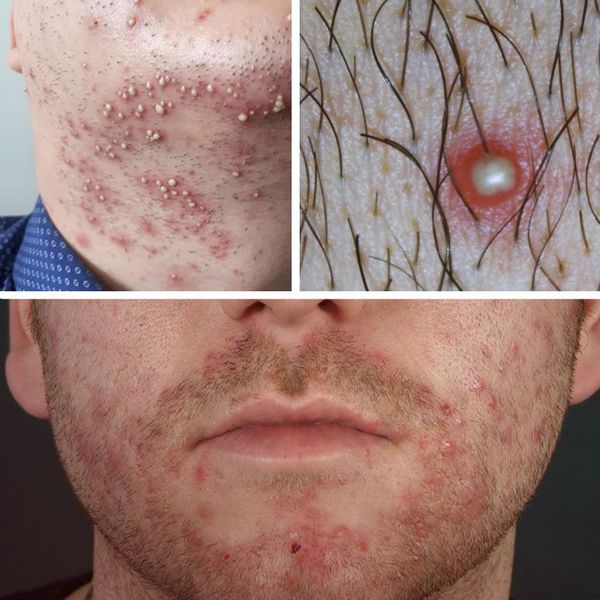
Чаще всего сикоз появляется в следующих местах:
- у мужчин: область усов и подбородка;
- у женщин: возникновение стафилококковых "заед" в углах рта или глаза;
- у детей: на крыльях носа, над верхней губой, иногда в области ноздрей;
- значительно реже отмечаются другие локализации сикоза — брови, подмышечные впадины, паховая область [1][2] .
Течение заболевания может быть разным в зависимости от формы: вульгарного сикоза, люпоидного сикоза и паразитарного.
Вульгарный сикоз (стафилококковый) — чаще всего появляется на коже лица, в некоторых случаях возможно поражение кожи лобка, подмышечных впадин, ног и других областей тела. При вульгарном сикозе происходит поверхностное поражение стафилококком кожных покровов. Такие процессы, как правило, не сопровождаются образованием рубцов.
Чаще всего клиническая картина вульгарного сикоза протекает по типу воспаления волосяных фолликулов. При обилии гнойничков кожа становится отёчной и гиперемированной, нередко отмечается зуд поражённых областей и болезненность при надавливании. Характерно чувство стянутости кожи в поражённом очаге. В случае большого скопления фолликулитов возможно образование очагов мокнутия. Самопроизвольного вскрытия пустул не происходит. С течением времени отмечается ссыхание гнойного содержимого пустул с образованием желтоватого цвета корок, которые после отпадают.
Люпоидный сикоз (глубокий) — отличается малым количеством пустулёзных высыпаний. Чаще всего гнойнички появляются по периферии воспалительного очага, тогда как в его центре возникновения новых высыпаний практически нет.
Люпоидному сикозу наиболее подвержены мужчины после сорока лет. Частыми местами поражения при люпоидном сикозе является область усов и бороды, хотя возможно поражение кожи волосистой части головы (висков и темени). Предрасполагающие факторы для развития люпоидного сикоза — иммунодефицитные состояния, выраженные нарушения эндокринной системы, системные заболевания соединительной ткани. Люпоидный сикоз быстро приобретает хроническое течение и плохо поддается терапии [5] [6] [8] .
В центре воспалительного очага при этой форме сикоза отмечается атрофия кожных покровов и выпадение волос, а также появление гладкой и блестящей бляшки диаметром до 3 см. В центре бляшки никогда не появляются новые пустулёзные высыпания. Возможно образование гиперемии по краю бляшки диаметром до 1-2 см. Высыпания на волосистой части головы чаще всего отличаются значительной болезненностью, хотя общее состояние пациента при этом не страдает. Патологический процесс при люпоидном сикозе протекает годами, с периодами обострения и утихания воспаления. На коже головы в центре гнойно-воспалительного очага с течением времени возникают очаги алопеции (облысения) с тонкими и ломкими волосами по периферии.
Паразитарный сикоз — причиной развития паразитарного сикоза являются не стафилококки, а грибы-трихофитии. Паразитарный сикоз чаще всего называют микозом (нагноительной трихофитией). Источником распространения патогенного грибка являются собаки, лошади, крупный рогатый скот и мыши. Поэтому чаще всего нагноительной трихофитией болеют жители сельских областей. В городе паразитарный сикоз возникает в результате заражения антропофильными грибами, передаваемыми при использовании предметов личной гигиены [2] [7] [9] . Высыпания при паразитарном сикозе отличаются болезненностью (из-за глубокого поражения кожи) и отёчностью, имеют более крупные размеры, чем при стафилококковых сикозах. Чаще всего поражается кожа шеи, подбородка, нижней челюсти, реже — кожа над верхней губой.
Высыпания отличаются своей асимметричностью и чёткой очерченностью от здоровых участков. Возможно образование синюшно-багровых узлов с пустулёзными элементами по периферии. В зависимости от тяжести патологического процесса узлы могут ссыхаться в корочки или же нагнаиваться с образованием абсцессов.
При надавливании на очаги можно наблюдать симптом "медовых сот" — выход большого количества гноя из поражённых участков [3] [5] [6] [8] .
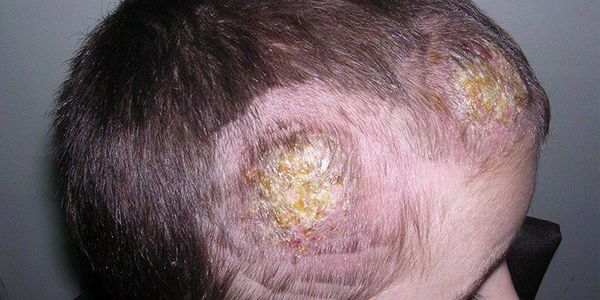
При данном виде сикоза не происходит разрушения волосяного фолликула, в связи с чем при стихании воспалительного процесса на месте выпавшего волоса может вырастать новый. В отличие от стафилококковых сикозов нагноительная трихофития имеет преимущественно острый характер воспаления и не склонна к рецидивированию и хронизации процесса.
Патогенез сикоза
В механизме развития сикоза можно условно выделить следующие основные блоки [4] :
- Функциональные расстройства нервной и эндокринной систем (астенические состояния на фоне стрессов и недосыпаний, сахарный диабет, нарушения функций щитовидной железы и др.) приводят к нарушениям нормальной деятельности сально-волосяного аппарата кожи. Например, недостаток гормонов щитовидной железы провоцирует сухость кожных покровов и снижение местного иммунитета. При сахарном диабете (недостатке инсулина) отмечается нарушение микроциркуляции кожи, что также приводит к ослаблению местного иммунитета и изменению кислотности кожи. При подобных состояниях создаются благоприятные условия для размножения стафилококка и развития заболевания.
- Наличие сопутствующих патологий в виде хронических очагов инфекций и иммунодефицитных состояний также способствует развитию гноеродной микрофлоры (в данном случае, стафилококка).
- Дополнительное воздействие на кожу экзогенных факторов, таких как:
- выделения из носа при рините (втирание назальной слизи, богатой бактериями, в раздражённую кожу);
- микротравматизация кожи во время бритья;
- воздействие грубых пылевых частиц (угольная, металлическая и др. пыль) при работе на производствах, связанных с вредными условиями труда.
Классификация и стадии развития сикоза
Существуют различные классификации сикоза, в основе которых лежит длительность течения заболевания, локализация, глубина поражения кожи и клинико-морфологические характеристики процесса.
В зависимости от длительности течения сикоз можно разделить на:
- острый;
- хронический (или рецидивирующий).
В зависимости от локализации поражения сикоз имеет различные формы:
- сикоз области бороды и усов;
- сикоз крыльев носа;
- сикоз век и бровей, часто сочетающиеся между собой;
- сикоз лобка;
- сикоз подмышечных впадин;
- сикоз гладкой кожи (с поражением пушковых волос) и др.
Разная глубина поражения кожи при сикозе позволяет разделить его на поверхностный и глубокий (люпоидный сикоз).
В основе клинико-морфологической классификации сикоза лежит не только тип поражения кожи при данном заболевании, но и глубина распространения патологического процесса и причина его появления:
- вульгарный сикоз (обыкновенный, стафилококковый);
- люпоидный (глубокий) сикоз;
- паразитарный сикоз.
Процесс возникновения и распространения сикоза можно разделить на определённые стадии [5] .
I. Стадия начальных проявлений: воспаление волосяного фолликула. На поверхности кожи можно наблюдать небольшие гиперемированные диски (фолликулиты). По мере того, как стафилококк размножается и образует всё новые и новые колонии, увеличивается и количество воспалённых волосяных фолликулов. На этом этапе воспаление может пройти самостоятельно. Но даже если краснота на время спадает и воспаление уменьшается, через время воспалительный процесс может снова обостриться и принять затяжной характер.
Кожа, поражённая стафилококком, гиперемирована, отёчна, покрыта большим количеством пустул (гнойничков) и остро болезненна при пальпации. При большом количестве гнойничков они собираются в одном месте, кожа под ними принимает ярко-алую окраску. Гнойнички быстро опорожняются, содержимое их ссыхается, образуя грязно-жёлтую, порой зеленоватую корку [2] [4] [6] .
II. Хронизация процесса: подсыхая, гнойные корки отпадают, обнажая поражённую поверхность. Так как очаг воспаления не санирован и в нём по-прежнему размножаются стафилококки, волосяные фолликулы вскоре воспаляются вновь, процесс приобретает хронический и рецидивирующий характер.
III. Прогрессирование и исходы: в том случае, если заболевание не лечить, постепенно будет происходить прогрессирование процесса. Подсохшие корочки будут появляться вновь, а воспаление тканей – распространяться на окружающие здоровые участки, увеличивая очаг поражения. Общее состояние организма, как правило, не страдает: нет повышения температуры тела, человек не ощущает общей слабости и недомогания. Поражённые участки кожи болезненны лишь при прикосновении (пальпации). При длительно текущем процессе кожа внутри сикозного диска постепенно подвергается атрофии.
Осложнения сикоза
Осложнения заболевания развиваются при отсутствии лечения, либо при неадекватной терапии . Среди возможных осложнений различных видов сикоза можно выделить следующие:
- часто: атрофия кожи на месте поражённых участков (приводит к выпадению волос и образованию рубцов);
- часто: экзематозные поражения (обширные мокнущие участки, усиление зуда) ;
- редко: формирование фурункулов, абсцессов, свищевых ходов, импетиго. Клинически импетиго проявляется возникновением пузырей с мутным содержимым, которые быстро прорываются с образованием корок медово-жёлтого цвета [1][2][4] .
- крайне редко: распространение инфекции по венозным сосудам лицевой области в полость черепа, что может привести к тромбозу пещеристого синуса, развитию менингита (воспаления мозговых оболочек) либо же энцефалиту (воспалению головного мозга).
Диагностика сикоза
Клиническая картина сикоза настолько яркая, что позволяет врачу-дерматологу практически сразу визуально поставить правильный диагноз. Лабораторные методы диагностики служат для определения возбудителя заболевания. С этой целью производят исследование биоматериала под микроскопом, идентифицируя таким образом возбудителя (стафилококк или грибок).
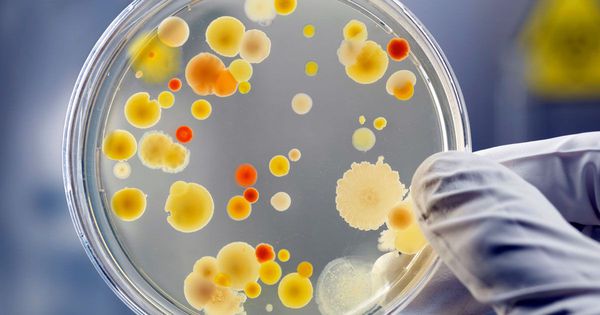
Бактериальный посев биоматериала на питательные среды позволяет выявить чувствительность стафилококков к антибиотикам, что позволит впоследствии правильно подобрать антимикробный лекарственный препарат.
Для постановки диагноза и назначения адекватной терапии необходимо определить форму заболевания (простой, люпоидный или паразитарный сикоз). В зависимости от причины возникновения заболевания назначаются либо антибиотики определённой группы, либо противогрибковые препараты.
Выльгарный сикоз следует дифференцировать с инфильтративно-нагноительной формой трихофитии (стригущего лишая). При трихофитии нередко увеличиваются регионарные лимфоузлы, при микроскопии и культуральном исследовании обнаруживается патогенный гриб — трихофитон.
Лечение сикоза
Важно отметить, что самолечение в случае с сикозом недопустимо, так как может привести к развитию осложнений.
При лечении сикозов арсенал применяемых лекарственных препаратов можно разделить на следующие блоки [3] [5] [10] :
- Этиологическая терапия — направлена на устранение причины заболевания, то есть возбудителя сикоза. Применяются местные или системные антибактериальные препараты (при вульгарном и люпоидном сикозе) или же антимикотики (в случае лечения паразитарного сикоза). Выбор и способ введения антибиотика определяется наличием устойчивости возбудителя к антибактериальным препаратам (выявляется с помощью посева патологического отделяемого из очагов на питательные среды), а также тяжестью и степенью поражения кожи. В качестве этиологического лечения возможно применение и специфических иммунобиологических препаратов (например стафилококковый анатоксин) [1][9] .
- Патогенетическая терапия — направлена на прерывание патологических механизмов развития сикоза, устранение провоцирующих и предрасполагающих факторов. Проводят санацию имеющихся очагов инфекции, корректируют расстройства эндокринной и нервной систем, проводят иммуномодулирующую и иммуностимулирующую терапию.
- Симптоматическая терапия — заключается в удалении поражённых волос из участков гнойно-воспалительного процесса, проведение ультрафиолетового облучения кожи.
Прогноз. Профилактика
Своевременное обращение к врачу-специалисту и адекватное лечение обеспечивает благоприятный прогноз сикозов. При этом стоит учитывать, что лучше всего лечению поддается вульгарный сикоз.
Основная мера профилактики — тщательное соблюдение правил личной гигиены, использование качественных и сугубо индивидуальных бритвенных принадлежностей. В случае пореза кожи при бритье необходимо незамедлительно обработать рану растворами антисептиков, чтобы не допустить заражения повреждённого участка кожи стафилококком.
Не менее важной мерой профилактики сикозов является борьба с имеющимися предрасполагающими факторами (санация хронических очагов инфекции, лечение расстройств эндокринной системы, коррекция иммунодефицитных состояний).
Читайте также:

