Стафилококковый бактериофаг научные статьи
Обновлено: 18.04.2024
Для цитирования. Костюкевич О.И. Применение бактериофагов в клинической практике: эпоха Возрождения // РМЖ. 2015. № 21. С. 1258–1262.
Предпосылки к применению бактериофагов
На сегодняшний день бактериальные инфекции представляют собой крайне актуальную проблему здравоохранения. И причинами этого являются не только возрастающая антибиотикорезистентность, но и крайне негативные последствия для здоровья нерациональной антибиотикотерапии.
Побочные эффекты антибиотикотерапии
Кроме того, клиницисты в своей практике все чаще сталкиваются с неудовлетворительной переносимостью АБП. Так, частота антибиотико-ассоциированной диареи за последние годы существенно возросла и составляет от 2 до 30% в зависимости от применяемого антибиотика [6]. Все больше пациентов отказываются от приема АБП в связи с развитием побочных эффектов или вследствие боязни (порой вполне обоснованной) кишечных дисбиозов. И все чаще, к сожалению, мы сталкиваемся с нарушением принципов рациональной антибиотикотерапии со стороны самих врачей, что, безусловно, усугубляет ситуацию и с резистентностью к АБП, и с безопасностью антибиотикотерапии.
В этой связи ключевыми задачами являются разработка и внедрение в клиническую практику дополнительных средств борьбы с инфекционными заболеваниями, в качестве которых, несомненно, можно рассматривать бактериофаги.
Бактериофаг (бактерии + греч. phagos – пожирающий; синоним: фаг, бактериальный вирус) – вирус, избирательно поражающий бактерии. Бактериофаги широко распространены в природе, каждый грамм почвы, каждый кубический сантиметр воды и воздуха, продукты питания, растения и животные содержат миллионы фаговых частиц (от 10 до 100 млн). Это древнейшие обитатели планеты, являющиеся естественными ограничителями распространения бактерий.
В 1921 г. Д. Мэйсин и Р. Брайонг впервые описали успешный способ лечения стафилококковых инфекций кожи с помощью стафилококкового фага. До середины ХХ в. на Западе бактериофаги широко изучались и эффективно использовались в качестве лечебного средства против ряда заболеваний, включая дизентерию, тиф, паратиф, холеру и гнойно-септические инфекции.
Однако с момента открытия А. Флемингом в 1928 г. пенициллина началась новая эра борьбы с инфекционными заболеваниями – эра антибиотиков. И бактериофаги, на тот период оказавшиеся менее эффективными, были преданы забвению в западном мире. В СССР же разработки и исследования препаратов бактериофагов не прекращались и активно поддерживались на самом высоком уровне. В 1930-е гг. был создан Институт исследования бактериофагов в Тбилиси, который в 1951 г. вошел в состав группы институтов вакцин и сывороток.
В литературе указывается, что в СССР в 1930–1940 гг. фаготерапия активно использовалась для лечения широкого спектра бактериальных инфекций в области дерматологии (Беридзе, 1938), офтальмологии (Родигина, 1938), урологии (Цулукидзе, 1938), стоматологии (Ручко и Третьяк, 1936), педиатрии (Александрова, 1935; Лурье, 1938), отоларингологии (Ермолиева, 1939) и хирургии (Цулукидзе, 1940, 1941). Эти статьи были опубликованы на русском языке и не были доступны западным ученым. Тем не менее прошлый опыт указывает на высокую эффективность фаготерапии и профилактики.
Клиническое применение препаратов бактериофагов в настоящее время
Фаготерапия с позиций доказательной медицины
За последние 10 лет количество публикаций в ведущих мировых медицинских изданиях, затрагивающих вопросы лечебного и профилактического применения бактериофагов, возросло в несколько раз и превысило уже 3000 (в базе данных PubMed). Количество опубликованных в последнее время работ свидетельствует о возрождении интереса к фаготерапии. Недавно завершившиеся клинические исследования предоставляют убедительные доказательства в отношении безопасности и эффективности фаготерапии у животных и человека [13–15]. Двойная терапия с использованием фагов и антибиотиков приводила к значимо лучшим результатам, чем монотерапия антибиотиками [16]. Показано, что бактериофаги могут быть более эффективными, чем традиционные антибиотики для разрушения бактериальных биопленок [17].
Механизм действия бактериофагов
Антибактериальный эффект бактериофагов обусловлен внедрением генома фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют уже другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления.
Достоинства фаготерапии
Таким образом, на основании накопленных данных можно сформулировать следующие предпосылки к широкому применению препаратов бактериофагов в лечебных и профилактических целях:
1. Эффективность в терапии инфекций, вызванных антибиотикорезистентными бактериями, в т. ч. ИСМП.
2. Возможность применения при аллергических реакциях на АБП.
3. Низкая токсичность, позволяющая считать их самыми безопасными препаратами, что определяет возможность их широкого применения у детей, беременных и кормящих женщин.
4. Высокая специфичность (отсутствие влияния на нормальную микрофлору человека) дает существенное преимущество в лечении любых инфекционных заболеваний у пациентов с различными нарушениями кишечной микрофлоры (в т. ч. с синдромом избыточного бактериального роста (СИБР) и другими дисбиозами), распространенность которых в последние годы значимо возросла.
5. Высокая эффективность в терапии хронических инфекций, особенно ассоциированных с образованием бактериальных биопленок.
6. Возможность применения в виде различных форм: местных аппликаций, жидких и таблетированных; парентеральных.
Ограничения фаготерапии
В то же время бактериофаги в настоящее время в реальной практике применяются намного реже, чем можно было бы ожидать, учитывая большой объем позитивной информации.
Можно выделить следующие причины, ограничивающие применение бактериофагов:
1. Прежде всего это отсутствие нормативно-правовых документов и недостаточная информированность специалистов [21].
2. Есть еще некоторые патогенные для человека бактерии (согласно утвержденному перечню биологических агентов [22]), для которых до сих пор не найдены литические фаги, в т. ч. представители 3-го уровня биобезопасности, такие как Rickettsia, Ehrlichia и Coxiella (возбудители эрлихиоза, эпидемического сыпного тифа, лихорадки Скалистых гор).
3. Выработка антифаговых антител. Проблема иммунного взаимодействия организма человека и фагов пока находится на стадии изучения. Наименьшее количество антител к бактериофагам вырабатывается у новорожденных и грудных детей, что определяет наибольшую эффективность фаготерапии именно в этой группе.
4. Довольно редко, но все же встречаются побочные эффекты употребления фагов, которые обычно связаны с массивным распадом бактериальных клеток с выделением эндотоксина. Справедливости ради надо отметить, что подобные эффекты гораздо более значимы при антибиотикотерапии. Нивелировать данные нежелательные явления в большинстве случаев можно при помощи энтеросорбентов.
Принципы рациональной фаготерапии
Необходимо отметить, что применение бактериофагов, как и любых АБП, должно основываться на рациональных принципах.
1. Предварительное определение чувствительности бактерий к препарату и литической активности бактериофагов в лаборатории.
Все бактериофаги можно разделить на умеренные и вирулентные (или литические).
А. Умеренные бактериофаги включают свой генетический материал в хромосомы бактерий и размножаются синхронно с клеткой хозяина, долгое время не вызывая лизиса. Умеренные бактериофаги играют существенную роль в эволюции бактерий, способствуя приобретению возбудителями дополнительных факторов вирулентности и антибиотикорезистентности. В настоящее время доказано, что множество факторов вирулентности у патогенных бактерий закодировано именно с помощью профаговых генов.
Б. Вирулентные фаги всегда приводят к разрушению бактерий (литический эффект) и высвобождению зрелых фаговых частиц, поражающих новые бактериальные клетки.
В связи с этим бактериофаги, применяемые для лечения инфекционных заболеваний, должны быть исключительно вирулентными, т. е. приводить к гибели бактерий. Литическая активность назначаемых для лечения препаратов бактериофагов обязательно должна быть предварительно проверена в лаборатории.
2. Выбор системы доставки играет ключевую роль в успешной фаготерапии.
Последние достижения в области фаготерапии показывают, что местная (адресная) доставка была более успешной для локализованной инфекции, в то время как для системных инфекций рекомендован парентеральный путь введения [23]. При использовании пероральных форм препаратов необходимо учитывать чувствительность фагов к действию соляной кислоты желудка и в этом случае отдавать предпочтение доставке в кислотоустойчивой оболочке.
Применение бактериофагов при заболеваниях ЖКТ
Лечение бактериофагами инфекций ЖКТ обладает существенным преимуществом по сравнению с антибиотиками в отношении влияния на нормальную кишечную микрофлору. Показана эффективность фаготерапии в отношении таких возбудителей инфекций ЖКТ, как энтеропатогенные E. coli [25], S. sonnae, flexneri, Salmonella E, P.vulgaris, mirabilis, S. aureus, P. aeruginosa, Enterococcus и др.
В практике гастроэнтеролога можно выделить 2 основные группы пациентов, которым может быть показана терапия бактериофагами:
1) с острыми бактериальными инфекциями (острый гастроэнтерит, гастроэнтероколит);
2) с различными нарушениями нормальной кишечной микрофлоры (СИБР в тонкой кишке, дисбиоз толстой кишки), встречающимися в той или иной степени у большинства пациентов с заболеваниями ЖКТ.
Фаготерапия острых бактериальных диарей
Лечение острых бактериальных диарей представляет порой значительные сложности из-за низкой эффективности АБП и развития побочных эффектов. Показано, что вследствие влияния антибиотиков на нормальную кишечную микрофлору угнетается механизм природной колонизационной резистентности. Кроме того, известен прямой механизм иммуносупрессивного действия антибиотиков. Все это может привести к длительной персистенции возбудителя острой кишечной инфекции (ОКИ) на фоне антибиотикотерапии [26, 27]. Так, по данным некоторых исследований, у пациентов, получавших АБП в острую фазу сальмонеллеза, достоверно чаще впоследствии встречалось бактериовыделение сальмонелл в сравнении с лицами, получавшими только патогенетическую терапию [28].
Показания к использованию бактериофагов при ОКИ на сегодняшний день можно сформулировать следующим образом:
– в качестве монотерапии – при легких формах ОКИ;
– в сочетании с антибактериальной терапией или последовательно – при среднетяжелых и тяжелых формах ОКИ;
– при бактериовыделении (у реконвалесцентных или транзиторных бактерионосителей);
– в комплексе терапии энтероколитов условно-патогенной и стафилококковой этиологии;
– для коррекции нарушений микробиоценоза кишечника [29].
Обязательным условием фаготерапии является посев кала с определением фаговой чувствительности. В случае неверифицированного возбудителя предпочтение следует отдавать комплексным препаратам бактериофагов (интести-бактериофаг), обладающим широким спектром действия в отношении возбудителей основных кишечных инфекций.
Перспективы применения бактериофагов
Мы стоим на пороге "Эпохи Возрождения" бактериофаготерапии, которая открывает новые перспективы в лечении антибиотикорезистентной микрофлоры, а также имеет хороший профиль безопасности. В России уже сегодня фаготерапия с успехом применяется при широком спектре заболеваний, и, безусловно, оправдывает себя при различных нарушениях кишечной микрофлоры. Прицельное действие препаратов позволяет сохранить тонкую грань баланса нормофлоры, что крайне важно для наших пациентов.
Человек живет впостоянном контакте исложнейшем взаимодействии снеисчислимым множеством микроорганизмов. Жить без микробов невозможно, ноисмногими изних— тоже. Ежегодно, посамым скромным оценкам, неучитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает отпневмонии 3,9млн человек, отдиареи— 1,6млн, оттуберкулеза— 1,6млн [1].
Человек живет в постоянном контакте и сложнейшем взаимодействии с неисчислимым множеством микроорганизмов. Жить без микробов невозможно, но и с многими из них — тоже. Ежегодно, по самым скромным оценкам, не учитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает от пневмонии 3,9 млн человек, от диареи — 1,6 млн, от туберкулеза — 1,6 млн [1].
С учетом нарастающей резистентности флоры к антибиотикам, вероятности аллергических и токсических реакций возникает проблема: что применять вместо антибиотиков или в комплексе с ними?
Строение и микробиология фага
Бактериофаги — древнейшие вирусы, наиболее распространенный в биосфере биологический объект. Чистая природная вода содержит в 1 мл 2×108 фагов, на каждую бактериальную единицу приходится не менее 10 фаговых [5, 6].
Длительное время фаги изучали на примере фагов , размножающихся на Escherichia (Е.) coli штамма В. Внедрение и совершенствование электронной микроскопии позволили говорить о разнообразии форм фагов. Принципиально фаг вне зависимости от вида построен из белковой или липопротеиновой оболочки, внутри которой заключены ДНК ( чаще, реже), еще реже 1- или РНК и ферменты. Выделяют головку фага (возможны нитчатая, сферическая, полигональная, плеоморфная формы фага), где и заключены генетическая информация и ферменты, и хвост фага, прикрепляющийся за счет специфических рецепторов на поверхности клетки. Фаг является облигатным внутриклеточным паразитом, он растворяет оболочку клетки, впрыскивает в клетку свой геном. Последний полностью за счет транскриптаз переключает метаболизм клетки, и начинается синтез ДНК или, соответственно, РНК фага, и капсида. За 1–24 ч образуется 100–300 новых фагов. Клетка разрушается, выделившиеся в окружающее пространство фаги инфицируют новые клетки. Экспоненциальное размножение фагов завершается только после уничтожения специфических для них клеток. Во внешней среде фаги способны переживать десятилетия [7].
Принципы выбора терапии бактериофагами
В многочисленных отечественных и зарубежных публикациях продемонстрирована эффективность применения бактериофагов, генетически модифицированных, в лечении поверхностной и системной инфекций [8, 9]. Лечение фагами привлекательно по следующим причинам:
2. Бактериофаги — естественные природные средства. Бактериофаг не может длительно циркулировать в макроорганизме — длительность его жизни лимитирована наличием .
При применении бактериофагов следует учитывать, что специфичность фагов может ограничивать их применение в острых случаях.
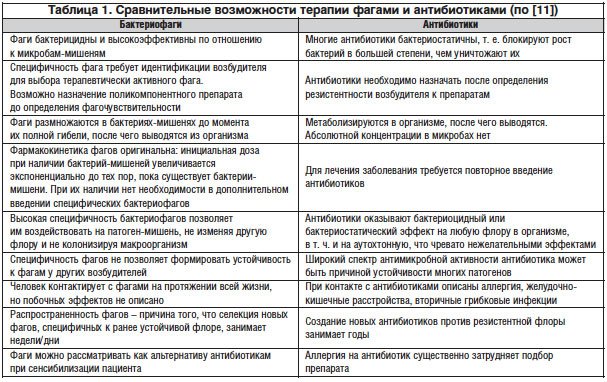
Соотношение бактериофаго- и антибиотикотерапии представлено в таблице 1.
Фаготерапия покровных и барьерных структур тканей
В эксперименте [14, 15] была показана эффективность фагов в лечении кожных инфекций и внутримышечных абсцессов (Pseudomonas (Ps.) aeruginosa, Staphylococcus (S.) aureus). В клинической практике эффективность лечения инфекций ран, инфицированных пострадиационных некрозов была продемонстрирована K. Markoishwili et al. [16] и другими представителями школы грузинского ученого Г. Элиавы.
В нашей стране для наружного применения используют комплексные фаговые препараты. Препарат пиобактериофаг поливалентный (Секстафаг®) для приема внутрь (20 мл 3 р./сут, 7–15 дней), местно или наружно способен лизировать стафило- и стрептококки, патогенные кишечные и синегнойные бактерии (Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae). Это позволяет применять его при заболеваниях уха, горла, носа, дыхательных путей, легких и плевры (воспалении пазух носа, среднего уха, ангине, фарингите, ларингите, трахеите, бронхите, пневмонии, плеврите). Секстафаг®, являясь эффективной альтернативой антибиотикам, может также применяться с ними комплексно. Крайне важно, что препарат может применяться при заболеваниях у новорожденных и детей грудного возраста (омфалит, гастроэнтероколит), беременных и рожениц. Все это подчеркивает безопасность препарата.
Гель Отофаг применяют местно в дозировке 1–2 мл: для профилактики рецидивов заболеваний — 2–3 р./сут в течение 7–10 дней, при наличии бактериального воспалительного заболевания — 2–3 р./сут в течение 7–14 дней.
Применение фагов как профилактического, лечебного и противорецидивного средства продемонстрировало свою эффективность в самой частой педиатрической группе: пациенты с инфекционной патологией верхних дыхательных путей (риносинуситы, тонзиллиты, ларингиты, фарингиты). Обычно эти инфекции трактуются как вирусные, хотя достаточно часто причиной бывают и бактерии, или бактериальная флора активируется в процессе манифестации вирусной инфекции.
Подавляющее большинство всех случаев острых заболеваний детей, особенно младшего возраста, вызваны острой респираторной инфекцией (ОРИ). Первичная заболеваемость детей и подростков по г. Москве за колебалась от 1680,2‰ до 1763,6‰3. Заболеваемость болезнями органов дыхания за этот же период составила 1147,4–1188,8‰. Общий экономический ущерб от заболеваний гриппом детей и взрослых в 2008 г. составил 375,2 млрд руб. Заболеваемость ОРВИ детей и подростков до 17 лет в 8,3 раза выше, чем взрослых. Так, при совместных исследованиях с [17] было показано, что на первом году жизни частота эпизодов ОРИ составляет 1535,9:1000, у детей достигает 3796,29:1000. Даже если первоначально заболевание разворачивается как вирусное, то впоследствии часто присоединяется бактериальная флора или активируется собственная, что требует взвешенного решения о выборе препарата или сочетании антибиотиков с иными препаратами, бактериофагами.
Инфекционный ринит дебютирует первоначально, как правило, как вирусный с типичным водянистым или отделяемым. Появление отделяемого, лихорадки, боли в области придаточных пазух говорит о присоединении бактериальной флоры. В качестве профилактики такого развития заболевания можно обсуждать местное применение поливалентного бактериофага.
Присоединение бактериальной инфекции с ее распространением на придаточные пазухи носа приводит к синуситу. Любые нарушения цилиарного клиренса, вентиляции, местного или системного иммунного ответа создают условия для хронизации синусита, вылечить который без воздействия на первоначальные причины невозможно. Признаки синусита:
- сохранение симптомов респираторной инфекции на протяжении 7–10 дней;
- дневной кашель и ринорея;
- заложенность носа;
- нередко низкий субфебрилитет;
- средний отит (у 60–70% больных);
- беспокойство;
- головные боли.
К признакам тяжелого течения синусита или его осложнений относятся гнойная ринорея, лихорадка выше 39ºС и периорбитальный отек. При остром и подостром синусите чаще обнаруживают Streptococcus pneumoniae, реже — Haemophilus (H.) influenzae, Moraxella catarrhalis, Streptococcus pyogenes (β-гемолитический). Хронический синусит чаще полимикробный, вызывается α-гемолитическим стрептококком, S. aureus, коагулазонегативными стафилококками, нетипичными H. influenzae, а также Moraxella catarrhalis и анаэробными бактериями (Peptostreptococcus spp., Prevotella, Bacteroides, Fusobacterium spр.), после многих курсов антибиотиков (или у иммунокомпрометированных пациентов) — Pseudomonads. Эти сведения еще раз заставляют оценить место и роль поливалентных бактериофагов в комплексном лечении синуситов.
При лечении риносинуситов препаратом пиобактериофаг путем его местного введения в пазухи отмечено значительное улучшение, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа. Таким образом, препарат пиобактериофаг поливалентный (Секстафаг®) обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета. В то же время применение антибиотиков при лечении больных хроническим гнойным риносинуситом сопровождается сохранением признаков воспаления в виде активации нейтрофильного звена иммунной системы, увеличением внеклеточной пероксидазной активности и угнетением процесса фагоцитоза с нарушением механизмов завершенности в клетках [18]. Пиобактериофаг при местном введении в пазухи улучшает показатели завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа [19].
Обострения хронического ларингита сопровождается обсеменением слизистой гортани патогенной микрофлорой. Использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь позволяет существенно сократить продолжительность лечения, значительно повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений [27].
Эффективность бактериофаготерапии у иммунокомпрометированных пациентов доказана в зарубежных исследованиях [28].
Бактериофаги продемонстрировали эффективность при лечении инфекции, находящейся под биопленкой. Биопленка — плотная колония микроорганизмов на поверхности биологических или небиологических сред, окружающих себя секретируемым экстрацеллюлярным полимером, практически непроницаемым для антибиотиков. Способность бактерий образовывать биопленку — важнейшее условие их выживания на поверхности тканей или медицинских объектов (катетеры, имплантаты). свойства биопленок позволили выдвинуть идею о кооперированных микробных группах как аналогах многоклеточных организмов и социобиологических общностей [29]. Разрушение биопленки возможно при применении фагов [30]. В частности, обработка катетеров перед их постановкой коагулазонегативными фагами резко снижает вероятность образования биопленки Staphylococcus epidermidis [31].
Применение бактериофагов известно также при собственно кишечных инфекциях [32] и при сепсисе, вызванном кишечной инфекцией Ps. aeruginosa [33]. При этом в эксперименте прием бактериофага per os привел к 67% выживаемости в экспериментальной группе животных и к 0% в контрольной.
Особое внимание привлекает возможность бактериофаготерапии при внутренних и системных инфекциях. Большинство таких исследований принадлежит отечественным ученым. Показано, что совместное применение бактериофагов и антибиотиков в лечении детей с осложненной инфекцией мочевыводящих путей значительно эффективней, чем изолированная антибиотикотерапия [34].
[35] пролечено 36 детей в возрасте от 14 дней до 3 лет с тяжелыми заболеваниями бронхолегочной системы с наличием в мокроте синегнойной и кишечной палочек, клебсиеллы, энтерококка, стафилококка, которые, будучи нозокомиальной флорой, в большинстве случаев были нечувствительны к большинству известных антибиотиков. Путем ингаляций вводили моно- или поливалентные бактериофаги, пиобактериофаг. Курс антибактериальной терапии сократился с 13–17 до 8–11 дней. Элиминация возбудителя и уменьшение воспаления в трахеобронхиальном дереве подтверждались контрольным бактериологическим посевом и цитологическим исследованием мокроты: эффективность составила 88,8%. Использование поливалентных фагов явилось более оправданным по сравнению с монофагами на фоне элиминации основного бактериального агента в меньшей мере происходила параллельная контаминация другими, не менее вирулентными, микробами. Таким образом, применение небулайзеротерапии бактериофагами в комплексном лечении острых и хронических обструктивных бронхолегочных заболеваний, включая муковисцидоз, показало высокую клиническую эффективность, позволило сократить сроки лечения дорогостоящими антибиотиками широкого спектра, уменьшить риск развития кандидоза. В эксперименте на животных, моделирующем лечение муковисцидоза, введение бактериофага при тяжелой пневмонии, вызванной Ps. aeruginosa, сопровождалось резким повышением выживаемости в подопытной группе [36].
Есть много нерешенных проблем, которые сводятся к организации многоцентровых исследований по принципам доказательной медицины, соотношению антибиотиков и бактериофагов при лечении.
В любом случае можно утверждать, что это направление перспективно и достаточно обнадеживающе, особенно при инфицировании резистентными штаммами.
Разнообразие лекарственных форм бактериофагов (таблетки, гели, растворы) позволяет применять их как перорально, так и наносить на раневые поверхности, вводить в полости организма. Препараты бактериофагов широко применяются в педиатрии, акушерстве и гинекологии, офтальмологии Например, назначение по поводу кесарева сечения препарата Секстафаг®, предварительно адаптированного к флоре, циркулирующей в конкретном учреждении, приводило к снижению осложнений (18,7%) в большей степени (26,7%), чем в группе женщин, получавших антибиотикопрофилактику.
Заключение
История изучения бактериофагов и анализ их применения в медицине позволяют с уверенностью сказать, что бактериофаги могут оказаться чрезвычайно востребованными в лечении самых разнообразных инфекционных заболеваний человека, особенно при антибиотикорезистентных возбудителях. Каждый препарат, тем более обладающий качествами живого и вводимый в организм человека, имеет свои положительные и вероятностные отрицательные эффекты. В частности, литический эффект фагов, приводящий к разрушению клеточной стенки микроба, сопровождается выбросом в кровь большого количества эндотоксинов, что приводит к эффекту септицемии. Обсуждается необходимость приема активированного угля или иных адсорбентов. Более перспективным направлением кажется генетическая инженерия фага, которая сохраняла бы свой , но фаг был бы . Такой фаг мог бы использоваться в клинической практике как эффективный антимикробный агент, лишенный побочных эффектов [37]. Кроме того, бактериофаги, как и любые другие вирусы, способны переносить гены вирулентности от одной бактерии к другой [38].
В настоящее время в большинстве публикаций указывается на безопасность фаготерапии; хорошо организованные двойные слепые рандомизированные контролируемые исследования позволят определить безопасность и эффективность фагов как альтернативы антибиотикам при инфекциях с полирезистентной флорой [39]. Дальнейшее изучение возможностей бактериофаготерапии будет зависеть от объективной заинтересованности медицинского сообщества, проведения многоцентровых независимых исследований, развития вирусологии с ее возможностями получения новых чистых препаратов фагов.
1 Сборник среднемосковских основных показателей деятельности учреждений Департамента здравоохранения г. Москвы за М., 2009. 87 с.
2 Выбор инфекционного агента для опытов не был случайным: отец был известным микробиологом, написавшим монографию о сибиреязвенной палочке, переведенную и на немецкий язык.
3 Департамент здравоохранения г. Москвы. Доклад о состоянии здоровья населения г. Москвы в 2008 г.
Информация только для специалистов в сфере медицины, фармации и здравоохранения!

И.М. ЩЕРБЕНКОВ, к.м.н., ЦЭЛТ, Москва
Бактерии, резистентные к большинству или ко всем из всех известных антибиотиков, вызывают все более серьезные проблемы. Это увеличивает риск возврата медицинского сообщества к проблемам того периода, когда антибиотики были неизвестны и широко распространены неизлечимые инфекции и эпидемии. Несмотря на интенсивную работу ведущих химиков и фармацевтов всего мира, за последние 30 лет резко снизился синтез новых классов антибиотиков, и в ближайшее время не предвидится поступления в клиническую практику принципиально новых представителей антибактериальных средств. Есть надежда, что вновь обнаруженная возможность полностью секвенировать микробные геномы и определять молекулярные основы патогенности откроет новые пути лечения инфекционных заболеваний, но все с большим рвением идет поиск других подходов к этой проблеме.
Одним из результатов такого поиска является вновь возникший интерес к возможностям терапевтического использования бактериофагов (от бактерии и греч. phagos пожиратель; букв. пожиратели бактерий) специфических вирусов, которые атакуют только бактерии и убивают патогенные микроорганизмы. Бактериофаги обладают способностью проникать в бактериальные клетки, репродуцироваться в них и вызывать их лизис.
История изучения и применения бактериофагов
В 1896 г. Эрнест Ханкин сообщил, что воды рек Ганга и Джамна в Индии обладают значительной антибактериальной активностью, которая сохранялась после прохождения через фарфоровый фильтр с порами очень малого размера, но устранялась при кипячении. Наиболее подробно изучал он действие неизвестной субстанции на Vibrio cholerae и предположил, что она ответственна за предупреждение распространения эпидемий холеры, вызванных употреблением воды из этих рек. Однако в последующем он не объяснил этот феномен.
В 1898 г. впервые перевиваемый лизис бактерий (сибиреязвенной палочки) наблюдал русский микробиолог Н.Ф. Гамалея.
В 1980-е гг. эффективность лечения антибиотиками значительно понизилась, бактерии активно вырабатывают лекарственную устойчивость. Чтобы создать новый сильнодействующий антибиотик, фармацевтические компании сегодня должны в среднем потратить 10 лет и 800 млн долл. Это послужило поводом к повышенному интересу к фаговой терапии. В начале 2000-х гг. Гленн Моррис, сотрудник Университета Мэриленд (США), совместно с НИИ бактериофагов, микробиологии и вирусологии в Тбилиси наладил испытания фаговых препаратов для получения лицензии на их применение в США. И уже в июле 2007 г. бактериофаги одобрены для использования в США. На протяжении последних нескольких лет исследования свойств бактериофагов проводятся в России, Грузии, Польше, Франции, Германии, Финляндии, Канаде, США, Великобритании, Мексике, Израиле, Индии, Австралии.
Характеристика фагов
Применение современных электронных микроскопов, а также усовершенствование методов приготовления препаратов для электронной микроскопии позволили более детально изучить тонкую структуру фагов. Оказалось, что она весьма разнообразна и у многих фагов более сложна, чем структура вирусов растений и ряда вирусов человека и животных. Бактериофаги, как и другие вирусы, несут свою генетическую информацию в форме ДНК либо РНК. Большинство бактериофагов имеют хвостики, кончики которых прикреплены к конкретным рецепторам, таким как молекулы углеводов, белков и липополисахаридов на поверхности бактерии-хозяина. Бактериофаг впрыскивает свою нуклеиновую кислоту в хозяина, где он использует генетический механизм хозяина, чтобы реплицировать свой генетический материал, и считывает его, чтобы сформировать новый фагокапсульный материал для создания частичек нового фага. Число фагов, произведенных в течение единичного цикла инфекции (размер выхода), варьирует между 50 и 200 новыми фаговыми частицами.
Фаги обладают строгой специфичностью, т. е. способны паразитировать только в определенном виде микроорганизмов: стрептококках, стафилококках и т. д. Фаги с более строгой специфичностью, которые паразитируют только на определенных представителях данного вида, называются типовыми. Фаги, которые лизируют микроорганизмы близких видов, например видов, входящих в род возбудителей дизентерии (шигелл), называются поливалентными.
Лизогенизация бактерий сопровождается изменением их морфологических, культуральных, ферментативных, антигенных и биологических свойств. Так, например, нетоксигенные штаммы коринебактерий дифтерии в результате лизогенизации превращаются в токсигенные.
Практическое использование фагов
Фаготерапия (применение бактериальных вирусов для лечения бактериальных инфекций) была проблемой, весьма интересующей ученых еще 60 лет назад. Открытие пенициллина и других антибиотиков в 1940-х гг. обеспечило более результативный и многосторонний подход к подавлению вирусных заболеваний и спровоцировало к закрытию работ в данной области.
В связи с катастрофически возрастающей антибиотикорезистентностью и отсутствием в ближайшей перспективе новых антибактериальных средств возродился активный интерес к фаготерапии.
Научные данные последних десятилетий доказывают, что в отличие от антибиотиков препараты бактериофагов имеют следующие положительные качества:
Обладая широким спектром антибактериальной активности и клинической эффективности, бактериофаги эффективны против лекарственно-устойчивых организмов, что предоставляет возможность расценивать их как аналоги или заменители антибиотиков и средства противосептической терапии.
Фаготерапия может использоваться профилактически с целью борьбы с распространением инфекционного заболевания там, где источник идентифицирован на ранней стадии, или там, где вспышки случаются внутри сравнительно закрытых организаций, таких как школы или детские сады.
Активность лечебно-профилактических бактериофагов при инфекционных болезнях пищеварительной системы, гнойно-септических заболеваниях кожных покровов, кровеносной системы, дыхательной системы, опорно-двигательного аппарата, мочеполовой системы (более 180 нозологических единиц заболеваний, вызванных бактериями Klebsiella, Escherichiae, Proteus, Pseudomonas, Staphylococcus, Streptococcus, Serratia, Enterobacter) довольно высока – от 72 до 90% – и часто является единственным эффективным лечебным средством. Также это касается штаммов больничного происхождения, характеризующихся множественной устойчивостью к антибиотикам.
Препараты бактериофагов
Препараты бактериофагов представляют собой стерильный фильтрат бактериальных фаголизатов, их прописывают для применения внутрь, местно для орошения повреждений и слизистых, введения в полости матки, мочевого пузыря, уха, придаточных пазух, а также в дренированные полости – брюшную, плевральную, а также в полости нарывов и гнойников после удаления экссудата. Бактериофаги способны стремительно проникать в кровоток, лимфатическую систему, а удаляются из организма вместе с мочой. Соответствие препаратов бактериофагов нынешней атиологической структуре возбудителей достигается производством штаммов, или штаммов-продуцентов, или синтезированного материала, не подлежащего каким-либо трансформациям. Такая пластичность бактериофаговых препаратов обеспечивает продолжительный эффект первичной фагоустойчивости возбудителей. Применение бактериофагов для лечения инфекционных заболеваний инициирует факторы специфического и неспецифического иммунитета, что в особенности результативно для терапии длительных инфекционных заболеваний, возникших в результате ослабления иммунитета на фоне депрессивного расстройства при бактерионосительстве. Научными исследованиями, во время клинических наблюдений, методом эксперимента выявлена несостоятельность плазмид передавать антибиотикам иммунитет к токсигенности профилактико-терапевтическим препаратам бактерионосительства, потому что они являются поликлональными комплексами вирулентных бактериофагов.
При использовании бактериофагов в крупных клиниках целесообразно включать в состав производственных штаммов, на которых готовятся коммерческие препараты, госпитальные штаммы возбудителей гнойно-воспалительных заболеваний, характерных для данного стационара. Отечественными неонатологами показана высокая эффективность фаготерапии гнойно-септических инфекций у детей раннего возраста. Помимо литического действия на микробы, отмечают их значение в механизме антитоксического, клеточного и гуморального иммунитета. Изучение возможности применения бактериофагов как альтернативы антибиотикотерапии для лечения острой кишечной инфекции (ОКИ) у детей в возрасте до 3 лет, проводимое на кафедре детских инфекционных болезней КНМУ, показало высокую эффективность поливалентного Интести-бактериофага. Был сделан вывод о возможности проведения этиотропной терапии поливалентным Интести-бактериофагом без включения антибиотиков больным ОКИ в легкой и средне-тяжелой форме даже в условиях общего кишечного отделения.
Дисбиоз как актуальная проблема у детей
В последние годы актуальной задачей в педиатрии остается рациональная фармакотерапия дисбиозов различного генеза. В особенности актуальна проблема дисбиоза кишечника у детей раннего возраста. Результаты современных исследований свидетельствуют о наличии дисбактериоза кишечника I-II степени у 50% здоровых детей грудного возраста, III-IV степени - у 20-25% детей. Нарушения микробиоценоза кишечника наблюдают практически при всех заболеваниях детского возраста. При формировании дисбактериоза усугубляется общее состояние пациента, снижается резистентность организма к инфекционным и антигенным агентам, толерантность к пищевым продуктам. Все это создает фон для более тяжелого течения заболеваний, возникновения осложнений, перехода острых форм в хронические. Дети первого полугода жизни особенно подвержены дисбиозу, что обусловлено транзиторной недостаточностью ферментов (в основном лактазы), незрелостью вегетативной нервной системы (ВНС), регулирующей моторику кишечника, несформированностью иммунных механизмов.
Основными причинами возникновения дисбиоза кишечника в детском возрасте являются:
• несвоевременное начало и неправильное ведение лактации;
• ранний переход и нерациональное искусственное вскармливание на первом году жизни ребенка и нарушение режима питания в старшем возрасте;
• острые кишечные инфекции и заболевания пищеварительного канала неинфекционного характера;
• нерациональное применение антибиотиков и других химиотерапевтических препаратов;
• аллергическая предрасположенность;
• снижение естественной резистентности организма.
Лечение пациентов с дисбиозом кишечника следует проводить дифференцированно и начинать с выявления основного заболевания, без лечения которого признаки дисбиоза рецидивируют. Длительность одного курса лечения детей индивидуальна и колеблется от 10 сут. до 1,52 мес. Повторные курсы проводят после промежуточного бактериологического контроля (исследование кала) не ранее, чем через 2 нед. после окончания курса терапии. Суммарная длительность восстановления (до уровня устойчивой клинической компенсации) зависит от многих сопутствующих факторов и составляет 69 мес.
В современной детской гастроэнтерологии используется широкий арсенал препаратов для коррекции нарушенного микробиоценоза кишечника. В клинической практике педиатры и гастроэнтерологи для коррекции дисбиоза всe чаще используют бактериофаги. Применяют коли-протейный, стафилококковый, синегнойный, поливалентный дизентерийный, сальмонеллезный, комбинированный (смесь стафилококкового, стрептококкового, коли, синегнойного, протейного бактериофагов), поливалентный пиобактериофаг, интестифаг и др. Применение специфических бактериофагов позволяет оптимальным образом осуществить селективную деконтаминацию, проводимую при ряде патологических состояний с целью санирующего эффекта, а также для восстановления нормального микробиоценоза. Являясь безвредным биологическим методом лечения, бактериофаготерапия может применяться у детей раннего возраста. Для получения положительных результатов использования бактериофагов необходимо предварительное исследование чувствительности к ним микроорганизмов.
Коли-протейный бактериофаг жидкий мы применяем при лечении детей с дисбиозом, обусловленным энтеропатогенной кишечной палочкой (эшерихией) и протеем (мирабилис или вульгарным). Бактериофаг назначаем внутрь или в клизме. Суточная доза препарата для применения внутрь: детям в возрасте до 6 мес. 5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме вместо одного из приемов через рот; от 6 мес. до 1 года 1015 мл 2 раза в сутки внутрь и 20 мл 1 раз в сутки в клизме; в возрасте 13 лет 1520 мл 2 раза в сутки внутрь и 40 мл 1 раз в сутки в клизме; старше 3 лет 20 мл 2 -3 раза в сутки внутрь и 40-60 мл 1 раз в сутки в клизме. Внутрь бактериофаг назначают за 1-1,5 ч до еды. Детям первого месяца жизни бактериофаг разводят кипяченой водой в 2 раза. Детям старше 6 мес. за 5-10 мин до введения препарата дают 10-20 мл (в зависимости от возраста) 2-3%-ного раствора натрия гидрокарбоната для нейтрализации желудочного сока. Курс лечения составляет 5-10 сут. в зависимости от степени выраженности дисбиотических нарушений.
В клизме препарат целесообразно применять при отсутствии синдрома мальабсорбции: детям до 6 мес. - 20 мл, от 6 мес. до 3 лет - 30-40 мл, старше 3 лет - 40–50 мл. Препарат вводят 1 раз в сутки 23 курсами продолжительностью 3-4 сут. С интервалом между курсами 3 сут. Противопоказаний к применению препарата нет. Назначение бактериофага не исключает применения других ЛС.
Стафилококковый бактериофаг жидкий мы назначаем внутрь в суточной дозе: детям до 6 мес. - 20 мл, 6 мес. - 3 года - 40 мл, старше 3 лет - 100 мл. Вводят в 2 приема, натощак, за 1,5-2 ч до еды. В клизме в этих же дозах следует вводить 1 раз в сутки по той же схеме.
Поскольку мы в реальной клинической практике при дисбиозах встречаемся с одновременным ростом различных представителей патогенной микрофлоры, важно назначение в подобных случаях с учетом данных бактериологических исследований комбинированных бактериофагов - смеси стафилококкового, стрептококкового, коли, синегнойного, протейного бактериофагов. Их назначают детям в возрасте до 3 лет по 3-5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме; старше 3 лет - 5-10 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме. Внутрь назначают за 1 ч до еды. Возможно дополнительное введение комбинированного фага в высокой клизме по 5-20 мл. Курс лечения 5-15 сут.
Интестифаг содержит фаголизаты кишечной палочки, шигеллезы сальмонелл, УПМ. Назначают внутрь за 1 ч до еды детям в возрасте до 3 лет по 3-5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме; детям старше 3 лет - по 5-10 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме. Курс лечения 5-6 сут.
Поливалентный пиобактериофаг, или секстифаг - смесь фаголизатов кишечной палочки, клебсиеллы, синегнойной палочки, стафилококка, стрептококка, протея. Данный препарат отличается наиболее высокой степенью очистки от бактериальных метаболитов, что значительно улучшает его вкусовые качества и делает средством первого выбора у детей до года. Назначают: детям в возрасте до 3 лет - 3-5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме; старше 3 лет - 5-10 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме. Внутрь применяют за 1 ч до еды. Курс лечения 5-15 сут.

А.В. АЛЕШКИН, д.б.н., руководитель Лаборатории клинической микробиологии и биотехнологии бактериофагов, Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского
В настоящее время доступны жидкие и таблетированные формы лечебных моновалентных препаратов стафилококкового, стрептококкового, коли, клебсиеллезного, сальмонеллезного, дизентерийного, брюшнотифозного, протейного и синегнойного бактериофагов и комбинированные рецептуры, содержащие несколько видов фагов: колипротейный, пиобактериофаг (против стафило-, стрептококков, клебсиелл, протеев, синегнойной и кишечной палочек) и интести-фаг (против шигелл, сальмонелл, стафило-, энтерококков, протея, кишечной и синегнойной палочек) (рис. 1). Лекарственные препараты представляют собой стерильные фильтраты бактериальных фаголизатов, их назначают внутрь и местно: орошение ран и слизистых оболочек, введение в полость матки, мочевого пузыря, среднего уха, придаточных пазух носа, конъюнктиву глаза, а также в дренированные полости – брюшную, плевральную, в полости абсцессов после удаления гноя. Они широко используются с лечебной, в т. ч. в хирургической практике, особенно при лекарственно-устойчивых формах инфекций, и профилактической целью в регионах, эндемичных по инфекционным заболеваниям, а также в организованных коллективах, таких как ясли, детские сады, школы и армейские казармы, где могут происходить быстрые вспышки инфекций. В современных отечественных и зарубежных литературных источниках достаточно подробно освещены клинические исследования, направленные на профилактику и лечение ОКИ бактериофаговыми препаратами [1--4]. В то же время в тени остались многочисленные клинические исследования, посвященные применению фагов в профилактике и лечении гнойно-септических осложнений в хирургии, в т. ч. для купирования часто возникающих патологических состояний органов дыхания.

Не менее выдающимся исследователем, применявшим бактериофаги при гнойных и некротических состояниях, по праву признается академик Н.Н. Жуков-Вережников. Он считал весьма целесообразным использование в хирургической клинике монофагов, адаптированных к штаммам возбудителей, выделенных от конкретных больных и примененных для их же лечения. Систематические клинико-микробиологические исследования применения бактериофагов проводились им с целью лечения различных форм хирургических гнойных инфекций (абсцессов, флегмон, маститов, карбункулов и т. д.), возбудителями которых в большинстве случаев были антибиотикорезистентные штаммы стафилококка, синегнойной палочки и других патогенных бактерий. В результате проводимой под его руководством фаготерапии гладкое заживление ран у пациентов данного профиля после наложения ранних вторичных швов наступало в кратчайшие сроки [7].
Позднее в сравнительном исследовании, проведенном под руководством Г.Д. Иоселиани, изучалась эффективность местного применения бактериофагов для профилактики пострезекционных острых эмпием плевры при хронических нагноительных заболеваниях легких. В рамках данных клинических испытаний 45 пациентам назначали стафилококковый или поливалентный бактериофаг, а 107 больным фаготерапия до и после операции не проводилась. Представителям обеих групп в процессе предоперационной подготовки осуществляли санацию трахеобронхиального дерева путем ингаляции, трансназальной катетеризации или бронхоскопии. При катетеризации пациентам опытной группы ежедневно вводили 5--10 мл бактериофагового препарата и антибиотики с учетом предварительно оцененной чувствительности к ним патогенной микрофлоры. Такой же тактики придерживались при проведении бронхоскопии. При наличии абсцессов и вскрывшихся в плевральную полость гнойников прибегали к пункции и дренированию очага инфекции антисептиками с последующим введением туда 10--30 мл бактериофагов с антибиотиками. В послеоперационном периоде аспирацию экссудата и расправление легкого осуществляли пункциями с последующим введением 10--50 мл бактериофага с антибиотиками. Результаты оперативного лечения больных, получавших и не получавших фаготерапию, представлены в таблице 1. Применение бактериофагов вместе с антибиотиками путем ингаляции, катетеризации, бронхоскопии и внутриплеврально по 5--50 мл ежедневно не вызывало аллергических и пирогенных реакций. По мнению авторов, местная фаготерапия значительно снижала возможность возникновения острой послеоперационной эмпиемы легких (с 18,7 до 6,7%) и хорошо переносилась пациентами [8].
| Таблица 1. Результаты хирургического лечения больных [8] | ||
| Показатель | Пациенты, получавшие бактериофаг (%) | Пациенты, не получавшие бактериофаг |
| Гнойные пострезекционные плевральные осложнения | 5 (11,11) | 23 (21,49) |
| Отсутствие плевральных осложнений | 40 (88,88) | 84 (78,50) |
| Всего | 45 | 107 |
В задачи другой группы исследователей, работавшей, как и предыдущие коллеги, в НИИ экспериментальной и клинической хирургии им. К.Д. Эристави Минздрава Грузинской ССР, входило не только изучение эффективности стафилококкового бактериофага для лечения, предоперационной подготовки и профилактики послеоперационных осложнений при нагноительных заболеваниях легких и плевры, но и создание методики его применения, определение показаний и противопоказаний к его использованию. Всего под наблюдением у данных клиницистов находилось 340 пациентов с неспецифическими гнойными заболеваниями легких и плевры, у 223 (1-я группа) из которых в комплекс лечения был включен бактериофаг, а 117 (2-я группа) получали только антибиотики. Стафилококковый бактериофаг применяли как отдельно, так и в комбинации с антибиотиками. Пути введения стафилококкового бактериофага подбирали индивидуально. Бактериофаг назначали как местно -- в виде эндобронхиальных санаций (ингаляции, катетеризация трахеи, бронхоскопия) непосредственно в гнойный очаг в легком или плевральной полости (трансторакальная пункция и катетеризация гнойных очагов), так и парентерально -- внутримышечно, внутривенно, путем длительной перфузии в бронхиальную или легочную артерию. Количество бактериофага лимитировалось местом введения: для эндобронхиальных санаций -- 10--30 мл, непосредственно в гнойный очаг в паренхиме легкого -- 10--50 мл, в полость эмпиемы -- 20--100 мл, парентерально -- 0,5--1,0 мл/кг. Длительность фаготерапии зависела от клинического и рентгенологического эффекта и составляла 2--4 нед. В таблице 2 приведены результаты лечения больных 1-й и 2-й групп. Подводя итоги многолетнего исследования, авторы на основании клинических и лабораторных данных не только подтверждали высокие лечебные свойства стафилококковых бактериофагов в комплексе с антибиотиками, выражавшиеся в т. ч. и в положительных статистически достоверных иммунологических сдвигах, но и отмечали отсутствие аллергических и пирогенных реакций даже при интравенозных инфузиях * фагового препарата [9].
* Стафилококковый бактериофаг, культивированный на полусинтетической питательной среде, свободный от белкового расщепления, не содержащий стафилококковых токсинов и пирогенных веществ, пригодный для внутривенного применения [9].
| Таблица 2. Результаты лечения больных стафилококковым бактериофагом с антибиотиком и только антибиотиками [9] | ||||||
| Заболевание | Стойкая ремиссия или выздоровление | Относительная ремиссия | Обострение или смерть | |||
| А | Б | А | Б | А | Б | |
| Острый абсцесс легкого | 23 | 8 | 0 | 2 | 1 | 7 |
| Хронический абсцесс легкого | 41 | 23 | 3 | 13 | 7 | 4 |
| Хроническая пневмония | 39 | 11 | 16 | 8 | 1 | 1 |
| Хронический гнойный бронхит | 24 | 9 | 5 | 4 | 0 | 0 |
| Бронхоэктатическая болезнь | 23 | 9 | 4 | 4 | 0 | 0 |
| Нагноившаяся киста легкого | 11 | 9 | 0 | 0 | 0 | 0 |
| Эмпиема плевры | 24 | 6 | 0 | 3 | 1 | 2 |
| Всего | 185 | 75 | 28 | 34 | 10 | 14 |
| Примечание. А -- больные 1-й группы; Б -- больные 2-й группы. | ||||||
В педиатрической практике бактериофаги активно применялись для лечения бактериальной пневмонии. Пятилетний опыт ингаляционного использования бактериофагов в НИИ педиатрии Грузинской ССР у 189 детей первого года жизни показал существенное сокращение срока болезни, сопровождавшееся как более редким выделением патогенных микроорганизмов из носоглотки, так и снижением их вирулентности. Для лечения применяли поливалентный бактериофаг, состоящий из 55% стафилофага, 30% стрептофага и 15% колифага, изготовленный в НИИ вакцин и сывороток Министерства здравоохранения Грузинской ССР. Исходная чувствительность к фаговому препарату микробов, выделенных из носоглотки пациентов, достигала 97%. Пациентам, страдавшим токсической (153 ребенка) и локализованной (36 детей) формой пневмонии, проводили 10 сеансов ингаляционной фаготерапии по 5--10 мин каждый. Учитывая, что бактериофаговый препарат не вызывал побочных явлений, авторы рекомендовали его включение в арсенал препаратов для лечения бактериальной пневмонии, особенно стафилококковой этиологии [10].
Под руководством заведующего кафедрой терапии Центрального института усовершенствования врачей Е.В. Ермакова на небольшой группе пациентов (34 человека) было проведено исследование эффективности бактериофагов в комплексной терапии острой абсцедирующей пневмонии и пневмонии затяжного течения с сопутствующим хроническим гнойным обструктивным бронхитом (ХОБ). Полученные клиницистами данные свидетельствовали о значительной лечебной эффективности фаг-препаратов у больных с давностью ХОБ не более 5 лет. Санационная бронхоскопия с применением фаг-препаратов Горьковского и Тбилисского НИИ вакцин и сывороток вызывала у этих пациентов выраженную реакцию Яриша -- Герксгеймера, после которой наступало резкое улучшение состояния, связанное с нормализацией бронхиального дренажа, снижением интоксикации, значительным повышением содержания сывороточных иммуноглобулинов IgA и IgG, разрешением эндобронхита и воспалительного процесса в легочной паренхиме. Менее значительный эффект фаг-препаратов авторы отмечали у больных с более длительным хроническим гнойным обструктивным бронхитом [11].
Ведущие онкологические научно-исследовательские институты СССР также активно использовали бактериофаги для профилактики и лечения послеоперационных гнойно-воспалительных осложнений. Так, в клиническом исследовании Т.Р. Пономарева и соавт. лечебные бактериофаги получали 77 пациентов с инфекционными осложнениями, в т. ч. у 6 больных очаг находился в легких и плевральной полости. Поливалентные препараты бактериофагов Горьковского НИИ эпидемиологии и микробиологии вводили в полость после эвакуации гнойного содержимого в течение 1--14 дней. В случаях когда у онкологических больных выделяли монокультуры золотистого стафилококка, включение в комплексную терапию фагов давало хороший клинический эффект, связанный с высокой (97%) чувствительностью S. aureus in vitro к стафилококковому бактериофагу [12].
Врачи-исследователи МНИОИ им. П.А. Герцена с целью объективной оценки эффективности фаготерапии провели сравнительный клинико-лабораторный анализ у 131 онкологического больного, из которых 65 пациентов (1-я группа) получали в плане этиотропного лечения гнойных осложнений бактериофаги, а 66 пациентов -- 2-я контрольная группа -- только антибиотики. У половины пациентов из обеих групп в опухолевый процесс были вовлечены органы дыхания, однако локализация гнойно-воспалительного очага могла быть другой. Сравнительный анализ показал, что купирование гнойного процесса -- эмпиемы плевры при лечении больных раком легкого с использованием фагов, которые вводили внутриплеврально по 50 мл ежедневно в течение 5--7 дней, наступало в 66,7% случаях против 43,8% в контрольной группе. Эффективность фаготерапии в целом по группам с различной локализацией гнойно-воспалительного процесса оказалась наиболее высокой при лечении раневой инфекции и менее успешной при лечении остеомиелита ребер, медиастинита и эмпиемы плевры со свищем. Кроме того, авторы резюмировали, что при моноинфекции было целесообразно использование одного фага; при смешанной инфекции лучшие результаты давала одновременно проводимая фаго- и антибиотикотерапия. Наибольшей терапевтической активностью (86,7%) обладал синегнойный фаг, меньшей (74,4 %) -- стафилококковый при лечении одноименной моноинфекции. Пиополивалентный бактериофаг, примененный при смешанной инфекции, дал положительный результат у 57,1% больных [13].
Несмотря на скептическое отношение в этот период к фаготерапии западных ученых, нам удалось обнаружить сделанные ими описания ряда случаев клинического использования бактериофагов при инфекционно-воспалительных заболеваниях органов дыхания. Так, M. Cevey и Z. Schwiez в 1958 г. применили стафилококковые бактериофагии у пациента с эмпиемой плевры, вызванной гомологичными антибиотикорезистентными штаммами на фоне активной формы туберкулеза. Фаговый препарат вводили внутриплеврально в течение 15 дней, постепенно увеличивая его объем. Улучшение состояние пациента было медленным, но стабильным, что позволило сделать авторам следующий вывод: в случаях гнойной инфекции, вызванной бактериальным штаммом, устойчивым к антибиотикам, стоит немедленно рассмотреть возможность комбинированного лечения антибиотиками и бактериофагами [14].
Годом позже P. Delacoste описал успешное лечение пациентов, страдавших упорным кашлем, с помощью ингаляционной фаготерапией. В 15 из 19 клинических случаях ему удалось добиться полного выздоровления, под которым он понимал купирование кашля и избавление больных от мокроты гнойного характера [15].
В 1962 г. J. Hoeflmayr добился излечения бронхита в 90% клинических случаев, также используя ингалятор (небулайзер). Лечение проводилось ежедневно в течение 11 дней сеансами по 10--15 мин аэрозолем из бактериофагов, разведенных 1:5-ным физиологическим раствором. Автор не наблюдал побочных эффектов от фаготерапии при таком режиме использования [16].

Литература
1. Sulakvelidze A, Alavidze Z and Morris JG Jr. Bacteriophage Therapy Antimicrob. Agents Chemother, 2001, 45, 649-659.
2. Chanishvili N. A Literature Review of the Practical Application of Bacteriophage Research. Nova Science Publishers, Hauppauge, New York, 2012, 283.
3. Солодовников Ю.П., Павлова Л.И., Емельянов П.И. и др. Профилактическое применение сухого поливалентного бактериофага с пектином в дошкольных учреждениях. ЖМЭИ, 1970,5, 131-137.
4. Aleshkin AV, Volozhantsev NV, Svetoch EA, Afanas’ev SS. Bacteriophages as Probiotics and Decontaminating Agents for Food Products, in book: Bacteriophages: Biology, Applications and Role in Health and Disease, Eds. Denton C. and Crosby R.J., N.Y.: NOVA Biomedical Publications, 93-110.
5. Кокин Г.А. Применение бактериофагов в хирургии. Советская медицина, 1941, 9, 15-18.
6. Покровская М.П., Каганова Л.С., Морозенко М.А. и др. Лечение ран бактриофагом. М.: Медгиз, 1942, 60.
7. Жуков-Вережников Н.Н., Перемитина Л.Д., Берило Э.А. и др. Изучение терапевтического эффекта препаратов бактериофага в комплексном лечении гнойных хирургических заболеваний. Советская медицина, 1978, 12, 64-66.
8. Иоселиани Г.Д., Меладзе Г.Д., Чхетия Н.Ш. Применение бактериофага с антибиотиками для профилактики острых пострезекционных эмпием плевры при хронических нагноительных заболеваниях легких. Грудная хирургия, 1980, 6, 63-67.
9. Меладзе Г.Д., Медуке М.Г., Чхетия Н.Ш. и др. Применение стафилококкового бактериофага при лечении неспецифических заболеваний легких и плевры. Грудная хирургия, 1982..1. 53-56.
10. Гарсеванишвили Т.И. Некоторые методические аспекты применения ингаляции поливалентного бактериофага при лечении пневмонии раннего детского возраста. Ж Педиатрия им. Сперанского, 1974, 53, 65-66.
11. Ермаков Е.В., Новожилов В.Г., Кириллова В.А. и др. Об эффективности бактериофагов в лечении неспецифических заболеваний легких. Сов. мед. 1984. 2. 37-39.
12. Пономарева Т.Р., Смолянская А.З., Соколова Е.Н. и др. Бактериофаги в лечении послеоперационных осложнений у онкологических больных. Сов. Мед. 1985. 4. 89-92.
13. Кочеткова В.А., Мамонтов А.С., Московцева P.JI. и др. Фаготерапия послеоперационных гнойных осложнений у онкологических больных. Сов. мед. 1989. 6. 23-26.
14. Cevey M, Schwiez Z. Le bacteriophage dans le traitement des empyemes pleuraux a germes resistants aux antibiotiques [Bacteriophage in the treatment of pleural empyema antibiotic resistant bacteria]. Tuberk (Swiss Tuberculosis Journal or Schw Zt Tbc) 1958; 15: 34-39.
15. Delacoste P. Considerations sur le traitement des affections respiratoires banales au moyen de bacteriophages [Considerations on the treatment of common respiratory diseases by means of bacteriophages]. Rev Med Suisse Romande 1959; 79:552-563; PMID:13815551.
16. Hoeflmayr J. Inhalationstherapie mit Bakteriophagen bei therapieresistenten Infektionen [Inhalation therapy with bacteriophages for treatment-resistant infections]. In: Nuckel H, ed. Fortschritte der biologischen Aerosol-Forschung in den Jahren 1957–1961 [Advances in Biological Aerosols Research in the Years 1957–1961]. Stuttgart, Germany: 1962: 403-409.
17. Slopek S, Weber-Dąbrowska B, Dąbrowski M, Kucharewicz-Krukowska A. Results of bacteriophage treatment of suppurative bacterial infections in the years 1981-1986. Arch Immunol Ther Exp, 1987, 35:569-583; PMID:3455647.
18. Abedon ST. Phage therapy of pulmonary infections, Bacteriophage, 2015, 5: 1, e1020260.
Читайте также:

