Стафилококковый бактериофаг во влагалище
Обновлено: 19.04.2024
Человек живет впостоянном контакте исложнейшем взаимодействии снеисчислимым множеством микроорганизмов. Жить без микробов невозможно, ноисмногими изних— тоже. Ежегодно, посамым скромным оценкам, неучитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает отпневмонии 3,9млн человек, отдиареи— 1,6млн, оттуберкулеза— 1,6млн [1].
Человек живет в постоянном контакте и сложнейшем взаимодействии с неисчислимым множеством микроорганизмов. Жить без микробов невозможно, но и с многими из них — тоже. Ежегодно, по самым скромным оценкам, не учитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает от пневмонии 3,9 млн человек, от диареи — 1,6 млн, от туберкулеза — 1,6 млн [1].
С учетом нарастающей резистентности флоры к антибиотикам, вероятности аллергических и токсических реакций возникает проблема: что применять вместо антибиотиков или в комплексе с ними?
Строение и микробиология фага
Бактериофаги — древнейшие вирусы, наиболее распространенный в биосфере биологический объект. Чистая природная вода содержит в 1 мл 2×108 фагов, на каждую бактериальную единицу приходится не менее 10 фаговых [5, 6].
Длительное время фаги изучали на примере фагов , размножающихся на Escherichia (Е.) coli штамма В. Внедрение и совершенствование электронной микроскопии позволили говорить о разнообразии форм фагов. Принципиально фаг вне зависимости от вида построен из белковой или липопротеиновой оболочки, внутри которой заключены ДНК ( чаще, реже), еще реже 1- или РНК и ферменты. Выделяют головку фага (возможны нитчатая, сферическая, полигональная, плеоморфная формы фага), где и заключены генетическая информация и ферменты, и хвост фага, прикрепляющийся за счет специфических рецепторов на поверхности клетки. Фаг является облигатным внутриклеточным паразитом, он растворяет оболочку клетки, впрыскивает в клетку свой геном. Последний полностью за счет транскриптаз переключает метаболизм клетки, и начинается синтез ДНК или, соответственно, РНК фага, и капсида. За 1–24 ч образуется 100–300 новых фагов. Клетка разрушается, выделившиеся в окружающее пространство фаги инфицируют новые клетки. Экспоненциальное размножение фагов завершается только после уничтожения специфических для них клеток. Во внешней среде фаги способны переживать десятилетия [7].
Принципы выбора терапии бактериофагами
В многочисленных отечественных и зарубежных публикациях продемонстрирована эффективность применения бактериофагов, генетически модифицированных, в лечении поверхностной и системной инфекций [8, 9]. Лечение фагами привлекательно по следующим причинам:
2. Бактериофаги — естественные природные средства. Бактериофаг не может длительно циркулировать в макроорганизме — длительность его жизни лимитирована наличием .
При применении бактериофагов следует учитывать, что специфичность фагов может ограничивать их применение в острых случаях.
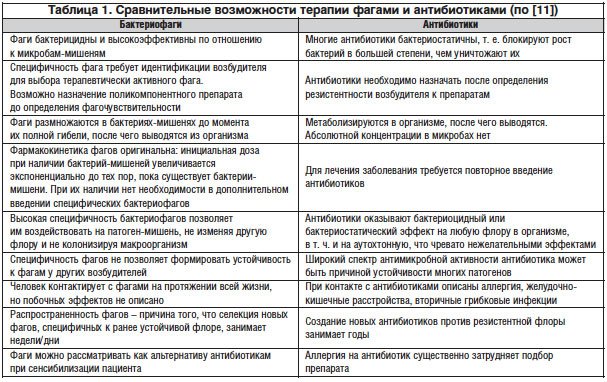
Соотношение бактериофаго- и антибиотикотерапии представлено в таблице 1.
Фаготерапия покровных и барьерных структур тканей
В эксперименте [14, 15] была показана эффективность фагов в лечении кожных инфекций и внутримышечных абсцессов (Pseudomonas (Ps.) aeruginosa, Staphylococcus (S.) aureus). В клинической практике эффективность лечения инфекций ран, инфицированных пострадиационных некрозов была продемонстрирована K. Markoishwili et al. [16] и другими представителями школы грузинского ученого Г. Элиавы.
В нашей стране для наружного применения используют комплексные фаговые препараты. Препарат пиобактериофаг поливалентный (Секстафаг®) для приема внутрь (20 мл 3 р./сут, 7–15 дней), местно или наружно способен лизировать стафило- и стрептококки, патогенные кишечные и синегнойные бактерии (Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae). Это позволяет применять его при заболеваниях уха, горла, носа, дыхательных путей, легких и плевры (воспалении пазух носа, среднего уха, ангине, фарингите, ларингите, трахеите, бронхите, пневмонии, плеврите). Секстафаг®, являясь эффективной альтернативой антибиотикам, может также применяться с ними комплексно. Крайне важно, что препарат может применяться при заболеваниях у новорожденных и детей грудного возраста (омфалит, гастроэнтероколит), беременных и рожениц. Все это подчеркивает безопасность препарата.
Гель Отофаг применяют местно в дозировке 1–2 мл: для профилактики рецидивов заболеваний — 2–3 р./сут в течение 7–10 дней, при наличии бактериального воспалительного заболевания — 2–3 р./сут в течение 7–14 дней.
Применение фагов как профилактического, лечебного и противорецидивного средства продемонстрировало свою эффективность в самой частой педиатрической группе: пациенты с инфекционной патологией верхних дыхательных путей (риносинуситы, тонзиллиты, ларингиты, фарингиты). Обычно эти инфекции трактуются как вирусные, хотя достаточно часто причиной бывают и бактерии, или бактериальная флора активируется в процессе манифестации вирусной инфекции.
Подавляющее большинство всех случаев острых заболеваний детей, особенно младшего возраста, вызваны острой респираторной инфекцией (ОРИ). Первичная заболеваемость детей и подростков по г. Москве за колебалась от 1680,2‰ до 1763,6‰3. Заболеваемость болезнями органов дыхания за этот же период составила 1147,4–1188,8‰. Общий экономический ущерб от заболеваний гриппом детей и взрослых в 2008 г. составил 375,2 млрд руб. Заболеваемость ОРВИ детей и подростков до 17 лет в 8,3 раза выше, чем взрослых. Так, при совместных исследованиях с [17] было показано, что на первом году жизни частота эпизодов ОРИ составляет 1535,9:1000, у детей достигает 3796,29:1000. Даже если первоначально заболевание разворачивается как вирусное, то впоследствии часто присоединяется бактериальная флора или активируется собственная, что требует взвешенного решения о выборе препарата или сочетании антибиотиков с иными препаратами, бактериофагами.
Инфекционный ринит дебютирует первоначально, как правило, как вирусный с типичным водянистым или отделяемым. Появление отделяемого, лихорадки, боли в области придаточных пазух говорит о присоединении бактериальной флоры. В качестве профилактики такого развития заболевания можно обсуждать местное применение поливалентного бактериофага.
Присоединение бактериальной инфекции с ее распространением на придаточные пазухи носа приводит к синуситу. Любые нарушения цилиарного клиренса, вентиляции, местного или системного иммунного ответа создают условия для хронизации синусита, вылечить который без воздействия на первоначальные причины невозможно. Признаки синусита:
- сохранение симптомов респираторной инфекции на протяжении 7–10 дней;
- дневной кашель и ринорея;
- заложенность носа;
- нередко низкий субфебрилитет;
- средний отит (у 60–70% больных);
- беспокойство;
- головные боли.
К признакам тяжелого течения синусита или его осложнений относятся гнойная ринорея, лихорадка выше 39ºС и периорбитальный отек. При остром и подостром синусите чаще обнаруживают Streptococcus pneumoniae, реже — Haemophilus (H.) influenzae, Moraxella catarrhalis, Streptococcus pyogenes (β-гемолитический). Хронический синусит чаще полимикробный, вызывается α-гемолитическим стрептококком, S. aureus, коагулазонегативными стафилококками, нетипичными H. influenzae, а также Moraxella catarrhalis и анаэробными бактериями (Peptostreptococcus spp., Prevotella, Bacteroides, Fusobacterium spр.), после многих курсов антибиотиков (или у иммунокомпрометированных пациентов) — Pseudomonads. Эти сведения еще раз заставляют оценить место и роль поливалентных бактериофагов в комплексном лечении синуситов.
При лечении риносинуситов препаратом пиобактериофаг путем его местного введения в пазухи отмечено значительное улучшение, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа. Таким образом, препарат пиобактериофаг поливалентный (Секстафаг®) обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета. В то же время применение антибиотиков при лечении больных хроническим гнойным риносинуситом сопровождается сохранением признаков воспаления в виде активации нейтрофильного звена иммунной системы, увеличением внеклеточной пероксидазной активности и угнетением процесса фагоцитоза с нарушением механизмов завершенности в клетках [18]. Пиобактериофаг при местном введении в пазухи улучшает показатели завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа [19].
Обострения хронического ларингита сопровождается обсеменением слизистой гортани патогенной микрофлорой. Использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь позволяет существенно сократить продолжительность лечения, значительно повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений [27].
Эффективность бактериофаготерапии у иммунокомпрометированных пациентов доказана в зарубежных исследованиях [28].
Бактериофаги продемонстрировали эффективность при лечении инфекции, находящейся под биопленкой. Биопленка — плотная колония микроорганизмов на поверхности биологических или небиологических сред, окружающих себя секретируемым экстрацеллюлярным полимером, практически непроницаемым для антибиотиков. Способность бактерий образовывать биопленку — важнейшее условие их выживания на поверхности тканей или медицинских объектов (катетеры, имплантаты). свойства биопленок позволили выдвинуть идею о кооперированных микробных группах как аналогах многоклеточных организмов и социобиологических общностей [29]. Разрушение биопленки возможно при применении фагов [30]. В частности, обработка катетеров перед их постановкой коагулазонегативными фагами резко снижает вероятность образования биопленки Staphylococcus epidermidis [31].
Применение бактериофагов известно также при собственно кишечных инфекциях [32] и при сепсисе, вызванном кишечной инфекцией Ps. aeruginosa [33]. При этом в эксперименте прием бактериофага per os привел к 67% выживаемости в экспериментальной группе животных и к 0% в контрольной.
Особое внимание привлекает возможность бактериофаготерапии при внутренних и системных инфекциях. Большинство таких исследований принадлежит отечественным ученым. Показано, что совместное применение бактериофагов и антибиотиков в лечении детей с осложненной инфекцией мочевыводящих путей значительно эффективней, чем изолированная антибиотикотерапия [34].
[35] пролечено 36 детей в возрасте от 14 дней до 3 лет с тяжелыми заболеваниями бронхолегочной системы с наличием в мокроте синегнойной и кишечной палочек, клебсиеллы, энтерококка, стафилококка, которые, будучи нозокомиальной флорой, в большинстве случаев были нечувствительны к большинству известных антибиотиков. Путем ингаляций вводили моно- или поливалентные бактериофаги, пиобактериофаг. Курс антибактериальной терапии сократился с 13–17 до 8–11 дней. Элиминация возбудителя и уменьшение воспаления в трахеобронхиальном дереве подтверждались контрольным бактериологическим посевом и цитологическим исследованием мокроты: эффективность составила 88,8%. Использование поливалентных фагов явилось более оправданным по сравнению с монофагами на фоне элиминации основного бактериального агента в меньшей мере происходила параллельная контаминация другими, не менее вирулентными, микробами. Таким образом, применение небулайзеротерапии бактериофагами в комплексном лечении острых и хронических обструктивных бронхолегочных заболеваний, включая муковисцидоз, показало высокую клиническую эффективность, позволило сократить сроки лечения дорогостоящими антибиотиками широкого спектра, уменьшить риск развития кандидоза. В эксперименте на животных, моделирующем лечение муковисцидоза, введение бактериофага при тяжелой пневмонии, вызванной Ps. aeruginosa, сопровождалось резким повышением выживаемости в подопытной группе [36].
Есть много нерешенных проблем, которые сводятся к организации многоцентровых исследований по принципам доказательной медицины, соотношению антибиотиков и бактериофагов при лечении.
В любом случае можно утверждать, что это направление перспективно и достаточно обнадеживающе, особенно при инфицировании резистентными штаммами.
Разнообразие лекарственных форм бактериофагов (таблетки, гели, растворы) позволяет применять их как перорально, так и наносить на раневые поверхности, вводить в полости организма. Препараты бактериофагов широко применяются в педиатрии, акушерстве и гинекологии, офтальмологии Например, назначение по поводу кесарева сечения препарата Секстафаг®, предварительно адаптированного к флоре, циркулирующей в конкретном учреждении, приводило к снижению осложнений (18,7%) в большей степени (26,7%), чем в группе женщин, получавших антибиотикопрофилактику.
Заключение
История изучения бактериофагов и анализ их применения в медицине позволяют с уверенностью сказать, что бактериофаги могут оказаться чрезвычайно востребованными в лечении самых разнообразных инфекционных заболеваний человека, особенно при антибиотикорезистентных возбудителях. Каждый препарат, тем более обладающий качествами живого и вводимый в организм человека, имеет свои положительные и вероятностные отрицательные эффекты. В частности, литический эффект фагов, приводящий к разрушению клеточной стенки микроба, сопровождается выбросом в кровь большого количества эндотоксинов, что приводит к эффекту септицемии. Обсуждается необходимость приема активированного угля или иных адсорбентов. Более перспективным направлением кажется генетическая инженерия фага, которая сохраняла бы свой , но фаг был бы . Такой фаг мог бы использоваться в клинической практике как эффективный антимикробный агент, лишенный побочных эффектов [37]. Кроме того, бактериофаги, как и любые другие вирусы, способны переносить гены вирулентности от одной бактерии к другой [38].
В настоящее время в большинстве публикаций указывается на безопасность фаготерапии; хорошо организованные двойные слепые рандомизированные контролируемые исследования позволят определить безопасность и эффективность фагов как альтернативы антибиотикам при инфекциях с полирезистентной флорой [39]. Дальнейшее изучение возможностей бактериофаготерапии будет зависеть от объективной заинтересованности медицинского сообщества, проведения многоцентровых независимых исследований, развития вирусологии с ее возможностями получения новых чистых препаратов фагов.
1 Сборник среднемосковских основных показателей деятельности учреждений Департамента здравоохранения г. Москвы за М., 2009. 87 с.
2 Выбор инфекционного агента для опытов не был случайным: отец был известным микробиологом, написавшим монографию о сибиреязвенной палочке, переведенную и на немецкий язык.
3 Департамент здравоохранения г. Москвы. Доклад о состоянии здоровья населения г. Москвы в 2008 г.
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

Н.Р. СТЕПАНОВА, М.А. ГЕВОРКЯН, д.м.н., профессор, Московский медико-стоматологический университет им. А.И. Евдокимова
В статье представлен обзор альтернативного метода лечения инфекционных заболеваний с помощью бактериофагов. Дана краткая характеристика бактериофагов, приведены данные имеющихся к настоящему времени клинических исследований и наблюдений, а также перспективы применения бактериофагов в акушерстве и гинекологии.
Профилактика и лечение инфекционных осложнений в акушерстве и гинекологии сохраняют свою актуальность, несмотря на достижения медицинской науки в последние десятилетия. Специалистам не только не удалось взять инфекционные осложнения (в т. ч. в акушерстве и гинекологии) под полный контроль, но даже сформировалась тенденция к их росту во всем мире [1--3].
В России около 25 тыс. женщин ежегодно погибают от инфекционно-септических осложнений, связанных с беременностью и родами. Важно отметить и ту опасность, которую несут инфекционные заболевания матери для внутриутробного плода и новорожденного. Так, в нашей стране среди причин перинатальной смертности внутриутробные инфекции занимают долю почти 25%; и 30% -- от всех случаев младенческой смертности, связанной с врожденными пороками развития по причине того же внутриутробного инфицирования [4, 5]. Гнойно-септические осложнения хирургического аборта составляют, по данным разных авторов, 5--25%, после кесарева сечения -- 5,2--48%, после экстирпации и надвлагалищной ампутации матки -- 6--23%, после лапароскопических операций -- около 7% [4]. В случае верификации у пациенток вагинальных инфекций, при опухолях, сахарном диабете, ожирении, а также в пожилом возрасте риск послеоперационных осложнений может достигать 40% [4, 6--8].
Настоящим вызовом для современной медицины можно считать выход из-под врачебного контроля инфекций, которые ранее считались безобидными или легкоуправляемыми у большинства пациентов. Условно-патогенные микроорганизмы, наряду с усилением болезнетворных свойств, приобретают факторы устойчивости к противомиробным средствам -- антибиотикам. По мнению большинства исследователей, в усилении условно-патогенными микроорганизмами патогенных свойств виновно массовое и бесконтрольное назначение антибиотиков. В 2012 г. председатель ВОЗ Маргарет Чен сообщила о вступлении мира в постантибиотическую эру, когда люди начнут гибнуть от банальной царапины.
Следует отметить, что лидирующей причиной и хронического воспаления, и гнойно-септических осложнений становятся полимикробные ассоциации: чаще всего врач в своей практической деятельности сталкивается с микст-инфекцией, представленной грам-отрицательными аэробными и анаэробными возбудителями, причем повреждающее действие на органы репродуктивной системы при таких ассоциациях значительно усиливается [9].
В таких условиях успех могла бы принести комплексная лечебная тактика при включении в лечебную схему антибиотиков, полностью перекрывающих весь возможный спектр возбудителей инфекций, причем, согласно современным клиническим рекомендациям, в терапию необходимо включать несколько антибактериальных препаратов. Однако эффект такой комплексной антибактериальной терапии на практике часто бывает недостаточным по нескольким причинам [9, 10].
• Выработка факторов устойчивости микроорганизмов к действию антибактериальных средств.
• Образование биопленок, защищающих микробное сообщество от действия терапевтических средств.
• Нарушение состава нормального биотопа при назначении антибиотиков.
• Высокая частота аллергических реакций на действие антибиотиков.
• Отсутствие на рынке новых антибиотиков.
• Недостаточный эффект и осложнения антибактериальной терапии, нарушение сроков лечения и использование неадекватных доз антибиотиков сопровождаются развитием дисбактериозов, аутоиммунных заболеваний и хронизации воспалительных процессов.
Кроме вышеописанных факторов, сохранению инфекционной угрозы способствуют диагностические сложности при верификации возбудителей, отсутствие единых протоколов лечения у врачей разных специальностей (у гинекологов, дерматовенерологов, урологов). Учитывая инфекционную угрозу, сегодня критически необходимы не только новые данные о свойствах болезнетворных бактерий и их чувствительности к антимикробным средствам, но и разработка инновационных продуктов.
В настоящее время во многих западных странах исследователи вновь заинтересовались терапевтическими возможностями бактериофагов. Причиной тому стала катастрофически нарастаящая антибиотикорезистентность микроорганизмов, особенно стафилококков и синегнойной палочки [28–31]. В Финляндии, например, бактериофаги даже предлагают включать в йогурты.
• Адсорбция фаговой частицы на поверхности бактериальной клетки;
• Инвазия внутрь бактерии;.
• Внутриклеточная репликация с использованием структурных компонентов бактериальной клетки;.
• Разрушение бактериальной клетки и выход нового пула бактериофагов, готовых к инфицированию сохранившихся гомологичных бактерий.
Кроме литического и лизогенного действия, бактериофаги стимулируют факторы специфической и неспецифической иммунной защиты: активируют фагоцитоз, активность нейтрофилов, повышают уровень Т-лимфоцитов, что предупреждает хронизацию воспалительного процесса и его рецидивирование [20, 36, 37].
В России проводятся исследования по изучению эффективности бактериофагов в акушерско-гинекологической практике.
Так, проведено сравнительное исследование с участием пациенток с бактериальным вагинозом [43]. В ходе лабораторного анализа был выявлен полимикробный состав измененного влагалищного микроценоза. Более чем у 80% пациенток была обнаружена колонизация условно-патогенной микрофлорой -- стафилококки составляли 34,3%; кишечная палочка -- 23,5%; протей -- 10,8%; клебсиелла -- 8,2% и синегнойная палочка -- 3,4%. Цервикальный биоценоз (просветный и пристеночный) был представлен стафилококком (16,8 и 26% соответственно), кишечной палочкой (12,1 и 17,2%), клебсиеллой (9,4 и 0,8%), синегнойной палочкой (3,8 и 0,4%) и протеем (7,6 и 6,0% соответственно). Была определена чувствительность микрофлоры к антибиотикам и бактериофагам. Данные анализа литической активности поливалентного пиофага показали чувствительность к нему у 76% штаммов стафилококков, у 73% штаммов кишечной палочки, у 55% штаммов представителей рода протей, для клебсиеллы -- на 70,8%; для синегнойной палочки -- на 66,7%.
Бактериофаги для лечения баквагиноза применяли в виде монотерапии или совместно с антибиотиками. Комбинированный поливалентный пиофаг назначался однократно внутрь в дозе 30 мл, или по 20 мл 3 раза в день с одновременным орошением влагалища или на тампонах в течение 5--7 дней. 36 больных получали традиционную антибиотикотерапию. Клиническое улучшение в подгруппах фаговой терапии наступало на 3--5 сут. быстрее в группе лечения антибиотиками. Результаты исследования показали преимущество именно комбинированного применения бактериофагов и антибиотиков [43].
Сравнение результатов бактериоскопии вагинального отделяемого показало снижение микробного обсеменения в группе антибиотикотерапии у 66,6% больных, монотерапии бактериофагами -- у 56%, комбинированного лечения -- у 89,5%. Отмечено также, что клиническое улучшение происходило на 3--5 сут. быстрее в группе, леченной фагами, чем в группе с антибиотиками.
Восстановление нормобиоценоза влагалища произошло через 1 мес. после фаготерапии у 33 из 42 больных (78,0%), после антибиотикотерапии — у 11 больных из 36 (30,6%). Сравнительную оценку эффективности лечения проводили по результатам клинического и микробиологического обследования через 3, 6 и 12 мес.: нормоценоз восстановился у 34,6% больных, леченных антибиотиками, у 77,4% получавших монофаготерапию, у 82,6% женщин, прошедших комбинированное лечение. Антибиотикотерапия в подгруппе из 36 женщин сопровождалась побочными эффектами в 38,9% случаев (n = 14): тошнота, диарея, головокружение, кожные высыпания и зуд, дисбактериоз. Бактериофаги ни в одном случае не вызывали аллергию. Таким образом, более эффективной и безопасной была сочетанная терапии антибиотиками и бактериофагом.
В упомянутое выше исследование вошли 246 женщин после планового кесарева сечения. Основную группу составили пациентки (n = 102), которым был назначен Секстафаг®, группу сравнения -- роженицы (n = 144), у которых проводилась традиционная антибиотикопрофилактика (b-лактамные пенициллины и цефалоспорины 1- го поколения). Одним из критериев включения женщин в группу фаготерапии были аллергические реакции на пенициллины (30,4% женщин). Средний возраст обследованных в обеих группах и структура показаний к абдоминальному родоразрешению (рубец на матке, экстрагенитальная патология, фетоплацентарная недостаточность, тазовое предлежание) не отличались.
В ходе операции кесарево сечение полость матки орошали препаратом Секстафаг® в количестве 20--30 мл, а ушиваемую рану -- 10,0 мл препарата, кроме того, поливалентный бактериофаг вводили интравагинально в объеме 10,0 мл. Назначение препарата бактериофага ни в одном случае не было сопряжено с развитием аллергических реакций и побочных явлений, на фоне антибиотикопрофилактики у двух родильниц были отмечены диспепсические явления.
У женщин группы бактериофаготерапии не было отмечено ранних послеоперационных осложнений, в группе антибиотикопрофилактики -- у 3 пациенток выявлена субинволюция матки на 6-е сутки. Этим женщинам потребовалось проведение дополнительных вмешательств -- вакуум-аспирации из полости матки, назначение дополнительных утеротонических и противомикробных средств.
Из осложнений послеоперационного периода был отмечен один случай развития серомы послеоперационного шва у женщины из подгруппы антибиотикопрофилактики, не потребовавший наложения вторичных швов. У всех пациенток, у которых применяли Секстафаг®, послеоперационный период проходил без осложнений, а заживление шва происходило первичным натяжением [9].
Имеющийся к сегодняшнему дню опыт фаготерапии и фагопрофилактики в акушерстве и гинекологии показывает сопоставимость лечебных эффектов при их применении с таковыми при назначении антибиотиков, однако требуется продолжение исследований в этом направлении.
К другим перспективам применения бактериофагов в акушерстве и гинекологии можно отнести лечение ВЗОМТ, профилактику и терапию экстрагенитальных инфекций во время беременности, внутриутробной инфекции, послеоперационных осложнений при гинекологических вмешательствах.
| Таблица. Комбинированные лечебно-профилактические бактериофаги [4] | |
| Наименование препарата | Спектр антибактериальной активности |
| Бактериофаг стрептококковый | Streptococcus, Enterococcus |
| Бактериофаг колипротейный | Энтеропатогенная E.coli, Proteus vulgaris, Proteus mirabilis |
| Пиобактериофаг поливалентный (Секстафаг) | Pseudomonas aeruginosa, Proteus mirabilis, vulgaris, Klebsiella pneumoniae, Staphylococcus, Enterococcus, энтеропатогенная E. coli |
| Пиобактериофаг комплексный | Pseudomonas aeruginosa, Proteus mirabilis, vulgaris, Klebsiella pneumoniae, oxytoca, Staphylococcus, Enterococcus, энтеропатогеннои E. coli |
| Интести-бактериофаг | Shigella sonnae, Shigella flexneri 1, 2, 3, 4, 6, Salmonella ABCDE, Энтеропатогенная E. coli, Proteus vulgaris, mirabilis, Staphylococcus aureus, Pseudomonas aeruginosa, Enterococcus |
Клинический опыт применения бактериофагов показал успешные результаты профилактики и лечения кишечных инфекций, дисбактериозов, гнойно-воспалительных заболеваний при хирургической, педиатрической, гинекологической, ЛОР- и офтальмологической патологии. Отечественными неонатологами доказана высокая эффективность фаготерапии гнойно-септических инфекций у детей раннего возраста [4].
Важно отметить основное условие, напрямую влияющее на результат фаготерапии, -- определение чувствительности к ним возбудителя. После верификации возбудителей и определения их чувствительности к конкретному фагу можно использовать монокопонентные поливалентные бактериофаги.
Лекарственные препараты бактериофагов выпускают в различных лекарственных формах (жидкие, таблетированные). Препараты бактериофагов следует хранить при температуре от 2 до 8° С в сухом темном месте.
К преимуществам фаготерапии относят:
• строгую специфичность,
• быстрое наступление клинического эффекта,
• селективное проникновение в инфекционный очаг, в т. ч. защищенный биопленками,
• способность к самовоспроизводству и саморегуляции бактериофагов,
• безопасность и отсутствие выявленных к сегодняшнему дню противопоказаний,
• стимуляцию иммунитета,
• возможность совместного применения с антибиотиками и иммунотропными средствами.
Результаты проведенных исследований продемонстрировали, что лечебный эффект применения поливалентного бактериофага сопоставим по с таковым при антибиотикопрофилактике. Назначение поливалентного бактериофага безопасно для женщин с аллергическими реакциями на антибиотики и хорошо переносится больными.
Учитывая, что бактериофаги являются одними из самых мощных антимикробных агентов, существующих в природе, совершенствование фаготерапии позволит обеспечить новый подход к лечению с целью преодолеть последствия антибиотикорезистентности бактерий и вернуть под врачебный контроль заболевания, вызванные бактериальными патогенами.
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

В настоящее время широкую распространённость приобретают инфекционные заболевания влагалища, вызываемые условно-патогенными микроорганизмами (УПМ), в том числе входящими в состав нормальной микрофлоры половых путей женщин [1]. К данным заболеваниям относится и состояние, обозначенное в литературе как аэробный вагинит [2, 3]. Являясь фоновым состоянием, аэробный вагинит (АВ), тем не менее, может оказывать влияние на репродуктивную функцию женщины. Следовательно, разработка и внедрение адекватных методов его терапии имеет важное медицинское и социальное значение. Вопросам лечения воспалительных заболеваний, обусловленных УПМ, уделяется повышенное внимание, поскольку этих возбудителей отличает высокая природная либо приобретённая антибиотикорезистентность. Традиционные схемы предусматривают использование антибактериальных препаратов, применение которых может способствовать селекции высоко резистентных штаммов УПМ и рядом нежелательных реакций [4]. Антибиотикотерапия, ликвидируя патогенные и условно-патогенные микроорганизмы, угнетает общие и местные защитные реакции, создавая предпосылки для формирования многокомпонентных бактериальных и бактериально-грибковых ассоциаций усугубляющих течение инфекционного процесса. В связи с этим, поиск новых подходов к адекватной терапии является актуальной проблемой.
Цель исследования: оценка эффективности санации влагалищного биотопа женщин репродуктивного возраста, АВ, поливалентным секстабактериофагом в свечах в качестве монотерапии и в комбинации с 1%-м раствором хлорофиллипта.
Материалы и методы
В исследование было включено 60 женщин с АВ в возрасте от 19 до 38 лет (средний возраст составил 27,3±1,2 года). Аэробный вагинит был установлен на основании клинических и лабораторных данных. У всех пациенток на момент обследования были исключены ИППП, а также заболевания верхних отделов половых путей, включая воспалительные заболевания органов малого таза. Все больные в течение двух предшествующих недель не применяли местную или локальную антибиотикотерапию. Пациенткам было проведено обследование, включающее гинекологический осмотр, рН-метрию влагалищного секрета, постановку аминотеста с 10% р-ром КОН, бактериоскопическое и бактериологическое исследование вагинального отделяемого, проводимое по общепринятым методикам. Забор материала для бактериологического исследования производился из заднего свода влагалища до проведения ручного исследования. Посев проводили с использованием набора стандартных питательных сред для выявления аэробов, микроаэрофилов и облигатных анаэробов. Условно-патогенных возбудителей идентифицировали по общепринятым методам с обязательным подсчетом количества колониеобразующих единиц. Также была определена фагочувствительность наиболее часто встречающихся в избыточном количестве аэробных видов бактерий. Материал для микроскопии наносили тонким слоем на предметное стекло. При микроскопическом исследовании вагинальных мазков обращали внимание на выраженность лейкоцитарной реакции, состо¬яние вагинального эпителия, количественный и качественный состав микрофлоры. Cтатистическая обработка данных производилась с помощью использования стандартных пакетов программ MS – Access, 2007, Excel, 2007 и Statistica 6.0.
Результаты и обсуждение
Доминирующими жалобами пациенток являлись дискомфорт во влагалище и бели (98%). При осмотре гиперемия слизистой влагалища выявлена у 96,7% обследуемых женщин. При рН-метрии реакция влагалища смещалась в щелочную сторону. Диапазон колебаний рН был от 4,3 до 5,5 и в среднем составил 4,8±0,02. Аминотест был отрицательным в 100% случаев. По микроскопической картине состояние влагалища у пациенток с АВ соответсвовало II и III степени чистоты с преобладанием смешанной флоры, преимущественно грамотрицательных палочек, типично повышение числа лейкоцитов (от 20 до 40 в поле зрения), нередко увеличенных в размерах, вакуолизированных. Однако, бактериоскопическое исследование не даёт исчерпывающей информации о качественном и количественном составе, а также функциональном состоянии влагалищной микрофлоры. Поэтому мы провели детальное бактериологическое исследование. При АВ отмечали уменьшение количества лактобацилл до 3,2 lg KOE/мл. На этом фоне расширился спектр и увеличилась численность условно-патогенных микроорганизмов. Так, Е. coli численностью 4,14±0,35 lg KOE/мл выявлены у 47 (78,3%) женщин; S. epidermidis – 4,26±0,17 lg KOE/мл у 33 (55%); St. haemolyticus – 4,53±0,21 lg KOE/мл у 54 (90%); Corynebacterium – 4,54±0,09 lg KOE/мл у 19 (31,7%) женщин. Во всех случаях высевали ассоциации микроорганизмов, представленные 2–5 видами. С целью определения эффективности этиотропной терапии АВ больные были разделены на 2 группы (по 30 женщин в каждой), не отличающиеся по эпидемиологическим характеристикам (возраст, масса тела, семейное положение, акушерский и гинекологический анамнез, методы контрацепции).
Выводы. Исследования показали, что хлорофиллипт позволяет быстрее адаптировать бактериофаг к влагалищной среде и обеспечивает лучший терапевтический эффект. Следовательно, включение специфических бактериофагов и растительных антисептиков в терапевтические схемы для местного лечения воспалительных заболеваний влагалища, ассоциированных с избыточной колонизацией слизистой оболочки вагины аэробными условно-патогенными бактериями, оправдано и может служить альтернативой традиционной антибиотикотерапии.
Для цитирования: Буданов П.В., Новахова Ж.Д., Чурганова А.А. Альтернатива антибактериальной терапии в акушерстве и гинекологии. РМЖ. Мать и дитя. 2015;23(1):14.
Инфекционная патология женских половых органов является наиболее актуальной проблемой акушерства, гинекологии и перинатологии, т. к. именно с ней связаны воспалительные заболевания гениталий, привычное невынашивание беременности, бесплодие, хронические тазовые боли, внутриутробная инфекция плода и новорожденного [1–4].
Этиологическая структура воспалительных заболеваний половых органов женщины крайне разнообразна. Спектр возбудителей включает в себя десятки видов всех классов микроорганизмов — бактерии, вирусы, простейшие и грибы [5, 6]. Преобладают смешанные инфекции, в составе которых частота бактериальных агентов и их ассоциаций превышает 60%. При внутриутробной инфекции резко увеличивается частота осложнений беременности, ассоциированных с бактериальными поражениями. Преобладают потери беременности и плацентарная недостаточность [3, 7, 8]. Среди инфекционных причин антенатальной смертности смешанные инфекции составляют 75% [2, 3, 7].
В последнее время стало понятно, что без использования современных достижений фундаментальной и клинической микробиологии решить проблему инфекционной патологии практически невозможно. Успехи в области молекулярной и биохимической вирусологии связаны с раскрытием стратегии вирусного генома, выявлением особенностей биосинтеза облигатных для бактерий паразитов — бактериофагов. Тем не менее, проблема профилактики и лечения различных острых и хронических, персистирующих бактериальных инфекций, до сих пор далека от окончательного разрешения [4, 5].
Важными вопросами являются выбор метода контроля за эффективностью лечения, определение критериев бактериологической излеченности, безопасность терапии [2, 4, 6, 9]. Неадекватная оценка тяжести течения инфекционного процесса и неправильно разработанная стратегия терапии приводят к развитию аутоиммунной патологии и хронизации воспалительных заболеваний [9–11].
В структуре патологии, связанной с персистирующими, рецидивирующими инфекциями, глобальной проблемой являются нарушения иммунитета. В настоящее время более 1/3 всей патологии человека протекает в сочетании с клиническими признаками иммунной недостаточности, что определяет тяжесть клинических проявлений заболевания, развитие осложнений и ухудшение прогноза. Именно снижение локальной и общей резистентности организма приводит к длительно существующим заболеваниям.
Изменение парадигмы иммунитета беременности создает длительно существующее повышение риска манифестации и рецидивирования персистирующих инфекций у беременных и новорожденных [1–3, 7].
В настоящее время основой правильной врачебной деятельности является использование принципов доказательной медицины, основывающейся на знании сочетания доказанной эффективности лечебных воздействий и подтверждения их безопасности. Именно оценка соотношения предполагаемой пользы и прогнозируемого (ожидаемого) риска является краеугольным камнем качественной клинической практики [2, 4]. Особенно высокие требования к безопасности назначаемого медикаментозного лечения предъявляются в акушерстве и педиатрии.
Широкое распространение антибиотикотерапии в середине XX в. имело свои преимущества за счет универсальности воздействия антибиотиков (широкого спектра их действия), возможности проведения эмпирической терапии и отсутствия устойчивых штаммов микроорганизмов.
В настоящее время проблема антибиотикорезистентности имеет критическое значение для всех областей клинической медицины. Полимикробная этиология инфекционных заболеваний в акушерстве и гинекологии, селекция резистентных штаммов возбудителей приводят к резкому снижению эффективности антибактериальных препаратов первого ряда выбора. Существующие рекомендации для лечения воспалительных заболеваний включают уже и применение нескольких антибактериальных препаратов [12].
Антибактериальная терапия может явиться причиной развития дисбактериоза. В случае применения антибиотиков на фоне дисбактериоза может усиливаться степень его выраженности. Кроме того, антибиотики снижают колонизационную резистентность влагалища и кишечника, увеличивают проницаемость слизистой оболочки, способствуя тем самым проникновению микроорганизмов в кровяное русло, внутренние органы и развитию вторичного очага инфекции и аллергизации организма [12, 13].
Назначение бактериофагов можно без преувеличений назвать высокоспецифичной антибактериальной терапией. Исторически единственными лекарственными средствами, подавляющими рост бактерий, были антибактериальные вирусы — бактериофаги. Препараты бактериофагов имеют хорошие перспективы в качестве альтернативы химиотерапевтической антибактериальной терапии. В отличие от антибиотиков они обладают строгой селективностью действия, не подавляют нормальную микрофлору, стимулируют факторы специфического и неспецифического иммунитета, что особенно значимо при лечении хронических воспалительных заболеваний или бактерионосительства.
Характеристика и классификация
бактериофаги содержат поликлональные вирулентные бактериофаги широкого диапазона действия, активные и в отношении бактерий, устойчивых к антибиотикам [18]. Фаготерапия может успешно сочетаться с назначением антибиотиков [19].
Для приготовления препаратов бактериофагов используют вирулентные фаги, выделенные из окружающей среды и адаптированные к гомологичным возбудителям [20].
Достоинство поливалентных (монокомпонентных) препаратов заключается в строгой специфичности действия, поскольку они вызывают гибель только своего конкретного вида бактерий и в отличие от антибиотиков не влияют на нормальную микрофлору влагалища и кишечника больного. Использование бактериофагов показало хорошие результаты при лечении и профилактике кишечных инфекций, дисбактериозов, заболеваний при хирургической, педиатрической, гинекологической, ЛОР и офтальмологической патологии. Отечественными неонатологами показана высокая эффективность фаготерапии инфекций у детей раннего возраста.
Поликомпонентные препараты бактериофагов наиболее удобны в клинической практике врача , принимая во внимание постоянное существование смешанных бактериальных ассоциаций [11, 17, 22].
После определения чувствительности бактерий к конкретному фагу можно использовать монокомпонентные поливалентные бактериофаги. Разнообразие механизмов резистентности к антибиотикам обусловливает возможность комбинированного применения химиопрепарата с антибактериальной активностью в сочетании с бактериофагом (). Особенно эффективна такая комбинация для разрушения микробных биопленок.
Препараты бактериофагов могут назначаться для профилактики и лечения инфекционных заболеваний, нарушений микроценоза, а также для предотвращения колонизации слизистых оболочек женских половых органов бактериями. В условиях роста антибиотикорезистентности можно рассматривать бактериофаги как успешную альтернативу антибиотикам [14, 15, 17, 22].
Комбинированные препараты фагов имеют более высокую активность литического действия на бактериальную клетку за счет синергизма действия отдельных фагов и обеспечивают получение лечебного эффекта при инфекциях, вызванных ассоциациями микробов.
Существуют разнообразные лекарственные формы бактериофагов: жидкие, таблетированные, гели. Хранятся бактериофаги при температуре от 2 до 10°С в сухом темном месте в течение лет. Важным условием, обеспечивающим результативность лечения фаговыми препаратами, является определение чувствительности к ним возбудителя [21].
Механизм действия бактериофагов
Вирулентные бактериофаги, адсорбируясь на поверхности гомологичной микробной клетки, инъецируют свой генетический материал в ее цитоплазму, где интенсивно размножаются, используя структурные компоненты клетки, и разрушают ее. Далее зрелые фаговые частицы готовы к новому заражению, и литический процесс повторяется с новыми и новыми бактериальными клетками. Скорость инфицирования бактериальных клеток может достигать 1023 за 1 секунду [21].
Методика определения чувствительности микроорганизмов к бактериофагам
Определение фагочувствительности проводят на 1,5% агаре или агаре Хоттингера (для стафилококков и стрептококков в питательный агар добавляют 0,4% глюкозы). Дно чашки Петри с обратной стороны предварительно расчерчивают соответственно используемым фаговым препаратам.
Бактериальную суспензию суточной агаровой культуры (5 ед. по ОСО П) выделенного бактериального штамма равномерно распределяют по поверхности чашки Петри с хорошо подсушенной питательной средой. Излишек жидкости удаляют пастеровской пипеткой и подсушивают в зоне пламени горелки в течение 20–30 с.
На поверхность агара с впитавшейся культурой пастеровской пипеткой с тонко оттянутым концом наносят по 1 капле (0,03 мл) образца препарата бактериофагов. После подсыхания капель фагов чашки инкубируют в термостате при температуре 37°С в течение 18–20 ч, для бактерий рода Proteus — в течение 4–6 ч.
Учет и регистрация результатов проводятся по схеме:
+++ — полусливной лизис (незначительный рост культуры в зоне лизиса);
++ — наличие в месте нанесения капли фага более 50 колоний фага (пятна лизиса);
+ — от 20 до 50 колоний фага;
± — менее 20 колоний фага;
— полное отсутствие лизиса. Наличие зон лизиса ++++ и +++ свидетельствует о высокой чувствительности изучаемого штамма к фагу, ++ — умеренной, + — слабой чувствительности. Предпочтение должно быть отдано бактериофагам, вызывающим лизис с интенсивностью ++++ и +++ [17].
Безопасность
Являясь безвредным биологическим методом лечения, фаготерапия может применяться во время беременности, в периоде новорожденности и у детей раннего возраста.
В настоящее время в клинической медицине используют только литические формы бактериофагов, которые обладают бактерицидным действием и четким механизмом саморегуляции собственной популяционной активности.
Для получения положительных результатов использования бактериофагов необходимо предварительное исследование чувствительности к ним микроорганизмов. При использовании бактериофагов в крупных клиниках, больницах целесообразно включать их в состав производственных штаммов, на которых готовятся коммерческие препараты, госпитальные штаммы возбудителей заболеваний, характерных для данного стационара.
Результаты собственных исследований
Всего в исследование включили 136 женщин. С воспалительными заболеваниями органов малого таза (ВЗОМТ) были 73 пациентки, 32 из которых получали стандартную антибактериальную терапию в сочетании с пероральным приемом Секстафага®, 41 — только противомикробные препараты. Критериями исключения явились тяжелое и осложненное течение инфекции.
Больных с рецидивирующими нарушениями микроценоза влагалища (63) также разделили на две группы: 28 женщин получали только Секстафаг®, 35 — только метронидазол интравагинально. Критерием исключения служило обнаружение вульвовагинального кандидоза.
Внутри подгрупп не было достоверных отличий по возрасту и соматической патологии. Наблюдение за пациентами продолжали на протяжении 6 мес.
Пиобактериофаг поливалентный (Секстафаг®) обладает способностью специфически лизировать микроорганизмы (стафилококки, стрептококки, патогенные кишечные и синегнойные бактерии), Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae. Перорально препарат поливалентного бактериофага пациенты получали по 20,0 мл 2 р./сут на протяжении 10 дней. Пероральный прием предваряли приемом щелочной минеральной воды или раствором пищевой соды.
Интравагинально Секстафаг® вводили по 10,0 мл 2 р./сут на тампоне с экспозицией 60 мин на протяжении 10 дней.
В результате проведения исследования отмечено, что у больных ВЗОМТ, получавших комбинированную фагоантибиотикотерапию, продолжительность лечения сократилась в среднем до 5,8 cут, в то время как у пациентов только с антибиотиками продолжительность эффективного курса составила 8,7 сут.
Среди пациенток с рецидивирующими нарушениями микроценоза влагалища эффективность монотерапии в виде интравагинального введения полифага составила 85,7% (24 из 28). При назначении метронидазола интравагинально микробиологическая эффективность достигала 71,4% (25 из 35). Частота рецидивов бактериального вагиноза и неспецифического кольпита на протяжении 6 мес. наблюдения снизилась в 4,2 раза после применения поливалентного бактериофага.
Во время назначения препарата бактериофага не было отмечено аллергических реакций, немотивированного отказа от лечения. На фоне антибиотикотерапии только у одной пациентки развились диспептические явления, не потребовавшие дополнительного лечения и отказа от основной терапии.
Изолированно от проведения настоящего исследования выполнена оценка эффективности профилактического использования препарата с бактериофагами для профилактики рецидивирования вагинальных инфекций.
Принимая во внимание, что целевую когорту пациентов составили 32 женщины, демонстрируем предварительные результаты наблюдений, длившихся на протяжении не более 7 мес.
Антибактериальное средство Фагогин предназначено для профилактики вульвовагинальных инфекций и инфекционных заболеваний половых органов, а также является средством интимной гигиены. Использование средства Фагогин как средства профилактики особенно актуально у беременных для снижения риска манифестации и рецидивирования персистирующих инфекций.
Гель Фагогин вводился интравагинально по 5 мл 2–3 р./сут на протяжении 3–4 недель. Обязательной рекомендацией являлось использование геля Фагогин в качестве гигиенической процедуры после полового контакта.
После 3 нед. терапии у 87,5% пациенток жалобы купировались. Явления посткоитального цистита регрессировали у 8 (66,7%) женщин. Принципы клинических решений применения бактериофагов в гинекологии представлены на рисунке 1.
На данном этапе накопленных знаний фундаментальной и клинической микробиологии и вирусологии, имеющегося клинического опыта необходимо выделить доказанные преимущества фаготерапии:
- строгая специфичность: бактериофаги воздействуют только на чувствительные к ним бактерии, в то время как антибиотики поражают бактерии без специфичности, вызывая угнетение нормальной микрофлоры и формирование резистентности;
- быстродействие и глубокое проникновение в очаг инфекции: при пероральном приеме через 1 ч бактериофаги попадают в кровь, через 1–1,5 ч выявляются из бронхолегочного экссудата и с поверхности ожоговых ран, через 2 ч — из мочи, а также из ликвора больных с травмами;
- самовоспроизведение: ДНК бактериофага встраивается в хромосому бактерии, вследствие чего бактериальная клетка начинает продуцировать сотни бактериофагов, поражающих бактерии до их полного уничтожения;
- саморегуляция: в отсутствие бактерий, необходимых для размножения, бактериофаги быстро и полностью удаляются из организма;
- безопасность и отсутствие противопоказаний: препараты бактериофагов можно назначать беременным, кормящим матерям и детям любого возраста, включая недоношенных;
- полная совместимость с любыми лекарственными средствами: доказанная эффективность препаратов бактериофагов как при монотерапии, так и в комбинации с антибиотиками;
- стимуляция специфического и неспецифического иммунитета: фаготерапия особенно эффективна при лечении хронических воспалительных заболеваний на фоне иммунодепрессивных состояний;
- постоянная актуализация фаговых клонов: препараты бактериофагов соответствуют современной этиологической структуре возбудителей.
- монотерапия нарушений микроценоза влагалища;
- монотерапия или комбинация с антибиотиками при лечении ВЗОМТ, хронического эндометрита;
- профилактика и лечение инфекций во время беременности с экстрагенитальной локализацией первичного очага;
- профилактика и лечение внутриутробной инфекции;
- профилактика и лечение послеоперационных осложнений при гинекологических вмешательствах и кесаревом сечении.
Таким образом, в условиях формирования антимикробной резистентности, формирования устойчивых бактериальных пленок необходимость в новых альтернативных лечебных технологиях и антимикробных препаратах приобретает все большую значимость. Перспективы применения бактериофагов касаются не только антимикробной терапии, но и высокоточной диагностики, а также онкологии. Проведенное исследование показало, что поливалентный пиобактериофаг в виде монотерапии и сочетанной с антибиотиками терапии повышает эффективность лечения, уменьшает частоту рецидивов и обладает высокой комплаентностью.



Читайте также:

