Статьи по лечении ротавирусной инфекции
Обновлено: 15.04.2024
Ротавирусная инфекция вызывается одноименным вирусом.
Это заболевание еще называют ротавирозом, ротавирусным энтероколитом, желудочным или кишечным гриппом (последнее название обусловлено совпадением вспышек ротавирусной инфекции с эпидемиями гриппа).
Ротавирусная инфекция отличается сезонностью, наиболее часто она диагностируется в зимне-весенний период (с декабря по май). Вспышки болезни обусловлены плохим проветриванием помещений, редкой влажной уборкой и продолжительностью тесных контактов большого количества людей в помещении.
Этим заболеванием страдают как взрослые, так и дети, однако у последних оно протекает тяжелее. Считается, что в возрасте до 5 лет каждый ребенок перенес ротавирусную инфекцию. У взрослых на тяжесть течения заболевания влияет иммунитет, в случае его ослабления (СПИД, онкозаболевания, прием некоторых лекарств) болезнь протекает тяжелее.
Пути передачи
Главным механизмом передачи ротавирусной инфекции является фекально-оральный.
Чаще всего люди заражаются данным вирусом при употреблении загрязненной воды, что во многом обусловлено постоянным спуском неочищенных сточных вод в открытые водоемы.
Из пищевых продуктов наиболее опасны в плане передачи вируса молоко и молочные продукты, хотя возможно заражение и через немытые овощи и фрукты.
Контактно-бытовой механизм передачи инфекции чаще наблюдается внутри одной семьи или в местах коллективного проживания людей (общежития, коммунальные квартиры).
Не исключается и воздушно-капельный путь проникновения ротавируса в организм: при кашле, чихании, что особенно актуально для детских коллективов.
Инкубационный период составляет 1-5 суток, но чаще всего - 2-3 дня. Острый период продолжается 3-4 суток (начальная фаза 12-24 часа, фаза разгара 2-3 суток). Период выздоровления длится 4-5 дней. Окончательное выздоровление наступает через 7-10 суток.
Ротавирусная инфекция у детей
Стул во время болезни имеет отличительные особенности. В первые сутки он желтого цвета, водянистый, затем приобретает серо-желтый оттенок и глинообразный вид.
Также для ротавируса характерно поражение верхних дыхательных путей. Появляется насморк, отмечается гиперемия слизистых мягкого неба, небных дужек, язычка. У детей изменения слизистых наблюдаются чаще, чем у взрослых.
Аппетит снижен или отсутствует. Рвота возникает сразу после еды, но возможно ее появление и на голодный желудок (слизью).
Ребенок жалуется на боли в животе. На обезвоживание организма указывают характерные признаки:
- сонливость, вялость, заторможенное состояние;
- плач без слез;
- сухость губ и ротовой полости;
- дряблость кожных покровов;
- отказ от питья;
- рвота сразу после употребления жидкости.
Ротавирусная инфекция у взрослых
Как правило, у взрослых заболевание протекает без значительного повышения температуры, выраженной рвоты или поноса.
Больной отмечает слабость, отсутствие аппетита, но возможно и бессимптомное течение заболевания.
При тяжелом течении ротавирусной инфекции наблюдается:
- выраженная интоксикация;
- резкая слабость;
- адинамия;
- апатия;
- сниженное артериальное давление вследствие развития сердечно-сосудистой недостаточности:
- уменьшение количества выделяемой мочи, в которой выявляется белок и патологический осадок;
- стул водянистый, более 16 раз в сутки;
- рвота многократная.
Следует отличать ротавирусную инфекцию от пищевых токсикоинфекций, холеры, сальмонеллеза, иерсиниоза. Для этого проводится дифференциальная диагностика.
Диагноз ставится на основании клинических данных при положительных результатах лабораторных анализов.
В обязательном порядке делается копрограмма. При инфицировании ротавирусом в фекалиях обнаруживают антиген ротавирусной инфекции.
Также сдается кровь на общий анализ. В сыворотке крови находят антитела (но только после выздоровления).
По оценкам экспертов ВОЗ, практически каждый ребенок в течение первых пяти лет жизни переносит ротавирусный гастроэнтерит, независимо от расы и социально-экономического статуса. Ежегодно ротавирусы вызывают в мире более 137 млн случаев острого гастроэнтерита, из которых до 592 000 заканчивается летально. В России в настоящее время заболеваемость ротавирусной инфекцией постоянно растет, что обусловлено как увеличением случаев инфицированности, так и улучшением диагностики данной патологии.
Эпидемиология. Общепризнанно, что источником инфекции является только человек (больной манифестной формой или вирусовыделитель), в фекалиях содержится огромное количество вирусов (до 1010-1011 вирусных частиц в 1 г). Ротавирусы млекопитающих и птиц в естественных условиях для человека не патогенны. Фекально-оральный механизм передачи реализуется пищевым (молоко, молочные продукты, заменители грудного молока), водным и контактно-бытовым путями. Дискутируется возможность аэрозольного пути передачи. Ротавирусная инфекция (РВИ) может протекать в виде спорадических случаев, групповых заболеваний и массовых вспышек. Спорадические заболевания регистрируются в течение всего года, однако большинство больных выявляется в зимне-весенний период, в отличие от летне-осеннего, характерного для других кишечных инфекций. По нашим данным, 63,9% случаев ротавирусного гастроэнтерита приходилось на зимне-весенний период, 25,8% регистрировались осенью и 10,3% - летом.
Естественная восприимчивость к РВИ очень высокая. Наибольшее число заболевших отмечается среди детей в возрасте от 6 до 18 месяцев, и в первую очередь находящихся на искусственном вскармливании. По нашим наблюдениям дети младше 3 лет составляют 70-80% заболевших. Инфекция регистрируется также и у новорожденных, но не всегда сопровождается у них клиническими проявлениями. Иммунитет после перенесенной инфекции непродолжительный и сероспецифичный.
Патогенез. В последние годы большое внимание уделяется изучению патогенеза РВИ. Установлено, что после попадания ротавирусов в организм в первые сутки он обнаруживается в эпителиоцитах двенадцатиперстной и в верхнем отделе тонкой кишки. Инфицирование ротавирусом зависит от ряда причин: состояния pH желудочного сока (кислая среда губительна для ротавируса), наличия ингибитора трипсина (трипсин является активатором репродукции вируса), количества функционально незрелых энтероцитов. Ротавирусы поражают "зрелый" эпителий микроворсинок, в щеточной каемке которого находятся дисахаридазы, возможно поражение до 2/3 слизистой оболочки тонкой кишки. Проникновение внутрь клетки вызывает повреждение цитоскелета эпителиоцитов и их отторжение. Одновременно ускоряется продвижение эпителиальных клеток от основания крипты к верхушке микроворсинки, появляется пул низкодифференцированных клеток, являющихся функционально незрелыми, что приводит к нарушению выработки дисахаридаз и накоплению избыточного количества негидролизованных углеводов, преимущественно лактозы в просвете кишки. Не всосавшиеся вещества с высокой осмотической активностью, оказавшись в просвете кишки, приводят к нарушению реабсорбции воды, электролитов и развитию водянистой диареи. Поступая в толстую кишку, эти вещества становятся субстратами для ферментации кишечной микрофлорой с образованием большого количества органических кислот, водорода, углекислого газа, воды. Результатом являются повышенное газообразование в кишечнике и снижение рН кишечного содержимого.
Диагностика. Для подтверждения РВИ используются вирусологические, молекулярно-генетические, серологические методы. Материалом для исследования служат фекалии, рвотные массы, сыворотка крови. Исследования, направленные на обнаружение вируса или вирусных антигенов, желательно проводить в 14-е сутки болезни. Существуют экспресс-тесты для выявления антигенаротавируса в фекалиях на основе иммунохроматографического метода (рота-тест). Для обнаружения генетического материала ротавируса в фекалиях все более широко применяется метод диагностики с помощью ПЦР. В специализированных лабораториях хорошие результаты получены при морфологической идентификации ротавируса с помощью электронной или иммунной микроскопии, или электрофореза в полиакриламидном геле. Наиболее распространенным способом диагностики является обнаружение антигенов ротавируса в фекалиях с помощью ИФА, для этих целей также может использоваться реакция латекс-агглютинации, реакция иммунофлюоресценции, реакция твердофазной коаагглютинации, реакция преципитации. Серологическая диагностика РВИ имеет вспомогательное значение.
Терапия. Основой лечебных мероприятий при ротавирусном гастроэнтерите является патогенетическая терапия. Она включает диетотерапию, оральную регидратацию, инфузионную и дезинтоксикационную терапию. Используются энтеросорбенты (Смекта, Фильтрум-СТИ и др.), пробиотики (Энтерол, Бифиформ, Линекс, Аципол, Ацилакт, Бифидумбактерин форте, Бактисубтил и др.), пребиотики (Дюфалак, Хилак форте), ферменты (панкреатические: Креон, Панцитрат, Панкреатин, Мезим форте; Лактаза). Проводится посиндромная терапия: спазмолитическая, жаропонижающая и т.д.
В настоящее время активно изучается эффективность использования противовирусных препаратов при РВИ. По нашим данным, назначение в острый период заболевания индукторов интерферона (таких как Циклоферон или Анаферон детский) способствует сокращению сроков клинических проявлений РВИ и быстрой санации макроорганизма от вируса. Применение препарата Кипферон оказывает стимулирующее влияние на системный и местный антителогенез, приводит к повышению концентрации интерферонов. В качестве этиотропных средств могут быть использованы Арбидол, Виферон, Комплексный иммуноглобулиновый препарат, Гепон или антиротавирусный иммуноглобулин.
В очаге заболевания проводится комплекс мероприятий, направленных на предупреждение инфекционных заболеваний с фекально-оральным механизмом передачи.
Профилактика. С 1998 года в США у детей с 6-недельного возраста использовалась ротавирусная генноинженерная вакцина RRV-TV, созданная на основе ротавируса штамма макаки-резуса, реассортированного с четырьмя человеческими штаммами. Однако оказалось, что это приводит к повышению частоты инвагинации кишечника (в 1,6 раза), что послужило причиной запрета применения данной вакцины. В настоящее время за рубежом и в нашей стране проходят третью (завершающую) фазу клинические испытания живых аттенуированных вакцин из рекомбинантных штаммов ротавирусов человека и животных для вакцинации детей начиная с 3-месячного возраста.
1 Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89
2 Самарская городская клиническая больница №2 имени Н.А. Семашко; 443008, Россия, Самара, ул. Калинина, д. 32
Резюме
Введение. Ротавирусная инфекция является ведущей причиной острых гастроэнтеритов у детей раннего возраста. В связи с отсутствием этиотропного лечения вирусных гастроэнтеритов интерес ученых и практических врачей к использованию противовирусных препаратов возрастает. В исследованиях отечественных авторов доказано, что низкомолекулярный индуктор интерферона (меглюмина акридонацетат) обладает противовирусной, иммунорегуляторной и противовоспалительной активностью.
Цель исследования. Оценить эффективность и безопасность противовирусного препарата меглюмина акридонацетата при лечении острого гастроэнтерита ротавирусной этиологии у детей 4-7 лет в условиях стационара.
Материалы и методы. Проведен проспективный анализ случаев лечения ротавирусного гастроэнтерита средней тяжести препаратом меглюмином акридонацетатом у детей дошкольного возраста (п = 29, 1-я группа). Группу сравнения составили пациенты, получавшие стандартную терапию (п = 31, 2-я группа). Наличие ротавирусной инфекции подтверждено обнаружением антигена возбудителя в кале. Препарат меглюмина акридонацетат назначался по схеме через день парентерально.
Результаты и обсуждение. Эффективность терапии противовирусным препаратом на 3-и сутки лечения ротавирусного гастроэнтерита средней тяжести составила 79,3% (р < 0,05). Ликвидация основных клинических симптомов заболевания отмечалась на 2-е-3-и сутки: наблюдалось снижение интоксикации, лихорадки, достоверное уменьшение продолжительности рвоты и диареи (р < 0,05), сокращение периода элиминации возбудителя на 2,67 суток (р < 0,01). У всех пациентов переносимость препарата была хорошей, побочные и нежелательные эффекты выявлены не были.
Выводы. Препарат меглюмина акридонацетат может быть рекомендован для комплексного лечения ротавирусной инфекции средней тяжести с первых дней заболевания.
Ключевые слова: дети, острый гастроэнтерит, ротавирусная инфекция, меглюмина акридонацетат, проспективный анализ
Experience with the use of the drug cycloferon in the treatment of rotaviral infection in children
Olga V. Borisova 1 , Nataliya M. Bochkareva 1 , Nataliya S. Polezhaeva 1 , Tamara A. Zhilyakovа 2 , Nataliya G. Tsaryova 1 , Ekaterina V. Berdnikova 1
1 Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia
2 Semashko Samara City Clinical Hospital No. 2; 32, Kalinin St., Samara, 443008, Russia
Abstract
Introduction. Rotavirus infection is the leading cause of acute gastroenteritis in young children. Due to the lack of etiotropic treatment of viral gastroenteritis, the interest of scientists and practitioners in the use of antiviral drugs is increasing. Studies of domestic authors have proven that the low molecular weight interferon inductor - meglumine acridonacetate has antiviral, immunoregulatory and anti-inflammatory activity.
Aim. Evaluation of the efficacy and safety of the antiviral drug meglumine acridonacenate in the treatment of acute gastroenteritis of rotavirus etiology in children aged 4-7 years in a hospital setting.
Materials and methods. A prospective analysis of cases of treatment with meglumine acridonacetate for moderately severe rotavirus gastroenteritis in preschool children (n = 29, group I) was carried out. The comparison group consisted of patients receiving standard therapy (n = 31, group II). The presence of rotavirus infection was confirmed by the detection of the pathogen antigen in the feces. Meglumine acridonacetate was prescribed according to the scheme, parenterally, every other day.
Results and discussion. The effectiveness of therapy with an antiviral drug on the 3 rd day of treatment of moderately severe rotavirus gastroenteritis was 79.3% (p < 0.05). The elimination of the main clinical symptoms of the disease was noted on days 2-3: a decrease in the symptoms of intoxication, fever, a significant decrease in the duration of vomiting and diarrhea (p < 0.05), a reduction in the pathogen elimination period by 2.67 days (p < 0.01), meglumine acridonacetate was well tolerated, no side effects of the drug were detected.
Conclusions. Meglumine acridonacetate can be recommended for the complex treatment of moderate rotavirus infection from the first days of the disease.
Keywords: children, acute gastroenteritis, rotavirus infection, meglumine acridonacetate, prospective analysis
Ротавирус вызывает диарейный синдром вследствие двух реализуемых механизмов: осмотической диареи, которая развивается из-за мальабсорбции (вторична по отношению к повреждению и гибели энтероцитов или снижению абсорбционной функции эпителия) и секреторной диареи, появляющейся из-за эффектов неструктурного белка энтеротоксина NSP4 и активации кальций-зависимых хлоридных каналов [4]. Восприимчивость к ротавирусной инфекции моделируется как иммунологическими, так и не иммунологическими факторами (дифференциальная экспрессия ротавирусных рецепторов в кишечнике, состав желудочного сока и др.) [5].
Ротавирусы распознаются рецепторами (PRR) в энтероцитах или в клетках иммунной системы, в т. ч. в макрофагах, дендритных клетках или в адаптивных В-клетках и Т-клетках. Вирус избегает воздействия направленных на него факторов врожденного иммунитета, синтезируя антагонист интерферонов - NSP1-протеин, - который воздействует на клеточные белки, необходимые для продукции IFN, а также ингибирует активацию STAT1, который вызывает транскрипцию IFN-стимулированных генов (ISG) и повышает продукцию IFN [3, 6, 7]. Таким образом, ротавирус блокирует ответы IFN I и III типов (рис. 1).

Рисунок 1. Ротавирус-опосредованное ингибирование индукции и амплификации интерферона [3]
Figure 1. Rotavirus-mediated inhibition of interferon induction and amplification [3]
Индукторы интерферона - это семейство природных и синтетических соединений, стимулирующих пролиферацию и дифференцировку клеток костного мозга с использованием механизмов врожденного и адаптивного иммунитетов [8]. Представителем низкомолекулярных индукторов IFN является Циклоферон (меглюмина акридонаце-тат), противовирусная активность которого связана с выработкой эндогенного интерферона и прямым воздействием на репликацию вируса. Препарат обладает иммунорегуляторной активностью вследствие активации IFN-γ и противовоспалительной активностью: он оказывает ингибирующее влияние на синтез провоспалительных цитокинов IL-1, IL-8, TNF-a. Кроме этого, Циклоферон активирует гуморальный и клеточный ответы, фагоцитоз, усиливает функциональную активность нейтрофильных гранулоцитов, способствует выработке всех трех типов интерферона - I, II, III (альфа-, бета-, гамма-интерферон и лямбда-интерферон) [8, 9]. Эндогенная интерферонизация (использование индукторов интерферона) имеет преимущества перед введением экзогенного IFN. При введении Циклоферона синтезируется собственный IFN, который не обладает антигенной активностью.
В Российской Федерации проводятся многочисленные исследования, посвященные эффективности использования индукторов интерферона в лечении острых респираторных вирусных инфекций. Так, Мазина Н.К. и др. в исследовании, проведенном в 2017 г., проанализировали 531 публикацию по оценке клинической эффективности Циклоферона при вирусных инфекциях органов дыхания и иммунодефицитных состояниях у детей и взрослых [10]. Однако известно не так много исследований применения препарата при кишечных инфекциях вирусной этиологии. Согласно данным научной работы Романцова М.Г. и др., осуществленной в 2010 г., Циклоферон в таблетках чаще назначается при ОРВИ (в 62,5% случаев) и герпесвирусных инфекциях (в 32% случаев), тогда как его применение при кишечных инфекциях составляет лишь 13,6% [8].Ученые Смоленского государственного медицинского университета изучили эффективность препарата у пациентов с хроническим эрозивным гастритом, ассоциированным с Helicobacter pylori, и герпесвирусной инфекцией [11]. Применение Циклоферона на фоне эрадикационной терапии позволяет сократить частоту обострений заболевания и увеличить срок ремиссии.
Гордеец А.В. и др. в 2007 г. провели плацебо-контролируемые исследования больных ротавирусной инфекцией, которые получали препарат Циклоферон (86 детей) и плацебо (22 ребенка). Авторы выявили высокую эффективность Циклоферона: основные симптомы заболевания (рвота, диарея, лихорадка) исчезали на 1,5-2 дня раньше по сравнению с группой контроля. Отмечено повышение продукции IL-2 до 60 кг/мл, что в 6 раз выше по сравнению с пациентами, получающими плацебо (10 кг/мл). Исследователи рекомендуют использовать препарат с первых дней заболевания в комплексной терапии ротавирусной инфекции [12].
Романцовым М.Г. и Тихомировой О.В. показана зависимость течения кишечных инфекций вирусной этиологии от интенсивности антительного ответа и индукции IFN-a, что является основанием применения Циклоферона в комплексной терапии кишечных инфекций [13]. Исследователями доказано, что использование препарата привело к сокращению продолжительности основных клинических проявлений ротавирусной инфекции (лихорадка, интоксикация, катаральные явления, диарея и др.). У пациентов, получавших препарат, отмечено снижение ротавирусного антигена в 7,1 раза на фоне стимуляции противовирусных антител, которые увеличились в 2,9 раза [13].
Таким образом, основываясь на данные научных исследований вышеуказанных авторов, при лечении ротавирусной инфекции Циклофероном значимое улучшение симптомов заболевания наступает на 2-й-3-й день терапии, отмечается также эффективность и хорошая переносимость лекарственного средства.
Целью нашего исследования является оценка эффективности и безопасности препарата Циклоферон при лечении ротавирусной инфекции у детей 4-7 лет.
Материалы и методы
Проведено проспективное исследование на базе инфекционного отделения Самарской городской клинической больницы №2 имени Н.А. Семашко (клиническая база кафедры детских инфекций Самарского государственного медицинского университета). В исследование вошли 60 детей, средний возраст которых составил 5,8 лет [4,2; 6,7], по половому составу преобладали мальчики (58,3%). У всех детей было диагностировано среднетяжелое течение ротавирусной инфекции. Пациенты были разделены на две группы:
1- я группа - дети с ротавирусной инфекцией (п = 29), которые получали Циклоферон (меглюмина акридонаце-тат) в инъекциях в дополнение к стандартной терапии [13]. В соответствии с инструкцией по использованию препарата детям были назначены инъекции 1 раз в сутки через день в дозировке 10 мг/кг;
2- я группа - дети с ротавирусной инфекцией (п = 31), получавшие стандартную терапию [14].
Критерии включения пациентов в исследование были следующими: наличие ротавирусной инфекции, подтвержденной обнаружением антигенов ротавируса в кале больных до начала терапии; отсутствие других вирусных и бактериальных агентов, поражающих желудочно-кишечный тракт; среднетяжелая форма заболевания; поступление в стационар не позднее 1-2 суток от начала заболевания. Критерии исключения: пациенты с легкими и тяжелыми формами ротавирусной инфекции; дети с иммунодефицитами и отягощенным преморбид-ным фоном (аллергические заболевания, дисбиотические проявления).
Всем пациентам проводились такие лабораторные исследования, как общеклинический анализ крови и мочи, биохимическое исследование крови, бактериологическое исследование кала на кишечную группу бактерий. Обнаружение антигенов ротавируса в образцах кала проведено методом иммунохроматографии с помощью набора 360 R Ротавирус (H&R Rotavirus, Испания). Методом иммунохроматографии исключали вирусную микст-инфекцию: адено-, астро- и норовирусы.
Протокол исследования был утвержден этическим комитетом Самарского государственного медицинского университета. Также было получено информированное письменное согласие законных представителей обследованных детей.
Статистическая обработка числового материала проводилась с использованием статистического пакета Statistica 7.0 (StatSoft, США). Для оценки различий показателей применялся U-критерий Манна-Уитни. Результаты считались статистически значимыми при р < 0,05.
Результаты и обсуждение
Диагноз ротавирусной инфекции устанавливался на основании характерных клинико-эпидемиологических данных: зимний/зимне-весенний сезон, локальность семейных очагов, наличие гастроэнтерита, рвоты, предшествующей им диареи или всех симптомов одновременно, у части детей присутствовали катаральные проявления. У всех пациентов заболевание началось с остро или умеренно выраженных симптомов интоксикации: дети поступали в стационар с жалобами на вялость, снижение аппетита, боль в животе, рвоту и диарею. У всех обследованных детей была среднетяжелая форма заболевания. Тяжелая форма болезни, осложненная токсикозом с эксикозом, чаще регистрировалась у детей в возрасте до 3 лет. Основные клинические симптомы при госпитализации детей представлены на рис. 2.
Рисунок 2. Основные клинические симптомы у детей с ротавирусной инфекцией
Figure 2. The main clinical symptoms in children with rotavirus infection
Всем пациентам была назначена стандартная базисная терапия: оральная или по показаниям парентеральная регидратация, диета, сорбенты (смектит диоктаэдрический - 1-2 пакетика в сутки), ферменты (креон, мезим форте, панкреатин), антипиретики (при лихорадке >38,5 о С рекомендовано применять литическую смесь или парацетамол в возрастных дозировках внутрь). В лечении всех изученных пациентов не использовались противовирусные препараты и пробиотики. В дополнение к вышеуказанной терапии пациентам 1-й группы был назначен Циклоферон в инъекциях через день. Средняя продолжительность клинических симптомов ротавирусной инфекции у детей в зависимости от терапии представлена в табл. 1.
Таблица 1.
Table 1.
Продолжительность основных симптомов ротавирусной инфекции в зависимости от проводимой терапии
The duration of the main symptoms of rotavirus infection, depending on the therapy
Основные клинические симптомы/синдромы
Средняя продолжительность (сутки)
Рисунок 3. Элиминация ротавируса у пациентов обеих групп
Figure 3. Elimination of rotavirus in patients of both groups
Согласно нашим данным, элиминация возбудителя (прекращение выделения антигена ротавируса в кале) у пациентов, получающих Циклоферон в дополнение к стандартной терапии, отмечалась на 2,67 дня раньше (р < 0,01). Следовательно, эффективность лечения была достигнута на 3-й день терапии Циклофероном и составила 79,3% (отношение шансов (ОШ): 0,22 (0,05-0,72), р < 0,05).
Безопасность препарата оценивалась по следующим критериям: переносимость и возникновение побочных реакций. Согласно проведенному исследованию Цикло-ферон обладает хорошей переносимостью, побочных нежелательных эффектов препарата выявлено не было.
Клинический случай
Мальчик, 6 лет, заболел остро: повышение температуры до 37,6 °С, двукратная рвота, на 2-е сутки болезни появился жидкий водянистый стул до 10-12 раз в день. При лихорадке в 38,5 о С машиной скорой помощи ребенок был доставлен в инфекционный стационар. В семье были больны еще двое детей-школьников. При объективном осмотре состояние пациента было средней тяжести: кожные покровы чистые бледные, губы сухие, слизистые ротоглотки гиперемированы. Живот умеренно вздут, отмечалась умеренная болезненность при пальпации. Печень и селезенка не увеличены. Обильный пенистый водянистый стул без видимых патологических примесей, с кислым запахом. Мочился достаточно. В общем анализе крови воспалительные изменения не обнаружены, СОЭ -10 мм/ч. Изменения копрограммы соответствовали поражению тонкого кишечника: наблюдалось умеренное количество непереваренной клетчатки, нейтрального жира и мышечных волокон. В кале обнаружен антиген ротавируса. В связи с этим был поставлен диагноз - ротавирусный гастроэнтерит средней тяжести.
Пациенту было назначено следующее лечение: диета, оральная регидратация, Циклоферон в дозе 10 мг/кг через день в/м, диоктаэдрический смектит, креон, литическая смесь при температуре выше 38,5 °С.
После 6-8 ч проводимой терапии состояние ребенка улучшилось: температура понизилась до 37,2 °С, рвота прекратилась, улучшился стул (3 раза в день, разжиженный, необильный). На 2-е сутки лечения наблюдалась нормализация температуры, стул - 2 раза в день, кашицеобразный. На 3-и сутки прекратилась диарея, температура тела имела нормальные показатели, восстановился аппетит, гиперемия ротоглотки не была выявлена.
Таким образом, использование Циклоферона привело к купированию основных симптомов болезни на 3-й день. Уже на 4-е сутки отмечалось полное выздоровление ребенка. Побочных эффектов при приеме препарата не было выявлено. Препарат Циклоферон доказал свое противовирусное и иммунорегуляторное действие. Показана его высокая эффективность и безопасность при лечении ротавирусного гастроэнтерита средней тяжести у детей.
Информация об авторах:
Борисова Ольга Вячеславовна, д.м.н., профессор, заведующая кафедрой детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Бочкарева Наталия Михайловна, к.м.н., доцент, доцент кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Полежаева Наталья Сергеевна, к.м.н., доцент, доцент кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Жилякова Тамара Анатольевна, ассистент кафедры детских инфекций, заведующая инфекционным отделением, Самарская городская клиническая больница №2 имени Н.А. Семашко; 443008, Россия, Самара, ул. Калинина, д. 32.
Царёва Наталия Герасимовна, ассистент кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Бердникова Екатерина Викторовна, аспирант кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Information about the authors:
Olga V. Borisova, Dr. Sci. (Med.), Professor, Head of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Nataliya M. Bochkareva, Cand. Sci. (Med.), Associate Professor of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Nataliya S. Polezhaeva, Cand. Sci. (Med.), Associate Professor of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Tamara A. Zhilyakovа, Assistant of the Department of Children’s Infections, Head of the Department of Infectious Diseases, N.A. Semashko Samara City Clinical Hospital No. 2; 32, Kalinin St., Samara, 443008, Russia.
Nataliya G. Tsareva, Assistant of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Ekaterina V. Berdnikova, Postgraduate Student of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Список литературы / References
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо).
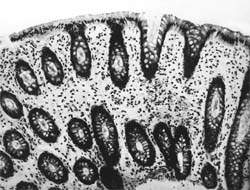 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
Методы диагностики ротавирусной инфекции
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
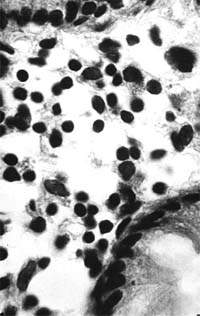 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
По данным экспертов ВОЗ, практически каждый ребенок до 5 лет переносит ротавирусную инфекцию (РВИ). Ежегодно в мире регистрируется до 25 млн случаев ротавирусной диареи, из них 3% заканчиваются летальным исходом. В России в год регистрируется около 300 тыс. ротавирусных гастроэнтеритов. В эпидемический период до 80% острых кишечных инфекций (ОКИ) приходится на РВИ, которая регистрируется в виде спорадических заболеваний или вспышек в семье и детских коллективах. Наиболее высокая восприимчивость у детей до 5 лет, и она обусловлена анатомо-физиологическими особенностями органов желудочно-кишечного тракта, незрелостью как специфических, так и неспецифических факторов иммунной защиты. Максимальная заболеваемость РВИ приходится на зимне-весенний период.
В типичных случаях клиническая картина РВИ характеризуется острым началом, лихорадкой, гастроэнтеритом, развитием токсикоза с эксикозом на фоне осмотической диареи, вторичной дисахаридазной недостаточностью. Практически у всех детей отмечаются изменения в микрофлоре кишечника (снижение индигенной флоры, рост условно-патогенной флоры), что существенно усугубляет клиническую симптоматику и элиминацию ротавирусов из кишечника.
В лечении больных РВИ используются принципы комплексной терапии, включающие диету и применение препарата Лактаза Бэби, этиотропные средства, патогенетические средства (энтеросорбенты, пероральная и инфузионная регидратация, пробиотики, ферменты). В современных условиях длительное использование одних и тех же этиотропных средств, долговременное использование одних и тех же пробиотиков и ферментов приводит к снижению их эффективности. Поэтому оправдан поиск эффективных препаратов, позволяющих сократить сроки элиминации вируса, избежать развития осложнений и возможных побочных действий.
Цель исследования — изучение клинико-эпидемиологических особенностей РВИ у детей в современных условиях и оценка эффективности проводимой терапии.
Материалы и методы
Из 1386 больных, поступивших в 2011 г. в ДИБ № 3 г. Санкт-Петербурга с диагнозом ОКИ неуточненной этиологии (ОКИНЭ), у 241 ребенка (17,4%) подтверждена РВИ.
Обнаружение ротавирусных антигенов группы А проводилось с помощью иммуноферментного анализа (ИФА) однократно в образцах стула, собранного в первые сутки с момента поступления ребенка в стационар. Для расшифровки диагноза проводилось бактериологическое исследование фекалий у всех детей на предмет энтеропатогенов (Shigella spp., Salmonella spp., патогенные Escherichia coli, Yersinia spp., Campylobacter spp.) и оппортунистических бактерий (Gram-negative bacteria, staphylococci). Подтверждение условно-патогенной этиологии заболевания осуществляли дважды — при поступлении и через 15 дней после выписки из стационара. Также в стандарт обследования входили исследования с дизентерийным, сальмонеллезным и иерсиниозным эритроцитарными антигенными диагностикумами в РНГА с целью обнаружения специфических антител в динамике заболевания. Потеря воды со стулом свыше 10 мл/кг массы тела в сутки расценивалась как диарейный синдром. Тяжесть дегидратации определяли клинически.
В день поступления в стационар всем больным назначалась базисная терапия, которая включала: диету (низколактозная и Лактаза Бэби — для детей на грудном вскармливании); оральную регидратацию; по показаниям инфузионную терапию (глюкозосолевыми растворами); этиотропные средства (интерфероны, противоротавирусный иммуноглобулин); энтеросорбенты; ферменты; пробиотики.
40 больным с РВИ проводилась пробиотическая терапия. В зависимости от применения пробиотика все дети были разделены на две группы.
Первая группа — основная (20 детей) получала пробиотик Примадофилус Детский, содержащий Bifidobacterium infantis, B. longum, Lactobacillus rhamnosus, L. acidophilus. Данный препарат не содержит лактозу, может назначаться с рождения, устойчив к антибиотикам, содержит пребиотик мальтодекстрин. Препарат назначался в дозе: детям от одного мес до одного года — 0,5 чайной ложки, от одного года до пяти лет — 1 чайная ложка 1 раз в день до еды в условиях стационара и после выписки из клиники общей продолжительностью 16–18 дней.
Вторая группа — группа сравнения (20 детей) получала пробиотики (Лактобактерин — 5 детей, Линекс — 5 детей, Бифиформ — 10 детей) в возрастной дозировке, в условиях стационара и после выписки из клиники общей продолжительностью 16–18 дней. Группы были репрезентативны по полу, возрасту, срокам поступления в стационар, преморбидному фону, тяжести заболевания, базисной терапии.
Возрастной состав групп: от одного мес до одного года — 42,5%, от одного года до трех лет — 42,5%, от трех до пяти лет 25%. Из 40 больных: мальчиков — 62,5%, девочек — 37,5%. Госпитализированы в первые сутки от начала заболевания — 67,5%, во вторые сутки — 15%, на третьи сутки и позже — 17,5%.
Преморбидный фон у 80% детей был отягощен ранним переходом на искусственное вскармливание, недоношенностью, перинатальной энцефалопатией, анемией, дисбактериозом кишечника, дискинезией желчевыводящих путей. Все 40 детей поступили в стационар в среднетяжелом состоянии с умеренно выраженными симптомами интоксикации (беспокойство, слабость, вялость, снижение аппетита и др.), развитием токсикоза с эксикозом I ст. у 65%, II ст. — у 35%. Начальными проявлениями РВИ было повышение температуры. У всех больных отмечались признаки поражения ЖКТ, включающие срыгивания, рвоту, болевой синдром, метеоризм, диарею. Рвота отмечалась у 85%, с частотой от одного до 3 раз/сут — у 35,3%, от 4 до 10 раз/сут — у 64,7%. Нелокализованные абдоминальные боли отмечались у половины больных, явления метеоризма — у 77,5%. Одновременно или через несколько часов после рвоты у всех больных появлялся жидкий обильный водянистый стул: с частотой до 5 раз/сут — у 35%; от 6 до 10 раз/сут — у 57,5%; свыше 10 раз/сут — у 7,5% детей. Патологические примеси в стуле (слизь, зелень) визуально определялись у 65%, у трети их них наблюдались прожилки крови. У всех больных в копроцитограмме отмечались различной степени выраженности нарушения: жирные кислоты, нейтральный жир, крахмал, клетчатка, йодофильная флора, свидетельствующие о развитии синдрома избыточного бактериального роста (СИБР). У 65% детей, наряду с признаками нарушения переваривания и всасывания в копроцитограмме, определялся колитический синдром (лейкоциты и эритроциты). У всех детей с РВИ в посевах кала на условно-патогенную микрофлору (УПМ) выявлено снижение роста полноценной кишечной палочки и активация Е. coli с измененными свойствами. У 80% высевалась УПМ (Staphylococcus aureus, Proteus mirabilis, P. vulgaris, P. rettgeri, Klebsiella pneumoniae, K. oxytoca, Citrobacter freundii, Enterobacter cloacae), превышающая допустимые концентрации в 1,5–2 раза. У 30% одновременно высевалось несколько возбудителей.
Результаты исследования, обсуждение и заключение
Из поступивших в стационар 1386 детей с диареей ротавирусный антиген обнаружен у 17,4%. Пик регистрации детей с ротавирусной диареей приходился на март-апрель, составляя соответственно 27,4% и 15,4%. В летние месяцы РВИ встречалась с частотой от 2,9% до 5,4%. С декабря отмечался сезонный подъем РВИ (8,7%). Наиболее часто ротавирусы выявлялись в фекалиях детей в возрасте от одного мес до двух лет, составляя в сумме 66,3%, с возрастным пиком от одного года до двух лет (43,1%). Результаты клинико-лабораторного исследования позволили установить моно-РВИ у 47,9% и микст-РВИ у 52,1% детей. Структура микст-ротавирусной диареи была следующей: у 44,2% детей обнаружена УПМ, у 27,9% — энтеропатогенный эшерихиоз (ЭПЭ), у 15,5% — сальмонеллы, у 12,4% — шигеллы.
У детей в возрасте до одного года моно-РВИ диагностирована у 12,1% детей, микст-РВИ у 87,9%. В большинстве случаев была выявлена УПМ — 59,7%, ЭПЭ — 25,9%, сальмонелла — 13,8%. Среди УПМ наиболее часто выделялись стафилококки, клебсиеллы, протей, цитробактер, синегнойная палочка. У детей в возрасте от одного года до двух лет также был выявлен высокий процент микст-инфекции (72,2%), но УПМ выделялись реже — 29,2%, шигеллы — 29,8%, сальмонеллы — 39,5% и только ЭПЭ — 1,5%. Среди детей старше двух лет моноинфекция встречалась у большинства больных (85,3%), микст-инфекция — у 14,7%. Ассоциантами были, как правило, шигеллы и ЭПЭ.
Клинические проявления моно-РВИ во всех возрастных группах характеризовались острым началом. Повышение температуры отмечалось у 93,7% больных, в большинстве случаев лихорадка была в пределах 38–39 °C (52,7% детей) общей продолжительностью 2–3 дня, только у 5,4% детей лихорадка сохранялась до 8–10 дней.
Постоянным признаком РВИ была рвота или срыгивание, наблюдаемые у всех больных. Ведущим симптомом заболевания, отмечавшимся у всех больных, была диарея. Характер стула — частый, обильный, водянистый, желтого цвета, пенистый, с резким запахом и незначительной примесью зелени. Кратность стула до 5 раз в сутки отмечена у 41,1%, от 6 до 10 раз — у 53,6%, более 10 раз — у 5,4%. Длительность диареи в среднем составила 4–6 дней у 73,2%. Боли в животе умеренные, без четкой локализации, метеоризм, урчание по ходу кишечника отмечены у половины больных.
В группе детей (20 чел.), получающих Примадофилус Детский, достоверные различия выявлены в динамике диарейного синдрома. Продолжительность диареи в основной группе, получающей Примадофилус Детский, составила 4,1 ± 1,2 дня, в группе сравнения — 5,6 ± 1,0 дня (Р ≤ 0,05). Одновременно с нормализацией частоты и характера стула у больных, получавших Примадофилус Детский, быстрее исчезали патологические примеси в стуле (слизь, зелень, примесь крови), что свидетельствовало о положительном влиянии препарата на процессы репарации кишечника. При изучении количественного содержания УПМ установлено, что в обеих группах по окончанию применения пробиотиков у больных повышалось количество ПКП до нормы и уменьшалось количество E. coli с измененными свойствами. В основной группе, получавшей Примадофилус Детский, у всех больных имело место достоверное снижение УПМ, а у 7 (41%) отмечалась полная санация от УПФ. В группе сравнения по окончанию курса лечения пробиотиками у 12 из 15 больных была отмечена тенденция к снижению количества УПМ, однако у 8 больных (53,3%) возбудители S. aureus, P. mirabilis, P. vulgaris, Kl. pneumoniae выделялись повторно в диагностически значимых концентрациях.
Заключение
За период проведенных исследований в стационаре ДИБ № 3 из 1386 больных с диагнозом ОКИНЭ у 241 (17,4%) верифицирована РВИ. Заболевание протекало в виде моно- и микст-РВИ преимущественно в среднетяжелой форме с возрастным пиком от одного года до двух лет.
Включение в комплексную терапию среднетяжелых форм РВИ у детей синбиотика Примадофилус Детский, в сравнении с применением других пробиотиков (Линекс, Бифиформ, Лактобактерин), способствовало более быстрому купированию диарейного синдрома и нормализации копроцитограммы. Препарат имеет высокие органолептические свойства, хорошо переносится больными, не дает побочных эффектов. Примадофилус Детский обладает более высоким санирующим эффектом в отношении УПМ (стафилококков, клебсиелл, энтеробактеров, цитробактеров, протея), у 41% отмечалась полная санация, что согласуется с литературными данными.
Литература
- Мазанкова Л. Н., Рыбалко Г. А. Профилактика ротавирусной инфекции у детей // Актуальные вопросы инфекционной патологии и вакцинопрофилактики у детей. V конгресс педиатров-инфекционистов России: тезисы. М., 2006. С. 99.
- Кафарская Л. И., Ефимов Б. А., Постникова Е. А. и др. Особенности становления микрофлоры у детей раннего возраста // Детские инфекции. 2006. Т. 5, № 1, с. 6–12.
- Учайкин В. Ф., Новокшонов А. А., Мазанкова Л. Н. и др. Острые кишечные инфекции у детей: пособие для врачей. М., 2005. 36 с.
В. Н. Тимченко, доктор медицинских наук, профессор, академик МАНЭБ
Е. Б. Павлова, кандидат медицинских наук, доцент
М. Д. Субботина, кандидат медицинских наук, доцент
СПбГПМА, Санкт-Петербург
Контактная информация об авторах для переписки: 194100 Санкт-Петербург, ул. Матросова, 5
Читайте также:

