Статистика по гнойно септическим заболеваниям родильниц
Обновлено: 19.04.2024
БИ — больничные инфекции
ВБИ — внутрибольничные инфекции
ГСИ — гнойно-септические инфекции
СГБ — стрептококки группы В
Внутрибольничные инфекции (ВБИ) относятся к числу важнейших проблем современной медицины и здравоохранения, оказывают существенное влияние на качество медицинской помощи родильницам и новорожденным, приводят к потреблению дополнительных ресурсов, создают угрозу здоровью и жизни пациентов акушерских стационаров. В непростых экономических и демографических условиях в современной России эта проблема приобретает особую социальную значимость. Важными факторами, определяющими актуальность данной проблемы в настоящее время, являются повсеместное увеличение частоты абдоминального родоразрешения и связанных с этим послеоперационных осложнений у пациенток с соматической патологией. В структуре ВБИ в акушерских стационарах преобладают гнойно-септические инфекции (ГСИ), из которых 90% приходится на заболевания новорожденных. В 80% случаев тяжелые формы ГСИ развиваются у новорожденных с внутриутробным инфицированием от матерей с хроническими заболеваниями [1, 2].
Учитывая новую терминологию в проблематике ВБИ, ГСИ родильниц и новорожденных следует относить к инфекциям, связанным с оказанием медицинской помощи в акушерском стационаре [2].
В последние 15 лет в России совершенствовалась система эпидемиологического контроля гнойно-септических ВБИ в акушерских стационарах, что нашло отражение в приказах Министерства здравоохранения. Вместе с тем до настоящего времени в России отсутствует научно обоснованная система эпидемиологического надзора и контроля в специализированных родильных домах для пациенток группы высокого риска с экстрагенитальной патологией [3]. Отсутствие исследований по данному направлению не позволяет в полной мере обеспечить высокую эффективность системы контроля ВБИ родильниц и новорожденных в подобных специализированных акушерских стационарах.
Одним из критериев качества оказания медицинской помощи является показатель заболеваемости ВБИ [4]. Актуальность ее определяется слабым знанием специалистов практического здравоохранения реальной заболеваемости ВБИ в стационарах, что обусловлено сложностью учета и недостаточностью проводимых профилактических и противоэпидемических мероприятий, а также наносимым этими заболеваниями значительным экономическим ущербом.
Проблема ВБИ актуальна для здравоохранения всех стран в связи с высоким уровнем заболеваемости и летальности, а также значительным социально-экономическим ущербом, причиняемым ими. Согласно данным отечественных и зарубежных исследователей ВБИ развиваются у 5—20% госпитализированных больных.
Заболеваемость ВБИ в Российской Федерации на протяжении последних лет обнаруживает тенденцию к росту. Причинами этого являются создание крупных больничных комплексов, где концентрируется большое число ослабленных лиц; увеличение числа инвазивных диагностических и лечебных процедур; использование сложного медицинского оборудования, стерилизация которого сопряжена с большими трудностями; формирование больничных штаммов, обладающих устойчивостью к лекарственным препаратам и дезинфицирующим средствам; увеличение в популяции групп повышенного риска: недоношенных детей, больных хроническими заболеваниями; демографические сдвиги в обществе (увеличение удельного веса лиц старших возрастных групп); снижение неспецифических защитных сил организма в связи с неблагоприятными экологическими условиями [5].
ВБИ, возникающие в стационарах, и проблемы, связанные с их ликвидацией и лечением поражаемых ими пациентов, требуют значительного бюджетного финансирования, минимальный экономический ущерб, наносимый ВБИ ежегодно, составляет более 5 млрд рублей [6].
По данным официальной статистики, ежегодно в Российской Федерации регистрируется от 50 до 60 тыс. случаев ВБИ, однако по расчетным данным, эта цифра в 40—50 раз выше. Присоединение ВБИ к основному заболеванию увеличивает в среднем на 6—8 дней продолжительность пребывания пациента в стационаре. Летальность в группе лиц с ВБИ значительно превышает таковую среди аналогичных групп больных без ВБИ.
В России введены учет и регистрация спорадических заболеваний ВБИ по основным нозологическим формам: ГСИ новорожденных, ГСИ родильниц, послеоперационные ГСИ, постинфекционные ГСИ, кишечные инфекции, инфекции мочевых путей и другие инфекционные заболевания [7].
Важность решения проблемы ВБИ обусловливает необходимость проведения в лечебно-профилактических учреждениях комплекса целенаправленных профилактических и противоэпидемических мероприятий, скоординированных в масштабах отдельных регионов и страны в целом.
Поэтому проблема больничных инфекций (БИ) — одна из актуальных в медицине. Это связанно с высоким уровнем ее распространения не только в России, но и во всем мире, а также медико-социальными последствиями и экономическими потерями.
За последние 10 лет число случаев ВБИ в Российской Федерации уменьшилось на 15 088, при этом они преимущественно регистрируются в родовспомогательных учреждениях (47,2%) и хирургических стационарах (21,7%). Заболеваемость ВБИ в Российской Федерации колеблется от 1,7 до 1,2 на 1000 пациентов, т. е. снизилась на 41,2% [9]. Для примера, в Швейцарии этот показатель составляет 117, в Чехии — 163, в Испании — 100, в США — 50. В Европейских странах ВБИ регистрируются у 3—10% пациентов, прошедших через стационары, а в отделениях интенсивной терапии — у 20%. В США ежегодно выявляется 2 млн случаев ВБИ, повышая продолжительность пребывания больных в стационаре на 6 дней, нанося общий ущерб здравоохранению.
Низкая заболеваемость в России объясняется недоучетом ВБИ. Так, практически не регистрируются ВБИ мочеполовой системы, гемоинфекции, пневмонии и другие инфекции дыхательных путей [10].
В последнее время спектр возбудителей ВБИ постоянно расширяется. Помимо бактерий и вирусов все большее значение приобретают грибы, особенно рода Candida, в качестве этиологического фактора повышается роль аспергилл.
Мониторинг лекарственной устойчивости играет важную роль в системе инфекционного контроля. Так, отмечается рост устойчивости возбудителей к антимикробным химиопрепаратам. Мультирезистентность установлена у 79—96% эшерихий, клебсиелл, энтеробактера, протея, псевдомонад. В родовспомогательных учреждениях спектр устойчивости ниже, но 75—100% штаммов устойчивы к наиболее часто применявшимся антибиотикам — пенициллину, ампициллину, карбенициллину и др. [10, 11].
Остается нерешенной проблема защиты медицинского персонала. Увеличение инфицирования населения микобактериями туберкулеза привело к росту числа профессиональных заражений туберкулезом медицинского персонала лечебно-профилактических учреждений.
Сложившаяся ситуация свидетельствует о крайне важной роли микробиологического мониторинга в системе инфекционного контроля. Слежение за этиологической структурой ВБИ, определение видового состава возбудителей, внутривидовое типирование, определение спектра чувствительности к антибиотикам, дезинфицирующим средствам и антисептикам позволят разобраться в сложной эпидемиологической ситуации [7].
Поскольку большинство возбудителей ВБИ относятся к условно-патогенным микроорганизмам, проявляющим свои свойства на фоне снижения неспецифических защитных сил организма, большое значение приобретает определение групп риска среди новорожденных и родильниц.
Группами риска возникновения ВБИ среди родильниц считаются пациентки с хроническими соматическими и инфекционными заболеваниями; с болезнями мочеполовой системы, в том числе кольпитами; с отягощенным акушерско-гинекологическим анамнезом (инфекционные осложнения при предыдущих беременностях, привычное невынашивание и др.); после хирургического родоразрешения, особенно кесарева сечения; с кровотечениями в послеродовом периоде; с анемией [7, 9].
К группам риска возникновения ВБИ среди новорожденных относятся недоношенные, переношенные, родившиеся у матерей с хроническими соматическими и инфекционными заболеваниями или перенесших острое инфекционное заболевание во время беременности, после хирургического родоразрешения, особенно кесарева сечения, дети с врожденными аномалиями развития; с родовой травмой, синдромом дыхательных расстройств, хронической внутриутробной гипоксией и асфиксией в родах, родившиеся у матерей, страдающих алкоголизмом, наркоманией [11]. Дети, относящиеся к группам риска, нуждаются в особо тщательном медицинском наблюдении и назначении препаратов, стимулирующих неспецифические защитные силы организма.
К факторам риска возникновения ВБИ новорожденных и родильниц относятся инвазивные лечебно-диагностические вмешательства (инъекции, трансфузии, катетеризация сосудов, мочевыводящих путей, взятие крови, пункции, эндоскопические исследования), искусственное вскармливание и др. Имееют значение кратность и длительность процедур. При абдоминальном родоразрешении (кесарево сечение) важно учитывать, в экстренном или плановом порядке оно проводится [3, 6, 12].
Факторы риска необходимо учитывать при осуществлении эпидемиологического надзора и проведении мер борьбы с ВБИ. В каждом случае необходимо строго обосновывать целесообразность выполнения тех или иных процедур, особенно инвазивных.
Осложнению эпидемиологической обстановки могут способствовать две группы факторов (предпосылок). Одна из них связана с санитарно-техническим состоянием стационара, другая — с организацией работы и контингентом лиц, поступающих на роды [9, 10, 13, 14].
К первой группе относятся недостаточное материально-техническое оснащение оборудованием, инструментарием, перевязочным материалом, лекарственными средствами; недостаточный набор и площади помещений, перекрест технологических потоков; нарушения в работе приточно-вытяжной вентиляции; аварийные ситуации на водопроводной и канализационной системах, перебой в подаче горячей и холодной воды, нарушения в тепло- и энергоснабжении; перебои в поставке белья, дезинфицирующих средств и т. д.
Вторая группа предпосылок включает перегрузку стационара; нарушение цикличности заполнения палат; несвоевременный перевод новорожденных и родильниц в соответствующие стационары.
При выявлении предпосылок возникновения эпидемиологического неблагополучия больничный эпидемиолог оперативно доводит всю информацию до сведения главного врача родильного дома и центров Госсанэпиднадзора. Принимаются меры по устранению нарушения. Усиливается весь комплекс профилактических и противоэпидемических мероприятий. В ходе оперативного анализа важно своевременно выявить предвестники осложнения эпидемиологической ситуации в стационаре: изменение заболеваемости (рост) ВБИ новорожденных; рост заболеваемости родильниц; рост частоты развития ВБИ после хирургических пособий в родах; изменение в структуре заболеваемости по локализации патологического процесса, появление случаев с множественной локализацией; изменение этиологической структуры заболеваемости, выделение преимущественно одного вида возбудителя; изменение в соотношении легких и тяжелых форм.
Рост числа тяжелых форм свидетельствует, как правило, о существенном недоучете легких форм и (или) возникшем эпидемиологическом неблагополучии: преобладание одной из клинических форм в структуре ВБИ новорожденных или родильниц, появление генерализованных форм; возникновение 2 случаев заболеваний и более, связанных между собой; рост заболеваемости гнойно-воспалительными и другими инфекциями среди медицинского персонала; возрастание числа диагнозов внутриутробной инфекции [14, 15].
Своевременное выявление указанных признаков позволяет оперативно провести необходимые мероприятия для предотвращения дальнейшего осложнения эпидемиологической ситуации.
За последние годы актуально в мире распространение стрептококковой инфекции. Стрептококки группы В (СГБ) вызывают тяжело протекающее заболевание у грудных детей и представляет опасность для определенных групп пациентов (беременных, родильниц и новорожденных) [16, 17]. На основании многочисленных наблюдений установлен ряд факторов, повышающих риск передачи инфекции от матери ребенку во время родов. Это преждевременные роды, длительный безводный период, повышение накануне родов температуры тела, хориоамнионит, бактериурия.
Инфекция СГБ распространена повсеместно. Бактерию обнаруживают у 7—30% беременных (этот показатель наиболее высок у женщин, которые перенесли инфекцию в прошлую беременность). Частота заболевания детей значительно ниже, что обусловлено неодинаковой патогенностью штаммов бактерии, а также защитой плодов и новорожденных материнскими антителами. Инцидентность вызываемых СГБ ранней и поздней формы болезни детей соответственно составляла 2—3 случая на 1000 рожденных живыми детей [16, 18, 19].
Регулярное проведение скрининговых обследований беременных с последующей антибиотикотерапией инфицированных СГБ привело к снижению в Северной Америке и большинстве стран Европы частоты заболевания новорожденных в 10—15 раз, при этом смертность снизилась с 50 до 4—6% (20—30% недоношенных и 1—2% рожденных в срок детей) вследствие совершенствования системы лечения новорожденных [16—21].
Вероятность клинического проявления инфекции и ее летального исхода у новорожденных с низкой массой тела (менее 1,5 кг) значительно возрастает.
Совершенствование методов лабораторной диагностики сделало их основой контроля инфекции, что позволило достичь в ряде стран Европы и Северной Америки значительного снижения частоты развития ранней формы болезни, вызываемой бактерией у новорожденных детей.
Непатогномоничность клинических проявлений инфекции, их отсутствие или слабая выраженность на начальных стадиях болезни не позволяют поставить окончательный диагноз — проявление у пациентов клинических признаков служит основанием для предположения о наличии у них инфекции, отбора и отправки в лабораторию проб для проверки предварительного диагноза [6, 7, 10, 22, 23].
Наличие инфекции у беременных исключают в максимально приближенный к родам срок — на 35—37-й неделе, так как возможны спонтанная элиминация бактерии из организма будущей матери в дородовой период (что делает применение антимикробных препаратов для профилактики заражения детей бесполезным), а также рецидив колонизации родовых путей после кратковременной обработки антибиотиками в отдаленный дородовой период [24].
Показаниями к проведению специфической диагностики инфекции служат плановое обследование беременных; преждевременные (раньше 37 нед) роды или нарушение целостности плодных оболочек; проявление у детей клинических нарушений, вызываемых СГБ; установление этиологии патологий, которые СГБ может вызывать у взрослых людей [24, 25].
Таким образом, анализ выполненных к настоящему времени исследований демонстрирует, что, несмотря на значительное количество обследований беременных и новорожденных в целях определения ВБИ, не разработан комплексный подход к этой проблеме [6, 7, 10, 26].
Мониторинг распространения ВБИ на определенных территориях среди разных групп населения важен в прогностическом отношении и для правильной интерпретации результатов бактериологических исследований. В будущем, когда будет проводиться плановая вакцинация против этой инфекции, значение такой информации возрастет в еще большей степени, поскольку на ее основе будут выбираться для применения вакцины с оптимальным антигенным составом.
Полученные результаты имеют большое практическое значение для оптимизации системы эпидемиологического контроля ВБИ родильниц и новорожденных детей в специализированных акушерских стационарах, где сосредоточены пациентки из группы высокого риска с экстрагенитальной патологией [27—30]. Идентификация особенностей эпидемиологии, групп и факторов, активно влияющих на эпидемический процесс, позволяет обеспечить высокую эффективность системы контроля БИ родильниц и новорожденных в акушерских стационарах данного типа.
Исследование выполняется за счет гранта Российского научного фонда (проект № 15−15−00109).
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Особенностями течения гнойных ВЗОМТ в современных условиях являются следующие:
1. Изменение характера микробного фактора, снижение его роли на последующих этапах воспалительного процесса при возрастании роли системных нарушений. Воспалительный процесс теряет специфичность и поддерживается вторичной, преимущественно условно-патогенной флорой (эпидермальный, сапрофитный стафилококк) в ассоциации с атипичными возбудителями (хламидии, микоплазмы, вирусы генитального герпеса, цитомегаловирусы) или патогенными штаммами с множественной устойчивостью к антибиотикам.
2. Высокая инфицированность девушек возбудителями инфекций, передаваемых половым путем (ИППП), начиная с подросткового возраста. Так, в последние десятилетия отмечается рост распространенности курения, пьянства, наркомании, а также свободных сексуальных отношений среди подростков. Этому способствует снижение роли семьи, многих нравственных ценностей - целомудрия, моногамного брака, не только свободный доступ к порнографической литературе, но и прямая пропаганда свободных сексуальных отношений. Так, по данным диссертационной работы Ю.М. Белой [3], 13,5% девочек-подростков Московской области сексуально активны уже в возрасте 14 лет, к 17-летнему возрасту их число увеличивается до 27,5%, более 1 /3 девочек имели 2 половых партнеров и более. Инфицированность онкогенными штаммами ВПЧ среди сексуально-активных девочек-подростков составляет 50,5%. У всех ВПЧ-позитивных девочек диагностированы другие ИППП: генитальные микоплазмы (16,6%), хламидии (6,6%), трихомонады (13,3%), гонорея (3,3%), цитомегаловирус (23,3%), генитальный герпес (16,6%); 78% опрошенных девочек курят (64% - до 10 сигарет в день, 36% - пачку и более), алкоголь употребляют 59%.
5. Преобладание инфильтративных и некротических форм воспаления, описанных еще К.П. Улезко-Строгановой (1939) как септические, в отсутствие сопряженных с тяжестью заболевания клинических и лабораторных признаков инфекции.
7. Присоединение системных нарушений:
а) тяжелых гемостазиологических нарушений с наличием тромбоза вен матки и магистральных сосудов малого таза у 35,7% больных;
б) иммунных нарушений, которые при длительном течении воспалительного процесса носят более тяжелый характер, связанный с повреждением рецепторного аппарата и присоединением аутоиммунного компонента воспаления: повышенный уровень антител к рецепторам γ-интерферона наблюдается у 81,8% больных, при этом средний уровень их концентрации превышает физиологические показатели в среднем на 71%, отражая тяжесть деструкции (при средней степени превышая физиологическую на 14%, при тяжелой - на 80%). У 65,8% больных определяется повышенный (в среднем от 35 до 85% от физиологических значений) уровень аутоантител к фосфолипидам, ДНК, коллагену, мембранам нейтрофилов, при этом также имеется достоверное сопряжение продукции данных аутоантител и тяжести гнойного воспаления;
Таким образом, течение гнойного процесса (особенно длительное) приводит к выраженным функциональным и морфологическим нарушениям (метаболическим, иммунным, аутоиммунным, гемостазиологическим, гормональным), повреждению рецепторного аппарата и тканей матки.
Тактика ведения
Поскольку гнойное воспаление всегда сопровождается необратимыми морфологическими изменениями, понятно, что тактика ведения таких больных должна быть только активной, консервативно-хирургической с обязательным хирургическим компонентом и последующим полноценным этапом реабилитации для восстановления естественной фертильности или подготовки к вспомогательным репродуктивным технологиям. Это относится как к гинекологическим, так и акушерским больным.
Послеродовой эндометрит – гнойно-воспалительное заболевание слизистой оболочки матки, развивающееся в раннем периоде после родов. При послеродовом эндометрите отмечается лихорадка, интоксикационный синдром, болезненность внизу живота, обильные гноевидные лохии, субинволюция матки. Диагноз послеродового эндометрита основан на клинических данных, подтвержденных результатами УЗИ малого таза, гистероскопии, бакпосева отделяемого матки. Послеродовой эндометрит требует назначения антибактериальной, дезинтоксикационной терапии; выполнения бережного кюретажа, вакуумной аспирации и промывания полости матки.

Общие сведения
Послеродовой эндометрит – форма послеродовой инфекции, характеризующаяся инфекционным воспалением внутренней выстилки матки (эндометрия). После отделения последа внутри матки образуется значительная раневая поверхность, при родоразрешении путем кесарева сечения дополнительно возникает операционная травма матки. Регенерация эндометрия происходит только к концу 5-6 недели после родов. Активация условно-патогенной микрофлоры и проникновение инфекции через поврежденный эндометрий в этот период приводит к возникновению в матке воспалительного процесса. Эндометрит развивается примерно у 7% родильниц, но среди послеродовой гнойно-воспалительной патологии его частота составляет 36–59%. Послеродовой эндометрит может быть острым и хроническим. В большинстве случаев отмечается легкое течение, около 25% случаев заболевания приходится на тяжелую форму с потенциалом генерализации инфекции. Воспалительный процесс обычно распространяется и на мышечный слой матки – миометрий, поэтому в большинстве случаев в гинекологии диагностируется послеродовой метроэндометрит.

Причины послеродового эндометрита
Причиной послеродового эндометрита выступает бактериальная инфекция, чаще всего попадающая в полость матки восходящим путем из нижних отделов половых путей или ЖКТ. В качестве инфекционных агентов в 90% случаев выступают факультативно-патогенные микроорганизмы, часто в виде полимикробных ассоциаций: энтеробактерии (E.coli, Klebsiella pneumoniae, Proteus spp., Enterococcus spp), эпидермальный стафилококк, стрептококки группы A и B, неспорообразующие анаэробы (Bacteroides fragilis, Peptococcus sp., Peptostreptococcus sp., Fusobacterium sp.), гарднерелла. Реже определяются микоплазмы, хламидии, гонококки.
Предпосылкой развития послеродового эндометрита считается снижение иммунной резистентности организма. В поздние сроки беременности и в ранний послеродовый период происходят значительные качественные сдвиги генитальной микрофлоры. Нарушается естественный антагонизм внутри ассоциаций микроорганизмов, обитающих во влагалище. Риск возникновения послеродового эндометрита повышается при наличии у беременной инфекционно-воспалительных заболеваний урогенитального и бронхолегочного тракта, очагов хронической инфекции, эндокринных нарушений, иммунодефицитов, аутоиммунных состояний и анемии. Фоном для снижения иммунитета беременной могут выступать низкий социальный уровень, недостаточное питание, вредные привычки.
Развитию послеродовых инфекционных осложнений способствуют проведенные ранее инструментальные вмешательства на полости матки (выскабливания, аборты), длительная внутриматочная контрацепция; особенности протекания беременности и родов (угроза прерывания, предлежание плаценты, хирургическая коррекция истмико-цервикальной недостаточности), инвазивные диагностические манипуляции (амнио- и кордоцентез, биопсия хориона), поздний разрыв плодных оболочек, длительный безводный промежуток и затяжные роды, хориоамнионит, патологическая кровопотеря, травмы промежности, ручное отделение плаценты, кесарево сечение. Причем, после родов через естественные родовые пути частота эндометрита составляет 1-3 % случаев, после планового оперативного родоразрешения - 5-15 %, после экстренного – более 20 %.
Неадекватное ведение послеродового периода, некомпенсированное восполнение кровопотери, продолжительный постельный режим, замедление инволюции матки, внутриутробная инфекция новорожденного (везикулез, пневмония, сепсис), плохая личная гигиена половых органов также формируют условия для развития инфекционных осложнений после родов.
Симптомы послеродового эндометрита
Послеродовой эндометрит может протекать в легкой, среднетяжелой и тяжелой форме, носить компенсированный, субкомпенсированный и декомпенсированный характер. При легком течении проявления острого послеродового эндометрита развиваются на 5-12 сутки после родоразрешения. Наблюдается озноб, подъем температуры до субфебрильной (до 38°С), учащение пульса до 80-100 уд/мин., болезненность брюшной стенки, умеренные кровяные лохии. Сократительная способность матки немного снижена. Состояние родильниц остается удовлетворительным и в течение 24 ч существенно не ухудшается.
Тяжелому течению заболевания нередко предшествуют хориоамнионит, осложнения родов или оперативное родоразрешение. Тяжелый послеродовой эндометрит возникает сразу на 2-3 сутки после родов. Характерны слабость, головная боль, фебрильный подъем температуры (39°С и выше) с ознобами, тахикардия (100-110 уд/мин.), боли внизу живота и в пояснице, нарушение аппетита и сна. Лохии становятся обильными мутными, кровянисто-гнойными с ихорозным запахом. В течение 24 ч возможна отрицательная динамика общего состояния. Инволюция матки происходит медленно. Послеродовой эндометрит может осложниться эндомиометритом, лимфаденитом и метротромбофлебитом, парезом кишечника, перитонитом, тазовым абсцессом, генерализацией инфекции.
Компенсированный тип эндометрита протекает с кратковременной (до 3 дней) резорбтивной лихорадкой и отсутствием субинволюции матки; субкомпенсированный - на фоне высокой лихорадки и выраженной субинволюции матки, декомпенсированный переходит в тяжелые гнойно-воспалительные осложнения - перитонит, сепсис, септический шок. Возможно протекание послеродового эндометрита в стертой форме со сравнительно поздним началом (5-7 сутки), нечеткой клиникой, затяжным течением, рецидивами и риском генерализации инфекции.
Диагностика послеродового эндометрита
В комплекс диагностики послеродового эндометрита входят анализ течения родов, данные клинической картины, бимануального осмотра, общего анализа крови и мочи, бакпосева отделяемого из полости матки, УЗИ малого таза с допплерографией, гистероскопия.
В общем анализе крови при послеродовом эндометрите обнаруживается лейкоцитоз (при легкой форме - 9–12×109/л, тяжелой - 10–30×109/л); нейтрофильный сдвиг формулы крови влево, подъем СОЭ (до 30–55 мм/ч и даже 55–65 мм/ч). Бакпосев отделяемого матки проводится для определения чувствительности микрофлоры к антибактериальным препаратам. Исследуется кислотно-основное состояние лохий (при эндометрите рН <7), при подозрении на сепсис осуществляется бакпосев крови. Дифференциальную диагностику послеродового эндометрита проводят с послеродовым параметритом, пельвиоперитонитом, метротромбофлебитом, тромбофлебитом вен таза.
Лечение послеродового эндометрита
Лечение послеродового эндометрита носит комплексный характер и включает медикаментозную и немедикаментозную тактику. Пациенткам с острым послеродовым эндометритом показана госпитализация в стационар, постельный режим, холод на низ живота, диета. Основной акцент делается на антибактериальную терапию. Сразу же назначаются антибиотики широкого спектра действия внутривенно (цефалоспорины III поколения), при выявлении чувствительности возбудителя к определенным препаратам – лечение. При легкой и среднетяжелой формах эндометрита достаточно монотерапии антибиотиками, при тяжелой – используются их различные комбинации (клиндамицин+гентамицин, метронидазол+гентамицин). При выраженной интоксикации необходимо назначение дезинтоксикационной инфузионной терапии, гемосорбции, лимфосорбции, плазмафереза.
Для улучшения оттока лохий используется сочетание средств, сокращающих матку (окситоцина) и спазмолитиков (дротаверина). Целесообразно применение антикоагулянтов (гепарина), антигистаминных препаратов, иммуностимуляторов, витаминов (А, C, К, труппы B). После купирования острой фазы хороший лечебный эффект дают физиопроцедуры - лекарственный электрофорез или ультрафонофорез, магнитотерапия, лазеротерапия, диадинамические токи, дарсонвализация и УФО (местно), иглорефлексотерапия.
При наличии остатков инфицированных и некротизированных плодных оболочек или последа необходимо проведение бережного кюретажа или вакуум-аспирации содержимого полости матки, внутриматочного лаважа дезинфицирующими растворами, промывного дренирования. В отсутствие эффекта от интенсивно проводимой терапии (по истечении 7 суток от начала лечения послеродового эндометрита) и сохранении клинико-лабораторных критериев воспаления решается вопрос об удалении матки - гистерэктомии.
Прогноз послеродового эндометрита зависит от степени тяжести заболевания: лечение легкой и среднетяжелой форм заканчивается выздоровлением и сохранением репродуктивной функции; тяжелая декомпенсированная форма может осложниться септическим состоянием, потерей матки, летальным исходом. Предупреждение послеродового эндометрита заключается в контроле микрофлоры влагалища беременных, правильном ведении родов и послеродового периода, профилактической антибиотикотерапии после кесарева сечения.
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
МКБ-10
Общие сведения

Причины
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Патогенез
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Классификация
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
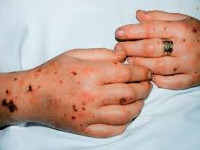
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
Осложнения
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
Диагностика
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
Прогноз и профилактика
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Послеродовые инфекции – группа заболеваний инфекционной этиологии, развивающихся в течение 6-ти недель после родов и непосредственно связанных с ними. Включают в себя локальные раневые инфекции, инфекции органов малого таза, генерализованные септические инфекции. В диагностике послеродовых инфекций первостепенное значение имеет время их развития и связь с родами, картина периферической крови, данные гинекологического осмотра, УЗИ, бактериологического исследования. Лечение послеродовых инфекций включает антибиотикотерапию, иммуностимулирующую и инфузионную терапию, экстракорпоральную детоксикацию, санацию первичного очага и др.
Общие сведения
Послеродовые (пуэрперальные) инфекции - гнойно-воспалительные заболевания, патогенетически обусловленные беременностью и родами. Включают в себя раневые инфекции (послеродовые язвы, эндометрит), инфекции, ограниченные полостью малого таза (метрит, параметрит, сальпингоофорит, пельвиоперитонит, метротромбофлебит и др.), разлитые инфекции (перитонит, прогрессирующий тромбофлебит) и генерализованные инфекции (септический шок, сепсис). Временные рамки, в течение которых могут развиваться данные осложнения - от момента выделения последа до окончания шестой недели послеродового периода. Пуэрперальные заболевания инфекционной этиологии встречаются у 2-10% родильниц. Септические осложнения играют ведущую роль в структуре материнской смертности, что ставит их в ряд приоритетных проблем акушерства и гинекологии.

Причины послеродовых инфекций
Этиологическая структура послеродовых инфекций весьма динамична и вариабельна. Из условно-патогенных микроорганизмов преобладают аэробные бактерии (энтерококки, кишечная палочка, стафилококки, стрептококки группы В, клебсиелла, протей), однако довольно часто встречаются и анаэробы (фузобактерии, бактероиды, пептострептококки, пептококки). Велика значимость специфических возбудителей - хламидий, микоплазм, грибов, гонококков, трихомонад. Особенностью послеродовых инфекций является их полиэтиологичность: более чем в 80% наблюдений высеваются микробные ассоциации, которые обладают большей патогенностью и устойчивостью к антибиотикотерапии.
Риск развития послеродовых инфекций существенно повышен у женщин с патологией беременности (анемия, токсикоз) и родов (раннее отхождение вод, слабая родовая деятельность, пролонгированные роды, кровотечение, задержка частей плаценты, лохиометра и др.), экстрагенитальной патологией (туберкулез, ожирение, сахарный диабет). Эндогенными факторами, предрасполагающими к микробному обсеменению родовых путей, могут служить вульвовагиниты, кольпиты, цервициты, пиелонефрит, тонзиллит, синуситы у родильницы. При инфицировании высоковирулентной флорой либо значительном снижении иммунных механизмов у родильницы инфекция может распространяться за пределы первичного очага гематогенным, лимфогенным, интраканаликулярным, периневральным путем.
Классификация послеродовых инфекций
На основании анатомо-топографического и клинического подхода выделяют 4 этапа прогрессирования послеродовой инфекции (авторы - С. В. Сазонова, А. В. Бартельс).
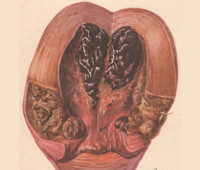
- 1-й этап – местная инфекция, не распространяющаяся за область раневой поверхности (послеродовая язва промежности, влагалища и стенки матки, нагноение швов, нагноение гематом, послеродовой эндометрит)
- 2-й этап – послеродовая инфекция, выходящая за границы раневой поверхности, но ограниченная полостью малого таза (метроэндометрит, аднексит, параметрит, метротромбофлебит, ограниченный тазовый тромбофлебит, пельвиоперитонит)
- 3-й этап – разлитая послеродовая инфекция (перитонит, прогрессирующий тромбофлебит)
- 4-й этап – генерализованная септическая инфекция (сепсис, инфекционно-токсический шок).
В качестве отдельной формы послеродовой инфекции выделяют лактационный мастит. Тяжесть инфекционных осложнений после родов зависит от вирулентности микрофлоры и реактивности макроорганизма, поэтому течение заболеваний варьирует от легких и стертых форм до тяжелых и летальных случаев.
Симптомы послеродовых инфекций
Послеродовая язва образуется в результате инфицирования ссадин, трещин и разрывов кожи промежности, слизистой влагалища и шейки матки. В клинической картине данного послеродового осложнения преобладают местные симптомы, общее состояние обычно не нарушается, температура не превышает субфебрильных цифр. Родильница жалуется на боли в области швов, иногда зуд и дизурические явления. При осмотре родовых путей обнаруживается язва с четкими границами, локальный отек и воспалительная гиперемия. На дне язвы определяется серовато-желтый налет, участки некроза, слизисто-гнойное отделяемое. Язвенный дефект легко кровоточит при контакте.
Послеродовой параметрит развивается на 10–12 день при переходе инфекции на параметрий - околоматочную клетчатку. Типичная клиника включает озноб, фебрильную лихорадку, которая длится 7-10 дней, интоксикацию. Родильницу беспокоят боли в подвздошной области на стороне воспаления, которые постепенно нарастают, иррадиируют в поясницу и крестец. Через несколько дней от начала послеродовой инфекции в области боковой поверхности матки пальпируется болезненный инфильтрат сначала мягковатой, а затем плотной консистенции, спаянный с маткой. Исходами послеродового параметрита может быть рассасывание инфильтрата или его нагноение с формированием абсцесса. Самопроизвольное вскрытие гнойника может произойти во влагалище, мочевой пузырь, матку, прямую кишку, брюшную полость.
Послеродовые тромбофлебиты могут затрагивать поверхностные и глубокие вены. В последнем случае возможно развитие метротромбофлебита, тромбофлебита вен нижних конечностей и вен таза. Обычно проявляются в течение 2-3 недель после родов. Клиническими предвестниками послеродовых осложнений данного типа служат длительная лихорадка; стойкое ступенеобразное учащение пульса; боли в ногах при движении и надавливании на мягкие ткани; отеки в области лодыжек, голени или бедра; цианоз нижних конечностей. На развитие метротромбофлебита указывает тахикардия до 100 уд./мин., субинволюция матки, длительные кровяные выделения, пальпация болезненных тяжей по боковым поверхностям матки. Тромбофлебит вен таза опасен развитием илеофеморального венозного тромбоза и тромбоэмболии легочной артерии.
Послеродовой пельвиоперитонит, или воспаление брюшины малого таза, развивается на 3-4 день после родов. Манифестация острая: температура тела быстро нарастает до 39-40°С, появляются резкие боли внизу живота. Может возникать рвота, метеоризм, болезненная дефекация. Передняя брюшная стенка напряжена, матка увеличена. Послеродовая инфекция разрешается рассасыванием инфильтрата в малом тазу или образованием абсцесса дугласова пространства.
Диагностика послеродовых инфекций
Факторами, указывающими на развитие послеродовых инфекций, служат признаки инфекционно-гнойного воспаления в области родовой раны или органов малого таза, а также общие септические реакции, возникшие в ранний период после родов (до 6-8 недель). Такие осложнения, как послеродовая язва, нагноение швов или гематомы диагностируются на основании визуального осмотра родовых путей. Заподозрить послеродовые инфекции органов малого таза гинекологу позволяет влагалищное исследование. В этих случаях обычно обнаруживается замедленное сокращение матки, ее болезненность, пастозность околоматочного пространства, инфильтраты в малом тазу, мутные зловонные выделения из половых путей.
Дополнительные данные получают при проведении гинекологического УЗИ. В случае подозрения на тромбофлебит показана допплерография органов малого таза, УЗДГ вен нижних конечностей. При послеродовом эндометрите информативна гистероскопия; при гнойном параметрите - пункция заднего свода влагалища. По показаниям применяют лучевые способы диагностики: флебографию, гистерографию, радиоизотопное исследование.
Для всех клинических форм послеродовой инфекции характерно изменение картины периферической крови: значительный лейкоцитоз с нейтрофильным сдвигом влево, резкое увеличение СОЭ. С целью идентификации инфекционных агентов производится бакпосев отделяемого половых путей и содержимого матки. Гистологическое исследование последа может указывать на признаки воспаления и, следовательно, высокую вероятность развития послеродовых инфекций. Важную роль в планировании терапии и оценке тяжести течения осложнений имеет исследование биохимии крови, КЩС, электролитов крови, коагулограммы.
Лечение послеродовых инфекций
Весь комплекс лечебных мероприятий при послеродовых инфекциях делится на местные и общие. Постельный режим и прикладывание льда к животу помогает остановить дальнейшее распространение инфекции из полости таза.
Локальные процедуры включают обработку ран антисептиками, перевязки, мазевые аппликации, снятие швов и раскрытие раны при ее нагноении, удаление некротизированных тканей, местное применение протеолитических ферментов. При послеродовом эндометрите может потребоваться проведение кюретажа или вакуум-аспирации полости матки (при задержке в ней плацентарной ткани и других патологических включений), расширение цервикального канала, аспирационно-промывное дренирование. При формировании абсцесса параметрия производится его вскрытие через влагалище или путем лапаротомии и дренирование околоматочной клетчатки.
Местные мероприятия при послеродовых инфекциях проводятся на фоне интенсивной общей терапии. В первую очередь, подбираются антибактериальные средства, активные в отношении всех выделенных возбудителей (пенициллины широкого спектра действия, цефалоспорины, аминогликозиды и другие), которые вводятся внутримышечно или внутривенно в сочетании в метронидазолом. На время лечения целесообразно прервать грудное вскармливание. С целью дезинтоксикации и устранения водно-солевого дисбаланса используются инфузии коллоидных, белковых, солевых растворов. Возможно проведение экстракорпоральной детоксикации: гемосорбции, лимфосорбции, плазмафереза.
При послеродовых инфекциях стафилококковой этиологии с целью повышения специфической иммунологической реактивности применяется антистафилококковый гамма-глобулин, стафилококковый анатоксин, антистафилококковая плазма. С целью профилактики тромбозов назначают антикоагулянты, тромболитики, антиагреганты под контролем коагулограммы. В комплексе медикаментозной терапии широко используются антигистаминные препараты, витамины, глюкокортикоиды. На этапе реабилитации назначают лазеротерапию, местное УФО, УВЧ-терапию, ультразвук, электростимуляцию матки, бальнеотерапию и другие методы физиотерапевтического воздействия.
В отдельных случаях может потребоваться хирургическая помощь – удаление матки (гистерэктомия) при ее гнойном расплавлении; тромбэктомия, эмболэктомия или флебэктомия - при тромбофлебитах.
Прогноз и профилактика
При раневых инфекциях и инфекциях, ограниченных областью малого таза, прогноз удовлетворительный. Своевременная и адекватная терапия позволяет остановить дальнейшее прогрессирование послеродовых инфекций. Однако в отдаленном периоде прогноз в отношении репродуктивной функции может быть вариабельным. Наиболее тяжелые последствия для здоровья и жизни родильницы влекут за собой разлитой перитонит, сепсис и септический шок.
Профилактика послеродовых инфекций обеспечивается строгим и неукоснительным соблюдением санитарно-гигиенического режима в родовспомогательных учреждениях, правил асептики и антисептики, личной гигиены персонала. Важное значение имеет санация эндогенной инфекции на этапе планирования беременности.
Читайте также:

