Стертая форма инфекции это
Обновлено: 19.04.2024
Дизентерия представляет собой острую кишечную инфекцию, вызываемую бактериями рода Shigella, характеризующуюся преимущественной локализацией патологического процесса в слизистой оболочке толстого кишечника. Дизентерия передается фекально-оральным путем (пищевым или водным). Клинически у больного дизентерией наблюдается диарея, боли в животе, тенезмы, интоксикационный синдром (слабость, разбитость, тошнота). Диагноз дизентерии устанавливают при выделении возбудителя из испражнений пациента, при дизентерии Григорьева-Шиги – из крови. Лечение проводится преимущественно амбулаторно и заключается в регидратации, антибактериальной и дезинтоксикационной терапии.
Общие сведения
Дизентерия представляет собой острую кишечную инфекцию, вызываемую бактериями рода Shigella, характеризующуюся преимущественной локализацией патологического процесса в слизистой оболочке толстого кишечника.
Характеристика возбудителя
Возбудители дизентерии – шигеллы, в настоящее время представлены четырьмя видами (S. dysenteriae, S.flexneri, S. boydii, S. Sonnei), каждый из которых (за исключением шигеллы Зонне) в свою очередь подразделяется на серовары, которых в настоящее время насчитывается более пятидесяти. Популяция S. Sonnei однородна по антигенному составу, но различается по способности продуцировать различные ферменты. Шигеллы – неподвижные грамотрицательные палочки, спор не образуют, хорошо размножатся на питательных средах, во внешней среде обычно малоустойчивы.
Оптимальная температурная среда для шигелл - 37 °С, палочки Зонне способны к размножению при температуре 10-15 °С, могут образовывать колонии в молоке и молочных продуктах, могут длительно сохранять жизнеспособность в воде (как и шигеллы Флекснера), устойчивы к действию антибактериальных средств. Шигеллы быстро погибают при нагревании: мгновенно - при кипячении, через 10 минут - при температуре более 60 градусов.
Резервуаром и источником дизентерии является человек - больной или бессимптомный носитель. Наибольшее эпидемиологическое значение имеют больные с легкой или стертой формой дизентерии, в особенности, имеющие отношение к пищевой промышленности и учреждениям общественного питания. Шигеллы выделяются из организма зараженного человека, начиная с первых дней клинической симптоматики, заразность сохраняется в течение 7-10 дней, после чего следует период реконвалесценции, в который, однако, также не исключено выделение бактерий (иногда может продолжаться несколько недель и месяцев).
Дизентерия Флекснера наиболее склонна к переходу в хроническую форму, наименьшая тенденция к хронизации отмечается при инфекции, вызванной бактериями Зонне. Дизентерия передается с помощью фекально-орального механизма преимущественно пищевым (дизентерия Зонне) или водным (дизентерия Флекснера) путем. При передаче дизентерии Григорьева-Шиги реализуется преимущественно контактно-бытовой путь передачи.
Люди обладают высокой естественной восприимчивостью к инфекции, после перенесения дизентерии формируется нестойкий типоспецифический иммунитет. Переболевшие дизентерией Флекснера могут сохранять постинфекционный иммунитет, предохраняющий от повторного заболевания в течение нескольких лет.
Патогенез дизентерии
Шигеллы попадают с пищей или водой в пищеварительную систему (частично погибая под воздействием кислого содержимого желудка и нормального биоценоза кишечника) и достигают толстой кишки, частично внедряясь в её слизистую оболочку и вызывая воспалительною реакцию. Пораженная шигеллами слизистая склонна к образованию участков эрозий, язв, кровоизлияний. Выделяемые бактериями токсины нарушают пищеварение, а также присутствие шигелл разрушает естественный биобаланс кишечной флоры.
Классификация
В настоящее время применяется клиническая классификация дизентерии. Выделяют ее острую форму (различается по преимущественной симптоматике на типичную колитическую и атипичную гатроэнтеритическую), хроническую дизентерию (рецидивирующую и непрерывную) и бактериовыделение (реконвалесцентное или субклиническое).
Симптомы дизентерии
Острая дизентерия в гастроэнтеритическом варианте характеризуется коротким инкубационным периодом (6-8 часов) и преимущественно энтеральными признаками на фоне общеинтоксикационного синдрома: тошнотой, многократной рвотой. Течение напоминает таковое при сальмонеллезе или токсикоинфекции. Боль при этой форме дизентерии локализуется в эпигастральной области и вокруг пупка, имеет схваткообразный характер, стул жидкий и обильный, патологические примеси отсутствуют, при интенсивной потере жидкости может отмечаться дегидратационный синдром. Симптоматика гастроэнтеритической формы бурная, но кратковременная.
Первоначально гастроэнтероколитическая дизентерия также напоминает по своему течению пищевую токсикоинфекцию, в последующем начинает присоединяться колитическая симптоматика: слизь и кровянистые прожилки в каловых массах. Тяжесть течения гастроэнтероколитической формы определяется выраженностью дегидратации.
Дизентерия стертого течения на сегодняшний день возникает довольно часто. Отмечается дискомфорт, умеренная болезненность в животе, кашицеобразный стул 1-2 раза в день, в основном без примесей, гипертермия и интоксикация отсутствуют (либо крайне незначительна). Дизентерия, продолжающаяся более трех месяцев, признается хронической. В настоящее время случаи хронической дизентерии в развитых странах кране редки. Рецидивирующий вариант представляет собой периодические эпизоды клинической картины острой дизентерии, перемежающиеся периодами ремиссии, когда больные чувствуют себя относительно благополучно.
Непрерывная хроническая дизентерия ведет к развитию тяжелых нарушений пищеварения, органических изменений слизистой оболочки кишечной стенки. Интоксикационная симптоматика при непрерывной хронической дизентерии обычно отсутствует, имеет место постоянная ежедневная диарея, испражнения кашицеобразные, могут иметь зеленоватый оттенок. Хронические нарушения всасывания ведут к снижению массы тела, гиповитаминозам, развитию синдрома мальабсорбции. Реконвалесцентное бактериовыделение обычно наблюдается после перенесения острой инфекции, субклиническое - бывает при перенесении дизентерии в стертой форме.
Осложнения
Осложнения при современном уровне медицинской помощи встречаются крайне редко, преимущественно в случае тяжело протекающей дизентерии Григорьева-Шиги. Эта форма инфекции может осложниться инфекционно-токсическим шоком, перфорацией кишечника, перитонитом. Кроме того, вероятно развитие парезов кишечника.
Дизентерия с интенсивной длительной диареей может осложниться геморроем, анальной трещиной, выпадением прямой кишки. Во многих случаях дизентерия способствует развитию дисбактериоза.
Диагностика
Максимально специфична бактериологическая диагностика. Выделение возбудителя обычно производят из испражнений, а в случае дизентерии Григорьева-Шиги – из крови. Поскольку нарастание титра специфических антител происходит довольно медленно, методы серологической диагностики (РНГА) имеют ретроспективное значение. Все больше в лабораторную практику диагностирования дизентерии входит выявление антигенов шигелл в испражнениях (обычно производят с помощью РКА, РЛА, ИФА и РНГА с антительным диагностикумом), реакция связывания комплимента и агрегатгемаглютинации.
В качестве общих диагностических мер применяют различные лабораторные методики для определения степени тяжести и распространенности процесса, выявления метаболических нарушений. Проводят анализ кала на дисбактериоз и копрограмму. Эндоскопическое исследование (ректороманоскопия) нередко может дать необходимую информацию для дифференциального диагноза в сомнительных случаях. С этой же целью пациентам с дизентерией, в зависимости от ее клинической формы, может понадобиться консультация гастроэнтеролога или проктолога.
Лечение дизентерии
Легкие формы дизентерии лечатся амбулаторно, стационарное лечение показано лицам с тяжело протекающей инфекцией, осложненными формами. Также госпитализируют больных по эпидемиологическим показаниям, в старческом возрасте, имеющих сопутствующие хронические заболевания, и детей первого года жизни. Пациентам назначают постельный режим при лихорадке и интоксикации, диетическое питание (в острый период – диета №4, при стихании диареи – стол №13).
Этиотропная терапия острой дизентерии заключается в назначении 5-7-дневного курса антибактериальных средств (антибиотики фторхинолонового, тетрациклинового ряда, ампициллина, котримоксазола, цефалоспоринов). Антибиотики назначают при тяжелых и среднетяжелых формах. С учетом способности антибактериальных препаратов усугублять дисбактериоз, в комплексе применяют эубиотики курсом в течение 3-4 недель.
При необходимости производится дезинтоксикационная терапия (в зависимости от тяжести дезинтоксикации препараты назначают орально или парентерально). Коррекцию нарушений всасывания производят с помощью ферментных препаратов (панкреатин, липаза, амилаза, протеаза). По показаниям назначают иммуномодуляторы, спазмолитики, вяжущие средства, энтеросорбенты.
Для ускорения регенеративных процессов и улучшения состояния слизистой в период реконвалесценции рекомендованы микроклизмы с настоем эвкалипта и ромашки, маслом шиповника и облепихи, винилина. Хроническая форма дизентерии лечится так же, как и острая, но антибиотикотерапия обычно менее эффективна. Рекомендовано назначение лечебных клизм, физиотерапевтическое лечение, бактериальные средства для восстановления нормальной микрофлоры кишечника.
Прогноз и профилактика
Прогноз преимущественно благоприятный, при своевременном комплексном лечении острых форм дизентерии хронизация процесса крайне редка. В некоторых случаях после перенесения инфекции могут сохраниться остаточные функциональные нарушения работы толстого кишечника (постдизентерийный колит).
Общие меры профилактики дизентерии подразумевают соблюдение санитарно-гигиенических норм в быту, в пищевом производстве и на предприятиях общественного питания, контроль за состоянием водных источников, очистку канализационных отходов (в особенности дезинфекция сточных вод лечебных учреждений).
Больных дизентерией выписывают из стационара не ранее, чем спустя три дня после клинического выздоровления при отрицательном однократном бактериологическом тесте (забор материала для бактериологического исследования производится не ранее 2 дня после окончания лечения). Работники пищевой промышленности и другие лица, приравненные к ним, подлежат выписке после двукратного отрицательного результата бактериологического анализа.
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо).
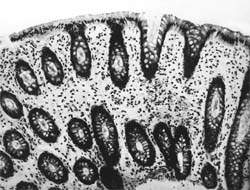 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
Методы диагностики ротавирусной инфекции
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
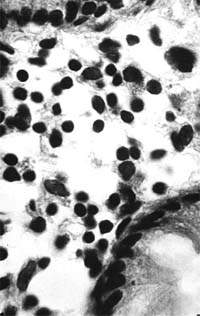 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей? Какие патогенные факторы играют существенную роль? Как вести больных? Респираторные заболевания являются частой причиной обращения к врачу в Великобритании,
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей?
Какие патогенные факторы играют существенную роль?
Как вести больных?
 |
Респираторные заболевания являются частой причиной обращения к врачу в Великобритании, причем в большинстве случаев они относятся к инфекционным [1]. Трем четвертям пациентов, обращающихся с признаками острого заболевания нижних дыхательных путей, врач общей практики назначает антибиотики, хотя лишь в немногих случаях удается выделить возбудителя и антибиотики или вообще не влияют, или мало влияют на естественный ход заболевания [2,3].
Назначая антибиотики, врач руководствуется ожиданиями пациента и старается действовать согласно определенной терапевтической стратегии, хотя зачастую, выписывая рецепт, чувствует, что при этом состоянии антибиотики будут неэффективны [4,5].
Причины, по которым пациент первый раз приходит на прием к своему врачу и затем повторно обращается за консультацией, довольно сложны и часто никак не соотносятся с течением болезни. Как правило, они обусловлены обеспокоенностью своим здоровьем или давлением со стороны друзей, семьи и сотрудников.
При необходимости назначить антибиотик для лечения инфекции нижних дыхательных путей обычно выбирают амоксициллин. Пациенты, повторно обращающиеся к врачу, скорее всего, получат другой антибиотик, например эритромицин или новейшее средство из группы макролидов, хинолонов или пероральный цефалоспорин [3,6].
Проведенные нами недавно исследования показали, что повторное обращение пациентов с инфекциями нижних дыхательных путей, уже получивших назначения на первичном приеме, никак не связано с антибиотикотерапией. Только у 4% таких больных сохранялась бактериальная инфекция и ни у одного из них не было устойчивости к амоксициллину [7]. Повторно приходить на прием побуждают пациентов немедицинские факторы, такие как привычка обращаться к врачу.
Таблица 1. Почему пациенты повторно обращаются к врачу при острой инфекции нижних дыхательных путей
- Пациент неверно представляет себе естественное течение болезни
- Пациент продолжает беспокоиться по поводу симптомов болезни
- Пациенту нравится ходить на прием к врачу
- По настоянию членов семьи, друзей, сотрудников
- У пациента появились соображения, касающиеся важности симптомов
- Инфекция хронизируется или к ней присоединяется другая инфекция
- Проявляется серьезное основное заболевание
При повторном обращении по поводу респираторного заболевания врач общей практики прежде всего должен попытаться установить причину такого обращения (табл. 1). Вполне возможно, что оно вызвано необоснованными ожиданиями пациента, и наилучшим средством здесь было бы объяснение нормальных сроков выздоровления от простуды. Или же есть какое-то основное заболевание, не распознанное на первичной консультации, например астма, недолеченное хроническое обструктивное легочное заболевание, рак или бронхоэктазы.
В том случае если врач считает, что причина в продолжающейся инфекции, необходимо определить возможного возбудителя и выбрать соответствующий антибиотик (табл. 2). Ниже мы обсудим некоторые сложные случаи, которые необходимо иметь в виду [8,9]. Однако нужно помнить, что наиболее распространенными возбудителями остаются Streptоcoccus pneumoniae и респираторные вирусы, а сложные случаи составляют скорее исключение, чем правило в ежедневной общей практике.
Пенициллин-резистентный Streptococcus pneumoniae. Хотя число случаев развития лекарственной устойчивости неуклонно возрастает и представляет серьезную проблему для целого ряда европейских стран, в Англии антибиотикорезистентность пока не считается причиной неудачного лечения инфекций дыхательных путей. Нужно убеждать врачей общей практики проводить пневмококковую вакцинацию населения, входящего в группу риска, а антибиотики назначать строго по показаниям и в адекватной дозе.
Амоксициллин-резистентный Haemophilus influenzae. Haemophilus influenza (Hi) является частой бактериальной причиной обострения хронических обструктивых заболеваний легких (ХОЗЛ), а также вызывает персистирующий бронхит у здоровых взрослых людей. Некоторые антибиотики, такие как эритромицин и цефалоспорины первого поколения, недостаточно эффективны в отношении Hi. Наличие b-лактамазы объясняет отсутствие реакции на амоксициллин. Такие штаммы называются амоксициллин-резистентными Hi (АRHi).
Таблица 2. Возможная причина отсутствия цикла терапии острой инфекции нижних отделов дыхательных путей, назначенной на первом приеме*
Заболеваемость, обусловленная АRHi, растет и составляет сегодня в Великобритании 10-25% общего числа респираторных заболеваний в зависимости от региона. В других странах, таких как Испания, Португалия и некоторые районы Франции, уровень лекарственной устойчивости гораздо выше — это нужно иметь в виду в тех случаях, когда пациент мог заразиться зарубежом.
Об этом возбудителе следует помнить, если у пациента с ХОЗЛ после лечения часто повторяющимися курсами амоксициллина сохраняются симптомы заболевания и гнойная мокрота. В данном случае целесообразным будет недельный курс хинолона или коамоксиклава. От назначения ципрофлоксацина следует воздержаться, если пациент принимает теофиллин.
Moraxella catarrhalis. Некоторым название этого микроорганизма может показаться незнакомым, поскольку раньше его относили к роду Neisseria вида Branhamella.
Это грамотрицательный диплококк, входящий в нормальную микрофлору молодых и пожилых людей. Вслед за Haemophilus influenza и Streptococcus pneumoniae он является третьей по распространенности причиной обострения ХОЗЛ и часто поражает пациентов с тяжелыми хроническими легочными заболеваниями или раком легких.
Обнаружение этого микроорганизма служит показателем тяжести процесса. Сообщалось о недавнем наблюдении 42 случаев пневмонии, вызванной M. catarrhalis, когда около половины пациентов погибло от основного заболевания в течение трех месяцев после обнаружения инфекции.
Важно и то обстоятельство, что практически все штаммы сегодня являются b-лактамазопродуцирующими и соответственно амоксициллинорезистентными. Имеется предположение, что b-лактамаза, продуцируемая M. Catarrhalis, обеспечивает устойчивость к амоксициллину в норме чувствительных респираторных возбудителей, таких как S. pneumoniae и H. influenzae. Проводимая терапия не отличается от той, которая применяется в случаях АРHi (см. выше).
Pseudomonas aeruginosa. Об этом возбудителе нужно помнить в связи с возможностью развития бронхоэктазов и кистозной болезни. Стоит один раз заразиться Pseudomonas aeruginosa, и рецидивы могут следовать один за одним. В настоящее время единственным эффективным пероральным средством является ципрофлоксацин, но к нему быстро развивается устойчивость, и пациентов приходится госпитализировать для проведения внутривенной антибиотикотерапии и физиотерапии.
Другие бактериальные возбудители. Изредка выделяют грамотрицательную кишечную палочку, или Staphylococcus aureus. Эти возбудители чаще связаны с больничными пневмониями, но иногда обнаруживаются у пациентов, недавно выписавшихся из больницы.
Под атипичными обычно подразумеваются инфекции, вызываемые Mycoplasma pneumoniae, Chlamydia psittaci, Chlamydia pneumoniae, Coxiella burnetti и Legionella pneumophila. Лихорадка Q, возбудителем которой служит Coxiella burnetti, встречается редко (как правило, в сельской местности), поэтому не будет упоминаться в дальнейшем. Все атипичные инфекции трудно поддаются распознаванию на ранних стадиях; серологические исследования, проведенные как в острый период, так и в период реконвалесценции, редко дают положительный ответ и не представляют клинической ценности.
Ни один из возбудителей атипичных инфекций не поддается воздействию b-лактамных антибиотиков, что объясняет отсутствие эффекта от назначения амоксициллина.
Mycoplasma pneumoniae. Эпидемия, вызванная этим возбудителем, случается каждые три-четыре года, и в такой период может составлять значительную часть всех респираторных заболеваний.
Обычно она охватывает школьников, студентов и людей среднего возраста; маленькие дети и старики страдают редко.
В отличие от бактериальных инфекций, заболевание начинается постепенно, через 10-14 дней после заражения, проявляясь сухим кашлем или выделением скудной чистой мокроты. Общее недомогание и повышение температуры тела обычно умеренные, при исследовании грудной клетки обнаруживаются незначительные изменения. Иногда такие проявления, как сыпь, буллезный мирингит, а также выявление холодовых агглютининов помогают поставить диагноз.
Микоплазменную инфекцию следует заподозрить, если взрослый человек, до этого не жаловавшийся на здоровье, при отсутствии серьезных патологических симптомов и признаков интоксикации не поддается лечению амоксициллином. В этом случае имеет смысл попробовать назначить антибиотик из группы макролидов; альтернативный подход — тетрациклины. Кашель, как правило, медленно поддается лечению.
Хламидии. Большинствo врачей общей практики время от времени сталкиваются со случаями пситаккоза, вызванного длительным контактом с какой-нибудь любимой домашней птичкой. В последние годы установлено, что наиболее распространенным возбудителем инфекций дыхательных путей является Chlamydia pneumoniae, передающаяся от человека к человеку [10]. Эта инфекция проявляется такими же стертыми симптомами, как и микоплазменная, среди которых выделяются кашель и фарингит. Но, в противоположность микоплазменной инфекции, данное заболевание поражает и пожилых людей, часто вследствие реинфекции.
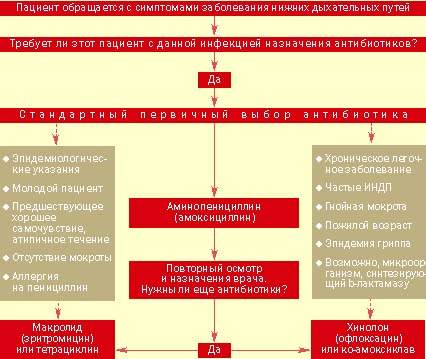 |
| Рисунок 2. Тактика ведения больного с выраженными клиническими показаниями для назначения антибиотиков при остром заболевании нижних дыхательных путей |
В некоторых исследованиях обнаружена связь между Chlamydia pneumoniaе и болезнями коронарных артерий и бронхиальной астмой, возможно обусловленная наличием хламидиального антигена, прикрепляющегося к эндотелию и эпителию. Рекомендуемое лечение — антибиотик из группы макролидов или тетрациклинов.
Legionella pneumophila. Болезнь легионеров все еще находится в центре внимания. Легионелла — редкий возбудитель пневмонии, развивающейся в местах большого скопления людей. Похоже, что легионелла не вызывает такие менее тяжелые заболевания дыхательной системы, как бронхит или инфекции верхних дыхательных путей. Состояние пациентов с болезнью легионеров достаточно тяжелое; обычно им требуется лечение в условиях стационара.
Известна связь этого заболевания с зараженными легионеллами источниками воды, поэтому упоминание пациента о заграничной поездке, пребывании в отеле или больнице, ванне джакузи помогает врачу общей практики правильно поставить диагноз. Нередко встречаются такие осложнения, как дыхательная недостаточность и энцефалит, поэтому все больные, даже в сомнительных случаях, должны быть направлены на госпитальное обследование.
- Практические советы по ведению больных с инфекциями дыхательных путей
Назначение антибиотиков. Подход к ведению больных с острыми инфекциями нижних дыхательных путей представлен на рис. 2. Ключевым моментом является принятие решения о назначении или неназначении антибиотиков. Большинство врачей общей практики считают необходимым применение антибиотиков при серьезных системных нарушениях, постоянном выделении гнойной мокроты, появлении местных признаков поражения легких и отягощенности предшествующими заболеваниями. Если уже решено использовать этот вид лечения, выбор нужного препарата не представляет особого труда.
 |
| Рисунок 3. Пациентам, входящим в группу риска, необходимо провести пневмококковую вакцинацию |
В большинстве случаев назначается амоксициллин. Согласно последним рекомендациям, доза амоксициллина принята равной 500 мг (а не 250 мг, как было раньше), чтобы снизить частоту развития резистентности пневмококков. Однако эта проблема лучше разрешается путем уменьшения общего количества назначений антибиотиков при инфекциях нижних дыхательных путей.
Врач общей практики не должен рекомендовать больному прием антибиотиков просто потому, что это самый легкий способ, или в случае, когда нет четких клинических показаний для их назначения. Проблемы резистентности возбудителей инфекций дыхательных путей решаются при назначении антибиотиков, обусловленном строгими показаниями. Снабжение пациентов простыми информационными листками значительно снижает необходимость повторных консультаций.
Литература
1. Office of Population Censuses and Surveys. Morbidity statistics from general practice: foutrh national study 1992. London: HMSO, 1995 (Series MB5;3).
2. Orr P. H., Scherer K., Macdonald A., Moffatt M. E. Randomosed placebo controlled trials of antibiotics for acute bronchitis: a critical review of the literature. J Fam Pract 1993; 36:507–512.
3. Macfarlane J. T., Holmes W. F., Macfarlane R. M., Lewis S. Contemporary use of antibiotics in 1089 adults presenting with acute lower respiratory tract illness in general practice in the UK: implications for developing managment guidelines. Respiratory Medicine, 1997; 91:427–434.
4. Holmes W. F., Macfarlane J. T., Macfarlane R. M., Lewis S. The influence of antibiotics and other factors on reconsultation for acute lower respiratory tract illness in primary care. Br J Gen Pract (in press).
5. Macfarlane J. T., Holmes W. F., Macfarlane R. M. Acutr lower respiratory tract illness in general practice; a study of the view on 787 patients and their influence on antibiotic prescribing. BMJ, 1997; 315:1211–1214.
6. Macfarlane J. T, Colville A., Guion A., Macfarlane R. M., Rose D. H. Prospective study of aetiology and outcome of adult lower respiratory tract infection in the community. Lancet, 1993; 341:511–514.
7. Macfarlane J., Prewett J., Rose D., Gard P., Guion A., Cunnigham R., Myint S. A prospective, case control study of the aetiology of community acquired lower respiratory tract infections in adult who felt to improve with initial antibiotics. BMJ, 1997; 315:1206–1210.
8. Venkatesan P., Innes J. A. Antibiotic resistance in common acute respiratory pathogenes. Thorax, 1995; 50:481–483.
9. Anon. Lower respiratory tract infections. MeReC Bulletin 1994; 5:5–8.
10. Torres A., ElEbiary M. Relevance of Chlamydia pneumoniae in community acquired respiratory infections. Eur Respir J, 1993; 6:7–8.
11. Macfarlane J. T., Holmes W. F., Macfarlane R. Reducing reconsultations for acute lower respiratory tract illness with an information leaflet. Br J Gen Pract, 1997; 47:710–722.
Персистентные инфекции в легких. Латентная инфекция в легких.
В последнее десятилетие в центре внимания исследователей различного профиля находятся сложные формы воспаления, явно отступающие от общепринятых канонов острых защитных реакций и характеризуемые своеобразными дисбалансами иммуноглобулинов и цитокинов. Эти формы воспаления характерны, прежде всего, для вирусной персистенции. Персистенция (постоянство, упорство) - понятие достаточно широкое и неоднозначное, которое, по современным представлениям, включает в себя несколько подвариантов: персистентная, латентная, хроническая и медленная инфекции, а также бессимптомное вирусоносительство.
Персистентными называют инфекции, при которых вирус либо его антигены в течение продолжительного времени обнаруживаются в организме человека. Указанное пребывание сопровождается определенными специфическими иммунологическими сдвигами. Клинические проявления заболевания могут быть выраженными, слабыми либо маскироваться симптомами общего хронического заболевания (кашель, слабость, субфебрилитет, одышка и т.д.), что нередко наблюдается у больных с хронической обструктивной болезнью легких и бронхиолите с облитерацией при нерсистенции респираторно-синцитиального вируса.
Латентная инфекция - это практически пожизненная инфекция, при которой вирус (чаще герпес) находится в наиболее тесном взаимодействии с геномом клетки и пребывает преимущественно то в дефектной (ДНК-транскрипт), то в полной инфекционной форме, что соответствует ремиссии и обострению. Активация латентной инфекции происходит, как правило, под влиянии других инфекций (чаще грипп), переохлаждения, перегрева, солнечной радиации, психических травм и т.д.
Наиболее типичным примером хронической инфекции является инфекция, вызываемая аденовирусами. Для нее характерна частая смена клинических ремиссий и обострений, но относительно благоприятный прогноз при своевременном и правильном лечении.
Медленная инфекция - имеет неизбежно летальный исход, характеризуется многомесячным или даже многолетним инкубационным периодом с последующим медленным, но неуклонным развитием симптомов заболевания (вирусы СПИД и спонгиозных энцефалитов).
Классификация вирусной персистенции весьма условна. При наличии отличительных свойств многие ее формы имеют общие черты: при всех вариантах весьма распространено формирование дефектных форм вируса, их тесное взаимодействие с геномом клетки-хозяина, чередование фаз обострения и клинической ремиссии. Вероятны переходы одной разновидности персистенция в другую, например персистентной инфекции в латентную или хроническую.
Как показали исследования, проведенные в Государственном научном центре пульмонологии (МЗ РФ), персистенция достаточно широко распространена не только при хронической, но и острой бронхолегочной патологии. При тяжелых полисегментарных пневмониях и острых абсцессах нередко отмечается замедленная элиминация респираторных вирусов и их компонентов из организма больного, что подтверждается и более длительными сроками образования специфических противовирусных иммуноглобулинов класса М и G. Персистенция сопровождается низкими показателями клеточного иммунитета (прежде всего Т-активные клетки), натуральной киллерной активности, всех видов интерферона. Иммуносупрессия, обусловленная вирусами, способствует более выраженной активации бактериальной флоры как аэробного, так и анаэробного плана.
При затяжных и рецидивирующих бронхитах, особенно с явлениями бронхоспазма, вирусы и вирусные компоненты удается обнаружить до 1,5-2 месяцев от начала заболевания. Их элиминация прямо коррелирует с исчезновением признаков воспаления бронхов.
При хронической обструктивной болезни легких и бронхиолите с явлениями облитерации у детей респираторно-синцитиальный вирус чрезвычайно часто выявляется как в период обострения, так и относительной клинической ремиссии.
У больных с ЛОР-патологией: аденоидитами, хроническими тонзиллитами и отитами основным персистирующим агентом является аденовирус. При одновременном наличии аденоидитов и шейных лимфоденитов чаще всего наблюдается ассоциация хронических аденовирусных и микоплазменных инфекций.
Особенности воспалительных реакций организма при вирусной персистенции чрезвычайно разнообразны, весьма вариабельны и зависят от громадного количества факторов, определяемых как макро-, так и микроорганизмами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Бессимптомные инфекции. Абортивная инфекция. Латентная ( скрытая ) инфекция. Инаппарантные инфекции. Дремлющие инфекции. Микробоносительство.
• Абортивная инфекция [от лат. aborto, не вынашивать, в данном контексте — не реализовывать патогенный потенциал] — одна из наиболее распространённых форм бессимптомных поражений. Такие процессы могут возникать при видовой или внутривидовой, естественной либо искусственной невосприимчивости (поэтому человек не болеет многими болезнями других животных). Механизмы невосприимчивости эффективно блокируют жизнедеятельность микроорганизмов, возбудитель не размножается в организме, инфекционный цикл возбудителя прерывается, он погибает и удаляется из макроорганизма.
• Латентная, или скрытая, инфекция [от лат. latentis, спрятанный] — ограниченный процесс с длительной и циклической циркуляцией возбудителя, аналогичной наблюдаемой при явных формах инфекционного процесса. Возбудитель размножается в организме; вызывает развитие защитных реакций, выводится из организма, но никаких клинических проявлений не наблюдают. Подобные состояния также известны как инаппарантные инфекции (от англ. inapparent, неявный, неразличимый). Так, нередко в латентной форме протекают вирусные гепатиты, полиомиелит, герпетические инфекции и т.д. Лица с латентными инфекционными поражениями представляют эпидемическую опасность для окружающих.
• Дремлющие инфекции могут быть разновидностью латентных инфекций или состояниями после перенесённого и клинически выраженного заболевания. Обычно при этом устанавливается клинически не проявляемый баланс между патогенными потенциями возбудителя и защитными системами организма. Однако под влиянием различных факторов, понижающих резистентность (стрессы, переохлаждения, нарушения питания и т.д.), микроорганизмы приобретают возможность оказывать патогенное действие. Таким образом, лица, переносящие дремлющие инфекции, — резервуар и источник патогена.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

