Столбняк материал для микробиологических исследований
Обновлено: 18.04.2024
Оборудование и материалы. Белые мыши с клиническими признаками ботулизма и столбняка, готовые фиксированные мазки из культур С. tetani, С. botulinum, биопрепараты.
Столбняк. Острое инфекционное заболевание животных и человека, вызываемое токсином микроба С. tetani. Характеризуется повышенной возбудимостью и судорожными сокращениями мускулатуры тела, приводящими к асфикции, развивается в результате попадания спор возбудителя в раны. К возбудителю восприимчивы все виды домашних животных, особенно чувствительны лошади. Болезнь может возникнуть после родовых травм, кастрации, обрезания хвостов или пуповины у новорожденных, если при этих операциях были нарушены правила асептики и антисептики.
Возбудитель столбняка - С. tetani, род Clostridium.
Лабораторная диагностика столбняка основана на результатах ^бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методами световой микроскопии и биопробы, выделение чистой культуры и идентификацию возбудителя по культурально-мор-фологическим, биохимическим и токсигенным свойствам.
Материал для исследования. Клиническая картина столбняка характерна, поэтому материал направляют для лабораторного исследования в сомнительных случаях. Им служит раневой экссудат, кусочки ткани из глубоких слоев мест поражения.
Выделение и идентификация культуры возбудителя. С. tetani — строгий анаэроб,
температурный оптимум 37 ºС, рН 7,4. 7,9. Исследование проводят с целью обнаружения токсина и выделения культуры возбудителя для последующего определения ее токсигенности. Чтобы выделить чистую культуру, материал высевают на среду Китта-Тароцци, содержащую 0,5 % глюкозы. Половину посевов (пробирки) прогревают при 80 °С в течение 1 ч.
Через 24 ч на среде Китта-Тароцци возбудитель дает интенсивное помутнение среды с незначительным газообразованием. Через 48. 72ч наступает просветление среды, а на дне пробирки образуется осадок. Для культуры характерен запах жженого рога (вследствие протеолиза белков).
Через 4. 5 сут у полученной культуры определяют токсигенные свойства. При необходимости первичные посевы, содержащие типичные клетки возбудителя, прогревают при 80 ºС 20 мин и делают дробный посев на_глкжозо-кровяной агар в чашках Петри. На кровяном агаре С. tetani образует нежные колонии с отростками и приподнятым центром, иногда мелкие круглые колонии. Некоторые колонии окружены зоной гемолиза (рис. 92).
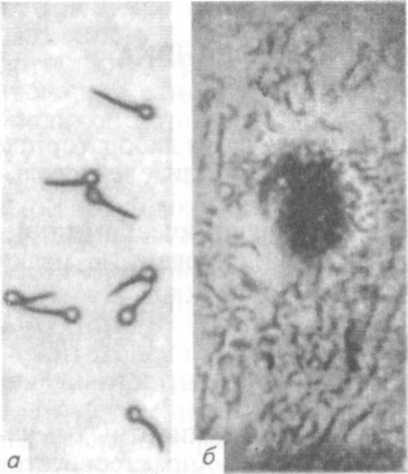
Рис. 92. С. tetani:
а — чистая культура; б — колония
У чистых культур возбудителя исследуют биохимические свойства. С. tetani гидролизует желатину, не образует индол, лецити-назу, расщепляет до кислоты глюкозу, мальтозу, фруктозу, свертывает молоко, образует сероводород.
Биопроба. Метод применяют для обнаружения токсина в исследуемом материале, а также для подтверждения токсигенных свойств выделенной культуры возбудителя. Для обнаружения токсина исследуемый материал растирают в физиологическом растворе, экстрагируют при комнатной температуре 1 ч, фильтруют. Фильтрат вбодят подкожно в заднюю лапку' двум-трем белым мышам по 0,5. 1 мл или двум морским свинкам по З. 5мл. При наличии токсина через 48. 96ч у животных развивается те-таническое сокращение мышц отдельных групп, а затем всей мускулатуры. Животное погибает в позе с вытянутыми лапками и искривлением позвоночника в сторону лапки, в которую вводили материал. При наличии токсина исследования по выделению культуры возбудителя прекращают.
Ботулизм. Это остро текущий кормовой токсикоз, возникающий вследствие поедания кормов, содержащих токсин возбудителя. Заболевание проявляется параличом мышц глотки, языка, нижней челюсти и скелетных мышц. К ботулизму восприимчивы многие виды животных, в том числе птицы, а также люди. Из лабораторных животных — белые мыши и морские свинки.
Возбудитель ботулизма — С. botulinum.
Лабораторная диагностика ботулизма основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии и его токсина методом биопробы, выделение чистой культуры и идентификацию возбудителя по культурально-морфологическим, ферментативным и токсиген-ным свойствам.
Материал для исследования. В лабораторию направляют пробы корма, вызвавшего отравление; от павших животных - содержимое желудка, кишечника, кусочки печени, селезенки; от больных животных — кровь. Материал берут в течение двух часов после гибели животного.
Нативный материал исследуют одновременно на наличие токсинов и возбудителя. Кровь исследуют только на токсин и быстро, на месте, так как токсин в крови быстро разрушается.
Выделение и идентификация культуры возбудителя. Основное направление при лабораторной диагностике ботулизма — обнаружение ботулинического токсина. Выделение чистой культуры с испытанием ее токсигенных свойств проводят только при отрицательных результатах исследований на наличие токсина в материале.
С. botulinum — строгий анаэроб, температурный оптимум 30. 35 °С, рН 7,2. 7,4. Чтобы выделить культуру возбудителя, исследуемый материал высевают в два флакона со средой Китта-Тароцци, один из них прогревают при 80 °С 1 ч, затем оба флакона инкубируют. Рост возбудителя характеризуется постепенным помутнением среды (на 2. 3-й сутки), газообразованием. У культуры отмечают специфический запах прогорклого масла. В культуре обнаруживают типичные для возбудителя клетки бактерий. На 5. 7-е сутки инкубирования испытывают токсигенные свойства культуры (см. биопробу). Для выделения чистой культуры возбудителя первичные посевы прогревают при 80 ºС 1 ч и дробно рассевают на глюкозо-кровяной агар в чашках Петри. Посевы инкубируют в анаэростате. Через 4. 5 сут просматривают посевы. Колонии С. botulinum круглые, с корневидными отростками, бесцветные или сероватые с зоной бета-гемолиза (рис. 93).
У выделенных культур определяют ферментативные свойства. Возбудитель медленно разжижает желатину, пентонизирует молоко, ферментирует до кислоты и газа глюкозу, мальтозу, салицин, глицерин, адонит.
Биопроба. Метод применяют ддя обнаружения токсина в исследуемом материале или для определения токсигенных свойств выделенной культуры возбудителя. С. botulinum продуцирует токсины семи типов: А, В, С, D, Е, F, G. Все семь сероваров экзотоксина иммунологически специфичны, что выявляют в реакции нейтрализации.
При обнаружении в исследуемом материале токсина проводят его идентификацию. Для этого смешивают по 0,2 мл различных антисывороток в одной пробирке (А, В, С, D, Е), добавляют 1 мл экстракта, выдерживают 45 мин при 35. 37 °С и вводят внутрибрюшинно двум белым мышам. Контрольным животным вводят смесь фильтрата с физиологическим раствором. При выживании мышей, зараженных смесью фильтрата и сыворотки, и при гибели контрольных токсин идентифицируют как ботулинический. Этот результат служит достаточным основанием для постановки положительного диагноза на ботулизм. При необходимости определяют тип токсина в РН: смешивают по 2,4 мл фильтрата и 0,6 мл типовых сывороток, выдерживают в термостате и ставят биопробу на мышах, как было описано выше.
Биопрепараты. Столбнячный анатоксин представляет собой фильтрат токсинсодержащей бульонной культуры, инактивированной формалином при 39. 40°С в течение 25. 30 сут. Затем к фильтрату добавляют алюмокалиевые квасцы, концентрируют удалением 80 % надосадочной жидкости и контролируют готовый препарат на стерильность, безвредность и активность иммунизацией морских свинок с последующим заражением 200 ДЛМ токсина.
Вакцину против ботулизма норок готовят из С. botulinum типа С. Бульонную токсинсодержащую культуру инактивируют формалином при 37 ºС в течение 35 сут. В каждой серии вакцины количество анатоксина варьирует, что не позволяет рекомендовать для вакцинации животных одну постоянную дозу вакцины. Поэтому в опыте вакцинации с последующим прямым заражением на мышах рассчитывают ЕД50 препарата (по методу Кербера) и, исходя из полученных данных, определяют рабочую дозу вакцины.
Ботулинические диагностические антитоксические сыворотки предназначены для идентификации ботулинических токсинов в реакции нейтрализации.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Окрасить по Граму мазки из культур возбудителей столбняка и ботулизма, зарисовать микроскопическую картину.
Изучить клиническую картину столбняка и ботулизма (лабораторные животные).
Проанализировать схемы лабораторной диагностики столбняка и ботулизма.
4. Ознакомиться с биопрепаратами.
Каковы морфологические и культуральные признаки возбудителя столбняка?
Каковы особенности бактериологического исследования при столбняке?
3. Какой материал направляют в лабораторию для диагностического исследования при ботулизме?
Исследование на присутствие возбудителя столбняка - С. tetani проводят в следующих случаях:
- для подтверждения клинического диагноза столбняка у больного или умершего;
- для проверки на стерильность перевязочного, шовного материала, изделий медицинского назначения, применяемых для парентерального введения;
- для оценки состояния окружающей среды и эпидзначимых объектов (почва, пыль, воздух в операционных и перевязочных и др.).
Так как клиническая картина столбняка бывает весьма характерна, лабораторная диагностика может служить для подтверждения диагноза чаще всего ретроспективно, поскольку манифестная клиника обычно свидетельствует о далеко зашедшем процессе.
Серологические исследования материала от больных столбняком не имеют диагностического значения.
При типичной клинической картине лабораторная диагностика может не требоваться. Необходимость в ней возникает при спорных и неясных случаях, и когда требуется подтверждение диагноза после операций, абортов, родов на дому без медицинской помощи.
Возбудителем столбняка является Clostridium tetani, прямая палочка длиной 2,4 - 5,0 мкм, диаметром 0,5 - 1,1 мкм, иногда образующая длинные нити. Большинство штаммов подвижны. Споры круглые, располагаются терминально, придавая возбудителю вид булавки или барабанной палочки. Грамположительна, но в старых культурах становится грамотрицательной. Капсулы не образует. Оптимальная температура для роста 37 °С (диапазон роста 14 - 45 °С). На среде Китта-Тароцци рост медленный, с равномерным помутнением и редким газообразованием (с сахоролитическими свойствами не обладает, лишь редкие штаммы ферментируют глюкозу). Культура издает своеобразный неприятный запах выгребной ямы. На кровяном агаре колонии размером 4 - 6 мм, круглые, плоские с неровными краями, полупрозрачные, серые, нередко в виде переплетающихся нитей напоминающих паучков; вокруг колоний - зона гемолиза. В столбике агара колонии в виде комочков ваты. С. tetani обладает слабыми протеолитическими свойствами, медленно гидролизуют желатин, молоко свертывают к 4 - 7 дню в виде мелких хлопьев, затем наступает его пептонизация; не образует индола, восстанавливает нитраты в нитриты.
Главным фактором патогенности С. tetani определяющим патогенез и клинику столбняка, является вырабатываемый им сильнейший экзотоксин. Экзотоксин состоит из двух фракций тетраноспазмина (нейротоксина) и тетополизина (разрушает эритроциты).
Резистентность. Вегетативные формы С. tetani не отличаются особой устойчивостью. При кипячении они разрушаются в течение 5 мин. Напротив, споры С. tetani обладают исключительно высокой резистентностью к различным физическим и химическим воздействиям. Для их разрушения требуется кипячение в течение 1 - 3 часов; автоклавирование при 120 °С они переносят до 40 мин. Споры нечувствительны к низким температурам, к рассеянному солнечному свету. Они практически нечувствительны к химиотерапевтическим препаратам. В высушенном состоянии споры сохраняют жизнеспособность несколько десятков лет, в почве сохраняются длительное время, а при благоприятных условиях могут в ней прорастать и размножаться. Поэтому почва, особенно загрязненная испражнениями животных и человека, является неиссякаемым резервуаром С. tetani и постоянным потенциальным источником заражения людей и животных столбняком.
Возбудитель столбняка распространен повсеместно в почве и других объектах внешней среды, поэтому проблема столбняка имеет глобальное значение. Больной столбняком человек неконтагиозен - передачи возбудителя столбняка от больного не происходит. Основным путем заражения является проникновение возбудителя через поврежденные кожные покровы и слизистые оболочки. Местом входных ворот служат различные раны: огнестрельные, колотые, резаные, занозы, потертости, ожоги, обморожения, травмированные родовые пути (послеродовый или послеабортный столбняк), операционные раны при инфицировании их руками, инструментами или перевязочным материалом. Иногда травмы настолько ничтожные, что входные ворота остаются необнаруженными (криптогенный столбняк). Особенно серьезную глобальную проблему представляет столбняк новорожденных (tetanus neonatorum). Он связан с тем, что в целом ряде развивающихся стран при обработке пуповины применяют такие традиционные методы (при родах на дому), как использование золы, земли, глины, навоза, помета птиц, порошков, приготовленных из различных растительных продуктов и других субстратов, которые часто содержат споры С. tetani. Попадая через пупочный канатик, они и служат причиной столбняка новорожденных. Летальность при этой форме столбняка составляет в среднем 85 % и достигает максимальных значений на 6 - 8 день жизни больного ребенка. По оценке ВОЗ, в 80-х годах XX в. ежегодно в развивающихся странах от столбняка новорожденных умерло более 1 млн. детей, а общее число случаев столбняка в них составляло более 2,5 млн.
4.1. Материал для исследования
Соответственно данным о патогенезе столбнячной инфекции, возбудителя можно обнаружить на месте проникновения в организм. Исследованию подвергают ткани вокруг предполагаемых входных ворот, а также гнойной, перевязочный материал (тампоны), лоскуты одежды, попавшие в рану, и пр. При столбняке у женщин после родов или аборта исследуют выделения из матки, у новорожденных берут выделения из пупка. Гной при большом его количестве (5 - 7 мл.) транспортируют непосредственно в шприце или помещают в стерильную пробирку. Для взятия материала из глубины раны используют стерильные ватные тампоны. Материал для исследования стерильного перевязочного материала и почвы берут как обычно.
При сборе материала от трупа рекомендуется, кроме сказанного, обратить внимание на старые рубцы и воспалительные очаги, а также взять кровь (5 мл) и кусочки печени и селезенки (по 20 г).
4.2. Подготовка проб к исследованию
Микробиологическая диагностика включает в себя следующие 3 этапа:
1) бактериоскопия исходного материала;
2) посев для выделения возбудителя и его идентификации;
3) обнаружение столбнячного токсина.
На первом этапе исследования производят микроскопию нативного материала. Приготовить из растертого материала, а также из гноя и отделяемого ран мазки и окрасить их по Граму. Наличие типичных бацилл с терминальной спорой (барабанные палочки), окрашивающихся по Граму положительно, заставляет настойчиво искать подтверждение бактериологическим методом. Изучение мазка позволяет также ориентироваться в наличии и составе сопутствующей флоры.
Целью второго этапа бактериологического исследования является выделение возбудителя. Для этого собранный для исследования материал, кроме жидкого, переводят в жидкую фазу путем растирания его физиологическим раствором в стерильной фарфоровой ступке. Посев производят в регенерированную среду Китта-Тароцци - в двойное количество пробирок и один ряд пробирок прогревают при 80 °С 20 минут. Эта процедура позволяет избавиться от находящихся в пробе вегетативных форм бактерий и существенно упрощает выделение спорообразующих анаэробов. Исследование гретого и негретого материала в дальнейшем ведут параллельно.
Посевы культивируют при 37 °С. Через 2, 4, 6 и 10 дней приготовляют мазок и микроскопируют после окраски по Граму. Наличие типичных микробов позволяет произвести высев на кровяной агар в чашках (инкубирование в условиях анаэростата) или в высокий столбик агара в пробирках, где наблюдают появление типичных колоний.
На поверхности кровяного агара клостридии столбняка растут в виде нежных прозрачных колоний, похожих на капельки росы, которые быстро распространяются и образуют нежную сетчатую пленку, покрывающую всю чашку и плохо видимую невооруженным глазом. Полезно воспользоваться нейтрализацией гемолизина при помощи антитоксической сыворотки. С этой целью перед посевом половину поверхности агара в чашке смачивают сывороткой, дают подсохнуть и производят посев на всей чашке. Сравнение роста на обеих половинах позволяет обнаружить специфическое угнетение гемолиза на той части чашки, где был нанесен антитоксин (Антитоксическая сыворотка не должна содержать консерванта, который может задержать рост клостридий столбняка).
В пробирки с высоким столбиком агара бульонную культуру высевают из пробирки, которая была предварительно прогрета, чтобы избежать загрязнения аэробами. Для посева агар растапливают и охлаждают до 45 °С. Чтобы получить рост отдельных колоний, посев производят запаянной пастеровской пипеткой, которую смачивают в посевной жидкости, а затем последовательно переносят в 2 - 3 пробирки расплавленного агара, после чего быстро опускают последние в холодную воду, чтобы задержать распространение подвижных клостридий. Через 1 - 2 дня пребывания засеянных пробирок в термостате палочка столбняка вырастает в виде плотных чечевицеобразных колоний или в виде колоний пушинок.
Решающим признаком для диагностики столбняка является обнаружение токсина. Для выявления токсического действия культуры или первичного материала ставят биологический опыт-реакцию нейтрализации на белых мышах. Исходный материал, полученный от больного или трупа, после растирания и посева оставляют в ступке на 1 час для экстрагирования токсина. Экстракт или культуру на жидкой среде фильтруют через ватно-марлевый фильтр. Часть приготовленного фильтрата смешивают с антитоксической сывороткой таким образом, чтобы на каждый мл экстракта приходилось 0,5 мл антитоксической сыворотки, разведенной до содержания 400 АЕ в 1 мл. Двум мышам внутримышечно в бедро задней лапки вводят по 0,5 или по 1 мл фильтрата, а двум - 0,75 или 1,5 мл смеси фильтрата с антитоксином.
Симптомы столбняка развиваются у животных на 2 - 3 сутки в мышцах той стороны, на которой введен токсин (ригидность хвоста, взъерошивание шерсти). Затем быстро наступает паралич, сначала конечностей, а вслед за ними остальных мышц тела. Гибель животного наступает при общем параличе мышц. Мыши погибают в характерной позе, вытянув задние лапки (поза тюленя). У животных, получивших смесь фильтрата с антитоксином, заболевание не наступает. Зараженных животных наблюдают 4 - 5 дней, инкубационный период равен 2 - 4 дням.
Таким образом, наиболее простым и эффективным методом лабораторной диагностики столбняка является биологическая проба на белых мышах.
Перечень нормативно-методической документации:
Возбудитель Clostridium tetani входит в семейство Bacillaceae, род Сlostridium.
Материалом для исследования служит отделяемое раны, кусочки ткани, выделения из влагалища и матки (при наличии столбняка после родов или аборта), выделения из пупочного канатика (при наличии столбняка новорожденных), экссудат, перевязочный и шовный хирургический материал, образцы почвы, воздуха, пыли. В некоторых случаях исследуют слизь из носа, глотки, бронхов, налет с миндалин.
Микробиологическую диагностику столбняка проводят с целью подтверждения клинического диагноза болезни, хотя к этому прибегают нечасто в связи с типичностью клинической картины заболевания.
Чаще всего выявление возбудителя столбняка и его спор проводят для проверки стерильности перевязочного материала, препаратов для парентерального введения, а также для определения распространения спор возбудителя в объектах окружающей среды.
Микробиологическую диагностику столбняка проводят микроскопическим, бактериологическим, биологическим методами.
Микроскопический метод. Из исследуемого материала готовят мазок и окрашивают по Граму. Плотный материал растирают в ступке со стерильным кварцевым песком и физиологическим раствором, делают мазок по общепринятой методике.
Во время микроскопии окрашенного по Граму препарата обнаруживают грамположительные большие прямые палочки с закругленными концами, располагающиеся одиночно, небольшими группами или в виде коротких цепочек. Наличие типичных бацилл в виде барабанных палочек с терминальными круглыми спорами, превышающими толщину бактерии, является показателем к проведению бактериологического метода.
Применяют также фазово-контрастную и люминесцентную микроскопию. Для РИФ мазки на предметных стеклах обрабатывают противостолбнячной флуоресцентной сывороткой и микроскопируют с помощью люминесцентного микроскопа.
Бактериологический метод. Классическим методом выявления возбудителя столбняка и его токсина является выделение чистой культуры C. tetani с последующим подтверждением специфичности токсина. Исследуемый материал, полученный от больного или с трупа, после растирания фильтруют через бумажный фильтр и производят посев в пробирки со средой Китта-Тароцци. Для уничтожения посторонней неспороносной микрофлоры часть исследуемого материала после посева прогревают на водяной бане при температуре 85°С в течение 20 минут.
Из проросшей питательной среды готовят мазок, окрашивают по Граму и микроскопируют. Наличие типичных микробов позволяет сделать посев на чашки с кровяным агаром и в столбик агара в пробирках. Поверхность кровяного агара в одной из чашек смачивают антитоксической сывороткой без консерванта. Посевы помещают в термостат при температуре 37°С и инкубируют в вакууме в течение суток. На кровяном агаре без антитоксической сыворотки вырастают прозрачные колонии в виде капелек росы с зоной гемолиза. На кровяном агаре с антитоксической сывороткой гемолиз не наблюдается (нейтрализация антитоксином).
В глубине столбика агара колонии столбнячных клостридий имеют вид нежных комочков ваты. Из выросших колоний готовят мазок, окрашивают его по Граму и микроскопируют.
Проросший бульон среды Китта-Тароцци исследуют на наличие столбнячного токсина с помощью биологической пробы в реакции нейтрализации. С этой целью фильтрат исследуемой культуры делят на две части. Одна из них, являющаяся фильтратом выделенной культуры микробов, составляет контроль, а другую смешивают с антитоксической противостолбнячной сывороткой и оставляют на 1 час при комнатной температуре (опыт). Белых мышей заражают контрольным и опытным фильтратом полученной культуры. За животными наблюдают 1-2 суток. Контрольные мыши погибают, а опытные остаются живыми.
Наличие столбнячного токсина можно обнаружить с помощью реакции обратной пассивной гемагглютинации с использованием эритроцитарного антительного диагностикума.
Биологический метод. Исследуемый материал эмульгируют в физиологическом растворе, фильтруют и вводят белым мышам по 0,5 мл под кожу или в мышцу у корня хвоста (опытная группа). Контрольным животным вводят фильтрат, смешанный с антитоксической сывороткой.
Возбудитель Clostridium tetani входит в семейство Bacillaceae, род Сlostridium.
Материалом для исследования служит отделяемое раны, кусочки ткани, выделения из влагалища и матки (при наличии столбняка после родов или аборта), выделения из пупочного канатика (при наличии столбняка новорожденных), экссудат, перевязочный и шовный хирургический материал, образцы почвы, воздуха, пыли. В некоторых случаях исследуют слизь из носа, глотки, бронхов, налет с миндалин.
Микробиологическую диагностику столбняка проводят с целью подтверждения клинического диагноза болезни, хотя к этому прибегают нечасто в связи с типичностью клинической картины заболевания.
Чаще всего выявление возбудителя столбняка и его спор проводят для проверки стерильности перевязочного материала, препаратов для парентерального введения, а также для определения распространения спор возбудителя в объектах окружающей среды.
Микробиологическую диагностику столбняка проводят микроскопическим, бактериологическим, биологическим методами.
Микроскопический метод. Из исследуемого материала готовят мазок и окрашивают по Граму. Плотный материал растирают в ступке со стерильным кварцевым песком и физиологическим раствором, делают мазок по общепринятой методике.
Во время микроскопии окрашенного по Граму препарата обнаруживают грамположительные большие прямые палочки с закругленными концами, располагающиеся одиночно, небольшими группами или в виде коротких цепочек. Наличие типичных бацилл в виде барабанных палочек с терминальными круглыми спорами, превышающими толщину бактерии, является показателем к проведению бактериологического метода.
Применяют также фазово-контрастную и люминесцентную микроскопию. Для РИФ мазки на предметных стеклах обрабатывают противостолбнячной флуоресцентной сывороткой и микроскопируют с помощью люминесцентного микроскопа.
Бактериологический метод. Классическим методом выявления возбудителя столбняка и его токсина является выделение чистой культуры C. tetani с последующим подтверждением специфичности токсина. Исследуемый материал, полученный от больного или с трупа, после растирания фильтруют через бумажный фильтр и производят посев в пробирки со средой Китта-Тароцци. Для уничтожения посторонней неспороносной микрофлоры часть исследуемого материала после посева прогревают на водяной бане при температуре 85°С в течение 20 минут.
Из проросшей питательной среды готовят мазок, окрашивают по Граму и микроскопируют. Наличие типичных микробов позволяет сделать посев на чашки с кровяным агаром и в столбик агара в пробирках. Поверхность кровяного агара в одной из чашек смачивают антитоксической сывороткой без консерванта. Посевы помещают в термостат при температуре 37°С и инкубируют в вакууме в течение суток. На кровяном агаре без антитоксической сыворотки вырастают прозрачные колонии в виде капелек росы с зоной гемолиза. На кровяном агаре с антитоксической сывороткой гемолиз не наблюдается (нейтрализация антитоксином).
В глубине столбика агара колонии столбнячных клостридий имеют вид нежных комочков ваты. Из выросших колоний готовят мазок, окрашивают его по Граму и микроскопируют.
Проросший бульон среды Китта-Тароцци исследуют на наличие столбнячного токсина с помощью биологической пробы в реакции нейтрализации. С этой целью фильтрат исследуемой культуры делят на две части. Одна из них, являющаяся фильтратом выделенной культуры микробов, составляет контроль, а другую смешивают с антитоксической противостолбнячной сывороткой и оставляют на 1 час при комнатной температуре (опыт). Белых мышей заражают контрольным и опытным фильтратом полученной культуры. За животными наблюдают 1-2 суток. Контрольные мыши погибают, а опытные остаются живыми.
Наличие столбнячного токсина можно обнаружить с помощью реакции обратной пассивной гемагглютинации с использованием эритроцитарного антительного диагностикума.
Биологический метод. Исследуемый материал эмульгируют в физиологическом растворе, фильтруют и вводят белым мышам по 0,5 мл под кожу или в мышцу у корня хвоста (опытная группа). Контрольным животным вводят фильтрат, смешанный с антитоксической сывороткой.
Читайте также:

