Стрептококк д энтерококк в зеве что это
Обновлено: 19.04.2024
Описание
Представляет собой прозрачную жидкость желтого цвета.
Фармакотерапевтическая группа
Фармакодинамика:
Препарат обладает способностью специфически лизировать бактерии Streptococcus.
Показания:
Лечение и профилактика заболеваний вызванных бактериями Streptococcus в составе комплексной терапии:
- заболевания уха горла носа дыхательных путей и легких (воспаления пазух носа среднего уха ангина фарингит ларингит трахеит бронхит пневмония плеврит);
- хирургические инфекции (нагноения ран ожоги абсцесс флегмона фурункулы карбункулы гидраденит панариции парапроктит мастит бурсит остеомиелит);
- урогенитальные инфекции (уретрит цистит пиелонефрит кольпит эндометрит сальпингоофорит);
- энтеральные инфекции (гастроэнтероколит холецистит) дисбактериоз кишечника;
- генерализованные септические заболевания;
- гнойно-воспалительные заболевания новорождённых (омфалит пиодермия конъюнктивит гастроэнтероколит сепсис и др.);
- другие заболевания вызванные стрептококками.
С профилактической целью препарат используют для обработки послеоперационных и свежеинфицированных ран а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Противопоказания:
Гиперчувствительность к компонентам препарата.
Беременность и лактация:
Применение данного медицинского препарата при беременности и в период кормления грудью возможно при наличии инфекций вызванных фагочувствительными штаммами стрептококков (по рекомендации врача).
Способ применения и дозы:
Препарат используют для приема внутрь (через рот) ректального введения аппликаций орошений введения в полости ран вагины матки носа пазух носа и дренированные полости.
Рекомендуемые дозировки препарата.
ДОЗА НА 1 ПРИЕМ (мл)
от 1 года до 3 лет
от 8 лет и старше
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно так и приемом препарата внутрь в течение 7-20 дней (по клиническим показаниям).
В случае если до применения бактериофага для лечения ран применялись химические антисептики рана должна быть тщательно промыта стерильным 09 % раствором натрия хлорида.
В зависимости от очага инфекции бактериофаг применяют:
- В виде орошения примочек и тампонирования в объеме до 200 мл в зависимости от размеров пораженного участка. При абсцессе после удаления гнойного содержимого с помощью пункции препарат вводят в количестве меньшем чем объем удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
- При введении в полости (плевральную суставную и другие ограниченные полости) до 100 мл оставляют капиллярный дренаж через который бактериофаг вводят в течение нескольких дней.
- При циститах пиелонефритах уретритах препарат принимают внутрь. В случае если полость мочевого пузыря или почечной. лоханки дренированы бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку.
- При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины матки в дозе 5-10 мл ежедневно однократно; при кольпите - по 10 мл орошением или тампонированием 2 раза в день. Тампоны закладывают на 2 часа.
- При гнойно-воспалительных заболеваниях уха горла носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания промывания закапывания введения смоченных турунд (оставляя их на 1 час).
- При энтеральных инфекциях дисбактериозе кишечника препарат принимают внутрь 3 раза в день за 1 ч до приема пищи в течение 7-20 дней по клиническим показаниям. Возможно сочетание двукратного приема внутрь с однократным ректальным введением разовой возрастной дозы бактериофага в виде клизмы после опорожнения кишечника.
Применение бактериофага у детей (до 6 месяцев).
При сепсисе энтероколите новорожденных включая недоношенных детей бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки в дозе 5-10 мл. При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в виде высоких клизм) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалита пиодермии инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или пораженный участок кожи).
Побочные эффекты:
Передозировка:
Симптомы передозировки меры по оказанию помощи при передозировке не установлены.
Взаимодействие:
Применение бактериофага не исключает использования других антибактериальных препаратов.
Особые указания:
Перед использованием флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Внимание! При помутнении препарат не применять!
Вследствие содержания в препарате питательной среды в которой могут развиваться бактерии из окружающей среды вызывая помутнение препарата необходимо при вскрытии флакона соблюдать следующие правила:
- тщательно мыть руки;
- обработать колпачок спиртсодержащим раствором;
- снять колпачок не открывая пробки;
- не класть пробку внутренней поверхностью на стол или другие предметы; не оставлять флакон открытым;
- вскрытый флакон хранить только в холодильнике.
Вскрытие флакона и извлечение необходимого объема препарата может проводиться стерильным шприцем путем прокола пробки.
Препарат из вскрытого флакона при соблюдении условий хранения вышеперечисленных правил и отсутствии помутнения может быть использован в течение всего срока годности.
Влияние на способность управлять трансп. ср. и мех.:
Сведения о возможном влиянии лекарственного препарата на способность управлять транспортными средствами механизмами отсутствуют.
Форма выпуска/дозировка:
Упаковка:
Условия хранения:
Срок годности:
Срок годности 2 года. Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска
Производитель
Акционерное общество "Научно-производственное объединение по медицинским иммунобиологическим препаратам "Микроген" (АО "НПО "Микроген"), 614089, Пермский край, г. Пермь, ул. Братская, д. 177, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
АО "НПО "Микроген"
Бактериофаг стрептококковый - цена, наличие в аптеках
Указана цена, по которой можно купить Бактериофаг стрептококковый в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
Инфекции вызванные оральными стрептококками и энтерококками: диагностика, лечение, профилактика
Метастазирующие абсцессы. Представители группы Streptococcus milleri, состоящей из видов S. constellatus, S. intermedius, S. anginosis, обычно колонизирующих слизистую оболочку полости рта и кишечника.
В то же время (попадая в кровоток) могут вызвать генерализованную инфекцию и быть причиной развития абсцессов головного мозга, лёгких или печени. Стрептококки этой группы часто выделяют в составе патогенной флоры при микст-инфекциях.
Инфекционный эндокардит. Возбудитель — а-гемолитический стрептококк. Инфекция может возникать после стоматологических вмешательств. В связи с отсутствием выраженных симптомов заболевания лицам из группы риска (например, пациентам, которым показаны стоматологические процедуры — удаление зубного камня, экстракция зубов и др.) рекомендовано проведение антибиотикопрофилактики.
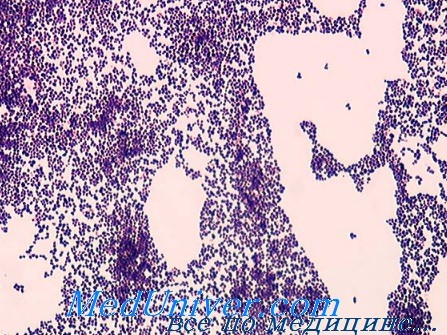
Оральные стрептококки
Энтерококки — представители нормальной микрофлоры кишечника, вызывающие инфекционный процесс только при попадании в другие органы и ткани организма. Возбудители обладают антигеном группы D (полисахаридный антиген клеточной стенки).
Из более чем двенадцати видов возбудителя патогенными для человека считают Enterococcus faecalis и Е. faecium, вызывающих заболевания мочевыводящих путей, раневые инфекции и эндокардит. Некоторые виды энтерококков (например, Е. faecium) играют важную роль в развитии внутрибольничных инфекций и обладают устойчивостью к ряду антибиотиков.
Возбудитель чувствителен к действию ампициллина или амоксициллина, но в последнее время наблюдают повышение его резистентности к этим препаратам. Значительной проблемой стало появление штаммов, устойчивых к гликопептидам. Для лечения инфекций, вызванных ими, применяют линезолид или пристинамицин.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Стрептококковые инфекции вызванные Streptococcus pyogenes: диагностика, лечение, профилактика
Стрептококки — грамположительные кокки, располагающиеся в микропрепарате в виде цепочки или парами. Факультативные анаэробы требовательны к питательным средам. Хорошо растут на средах с большим содержанием крови. Колонии бета-гемолитического стрептококка на кровяном агаре окружены зоной полного гемолиза, а-гемолитического стрептококка — зоной частичного гемолиза.
Дальнейшая идентификация основана на изучении биохимических и серологических (классификация Лэнсфилд) свойств возбудителя. Исследуемый материал — мазок из зева, раневое отделяемое, кровь и др.
Стрептококковые инфекции вызванные Streptococcus pyogenes
Носительство в глотке S. pyogenes протекает бессимптомно примерно у 5—30% населения. Передача инфекции осуществляется посредством аэрозольного и контактного механизмов. Заражение может произойти в любом возрасте, но чаще всего инфекция возникает у детей.
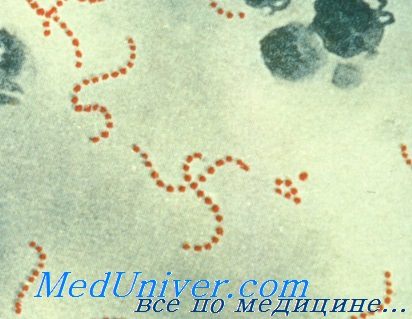
Патогенез стрептококковых инфекций вызванных Streptococcus pyogenes
S. pyogenes имеет углеводный (полисахаридный) группоспецифический антиген А (антиген Лэнсфилд) и группоспецифический белковый М-антиген, и располагающиеся на поверхности микроорганизма М-протеином (антиген), препятствующий лейкоцитарному фагоцитозу.
Антитела к М-протеину и располагающимся на поверхности микроорганизма М-протеину (антиген) формируют устойчивый иммунитет к последующей инфекции, вызванной микроорганизмами с такими же типами М-протеина. Кроме того, S. pyogenes продуцируют несколько токсинов: эритрогенный токсин (вызывает сыпь при скарлатине) и пирогенные экзотоксины А, В и С. Адгезию обеспечивают рецепторы к фибронектину.
Возбудители способны долгое время персистировать внутри клеток эпителия зева, а потому некоторые антибиотики (не проникающие внутриклеточно) не избавляют пациента от носительства.
Клинические признаки стрептококковых инфекций вызванных Streptococcus pyogenes
S. pyogenes входит в число десяти самых смертоносных возбудителей в мире. Он вызывает три вида патологических состояний:
• Инфекционное заболевание. S. pyogenes — самая частая причина развития бактериального фарингита. Кроме того, он вызывает рожу, импетиго, целлюлит, раневые инфекции и реже некротизирующий фасцит и пневмонию. Иногда развивается септицемия, приводящая к метастазирующим инфекциям (остеомиелит). Инфекционный процесс, обусловленный S. pyogenes, характеризуется острым началом с деструкцией поражённых тканей и быстро прогрессирующим течением.
Неотъемлемой частью патогенеза, развивающегося выраженного интоксикационного синдрома, является способность S. pyogenes продуцировать токсины.
• Токсин — индуцированные синдромы, протекающие на фоне инфекционного заболевания. Инфекционное заболевание, связанное с S. pyogenes, может протекать в виде генерализованного процесса или, оставаясь локализованным, сопровождаться системными проявлениями, связанными с действием экзотоксинов.
Например, действие эритрогенного токсина обусловливает возникновение сыпи при скарлатине, а пирогенные токсины становятся причиной стрептококкового шока, часто приводящего к смерти пациента вследствие полиорганной патологии. • Постинфекционные аутоиммунные заболевания. Перекрёстное взаимодействие антител к антигенам бактерии и структурным компонентам собственных тканей организма иногда приводит к развитию аутоиммунных заболеваний: ревматической лихорадке, гломерулонефриту или узловатой эритеме.
Достаточно редкая в странах с развитой рыночной экономикой ревматическая лихорадка — частая причина смерти и инвалидизации населения в регионах с низким уровнем жизни и нищетой.
Профилактика стрептококковых инфекций вызванных Streptococcus pyogenes
Распространение S. pyogenes в хирургических отделениях и родильных домах происходит достаточно быстро. Именно поэтому больных и носителей стрептококковой инфекции нужно немедленно изолировать в отдельные боксы на срок не менее 48 ч от начала проведения эффективной антибиотикотерапии. Своевременное полноценное лечение позволяет избежать развития вторичных аутоиммунных заболеваний (ревматическая лихорадка).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Энтерококки (Enterococcus spp.) как причина раневых инфекций. Факторы патогенности
О патогенности энтерококков впервые упоминается в конце XIX в.: MacCallum и Hastings выделили этот микроорганизм из биоматериала больного острым эндокардитом и дали название Micrococcus zymogenes на основании его ферментативных свойств. Микроорганизм был устойчив к нагреванию до 60 °С, а также к различным антисептикам, включая карболовую кислоту и хлороформ. Также было установлено, что при внутрибрюшинном введении белым мышам этот микроб вызывал летальный исход, в экспериментальных условиях Micrococcus zymogenes был причиной эндокардита.
Спустя столетие энтерококки приобрели существенное значение и заняли 2-е место после Е. coli, составив более 12% всех возбудителей нозокомиальных инфекций (НКИ). В последние го/ты, по данным зарубежных авторов, энтерококки как причина НКИ в клиниках интенсивной терапии занимают 3-е место. Энтерококки по антигенному строению (группоспецифическая тейхоевая кислота) отнесены R. Lancefield в начале 1930-х годов к стрептококкам группы D. Четкие отличия энтерококков от стрептококков по ряду признаков указывают на необходимость выделить энтерококки в самостоятельный род.
Это было подтверждено в 1984 г. в сравнительных исследованиях по гибридизации нуклеиновых кислот, а также анализом иммунотипировапия белкового комплекса энтерококков, в котором не обнаружено родства со стрептококками других серологических групп.
В настоящее время Enterococcus spp. разделяют на пять групп:
Группа I - Е. avium, E. gilvus E. malodoralus, Е. pollens, E.pseudoaxnum, Е. raffinosus, E.saccharolyticus.
Группа II - E.faecalis, E.faecium, Lactococcus spp., E. casseliflavus, E.galUnarum, E. mandtii.
Группа III — E. dispar, E. durans, E. hirae, E. porcinus, E. ratli.
Группа IV - E. asini, E. cecorum, E. sulfureus. Группа V E. columbae, Vagococcus spp.
Энтерококки окрашиваются по Граму положительно, представляют собой кокки, факультативные анаэробы. Enterococcus spp. это часть нормальной микрофлоры слизистых оболочек ЖКТ и половых путей женщин. Некоторые особенности этого микроорганизма обеспечивают ему длительное выживание в условиях окружающей среды. Энтерококки способны активно приспосабливаться к различным неблагоприятным факторам, передаваться в условиях стационара от человека к человеку через руки, инструменты. В литературе описаны случаи, когда источником НКИ оказались мобильные телефоны, стетоскопы, термометры и прочие объекты нозокомиальной среды.
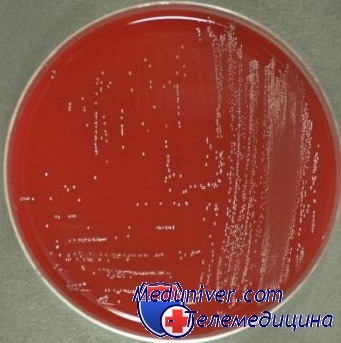
Enterococcus spp. сохраняют жизнеспособность в течение не менее педели на различных поверхностях окружающей среды: на продуктах (например, па сыре — 180 дней), в почве — до 77 дней, на загрязненной одежде до 90 дней; при температуре -70 °С чистая культура энтерококка выживает в течение нескольких лет, на поверхности агара при +4°С -- нескольких месяцев. Энтерококки утрачивают жизнеспособность при автоклавировании при температуре 121 С через 15 мин, при обработке сухим жаром при 160 -170 °С — через час. Эффективные дезинфектанты — 1% гипохлорит, формальдегид, 70% этиловый спирт, 2% глутаральдегид, препараты йода.
Например, резистентность энтерококков к аминогликозидам есть следствие их способности блокировать проникновение препаратов через клеточную стенку. Впрочем, применение аминогликозидов возможно, но в комбинации с препаратами, способными проникать через клеточную стенку микроорганизмов. Следует заметить, что в настоящее время отмечается быстрое распространение штаммов энтерококков с высоким уровнем устойчивости к аминогликозпдам (> 1000 мкг/мл для стрептомицина и >500 мкг/мл для гентамицина), по пока это явление не до конца изучено.
Колонизация слизистых оболочек основное условие развития энтерококковой инфекции. Энтерококки, как уже отмечалось, колонизируют слизистую оболочку ЖКТ у здоровых людей, входя в состав микрофлоры фекалий (103—108 колониеобразующих единиц [КОЕ] в 1 г). Между энтерококками и эпителиальными клетками организма хозяина существует тесная связь, которая препятствует выведению их вследствие естественной подвижности кишечника. Большинство известных микроорганизмов растет в узком диапазоне значений pH, близких к нейтральному. Энтерококки должны преодолеть кислую среду желудка, чтобы попасть в нижние отделы кишечника, что возможно благодаря устойчивости этих микробов к низким значениям pH среды их обитания (pH 3,2-4,8 в течение 15-30 мин).
Прикрепленные бактерии гораздо легче, чем свободноплавающие, образуют кооперативные структуры с другими бактериями. Это особенно важно для развития синтрофной кооперации (вариант кооперации, при которой оба партнера полностью зависят друг от друга в своей жизнедеятельности). В прикрепленных бактериальных сообществах имеются более существенные возможности обмена плазмидами или эписомами. Плазмиды - это специальные внехромосомные генетические элементы, ответственные за внехромосомную передачу резистентности к одному или нескольким антимикробным препаратам. Энтерококки способны прикрепляться к эпителиальным клеткам различных отделов тонкой и толстой кишки, а затем проникать из просвета тонкой кишки через мезентериальные лимфоузлы в печень, селезенку.
Лечение антимикробными препаратами предрасполагает к развитию энтерококковых инфекций. Антибиотик-индуцированный усиленный рост Е. faecalis при соответствующих условиях (например, мукозит, энтеропатия) может привести к проникновению микроорганизма в кровь, что часто проявляется лихорадкой неясной этиологии. Механизм этот до конца не изучен.
Первый активный защитный барьер хозяина представляют различные типы клеток и гуморальных факторов иммунной системы, которые атакуют проникающие микроорганизмы. Фагоциты поглощают и лизируют патогенные микроорганизмы, очищая организм от них. Фагоцитированные микробные клетки оказываются внутри вакуоли (фагосомы), которая сливается с лизосомами и образует фаголизосому, внутри которой микробы подвергаются воздействию бактерицидных механизмов, зависящих и не зависящих от кислорода. В фаголизосоме образуются токсичные формы кислорода (супероксид-анион, пероксид водорода, синглетный кислород и гидроксил-радикал), которые вместе с другими антимикробными соединениями и оксидами азота вызывают гибель микроорганизмов.
Некоторые микробы способны избегать действия бактерицидных механизмов. Одно из предположений состоит в том, что фагоцитированные, но не лизированные тканевыми макрофагами энтерококки проникают через стенку кишки в лимфатическую систему, что приводит к системному распространению этого возбудителя.
E. faecalis отличаемся от Е. faecium мощной продукцией супероксид-аниона. Установлено, что основная часть штаммов Е. faecalis образует супероксид-анион, тогда как среди рода E. faecium такие штаммы встречаются менее часто. Покапано, что штаммы Е. faecalis, выделенные из крови больных, вырабатывают супероксид-анион на 60% больше, чем штаммы, выделенные из фекалий. Пока остается неясным, какую роль играет способность вырабатывать супероксид-анион в патогенезе энтерококковых инфекций. Возможно, штаммы энтерококков, отличающиеся мощной продукцией супероксид-аниона, способны лучше использовать среду своего обитания, лучше физиологически адаптированы к утилизации ограниченных ресурсов кишечника в условиях огромной конкуренции, что ведет к усилению их роста.
Готовность колонизировать слизистые оболочки хозяина, уже заселенные другими микробными сообществами, считают одной из загадок нозокомиальных энтерококковых инфекций. В связи с этим можно считать вполне обоснованным мнение, что активное применение цефалоспоринов III поколения - важный фактор риска колонизации и развития, энтерококковой инфекции в условиях стационара. Эти инфекции часто обусловлены полирезистентными штаммами энтерококков экзогенного происхождения, которые вынуждены конкурировать с эндогенными энтерококками за места обитания в организме хозяина. Показано, что госпитальные штаммы могут вырабатывать поверхностный белок новой структуры, который был обнаружен у 40% штаммов при эндокардитах, у 29% штаммов при бактериемии и у 3% штаммов, выделенных из фекалий. Функция этого белка в биологии Е. faecalis пока неизвестна, по не исключено его значение для колонизации экзогенных штаммов энтерококков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что подразумевают под острым тонзиллитом? Почему при БГСА-тонзиллите необходима антибактериальная терапия? Какие антибактериальные средства выбрать? Острый тонзиллит (ангина) 1 — заболевание, которое характеризуется острым воспалением одного ил
Что подразумевают под острым тонзиллитом?
Почему при БГСА-тонзиллите необходима антибактериальная терапия?
Какие антибактериальные средства выбрать?

Острый тонзиллит (ангина) 1 — заболевание, которое характеризуется острым воспалением одного или нескольких лимфоидных образований глоточного кольца (чаще небных миндалин) и принадлежит к числу широко распространенных инфекций верхних дыхательных путей.
Наиболее значимым бактериальным возбудителем острого тонзиллита является β-гемолитический стрептококк группы А (Streptococcus pyogenes, БГСА). Реже острый тонзиллит вызывают вирусы, стрептококки групп C и G, Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheria (дифтерия), анаэробы и спирохеты (ангина Симановского — Плаута — Венсана), крайне редко — микоплазмы и хламидии.
БГСА передается воздушно-капельным путем. Источниками инфекции являются больные и реже бессимптомные носители. Вероятность заражения увеличивается при высокой степени обсемененности и тесном контакте с больным. Вспышки острого БГСА-тонзиллита чаще всего встречаются в организованных коллективах (в детских дошкольных учреждениях, школах, воинских частях и т. д.). Поражаются преимущественно дети в возрасте 5-15 лет, а также лица молодого трудоспособного возраста. Наибольшая заболеваемость отмечается в зимне-весенний период.
Высокая частота заболевания, контагиозность инфекции, большие трудопотери, влекущие за собой экономический ущерб, возможность развития серьезных осложнений — все это свидетельствует о том, что проблема БГСА-тонзиллита по-прежнему стоит достаточно остро как в научном, так и в практическом аспекте.
Клиническая картина. Инкубационный период при остром БГСА- тонзиллите составляет от нескольких часов до 2-4 дней. Для этого заболевания характерны острое начало с повышением температуры до 37,5–39°С, познабливание или озноб, головная боль, общее недомогание, боль в горле, усиливающаяся при глотании; нередки артралгии и миалгии. У детей могут быть тошнота, рвота, боли в животе. Развернутая клиническая картина наблюдается, как правило, на вторые сутки с момента начала заболевания, когда общие симптомы достигают максимальной выраженности. При осмотре выявляется покраснение небных дужек, язычка, задней стенки глотки. Миндалины гиперемированы, отечны, часто с гнойным налетом желтовато-белого цвета. Налет рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечаются уплотнение, увеличение и болезненность при пальпации шейных лимфатических узлов на уровне угла нижней челюсти (регионарный лимфаденит). В анализах крови — повышенный лейкоцитоз (9-12 10 9 /л), сдвиг лейкоцитарной формулы влево, ускорение СОЭ (иногда до 40-50 мм/ч), появление С-реактивного белка. Длительность периода разгара (без лечения) составляет примерно 5-7 дней. В дальнейшем при отсутствии осложнений основные клинические проявления болезни (лихорадка, симптомы интоксикации, воспалительные изменения в миндалинах) быстро исчезают, нормализуется картина периферической крови. Симптомы регионарного лимфаденита могут сохраняться до 10-12 дней.
Диагноз БГСА-тонзиллита подтверждается микробиологическим исследованием мазка с поверхности миндалин и/или задней стенки глотки. При соблюдении правил техники забора образца чувствительность метода достигает 90 %, а специфичность — 95-99 %. Популярные за рубежом методы экспресс-диагностики А-стрептококкового антигена в мазках из зева дают возможность получить ответ через 15-20 мин. В то же время следует подчеркнуть, что культуральный метод не позволяет дифференцировать активную инфекцию от БГСА-носительства, а современные экспресс-тесты, несмотря на их высокую специфичность (95-100%), характеризуются сравнительно низкой чувствительностью (60-80%), то есть отрицательный результат быстрой диагностики не исключает стрептококковой этиологии заболевания.
Дифференциальная диагностика острого БГСА-тонзиллита, основанная только на клинических признаках, нередко представляет собой достаточно трудную задачу даже для опытных врачей. Однако необходимо отметить, что наличие респираторных симптомов (кашля, ринита, охриплости голоса и др.), а также сопутствующие конъюнктивит, стоматит или диарея указывают на вирусную этиологию острого тонзиллита. В отличие от скарлатины для острого БГСА-тонзиллита не характерны какие-либо виды высыпаний на коже и слизистых. При локализованной дифтерии ротоглотки налет с миндалин снимается с трудом, не растирается на предметном стекле, не растворяется в воде, а медленно оседает на дно сосуда; после удаления налета отмечается кровоточивость подлежащих тканей. Ангинозная форма инфекционного мононуклеоза, как правило, начинается с распространенного поражения лимфатических узлов (шейных, затылочных, подмышечных, абдоминальных, паховых), симптоматика тонзиллита развивается на 3-5-й день болезни, при исследовании периферической крови выявляется лейкоцитоз с преобладанием мононуклеаров (до 60-80%). Ангина Симановского — Плаута — Венсана характеризуется слабо выраженными признаками общей интоксикации и явлениями одностороннего язвенно-некротического тонзиллита, при этом возможно распространение некротического процесса на мягкое и твердое небо, десны, заднюю стенку глотки и гортань.
Поскольку БГСА-тонзиллит по своей сути — самокупирующееся заболевание и может заканчиваться полным выздоровлением (даже при отсутствии лечения) без каких-либо осложнений, у некоторых врачей по-прежнему существуют сомнения в отношении тщательности курации таких больных. Совершенно необоснованно отдается предпочтение местному лечению (полосканиям, ингаляциям и др.) в ущерб системной антибиотикотерапии. Подобный подход ни в коей мере не оправдывает себя и может привести к весьма печальным для больного последствиям.
Лечение. Несмотря на то что БГСА по-прежнему сохраняет практически полную чувствительность к β-лактамным антибиотикам, в последние годы отмечаются определенные проблемы в терапии тонзиллитов, вызванных этим микроорганизмом. По данным разных авторов, частота неудач пенициллинотерапии БГСА-тонзиллитов составляет 25-30%, а в некоторых случаях — даже 38%. Одной из возможных причин этого может быть гидролиз пенициллина специфическими ферментами — β-лактамазами, которые продуцируются микроорганизмами — копатогенами (золотистым стафилококком, гемофильной палочкой и др.), присутствующими в глубоких тканях миндалин, особенно при наличии хронических воспалительных процессов в последних.
Как видно из табл. 1, препараты пенициллинового ряда остаются средствами выбора только при лечении острого БГСА-тонзиллита. На сегодняшний день оптимальным препаратом из группы оральных пенициллинов представляется амоксициллин, который по противострептококковой активности аналогичен ампициллину и феноксиметилпенициллину, но существенно превосходит их по своим фармакокинетическим характеристикам, отличаясь большей биодоступностью (95, 40 и 50 % соответственно) и меньшей степенью связывания с сывороточными белками (17, 22 и 80 %). При сомнительной комплаентности (исполнительности) больного, а также в определенных клинико-эпидемиологических ситуациях показано назначение однократной инъекции бензатин-пенициллина.
Феноксиметилпенициллин целесообразно назначать только детям младшего возраста, учитывая наличие лекарственной формы в виде суспензии, а также несколько большую комплаентность, обеспечиваемую благодаря контролю со стороны родителей, чего нельзя сказать о подростках.
Наряду с пенициллинами несомненного внимания заслуживает представитель оральных цефалоспоринов I поколения цефадроксил, высокая эффективность которого в терапии БГСА-тонзиллитов, а также хорошая переносимость подтверждены в ходе многочисленных клинических исследований.
При непереносимости β-лактамных антибиотиков целесообразно назначать макролиды (спирамицин, азитромицин, рокситромицин, кларитромицин, мидекамицин). Наряду с высокой противострептококковой активностью преимуществами этих препаратов являются способность создавать высокую тканевую концентрацию в очаге инфекции, более короткий (в частности, для азитромицина) курс лечения, хорошая переносимость. Применение эритромицина — первого представителя антибиотиков данного класса — в настоящее время существенно сократилось, особенно в терапевтической практике, поскольку он чаще других макролидов вызывает нежелательные эффекты со стороны желудочно-кишечного тракта, обусловленные стимулирующим действием эритромицина на моторику желудка и кишечника.
Антибиотики-линкозамины (линкомицин, клиндамицин) назначают при БГСА-тонзиллите только при непереносимости как b-лактамов, так и макролидов. Широко применять эти препараты при данной нозологической форме не рекомендуется. Известно, что при частом применении оральных пенициллинов чувствительность к ним со стороны зеленящих стрептококков, локализующихся в ротовой полости, существенно снижается. Поэтому у данной категории пациентов, среди которых немало больных с ревматическими пороками сердца, линкозамины рассматриваются как препараты первого ряда для профилактики инфекционного эндокардита при выполнении различных стоматологических манипуляций.
При наличии хронического рецидивирующего БГСА-тонзиллита вероятность колонизации очага инфекции микроорганизмами, продуцирующими b-лактамазы, достаточно высока. В этом случае целесообразно проведение курса лечения ингибитор-защищенными пенициллинами (амоксициллин/клавуланат) или оральными цефалоспоринами II поколения (цефуроксим — аксетил), а при непереносимости b-лактамных антибиотиков — линкозаминами (табл. 2). Указанные антибиотики рассматриваются также как препараты второго ряда для случаев, когда пенициллинотерапия острого БГСА-тонзиллита оказывается безуспешной (что чаще встречается при использовании феноксиметилпенициллина). Универсальной же схемы, обеспечивающей 100%-ную элиминацию БГСА из носоглотки, в мировой клинической практике не сууществует.
Необходимо отметить, что применение тетрациклинов, сульфаниламидов, ко-тримоксазола и хлорамфеникола при БГСА-инфекции глотки в настоящее время не оправдано по причине высокой частоты резистентности и, следовательно, низких показателей эффективности терапии.
Таким образом, в современных условиях вопросы своевременной и качественной диагностики и рациональной антибиотикотерапии БГСА-тонзиллита сохраняют свою актуальность. Появившиеся в последние годы новые антибактериальные средства существенно расширили возможности антимикробной терапии БГСА-тонзиллита, но полностью данную проблему не решили. В связи с этим многие исследователи возлагают большие надежды на создание вакцины, содержащей эпитопы М-протеинов ревматогенных БГСА- штаммов, не вступающих в перекрестную реакцию с тканевыми антигенами человеческого организма. Такая вакцина, в частности в рамках первичной профилактики ОРЛ, очень необходима в первую очередь лицам с генетическими маркерами, указывающими на предрасположенность к заболеванию.
Назначение антибиотиков при катаральной ангине и неосложненных формах хронического тонзиллита не всегда оправданно, тем более без четкого представления о возбудителе.
На этих стадиях заболевания, еще не отягощенных суперинфекцией, альтернативным лечением может стать гомеопатия. Это регулирующая терапия, воздействующая на процессы саморегуляции с помощью лекарств, подобранных индивидуально с учетом реакции больного. С позиций классической гомеопатии ангина и хронический тонзиллит являются не локальными заболеваниями, а частным проявлениями конституционной слабости и наследственной предрасположенности.
1 В зарубежной литературе широко используются взаимозаменяемые термины "тонзиллофарингит" и "фарингит".
Читайте также:

