Стрептококк констеллатус чувствительность к антибиотикам
Обновлено: 24.04.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
- Streptococcussanguis – воистину могуч и вездесущ. Обнаруживается в зубных отложениях с самого прорезывания зубов и до конца жизни, где и есть основное место его обитания. Иногда может быть обнаружен на слизистой глотки и в фекалиях, куда попадают транзитом. При этом надо помнить, что этот микроб вносит существенный вклад в процессы, связанные с кариесом, занимая в последующем ведущее место в ассоциациях микроорганизмов, выделяемых из гнойного экссудата при воспалительных процессах в челюстно-лицевой области, включая одонтогенные абсцессы мозга и других органов. Кроме того, они же могут быть выделены их крови и сердечных клапанов больных инфекционным эндокардитом.
- Streptococcussalivarius – также является одним из основных компонентов нормальной микрофлоры полости рта, а также, но в меньшем количестве, может быть выделен со слизистых дыхательного, желудочно-кишечного и урогенитального тракта. Особенно часто выделяются при анализе микрофлоры языка, слюны и фекалий. И крайне редко из крови при менингитах, септицимии и эндокардитах.
- Streptococcusmutans – выделяется с поверхности зубов и фекалий. Этот микроб является кариесогенным, а значит, может в дальнейшем вызывать бактериемию и бактериальный эндокардит у пациентов, не занимающихся регулярной санацией кариозных очагов в полости рта.
- Streptococcusmitis – в норме выделяется из слюны, мокроты фекалий, при этом может выделяться из верхних дыхательных путей и крови при нозокомиальном инфицировании.
- Совсем неверно упоминать в этом блоке стрептококки группы Anginosus -Streptococcusintermedius/S.anginosus/S.constellatus, но так как мы обсуждаем в основном орофарингеальную флору, способную вызвать инфекционные эндокардиты (и чтобы не писать еще один, совсем малюсенький блок), мы упомянем их здесь. В норме они являются представителями пародонтогенной группы. Но стоит представителю группы S.intermedius оттуда выбраться, как он может вызывать абсцессы печени, мозга и эндокардиты, так как проявляет высокую тропность к их тканям.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
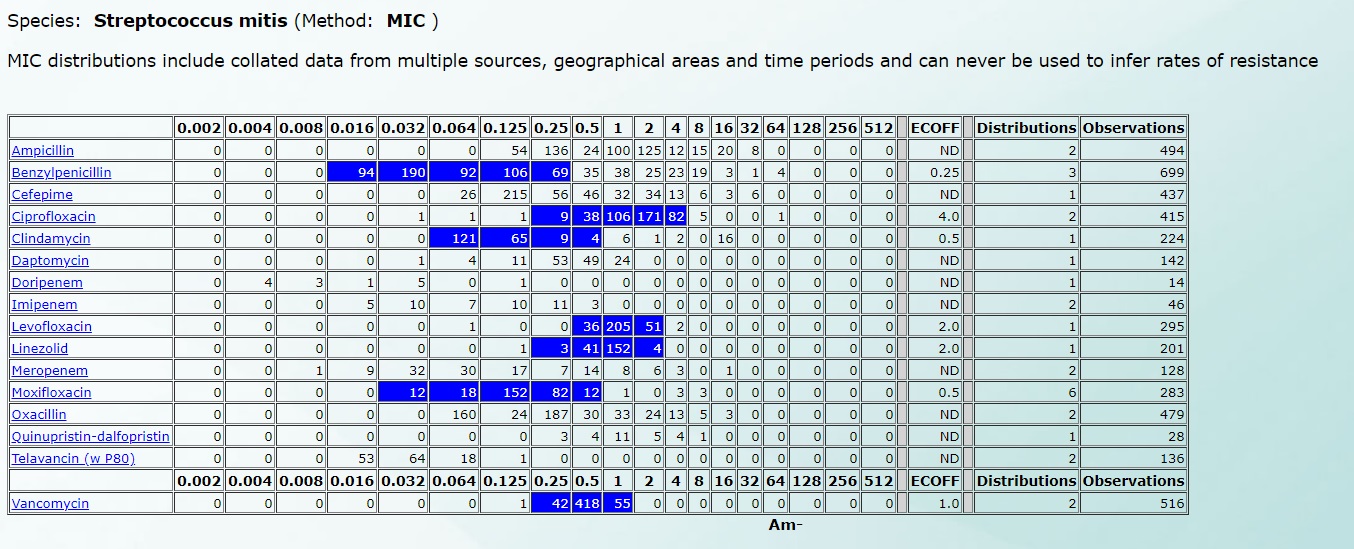
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
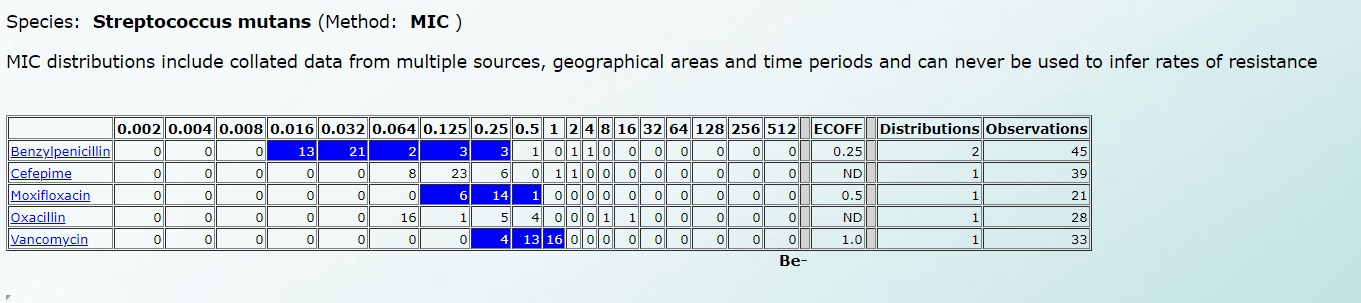
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
- Пенициллин в высоких дозировках (до 24 млн ЕД в сутки), возможно, в сочетании с аминогликозидами
- Цефтриаксон
- Ванкомицин
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
Для определения чувствительности стрептококков используют следующие питательные среды:
- Для методов серийных разведений в бульоне необходимо использовать бульон Мюллера-Хинтон с добавлением 2,0 - 5,0 % лизированной лошадиной крови. Кровь лизируют замораживанием-оттаиванием с последующим центрифугированием для освобождения от теней эритроцитов.
- Для методов серийных разведений в агаре и ДДМ используют агар Мюллера-Хинтон с добавлением 5 % дефибринированной бараньей крови.
Указанные добавки асептически вносят в питательную основу после автоклавирования и охлаждения до 48 - 50 °С.
Определение чувствительности Streptococcus pneumoniae
Бета-лактамные антибиотики (в частности пенициллин) являются препаратами выбора для терапии пневмококковых инфекций. В то же время критерии интерпретации результатов определения чувствительности пневмококков к этим препаратам постоянно пересматриваются в связи с появлением новых клинических и экспериментальных данных об эффективности различных бета-лактамов при пневмококковых инфекциях, вызванных штаммами с различным уровнем чувствительности к пенициллину.
Механизм резистентности S.pneumoniae к пенициллину и другим бета-лактамным антибиотикам обусловлен изменением пенициллиносвязывающих белков (ПСБ) клеточной стенки. В результате ступенчатых мутаций уменьшается сродство ПСБ к бета-лактамным антибиотикам.
При этом установлено, что при лечении инфекций дыхательных путей, вызванных штаммами S.pneumoniae с промежуточным уровнем резистентности к пенициллину, бета-лактамные антибиотики остаются клинически эффективными, но применение их при менингите приводит к неудаче терапии.
В связи с этим при разработке критериев интерпретации результатов определения чувствительности S.pneumoniae к бета-лактамным антибиотикам было проведено подразделение штаммов по источникам выделения (инфекции дыхательных путей, ликвор) и пересмотрены критерии оценки чувствительности к амоксициллину, цефотаксиму и цефтриаксону. Критерии интерпретации результатов определения чувствительности к пенициллину не пересмотрены.
Следует обратить внимание на несколько важных особенностей определения чувствительности S.pneumoniae:
- невозможность определения чувствительности к бета-лактамным антибиотикам (пенициллину, аминопенициллинам, цефалоспоринам, карбапенемам) ДДМ;
- невозможность определения чувствительности S.pneumoniae к АБП методом разведений в агаре.
Поэтому определение чувствительности пневмококков к пенициллину и другим бета-лактамным антибиотикам подразумевает последовательное (выделение S.pneumoniae из нестерильных локусов) или одновременное (при тяжелых инфекциях, выделении пневмококков из крови и ликвора) выполнение двух исследований:
- Скрининг с диском, содержащим 1,0 мкг оксациллина, с целью выявления возможной пенициллинорезистентности. Скрининговый метод позволяет разделить микроорганизмы на две группы: группу чувствительных штаммов и группу, в которую входят часть чувствительных, а также умеренно-резистентные и резистентные штаммы пневмококков.
- Определение МПК пенициллина и других бета-лактамных антибиотиков методом разведений в бульоне или с помощью Е-тестов у штаммов, отнесенных ко второй группе по результатам скрининга.
Скрининг на наличие пенициллинорезистентности у штаммов S.pneumoniae
Постановка теста
Методика проведения исследования не отличается от обычной процедуры определения чувствительности пневмококков к АБП ДДМ.
Интерпретация результатов
- При выявлении диаметра зоны подавления роста штамма пневмококка вокруг диска с 1 мкг оксациллина ≥ 20 мм, S.pneumoniae расценивается как чувствительный ко всем бета-лактамным антибиотикам.
- При выявлении диаметра зоны подавления роста < 20 мм необходимо определение МПК всех бета-лактамных антибиотиков (пенициллина, аминопенициллинов, цефалоспоринов II - IV поколенй, карбапенемов) методами серийных разведений в бульоне или с помощью Е-тестов.
Макролиды и линкозамиды
Вторыми по значимости в лечении пневмококковых инфекций являются макролидные и линкозамидные антибиотики. Оценка чувствительности S.pneumoniae к перечисленным антибиотикам возможна как диско-диффузионным методом, так и методом серийных разведений. В связи с разнообразием механизмов устойчивости S.pneumoniae к макролидам в повседневной практике могут встречаться различные варианты перекрестной резистнетности микроорганизмов к АБП этой группы.
Однако в практических целях для характеристики чувствительности S.pneumoniae к рассматриваемой группе АБП достаточно оценить чувствительность к эритромицину и клиндамицину, что позволяет дифференцировать два основных фенотипа:
- MLSB - перекрестная устойчивость ко всем макролидам, линкозамидам и стрептограминам В, обусловленная метилированием мишени действия препаратов.
- М - устойчивость к 14- и 15-членным макролидам (при сохранении чувствительности к 16-членным макролидам, линкозамидам и стрептограминам), обусловленная активным выыедением АБП.
Фторхинолоны
Традиционные фторхинолоны (пефлоксацин, офлоксацин, ципрофлоксацин и ломефлоксацин) не являются адекватными для лечения пневмококковых инфекций, соответственно, оценивать чувствительность к этим препаратам нецелесообразно. В последние годы в лечении пневмококковых инфекций важное место заняли антипневмококковые фторхинолоны (левофлоксацин, спарфлоксацин, моксифлоксацин и гатифлоксацин). Частота устойчивости к перечисленным препаратам минимальна, однако, поскольку между ними не наблюдают полной перекрестной резистентности, возникает необходимость включения в исследование всей группы.
АБП других групп
Из антибиотиков других групп для лечения пневмококковых инфекций применяют ко-тримоксазол, хлорамфеникол, тетрациклины. Однако роль перечисленных препаратов в последние годы резко снижается в связи с нарастанием устойчивости, меньшей клинической эффективностью в сравнении с бета-лактамами, макролидами и антипневмококковыми фторхинолонами, также значительным числом нежелательных эффектов.
Для лечения тяжелых пневмококковых инфекций, вызванных штаммами с высоким уровнем устойчивости к антибактериальным препаратам других групп, в ряде случаев рекомендуется ванкомицин.
Критерии интерпретации результатов определения чувствительности S.pneumoniae (пограничные значения диаметров зон подавления роста и МПК АБП) приведены в таблице 17.
Таблица 17.
Определение чувствительности Streptococcus spp. группы "viridans"
Проводить определение чувствительности штаммов стрептококков группы "viridans", выделенных из нестерильных локусов в рутинной практике нецелесообразно. У штаммов, выделенных из стерильных в норме локусов организма, необходимо, в первую очередь, исследовать чувствительность к пенициллину. Воспроизводимые результаты при определении чувствительности стрептококков группы "viridans" к пенициллину удается получить только при помощи метода серийных разведений, ДДМ не пригоден для этой цели.
Штаммы, чувствительные к этому антибиотику, следует расценивать как чувствительные ко всем бета-лактамным антибиотикам. Часть штаммов, устойчивых к пенициллину, могут сохранять чувствительность к некоторым цефалоспоринам III поколения (цефотаксиму и цефтриаксону), IV поколения (цефепиму) и карбапенемам. Однако критерии интерпретации результатов определения чувствительности в настоящее время установлены только для цефотаксима и цефтриаксона.
Определенный интерес может представлять изучение чувствительности стрептококков группы "viridans" к эритромицину и другим макролидам, клиндамицину, тетрациклину и хлорамфениколу, однако клиническое значение получаемых при этом данных не определено.
В случае сниженной чувствительности или резистентности зеленящих стрептококков к пенициллину, при выдаче результатов тестирования клиницистам целесообразно рекомендовать проведение комбинированной терапии бета-лактамами с аминогликозидами, которые проявляют синергизм при совместном применении с бета-лактамами, несмотря на отсутствие у аминогликозидов собственной значимой активности в отношении стрептококков.
Определение чувствительности бета-гемолитических стрептококков
К бета-гемолитическим стрептококкам относятся микроорганизмы, принадлежащие к различным серологическим группам по Лансфельд (А, B, C, G). Среди них наибольшее клиническое значение имеют стрептококки группы А (Streptococcus pyogenes) и группы В (Streptococcus agalactiae).
Препаратами выбора для лечения инфекций, вызванных бета-гемолитическими стрептококками, являются бета-лактамы, причем достоверных случаев устойчивости к АБП этой группы не описано. Не описана и устойчивость к ванкомицину. Следовательно, оценивать чувствительность к указанным АБП в рутинной практике нецелесообразно.
При выделении из нестерильных локусов необходимость в оценке чувствительности возникает только для S.pyogenes и S.agalactiae. Примерный перечень препаратов для определения чувствительности этих микроорганизмов включает: макролиды (эритромицин) и линкосамиды (клиндамицин). С целью мониторига антибиотикорезистентности возможно определение чувствительности к хлорамфениколу и левофлоксацину. Для бета-гемолитических стрептококков, выделенных из стерильных локусов, необходимо определять чувствительность ко всем вышеперечисленным препаратам одновременно.
Примерный перечень АБП, рекомендуемых для определения чувствительности S.pneumoniae, стрептококков группы "viridans" и бета-гемолитических стрептококков, выделенных из различных локусов организма, представлен в таблице 18.
Таблица 18.
Критерии интерпретации результатов определения чувствительности Streptococcus spp. (кроме S.pneumoniae) (пограничные значения диаметров зон подавления роста и МПК АБП) приведены в таблице 19.
ИССЛЕДОВАНИЕ ЧУВСТВИТЕЛЬНОСТИ STREPTOCOCCUS PYOGENES, ВЫДЕЛЕННЫХ ИЗ ЗЕВА, К ТРАДИЦИОННЫМ АНТИБИОТИКАМ
Аннотация
Ключевые слова: Streptococcus pyogenes, гемолитические штаммы Streptococcus spp., чувствительность к антибиотикам.
Stepanenko I.S. 1 , Kostina Yu.A. 2 , Batarsheva A.A. 3 , Slastnikov E.D. 4
1 ORCID: 0000-0001-5793-438Х, MD, Associate Professor, 2 ORCID: 0000-0002-7825-7856, MD, Associate Professor, 3 ORCID: 0000-0001-7604-0680, Postgraduate Student, 4 ORCID: 0000-0003-2843-8672, Student, FSBEI of Higher Education “Ogarev Mordovia State University” in Saransk
RESEARCH OF SENSITIVITY OF STREPTOCOCCUS PYOGENES EGESTED FROM OROPHARYNX TO TRADITIONAL ANTIBIOTICS
Abstract
The study involved 350 students of the Medical Institute at the age of 22-24 years old without signs of acute infectious diseases of the upper respiratory tract. 19 β-hemolytic strains were identified as Streptococcus spp. Final identification and sensitivity of S. pyogenes to 13 antimicrobials was examined using the bacteriological analyser “Magellan diagnostics” (UK) and evaluated according to the EUCAST recommendations. Investigated strains of S.pyogenes showed sensitivity to levofloxacin, linezolid, vancomycin, amoxicillin/clavulanate, clindamycin, meropenem, tetracycline, cefepime, cefotaxime, ceftriaxone and chloramphenicol. Resistance of the isolated strains was noted for azithromycin and erythromycin. The results of the study indicate the necessity to limit the use of these drugs in the treatment of infections caused by pyogenic streptococci.
Keywords: Streptococcus pyogenes, hemolytic strains of Streptococcus spp., sensitivity to antibiotics.
Стрептококки – это большая группа условно-патогенных кокков и заболевания, вызываемые различными видами этого рода, описаны задолго до выявления и идентификации этих микроорганизмов. Т. Бильротом в 1874 г. стрептококки впервые были обнаружены в тканях человека при рожистом воспалении, раневых инфекциях и описаны [3, С. 57].
Streptococcus pyogenes классифицируется как β-гемолитический стрептококк серогруппы А. Этот вид довольно часто является возбудителей бактериальных инфекций человека. S. pyogenes вызывает тонзиллофарингиты, скарлатину, импетиго, рожистое воспаление, флегмоны, некротизирующий фасцит, миозит, артрит, синдром токсического шока [4, С. 1]. Осложнениям некоторых инфекций, при не рациональной антибиотикотерапии и длительном носительстве, являются острая ревматическая лихорадка и гломерулонефрит, связанные с наличием у S. рyogenes перекрестно-реагирующих антигенов с клетками суставов, миокарда и почек [5, С. 205]. В последние десятилетие наблюдается изменение эпидемиологии стрептококковых инфекций и рост заболеваемости тяжелыми инфекциями (некротизирующий фасцит, синдром токсического шока), а так же отмечается появление и распространение штаммов пиогенного стрептококка, резистентных к макролидам, линкозамидам, тетрациклинам [6, С. 12], [7, С. 1]. Поэтому, принимая во внимание, что структура заболеваемости и резистентности S. рyogenes к антимикробным препаратам значительно варьирует в различных регионах РФ, целесообразно проведение мониторинга антибиотикочувствительности представителей данного вида.
Слизистые верхних дыхательных путей человека являются поставщиком микроорганизмов для замкнутых помещений, в том числе и медицинских учреждений. Медицинские работники, чья профессиональная деятельность связана с длительным нахождением в условиях стационара, могут стать источником развития внутрибольничных заболеваний в медицинских учреждениях различного профиля, обусловленных условно-патогенными микроорганизмами [2, С. 12].
Результаты исследования. В ходе исследования отделяемого зева 350 студентов, без острых респираторных заболеваний, был выделен 41 штамм (рис. 1), образующий гемолиз на кровяном агаре.
Из них, как Streptococcus spp. были идентифицированы 19 штаммов (рис. 2). 11 штаммов из 19 после конечной верификации были идентифицированы как S.pyogenes, 3 – S.dys.ss equisimilis, 5 – S.agalactia (рис. 3).

Рис. 1 – Выделение гемолитических штаммов микроорганизмов из зева, (%)

Рис. 2 – Выделение штаммов Streptococcus spp. из зева, (%)

Рис. 3 – Выделение видов Streptococcus spp. из зева, (%)
Чувствительность выделенных штаммов изучали к 13 традиционно применяемым для исследования S.pyogenes антимикробным препаратам: азитромицин, амоксициллин/клавулановая кислота, ванкомицин, клиндамицин, левофлоксацин, линезолид, меропенем, тетрациклин, хлорамфеникол, цефепим, цефотаксим, цефтриаксон, эритромицин. Согласно пограничным значениям EUCAST (версия 4.0) [9, С. 66] чувствительность стрептококков групп A к пенициллинам и карбапенемам оценивается на основании их чувствительности к бензилпенициллину и пограничные значения минимальной подавляющей концентрации (МПК) составляют 0,25 мг/л. Исходя из этого, выделенные штаммы S.pyogenes оказались чувствительны к амоксициллин/клавуланату, цефепиму, цефотаксиму, цефтриаксону и меропенему, так как МПК этих соединений составили 0,12 и 0,25 мг/л (см. таблицу 1). Пограничные значения МПК для фторхинолонов (EUCAST, версия 4.0) [9, С. 68] составляют для чувствительных штаммов ≤1 мг/л, для резистентных – >2 мг/л. МПК к левофлоксацину для выделенных штаммов составила 0,5 мг/л, то есть все штаммы S.pyogenes чувствительны к левофлоксацину. Пограничные значения МПК для гликопептидов составляют 2 мг/л (EUCAST, версия 4.0) [9, С. 69]. Выделенные штаммы пиогенного стрептококка оказались чувствительны к ванкомицину, так как МПК составили от 0,12 мг/л до 2 мг/л. Согласно EUCAST (версия 4.0) [9, С. 69] пограничные МПК для азитромицина и эритромицина составляют для чувствительных штаммов ≤0,25 мг/л, для резистентных – >0,5 мг/л. Пять штаммов изученных стрептококков проявили устойчивость к эритромицину и 3 штамма – к азитромицину. Все штамма стрептококков оказались чувствительны к клиндамицину, так как пограничные МПК составили от 0,12 мг/л до 0,5 мг/л и соответствуют требованиям EUCAST (версия 4.0) [9, С. 69], которые для чувствительных штаммов ≤0,5 мг/л, для резистентных – >0,5 мг/л.
Таблица 1 – Антибиотикочувствительность штаммов S.pyogenes
| Антибиотик | Штаммы | МПК мг/л | ||||||
| 0,12 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | ||
| Азитромицин | 11 | 8 | 2 | 1 | ||||
| Амоксициллин/ Клавулановая кислота | 11 | 8 | 3 | |||||
| Ванкомицин | 11 | 4 | 4 | 2 | ||||
| Клиндамицин | 11 | 4 | 2 | 5 | ||||
| Левофлоксацин | 11 | 11 | ||||||
| Линезолид | 11 | 3 | 1 | 7 | ||||
| Меропенем | 11 | 4 | 7 | |||||
| Тетрациклин | 11 | 1 | 10 | |||||
| Хлорамфеникол | 11 | 5 | 4 | 2 | ||||
| Цефепим | 11 | 8 | 3 | |||||
| Цефотаксим | 11 | 8 | 3 | |||||
| Цефтриаксон | 11 | 8 | 3 | |||||
| Эритромицин | 11 | 6 | 5 | |||||
Выделенные штаммы S.pyogenes проявили чувствительность к тетрациклину, МПК составили не более 1 мг/л (пограничные значения согласно EUCAST [9, С. 70] – для чувствительных штаммов ≤1 мг/л, для резистентных – >2 мг/л), оказались чувствительны к линезолиду, так как МПК составили не более 2 мг/л (пограничные значения согласно EUCAST [9, С. 70] – для чувствительных штаммов ≤2 мг/л, для резистентных – >4 мг/л) и к хлорамфениколу – МПК к которому не превысили 4 мг/л (пограничные значения согласно EUCAST [9, С. 70] – для чувствительных штаммов ≤8 мг/л, для резистентных – >8 мг/л).
Выводы. Полученные данные о частоте носительства условно-патогенных стрептококков (5%) в зеве молодых людей, участвующих в исследовании, которое не ведет к формированию острых патологических процессов в зеве, не требует активной эрадикации стрептококков и свидетельствует о динамическом равновесии биоценоза. Выделенные штаммы S.pyogenes оказались чувствительными к левофлоксацину, линезолиду, ванкомицину, хлорамфениколу, амоксициллин/клавуланату, клиндамицину, меропенему, тетрациклину, цефепиму, цефотаксиму, цефтриаксону. Выявленная резистентность к азитромицину и эритромицину свидетельствует о необходимости ограничения использования данных препаратов для лечения инфекций, вызванных пиогенными стрептококками.
Список литературы / References
Список литературы на английском языке / References in English
Для цитирования: Садова Н.В., Заплатников, Шипулина О.Ю. и др. Диагностика, профилактика и лечение перинатальной Streptococcus agalactiae инфекции. РМЖ. 2011;22:1334.
Одним из частых бактериальных заболеваний перинатального периода является инфекция, вызванная Streptococcus agalactiae (S. agalactiae). У женщин в период беременности S. agalactiae–инфекция может протекать как бессимптомно, так и клинически значимо с развитием бактериемии, эндометрита, хориоамнионита, воспаления мочевых и родовых путей, а у новорожденных детей проявляться локализованными и инвазивными поражениями [1–13].
S. agalactiae относится к стрептококкам группы В, которые являются грамположительными инкапсулированными факультативными анаэробами, не образующими спор. Главным фактором вирулентности S. agalactiae является полисахаридная капсула. Из белковых факторов патогенности особо отмечают С5а пептидазу, бета–гемолизин, С протеины (альфа– и бета–), гиалуронидазу, Sip белок, CAMP фактор (В–белок), а также комплекс протеаз, гемолизин, адгезины и др. [2,14–16].
Установлено, что 15–40% женщин являются носителями S. agalactiae, колонизирующей слизистые влагалища или прямой кишки [1,2,6,8]. Рождение детей от S. agalactiae–инфицированных женщин в 50% сопровождается вертикальной трансмиссией возбудителя. Передача инфекции от инфицированной матери происходит, как правило, незадолго до родов или непосредственно во время родов. В постнатальный период, особенно в ближайшие часы и сутки после рождения, ребенок также может инфицироваться, однако это случается значительно реже по сравнению с пре– и интранатальной контаминацией. Отмечено, что S. agalactiae–инфицирование новорожденных не всегда приводит к развитию инфекционного процесса. Факторами риска реализации инфекции у ребенка, рожденного от S. agalactiae–инфицированной женщины, являются: возраст беременной (12 часов), задержка внутриутробного развития и наличие S. agalactiae–инфекции у ранее рожденных детей [6,8].
Неонатальная заболеваемость S. agalactiae–инфекцией до недавнего времени составляла 1–4 на 1000 живорожденных детей, среди которых в 75% случаев имела место манифестация в 1–7–е сутки жизни. При этом на 100 инфицированных беременных женщин рождался 1 ребенок с тяжелой S. agalactiae–инфекцией [4–6]. Благодаря активному использованию в акушерской практике рекомендаций по профилактике S. agalactiae–инфекции, удалось существенно снизить уровень инфицированности новорожденных, а также частоту инвазивных форм заболевания у детей первого месяца жизни. Так, в странах, где проводится антибактериальная профилактика перинатальной S. agalactiae–инфекции, заболеваемость в ранний неонатальный период удалось снизить более чем на 80%, а показатели неонатальной заболеваемости в целом не превышают 0,3 случая на 1000 живорожденных детей [8].
Клиническими проявлениями перинатальной S. agalactiae–инфекции у женщин являются послеродовые инфекции эндометрия, мочевыводящих путей, головного мозга, а также сепсис и осложнения кесарева сечения. У новорожденных выделяют локализованные и инвазивные формы перинатальной S. agalactiae–инфекции. При этом в зависимости от времени манифестации выделяют заболевания с ранним (до 7 дня жизни) и поздним (после 7 суток жизни) дебютом. S. agalactiae–инфекция у новорожденных наиболее часто протекает в виде инвазивных форм с бактериемией, поражением легких, мозговых оболочек. Нередко при этом заболевание приобретает септический характер, особенно у недоношенных и маловесных детей, у которых сепсис отмечен в 77–88% среди всех случаев S. agalactiae–инфекции. Именно в этой группе пациентов S. agalactiae–инфекция протекает наиболее тяжело и нередко заканчивается летально [3,8]. Особо следует отметить, что в подавляющем большинстве случаев дети при этом рождаются в нормальном состоянии, однако уже через несколько часов клиническая картина резко меняется.
Манифестация ранних форм, как правило, дебютирует цианозом и респираторными нарушениями (апноэ, тахипноэ). Возможна также молниеносная форма заболевания, при которой очень быстро появляются все признаки септического шока [3–10]. В клинических анализах крови при этом нередко обнаруживают лейкопению. При позднем дебюте (после 7–го дня жизни) S. agalactiae–инфекция также может протекать в виде сепсиса или менингита [8]. Клинически при этом чаще регистрируют напряжение родничков, лихорадку, угнетение сознания вплоть до комы и тонико–клонические судороги. Реже отмечаются другие проявления инфекции: омфалит, отит, синусит, конъюнктивит, артрит, остеомиелит, поражения кожи, мочевой системы, эндокардит, миокардит.
В связи с низкой специфичностью клинических проявлений S. agalactiae–инфекции у новорожденных детей особое значение в верификации этиологии заболевания приобретают лабораторные методы диагностики (классические бактериологические, серологические, молекулярно–биологические) [2,11,17,18]. При бактериоскопии обнаруживают типичные грамположительные кокки, образующие короткие цепочки. Для выявления S. agalactiae в биологических жидкостях организма (в крови, ликворе, моче, трахео–бронхиальном аспирате) методом бактериологических посевов необходимо использовать среды, обогащенные кровью или сывороткой, т.к. выделение S. agalactiae на обычных средах, как правило, не превышает 10–12%. Серологические методы диагностики имеют значение лишь в плане ретроспективного подтверждения диагноза, а также для выявления напряженности пассивного иммунитета, трансплацентарно полученного от матери. При этом к факторам высокого риска реализации S. agalactiae–инфекции в неонатальный период относят указание на серонегативность или низкие титры специфических антител у инфицированных беременных женщин.
В последние годы все большую значимость приобретают молекулярно–биологические методы диагностики. Быстрота получения результатов при использовании полимеразной цепной реакции (ПЦР) в сочетании с высокой чувствительностью и специфичностью делают ПЦР незаменимым методом верификации инфекционных заболеваний, особенно в неонатологической практике [17,18]. Так, нами в пилотном исследовании было проведено изучение чувствительности ПЦР в детекции генома S. agalactiae в сравнении с методом бактериологических посевов. При исследовании аспирата из трахеи у 62 новорожденных, находящихся в отделении неонатальной реанимации и интенсивной терапии в связи с тяжелыми инфекциями неонатального периода, у 9 детей (14,5%) методом ПЦР удалось выявить геном S. agalactiae, в то время как при параллельно выполненных бактериологических посевах результаты были отрицательными. Вероятно, негативные результаты бактериологического исследования были обусловлены массивной антибиотикотерапией, проводимой детям с первых дней жизни, что могло привести к изменению культурально–морфологических характеристик возбудителя и снижению числа жизнеспособных микроорганизмов.
Методы специфической иммунопрофилактики S. agalactiae–инфекции до настоящего времени не разработаны, поэтому для предупреждения перинатальной S. agalactiae–инфекции используют антибиотикопрофилактику (АБ–профилактика). Разработанные в 2002 г. рекомендации СDC предусматривают обязательное обследование на S. agalactiae–носительство всех беременных женщин на сроке 35–37 недель [6]. При выделении возбудителя из влагалища и/или заднепроходного канала женщине в период родов назначают антибиотики в тех случаях, когда имеются определенные факторы риска. К факторам риска при этом относят следующие состояния: предыдущий ребенок перенес инвазивную S. agalactiae–инфекцию, во время настоящей беременности имели место S. agalactiae–бактериурия, угроза преждевременных родов (до 37 нед.), безводный промежуток больше 12 часов, лихорадка в родах. В случае выявления у S. agalactia–инфицированной женщины одного из указанных выше факторов риска, для профилактики перинатальной S. agalactiae–инфекции в период родов назначают антибиотик.
Для АБ–профилактики рекомендовано использовать бензилпенициллин, который вводят внутривенно в дозе 5 млн. ЕД с момента начала родовой деятельности, переходя в дальнейшем на дозу 2,5 млн. ЕД каждые 4 часа до окончания родов. Альтернативой бензилпенициллину является ампициллин, который вводят также внутривенно, первоначально в дозе 2 г на введение, а затем – по 1 г каждые 4 часа. При аллергии к пенициллинам их заменяют клиндамицином или эритромицином, но чаще в этих случаях рекомендуют цефазолин (вначале – 2 г на введение внутривенно, затем по 1 г каждые 8 часов внутривенно до окончания родов). При высоком риске развития анафилаксии на бета–лактамные антибиотики может быть использован ванкомицин, который рекомендуют вводить внутривенно по 1 г каждые 12 часов до окончания родов. Анализ результатов проведенных исследований показал, что благодаря АБ–профилактике удалось существенно снизить не только неонатальную заболеваемость S. agalactiae–инфекцией (регресс более чем на 80%), но и частоту развития инвазивных форм, что определило значительное улучшение прогноза заболевания [6,8].
В тех случаях, когда женщине во время родов АБ–профилактика S. agalactiae–инфекции проведена не была, а у новорожденного имеются факторы риска (мать – носитель S. agalactiae, возраст матери менее 20 лет, отягощенный акушерский анамнез, преждевременные роды, лихорадка в родах, длительный безводный период, S. agalactiae–инфекции у ранее рожденных детей, а также признаки задержки внутриутробного развития у самого ребенка), следует как можно быстрее начать этиотропную терапию. Выбор стартовой АБ–терапии при этом проводится эмпирически. В связи с тем, что S. agalactiae высокочувствителен к бета–лактамным антибиотикам, при подозрении на S. agalactiae–инфекцию препаратом выбора является ампициллин. Однако учитывая, что клиническая картина неспецифична и имеется вероятность иной этиологии заболевания, ампициллин комбинируют с гентамицином. При этом предпочтителен внутривенный путь введения антибиотиков. В тех случаях, когда развивается неонатальный S. agalactiae–сепсис, ампициллин назначают из расчета 200 мг/кг/сутки [3,8]. При менингите дозы антибиотиков увеличивают, ампицилин при этом вводят из расчета 300 мг/кг/сутки. При выделении S. agalactiae и его генома лечение продолжают выбранной комбинацией антибиотиков до улучшения состояния, а в дальнейшем переходят на монотерапию ампициллином. При неинвазивных формах S. agalactiae–инфекции продолжительность монотерапии составляет 10 суток, при S. agalactiae–неосложненных менингитах – 14 суток, при S. agalactiae–артритах и остеомиелитах – 3–4 недели, при S. agalactiae–эндокартите и S. agalactiae–вентрикулите – не менее 4 недель [6,8].
Таким образом, в настоящее время имеются все возможности для снижения заболеваемости и летальности от перинатальной S. agalactiae–инфекции. Для этого необходимо у всех беременных женщин на сроке 35–37 недель проводить скрининг на S. agalactiae–носительство. При его подтверждении и наличии факторов риска (предыдущий ребенок в неонатальном периоде перенес S. agalactiae–инфекцию, наличие у женщины S. agalactiae–бактериурии, преждевременные роды, длительный безводный период, лихорадка в родах) женщине в родах должны быть назначены антибиотики для профилактики перинатальной S. agalactiae–контаминации ее ребенка. Строгое выполнение указанных рекомендаций позволяет достоверно снизить риск вертикального инфицирования и значительно уменьшает частоту инвазивных форм S. agalactiae–заболеваний у новорожденных детей.
Литература
1. Оганян К.А. Течение и исход беременности при колонизации мочеполового тракта женщин стрептококками группы В и D. Автореф. дисс. канд. мед. наук.– СПБ, 2008, 24
2. Покровский В.И., Поздеев О.К. Семейство Streptococcaceae/ Медицинская микробиология. ГЭОТАР Медицина, М, 1999: 193–206.
3. Шабалов Н. П. Внутриутробные инфекции/ Неонатология. В 2 т. – С–Пб.: Специальная литература, 1996, Т. 2: 43–76.
4. Baltimore R.S. Huie S.M., Meek J.I., Schuchat A. Early–onset neonatal sepsis in the era of group В streptococcal prevention. Pediatrics. 2001. Vol. 108: 1094–8.
5. Boyer K.M.: Neonatal group В streptococcal infections // Current Opinion Pediatrics, 1995, 7: 13–18.
6. Centers for Disease Control and prevention (CDC). Prevention of perinatal group В streptococcal disease: Revised Guidelines from CDC // Morb. Mortal. Wkly Rep. 2002.Vol.51: 10–22
7. Kenyon S.L., Taylor PJ., Tarnow–Mordi W. Broad–spectrum antibiotics for preterm, prelabour rupture of fetal membranes, ORACLE Collaborative Group // Lancet. 2001. Vol. 357: 979–88.
8. Red Book: Report of the Committee on Infectious Diseases. 27h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2006; 992.
9. Weisner A.M., Johnson A.P., Lamagni T.L. et al. Characterization of group В streptococci recovered from infants with invasive disease in England and Wales // Clin Infect Dis. 2004. Vol. 38: 1203–1208.
10. Nandyal RR. Update on group B streptococcal infections: perinatal and neonatal periods. J Perinat Neonatal Nurs. 2008, 22, 3: 230—37.
11. Шуляк Б.Ф. Инфекция стрептококка группы В, методы ее лабораторной диагностики и профилактики. Медицинский алфавит. 2010, №2: 47–53
12. Gardam M.A., Low D.E., Saginur R. Group B streptococcal necrotizing fasciitis and streptococcal toxic shock–like syndrome in adults. Arch Intern Med, 1998, 158: 1704–08.
13. Sendi P., Johansson L., Norrby–Teglund A. Invasive group B Streptococcal disease in non–pregnant adults: a review with emphasis on skin and soft–tissue infections. Infection. 2008, 36, 2, 100–11.
14. Дмитриев А.В., Шаклеина Е.В. Молекулярная эпидемиология патогенных стрептококков группы В // Ж. микроб. эпидемиол. и иммунол. 2003: 83–92.
15. Fischetti V.A. Gram–Positive Pathogens, American Society Microbiology, Washington, D.C, 2000. 511 p.
16. Jacobsson K. A Novel family of fibrinogen–binding proteins in Streptococcus agalactiae // Vet. Microbiol. 2003. Vol. 96: 103–113.
17. Эйдельштейн И.А., Сехин С.В., Иванчик Н.В. и др. Валидация тест–системы на основе ПЦР в режиме реального времени для выявления Streptococcus agalactiae в сравнении с микробиологическим методом. Молекулярная диагностика. М., 2010, 3: 346–348.
18. Сафонова А.П., Пиксасова О.В., Скачкова Т.С. и др. Разработка методики выявления и количественного определения ДНК Streptococcus agalactiae на основе ПЦР в режиме реального времени. II Ежегодный Всероссийский Конгресс по инфекционным болезням. М, 2010: 282.
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Микробиологические аспекты
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста. Так что без клинической картины острого фарингита не надо хвататься за антибиотики, как собственно и что-то сеять вне обострений.
100% штаммов чувствительны к пенициллинам, при этом Резистентность к макролидам в Европе – от 2 до 32%, в США – 7%. У нас в связи с великой любовью к этой группе, особенно среди педиатров, скорее всего, как в Европе. То есть о макролидах в этой ситуации надо забыть, к тому же тем же азитромицином не получится создать необходимую экспозицию в связи с ограничениями по срокам применения.
Клинические аспекты
При всем вышеперечисленном БГСА – зверь страшный, и основная проблема в том, что страх к нему мы почти потеряли. Лирическое отступление on. Именно этот зверь был постоянной причиной хирургических инфекций и родильной горячки (послеродового сепсиса) в доантибиотиковую эру. А женщины, как вы помните, умирали от нее, как мухи, пока Земмельвейс не заставил врачей мыть руки (за что закончил в психушке), но они их хотя бы на руках таскать перестали. Но даже сейчас, не дай бог, хирургу со стрептококковой ангиной подойти к операционному столу, и к концу первых суток стрептококк организует очень больную и страшно воняющую проблему в конкретной послеоперационной ране. Лирическое отступление off.
Потому напомним, что S.pyogenes может вызывать следующие заболевания:
- Фарингиты
- Поражения кожи и мягких тканей – целлюлиты, эризипелоид, лимфангит, рожа
- Некротические миозиты и фасцииты
- Послеродовый сепсис
- Пневмонии
- Сепсис
- Бактериальные эндокардиты (раньше редко, все же ангины и скарлатины старая школа требовала лечить строго 14 дней и ампициллином в задницу: сейчас стали встречаться почаще – привет коротким курсам антибиотиков при лечении ангин)
- Действие токсинов запускают синдром токсического шока и скарлатину
- Аутоиммунное воздействие приводит к ревматическим лихорадкам, с последующими возможным формированием пороков сердца и острому гломерулонефриту
- Послеоперационные раневые инфекции первых суток
Практические вопросы диагностики:
Микробиологическая диагностика S.pyogenes не представляет никакого труда, здесь в прямом смысле достаточно покрасить мазок по Граму. Все упирается в организационные аспекты – пока мазок доберется до лаборатории, пока покрасят. Пока ответят, пациент успеет много раз осложнится, если это стрептококк, или выздороветь, если это был фарингит и вызвавший его вирус (все-таки до 60% фарингитов вызваны вирусами, а не бактериальной флорой). Не хотелось бы останавливаться подробно на каждом перечисленном заболевании, но не упомянуть о диагностике острого фарингита, которая чаще всего и запускает множество вторичных осложнений, мы не можем. Для облегчения диагностики острого существуют несколько диагностических шкал. Автору более всего симпатична шкала Мак-Айзека в виду максимальной простоты ее использования.
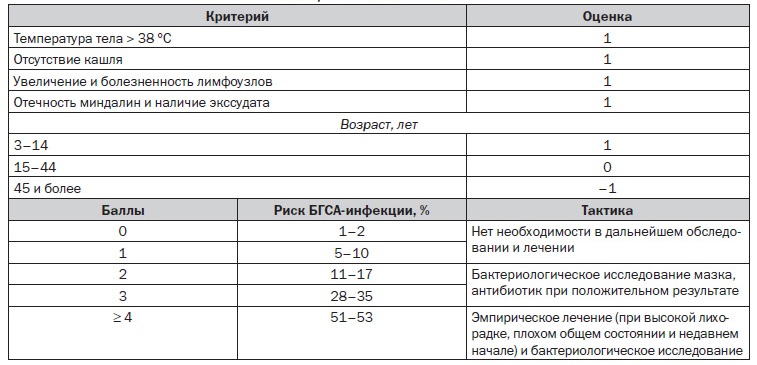
Но самым быстрым тестом для точной диагностики на месте является стрептатест, который в течение пяти минут дает ответ о вероятности наличия БГСА у больного с острым фарингитом.
Аспекты медикаментозного лечения
- Итак, мы определили, что имеем дело с БГСА, и тогда препаратами выбора в амбулаторной практике будут являться аминопенициллины, так как их много, они доступны, и главное, к ним 100% чувствительность у возбудителя.
Если ангина произошла впервые в жизни – лечим 10 дней. Если имеем дело с постоянными рецидивами – 14 дней, так как зверь может уйти во внутриклеточное состояние, оттуда руля процессом, и, чтобы до него добраться, доза должна быть выше средней, а курс лечения соответствующим.
Когда БГСА может уйти внутрь клетки? На тех самых пресловутых 5-7 днях, когда налеты с миндалин только сошли, температура только-только нормализовалась, а антибиотик взяли и отменили. И хорошо, если после подобного произойдет только рецидивирование фарингита, а не начнутся такие осложнения, как ревматизм, гломерулонефриты и далее по списку.
- Если пациент оказался в стационаре и ему обеспечен венозный доступ, то могут использоваться и пенициллины, и ампициллин в разных его вариациях. Главное – правильная доза, правильная кратность и ПРАВИЛЬНАЯ ДЛИТЕЛЬНОСТЬ КУРСА. Идеальный вариант из серии "дешево и сердито". Но обязательно должна быть доказанная микробиология.
При непереносимости пенициллинов помним о клиндамицине как об их адекватной замене.
- Пиогенный стрептококк, как мы выше упомянули, является причиной ранней послеоперационной раневой инфекции. Напомним, что стандартная послеоперационная раневая инфекция развивается к седьмым суткам. А если это произошло в первые сутки, да к тому же страшно завоняло (пиогенный стрептококк недаром называют мясоедным), немедленно делаем мазок, бежим с ним в лабораторию (можно даже своими ногами – это же ваш пациент осложнился, там так же бегом делают мазок по Граму, обнаруживают цепочки, и после этого начинаем лить аминопенициллин в вену, если не использовали его для периоперационной антибиотикопрофилактики (если использовали, то просто продолжаете дальше). Если совсем все бедно, можно пенициллин – 12 млн в сутки. Но если вы провели правильную периоперационную антибиотикопрофилактику, учли все риски и не забыли про свой личный стрептококк в горле, то риск ранней раневой минимален, а если профилактика продленная на 72 часа, то она и раскрутиться не успеет.
- При инфекциях кожи и мягких тканей, а также стрептококковом сепсисе препаратами выбора будут клиндамицин (который блокирует выработку токсических продуктов) в сочетании с пенициллином (24 млн ЕД в сутки) – это наиболее предпочтительная и малозатратная комбинация
Альтернативой в режиме монотерапии могут служить:
-
600 мг в/в каждые 6 часов 2,0 каждые шесть часов 2-3 г в/в каждые 6 часов или цефтриаксон по 2 г в сутки внутривенно в расчете 15 мг/кг в/в каждые 12 часов
Почему максимально важно соблюдать как дозировку, так и кратность введения читаем тут – /vracham/antibiotikoterapiya/polozheniya (часть 1 и часть 2).
В заключение хочется снова воскликнуть – пожалуйста, помните о пиогенном стрептококке и о правильной длительности его лечения.
Читайте также:

