Стрептококк митис в зеве что это такое
Обновлено: 17.04.2024
Streptococcus mitis — микроорганизм из группы зеленящих стрептококков, образующих на кровяном агаре альфа-гемолиз. Он является нормальным обитателем ротовой полости и приобретает болезнетворные свойства лишь при определенных условиях. Стрептококк митис в горле продуцирует факторы патогенности и вызывает развитие фарингита. Это наиболее частая форма патологии ЛОР-органов стрептококковой этиологии.
Стрептококк получил название зеленящий, потому что он не полностью разрушает эритроциты. Streptococcus mitis постоянно присутствует во рту здорового человека. Нормальное функционирование иммунной системы сдерживает размножение микробов. Они мирно сосуществуют с макроорганизмом и называются потенциально-патогенными. При снижении общей сопротивляемости к инфекциям происходит активное размножение этих бактерий, возникают воспалительные явления в глотке.
Стрептококк митис, проникающий в организм извне через ротовую полость, вызывает различные заболевания:
- Кариес – под воздействием молочной кислоты и бактерий происходит деминерализация зубов.
- Пульпит – воспаление зубной пульпы развивается при локализации S. mitis в щелях между десной и поверхностью зуба.
- Заболевания ЛОР-органов — фарингит, тонзиллит, синусит возникают чаще всего.
- Эндокардит — микротравмы слизистой рта, обусловленные стоматологическими манипуляциями или банальной чисткой зубов, являются входными воротами для инфекции. Бактерии попадают в системный кровоток и оседают на эндокарде, взывая его воспаление.
- Зеленящие стрептококки в составе смешанной инфекции обнаруживают при менингите, воспалении легких, абсцедировании мозговой и печеночной ткани, сепсисе.
Возбудитель поражает одинаково часто организм взрослых людей и маленьких детей.
Чтобы правильно лечить инфекцию, необходимо выявить ее возбудителя. Для этого проводят микробиологическое исследование биоматериала, взятого от больного. После определения рода и вида микроорганизма ставят тест на чувствительность к антибиотикам. Лечение любой инфекции, в том числе и стрептококковой, этиотропное. Кроме антибиотиков больным назначают симптоматическую терапию, подобранную врачом с учетом индивидуальных особенностей организма.
Этиология

streptococcus mitis под микроскопом
Streptococcus mitis — грамположительные неподвижные бактерии сферической формы, располагающиеся в мазке цепочками. Они входят в группу зеленящих стрептококков, благодаря способности окрашивать среды с кровью в зеленый цвет, то есть образовывать на кровяном агаре альфа-гемолиз.
Стрептококк митис вне организма человека быстро погибает. Его можно легко уничтожить с помощью антисептиков, антибиотиков и ультрафиолета. При снижении иммунитета микроб приобретает болезнетворные свойства, обусловленные способностью продуцировать ферменты патогенности.
Streptococcus mitis – клинически значимый вид, который при активизации проникает в кровь и вызывает воспаление эндокарда. Зеленящие стрептококки легко передаются от человека к человеку и требуют обязательного лечения при наличии явной клиники недуга.
Для роста стрептококка в лабораторных условиях необходимы особые условия — наличие крови или сыворотки в питательных средах. На кровяном агаре вырастают мелкие серые колонии с зонами неполного просветления – альфа-гемолизом, в бульоне образуется придонный и пристеночный рост с крошковатым осадком. Бактерии расщепляют сахара с выделением кислоты, а также некоторые аминокислоты.
Эпидемиология
Streptococcus mitis проникает в организм пероральным путем. Бактерии в норме обитают в полости рта здоровых людей, не вызывая развития патологий. Носители инфекции, не имея никакой клинической симптоматики, могут заражать окружающих людей. Когда бактерии выходят из-под контроля иммунной системы, развивается воспалительный процесс.
- Долгая и высокодозная химиотерапия при онкопатологии,
- Активная антибиотикотерапия,
- Частые воспалительные заболевания ЛОР-органов,
- Регулярный прием антацидов,
- Глубокая нейтропения,
- Пересадка костного мозг,
- Несоблюдение правил личной гигиены,
- Переохлаждение организма,
- Курение,
- Травматическое повреждение слизистой оболочки ротовой полости,
- Герпес-вирусы,
- Гормонотерапия,
- Иммунодефицит.
Стрептококк митис чаще активизируется после переохлаждения осенью или весной.
Распространение инфекции происходит аэрогенным механизмом, который реализуется воздушно-капельным путем, и контактно-бытовым механизмом, который реализуется контактным и половым путями. Возможно самоинфицирование — миграция возбудителя в горло из воспаленных пазух при наличии гайморита.
Клиническая картина
Инфекционное поражение горла проявляется местными и общими признаками.
покраснение и отек слизистой горла
Симптомы патологии одинаковы у взрослых и детей. Если клинические признаки отсутствуют, а в мазке из зева обнаруживают зеленящего стрептококка, лечение не требуется. Мирно сосуществующие бактерии не представляют опасности и не должны вызывать панику. Чтобы избежать дальнейших неприятностей, необходимо постоянно укреплять иммунитет и вести здоровый образ жизни.
Диагностика
Самым информативным методом диагностики заболеваний, вызванных Streptococcus mitis, является бактериологический. Исследуют в микробиологической лаборатории отделяемое зева, кровь, мокроту и прочие выделения из очагов поражения. Диагностирование также включает выявление основных симптомов и проведение общего анализа крови. Все полученные результаты обязательно подтверждаются культуральным методом.

Стерильным ватным тампоном отбирают материал с миндалин и дужек больного. В течение двух часов необходимо произвести посев на стандартные питательные среды с сывороткой или кровью. После суточной инкубации посевов их просматривают и изучают характер роста. Для стрептококков данной группы характерны мелкие круглые серые колонии, окруженные зоной зеленоватого гемолиза. Подозрительные колонии снимают, микроскопируют и определяют их морфологические и тинкториальные свойства. Затем проводят более подробную идентификацию. Определив биохимические и серологические свойства микробов делают вывод о видовой принадлежности данного микроорганизма. В завершении ставят тест на чувствительность к антибиотикам.
Экспресс – диагностика проводится с помощью ПЦР – в слюне больных обнаруживают генетический материал Streptococcus mitis.
Лечебный процесс
Лечение заболеваний, вызванных Streptococcus mitis, направлено на предупреждение осложнений, которые могут развиться на 5-6 сутки. При отсутствии адекватной терапии бактерии проникают в кровь, распространяются по всему организму и вызывают развитие серьезных осложнений – менингита, воспаления легких, среднего уха. Длительность лечения зависит от тяжести заболевания и времени заражения.

Если симптомы патологии игнорировать и не лечить инфекционное воспаление горла, могут развиться тяжелые осложнения на сердце, почки и другие органы.
По мере стихания острых признаков воспаления подключают физиотерапевтические процедуры. Больным показано УФО, электрофорез с хлоридом кальция, ингаляции. Физиопроцедуры улучшают приток крови к органам и стимулируют выздоровление.
Средства народной медицины, облегчающие симптомы стрептококковой инфекции:
иммуностимулирующим действием обладают цитрусовые, шиповник, клюква, киви, петрушка, смородина;
Народные средства не могут заменить прием антибиотиков. Перед их применением необходимо проконсультироваться с врачом. Эти дополнительные методы лечения стрептококковой инфекции следует брать на вооружение.
Профилактика
Лучшие профилактические мероприятия любой инфекции направлены на укрепление иммунитета. Рекомендации специалистов, позволяющие избежать болезнь:
- Закаляться,
- Заниматься спортом,
- Не курить и не пить,
- Содержать в чистоте тело и жилище,
- Избегать переохлаждений и сквозняков,
- Высыпаться,
- Соблюдать оптимальный режим труда и отдыха.
Streptococcus mitis — условно-патогенный микроорганизм, который обитает в ротовой полости и мирно уживается с огромным количеством других бактерий, активно заселяющих данный локус. При снижении защитных сил организма стрептококк митис становится патогеном, вызывающим острые инфекционные заболевания горла — фарингит или тонзиллит. Больные с першением и болью в горле, интоксикацией и сухим кашлем должны как можно скорее обратиться к врачу.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
- Streptococcussanguis – воистину могуч и вездесущ. Обнаруживается в зубных отложениях с самого прорезывания зубов и до конца жизни, где и есть основное место его обитания. Иногда может быть обнаружен на слизистой глотки и в фекалиях, куда попадают транзитом. При этом надо помнить, что этот микроб вносит существенный вклад в процессы, связанные с кариесом, занимая в последующем ведущее место в ассоциациях микроорганизмов, выделяемых из гнойного экссудата при воспалительных процессах в челюстно-лицевой области, включая одонтогенные абсцессы мозга и других органов. Кроме того, они же могут быть выделены их крови и сердечных клапанов больных инфекционным эндокардитом.
- Streptococcussalivarius – также является одним из основных компонентов нормальной микрофлоры полости рта, а также, но в меньшем количестве, может быть выделен со слизистых дыхательного, желудочно-кишечного и урогенитального тракта. Особенно часто выделяются при анализе микрофлоры языка, слюны и фекалий. И крайне редко из крови при менингитах, септицимии и эндокардитах.
- Streptococcusmutans – выделяется с поверхности зубов и фекалий. Этот микроб является кариесогенным, а значит, может в дальнейшем вызывать бактериемию и бактериальный эндокардит у пациентов, не занимающихся регулярной санацией кариозных очагов в полости рта.
- Streptococcusmitis – в норме выделяется из слюны, мокроты фекалий, при этом может выделяться из верхних дыхательных путей и крови при нозокомиальном инфицировании.
- Совсем неверно упоминать в этом блоке стрептококки группы Anginosus -Streptococcusintermedius/S.anginosus/S.constellatus, но так как мы обсуждаем в основном орофарингеальную флору, способную вызвать инфекционные эндокардиты (и чтобы не писать еще один, совсем малюсенький блок), мы упомянем их здесь. В норме они являются представителями пародонтогенной группы. Но стоит представителю группы S.intermedius оттуда выбраться, как он может вызывать абсцессы печени, мозга и эндокардиты, так как проявляет высокую тропность к их тканям.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
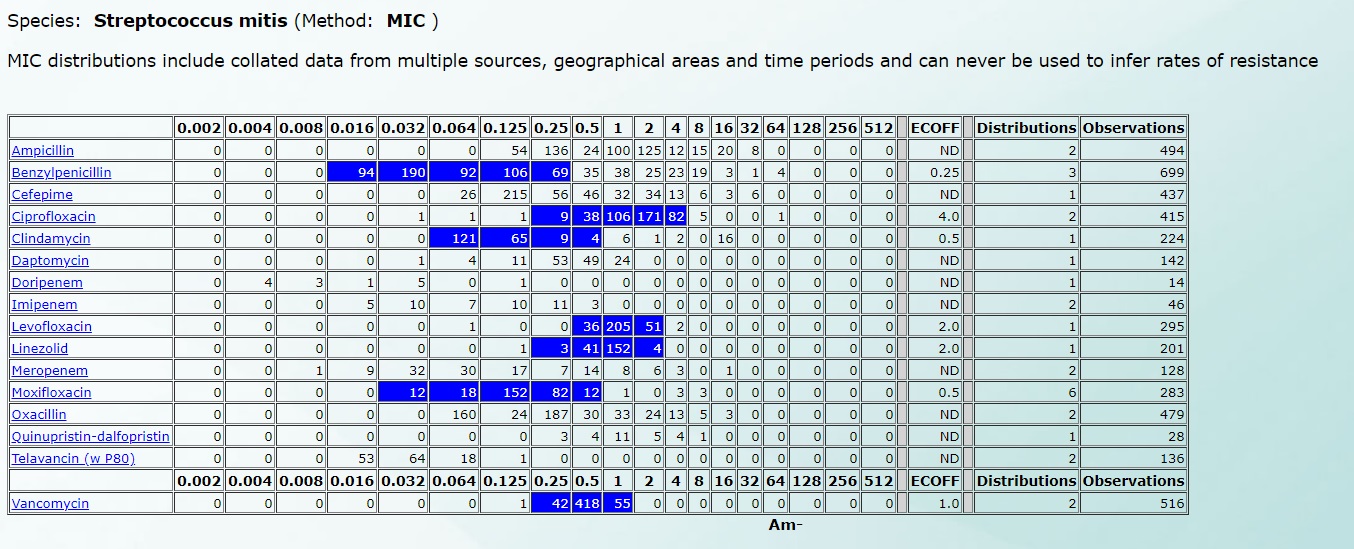
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
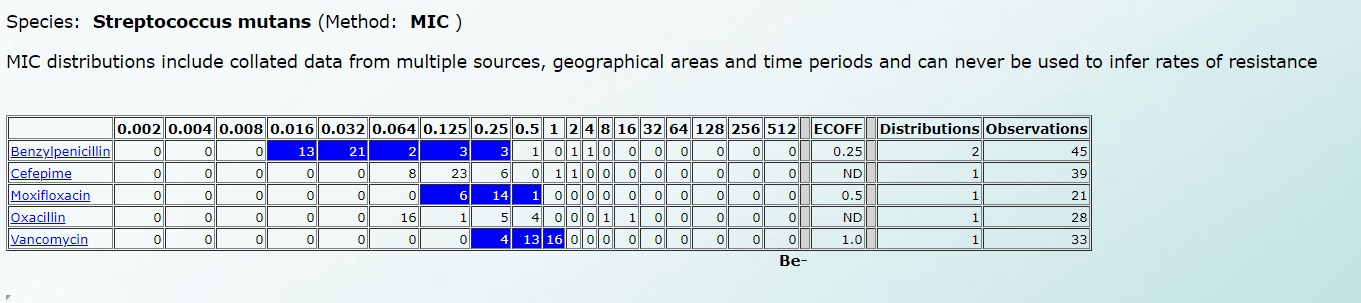
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
- Пенициллин в высоких дозировках (до 24 млн ЕД в сутки), возможно, в сочетании с аминогликозидами
- Цефтриаксон
- Ванкомицин
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
В этой статье мы поговорим о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Почему за исключением S. pyogenes? Да потому что данного возбудителя мы рассмотрели в отдельной статье. Кроме того, мы уже говорим практически на одном языке, а потому можем себе позволить поговорить о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Микробиологические аспекты
Для начала разберемся с классификациями, чтобы понимать принципы разнесения стрептококков по группам. Так сложилось, что для классификации стрептококков используются их фенотипические характеристики, а именно характеристики по гемолитическим свойствам:
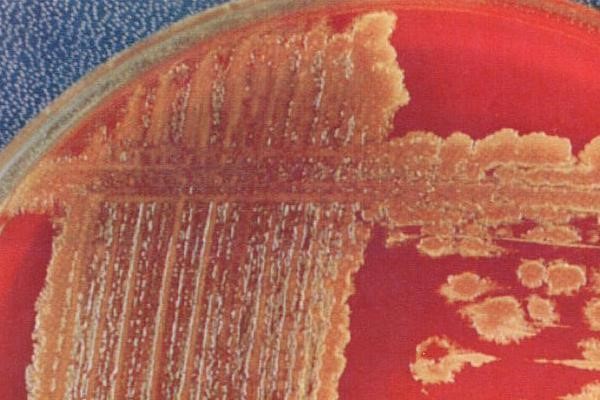
- β-гемолитические стрептококки вызывают полный гемолиз эритроцитов питательной среды с формированием прозрачной зоны вокруг колоний на кровяном агаре
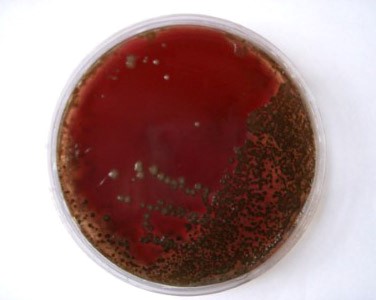
- α-гемолитические (зеленящие) образуют зеленоватый ореол вокруг колоний в результате неполного разложения гемоглобина
- γ-гемолитические по-другому именуются негемолитическими, то есть ничего никуда из крови не разлагают.
Собственно, почему кровь? Дело в том, что стрептококки крайне требовательны к питательным средам и к условиям, в которых их растят. И чтобы они выросли, в питательные среды (в основном, жидкие) необходимо или добавлять мясной экстракт, или использовать коммерческие питательные среды с добавлением крови барана, или 5%-й кровяной агар – и все это с большим количеством дополнительных компонентов. Для определения характера гемолиза традиционно используется среда с 5%-й дефибринированной кровью барана.
Подобное разделение по группам и типам гемолиза является решающим для деления стрептококков, имеющих медицинское значение, позволяя разделить патогенные и условно-патогенные микроорганизмы. Про патогенные мы уже поговорили ранее, теперь будем вести разговор о более обширной группе условно-патогенных представителей и начнем со стрептококков групп A, C, D и F, оставив для отдельного разговора группу В и единственного ее представителя – S. agalactiae.
Основными характеристиками представителей этих групп является то, что все они:
- Обладают β-гемолитической активностью
- Относятся к нормальной микрофлоре человека и животных
- Могут вызывать оппортунистические инфекции в различных локализациях
- Fc-антиген, способный взаимодействовать с Fc-фрагментом IgG, тем самым угнетая систему комплемента и подавляя активность фагоцитов. Кроме того, он же активирует выработку аутоиммунных антител, которые в дальнейшем участвуют в развитии иммунного воспаления;
- Р-антиген, обладающий иммуносупрессивной активностью и являющийся общим для всех стрептококков. Он подавляет выработку антител и усиливает реакции гиперчувствительности замедленного типа.
Кроме того, стрептококки имеют такой фактор патогенности, как М-протеин, который нарушает фагоцитарную активность путем маскировки рецепторов для комплемента, что очень затрудняет борьбу с этими возбудителями.
Клинические аспекты
1. Streptococcus dysgalactiae – объединяет двух представителей Streptococcus dysgalactiae subsp. dysgalactiae и Streptococcus dysgalactiae subsp. equisimilis. Первый живет на животных (и вызывает маститы у коров, на человеке в качестве возбудителя пока не ловили), второй на человеке – в верхних дыхательных путях и влагалище – и может быть причиной менингита, септических артритов и инфекций кожи (при условии наличия соответствующей симптоматики и в отсутствии других вероятных возбудителей).
2. Стрептококки группы Anginosus (S. anginosus, S. constellatus, S. intermedius) относятся к представителям нормальной флоры человека. Обрести зубы и стать возбудителями инфекции их могут заставить травмы, оперативные вмешательства, сахарный диабет, онкологические заболевания и иммунодефициты различной этиологии. Сами по себе на человека не бросаются и обнаружение оных вне клинической картины истребления не требует.
- S.anginosus – в норме обитает в полости рта, верхних дыхательных путях и влагалище. При патологии может быть высеян из урогенитальной и желудочно-кишечной локализаций.
- S. constellatus – в норме живет в верхних дыхательных путях и ЖКТ. При патологических процессах могут быть обнаружены где угодно.
- S. intermedius – в норме обитает в полости рта и верхних дыхательных путях. При патологических процессах в основном высевается из мозга, из крови при эндокардитах и из печеночных абсцессов (проще говоря оттуда, где в норме все должно быть стерильно).
3. S. equi клинического значения не имеет, так как является зоонозом и вызывает ветеринарные проблемы у коров, лошадей, морских свинок, овец и коз. Иногда – при употреблении зараженных молочных продуктов – может быть обнаружен у людей, больных нефритом.
4. S. canis, как понятно из названия, выделяют от собак. У людей могут вызывать инфекции мягких тканей, пневмонии, сепсис, остеомиелит.
5. S. iniae – обнаруживается у дельфинов и рыб. А также у людей, занятых на обработке замороженной рыбы. Крайне редко вызывает заболевание (описаны всего несколько случаев), хорошо лечится бета-лактамами и макролидами.
6. И несколько чисто зоонозных представителей, не имеющих медицинского значения, но иногда сеющихся с людей, которые за этими животными ухаживают или лечат:
- S. porcinus – вызывает абсцессы глотки свиней, пневмонию и аборты;
- S. didelphis – вызывает инфекции кожи, печени, легких и селезенки у опоссумов;
- S. phocae – выделяется у морских котиков при пневмонии у оных.
Как мы увидели, в большинстве своем перечисленные возбудители относятся к нормальной микрофлоре верхних дыхательных путей, кожи, ЖКТ и урогенитального тракта, а чтобы они вызвали заболевание, во внутреннюю среду организма должно проникнуть очень большое количество оных, при этом иммунная система должна быть подавлена тем или иным образом. Чаще всего такую роль играют медицинские вмешательства (инъекции, операции, катетеризация сосудов, гемодиализ и т. п.) на фоне тяжелых основных или сопутствующих заболеваний. Тогда стрептококки способны вызвать инфекции кожи и мягких тканей, верхних дыхательных путей, эндокардиты и сепсис, инфекции урогенитального тракта, при этом строгой локализации процесса соответствующим возбудителем уже не будет, а будет инфекция, связанная с медицинским вмешательством.
Что делать?
Как можно раньше провести бактериологическую диагностику и главным в ней будет правильная техника взятия биологического материала, чтобы точно исключить его контаминацию ни в чем не повинными мирными соседями, просмотрев истинного возбудителя. Техника взятия материала и правила транспортировки в лабораторию подробно расписаны здесь.
Чем лечить?
Этот вопрос мы можем задать только тогда, когда точно понимаем, что именно вышеуказанные зверушки являются возбудителями и никто за ними не прячется. Хорошая новость в том, что стрептококки до сих пор сохранили высокую чувствительность к бета-лактамам вообще и к пенициллинам в частности, то есть лечить их дешево. Плохая новость в том, что фактически утеряна чувствительность к макролидам, и поэтому они не могут быть препаратами выбора – это обязательно надо учитывать при назначении стартовой терапии.
Кроме того, стрептококки продолжают демонстрировать высокую чувствительность к ванкомицину, но в виду неоднозначности самого препарата в плане безопасности его применения, им тоже не следует злоупотреблять и включать его в схему лечения только в случае наличия аллергии к пенициллиновому ряду.
Итак, мы закончили краткое рассмотрение представителей стрептококков групп A, C, D, F и G, и нам осталось рассмотреть только одного представителя из группы В, а именно S.agalactiae, чем мы и займемся в следующей статье.
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Микробиологические аспекты
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста. Так что без клинической картины острого фарингита не надо хвататься за антибиотики, как собственно и что-то сеять вне обострений.
100% штаммов чувствительны к пенициллинам, при этом Резистентность к макролидам в Европе – от 2 до 32%, в США – 7%. У нас в связи с великой любовью к этой группе, особенно среди педиатров, скорее всего, как в Европе. То есть о макролидах в этой ситуации надо забыть, к тому же тем же азитромицином не получится создать необходимую экспозицию в связи с ограничениями по срокам применения.
Клинические аспекты
При всем вышеперечисленном БГСА – зверь страшный, и основная проблема в том, что страх к нему мы почти потеряли. Лирическое отступление on. Именно этот зверь был постоянной причиной хирургических инфекций и родильной горячки (послеродового сепсиса) в доантибиотиковую эру. А женщины, как вы помните, умирали от нее, как мухи, пока Земмельвейс не заставил врачей мыть руки (за что закончил в психушке), но они их хотя бы на руках таскать перестали. Но даже сейчас, не дай бог, хирургу со стрептококковой ангиной подойти к операционному столу, и к концу первых суток стрептококк организует очень больную и страшно воняющую проблему в конкретной послеоперационной ране. Лирическое отступление off.
Потому напомним, что S.pyogenes может вызывать следующие заболевания:
- Фарингиты
- Поражения кожи и мягких тканей – целлюлиты, эризипелоид, лимфангит, рожа
- Некротические миозиты и фасцииты
- Послеродовый сепсис
- Пневмонии
- Сепсис
- Бактериальные эндокардиты (раньше редко, все же ангины и скарлатины старая школа требовала лечить строго 14 дней и ампициллином в задницу: сейчас стали встречаться почаще – привет коротким курсам антибиотиков при лечении ангин)
- Действие токсинов запускают синдром токсического шока и скарлатину
- Аутоиммунное воздействие приводит к ревматическим лихорадкам, с последующими возможным формированием пороков сердца и острому гломерулонефриту
- Послеоперационные раневые инфекции первых суток
Практические вопросы диагностики:
Микробиологическая диагностика S.pyogenes не представляет никакого труда, здесь в прямом смысле достаточно покрасить мазок по Граму. Все упирается в организационные аспекты – пока мазок доберется до лаборатории, пока покрасят. Пока ответят, пациент успеет много раз осложнится, если это стрептококк, или выздороветь, если это был фарингит и вызвавший его вирус (все-таки до 60% фарингитов вызваны вирусами, а не бактериальной флорой). Не хотелось бы останавливаться подробно на каждом перечисленном заболевании, но не упомянуть о диагностике острого фарингита, которая чаще всего и запускает множество вторичных осложнений, мы не можем. Для облегчения диагностики острого существуют несколько диагностических шкал. Автору более всего симпатична шкала Мак-Айзека в виду максимальной простоты ее использования.
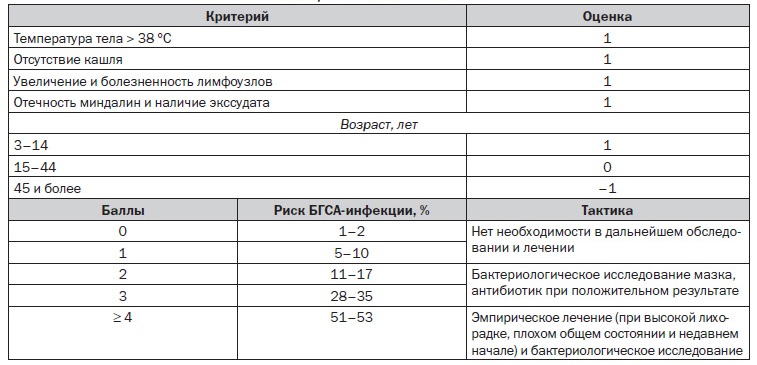
Но самым быстрым тестом для точной диагностики на месте является стрептатест, который в течение пяти минут дает ответ о вероятности наличия БГСА у больного с острым фарингитом.
Аспекты медикаментозного лечения
- Итак, мы определили, что имеем дело с БГСА, и тогда препаратами выбора в амбулаторной практике будут являться аминопенициллины, так как их много, они доступны, и главное, к ним 100% чувствительность у возбудителя.
Если ангина произошла впервые в жизни – лечим 10 дней. Если имеем дело с постоянными рецидивами – 14 дней, так как зверь может уйти во внутриклеточное состояние, оттуда руля процессом, и, чтобы до него добраться, доза должна быть выше средней, а курс лечения соответствующим.
Когда БГСА может уйти внутрь клетки? На тех самых пресловутых 5-7 днях, когда налеты с миндалин только сошли, температура только-только нормализовалась, а антибиотик взяли и отменили. И хорошо, если после подобного произойдет только рецидивирование фарингита, а не начнутся такие осложнения, как ревматизм, гломерулонефриты и далее по списку.
- Если пациент оказался в стационаре и ему обеспечен венозный доступ, то могут использоваться и пенициллины, и ампициллин в разных его вариациях. Главное – правильная доза, правильная кратность и ПРАВИЛЬНАЯ ДЛИТЕЛЬНОСТЬ КУРСА. Идеальный вариант из серии "дешево и сердито". Но обязательно должна быть доказанная микробиология.
При непереносимости пенициллинов помним о клиндамицине как об их адекватной замене.
- Пиогенный стрептококк, как мы выше упомянули, является причиной ранней послеоперационной раневой инфекции. Напомним, что стандартная послеоперационная раневая инфекция развивается к седьмым суткам. А если это произошло в первые сутки, да к тому же страшно завоняло (пиогенный стрептококк недаром называют мясоедным), немедленно делаем мазок, бежим с ним в лабораторию (можно даже своими ногами – это же ваш пациент осложнился, там так же бегом делают мазок по Граму, обнаруживают цепочки, и после этого начинаем лить аминопенициллин в вену, если не использовали его для периоперационной антибиотикопрофилактики (если использовали, то просто продолжаете дальше). Если совсем все бедно, можно пенициллин – 12 млн в сутки. Но если вы провели правильную периоперационную антибиотикопрофилактику, учли все риски и не забыли про свой личный стрептококк в горле, то риск ранней раневой минимален, а если профилактика продленная на 72 часа, то она и раскрутиться не успеет.
- При инфекциях кожи и мягких тканей, а также стрептококковом сепсисе препаратами выбора будут клиндамицин (который блокирует выработку токсических продуктов) в сочетании с пенициллином (24 млн ЕД в сутки) – это наиболее предпочтительная и малозатратная комбинация
Альтернативой в режиме монотерапии могут служить:
-
600 мг в/в каждые 6 часов 2,0 каждые шесть часов 2-3 г в/в каждые 6 часов или цефтриаксон по 2 г в сутки внутривенно в расчете 15 мг/кг в/в каждые 12 часов
Почему максимально важно соблюдать как дозировку, так и кратность введения читаем тут – /vracham/antibiotikoterapiya/polozheniya (часть 1 и часть 2).
В заключение хочется снова воскликнуть – пожалуйста, помните о пиогенном стрептококке и о правильной длительности его лечения.
Что подразумевают под острым тонзиллитом? Почему при БГСА-тонзиллите необходима антибактериальная терапия? Какие антибактериальные средства выбрать? Острый тонзиллит (ангина) 1 — заболевание, которое характеризуется острым воспалением одного ил
Что подразумевают под острым тонзиллитом?
Почему при БГСА-тонзиллите необходима антибактериальная терапия?
Какие антибактериальные средства выбрать?

Острый тонзиллит (ангина) 1 — заболевание, которое характеризуется острым воспалением одного или нескольких лимфоидных образований глоточного кольца (чаще небных миндалин) и принадлежит к числу широко распространенных инфекций верхних дыхательных путей.
Наиболее значимым бактериальным возбудителем острого тонзиллита является β-гемолитический стрептококк группы А (Streptococcus pyogenes, БГСА). Реже острый тонзиллит вызывают вирусы, стрептококки групп C и G, Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheria (дифтерия), анаэробы и спирохеты (ангина Симановского — Плаута — Венсана), крайне редко — микоплазмы и хламидии.
БГСА передается воздушно-капельным путем. Источниками инфекции являются больные и реже бессимптомные носители. Вероятность заражения увеличивается при высокой степени обсемененности и тесном контакте с больным. Вспышки острого БГСА-тонзиллита чаще всего встречаются в организованных коллективах (в детских дошкольных учреждениях, школах, воинских частях и т. д.). Поражаются преимущественно дети в возрасте 5-15 лет, а также лица молодого трудоспособного возраста. Наибольшая заболеваемость отмечается в зимне-весенний период.
Высокая частота заболевания, контагиозность инфекции, большие трудопотери, влекущие за собой экономический ущерб, возможность развития серьезных осложнений — все это свидетельствует о том, что проблема БГСА-тонзиллита по-прежнему стоит достаточно остро как в научном, так и в практическом аспекте.
Клиническая картина. Инкубационный период при остром БГСА- тонзиллите составляет от нескольких часов до 2-4 дней. Для этого заболевания характерны острое начало с повышением температуры до 37,5–39°С, познабливание или озноб, головная боль, общее недомогание, боль в горле, усиливающаяся при глотании; нередки артралгии и миалгии. У детей могут быть тошнота, рвота, боли в животе. Развернутая клиническая картина наблюдается, как правило, на вторые сутки с момента начала заболевания, когда общие симптомы достигают максимальной выраженности. При осмотре выявляется покраснение небных дужек, язычка, задней стенки глотки. Миндалины гиперемированы, отечны, часто с гнойным налетом желтовато-белого цвета. Налет рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечаются уплотнение, увеличение и болезненность при пальпации шейных лимфатических узлов на уровне угла нижней челюсти (регионарный лимфаденит). В анализах крови — повышенный лейкоцитоз (9-12 10 9 /л), сдвиг лейкоцитарной формулы влево, ускорение СОЭ (иногда до 40-50 мм/ч), появление С-реактивного белка. Длительность периода разгара (без лечения) составляет примерно 5-7 дней. В дальнейшем при отсутствии осложнений основные клинические проявления болезни (лихорадка, симптомы интоксикации, воспалительные изменения в миндалинах) быстро исчезают, нормализуется картина периферической крови. Симптомы регионарного лимфаденита могут сохраняться до 10-12 дней.
Диагноз БГСА-тонзиллита подтверждается микробиологическим исследованием мазка с поверхности миндалин и/или задней стенки глотки. При соблюдении правил техники забора образца чувствительность метода достигает 90 %, а специфичность — 95-99 %. Популярные за рубежом методы экспресс-диагностики А-стрептококкового антигена в мазках из зева дают возможность получить ответ через 15-20 мин. В то же время следует подчеркнуть, что культуральный метод не позволяет дифференцировать активную инфекцию от БГСА-носительства, а современные экспресс-тесты, несмотря на их высокую специфичность (95-100%), характеризуются сравнительно низкой чувствительностью (60-80%), то есть отрицательный результат быстрой диагностики не исключает стрептококковой этиологии заболевания.
Дифференциальная диагностика острого БГСА-тонзиллита, основанная только на клинических признаках, нередко представляет собой достаточно трудную задачу даже для опытных врачей. Однако необходимо отметить, что наличие респираторных симптомов (кашля, ринита, охриплости голоса и др.), а также сопутствующие конъюнктивит, стоматит или диарея указывают на вирусную этиологию острого тонзиллита. В отличие от скарлатины для острого БГСА-тонзиллита не характерны какие-либо виды высыпаний на коже и слизистых. При локализованной дифтерии ротоглотки налет с миндалин снимается с трудом, не растирается на предметном стекле, не растворяется в воде, а медленно оседает на дно сосуда; после удаления налета отмечается кровоточивость подлежащих тканей. Ангинозная форма инфекционного мононуклеоза, как правило, начинается с распространенного поражения лимфатических узлов (шейных, затылочных, подмышечных, абдоминальных, паховых), симптоматика тонзиллита развивается на 3-5-й день болезни, при исследовании периферической крови выявляется лейкоцитоз с преобладанием мононуклеаров (до 60-80%). Ангина Симановского — Плаута — Венсана характеризуется слабо выраженными признаками общей интоксикации и явлениями одностороннего язвенно-некротического тонзиллита, при этом возможно распространение некротического процесса на мягкое и твердое небо, десны, заднюю стенку глотки и гортань.
Поскольку БГСА-тонзиллит по своей сути — самокупирующееся заболевание и может заканчиваться полным выздоровлением (даже при отсутствии лечения) без каких-либо осложнений, у некоторых врачей по-прежнему существуют сомнения в отношении тщательности курации таких больных. Совершенно необоснованно отдается предпочтение местному лечению (полосканиям, ингаляциям и др.) в ущерб системной антибиотикотерапии. Подобный подход ни в коей мере не оправдывает себя и может привести к весьма печальным для больного последствиям.
Лечение. Несмотря на то что БГСА по-прежнему сохраняет практически полную чувствительность к β-лактамным антибиотикам, в последние годы отмечаются определенные проблемы в терапии тонзиллитов, вызванных этим микроорганизмом. По данным разных авторов, частота неудач пенициллинотерапии БГСА-тонзиллитов составляет 25-30%, а в некоторых случаях — даже 38%. Одной из возможных причин этого может быть гидролиз пенициллина специфическими ферментами — β-лактамазами, которые продуцируются микроорганизмами — копатогенами (золотистым стафилококком, гемофильной палочкой и др.), присутствующими в глубоких тканях миндалин, особенно при наличии хронических воспалительных процессов в последних.
Как видно из табл. 1, препараты пенициллинового ряда остаются средствами выбора только при лечении острого БГСА-тонзиллита. На сегодняшний день оптимальным препаратом из группы оральных пенициллинов представляется амоксициллин, который по противострептококковой активности аналогичен ампициллину и феноксиметилпенициллину, но существенно превосходит их по своим фармакокинетическим характеристикам, отличаясь большей биодоступностью (95, 40 и 50 % соответственно) и меньшей степенью связывания с сывороточными белками (17, 22 и 80 %). При сомнительной комплаентности (исполнительности) больного, а также в определенных клинико-эпидемиологических ситуациях показано назначение однократной инъекции бензатин-пенициллина.
Феноксиметилпенициллин целесообразно назначать только детям младшего возраста, учитывая наличие лекарственной формы в виде суспензии, а также несколько большую комплаентность, обеспечиваемую благодаря контролю со стороны родителей, чего нельзя сказать о подростках.
Наряду с пенициллинами несомненного внимания заслуживает представитель оральных цефалоспоринов I поколения цефадроксил, высокая эффективность которого в терапии БГСА-тонзиллитов, а также хорошая переносимость подтверждены в ходе многочисленных клинических исследований.
При непереносимости β-лактамных антибиотиков целесообразно назначать макролиды (спирамицин, азитромицин, рокситромицин, кларитромицин, мидекамицин). Наряду с высокой противострептококковой активностью преимуществами этих препаратов являются способность создавать высокую тканевую концентрацию в очаге инфекции, более короткий (в частности, для азитромицина) курс лечения, хорошая переносимость. Применение эритромицина — первого представителя антибиотиков данного класса — в настоящее время существенно сократилось, особенно в терапевтической практике, поскольку он чаще других макролидов вызывает нежелательные эффекты со стороны желудочно-кишечного тракта, обусловленные стимулирующим действием эритромицина на моторику желудка и кишечника.
Антибиотики-линкозамины (линкомицин, клиндамицин) назначают при БГСА-тонзиллите только при непереносимости как b-лактамов, так и макролидов. Широко применять эти препараты при данной нозологической форме не рекомендуется. Известно, что при частом применении оральных пенициллинов чувствительность к ним со стороны зеленящих стрептококков, локализующихся в ротовой полости, существенно снижается. Поэтому у данной категории пациентов, среди которых немало больных с ревматическими пороками сердца, линкозамины рассматриваются как препараты первого ряда для профилактики инфекционного эндокардита при выполнении различных стоматологических манипуляций.
При наличии хронического рецидивирующего БГСА-тонзиллита вероятность колонизации очага инфекции микроорганизмами, продуцирующими b-лактамазы, достаточно высока. В этом случае целесообразно проведение курса лечения ингибитор-защищенными пенициллинами (амоксициллин/клавуланат) или оральными цефалоспоринами II поколения (цефуроксим — аксетил), а при непереносимости b-лактамных антибиотиков — линкозаминами (табл. 2). Указанные антибиотики рассматриваются также как препараты второго ряда для случаев, когда пенициллинотерапия острого БГСА-тонзиллита оказывается безуспешной (что чаще встречается при использовании феноксиметилпенициллина). Универсальной же схемы, обеспечивающей 100%-ную элиминацию БГСА из носоглотки, в мировой клинической практике не сууществует.
Необходимо отметить, что применение тетрациклинов, сульфаниламидов, ко-тримоксазола и хлорамфеникола при БГСА-инфекции глотки в настоящее время не оправдано по причине высокой частоты резистентности и, следовательно, низких показателей эффективности терапии.
Таким образом, в современных условиях вопросы своевременной и качественной диагностики и рациональной антибиотикотерапии БГСА-тонзиллита сохраняют свою актуальность. Появившиеся в последние годы новые антибактериальные средства существенно расширили возможности антимикробной терапии БГСА-тонзиллита, но полностью данную проблему не решили. В связи с этим многие исследователи возлагают большие надежды на создание вакцины, содержащей эпитопы М-протеинов ревматогенных БГСА- штаммов, не вступающих в перекрестную реакцию с тканевыми антигенами человеческого организма. Такая вакцина, в частности в рамках первичной профилактики ОРЛ, очень необходима в первую очередь лицам с генетическими маркерами, указывающими на предрасположенность к заболеванию.
Назначение антибиотиков при катаральной ангине и неосложненных формах хронического тонзиллита не всегда оправданно, тем более без четкого представления о возбудителе.
На этих стадиях заболевания, еще не отягощенных суперинфекцией, альтернативным лечением может стать гомеопатия. Это регулирующая терапия, воздействующая на процессы саморегуляции с помощью лекарств, подобранных индивидуально с учетом реакции больного. С позиций классической гомеопатии ангина и хронический тонзиллит являются не локальными заболеваниями, а частным проявлениями конституционной слабости и наследственной предрасположенности.
1 В зарубежной литературе широко используются взаимозаменяемые термины "тонзиллофарингит" и "фарингит".
Читайте также:

