Стрептококк пневмонии у новорожденного
Обновлено: 18.04.2024
Успехи медицины ощутимы, пожалуй, больше всего в лечении пневмонии у детей— одного из самых частых, серьезных, потенциально угрожающих жизни заболеваний, которое среди причин смерти ушло с первого места далеко в середину и&n
Успехи медицины ощутимы, пожалуй, больше всего в лечении пневмонии у детей— одного из самых частых, серьезных, потенциально угрожающих жизни заболеваний, которое среди причин смерти ушло с первого места далеко в середину и даже в конец списка. Но это не меняет серьезного отношения к пневмонии, поскольку хороший ее прогноз зависит от своевременности диагноза и правильности лечебной тактики.
Диагностика
Для пневмонии типично наличие кашля, нередки и другие признаки острого респираторного заболевания (ОРЗ), а также, в большинство случаев, температура >38°С (исключение— атипичные формы в первые месяцы жизни), без лечения она держится 3 дня и дольше, тогда как при бронхитах обычно температура
Первая задача в диагностике— выявить у ребенка с признаками ОРЗ поражение нижних дыхательных путей, для них характерно наличие хотя бы одного из следующих признаков, легко распознаваемых при осмотре ребенка:
Вторая задача— отличить пневмонию от бронхита— преимущественно вирусного поражения нижних дыхательных путей. Важный симптом пневмонии— учащение дыхания, оно наблюдается тем чаще, чем обширнее поражение легких и чем меньше ребенок. Однако этот признак значим только при отсутствии симптомов обструкции, которая характерна для крупа и бронхитов, в т.ч. обструктивного. Следующие параметры частоты дыхания (в 1 мин.), по данным ВОЗ, характерны для пневмонии: ≥60 у детей 0–2 мес, ≥50— 2–12 мес, ≥40— 1–4 лет. Бронхиальная обструкция с высокой вероятностью исключает типичную (вызванную пневмококками, гемофильной палочкой, стрептококками) внебольничную пневмонию и встречается лишь при атипичных формах и внутрибольничном заражении.
Укорочение перкуторного звука характерно для пневмонии, но оно встречается лишь в половине случаев, так что его отсутствие не исключает пневмонии. Это же относится и к локализованным над местом поражения мелкопузырчатым или крепитирующим хрипам и ослабленному и/или бронхиальному дыханию— их выявление позволяет поставить диагноз пневмонии, но их отсутствие этот диагноз не исключает. У половины всех больных с типичной пневмонией в остром периоде хрипы отсутствуют. С другой стороны, хрипы, равномерно выслушиваемые в обоих легких, как и обструкция, характерны для бронхитов, но не для пневмонии: сухие хрипы обнаруживаются только у 10%, а рассеянные влажные— у 25% больных, чаще всего они асимметричны (в основном, при атипичных формах).
Поскольку диагноз пневмонии по указанным выше физикальным данным удается поставить менее чем в половине случаев, следует использовать алгоритм, созданный на основании предложенных ВОЗ признаков (рис.). Он позволяет выявить больных, у которых при рентгеновском исследовании с высокой вероятностью будут обнаружены пневмонические изменения; в отсутствие рентгена вполне оправдана их антибактериальная терапия.
Алгоритм освобождает педиатра от необходимости ставить диагноз при недостатке информации. Он позволяет снизить гипердиагностику пневмонии и сократить число необоснованных рентгеновских снимков и назначений антибиотиков; его чувствительность— 94%, а специфичность— 95%.
В какой степени помогают диагностике лабораторные данные? Лейкоцитоз 10–15·10 9 /л наблюдается в первые дни у половины больных пневмонией, но также и у трети больных с ОРЗ, крупом, острым бронхитом. Так что сам по себе он не говорит о бактериальной инфекции и не требует назначения антибиотиков. Но и число лейкоцитов ниже 10·10 9 /л не исключает пневмонии, оно характерно для пневмоний, вызванных гемофильной палочкой и микоплазмой, а также нередко наблюдается при кокковой пневмонии в первые дни болезни. Цифры лейкоцитоза выше 15·10 9 /л (и/или абсолютное число нейтрофилов ≥10·10 9 /л и/или палочкоядерных форм ≥ 1,5·10 9 /л) делают диагноз пневмонии весьма вероятным. Это же относится и к повышению СОЭ выше 30 мм/ч, более низкие цифры не исключают пневмонию, но они нередки и при бронхитах.
Из дополнительных маркеров бактериальной инфекции в диагностике помогает С-реактивный белок (СРБ), уровни которого >30 мг/л, а также уровни прокальцитонина >2 нг/мл позволяют на 90% исключить вирусную инфекцию. Но низкие уровни этих маркеров могут наблюдаться при пневмониях, чаще атипичных, так что их отрицательная прогностическая ценность в отношении диагноза пневмонии недостаточна.
Классификация
Наиболее важным классификационным признаком пневмонии является место ее возникновения— внебольничные и внутрибольничные пневмонии резко отличаются по этиологии и, следовательно, требуют разных терапевтических подходов. Внебольничные пневмонии возникают у ребенка в обычных условиях его жизни, внутрибольничные— через 72 ч пребывания в стационаре или в течение 72 ч после выписки оттуда. Отдельно классифицируют пневмонии новорожденных, к внутриутробным относят пневмонии, развившиеся в первые 72 ч жизни ребенка. Различают также пневмонии, ассоциированные с искусственной вентиляцией легких (ИВЛ) (ранние— первые 72 ч и поздние) и пневмонии у лиц с иммунодефицитными состояниями.
Практически важно различать типичные пневмонии, вызванные кокковой или бактериальной флорой, они выглядят на рентгенограмме как легочные очаги или инфильтраты достаточно гомогенного вида с четкими контурами; клинически это больные с фебрильной лихорадкой, часто токсичные, нередко с локальными необильными хрипами и притуплением перкуторного звука. Атипичные пневмонии, обусловленные микоплазмой, хламидиями и, редко, пневмоцистами, выглядят как негомогенные инфильтраты без четких границ или диссеминированные очаги; их отличает обилие мелкопузырчатых влажных хрипов, крепитации с двух сторон, обычно асимметричные с преобладанием над пневмоническим фокусом. Характерно отсутствие токсикоза, хотя температурная реакция может быть выраженной, как при микоплазмозе, или отсутствовать (у детей 1–6 мес с хламидиозом).
Тяжесть пневмонии обусловливается токсикозом, легочно-сердечной недостаточностью, наличием осложнений (плеврит, инфекционно-токсический шок, очагово-сливная форма чревата легочной деструкцией). При адекватном лечении большинство неосложненных пневмоний рассасывается за 2–4 недели, осложненные— за 1–2 месяца; затяжное течение диагностируется при отсутствии обратной динамики в сроки от 1,5 до 6 месяцев.
Этиология пневмоний
Расшифровывается с большим трудом, поскольку требует выделения возбудителя из в норме стерильных сред; поэтому лечение пневмонии начинают эмпирически исходя из данных о частоте той или иной этиологии в данном возрасте при соответствующей клинической картине (см. ниже). Обнаружение пневмотропной (пневмококки, гемофильная палочка, стрепто- и стафилококки) или кишечной флоры, а также вирусов, микоплазм, хламидий, грибков, пневмоцист в мокроте не говорит о их роли как возбудителя, т.к. их носительство скорее правило, чем исключение. Нарастание титров антител к пневмотропным возбудителям имеет относительное значение, так как часто наблюдается при любом ОРЗ (поликлональная активация иммунной системы). Более надежно выявление в крови антител класса IgM к микоплазме и Chlamydia trachomatis, в меньшей степени к C. pneumoniae. Приводимые ниже данные о бактериальной этиологии пневмоний у детей разного возраста основаны на исследованиях по выявлению возбудителя или его антигена в пунктатах легкого и плевральной полости, антител к хламидиям и микоплазме, пневмококковых иммунных комплексов.
Новорожденные. Этиологический спектр пневмоний во многом зависит от характера инфицирования (табл. 1). Нередко пневмонии имеют септическое происхождение. Респираторные вирусы могут вызывать инфекцию только верхних дыхательных путей или бронхит, однако она часто осложняется бактериальной пневмонией либо появлением в легких ателектазов и участков вздутия, что также соответствует критериям пневмонии.
Дети 1–6 месяцев. В этом возрасте часто наблюдается два вида пневмоний. Для вызываемых C. trachomatis пневмоний характерно постепенное начало без температуры, кашель стокатто, тахипноэ, мелкопузырчатые хрипы, отсутствие обструкции, лейкоцитоз (часто >30·10 9 /л) и эозинофилия (>5%), на снимках— множество мелких очажков (как при милиарном туберкулезе). В анамнезе— влагалищные выделения у матери и конъюнктивит на первом месяце жизни. Стафилококковые пневмонии вне стационара возникают редко— у детей первых месяцев жизни и иммунодефицитных, чаще имеет место внутрибольничные заболевания, обусловленными штаммами, резистентными к пенициллину, а часто— и к метициллину. При аэрогенном заражении в легких возникают сливные очаги со склонностью к некрозу, при сепсисе— очаг в интерстиции с последующим формированием абсцессов. Характерен лейкоцитоз >25·10 9 /л. Аспирационная пневмония может проявляться как острая, с токсикозом, высокой температурой, одышкой или как малосимптомная с картиной бронхита. Бактериальный процесс обусловлен кишечной флорой, часто полирезистентной (Proteus spp., K.pneumoniae, Р.aeruginosa), а также анаэробами. Ее локализация— правая, реже левая верхняя доля; в фазе обратного развития она имеет вид негомогенной тени, часто с вогнутой нижней границей. Разрешение пневмонии длительное. Диагноз подтверждает выявление дисфагии (наблюдение за кормлением!), рентгеноконтрастное исследование пищевода позволяет выявить рефлюкс и аномалии пищевоа.
Внебольничные пневмонии в первые недели жизни обычно возникают при заражении от старшего ребенка в семье и вызываются кокковой или бактериальной флорой. В этом возрасте обычны пневмонии, обусловленные иммунодефицитом, муковисцидозом, так что всех детей с пневмонией следует обследовать в этом направлени.
В возрасте 6 месяцев— 5 лет основная масса пневмоний типичные, они вызываются пневмококками, 5–10%— гемофильной палочкой типа b; лишь 10–15%— микоплазмой и C.pneumoniae. Пневмококковая пневмония может протекать как неосложненная с умеренным токсикозом, но в этом возрасте она часто сопровождается образованием крупных очагов с последующей деструкцией и образованием внутрилегочных полостей, часто сопровождается плевритом. Типичная крупозная пневмония свойственна подросткам. Пневмония, вызыванная гемофильной палочкой типа b, встречается практически только до 5-летнего возраста, она сопровождается гомогенным инфильтратом с плевритом и деструкцией. Заподозрить ее помогает невысокий лейкоцитоз и СОЭ, геморрагический экссудат. Стрептококковая пневмония, вызванная гемолитическим стрептококком группы А, развивается лимфогенно из очага в зеве— чаще у детей 2–7 лет. Характерен выраженный интерстициальный компонент с очагами в обоих легких (часто с полостями), плевритом. Клиническая картина с бурным началом неотличима от таковой при пневмококковой пневонии.
Дети и подростки 5–17 лет. В этом возрасте пневмококк остается практически единственным возбудителем типичных пневмоний, которые составляют лишь 40–60% всех пневмоний, тогда как остальные пневмонии— атипичные, вызываются микоплазмой и хламидиями. M. pneumoniae вызывает до 45% всех пневмоний у подростков. Характерны: кашель, масса мелкопузырчатых хрипов, чаще асимметричных, покраснение конъюнктив при скудных катаральных симптомах, негомогенный инфильтрат, нормальное число лейкоцитов и несильно повышенная СОЭ; температура выше 39°С обычно сочетается с нетяжелым состоянием, что часто ведет к позднему (на 9–12-й день) обращению. C.pneumoniае в этом возрасте вызывает 15–25% пневмоний, иногда она сочетается с фарингитом и шейным лимфаденитом; характерны лихорадка, развитие бронхоспазма. Изменения крови не характерны. Без лечения течет длительно. Диагностические критерии не разработаны, в пользу этой этиологии говорят антитела класса IgM (микро-ИФА) в титре 1:8 и выше, IgG— 1:512 и выше или 4-кратное нарастание их титра.
Осложнения пневмоний. Пневмококки ряда серотипов, стафилококки, H.influenzae типа b, БГСА, клебсиеллы, синегнойная палочка, серрации вызывают синпневмонический гнойный плеврит и рано нагнаивающиеся инфильтраты с полостями деструкции в легких. Снижение иммунного ответа (первичный иммунодефицит, недоношенность, тяжелая гипотрофия) или эффективности очищения бронхов (муковисцидоз, инородное тело, аспирация пищи и др.) утяжеляют процесс. До опорожнения гнойника нагноение сопровождается стойкой лихорадкой и нейтрофильным лейкоцитозом, оно часто сочетается с серозно-фибринозным метапневмоническим плевритом, имеющим иммунопатологическую природу; для него характерны 5–7-дневная лихорадка, повышение СОЭ на 2-й неделе болезни.
Дыхательная недостаточность характерна для диссеминированных процессов (пневмоцистоз, хламидиоз у детей 0–6 мес). Токсические осложнения (нарушения со стороны ЦНС, сердца, микроциркуляции, кислотно-щелочного состояния, диссеминированного внутрисосудистого свертывания (ДВС)) зависят от тяжести процесса и адекватности терапии. Их следует отличать от компенсаторных сдвигов (гиперкоагуляция, олигурия, снижение объема циркулирующей крови менее чем на 25%, уровня гемоглобина и сывороточного железа, компенсированный ацидоз), коррекция которых нецелесообразна и может быть опасной.
Новорожденные (табл. 2). Для эмпирического лечения пневмоний, возникших в первые 3 дня после родов (в т. ч на ИВЛ) используют ампициллин (или амоксициллин/клавуланат) в комбинации с аминогликозидом или цефалоспорином III поколения. Возникшие в более поздние сроки нозокомиальные пневмонии требуют введения в комбинации с цефалоспоринами аминогликозидов, ванкомицина, а при высеве псевдомонад— цефтазидима, цефоперазона или имипенема/циластатина.
Дети 1–6 месяцев жизни. Препараты выбора при атипичных пневмониях (чаще всего хламидийной)— макролиды. Азитромицин эффективен как в дозе 10 мг/кг/сут курсом 5 дней, так и в виде 1 дозы 30 мг/кг. С учетом опасности пилоростеноза у детей 0–2 месяцев при использовании эритромицина и азитромицина обосновано применение 16-членных макролидов (мидекамицин 50 мг/кг/сут, джозамицин 30–50 мг/кг/сут, спирамицин 150 000 МЕ/кг/сут) с менее выраженным прокинетическим действием; длительность курса— 7–10 дней. Поскольку сходная клиническая картина у пневмоцистоза, при неэффективности макролидов уместно ввести ко-тримоксазол (10–15 мг/кг/сут по триметоприму). При типичных пневмониях удобна стартовая терапия в/в амоксициллином/клавуланатом (90 мг/кг/сут), в/в или в/м цефуроксимом (50 мг/кг/сут), цефотаксимом (100 мг/кг/сут) или цефтриаксоном (80 мг/кг/сут) для подавления как вероятной грамотрицательной флоры, так и пневмококков.
Дети старше 6 мес (табл. 3). При тяжелой, в т.ч. осложненной, пневмонии антибиотик вводят парентерально и срочно госпитализируют больного; используют, в основном, бета-лактамные препараты, при наступлении эффекта их заменяют на оральные. О тяжести говорит наличие у больного хотя бы одного из следующих симптомов, независимо от уровня температуры:
токсикоз (больной вид, отказ от еды и питья, сонливость, нарушение сознания, резкая бледность при повышенной температуре).
При неосложненной внебольничной пневмонии— в отсутствие указанных выше признаков тяжести— и при сомнении в диагнозе у нетяжелых больных начало терапии можно отложить до рентгенологического подтверждения. Используют оральные препараты, их выбор определяется характером пневмонии. При признаках типичной пневмонии назначают бета-лактамные препараты, при атипичной— макролиды. В сомнительных случаях оценивают эффект лечения через 24–36 часов и, при необходимости, меняют препарат либо, при невозможности оценки, назначают 2 препарата разных групп сразу. Достижение эффекта от назначения макролидов не обязательно указывает на атипичный характер пневмонии, поскольку они действуют (хотя и не во всех случаях) на пневмококки. Длительность лечения неосложненных форм— 5–7 дней (2–3 дня после падения температуры). При пневмоцистозе (частом у ВИЧ-инфицированных) используют ко-тримоксазол в дозе 20 мг/кг/сут (расчет по триметоприму).
Из препаратов для приема внутрь на сегодняшний день особый интерес представляют антибиотики, выпускающиеся в лекарственной форме Солютаб— так называемые диспергируемые таблетки. К ним относят Флемоксин (амоксициллин), Флемоклав (амоксициллин/клавуланат), Вильпрафен (джозамицин) и Юнидокс (доксициклин). Антибиотики в форме Солютаб позволяют выбрать удобный для каждого пациента способ приема (их можно принимать целиком, либо растворять в воде), обеспечивают наиболее высокую биодоступность среди аналогов, выпускающихся в твердой лекарственной форме, они гораздо проще суспензий в приготовлении и хранении. Применение амоксициллина/клавуланата в форме Солютаб позволяет значительно сократить частоту диареи, характерной для данной группы антибиотиков.
При выборе препарата для лечения внутрибольничных пневмоний (табл. 4) следует учитывать предыдущую терапию; оптимально лечение по бактериологическим данным. Фторхинолоны используют у лиц >18 лет, у детей— только по жизненным показаниям. При анаэробных процессах используют амоксициллин/клавуланат, метронидазол, при грибковых— флуконазол.
Другие виды терапии. В остром периоде дети практически не едят; появление аппетита— признак улучшения. Витамины вводят при неправильном питании до болезни.
Соблюдение питьевого режима (1 л/сут и более), оральная гидратация обязательны. Внутривенное введение жидкости в большинстве случаев не показано, при необходимости введения в вену препаратов общий объем жидкости не должен превышать 20–30 мл/кг/сут; инфузии кристаллоидов более 50–80 мл/кг/сут чреваты развитием отека легких 2 типа.
У больных с массивным инфильтратом, гнойным плевритом (цитоз >5 000), гиперлейкоцитозом оправдано введение антипротеаз (Контрикал, Гордокс) для профилактики деструкции— но только в первые 2–3 дня болезни В случае развития ДВС-синдрома (обычно в сочетании с нарушением микроциркуляции— мраморность кожи, холодные конечности при высокой температуре) показано назначение гепарина в/в или п/к (200–400 ЕД/кг/сут в 4 приема), Реополиглюкина— 15–20 мл/кг/сутки, бикарбоната, стероидов. Инфекционно-токсический шок требует введения вазотонических средств (Адреналин, Мезатон), стероидов, борьбы с ДВС-синдромом. Эффективен плазмоферез. Внутрилегочные полости после опорожнения обычно закрываются, к дренированию напряженных полостей по Мональди либо окклюзии приводящего бронха в настоящее время приходится прибегать редко.
Лечение дисфагий у грудных детей с аспирационной пневмонией предусматривает подбор позиции кормления, густоты пищи, отверстия соски. При неуспехе этих мер— кормление через зонд или гастростому, устранение гастроэзофагального рефлюкса. Антибиотики назначают в остром периоде (защищенные пенициллины, цефалоспорины II–III поколения с аминогликозидами), вне обострения, даже при обилии мокроты и хрипов, их не вводят. Гиперсекрецию слизи снижают противогистаминными препаратами курсами до 2 недель.
Синпневмонический плеврит специальных назначений не требует, внутриплевральное введение антибиотиков нецелесообразно, дренирования требует сдавление легкого (редко) и быстрое накопление экссудата после 1–2 повторных пункций (неэффективность антибиотика). Метапневмонический плеврит усиления антибактериальной терапии не требует, при сохранении температурных волн— нестероидные противовоспалительные препараты (ибупрофен, диклофенак), стероиды (преднизолон 1 мг/кг/сут) 2–5 дней. Дренирование не показано, рассасыванию фибрина способствует лечебная физкультура.
По вопросам литературы обращайтесь в редакацию.
В. К. Таточенко, доктор медицинских наук, профессор
Стрептококковая пневмония – это инфекционное воспаление ткани легких, развивающееся при участии патогенных бактерий рода Streptococcus. Заболевание чаще поражает детей, в основном возникает как осложнение других респираторных инфекций. Стрептококковая пневмония протекает с лихорадкой, кашлем, одышкой, болями в груди; нередко осложняется гнойным плевритом, перикардитом, абсцедированием, гломерулонефритом. Диагноз верифицируется с помощью рентгенографии легких, определения стрептококка в мокроте, крови или плевральном аспирате. При подтверждении стрептококковой этиологии пневмонии предпочтительно назначение пенициллинов; при наличии выпота может потребоваться проведение торакоцентеза.
МКБ-10
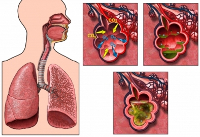
Общие сведения

Причины
Представители рода Streptococcus являются возбудителями широкого спектра стрептококковых инфекций. Чаще всего данные микроорганизмы вызывают фарингит, тонзиллит, синуситы, скарлатину, отит, импетиго, однако также могут становиться причиной менингита, сепсиса новорожденных, инфекционного эндокардита, абсцессов головного мозга и брюшной полости.
Инфекции нижних дыхательных путей – трахеобронхит и стрептококковая пневмония встречаются нечасто. Бета-гемолитические стрептококки группы A обычно вызывают пневмонию у детей, а также пациентов, страдающих сахарным диабетом и другими тяжелыми сопутствующими заболеваниями. Известны случаи массовой заболеваемости солдат, проходящих воинскую службу (самая крупная эпидемия стрептококковой пневмонии возникла в первую мировую войну), однако обычно встречаются спорадические случаи.
Способ проникновения стрептококка в дыхательные пути – воздушно-капельный. Заболеваемость стрептококковой пневмонией выше осенью и весной, в периоды вспышек ОРВИ. В большинстве случаев бактериальная инфекция легких осложняет такие заболевания, как грипп, корь, коклюш, ветряная оспа, внезапная экзантема. Поражение легких чаще всего проявляется в форме сегментарной или интерстициальной пневмонии, реже – очаговой или долевой пневмонии.
Патогенез
Попадая в дыхательные пути, стрептококк вызывает изъязвление и некроз слизистой оболочки трахеи и бронхов, сопровождающийся обильной экссудацией и геморрагиями. В легочной ткани патологические изменения обычно затрагивают межальвеолярные перегородки. По лимфатической системе стрептококковая инфекция быстро распространяется на лимфатические узлы корня легкого и средостения. Гематогенным путем гноеродная флора проникает в плевральную полость: выпот при стрептококковой пневмонии обычно обильный, по характеру - серозный (серозно-геморрагический) или жидкий гнойный.
Симптомы стрептококковой пневмонии
Характерной особенностью стрептококковой пневмонии является частое присоединение парапневмонического плеврита и эмпиемы плевры, которые возникают уже на 2-3 день заболевания. Данные осложнения встречаются почти у 60% детей и 50% взрослых. Несколько реже (у 35% пациентов) отмечается гнойный перикардит, формирование легочных абсцессов в зоне пневмонического очага. Случаи гнойного артрита, остеомиелита и гломерулонефрита встречаются еще реже.
Отдельно выделяют стрептококковую пневмонию новорожденных, которая манифестирует в первые 5-7 дней жизни ребенка. Чаще всего она служит проявлением внутриутробного сепсиса, вызванного стрептококковой инфекцией. Такая пневмония протекает с тяжелыми дыхательными расстройствами (тахипноэ, диспноэ, эпизодами апноэ, диффузным цианозом, нарастающей гипоксемией).
Диагностика
При этиологической верификации пневмонии пульмонолог учитывает анамнез (перенесенные вирусные и бактериальные инфекции), острое начало, ранее присоединение плеврита. Перкуторные и аускультативные данные при стрептококковой пневмонии скудные, что объясняется небольшими размерами пневмонических очагов. Между тем, в общем анализе крови с первых дней заболевания отмечается выраженный лейкоцитоз (до 20-30х10 9 /л), сдвиг лейкоцитарной формулы влево.
Рентгенография легких выявляет рассеянные инфильтративные тени, чаще в средней и нижней долях. При формировании абсцесса определяется полость с горизонтальным уровнем жидкости; на развитие плеврита указывает интенсивное гомогенное затемнение с косой верхней границей. Для установления характера экссудата (серозного или гнойного) выполняется плевральная пункция.
Важной частью подтверждения диагноза стрептококковой пневмонии является бактериологический посев мокроты. Культура стрептококка также может быть выделена из других биологических сред – крови, плеврального экссудата. На стрептококковую этиологию пневмонии может указывать нарастание титров антистрептолизина-О (АСЛ-О) в крови пациента. Дифференциальную диагностику следует осуществлять с другими видами пневмоний (пневмококковой, стафилококковой, атипичной и др.).
Лечение стрептококковой пневмонии
Принципы лечения стрептококковой пневмонии не отличаются от основных подходов к лечению бактериальной пневмонии в целом. Основные звенья включают назначение постельного режима на период лихорадки, проведение антибиотикотерапии, дезинтоксикационных мероприятий, реабилитационных процедур.
Антибиотиками первого ряда при стрептококковой пневмонии выступают пенициллины (пенициллин G, карбенициллин, ампициллин, амоксициллин), которые часто применяются в комбинации с аминогликозидами. Препаратами второго и третьего ряда соответственно являются макролиды и цефалоспорины 2-го поколения. Антибиотики вначале вводятся парентерально, затем после наступления клинического улучшения - внутрь в течение 2-3-х недель.
В целях дезинтоксикации, коррекции водно-электролитного баланса и восполнения белковых потерь осуществляется внутривенное введение глюкозы, водно-солевых растворов, переливание плазмы. При осложнении стрептококковой пневмонии плевритом (серозным или гнойным) показан повторный торакоцентез или закрытое дренирование плевральной полости с аспирацией экссудата и последующими промываниями антисептиками или антибиотиками.
В позднем периоде, после купирования лихорадочно-интоксикационного синдрома, назначается физиотерапевтическая реабилитация (лекарственный электрофорез, УВЧ, индуктотермия, СВЧ-терапия, ингаляционная терапия), массаж грудной клетки, ЛФК.
Прогноз и профилактика
В целом летальность от стрептококковой пневмонии невысока. Затяжное течение заболевания и гнойные осложнения при своевременной и рациональной антибиотикотерапии встречаются редко. Профилактика заключается в укреплении защитных функций организма, санации очагов стрептококковой инфекции в носоглотке. Мерой специфической профилактики осложнений является вакцинация детей и пожилых людей от пневмококковой инфекции.
2. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике (Пособие для врачей)/ Чучалин А.Г., Синопальников А.И., Козлов Р.С., Тюрин И.Е., Рачина С.А.// Клиническая микробиология и антимикробная химиотерапия. – 2010 – Т.12, №3.
3. Микробиологические аспекты внебольничных пневмоний пневмококковой этиологии у лиц молодого возраста в закрытых коллективах: Автореферат диссертации/ Мартынова А.В. – 2005.
4. Эпидемиологические аспекты пневмококковых инфекций и молекулярно-генетическая характеристика Streptoroccus pneumonia: Автореферат диссертации/ Мартынова А.В. – 2008.
Внутриутробная пневмония – воспаление легочной ткани, возникшее антенатально, сопровождающееся развитием клинических проявлений в первые 72 часа жизни ребенка. Проявляется выраженной дыхательной недостаточностью, явлениями респираторного дистресс-синдрома, интоксикацией, неврологическими нарушениями вследствие отека мозга и др. Внутриутробная пневмония диагностируется рентгенологически, лабораторные исследования позволяют выявить конкретного возбудителя инфекции. Показана этиотропная терапия (антибиотики, противовирусные препараты и др.), кислородотерапия, коррекция симптомов полиорганной недостаточности.
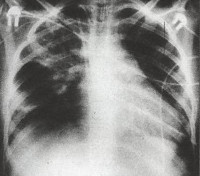
Общие сведения
Внутриутробная пневмония – одна из наиболее часто встречающихся патологий в структуре внутриутробных инфекций. Примерно 30% всех внутриутробных пневмоний протекает в виде локализованных форм, в остальных случаях воспаление легких у новорожденных возникает в рамках генерализованной внутриутробной инфекции. В настоящее время внутриутробные пневмонии продолжают представлять опасность. Средний показатель заболеваемости – около 2 случаев на 1000 новорожденных, также на долю заболевания приходится до 80-90% младенческой смертности. Отдельный акцент делается на внутриутробной пневмонии, вызванной условно-патогенной флорой. Во-первых, оппортунистическим микроорганизмам, как правило, не уделяется должного внимания. Во-вторых, именно они часто остаются резистентными к терапии.
Внутриутробная пневмония остается актуальной проблемой современной педиатрии. Даже будучи успешно вылеченной, болезнь наносит серьезный удар по детскому иммунитету. Впоследствии любая простуда легко может осложняться пневмонией. Если диагностика была запоздалой, высок риск развития осложнений, опасных для жизни (плеврит, сепсис и др.). Часто у детей, перенесших внутриутробную пневмонию, развивается спаечный процесс в плевре, что ведет к хронической дыхательной недостаточности с неизбежной инвалидностью.

Причины внутриутробной пневмонии
Внутриутробная пневмония одинаково часто вызывается бактериями и вирусами, реже – бактериально-вирусными ассоциациями и грибами. Бактерии, наиболее часто являющиеся причинами инфекции, – стрептококк, стафилококк, энтерококк, кишечная палочка, микоплазма и др. Вирусная внутриутробная пневмония развивается, как правило, при участии вирусов TORCH-группы, вирусов гриппа и др. Грибковая этиология связана с грибами рода Candida. Особую роль играют ИППП, которые также могут быть причиной заболевания. Встречается также врожденная сифилитическая пневмония.
Помимо причин заболевания, существует множество факторов риска, способствующих развитию внутриутробной пневмонии. Отдельно выделяют факторы риска со стороны матери и со стороны плода. К акушерско-гинекологическим патологиям, повышающим вероятность развития заболевания, относятся аборты и выкидыши в анамнезе женщины, патологии родов, гестозы и хронические заболевания малого таза, в том числе вследствие широкого применения внутриматочных контрацептивов. К факторам риска со стороны плода относится недоношенность и низкая масса ребенка при рождении, воспалительные процессы в плаценте и фетоплацентарная недостаточность.
Существует два пути заражения плода – восходящий и гематогенный. Первый из них подразумевает наличие у матери инфекции внутренних половых органов, чаще бактериальной природы. Гематогенный путь инфицирования – это трансплацентарное проникновение возбудителя через пупочную вену в кровь плода, характерное в большей степени для внутриутробной пневмонии вирусной этиологии. Независимо от ворот инфекции, микроорганизм попадает в кровь плода и уже оттуда достигает легочной ткани. Поскольку в утробе матери ребенок не дышит воздухом, инфекционный агент остается в тканях бессимптомно до момента родов. С первых вдохом кровоснабжение в легких резко возрастает. Именно этот момент является пусковым, и внутриутробная пневмония начинает проявляться клинически.
Классификация внутриутробных пневмоний
Этиологически выделяют бактериальную, вирусную и грибковую внутриутробную пневмонию, иногда встречаются бактериально-вирусные инфекции. По степени тяжести заболевание делится на легкую, средней тяжести и тяжелую формы. В зависимости от момента заражения внутриутробная пневмония бывает врожденной и интранатальной, когда инфицирование происходит в момент прохождения плода по родовым путям. Течение заболевания может быть острым и затяжным, с осложнениями и без. Различают легочные осложнения в виде пневмоторакса, ателектаза, абсцедирования легкого, а также внелегочные осложнения, основными из которых являются менингит, поражение оболочек сердца и сепсис. Отдельно выделяют 3 степени дыхательной недостаточности.
Симптомы внутриутробной пневмонии
Часто развиваются осложнения со стороны легких, такие как пневмоторакс, ателектаз легкого, респираторный дистресс-синдром, абсцессы легкого, сепсис. Внутриутробная пневмония редко встречается как локализованное заболевание. В связи с этим всегда имеются другие, внелегочные симптомы внутриутробных инфекций: со стороны нервной, сердечно-сосудистой, пищеварительной системы, органов слуха и зрения. У недоношенных детей заболевание протекает тяжелее, вероятность осложнений всегда выше.
Неврологическая симптоматика представлена запрокидыванием головы назад, повышением или снижением мышечного тонуса. Среди осложнений – менингит, который особенно часто встречается при микоплазменной внутриутробной пневмонии. Неврологические расстройства связаны в первую очередь с отеком мозговых оболочек, причиной которого является дыхательная недостаточность. Примерно у половины заболевших детей диагностируются гастроинтестинальные нарушения, в частности, срывания и позывы на рвоту, метеоризм, парез кишечника. Таким образом, при внутриутробной пневмонии речь часто идет о полиорганной недостаточности, основные причины которой – генерализация инфекции и общее нарушение кровообращения.
Диагностика внутриутробной пневмонии
Дыхательная недостаточность легко выявляется при физикальном осмотре ребенка. На рентгенограмме легких заметно усиление легочного рисунка, перибронхиальные изменения, многочисленные очаги инфильтрации легочной ткани. Изменения на рентгенограмме сохраняются до месяца с момента начала острой фазы внутриутробной пневмонии. В тяжелых случаях инфекции возможно отсутствие признаков заболевания по данным рентгенографии легких в течение первых трех дней.
Лабораторная диагностика внутриутробной пневмонии включает общий и биохимический анализ крови, мазок из зева на флору, микробиологическое исследование трахеобронхиального аспирата, анализ отделяемого из полости носа. Анализ крови позволяет выявить признаки воспалительного процесса, анемию разной степени, гипербилирубинемию и др. Обязательно проводятся серологические исследования (ИФА-диагностика) для обнаружения различных классов антител к конкретным возбудителям. В отношении диагностики вирусной этиологии внутриутробной пневмонии эффективен метод ПЦР. Необходимо выявление первичного очага инфекции у матери.
Лечение внутриутробной пневмонии
Лечение проводится в отделении интенсивной терапии или реанимации новорожденных. В зависимости от выраженности дыхательной недостаточности используются различные методы кислородной поддержки: кислородная маска, ИВЛ. Этиотропная терапия внутриутробной пневмонии – антибиотики, противовирусные, противогрибковые препараты – может назначаться эмпирически, либо подбираться исходя из других признаков, патогномоничных для конкретных внутриутробных инфекций (краснуха, токсоплазмоз, хламидиоз и др.). Список антибиотиков ограничен возрастом, противопоказано применение препаратов аминогликозидного ряда.
Недоношенным детям обязательно назначение сурфактантов, способствующих развитию легочной ткани и расправлению спавшихся альвеол. Санация трахеобронхиального дерева проводится практически всем детям, частота регулируется тяжестью состояния. Проводятся дегидратационные мероприятия, детоксикация солевыми растворами, коррекция ацидоза, анемии, нарушений свертываемости крови, симптоматическая терапия. Переливание эритроцитарной массы осуществляется по показаниям. По окончании острой фазы внутриутробной пневмонии показана физиотерапия.
Прогноз и профилактика внутриутробной пневмонии
Прогноз внутриутробной пневмонии определяется конкретной нозологией и тяжестью состояния. Заболевание было и остается одной из основных причин детской смертности. Более благоприятное течение отмечается при внутриутробной пневмонии стафилококковой этиологии (кроме золотистого стафилококка) и вирусного генеза. Частота летального исхода выше в случае инфицирования энтерококками, кишечной палочкой, микоплазмой, золотистым стафилококком; особенно опасны бактериально-вирусные ассоциации. Также уровень смертности повышается в случае развития осложнений, в частности, сепсиса.
Первичная профилактика внутриутробной пневмонии сводится к определению возможных факторов риска заболевания у беременной женщины. Это обеспечит высокую настороженность и готовность медицинского персонала к реанимационным мероприятиям непосредственно в родовом зале. Также необходима своевременная диагностика внутриутробных инфекций, поскольку клиника многих из них включает поражение легких в виде внутриутробной пневмонии. Всем детям, перенесшим заболевание в период новорожденности, проводится профилактика повторной пневмонии: витаминотерапия, массаж, гимнастика и др.
Пневмония у новорожденных — это острое инфекционно-воспалительное поражение респираторных отделов легких. Основные причины: возбудители TORCH-комплекса, стрептококки и стафилококки, хламидии, другие патогены, колонизирующие родовые пути матери. Заболевание проявляется синдромом дыхательных расстройств, инфекционным токсикозом, неврологическими нарушениями. Для диагностики неонатальных пневмоний проводят рентгенографию ОГК, бакпосев мокроты, серологические и общеклинические исследования крови. Лечение включает этиотропную антибиотикотерапию, кислородную поддержку, патогенетические медикаменты (иммуномодуляторы, инфузионные растворы).
МКБ-10
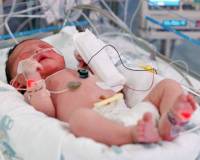
Общие сведения
Пневмония — одна из основных проблем практической неонатологии. Заболеваемость составляет около 1% среди доношенных новорожденных и до 10% среди недоношенных. У младенцев, которые сразу после рождения находились на длительной ИВЛ, распространенность нозокомиальной пневмонии составляет до 40-45%. Воспаление легких рассматривается в качестве основной причины или сопутствующего фактора до 25% летальных исходов в период неонатальности. По данным Росстата, младенческая смертность от пневмонии достигает 7,5%.

Причины
У новорожденного собственный иммунитет крайне низкий, а все системы органов находятся в состоянии транзиторных приспособительных реакций и еще не адаптировались к смене условий после рождения. Поэтому младенцы очень чувствительны к любым видам инфекций, от которых преимущественно страдают кожа и респираторный тракт. Этиологическая структура неонатальных пневмоний отличается от таковой у старших детей и взрослых. Конкретные причины зависят от пути заражения:
- Трансплацентарный. В утробе матери ребенок чаще сталкивается с инфекциями TORCH-комплекса, которые имеют тропность к эпителию дыхательных путей, — с краснухой, токсоплазмозом, простым герпесом и цитомегаловирусом. В редких случаях происходит заражение сифилисом и туберкулезом.
- Интранатальный. Во время родов основной путь инфицирования — контактный, который реализуется при прохождении через материнские родовые пути. Если они не санированы, новорожденный может заразиться хламидиями, кишечной палочкой микоплазмой и уреаплазмой. Чаще других встречается хламидийная пневмония (33% случаев).
- Постнатальный. После рождения заражение младенца может произойти в стационаре, особенно, если ему проводят инвазивные манипуляции или кислородную поддержку. Здесь на первый план выходят золотистые стафилококки, синегнойная палочка, вирусы гриппа и парагриппа. Причины постнатальных пневмоний также включают грибы рода Кандида, аденовирусы, микобактерии туберкулеза.
Основной предрасполагающий фактор пневмонии у новорожденных — недоношенность, которая в 10 раз повышает риск заболевания. На втором месте стоят дыхательные нарушения, требующие интубации и применения ИВЛ. Частота пневмоний возрастает у детей с врожденными аномалиями дыхательных путей. Легочному воспалению способствует желудочно-пищеводный рефлюкс, при котором зачастую развивается аспирационный синдром и патогенные бактерии попадают в дыхательные пути.
Патогенез
В большинстве случаев при неонатальных пневмониях наблюдается двустороннее поражение интерстициальной ткани и альвеол, которое вызывает тяжелые гипоксические расстройства и связанный с ними ацидоз. Сочетание гипоксемии и нарушений кислотно-основного равновесия провоцирует полиорганную недостаточность. В первую очередь страдает сердечно-сосудистая система, а при тяжелом течении и другие органы — почки, печень, головной мозг.
Независимо от причины, пневмонии у новорожденных протекают в 3 стадии. Сначала происходит инфильтрация (первая неделя болезни), когда поражаются преимущественно периферические отделы легких. На второй неделе начинается стадия рассасывания, характеризующаяся уменьшением процента затемненных участков и повышением пневматизации. На третьей неделе наступает этап интерстициальных изменений и деформации легочного рисунка.
Классификация
В зависимости от причины, у новорожденных выделяют бактериальную, вирусную, грибковую или протозойную формы заболевания. Если патология возникла при отсутствии других очагов инфекции в организме, ее называют первичной. Вторичное воспаление легких формируется при аспирационном синдроме, сепсисе. В современной неонатологии важна классификация пневмоний по времени развития на 2 группы:
- Врожденные. Инфицирование в этом случае происходит анте- или интранатально, а первые клинические признаки определяются в течение 3 суток после родов. Частые причины врожденного воспаления — внутриутробные инфекции.
- Приобретенные (постнатальные). Заражение патогенными микробами происходит в роддоме (нозокомиальная форма) или после выписки младенца (внебольничная форма). Симптомы выявляются спустя 72 часа после рождения ребенка, но не позже 28 дня жизни.
Симптомы пневмонии у новорожденных
Кашель у новорожденного обычно отсутствует. Изо рта периодически выделяется слизь или пена с неприятным запахом. Симптоматика дополняется общими признаками: отказом от сосания груди, повышением температуры тела, патологической возбудимостью или угнетением ЦНС. В неонатальном периоде пневмониям сопутствует инфекционный токсикоз, для которого характерен серый оттенок кожи, геморрагическая сыпь, желтуха и гепатоспленомегалия.
Осложнения
Болезнь может приводить к отеку легких, гнойно-деструктивным процессам (абсцессам, буллам, гангрене), пиопневмотораксу. Продолжительные дыхательные расстройства у новорожденных провоцируют гипоксическую энцефалопатию, кардиопатию, нефропатию. Наиболее тяжело протекают пневмонии у недоношенных детей: они часто заканчиваются генерализацией инфекции и сепсисом, а в 40% вызывают летальный исход.
Диагностика
Неонатолог начинает обследование со сбора анамнеза матери (течение беременности и родов, экстрагенитальные патологии), чтобы предположить причины дыхательных нарушений у новорожденного. Физикальные данные малоинформативны, поскольку у младенцев намного труднее выявить хрипы и крепитацию при аускультации. Расстройства дыхания оценивают по шкале Сильвермана или Даунса. Основными диагностическими методами для верификации возможной пневмонии у новорожденных являются:
Лечение пневмонии у новорожденных
Консервативная терапия
Лечение младенцев с воспалением легких проводится только стационарно: в отделении патологии новорожденных или в блоке реанимации и интенсивной терапии. Основу лечения составляют антибиотики, которые сначала подбираются эмпирически, а затем корректируются после получения результатов бактериологической диагностики. В неонатологии в основном используют бета-лактамные препараты и макролиды. Как патогенетические методы применяются:
- Кислородная поддержка. Обеспечение нормальной сатурации — первостепенная задача врачей, поскольку это снижает риск метаболических и полиорганных нарушений. Рекомендована неинвазивная вентиляция (бифазик, CIPAP), в тяжелых случаях ребенка переводят на ИВЛ.
- Иммунотерапия. Для стимуляции собственных защитных сил организма новорожденного назначают иммуноглобулины II поколения, которые включают комплекс IgG, IgM, IgA (пентаглобин).
- Инфузионная терапия. Для восполнения ОЦК и коррекции электролитных показателей показано внутривенное вливание растворов. Базовым считается 10% раствор глюкозы, который обеспечивает организм энергией. При гипоксических нарушениях эффективно ведение неотона.
Прогноз и профилактика
Вероятность полного выздоровления высокая у доношенных новорожденных без врожденных пороков и иммунодефицитов. Менее благоприятнен прогноз у недоношенных младенцев, особенно когда они требуют кислородной поддержки на ИВЛ. Профилактика неонатальных пневмоний включает антенатальную охрану плода, своевременную диагностику и лечение инфекций у беременной, предотвращение РДС путем введения дексаметазона при высоком риске преждевременных родов.
2. Диагностическая значимость признаков пневмонии у новорожденных детей/ В.В. Зубков, Е.Н. Байбарина, И.И. Рюмина // Акушерство и гинекология. — 2012.
4. Врожденная пневмония у недоношенных новорожденных: особенности этиологии, диагностики и лечения/ Е.В. Волянюк // Практическая медицина. — 2011.

25 июня 2019 г. American College of Obstetricians and Gynecologists опубликовала документ № 782 по профилактике ранней стрептококковой группы В инфекции у новорожденных.
- Целевое профилактическое внутривенное введение антибиотика во время родов (intrapartum) продемонстрировало эффективность в профилактике ранней стрептококковой группы В инфекции у новорожденных у матерей с положительным дородовым посевом на стрептококк группы В и у женщин с другими факторами риска внутриродовой колонизации стрептококками группы В. Ни пероральные, ни внутримышечные режимы до родов или во время родов не показали сравнимую эффективность по снижению ранней стрептококковой группы В инфекции у новорожденных.
- Вне зависимости от запланированного метода родовспоможения, все беременные должны пройти дородовый скрининг на стрептококк группы В на 36 0/7 - 37 6/7 неделе гестации, если только нет показаний для внутриродовой антибиотикопрофилактики стрептококковой группы В инфекции ввиду бактериурии стрептококком группы В во время беременности, либо ввиду наличия в анамнезе у беременной стрептококковой группы В инфекции у новорожденного. Данная рекомендация по времени проведения скрининга дает промежуток в 5 недель для получения результатов посева, и данный промежуток включает роды вплоть до 41 0/7 недель гестации.
- Все женщины с положительным вагинально-ректальным посевом на стрептококк группы В на 36 0/7 - 37 6/7 неделе гестации, должны получить внутриродовую надлежащую антибиотико-профилактику, если только не выполняется кесарево сечение до родовой деятельности при интактных мембранах.
- Женщинам с положительным пренатальным результатом посева на стрептококк группы В, у которых выполняется кесарево сечение до начала родовой деятельности и у которых интактны мембраны, то им не требуется антибиотикопрофилактики стрептококковой группы В инфекции.
- Если результат пренатального посева на стрептококк группы В не известен при начале родов, то внутриродовая антибиотикопрофилактика показана женщинам, у которых имеются факторы риска ранней стрептококковой группы В инфекции у новорожденных. В группу риска входят женщины, которые поступают со значительным риском преждевременных родов, с преждевременным дородовым разрывом плодных оболочек, либо поступают в срок, но с разрывом плодных оболочек в течение 18 часов и более, с внутриродовой лихорадкой (38 градусов или выше). Если подозревается интраамниотическая инфекция, то антибиотик широкого спектра действия с покрытием полимикробной инфекции включая стрептококк группы В должен применяться вместо антибиотика, специфически показанного для профилактики стрептококковой группы В инфекции.
- Если женщина поступает в срок в родах с неизвестным статусом по стрептококку группы В и у нее нет факторов риска, при которых показана внутриродовая антибиотикопрофилактика, но при этом женщина сообщает об наличии в анамнезе колонизации стрептококком группы В во время предыдущей беременности, то риск ранней стрептококковой группы В инфекции у новорожденного повышается. С таким повышенным риском будет резонным применить внутриродовую антибиотикопрофилактику на основании анамнеза женщины. Врач может также рассмотреть обсуждение с пациенткой эмпирическую внутриродовую антибиотикопрофилактику как совместное с пациенткой решение в такой ситуации.
- Пенициллин внутривенно остается препаратом выбора для внутриродовой профилактики, а ампициллин внутривенно является приемлемой альтернативой. Цефалоспорины 1-го поколения (например, цефазолин) рекомендуются для женщин с аллергией на пенициллин с низким риском анафилаксии, либо с неуточненной степенью тяжести. Для женщин с высоким риском анафилаксии рекомендованной альтернативой пенициллину является клиндамицин, но только если посев показал стрептококк группы В с чувствительностью к клиндамицину.
- Как альтернатива, кожный тест на аллергию к пенициллину является безопасным во время беременности и может быть полезен для женщин, у которых имеется аллергия на пенициллин низкого риска, либо с неизвестной степенью тяжести. Уточнение что отсутствует реакция гиперсенситивности 1-го типа позволит избежать необходимости применения альтернатив пенициллину для профилактики ранней стрептококковой группы В инфекции у новорожденных, и даст долгосрочную пользу, если в будущем понадобится лечение бета-лактамными антибиотиками. Ввиду того, что большинство женщин, которые сообщают об аллергии на пенициллин, в действительности переносят пенициллин, все чаще в разных сферах здравоохранения применяют тестирование на аллергию на пенициллин и более широкое применение такого тестирования приветствуется в акушерстве.
- Для женщин с высоким риском анафилактической реакции на пенициллин, необходимо указать на направлении на посев на стрептококк группы В, что имеется аллергия на пенициллин. Это необходимо, чтобы в лаборатории проверили чувствительность на клиндамицин, и врач должен понимать важность уточнения данной информации при получении заключения из лаборатории.
- Внутривенный ванкомицин остается единственным фармакокинетическим и микробиологически валидированным методом внутриродовой антибиотикопрофилактики у женщин с аллергией на пенициллин высокого риска и у которых посев на стрептококк группы В показал нечувствительность к клиндамицину. Дозировка ванкомицина для внутриродовой профилактики стрептококковой группы В инфекции рассчитывается по весу и исходной функции почек (20 мг/кг внутривенно каждые 8 часов, с максимальной дозой 2 г на одну дозу).
- Акушерские вмешательства при необходимости не должны задерживаться только по причине необходимости введения антибиотика 4 часа до родов. Такие вмешательства включают (но не ограничены) введение окситоцина, искусственный разрыв плодных оболочек, или запланированное кесарево сечение с или без разрыва мембран до кесарева сечения. Однако, определенная вариабельность в подходах может быть необходима в зависимости от потребностей индивидуальных пациенток для улучшения воздействия внутриродового антибиотика.
Читайте также:

