Стрептококк в моче у ребенка причины симптомы лечение
Обновлено: 24.04.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
- Streptococcussanguis – воистину могуч и вездесущ. Обнаруживается в зубных отложениях с самого прорезывания зубов и до конца жизни, где и есть основное место его обитания. Иногда может быть обнаружен на слизистой глотки и в фекалиях, куда попадают транзитом. При этом надо помнить, что этот микроб вносит существенный вклад в процессы, связанные с кариесом, занимая в последующем ведущее место в ассоциациях микроорганизмов, выделяемых из гнойного экссудата при воспалительных процессах в челюстно-лицевой области, включая одонтогенные абсцессы мозга и других органов. Кроме того, они же могут быть выделены их крови и сердечных клапанов больных инфекционным эндокардитом.
- Streptococcussalivarius – также является одним из основных компонентов нормальной микрофлоры полости рта, а также, но в меньшем количестве, может быть выделен со слизистых дыхательного, желудочно-кишечного и урогенитального тракта. Особенно часто выделяются при анализе микрофлоры языка, слюны и фекалий. И крайне редко из крови при менингитах, септицимии и эндокардитах.
- Streptococcusmutans – выделяется с поверхности зубов и фекалий. Этот микроб является кариесогенным, а значит, может в дальнейшем вызывать бактериемию и бактериальный эндокардит у пациентов, не занимающихся регулярной санацией кариозных очагов в полости рта.
- Streptococcusmitis – в норме выделяется из слюны, мокроты фекалий, при этом может выделяться из верхних дыхательных путей и крови при нозокомиальном инфицировании.
- Совсем неверно упоминать в этом блоке стрептококки группы Anginosus -Streptococcusintermedius/S.anginosus/S.constellatus, но так как мы обсуждаем в основном орофарингеальную флору, способную вызвать инфекционные эндокардиты (и чтобы не писать еще один, совсем малюсенький блок), мы упомянем их здесь. В норме они являются представителями пародонтогенной группы. Но стоит представителю группы S.intermedius оттуда выбраться, как он может вызывать абсцессы печени, мозга и эндокардиты, так как проявляет высокую тропность к их тканям.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
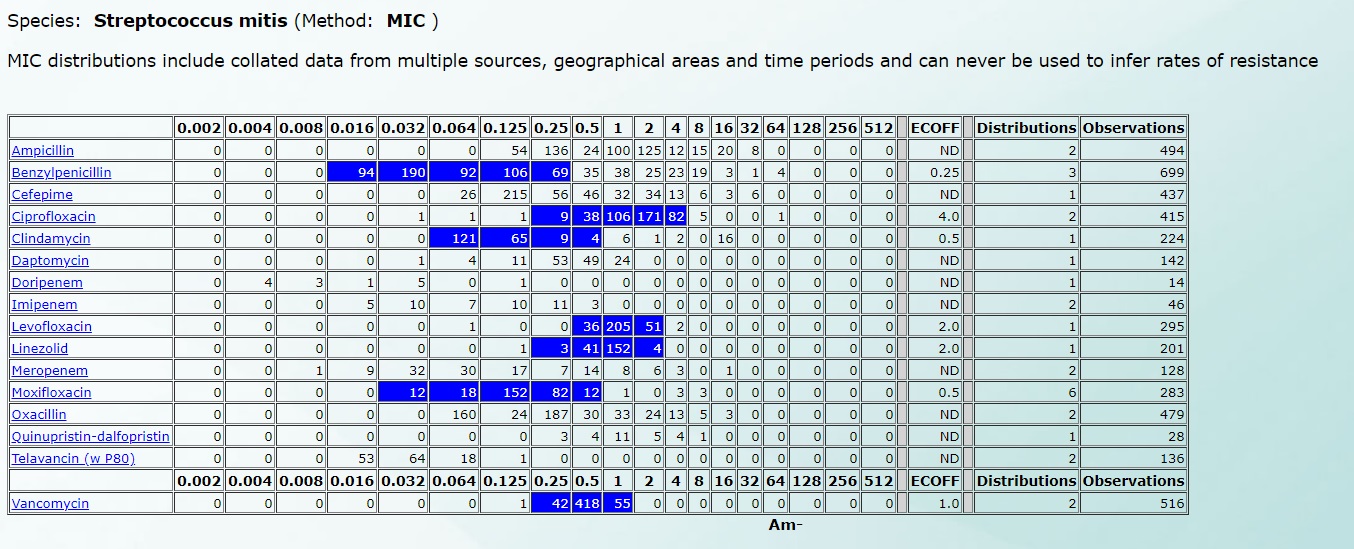
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
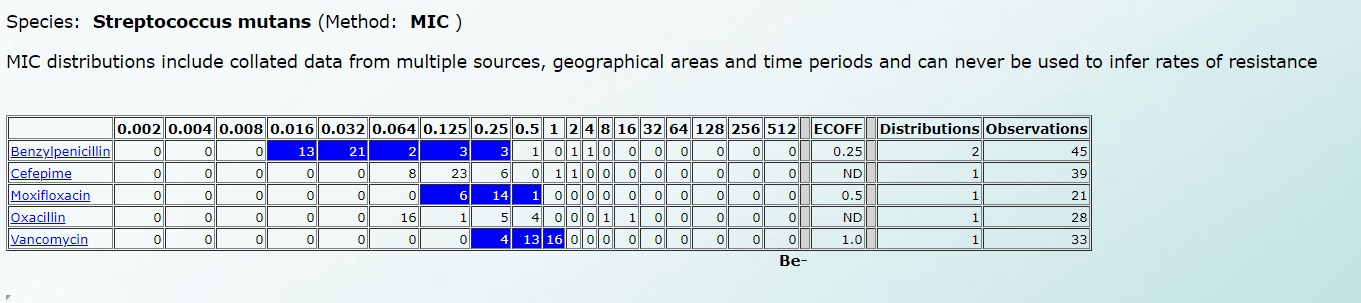
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
- Пенициллин в высоких дозировках (до 24 млн ЕД в сутки), возможно, в сочетании с аминогликозидами
- Цефтриаксон
- Ванкомицин
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
Стрептококковый менингит - (m. streptococcica) гнойный менингит, возникающий при генерализации стрептококковой инфекции или при проникновении возбудителей в мозговые оболочки из близлежащих органов (среднего уха, околоносовых пазух и др.). Характеризуется бурным началом с развитием отека-набухания головного мозга, энцефалической очаговой симптоматики, поражением других органов и систем.
Что провоцирует / Причины Стрептококкового менингита:
Возбудителем менингита являются стрептококки, которые представляют собой сферические или овоидные клетки размером 0,5–2,0 мкм, в мазках располагающиеся парами или короткими цепочками, при неблагоприятных условиях могут приобретать вытянутую или ланцетовидную форму, напоминая коккобациллы. Неподвижны, спор и капсул не образуют, анаэробы или факультативные анаэробы, температурный оптимум - 37 °С. По наличию спе¬цифических углеводов в клеточной стенке выделяют 17 серогрупп, обозначаемых заглавными буквами латинского алфавита.
Гемолитические стрептококки группы А являются основными возбудителями болезней у человека. Они ответственны за фарингиты, скарлатину, целлюлиты, рожистые воспаления, пиодермии, импетиго, стрептококковый синдром токсического шока, септический эндокардит, острый гломерулонефрит и другие заболевания.
Стрептококки группы В заселяют носоглотку, ЖКТ и влагалище. Серовары 1а и 111 тропны к тканям ЦНС и дыхательных путей и наиболее часто вызывают менингиты и пневмонии у новорожденных, а также поражения кожных покровов, мягких тканей, пневмонии, эндокардиты, менингиты и эндометриты, поражения мочевых путей и осложнения хирургических ран при кесаревом сечении.
Возбудителем менингита является гемолитический или зеленящий стрептококк, обладающий выраженными токсическими свойствами, которые обусловливают вирулентность микроба и его агрессивность. Основными из них являются: фимбриальный белок, капсула и С5а-пептидаза.
Фимбриальный белок - основной фактор вирулентности, являющийся типоспецифическим антигеном. Он препятствует фагоцитозу, связывает фибриноген, фибрин и продукты их деградации, адсорбирует их на своей поверхности, маскируя рецепторы для компонентов комплемента и опсонинов, вызывает активацию лимфоцитов и образование антител с низким аффинитетом.
Капсула является вторым по значимости фактором вирулентности. Она защищает стрептококи от антимикробного потенциала фагоцитов и способствует адгезии к эпителию.
Третьим фактором вирулентности является С5а-пептидаза, которая подавляет активность фагоцитов. Важную роль в патогенезе играют также стрептокиназа, гиалуронидаза, эритрогенные (пирогенные) токсины, кардиогепатический токсин, стрептолизин О и S.
Несмотря на широкое распространение стрептококковой инфекции с обширной и разнообразной патологией, гнойные менингиты стрептококковой природы встречаются редко. Возбудителями являются гемолитический и зеленящий стрептококки (И. Г. Вайнштейн, Н. И. Гращенков, 1962). Подчеркивая редкость заболевания, Ноуnе и Herzen (1950) указывают, что в мировой литературе до 1948 г. они нашли только 63 случая стрептококкового менингита. По статистическим данным, стрептококковый менингит наблюдается преимущественно у грудных и маленьких детей, чаще возникая в период стрептококковой септицемии при гнойном отите, роже лица, воспалении придаточных полостей носа, эндокардите, тромбофлебите мозговых синусов и других гнойных очагах (Biedel, 1950; Baccheta, Digilio, 1960; Mannik, Baringer, Stokes, 1962). В значительном проценте случаев источник гнойного менингита остается невыясненным (Hoyne, Herzen, 1950).
Эпидемиология
Резервуаром является больной человек или бактерионоситель. Основные пути передачи: контактный, воздушно-капельный и алиментарный (через инфицированные пищевые продукты, например молоко). Болеют дети любого возраста, но чаще новорожденные, у которых менингит развивается как проявление сепсиса. У 50 % новорожденных наиболее часто заражение происходит вертикальным путем - при прохождении плода по родовым путям, инфицированным стрептококками.
Значительная колонизация родовых путей матери стрептококками приводит к раннему развитию менингита (в течение первых 5 суток), а у детей, инфицированных небольшой дозой, менингит развивается значительно позднее (от 6 суток до 3 мес.). У 50 % больных новорожденных, не имеющих конкретного очага инфицирования, менингит развивается в течение 24 часов, при этом смертность достигает 37 %. Из общего числа детей с поздними проявлениями инфицирования, развития менингита и бактериемии погибают 10–20 %, а у 50 % выживших детей наблюдаются грубые остаточные явления. У больных септическим эндокардитом менингит может возникнуть как результат эмболии сосудов мозговых оболочек.
Патогенез (что происходит?) во время Стрептококкового менингита:
Чаще всего входными воротами инфекции являются поврежденные кожные покровы (опрелости, участки мацерации, ожоги, раны), а также слизистые оболочки носоглотки, верхних дыхательных путей (стрептодермия, флегмона, абсцесс, гнойно-некротический ринит, назофарингит, отит, трахеобронхит и др.). Однако в большинстве случаев источник развития гнойного менингита выявить не удается. Исход инфицирования стрептококком новорожденного ребенка в прямой степени зависит от состояния его клеточных и гуморальных факторов защиты и величины инфицирующей дозы.
В месте внедрения стрептококк вызывает не только катаральное, но и гнойно-некротическое воспаления, откуда быстро разносится по всему организму лимфогенно или гематогенно. Находящийся в крови стрептококк, его токсины, ферменты, приводят к активации и повышению уровня биологически активных веществ, нарушению гемостаза, обменных процессов с развитием ацидоза, повышением проницаемости клеточных и сосудистых мембран, а также ГЭБ. Это способствует проникновению стрептококка в ЦНС, поражению мозговых оболочек и вещества мозга.
Симптомы Стрептококкового менингита:
Клинические проявления стрептококкового менингита не имеют специфических черт, отличающих его от других вторичных гнойных менингитов.
Заболевание начинается остро, с повышения температуры тела, анорексии, озноба, головной боли, рвоты, иногда повторной, выраженных менингеальных симптомов. Возможно развитие энцефалических проявлений в виде нарушения сознания, клонико-тонических судорог, тремора конечностей. Характерными для стрептококкового менингита являются признаки тяжелой септицемии: высокая с большими размахами температура тела, геморрагическая сыпь, увеличение размеров сердца, глухость сердечных тонов. Закономерно страдают функции паренхиматозных органов, возникает гепатолиенальный синдром, почечная недостаточность, поражение надпочечников. При остром течении болезни признаки тяжелой септицемии и энцефалические проявления могут преобладать над менингеальными симптомами. Стрептококковый менингит при эндокардите часто сопровождается поражением сосудов мозга с кровоизлияниями в подпаутинное пространство, ранним возникновением очаговой симптоматики. Характерно развитие отека-набухания головного мозга, но абсцессы мозга развиваются редко.
Стафилококковый и стрептококковый менингиты, как правило, бывают вторичными. Выделяют контактные и гематогенные формы. Контактные гнойные мненигиты развиваются при остеомиелите костей черепа и позвоночника, эпидурите, абсцессе мозга, хроническом гнойном среднем отите, синусите. Гематогенные менингиты возникают при сепсисе, остром стафилококковом и стрептококковом эндокардите. Воспалительный процесс в оболочках мозга характеризуется склонностью к абсцедированию.
Начало болезни острое. Основной жалобой являются сильные головные боли разлитого или локального характера. Со 2-3-го дня болезни выявляется менингеальная симптоматика, общая гиперестезия кожи, иногда судорожный синдром. Часто поражаются черепные нервы, возможно появление патологических рефлексов, в тяжелых случаях наблюдаются расстройства сознания и нарушение стволовых функций. Цереброспинальная жидкость опалесцирующая или мутная, ее давление резко повышено; плеоцитоз преимущественно нейтрофильный или смешанный в пределах от нескольких сотен до 3-3 тыс. клеток в 1 мкл; содержание сахара и хлоридов снижено, белка повышено. При исследовании крови обнаруживают нейтрофильный лейкоцитоз, увеличение СОЭ. Диагноз основывается на данных анамнеза, клинических проявлениях и результатах исследования крови и цереброспинальной жидкости (обнаружение в них возбудителя).
Необходимо раннее активное лечение первичного гнойного очага на фоне антибактериальной терапии оксациллином, аминогликозидами, цефалоспоринами, бисептолом и др. (в зависимости от чувствительности выделенного штамма возбудителя). Антибактериальную терапию сочетают с применением антистафилококкового гамма-глобулина, антистафилококковой плазмы, бактериофага, иммуномодуляторов. Прогноз тяжелый, определяется как непосредственным поражением ЦНС, так и течением общего септического процесса.
Диагностика Стрептококкового менингита:
Основные диагностические критерии стрептококкового менингита:
1. Эпиданамнез: заболевание развивается на фоне стрептококкового сепсиса, реже - другого стрептококкового заболевания, возбудитель распространяется гематогенно или лимфогенно, болеют дети любого возраста, но чаще новорожденные.
2. Начало менингита острое, с развитием признаков тяжелой септицемии: значительных размахов температурной реакции, наличия геморрагической сыпи, гепатолиенального синдрома и выраженных менингеальных симптомов.
3. Нередко быстро развивается отек-набухание головного мозга, энцефалическая очаговая симптоматика.
4. Часто протекает с вовлечением в инфекционный процесс других жизненно важных органов и систем (печени, сердца, легких, надпочечников).
5. Выделение гемолитического стрептококка из ЦСЖ, крови подтверждает этиологический диагноз.
Лабораторная диагностика
Общий анализ крови. В периферической крови обнаруживается лейкоцитоз, нейтрофилез, сдвиг формулы крови влево, повышенная СОЭ.
Исследование ликвора. В цереброспинальной жидкости выявляется высокий нейтрофильный плеоцитоз (тысячи клеток в 1 мкл), повышение содержания белка (1–10 г/л) и снижение уровня глюкозы. При бактериоскопии обнаруживают грамотрицательные кокки.
Бактериологическое исследование. Выделение возбудителя является наиболее достоверным методом. Производят его путем посева крови, слизи из носа и зева, мокроты, ликвора на кровяной агар. На жидких средах стрептококки дают придонный, поднимающийся вверх рост. Для дифференцирования выявленные микроорганизмы засевают на тиогликолевую среду, полужидкий агар.
Бактериоскопическое исследование. При бактериоскопии в мазках выявляют типичные грамположительные кокки, образующие короткие цепочки, но могут быть обнаружены и полиморфные формы.
Серологическое исследование. Серотипирование проводят в реакции латекс-агглютинации или коагглютинации с помощью моноклональных антител, меченных флюоресцинами.
Лечение Стрептококкового менингита:
Вторичный гнойный менингит протекает не менее тяжело, чем менингококковый менингит. Лечение надо начинать уже на догоспитальном этапе с введения пенициллина. Его назначают по 200 000 - 300 000 ЕД/кг массы тела в сутки внутримышечно.
При пневмококковом менингите доза пенициллина составляет 300 000-500 000 ЕД/кг в сутки, при тяжелом состоянии - 1 000 000 ЕД/кг в сутки. При стрептококковом менингите пенициллин назначают по 200 000 ЕД/кг в сутки.
При стафилококковом и стрептококковом менингите внутримышечно применяют также полусинтетические пенициллины (метициллин, оксациллин, ампициллин) в дозе 200-300 мг/кг в сутки. Можно назначить левомицетина сукцинат натрия в дозе 60-80 мг/кг в сутки, клафоран - по 50-80 мг/кг в сутки.
При менингите, вызванном палочкой Пфейффера-Афанасьева, кишечной палочкой, бациллой Фридлендера или сальмонеллами, максимальный эффект дает левомицетина сукцинат натрия, который назначают в дозе 60-80 мг/кг в сутки внутримышечно с интервалом в 6 - 8 ч. Эффективен также неомицина сульфат - по 50 000 ЕД/кг 2 раза в сутки.
Рекомендуют также морфоциклин - по 150 мг 2 раза в сутки внутривенно капельно.
При стафилококковом менингите вводят стафилококковый анатоксин в дозе 0,1-0,3-0,5-0,7-1 мл внутримышечно, антистафилокковый гамма-глобулин - по 1 - 2 дозы внутримышечно в течение 6 - 10 дней, иммунизированную антистафилококковую плазму - по 250 мл 1 раз в 3 дня.
Профилактика Стрептококкового менингита:
В профилактике стрептококковых менингитов важную роль играет популяризация сведений о путях распространения инфекции, Так как заболевание чаще передается воздушно-капельным путем, больной и окружающие должны знать, что инфицирование возможно при разговоре, кашле, чихании. Важную роль в профилактике менингита играют гигиенические навыки, бытовые условия.
К каким докторам следует обращаться если у Вас Стрептококковый менингит:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Стрептококкового менингита, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Садова Н.В., Заплатников А.Л., Шипулина О.Ю., Подкопаев В.Н., Фомина С.Г., Скачкова Т.С., Домонова Э.А., Сафонова А.П.
Одним из частых бактериальных заболеваний перинатального периода является инфекция, вызванная Streptococcus agalactiae (S. agalactiae). У женщин в период беременности S. agalactiae–инфекция может протекать как бессимптомно, так и клинически значимо с развитием бактериемии, эндометрита, хориоамнионита, воспаления мочевых и родовых путей, а у новорожденных детей проявляться локализованными и инвазивными поражениями [1–13].
S. agalactiae относится к стрептококкам группы В, которые являются грамположительными инкапсулированными факультативными анаэробами, не образующими спор. Главным фактором вирулентности S. agalactiae является полисахаридная капсула. Из белковых факторов патогенности особо отмечают С5а пептидазу, бета–гемолизин, С протеины (альфа– и бета–), гиалуронидазу, Sip белок, CAMP фактор (В–белок), а также комплекс протеаз, гемолизин, адгезины и др. [2,14–16].
Установлено, что 15–40% женщин являются носителями S. agalactiae, колонизирующей слизистые влагалища или прямой кишки [1,2,6,8]. Рождение детей от S. agalactiae–инфицированных женщин в 50% сопровождается вертикальной трансмиссией возбудителя. Передача инфекции от инфицированной матери происходит, как правило, незадолго до родов или непосредственно во время родов. В постнатальный период, особенно в ближайшие часы и сутки после рождения, ребенок также может инфицироваться, однако это случается значительно реже по сравнению с пре– и интранатальной контаминацией. Отмечено, что S. agalactiae–инфицирование новорожденных не всегда приводит к развитию инфекционного процесса. Факторами риска реализации инфекции у ребенка, рожденного от S. agalactiae–инфицированной женщины, являются: возраст беременной (12 часов), задержка внутриутробного развития и наличие S. agalactiae–инфекции у ранее рожденных детей [6,8].
Неонатальная заболеваемость S. agalactiae–инфекцией до недавнего времени составляла 1–4 на 1000 живорожденных детей, среди которых в 75% случаев имела место манифестация в 1–7–е сутки жизни. При этом на 100 инфицированных беременных женщин рождался 1 ребенок с тяжелой S. agalactiae–инфекцией [4–6]. Благодаря активному использованию в акушерской практике рекомендаций по профилактике S. agalactiae–инфекции, удалось существенно снизить уровень инфицированности новорожденных, а также частоту инвазивных форм заболевания у детей первого месяца жизни. Так, в странах, где проводится антибактериальная профилактика перинатальной S. agalactiae–инфекции, заболеваемость в ранний неонатальный период удалось снизить более чем на 80%, а показатели неонатальной заболеваемости в целом не превышают 0,3 случая на 1000 живорожденных детей [8].
Клиническими проявлениями перинатальной S. agalactiae–инфекции у женщин являются послеродовые инфекции эндометрия, мочевыводящих путей, головного мозга, а также сепсис и осложнения кесарева сечения. У новорожденных выделяют локализованные и инвазивные формы перинатальной S. agalactiae–инфекции. При этом в зависимости от времени манифестации выделяют заболевания с ранним (до 7 дня жизни) и поздним (после 7 суток жизни) дебютом. S. agalactiae–инфекция у новорожденных наиболее часто протекает в виде инвазивных форм с бактериемией, поражением легких, мозговых оболочек. Нередко при этом заболевание приобретает септический характер, особенно у недоношенных и маловесных детей, у которых сепсис отмечен в 77–88% среди всех случаев S. agalactiae–инфекции. Именно в этой группе пациентов S. agalactiae–инфекция протекает наиболее тяжело и нередко заканчивается летально [3,8]. Особо следует отметить, что в подавляющем большинстве случаев дети при этом рождаются в нормальном состоянии, однако уже через несколько часов клиническая картина резко меняется.
Манифестация ранних форм, как правило, дебютирует цианозом и респираторными нарушениями (апноэ, тахипноэ). Возможна также молниеносная форма заболевания, при которой очень быстро появляются все признаки септического шока [3–10]. В клинических анализах крови при этом нередко обнаруживают лейкопению. При позднем дебюте (после 7–го дня жизни) S. agalactiae–инфекция также может протекать в виде сепсиса или менингита [8]. Клинически при этом чаще регистрируют напряжение родничков, лихорадку, угнетение сознания вплоть до комы и тонико–клонические судороги. Реже отмечаются другие проявления инфекции: омфалит, отит, синусит, конъюнктивит, артрит, остеомиелит, поражения кожи, мочевой системы, эндокардит, миокардит.
В связи с низкой специфичностью клинических проявлений S. agalactiae–инфекции у новорожденных детей особое значение в верификации этиологии заболевания приобретают лабораторные методы диагностики (классические бактериологические, серологические, молекулярно–биологические) [2,11,17,18]. При бактериоскопии обнаруживают типичные грамположительные кокки, образующие короткие цепочки. Для выявления S. agalactiae в биологических жидкостях организма (в крови, ликворе, моче, трахео–бронхиальном аспирате) методом бактериологических посевов необходимо использовать среды, обогащенные кровью или сывороткой, т.к. выделение S. agalactiae на обычных средах, как правило, не превышает 10–12%. Серологические методы диагностики имеют значение лишь в плане ретроспективного подтверждения диагноза, а также для выявления напряженности пассивного иммунитета, трансплацентарно полученного от матери. При этом к факторам высокого риска реализации S. agalactiae–инфекции в неонатальный период относят указание на серонегативность или низкие титры специфических антител у инфицированных беременных женщин.
В последние годы все большую значимость приобретают молекулярно–биологические методы диагностики. Быстрота получения результатов при использовании полимеразной цепной реакции (ПЦР) в сочетании с высокой чувствительностью и специфичностью делают ПЦР незаменимым методом верификации инфекционных заболеваний, особенно в неонатологической практике [17,18]. Так, нами в пилотном исследовании было проведено изучение чувствительности ПЦР в детекции генома S. agalactiae в сравнении с методом бактериологических посевов. При исследовании аспирата из трахеи у 62 новорожденных, находящихся в отделении неонатальной реанимации и интенсивной терапии в связи с тяжелыми инфекциями неонатального периода, у 9 детей (14,5%) методом ПЦР удалось выявить геном S. agalactiae, в то время как при параллельно выполненных бактериологических посевах результаты были отрицательными. Вероятно, негативные результаты бактериологического исследования были обусловлены массивной антибиотикотерапией, проводимой детям с первых дней жизни, что могло привести к изменению культурально–морфологических характеристик возбудителя и снижению числа жизнеспособных микроорганизмов.
Методы специфической иммунопрофилактики S. agalactiae–инфекции до настоящего времени не разработаны, поэтому для предупреждения перинатальной S. agalactiae–инфекции используют антибиотикопрофилактику (АБ–профилактика). Разработанные в 2002 г. рекомендации СDC предусматривают обязательное обследование на S. agalactiae–носительство всех беременных женщин на сроке 35–37 недель [6]. При выделении возбудителя из влагалища и/или заднепроходного канала женщине в период родов назначают антибиотики в тех случаях, когда имеются определенные факторы риска. К факторам риска при этом относят следующие состояния: предыдущий ребенок перенес инвазивную S. agalactiae–инфекцию, во время настоящей беременности имели место S. agalactiae–бактериурия, угроза преждевременных родов (до 37 нед.), безводный промежуток больше 12 часов, лихорадка в родах. В случае выявления у S. agalactia–инфицированной женщины одного из указанных выше факторов риска, для профилактики перинатальной S. agalactiae–инфекции в период родов назначают антибиотик.
Для АБ–профилактики рекомендовано использовать бензилпенициллин, который вводят внутривенно в дозе 5 млн. ЕД с момента начала родовой деятельности, переходя в дальнейшем на дозу 2,5 млн. ЕД каждые 4 часа до окончания родов. Альтернативой бензилпенициллину является ампициллин, который вводят также внутривенно, первоначально в дозе 2 г на введение, а затем – по 1 г каждые 4 часа. При аллергии к пенициллинам их заменяют клиндамицином или эритромицином, но чаще в этих случаях рекомендуют цефазолин (вначале – 2 г на введение внутривенно, затем по 1 г каждые 8 часов внутривенно до окончания родов). При высоком риске развития анафилаксии на бета–лактамные антибиотики может быть использован ванкомицин, который рекомендуют вводить внутривенно по 1 г каждые 12 часов до окончания родов. Анализ результатов проведенных исследований показал, что благодаря АБ–профилактике удалось существенно снизить не только неонатальную заболеваемость S. agalactiae–инфекцией (регресс более чем на 80%), но и частоту развития инвазивных форм, что определило значительное улучшение прогноза заболевания [6,8].
В тех случаях, когда женщине во время родов АБ–профилактика S. agalactiae–инфекции проведена не была, а у новорожденного имеются факторы риска (мать – носитель S. agalactiae, возраст матери менее 20 лет, отягощенный акушерский анамнез, преждевременные роды, лихорадка в родах, длительный безводный период, S. agalactiae–инфекции у ранее рожденных детей, а также признаки задержки внутриутробного развития у самого ребенка), следует как можно быстрее начать этиотропную терапию. Выбор стартовой АБ–терапии при этом проводится эмпирически. В связи с тем, что S. agalactiae высокочувствителен к бета–лактамным антибиотикам, при подозрении на S. agalactiae–инфекцию препаратом выбора является ампициллин. Однако учитывая, что клиническая картина неспецифична и имеется вероятность иной этиологии заболевания, ампициллин комбинируют с гентамицином. При этом предпочтителен внутривенный путь введения антибиотиков. В тех случаях, когда развивается неонатальный S. agalactiae–сепсис, ампициллин назначают из расчета 200 мг/кг/сутки [3,8]. При менингите дозы антибиотиков увеличивают, ампицилин при этом вводят из расчета 300 мг/кг/сутки. При выделении S. agalactiae и его генома лечение продолжают выбранной комбинацией антибиотиков до улучшения состояния, а в дальнейшем переходят на монотерапию ампициллином. При неинвазивных формах S. agalactiae–инфекции продолжительность монотерапии составляет 10 суток, при S. agalactiae–неосложненных менингитах – 14 суток, при S. agalactiae–артритах и остеомиелитах – 3–4 недели, при S. agalactiae–эндокартите и S. agalactiae–вентрикулите – не менее 4 недель [6,8].
Таким образом, в настоящее время имеются все возможности для снижения заболеваемости и летальности от перинатальной S. agalactiae–инфекции. Для этого необходимо у всех беременных женщин на сроке 35–37 недель проводить скрининг на S. agalactiae–носительство. При его подтверждении и наличии факторов риска (предыдущий ребенок в неонатальном периоде перенес S. agalactiae–инфекцию, наличие у женщины S. agalactiae–бактериурии, преждевременные роды, длительный безводный период, лихорадка в родах) женщине в родах должны быть назначены антибиотики для профилактики перинатальной S. agalactiae–контаминации ее ребенка. Строгое выполнение указанных рекомендаций позволяет достоверно снизить риск вертикального инфицирования и значительно уменьшает частоту инвазивных форм S. agalactiae–заболеваний у новорожденных детей.
1. Оганян К.А. Течение и исход беременности при колонизации мочеполового тракта женщин стрептококками группы В и D. Автореф. дисс. канд. мед. наук.– СПБ, 2008, 24
2. Покровский В.И., Поздеев О.К. Семейство Streptococcaceae/ Медицинская микробиология. ГЭОТАР Медицина, М, 1999: 193–206.
3. Шабалов Н. П. Внутриутробные инфекции/ Неонатология. В 2 т. – С–Пб.: Специальная литература, 1996, Т. 2: 43–76.
4. Baltimore R.S. Huie S.M., Meek J.I., Schuchat A. Early–onset neonatal sepsis in the era of group В streptococcal prevention. Pediatrics. 2001. Vol. 108: 1094–8.
5. Boyer K.M.: Neonatal group В streptococcal infections // Current Opinion Pediatrics, 1995, 7: 13–18.
6. Centers for Disease Control and prevention (CDC). Prevention of perinatal group В streptococcal disease: Revised Guidelines from CDC // Morb. Mortal. Wkly Rep. 2002.Vol.51: 10–22
7. Kenyon S.L., Taylor PJ., Tarnow–Mordi W. Broad–spectrum antibiotics for preterm, prelabour rupture of fetal membranes, ORACLE Collaborative Group // Lancet. 2001. Vol. 357: 979–88.
8. Red Book: Report of the Committee on Infectious Diseases. 27h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2006; 992.
9. Weisner A.M., Johnson A.P., Lamagni T.L. et al. Characterization of group В streptococci recovered from infants with invasive disease in England and Wales // Clin Infect Dis. 2004. Vol. 38: 1203–1208.
10. Nandyal RR. Update on group B streptococcal infections: perinatal and neonatal periods. J Perinat Neonatal Nurs. 2008, 22, 3: 230—37.
11. Шуляк Б.Ф. Инфекция стрептококка группы В, методы ее лабораторной диагностики и профилактики. Медицинский алфавит. 2010, №2: 47–53
12. Gardam M.A., Low D.E., Saginur R. Group B streptococcal necrotizing fasciitis and streptococcal toxic shock–like syndrome in adults. Arch Intern Med, 1998, 158: 1704–08.
13. Sendi P., Johansson L., Norrby–Teglund A. Invasive group B Streptococcal disease in non–pregnant adults: a review with emphasis on skin and soft–tissue infections. Infection. 2008, 36, 2, 100–11.
14. Дмитриев А.В., Шаклеина Е.В. Молекулярная эпидемиология патогенных стрептококков группы В // Ж. микроб. эпидемиол. и иммунол. 2003: 83–92.
15. Fischetti V.A. Gram–Positive Pathogens, American Society Microbiology, Washington, D.C, 2000. 511 p.
16. Jacobsson K. A Novel family of fibrinogen–binding proteins in Streptococcus agalactiae // Vet. Microbiol. 2003. Vol. 96: 103–113.
17. Эйдельштейн И.А., Сехин С.В., Иванчик Н.В. и др. Валидация тест–системы на основе ПЦР в режиме реального времени для выявления Streptococcus agalactiae в сравнении с микробиологическим методом. Молекулярная диагностика. М., 2010, 3: 346–348.
18. Сафонова А.П., Пиксасова О.В., Скачкова Т.С. и др. Разработка методики выявления и количественного определения ДНК Streptococcus agalactiae на основе ПЦР в режиме реального времени. II Ежегодный Всероссийский Конгресс по инфекционным болезням. М, 2010: 282.
Стрептококковая инфекция приводит к таким болезням как скарлатина, ангина, гломерулонефрит, ревматизм, пиодермия, рожа, вызывает генерализованные процессы по типу септицемии и т. д. Стрептококковая инфекция может вызвать осложнение других болезней.
Согласно международной классификации, различают:
- септицемию, вызванную стрептококком группы А;
- септицемию, вызванную стрептококком группы D;
- септицемию, вызванную стрептококком pnevmonine (пневмококковую септицемию);
- стрептококковую септицемию неуточненную;
- другие стрептококковые септицемии.
Заболевания, вызванные стрептококками, случаются по всей планете. Болезни кожи характерные для жарких стран. Скарлатина и ангина чаще встречаются в странах, где преобладает холодный и умеренный климат. Болезни подвержены дети любого возраста, даже новорожденные. Инфекция передается воздушно-капельным и контактно-бытовым путями. Также заражение может произойти через инфицированные продукты питания.
Опасаться стоит больных ангиной, пневмонией, стрептодермией, скарлатиной и другими стрептококковыми заболеваниями, а также бактерионосителей без клинических проявлений.
Формально все болезни, которые вызваны стрептококками, относят к инфекционным болезням. Но при гломерулонефрите, ревматизме и пр. нет заразительности – отличительного признака инфекционных болезней. Потому в группу стрептококковых инфекций следует относить только те, что имеют все признаки инфекционной болезни: заразительность, циклическое развитие клинических симптомов, инкубационный период, формирование специфического иммунитета. Эти признаки характерны для заболеваний, вызываемых Р-гемолитическим стрептококком группы А: ангина, скарлатина, пневмония, бронхит, рожа, фарингит, а также некоторые гнойно-воспалительные заболевания новорожденных, которые вызваны стрептококками других групп: флегмона, стрептодермия, абсцесс и т. д.
Что провоцирует / Причины Стрептококковой инфекции у детей:
Стрептококки — это грамположительные бактерии, диаметр которых от 0,6 до 1 мкм. Имеют шаровидную или овальную форму. Располагаются они парами или цепочками.
Стрептококки делят на 21 группу по углеводным антигенам клеточной стенки. Обозначаются они литерами от А до U. Болезнь у человека возникает в основном от стрептококков группы A. Для новорожденных и грудничков опасны стрептококки групп В, С и D. Они вызывают эндокардит, тяжелый сепсис, остеомиелит, менингит, инфекции мочевых путей и т. д. Стрептококки группы F вызывают глубокие воспалительные процессы ротовой полости и дыхательных путей.
Стрептококки вырабатывают разные ферменты и токсины: эритрогенные токсины (А, В, С), стрептокиназы А и В, стрептолизины О и S, дезоксирибонуклеазы и т. д. Самый токсичный компонент, который вырабатывается стрептококком, это экзотоксин. Он повреждает ткани организма, подавляет функции ретикулоэндотелиальной системы, влияет на проницаемость мембран, вызывает иммуносупрессию и др.

Патогенез (что происходит?) во время Стрептококковой инфекции у детей:
В патогенезе стрептококковых заболеваний большая роль принадлежит токсическому синдрому, который связан в основном с эритрогенным токсином, а также с аллергическим, что обусловлен сенсибилизацией к белковым структурам стрептококка и разрушенным им тканям.
Симптомы Стрептококковой инфекции у детей:
Проявления стрептококковой инфекции зависят от направленности патологического процесса.
Вторичные формы развиваются в результате включения аутоиммунных и токсико-септических механизмов развития воспаления в различных органах и системах. Это такие болезни как стрептококковый васкулит, гломерулонефрит и ревматизм.
К редким клиническим формам стрептококковых инфекций относят энтерит, некротическое воспаление мышц и фасций, очаговые инфекционные поражения органов и тканей, синдром токсического шока. Стрептококкам группы В подвержены в основном (но не только) новорожденные. Младенцы заражаются интранатально. Стрептококки группы В вызывают в основном поражение мочеполовых путей.
Стрептококковые инфекции новорожденных проявляются в виде бактериемии (30% случаев), пневмонии (32-35%) и менингита. В ½ случаев симптомы начинают проявляться в первые 24 часа после рождения. Такие инфекции имеют крайне тяжелое течение, летальный исход наступает в 37 случаях из 100. После проявления бактериемии и менингита погибают около 10-20% заболевших, а у 50% тех, кто выжил, фиксируют нарушения развития.
Стрептококковые инфекции группы В часто служат причиной послеродовых эндометритов, циститов, аднекситов у родильниц и осложнений в послеоперационном периоде при проведении кесарева сечения.
Диагностика Стрептококковой инфекции у детей:
Стрептококковая инфекция слизистой оболочки глотки и кожных покровов требует подтверждения с помощью бактериологических методов, позволяющих выделить и идентифицировать возбудителя. Перед лечением проводят тест на чувствительность к антибиотикам, поскольку на сегодняшний день многие виды стрептококка стали устойчивы к антибиотикам.
Экспресс-диагностика стрептококков группы А дает возможность выявить возбудителя за 15-20 минут, при этом чистую культуру не выделяют. Но выявление стрептококков не во всех случаях означает, что именно они спровоцировали патологический процесс (болезнь). Ребенок может быть просто носителем, а проявляющиеся симптомы спровоцированы другими вирусами/бактериями/организмами.
Ревматизм и гломерулонефрит практически всегда характеризуются повышением титра антител к стрептококкам уже с первые дни обострения. Титр антител к внеклеточным антигенам определяют с помощью реакции нейтрализации.
Если есть необходимость, проводят обследование пораженных стрептококковой инфекцией органов: осмотр отоларинголога, УЗИ мочевого пузыря, рентгенографию легких и т. д.
Лечение Стрептококковой инфекции у детей:
Лечение проводится разными специалистами – в зависимости от формы инфекции – уролог, гинеколог, пульмонолог, дерматолог и т. д. Этиологическое лечение первичных клинических форм стрептококковых инфекций проводится антибиотиками пенициллинового ряда. Если за пять дней антибиотик не доказал свою эффективность, его отменяют.
Тест на чувствительность к антибиотикам включает такие препараты: азитромицин, эритромицин, оксациллин, кларитромицин и т. д. Неэффективными для лечения стрептококковой инфекции у детей считаются гентомицин, препараты тетрациклинового ряда, канамицин.
Также должно применяться симптоматическое и патогенетическое лечение, которые зависят от клинической формы болезни. При вторичных формах стрептококковой инфекции часто возникает необходимость применения длительных курсов антибиотикотерапии, при которых нередко назначают препараты пролонгированного действия.
В последние годы было открыто, что на течение болезни положительно влияени применение иммуностимулирующих средств и иммуноглобулина человека.
Профилактика Стрептококковой инфекции у детей:
Следует соблюдать меры индивидуальной профилактики и личной гигиены, контактируя с теми, кто болен респираторными заболеваниями. Указанные меры подразумевают ношение маски, обработку поверхностей и посуды, мытье рук с мылом.
Должен осуществляться контроль над состоянием здоровья коллективов: осмотры в школах и детских садах, изоляция заболевших детей, необходимые лечебные мероприятия, выявление скрытых форм носительства стрептококковой инфекции и их лечение.
Чтобы полностью очистить организм от возбудителя и излечиться от заболевания, Всемирная организация здравоохранения рекомендует применять пенициллины согласно назначению врача более 10-ти дней.
Важны профилактические меры, препятствующие распространению внутрибольничной стрептококковой инфекции. Потому что в стационарах находятся дети, у которых ослабленное состояние, потому их организмам многократно сложнее противиться заболеванию, и у них вероятнее летальный исход.
Чтобы предупредить заражение рожениц и новорожденных, следует соблюдать санитарно-гигиенические нормы и режим, разработанные для отделений гинекологии и родильных домов.
К каким докторам следует обращаться если у Вас Стрептококковая инфекция у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Стрептококковой инфекции у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Тема эта очень узконаправленная, и вопрос в том, насколько она может быть интересна широкому кругу читателей. Однако ради одних только отдаленных последствий заболеваний, вызванных S. agalactiae, ее стоит рассмотреть.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Для начала капелька истории.
Микробиологические аспекты
Согласно современной классификации S. agalactiae относится к стрептококкам группы В и является единственным представителем в указанной группе. Общим с остальными стрептококками является то, что и этот зверь плохо растет в лабораторных условиях на обычных питательных средах, и ему тоже необходимы специальные среды с 5% бараньей кровью (вопрос капризности стрептококков мы обсуждали в первой статье этого года).
Несмотря на капризы вне естественной среды обитания (коей является кишечник), внутри организма человека S. agalactiae проявляет одно из своих главных свойств – устойчивость к фагоцитозу нейтрофилами и моноцитами, что позволяет ему спокойно выживать и колонизировать доступные слизистые оболочки.
Клинические аспекты
S. agalactiae способен вызывать следующие состояния:
- неонатальный сепсис
- менингиты у новорожденных
- хориоамниониты
- аборты в поздние сроки беременности
- спонтанные аборты
- инфекции мочевыводящих путей
- эндокардиты
- сепсис (у матерей)
- инфекции кожи и мягких тканей, как осложнение после кесарева сечения
- маститы и эндометриты у родильниц
- септический артрит
Наиболее чувствительны к S. agalactiae:
- беременные женщины
- новорожденные
- больные с сахарным диабетом
- дети с низкой массой тела и дистрофией
- пожилые пациенты
- иммунокопрометированные пациенты (вне зависимости от причины этих состояний)
Давайте рассмотрим наиболее уязвимые (и актуальные) категории, а именно беременных женщин и новорожденных.
Как мы знаем, основным местом жительства S. agalactiae в организме человека является ЖКТ, еще точнее – кишечник. Считается, что именно оттуда и происходит колонизация влагалища. Правда, тут же у автора возникает логичный вопрос – как? Стрептококки ног не отрастили, данный представитель также не является исключением. Проблемы с гигиеной? В таких масштабах и в странах с нормальным доступом к воде? Ответ нашелся достаточно быстро – колонизации S. agalactiae наиболее подвержены женщины, ведущее бурную сексуальную жизнь в течение года до развития заболевания/беременности, причем ведущие ее с многочисленными непостоянными партнерами. А судя по наличию кишечной флоры в непредназначенной для ее жизни локации, практики этой самой жизни тоже весьма разнообразны. Поэтому при сборе анамнеза, если, конечно, удастся, стоит выяснять регулярность анальных практик (автор с уверенностью может утверждать, что это сложно), и если удалось выяснить этот аспект, в голове должен прозвучать звоночек о том, что пациентка оказывается в группе риска, особенно если она уже беременна. Хотя следует отметь, что роль именно полового пути до сих пор вызывает определенные споры (даже несмотря на многочисленные исследования связи с ЗППП и с носительством S. agalactiae в уретре мужчин). Но автор согласен оставить этот вопрос дискутабельным.
Когда лучше всего определять факт носительства S. agalactiae для принятия адекватных мер по профилактике вышеперечисленных состояний? На 35-37 неделе беременности. Но следует учитывать, что носительство может быть непостоянным (транзиторным или перемежающимся), что затрудняет его обнаружение в скрининговых исследованиях, то есть если при исследованиях его нет, это не значит, что его там действительно нет, особенно если дама вела активную добеременную жизнь.
Какие факторы могут влиять на наличие носительства S. agalactiae?
- Женщины старшего возраста с репродуктивными проблемами ранее
- Расовые различия – у белых женщин частота колонизации в разы меньше (автор уже не может угадать, откуда его читают, поэтому решил указать и этот фактор)
- Количество предыдущих беременностей
Можно ли проводить скрининг до беременности? Можно, но смысла в нем не будет, ибо даже фаза менструального цикла влияет на выявляемость S. agalactiae.
Какие именно осложнения вызывает носительство S. agalactiae у беременных:
- преждевременные роды
- длительный безводный период
- малый вес новорожденных
- мертворождение
А к числу факторов риска развития этих состояний относят:
- кесарево сечение
- сахарный диабет
- общее снижение иммунитета
- массивную колонизацию S. agalactiae
Учитывая вышеперечисленное, массивная колонизация родовых путей матери создает серьезные угрозы инфекции у новорожденных – почти половина новорожденных от таких матерей будет иметь массированную колонизацию кожи и слизистых оболочек S. agalactiae. Заболеет ли каждый из них? Конечно, нет. Статистика говорит, что из таких детей-носителей заболеет не более 2%, которые будут иметь следующий набор факторов риска:
- Факторы, которые непосредственно связаны с матерью:
- Самый главный – наличие S. agalactiae на слизистой шейки матки у беременных
- Инфекции, связанные с S. agalactiae у ранее рожденных детей
- Длительный безводный период
- Преждевременные роды
- Подъем температуры во время родов
- Бактериурия
- Хориоамнионит
- Факторы, связанные непосредственно с новорожденным:
- Недоношенность и малый вес при рождении
- Кесарево сечение
- Длительное инструментальное обследование внутриутробно
У детей S. agalactiae может стать причиной:
- Менингитов
- Пневмоний
- Остеомиелитов
- Сепсиса
- Заболеваний глаз
- Артритов
- Ангин
- Нейтропений
У новорожденных заболевания могут развиваться в разные сроки. Чаще всего инфекции развиваются в течение первых 12 часов (сепсис, менингит, пневмония и нейтропения). Заражение происходит во время родов или внутриутробно перед родами через разорванный плодный пузырь. Летальность при раннем развитии колоссальная – более 50% и развивается в первые сутки. Как вы помните, в таких сроках антибиотики фактически бессильны (вспоминаем правило 48 часов для бактерицидных препаратов). У половины выживших детей затем могут развиваться осложнения со стороны ЦНС (например, ДЦП).
Значительно реже инфекция раскручивается в поздние сроки (от недели до трех месяцев), и чаще всего это будет менингит. Течет более благоприятно, летальность значительно ниже, но она есть. Также могут встречаться инфекции кожи и мягких тканей, септические артриты. После выздоровления в дальнейшем половина детей наблюдаются у неврологов в связи с серьезными неврологическими осложнениями.
Отдельного упоминания требует внутрибольничное распространение S. agalactiae в случае, когда мать не является его носителем и речь идет об инфекциях, связанных с медицинскими вмешательствами. Со всеми вытекающими, которые мы обсуждали в соответствующей статье.
Что со всем этим делать?
- Скрининг – мазок из влагалища и прямой кишки. То есть активное выявление беременных женщин – носителей S. agalactiae для последующей профилактики в родах, если наличие микроорганизма подтвердится. Руководства и рекомендации говорят о проведении скрининга в сроках 35-37 недель. Положительным считается наличие S. agalactiae в любом локусе.
- Далее должна быть проведена оценка факторов риска – если они есть, то рекомендуется назначение препаратов пенициллинового ряда во время родов (по аналогии с периоперационной антибиотикопрофилактикой, с одной существенной разницей – там препараты назначаются за 30-40 минут до оперативного вмешательства, а здесь непосредственно во время родов, и в идеале внутривенно капельно для создания максимальной времязависимой концентрации в тканях и крови, которые сдержат размножение патогенна).
- Если скрининг не проводился и женщина поступила в роддом как есть, то в случае длительного безводного периода и/или подъема температуры в родах выше 38°С также назначается пенициллин в родах.
- Если на скрининге S. agalactiae не выявлен, а также нет факторов риска (лихорадка и безводный период в родах), то профилактика не проводится.
Если имеется аллергия на пенициллиновый ряд, используем клиндамицин, так как эритромицин нам не помощник в виду высочайшего уровня резистентности у почти всех стерептококков.
К сожалению, профилактика не всесильна. Конечно, она предупреждает раннее развитие инфекции, но ничего не может сделать с мертворождением, преждевременными родами или инфекциями, развивающимися в более поздние сроки. Так что вопрос инфекций, связанных с S. agalactiae, будет еще достаточно длительное время очень актуальным, и в нем, к сожалению, нет простых решений.
Читайте также:

