Стрептококки агалактия после родов
Обновлено: 17.04.2024
В этой статье мы поговорим о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Почему за исключением S. pyogenes? Да потому что данного возбудителя мы рассмотрели в отдельной статье. Кроме того, мы уже говорим практически на одном языке, а потому можем себе позволить поговорить о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Микробиологические аспекты
Для начала разберемся с классификациями, чтобы понимать принципы разнесения стрептококков по группам. Так сложилось, что для классификации стрептококков используются их фенотипические характеристики, а именно характеристики по гемолитическим свойствам:
- β-гемолитические стрептококки вызывают полный гемолиз эритроцитов питательной среды с формированием прозрачной зоны вокруг колоний на кровяном агаре
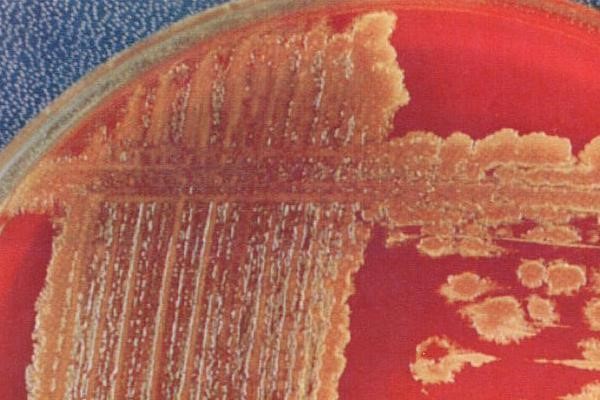
- α-гемолитические (зеленящие) образуют зеленоватый ореол вокруг колоний в результате неполного разложения гемоглобина
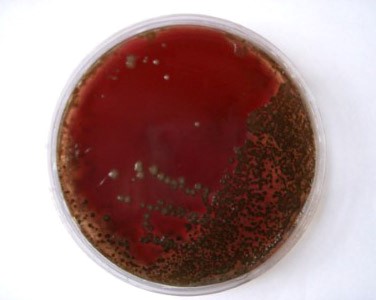
- γ-гемолитические по-другому именуются негемолитическими, то есть ничего никуда из крови не разлагают.
Собственно, почему кровь? Дело в том, что стрептококки крайне требовательны к питательным средам и к условиям, в которых их растят. И чтобы они выросли, в питательные среды (в основном, жидкие) необходимо или добавлять мясной экстракт, или использовать коммерческие питательные среды с добавлением крови барана, или 5%-й кровяной агар – и все это с большим количеством дополнительных компонентов. Для определения характера гемолиза традиционно используется среда с 5%-й дефибринированной кровью барана.
Подобное разделение по группам и типам гемолиза является решающим для деления стрептококков, имеющих медицинское значение, позволяя разделить патогенные и условно-патогенные микроорганизмы. Про патогенные мы уже поговорили ранее, теперь будем вести разговор о более обширной группе условно-патогенных представителей и начнем со стрептококков групп A, C, D и F, оставив для отдельного разговора группу В и единственного ее представителя – S. agalactiae.
Основными характеристиками представителей этих групп является то, что все они:
- Обладают β-гемолитической активностью
- Относятся к нормальной микрофлоре человека и животных
- Могут вызывать оппортунистические инфекции в различных локализациях
- Fc-антиген, способный взаимодействовать с Fc-фрагментом IgG, тем самым угнетая систему комплемента и подавляя активность фагоцитов. Кроме того, он же активирует выработку аутоиммунных антител, которые в дальнейшем участвуют в развитии иммунного воспаления;
- Р-антиген, обладающий иммуносупрессивной активностью и являющийся общим для всех стрептококков. Он подавляет выработку антител и усиливает реакции гиперчувствительности замедленного типа.
Кроме того, стрептококки имеют такой фактор патогенности, как М-протеин, который нарушает фагоцитарную активность путем маскировки рецепторов для комплемента, что очень затрудняет борьбу с этими возбудителями.
Клинические аспекты
1. Streptococcus dysgalactiae – объединяет двух представителей Streptococcus dysgalactiae subsp. dysgalactiae и Streptococcus dysgalactiae subsp. equisimilis. Первый живет на животных (и вызывает маститы у коров, на человеке в качестве возбудителя пока не ловили), второй на человеке – в верхних дыхательных путях и влагалище – и может быть причиной менингита, септических артритов и инфекций кожи (при условии наличия соответствующей симптоматики и в отсутствии других вероятных возбудителей).
2. Стрептококки группы Anginosus (S. anginosus, S. constellatus, S. intermedius) относятся к представителям нормальной флоры человека. Обрести зубы и стать возбудителями инфекции их могут заставить травмы, оперативные вмешательства, сахарный диабет, онкологические заболевания и иммунодефициты различной этиологии. Сами по себе на человека не бросаются и обнаружение оных вне клинической картины истребления не требует.
- S.anginosus – в норме обитает в полости рта, верхних дыхательных путях и влагалище. При патологии может быть высеян из урогенитальной и желудочно-кишечной локализаций.
- S. constellatus – в норме живет в верхних дыхательных путях и ЖКТ. При патологических процессах могут быть обнаружены где угодно.
- S. intermedius – в норме обитает в полости рта и верхних дыхательных путях. При патологических процессах в основном высевается из мозга, из крови при эндокардитах и из печеночных абсцессов (проще говоря оттуда, где в норме все должно быть стерильно).
3. S. equi клинического значения не имеет, так как является зоонозом и вызывает ветеринарные проблемы у коров, лошадей, морских свинок, овец и коз. Иногда – при употреблении зараженных молочных продуктов – может быть обнаружен у людей, больных нефритом.
4. S. canis, как понятно из названия, выделяют от собак. У людей могут вызывать инфекции мягких тканей, пневмонии, сепсис, остеомиелит.
5. S. iniae – обнаруживается у дельфинов и рыб. А также у людей, занятых на обработке замороженной рыбы. Крайне редко вызывает заболевание (описаны всего несколько случаев), хорошо лечится бета-лактамами и макролидами.
6. И несколько чисто зоонозных представителей, не имеющих медицинского значения, но иногда сеющихся с людей, которые за этими животными ухаживают или лечат:
- S. porcinus – вызывает абсцессы глотки свиней, пневмонию и аборты;
- S. didelphis – вызывает инфекции кожи, печени, легких и селезенки у опоссумов;
- S. phocae – выделяется у морских котиков при пневмонии у оных.
Как мы увидели, в большинстве своем перечисленные возбудители относятся к нормальной микрофлоре верхних дыхательных путей, кожи, ЖКТ и урогенитального тракта, а чтобы они вызвали заболевание, во внутреннюю среду организма должно проникнуть очень большое количество оных, при этом иммунная система должна быть подавлена тем или иным образом. Чаще всего такую роль играют медицинские вмешательства (инъекции, операции, катетеризация сосудов, гемодиализ и т. п.) на фоне тяжелых основных или сопутствующих заболеваний. Тогда стрептококки способны вызвать инфекции кожи и мягких тканей, верхних дыхательных путей, эндокардиты и сепсис, инфекции урогенитального тракта, при этом строгой локализации процесса соответствующим возбудителем уже не будет, а будет инфекция, связанная с медицинским вмешательством.
Что делать?
Как можно раньше провести бактериологическую диагностику и главным в ней будет правильная техника взятия биологического материала, чтобы точно исключить его контаминацию ни в чем не повинными мирными соседями, просмотрев истинного возбудителя. Техника взятия материала и правила транспортировки в лабораторию подробно расписаны здесь.
Чем лечить?
Этот вопрос мы можем задать только тогда, когда точно понимаем, что именно вышеуказанные зверушки являются возбудителями и никто за ними не прячется. Хорошая новость в том, что стрептококки до сих пор сохранили высокую чувствительность к бета-лактамам вообще и к пенициллинам в частности, то есть лечить их дешево. Плохая новость в том, что фактически утеряна чувствительность к макролидам, и поэтому они не могут быть препаратами выбора – это обязательно надо учитывать при назначении стартовой терапии.
Кроме того, стрептококки продолжают демонстрировать высокую чувствительность к ванкомицину, но в виду неоднозначности самого препарата в плане безопасности его применения, им тоже не следует злоупотреблять и включать его в схему лечения только в случае наличия аллергии к пенициллиновому ряду.
Итак, мы закончили краткое рассмотрение представителей стрептококков групп A, C, D, F и G, и нам осталось рассмотреть только одного представителя из группы В, а именно S.agalactiae, чем мы и займемся в следующей статье.
Для цитирования: Садова Н.В., Заплатников, Шипулина О.Ю. и др. Диагностика, профилактика и лечение перинатальной Streptococcus agalactiae инфекции. РМЖ. 2011;22:1334.
Одним из частых бактериальных заболеваний перинатального периода является инфекция, вызванная Streptococcus agalactiae (S. agalactiae). У женщин в период беременности S. agalactiae–инфекция может протекать как бессимптомно, так и клинически значимо с развитием бактериемии, эндометрита, хориоамнионита, воспаления мочевых и родовых путей, а у новорожденных детей проявляться локализованными и инвазивными поражениями [1–13].
S. agalactiae относится к стрептококкам группы В, которые являются грамположительными инкапсулированными факультативными анаэробами, не образующими спор. Главным фактором вирулентности S. agalactiae является полисахаридная капсула. Из белковых факторов патогенности особо отмечают С5а пептидазу, бета–гемолизин, С протеины (альфа– и бета–), гиалуронидазу, Sip белок, CAMP фактор (В–белок), а также комплекс протеаз, гемолизин, адгезины и др. [2,14–16].
Установлено, что 15–40% женщин являются носителями S. agalactiae, колонизирующей слизистые влагалища или прямой кишки [1,2,6,8]. Рождение детей от S. agalactiae–инфицированных женщин в 50% сопровождается вертикальной трансмиссией возбудителя. Передача инфекции от инфицированной матери происходит, как правило, незадолго до родов или непосредственно во время родов. В постнатальный период, особенно в ближайшие часы и сутки после рождения, ребенок также может инфицироваться, однако это случается значительно реже по сравнению с пре– и интранатальной контаминацией. Отмечено, что S. agalactiae–инфицирование новорожденных не всегда приводит к развитию инфекционного процесса. Факторами риска реализации инфекции у ребенка, рожденного от S. agalactiae–инфицированной женщины, являются: возраст беременной (12 часов), задержка внутриутробного развития и наличие S. agalactiae–инфекции у ранее рожденных детей [6,8].
Неонатальная заболеваемость S. agalactiae–инфекцией до недавнего времени составляла 1–4 на 1000 живорожденных детей, среди которых в 75% случаев имела место манифестация в 1–7–е сутки жизни. При этом на 100 инфицированных беременных женщин рождался 1 ребенок с тяжелой S. agalactiae–инфекцией [4–6]. Благодаря активному использованию в акушерской практике рекомендаций по профилактике S. agalactiae–инфекции, удалось существенно снизить уровень инфицированности новорожденных, а также частоту инвазивных форм заболевания у детей первого месяца жизни. Так, в странах, где проводится антибактериальная профилактика перинатальной S. agalactiae–инфекции, заболеваемость в ранний неонатальный период удалось снизить более чем на 80%, а показатели неонатальной заболеваемости в целом не превышают 0,3 случая на 1000 живорожденных детей [8].
Клиническими проявлениями перинатальной S. agalactiae–инфекции у женщин являются послеродовые инфекции эндометрия, мочевыводящих путей, головного мозга, а также сепсис и осложнения кесарева сечения. У новорожденных выделяют локализованные и инвазивные формы перинатальной S. agalactiae–инфекции. При этом в зависимости от времени манифестации выделяют заболевания с ранним (до 7 дня жизни) и поздним (после 7 суток жизни) дебютом. S. agalactiae–инфекция у новорожденных наиболее часто протекает в виде инвазивных форм с бактериемией, поражением легких, мозговых оболочек. Нередко при этом заболевание приобретает септический характер, особенно у недоношенных и маловесных детей, у которых сепсис отмечен в 77–88% среди всех случаев S. agalactiae–инфекции. Именно в этой группе пациентов S. agalactiae–инфекция протекает наиболее тяжело и нередко заканчивается летально [3,8]. Особо следует отметить, что в подавляющем большинстве случаев дети при этом рождаются в нормальном состоянии, однако уже через несколько часов клиническая картина резко меняется.
Манифестация ранних форм, как правило, дебютирует цианозом и респираторными нарушениями (апноэ, тахипноэ). Возможна также молниеносная форма заболевания, при которой очень быстро появляются все признаки септического шока [3–10]. В клинических анализах крови при этом нередко обнаруживают лейкопению. При позднем дебюте (после 7–го дня жизни) S. agalactiae–инфекция также может протекать в виде сепсиса или менингита [8]. Клинически при этом чаще регистрируют напряжение родничков, лихорадку, угнетение сознания вплоть до комы и тонико–клонические судороги. Реже отмечаются другие проявления инфекции: омфалит, отит, синусит, конъюнктивит, артрит, остеомиелит, поражения кожи, мочевой системы, эндокардит, миокардит.
В связи с низкой специфичностью клинических проявлений S. agalactiae–инфекции у новорожденных детей особое значение в верификации этиологии заболевания приобретают лабораторные методы диагностики (классические бактериологические, серологические, молекулярно–биологические) [2,11,17,18]. При бактериоскопии обнаруживают типичные грамположительные кокки, образующие короткие цепочки. Для выявления S. agalactiae в биологических жидкостях организма (в крови, ликворе, моче, трахео–бронхиальном аспирате) методом бактериологических посевов необходимо использовать среды, обогащенные кровью или сывороткой, т.к. выделение S. agalactiae на обычных средах, как правило, не превышает 10–12%. Серологические методы диагностики имеют значение лишь в плане ретроспективного подтверждения диагноза, а также для выявления напряженности пассивного иммунитета, трансплацентарно полученного от матери. При этом к факторам высокого риска реализации S. agalactiae–инфекции в неонатальный период относят указание на серонегативность или низкие титры специфических антител у инфицированных беременных женщин.
В последние годы все большую значимость приобретают молекулярно–биологические методы диагностики. Быстрота получения результатов при использовании полимеразной цепной реакции (ПЦР) в сочетании с высокой чувствительностью и специфичностью делают ПЦР незаменимым методом верификации инфекционных заболеваний, особенно в неонатологической практике [17,18]. Так, нами в пилотном исследовании было проведено изучение чувствительности ПЦР в детекции генома S. agalactiae в сравнении с методом бактериологических посевов. При исследовании аспирата из трахеи у 62 новорожденных, находящихся в отделении неонатальной реанимации и интенсивной терапии в связи с тяжелыми инфекциями неонатального периода, у 9 детей (14,5%) методом ПЦР удалось выявить геном S. agalactiae, в то время как при параллельно выполненных бактериологических посевах результаты были отрицательными. Вероятно, негативные результаты бактериологического исследования были обусловлены массивной антибиотикотерапией, проводимой детям с первых дней жизни, что могло привести к изменению культурально–морфологических характеристик возбудителя и снижению числа жизнеспособных микроорганизмов.
Методы специфической иммунопрофилактики S. agalactiae–инфекции до настоящего времени не разработаны, поэтому для предупреждения перинатальной S. agalactiae–инфекции используют антибиотикопрофилактику (АБ–профилактика). Разработанные в 2002 г. рекомендации СDC предусматривают обязательное обследование на S. agalactiae–носительство всех беременных женщин на сроке 35–37 недель [6]. При выделении возбудителя из влагалища и/или заднепроходного канала женщине в период родов назначают антибиотики в тех случаях, когда имеются определенные факторы риска. К факторам риска при этом относят следующие состояния: предыдущий ребенок перенес инвазивную S. agalactiae–инфекцию, во время настоящей беременности имели место S. agalactiae–бактериурия, угроза преждевременных родов (до 37 нед.), безводный промежуток больше 12 часов, лихорадка в родах. В случае выявления у S. agalactia–инфицированной женщины одного из указанных выше факторов риска, для профилактики перинатальной S. agalactiae–инфекции в период родов назначают антибиотик.
Для АБ–профилактики рекомендовано использовать бензилпенициллин, который вводят внутривенно в дозе 5 млн. ЕД с момента начала родовой деятельности, переходя в дальнейшем на дозу 2,5 млн. ЕД каждые 4 часа до окончания родов. Альтернативой бензилпенициллину является ампициллин, который вводят также внутривенно, первоначально в дозе 2 г на введение, а затем – по 1 г каждые 4 часа. При аллергии к пенициллинам их заменяют клиндамицином или эритромицином, но чаще в этих случаях рекомендуют цефазолин (вначале – 2 г на введение внутривенно, затем по 1 г каждые 8 часов внутривенно до окончания родов). При высоком риске развития анафилаксии на бета–лактамные антибиотики может быть использован ванкомицин, который рекомендуют вводить внутривенно по 1 г каждые 12 часов до окончания родов. Анализ результатов проведенных исследований показал, что благодаря АБ–профилактике удалось существенно снизить не только неонатальную заболеваемость S. agalactiae–инфекцией (регресс более чем на 80%), но и частоту развития инвазивных форм, что определило значительное улучшение прогноза заболевания [6,8].
В тех случаях, когда женщине во время родов АБ–профилактика S. agalactiae–инфекции проведена не была, а у новорожденного имеются факторы риска (мать – носитель S. agalactiae, возраст матери менее 20 лет, отягощенный акушерский анамнез, преждевременные роды, лихорадка в родах, длительный безводный период, S. agalactiae–инфекции у ранее рожденных детей, а также признаки задержки внутриутробного развития у самого ребенка), следует как можно быстрее начать этиотропную терапию. Выбор стартовой АБ–терапии при этом проводится эмпирически. В связи с тем, что S. agalactiae высокочувствителен к бета–лактамным антибиотикам, при подозрении на S. agalactiae–инфекцию препаратом выбора является ампициллин. Однако учитывая, что клиническая картина неспецифична и имеется вероятность иной этиологии заболевания, ампициллин комбинируют с гентамицином. При этом предпочтителен внутривенный путь введения антибиотиков. В тех случаях, когда развивается неонатальный S. agalactiae–сепсис, ампициллин назначают из расчета 200 мг/кг/сутки [3,8]. При менингите дозы антибиотиков увеличивают, ампицилин при этом вводят из расчета 300 мг/кг/сутки. При выделении S. agalactiae и его генома лечение продолжают выбранной комбинацией антибиотиков до улучшения состояния, а в дальнейшем переходят на монотерапию ампициллином. При неинвазивных формах S. agalactiae–инфекции продолжительность монотерапии составляет 10 суток, при S. agalactiae–неосложненных менингитах – 14 суток, при S. agalactiae–артритах и остеомиелитах – 3–4 недели, при S. agalactiae–эндокартите и S. agalactiae–вентрикулите – не менее 4 недель [6,8].
Таким образом, в настоящее время имеются все возможности для снижения заболеваемости и летальности от перинатальной S. agalactiae–инфекции. Для этого необходимо у всех беременных женщин на сроке 35–37 недель проводить скрининг на S. agalactiae–носительство. При его подтверждении и наличии факторов риска (предыдущий ребенок в неонатальном периоде перенес S. agalactiae–инфекцию, наличие у женщины S. agalactiae–бактериурии, преждевременные роды, длительный безводный период, лихорадка в родах) женщине в родах должны быть назначены антибиотики для профилактики перинатальной S. agalactiae–контаминации ее ребенка. Строгое выполнение указанных рекомендаций позволяет достоверно снизить риск вертикального инфицирования и значительно уменьшает частоту инвазивных форм S. agalactiae–заболеваний у новорожденных детей.
Литература
1. Оганян К.А. Течение и исход беременности при колонизации мочеполового тракта женщин стрептококками группы В и D. Автореф. дисс. канд. мед. наук.– СПБ, 2008, 24
2. Покровский В.И., Поздеев О.К. Семейство Streptococcaceae/ Медицинская микробиология. ГЭОТАР Медицина, М, 1999: 193–206.
3. Шабалов Н. П. Внутриутробные инфекции/ Неонатология. В 2 т. – С–Пб.: Специальная литература, 1996, Т. 2: 43–76.
4. Baltimore R.S. Huie S.M., Meek J.I., Schuchat A. Early–onset neonatal sepsis in the era of group В streptococcal prevention. Pediatrics. 2001. Vol. 108: 1094–8.
5. Boyer K.M.: Neonatal group В streptococcal infections // Current Opinion Pediatrics, 1995, 7: 13–18.
6. Centers for Disease Control and prevention (CDC). Prevention of perinatal group В streptococcal disease: Revised Guidelines from CDC // Morb. Mortal. Wkly Rep. 2002.Vol.51: 10–22
7. Kenyon S.L., Taylor PJ., Tarnow–Mordi W. Broad–spectrum antibiotics for preterm, prelabour rupture of fetal membranes, ORACLE Collaborative Group // Lancet. 2001. Vol. 357: 979–88.
8. Red Book: Report of the Committee on Infectious Diseases. 27h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2006; 992.
9. Weisner A.M., Johnson A.P., Lamagni T.L. et al. Characterization of group В streptococci recovered from infants with invasive disease in England and Wales // Clin Infect Dis. 2004. Vol. 38: 1203–1208.
10. Nandyal RR. Update on group B streptococcal infections: perinatal and neonatal periods. J Perinat Neonatal Nurs. 2008, 22, 3: 230—37.
11. Шуляк Б.Ф. Инфекция стрептококка группы В, методы ее лабораторной диагностики и профилактики. Медицинский алфавит. 2010, №2: 47–53
12. Gardam M.A., Low D.E., Saginur R. Group B streptococcal necrotizing fasciitis and streptococcal toxic shock–like syndrome in adults. Arch Intern Med, 1998, 158: 1704–08.
13. Sendi P., Johansson L., Norrby–Teglund A. Invasive group B Streptococcal disease in non–pregnant adults: a review with emphasis on skin and soft–tissue infections. Infection. 2008, 36, 2, 100–11.
14. Дмитриев А.В., Шаклеина Е.В. Молекулярная эпидемиология патогенных стрептококков группы В // Ж. микроб. эпидемиол. и иммунол. 2003: 83–92.
15. Fischetti V.A. Gram–Positive Pathogens, American Society Microbiology, Washington, D.C, 2000. 511 p.
16. Jacobsson K. A Novel family of fibrinogen–binding proteins in Streptococcus agalactiae // Vet. Microbiol. 2003. Vol. 96: 103–113.
17. Эйдельштейн И.А., Сехин С.В., Иванчик Н.В. и др. Валидация тест–системы на основе ПЦР в режиме реального времени для выявления Streptococcus agalactiae в сравнении с микробиологическим методом. Молекулярная диагностика. М., 2010, 3: 346–348.
18. Сафонова А.П., Пиксасова О.В., Скачкова Т.С. и др. Разработка методики выявления и количественного определения ДНК Streptococcus agalactiae на основе ПЦР в режиме реального времени. II Ежегодный Всероссийский Конгресс по инфекционным болезням. М, 2010: 282.
Рассмотрена проблема стрептококковой инфекции у беременных и новорожденных, факторы риска развития внутрибольничных инфекций, развития внутриутробной инфекции, вызванной стрептококком группы В, подходы к диагностике и лечению.
The issue of streptococcus infection in the pregnant and newborns was considered, as well as risk factors for intrahospital infection development and development of transplacental infection caused by group B streptococcus, approaches to the diagnostics and treatment.
Заболевания, вызванные стрептококком группы В (СГБ), являются ведущей причиной детской смертности во всем мире. СГБ колонизирует в прямой кишке и влагалище матери, передается при прохождении через родовые пути, что является важным фактором риска для заболевания СГБ. Известны также пути передачи СГБ через грудное молоко. Однако большинство младенцев не инфицируются СГБ. Ученые Англии попытались разобраться в механизмах, связанных с передачей СГБ, и механизмах защиты грудных младенцев от инфицирования: колонизация в грудном молоке, с одной стороны, и врожденные адаптивные иммунные факторы защиты у ребенка, с другой стороны. Рассмотрено значение олигосахаридов человека в защите от заболеваний, вызываемых СГБ. Все это важно для снижения риска передачи СГБ от матери к ребенку, защиты новорожденного от тяжелых заболеваний, вызываемых СГБ, и способствует разработке новых мер профилактики, в том числе материнской иммунизации для предотвращения детских болезней [1–3].
СГБ колонизирует в грудном молоке, передается грудным младенцам при вскармливании, вызывает тяжелые заболевания. Все это подтолкнуло исследователей из Италии поставить вопрос важности и ценности грудного вскармливания под сомнение [4–6]. Ими были предложены меры профилактики инфицирования/реинфицирования младенцев СГБ: сочетанное применение антибактериальных препаратов (в частности, ампициллина и рифампицина) с временным прекращением грудного вскармливания и/или использование обработанного, очищенного грудного молока. Ученые подчеркивали важность наличия единых рекомендаций по грудному вскармливанию и профилактике заболеваний новорожденных, вызванных СГБ.
Ученые Франции единодушно поддерживают мнение научного мирового сообщества, что СГБ является основной причиной угрожающих жизни новорожденных бактериальных инфекций в развитых странах. Они изучили ситуацию, связанную с СГБ, в своей стране. Во Франции СГБ колонизируют во влагалище примерно у 10–15% женщин к концу беременности. Вертикальная передача бактериального агента происходит, по мнению исследователей, при излитии околоплодных вод (разрыв плодного пузыря) или во время родов. Одна треть детей, рожденных от инфицированных СГБ матерей, получают инфект, но только в 3% случаев развиваются серьезные заболевания (в частности, менингит) в первые 7 дней жизни у новорожденных. Усугубляющими факторами, повышающими риск тяжелых бактериальных инфекций грудничков (до 50–75% ранних неонатальных заболеваний СГБ), являются повышение температуры тела у роженицы и длительный безводный промежуток (более 18 часов). Несколько рандомизированных исследований позволяют предположить эффективность внутривенного применения антибактериальных препаратов во время родов. Препаратом выбора является бензилпенициллин, далее следуют ампициллин или амоксициллин, далее — эритромицин, клиндамицин. Среди осложнений антибактериальной терапии выделяют анафилактическую реакцию. Широкое внедрение стандартного вагинального скрининга в 35–38 недель привело к снижению роста ранних неонатальных заболеваний, вызванных СГБ. В США применяют скрининг с последующей антибактериальной терапией при инфицировании СГБ матери. В Соединенном Королевстве систематическая антибактериальная терапия рекомендуется в группах повышенного инфекционного риска без проведения скрининга. Ученые Франции рекомендуют проведение антибиотикопрофилактики во время родов при высоком риске инфекции новорожденных, вызванных СГБ, подтвержденным лабораторно [2].
Ученые Германии подтверждают своей глубокой заинтересованностью, что СГБ остается ведущей причиной неонатального сепсиса и менингита. Интранатальная антибиотикопрофилактика привела к значительному снижению частоты раннего сепсиса, однако частота позднего сепсиса остается неизменной. По их мнению, важно выявить этиологический фактор возникновения позднего сепсиса: колонизация СГБ на коже новорожденного (превалирующий фактор) или острая экзогенная инфекция. Есть и другие работы из Германии, Финляндии, подчеркивающие большую значимость колонизации СГБ в грудном молоке и горизонтальный путь передачи инфекта [7–10]. Любопытен клинический случай итальянских исследователей: развитие позднего неонатального сепсиса у недоношенного новорожденного, начавшегося с возникновения подчелюстной флегмоны при переводе на грудное вскармливание. Младенец с синдромом задержки развития плода, родившийся путем операции экстренного кесарева сечения у матери с HELLP-синдромом, находился в отделении интенсивной терапии, получал пастеризованное молоко матери, набирал вес. При улучшении общего состояния ребенка на 23?й день жизни перевели на грудное вскармливание, после чего у него спустя короткое время развилась подчелюстная флегмона, подтвержденная клиническими и ультразвуковыми данными, и сепсис. Бактериологическое исследование крови новорожденного путем полимеразной цепной реакции выявило наличие Streptococcus agalactiae, который также был найден в материнском молоке, что, по мнению авторов, подтверждает источник инфицирования [5].
В Саудовской Аравии провели исследование, целью которого явилось выявление степени колонизации СГБ среди беременных с определением чувствительности к антибиотикам. Возрастная группа составила от 17 до 47 лет, колонизация СГБ была обнаружена во всех возрастных группах до 13%. Более высокий уровень колонизации был замечен у женщин старше 40 лет (27%), у женщин с гестационным сроком от 42 недель и выше, у многорожавших женщин. Все высеянные культуры были высокочувствительны к бензилпенициллину, ампициллину и ванкомицину; малочувствительны — к эритромицину и клиндамицину [11]. Резюмируя все это, ученые считают обоснованной и необходимой проведение интранатальной антибиотикопрофилактики у пациенток с вагинальной колонизацией СГБ, установленной путем скрининга после 35 нед в женской консультации, с целью предотвращения передачи инфекта новорожденному [11–18].
Итак, следует выделить основные моменты профилактики раннего и позднего неонатального сепсиса: проведение влагалищного скрининга на поздних сроках беременности; проведение интранатальной антибиотикопрофилактики в группах высокого риска; препарат выбора — антибиотики пенициллинового ряда. Несмотря на снижение частоты инфекционно-воспалительных заболеваний у новорожденных, вызванных СГБ, и доказанную эффективность профилактического введения антибактериальных препаратов у матери в родах, данная проблема не теряет своей актуальности. В настоящее время назрела необходимость разработки отечественных рекомендаций, основанных на современной диагностике, включающих молекулярно-биологические методы исследования, анализе эффективности используемых схем терапии, направленных на снижение неблагоприятных акушерских и перинатальных исходов.
Материнский сепсис — серьезная проблема в акушерстве, нередко приводящая к материнской смертности. В настоящее время в мире инфекции стоят на третьем месте в структуре материнской смертности и составляют 15%, а в развивающихся странах септический шок, связанный с септическим абортом и послеродовым эндометритом по-прежнему занимает одно из ведущих мест, несмотря на значительный прогресс в отношении профилактики и лечения гнойно-септических осложнений в акушерстве. В России материнская смертность, связанная с сепсисом во время родов и в послеродовом периоде, в общей структуре материнской смертности составляет 3,4%, но если учесть все случаи, связанные с абортами (больничными и внебольничными), а это 10%, то проблема становится весьма актуальной.
Самарские ученые провели свое исследование, согласно которому основными клиническими и организационными аспектами материнской и поздней материнской смертности от сепсиса явились: криминальный аборт (86,7% случаев); позднее обращение за медицинской помощью (87,5% случаев); сокрытие факта криминального вмешательства (100% случаев); выскабливание стенок полости матки на фоне септического шока (26,7% случаев); недооценка объема кровопотери и неадекватная инфузионная терапия (20% случаев); запоздалое оперативное вмешательство — гистерэктомия (41,7%). В предотвращении летальных исходов от гнойно-септических осложнений определяющим является фактор времени. Своевременное и адекватное лечение позволяет предотвратить такое грозное осложнение, как септический шок [19].
В России основными возбудителями сепсиса являются энтеробактерии (чаще E. coli), грамположительные кокки (СГБ, Enterococcus spp., S. aureus и др.) и неспорообразующие анаэробы (Bacteroides spp., Peptococcus spp., Peptostreptococcus spp.). В отдельных случаях (особенно при криминальных абортах) возбудителем может быть C. perfringens [20].
Изучая причастность СГБ к развитию материнского сепсиса, исследователи Ирландии пришли к выводу, что на первом месте среди возбудителей стоит E. coli (37%), далее следует СГБ (25%), S. aureus (11%) и анаэробы (4%). Эти данные были подтверждены ретроспективным анализом акушерских пациентов с 2001 по 2014 г. (выявление клинически значимой бактериемии) [21].
Таким образом, проблема стрептококковой инфекции у беременных и новорожденных требует дальнейшего изучения для разработки тактики ведения беременности и снижения развития неонатальных инфекций.
Исследование выполнено за счет гранта Российского научного фонда (проект № 15-15-00109).
Литература
- Le Doare K., Kampmann B. Breast milk and Group B streptococcal infection: vector of transmission or vehicle for protection? // Vaccine. 2014, May 30; 32 (26): 3128–3132. DOI: 10.1016/j.vaccine.2014.04.020.
- Preventing neonatal group B streptococcal infection. Intrapartum antibiotic prophylaxis in some high-risk situations // Prescrire Int. 2011, Mar; 20 (114): 72–77.
- Kalin A., Acosta C., Kurinczuk J. J., Brocklehurst P., Knight M. Severe sepsis in women with group B Streptococcus in pregnancy: an exploratory UK national case-control study // BMJ Open. 2015, Oct 8; 5 (10): e007976. DOI: 10.1136/bmjopen-2015–007976.
- Davanzo R., De Cunto A., Travan L., Bacolla G., Creti R., Demarini S. To feed or not to feed? Case presentation and best practice guidance for human milk feeding and group B streptococcus in developed countries // J Hum Lact. 2013, Nov; 29 (4): 452–457. DOI: 10.1177/0890334413480427.
- Bertini G., Dani C. Group B streptococcal late-onset sepsis with submandibular phlegmon in a premature infant after beginning of breast-feeding // J Matern Fetal Neonatal Med. 2008, Mar; 21 (3): 213–215. DOI: 10.1080/14767050801924886.
- Lanari M., Serra L., Cavrini F., Liguori G., Sambri V. Late-onset group B streptococcal disease by infected mother’s milk detected by polymerase chain reaction // New Microbiol. 2007, Jul; 30 (3): 253–254.
- Elling R., Hufnagel M., de Zoysa A., Lander F., Zumstein K., Krueger M., Henneke P. Synchronous recurrence of group B streptococcal late-onset sepsis in twins // Pediatrics. 2014, May; 133 (5): e1388–1391. DOI: 10.1542/peds.2013-0426.
- Salamat S., Fischer D., van der Linden M., Buxmann H., Schlösser R. Neonatal group B streptococcal septicemia transmitted by contaminated breast milk, proven by pulsed field gel electrophoresis in 2 cases // Pediatr Infect Dis J. 2014, Apr; 33 (4): 428. DOI: 10.1097/INF.0000000000000206.
- Christiansen H., Leth H. Breast milk as a cause of group B streptococcal sepsis // Ugeskr Laeger. 2011, Jan 10; 173 (2): 129–130.
- Soukka H., Rantakokko-Jalava K., Vähäkuopus S., Ruuskanen O. Three distinct episodes of GBS septicemia in a healthy newborn during the first month of life // Eur J Pediatr. 2010, Oct; 169 (10): 1275–1277. DOI: 10.1007/s00431-010-1187-6.
- Khan M. A., Faiz A., Ashshi A. M. Maternal colonization of group B streptococcus: prevalence, associated factors and antimicrobial resistance // Ann Saudi Med. 2015, Nov-Dec; 35 (6): 423–427. DOI: 10.5144/0256–4947.2015.423.
- Shirazi M., Abbariki E., Hafizi A., Shahbazi F., Bandari M., Dastgerdy E. The prevalence of group B streptococcus colonization in Iranian pregnant women and its subsequent outcome // Int J Fertil Steril. 2014, Jan; 7 (4): 267–270.
- Burianová I., Paulová M., Cermák P., Janota J. Group B streptococcus colonization of breast milk of group B streptococcus positive mothers // J Hum Lact. 2013, Nov; 29 (4): 586–590. DOI: 10.1177/0890334413479448.
- Jawa G., Hussain Z., da Silva O. Recurrent late-onset group B Streptococcus sepsis in a preterm infant acquired by expressed breastmilk transmission: a case report // Breastfeed Med. 2013, Feb; 8 (1): 134–136. DOI: 10.1089/bfm.2012.0016.
- Javanmanesh F., Eshraghi N. Prevalence of positive recto-vaginal culture for Group B streptococcus in pregnant women at 35–37 weeks of gestation // Med J Islam Repub Iran. 2013, Feb; 27 (1): 7–11.
- Chapman E., Reveiz L., Illanes E., Bonfill Cosp X. Antibiotic regimens for management of intra-amniotic infection // Cochrane Database Syst Rev. 2014, Dec 19; 12: CD010976. DOI: 10.1002/14651858.CD010976.pub2.
- Teatero S., McGeer A., Li A., Gomes J., Seah C., Demczuk W., Martin I., Wasserscheid J., Dewar K., Melano R. G., Fittipaldi N. Population structure and antimicrobial resistance of invasive serotype IV group B Streptococcus, Toronto, Ontario, Canada // Emerg Infect Dis. 2015, Apr; 21 (4): 585–591. DOI: 10.3201/eid2014.140759.
- Meehan M., Cafferkey M., Corcoran S., Foran A., Hapnes N., LeBlanc D., McGuinness C., Nusgen U., O’Sullivan N., Cunney R., Drew R. Real-time polymerase chain reaction and culture in the diagnosis of invasive group B streptococcal disease in infants: a retrospective study // Eur J Clin Microbiol Infect Dis. 2015, Dec; 34 (12): 2413–2420. DOI: 10.1007/s10096–015–2496–5.
- Тутынина О. В., Егорова А. Т. Сепсис как причина материнских потерь // Известия Самарского научного центра Российской академии наук. Акушерство, гинекология, неонатология, педиатрия. 2014. Т. 16. № 5 (4). С. 1481–1484.
- Куликов А. В., Шифман Е. М., Заболотских И. Б. Начальная терапия сепсиса и септического шока в акушерстве // Проект клинических рекомендаций. 2014. С. 1–28.
- Drew R. J., Fonseca-Kelly Z., Eogan M. A Retrospective Audit of Clinically Significant Maternal Bacteraemia in a Specialist Maternity Hospital from 2001 to 2014 // Infect Dis Obstet Gynecol. 2015; 2015: 518562. DOI: 10.1155/2015/518562.
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
Э. И. Харченко, кандидат медицинских наук
К. Н. Арсланян, кандидат медицинских наук
О. В. Конышева, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Тема эта очень узконаправленная, и вопрос в том, насколько она может быть интересна широкому кругу читателей. Однако ради одних только отдаленных последствий заболеваний, вызванных S. agalactiae, ее стоит рассмотреть.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Для начала капелька истории.
Микробиологические аспекты
Согласно современной классификации S. agalactiae относится к стрептококкам группы В и является единственным представителем в указанной группе. Общим с остальными стрептококками является то, что и этот зверь плохо растет в лабораторных условиях на обычных питательных средах, и ему тоже необходимы специальные среды с 5% бараньей кровью (вопрос капризности стрептококков мы обсуждали в первой статье этого года).
Несмотря на капризы вне естественной среды обитания (коей является кишечник), внутри организма человека S. agalactiae проявляет одно из своих главных свойств – устойчивость к фагоцитозу нейтрофилами и моноцитами, что позволяет ему спокойно выживать и колонизировать доступные слизистые оболочки.
Клинические аспекты
S. agalactiae способен вызывать следующие состояния:
- неонатальный сепсис
- менингиты у новорожденных
- хориоамниониты
- аборты в поздние сроки беременности
- спонтанные аборты
- инфекции мочевыводящих путей
- эндокардиты
- сепсис (у матерей)
- инфекции кожи и мягких тканей, как осложнение после кесарева сечения
- маститы и эндометриты у родильниц
- септический артрит
Наиболее чувствительны к S. agalactiae:
- беременные женщины
- новорожденные
- больные с сахарным диабетом
- дети с низкой массой тела и дистрофией
- пожилые пациенты
- иммунокопрометированные пациенты (вне зависимости от причины этих состояний)
Давайте рассмотрим наиболее уязвимые (и актуальные) категории, а именно беременных женщин и новорожденных.
Как мы знаем, основным местом жительства S. agalactiae в организме человека является ЖКТ, еще точнее – кишечник. Считается, что именно оттуда и происходит колонизация влагалища. Правда, тут же у автора возникает логичный вопрос – как? Стрептококки ног не отрастили, данный представитель также не является исключением. Проблемы с гигиеной? В таких масштабах и в странах с нормальным доступом к воде? Ответ нашелся достаточно быстро – колонизации S. agalactiae наиболее подвержены женщины, ведущее бурную сексуальную жизнь в течение года до развития заболевания/беременности, причем ведущие ее с многочисленными непостоянными партнерами. А судя по наличию кишечной флоры в непредназначенной для ее жизни локации, практики этой самой жизни тоже весьма разнообразны. Поэтому при сборе анамнеза, если, конечно, удастся, стоит выяснять регулярность анальных практик (автор с уверенностью может утверждать, что это сложно), и если удалось выяснить этот аспект, в голове должен прозвучать звоночек о том, что пациентка оказывается в группе риска, особенно если она уже беременна. Хотя следует отметь, что роль именно полового пути до сих пор вызывает определенные споры (даже несмотря на многочисленные исследования связи с ЗППП и с носительством S. agalactiae в уретре мужчин). Но автор согласен оставить этот вопрос дискутабельным.
Когда лучше всего определять факт носительства S. agalactiae для принятия адекватных мер по профилактике вышеперечисленных состояний? На 35-37 неделе беременности. Но следует учитывать, что носительство может быть непостоянным (транзиторным или перемежающимся), что затрудняет его обнаружение в скрининговых исследованиях, то есть если при исследованиях его нет, это не значит, что его там действительно нет, особенно если дама вела активную добеременную жизнь.
Какие факторы могут влиять на наличие носительства S. agalactiae?
- Женщины старшего возраста с репродуктивными проблемами ранее
- Расовые различия – у белых женщин частота колонизации в разы меньше (автор уже не может угадать, откуда его читают, поэтому решил указать и этот фактор)
- Количество предыдущих беременностей
Можно ли проводить скрининг до беременности? Можно, но смысла в нем не будет, ибо даже фаза менструального цикла влияет на выявляемость S. agalactiae.
Какие именно осложнения вызывает носительство S. agalactiae у беременных:
- преждевременные роды
- длительный безводный период
- малый вес новорожденных
- мертворождение
А к числу факторов риска развития этих состояний относят:
- кесарево сечение
- сахарный диабет
- общее снижение иммунитета
- массивную колонизацию S. agalactiae
Учитывая вышеперечисленное, массивная колонизация родовых путей матери создает серьезные угрозы инфекции у новорожденных – почти половина новорожденных от таких матерей будет иметь массированную колонизацию кожи и слизистых оболочек S. agalactiae. Заболеет ли каждый из них? Конечно, нет. Статистика говорит, что из таких детей-носителей заболеет не более 2%, которые будут иметь следующий набор факторов риска:
- Факторы, которые непосредственно связаны с матерью:
- Самый главный – наличие S. agalactiae на слизистой шейки матки у беременных
- Инфекции, связанные с S. agalactiae у ранее рожденных детей
- Длительный безводный период
- Преждевременные роды
- Подъем температуры во время родов
- Бактериурия
- Хориоамнионит
- Факторы, связанные непосредственно с новорожденным:
- Недоношенность и малый вес при рождении
- Кесарево сечение
- Длительное инструментальное обследование внутриутробно
У детей S. agalactiae может стать причиной:
- Менингитов
- Пневмоний
- Остеомиелитов
- Сепсиса
- Заболеваний глаз
- Артритов
- Ангин
- Нейтропений
У новорожденных заболевания могут развиваться в разные сроки. Чаще всего инфекции развиваются в течение первых 12 часов (сепсис, менингит, пневмония и нейтропения). Заражение происходит во время родов или внутриутробно перед родами через разорванный плодный пузырь. Летальность при раннем развитии колоссальная – более 50% и развивается в первые сутки. Как вы помните, в таких сроках антибиотики фактически бессильны (вспоминаем правило 48 часов для бактерицидных препаратов). У половины выживших детей затем могут развиваться осложнения со стороны ЦНС (например, ДЦП).
Значительно реже инфекция раскручивается в поздние сроки (от недели до трех месяцев), и чаще всего это будет менингит. Течет более благоприятно, летальность значительно ниже, но она есть. Также могут встречаться инфекции кожи и мягких тканей, септические артриты. После выздоровления в дальнейшем половина детей наблюдаются у неврологов в связи с серьезными неврологическими осложнениями.
Отдельного упоминания требует внутрибольничное распространение S. agalactiae в случае, когда мать не является его носителем и речь идет об инфекциях, связанных с медицинскими вмешательствами. Со всеми вытекающими, которые мы обсуждали в соответствующей статье.
Что со всем этим делать?
- Скрининг – мазок из влагалища и прямой кишки. То есть активное выявление беременных женщин – носителей S. agalactiae для последующей профилактики в родах, если наличие микроорганизма подтвердится. Руководства и рекомендации говорят о проведении скрининга в сроках 35-37 недель. Положительным считается наличие S. agalactiae в любом локусе.
- Далее должна быть проведена оценка факторов риска – если они есть, то рекомендуется назначение препаратов пенициллинового ряда во время родов (по аналогии с периоперационной антибиотикопрофилактикой, с одной существенной разницей – там препараты назначаются за 30-40 минут до оперативного вмешательства, а здесь непосредственно во время родов, и в идеале внутривенно капельно для создания максимальной времязависимой концентрации в тканях и крови, которые сдержат размножение патогенна).
- Если скрининг не проводился и женщина поступила в роддом как есть, то в случае длительного безводного периода и/или подъема температуры в родах выше 38°С также назначается пенициллин в родах.
- Если на скрининге S. agalactiae не выявлен, а также нет факторов риска (лихорадка и безводный период в родах), то профилактика не проводится.
Если имеется аллергия на пенициллиновый ряд, используем клиндамицин, так как эритромицин нам не помощник в виду высочайшего уровня резистентности у почти всех стерептококков.
К сожалению, профилактика не всесильна. Конечно, она предупреждает раннее развитие инфекции, но ничего не может сделать с мертворождением, преждевременными родами или инфекциями, развивающимися в более поздние сроки. Так что вопрос инфекций, связанных с S. agalactiae, будет еще достаточно длительное время очень актуальным, и в нем, к сожалению, нет простых решений.
Читайте также:

