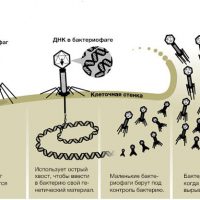
Строение бактериофага кишечной палочки
Обновлено: 18.04.2024
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Лауреат Государственной премии РФ (1999). Автор и соавтор более 300 научных работ и 20 патентов.
Вера Витальевна Морозова — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор более 30 научных работ и 6 патентов.
Игорь Викторович Бабкин — кандидат биологических наук, ведущий научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 58 научных работ и 2 патентов.
Нина Викторовна Тикунова — доктор биологических наук, заведующая лабораторией молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 120 научных работ и 21 патента.
Когда в 1930-х гг. группа ученых занялась проблемами функционирования живых систем, то в поиске простейших моделей они обратили внимание на бактериофаги — вирусы бактерий. Ведь среди биологических объектов нет ничего проще, чем бактериофаги, к тому же их можно легко и быстро выращивать и анализировать, а вирусные генетические программы невелики.
Фаг — это минимального размера природная структура, содержащая плотно упакованную генетическую программу (ДНК или РНК), в которой нет ничего лишнего. Эта программа заключена в белковую оболочку, снабженную минимальным набором устройств для ее доставки внутрь бактериальной клетки. Бактериофаги не могут размножаться сами по себе, и в этом смысле их нельзя считать полноценными живыми объектами. Их гены начинают работать только в бактерии, используя имеющиеся в бактериальной клетке биосинтетические системы и запасы молекул, необходимых для синтеза. Однако генетические программы этих вирусов принципиально не отличаются от программ более сложных организмов, поэтому эксперименты с бактериофагами позволили установить основополагающие принципы устройства и работы генома.
В дальнейшем эти знания и разработанные в ходе исследований методы стали фундаментом для развития биологической и медицинской науки, а также широкого спектра биотехнологических приложений.
Бактериофаги — наши друзья, когда речь идет о бактериях, патогенных для человека. Однако есть и другие, дружественные нам бактерии, которые используются в современных биотехнологических производствах, а также в традиционных производствах пищевой промышленности, таких как сыроварение и т. п. В этих случаях фаги могут приносить большой вред, поскольку в больших популяциях микроорганизмов, находящихся в стадии интенсивного роста, создаются благоприятные условия для размножения фагов, что приводит к лизису производственных бактериальных культур. При производстве сыра проблема не столь серьезна, так как при этом обычно применяют закваски, состоящие из многих культур, часть которых выдержит фаговую атаку и продолжит процесс молочнокислого брожения. Серьезные неприятности возникают, если весь процесс основан на применении одного конкретного бактериального штамма, как, например, при производстве антибиотиков или терапевтических белков.
Борцы с патогенами
Первые попытки использовать бактериофаги для лечения инфекционных заболеваний были предприняты практически сразу после их открытия, однако недостаток знаний и несовершенные биотехнологии того времени не позволили достичь полного успеха. Тем не менее дальнейшая клиническая практика показала принципиальную возможность успешного применения бактериофагов при инфекционных заболеваниях желудочно-кишечного тракта, мочеполовой системы, при острых гнойно-септических состояниях больных, для лечения хирургических инфекций и т. д.
По сравнению с антибиотиками бактериофаги имеют ряд преимуществ: они не вызывают побочных эффектов, к тому же строго специфичны для определенных видов бактерий, поэтому при их использовании не нарушается нормальный микробиом человека. Однако такая высокая избирательность создает и проблемы: чтобы успешно лечить пациента, нужно точно знать инфекционный агент и подбирать бактериофаг индивидуально.
Бактериофагами лечат инфекционные болезни не только людей, но и домашних и сельскохозяйственных животных: мастит у коров, колибактериоз и эшерихиоз у телят и свиней, сальмонеллез у кур. Особенно удобно применять фаговые препараты в случае аквакультуры — для лечения промышленно выращиваемых рыб и креветок, так как в воде они долго сохраняются. Бактериофаги помогают защитить и растения, хотя применение фаговых технологий в этом случае затруднено из-за воздействия природных факторов, таких как солнечный свет и дождь, губительных для вирусов.
Фаги могут сыграть большую роль в поддержании микробиологической безопасности продуктов питания, так как применение антибиотиков и химических агентов в пищевой отрасли не решает эту проблему, одновременно снижая уровень экологической чистоты продукции. О серьезности самой проблемы говорят статистические данные: например, в США и России ежегодно регистрируется до 40 тыс. заболевших сальмонеллезом, из которых 1% умирает. Распространение этой инфекции в значительной степени связано с выращиванием, переработкой и потреблением различных видов птицы, и попытки применить для борьбы с ней бактериофаги дали многообещающие результаты.
Так, американская компания Intralytix производит фаговые препараты для борьбы с листериозом, сальмонеллезом и бактериальным загрязнением кишечной палочкой. Они разрешены к применению как добавки, предотвращающие размножение бактерий на продуктах питания — их распыляют на продукты из мяса и домашней птицы, а также на овощи и фрукты. Эксперименты показали, что коктейль из бактериофагов может быть успешно применен и при транспортировке и реализации живой прудовой рыбы для снижения бактериального загрязнения не только воды, но и самой рыбы.
Очевидным применением бактериофагов является дезинфекция, то есть уничтожение бактерий в тех местах, где их не должно быть: в больницах, на пищевых производствах и т. п. Для этой цели британская компания Fixed-Phage разработала метод фиксации фаговых препаратов на поверхностях, обеспечивающий сохранение биологической активности фагов до трех лет.
Эксперимент американских исследователей А. Херши и М. Чейза с использованием бактериофагов, меченных изотопами серы и фосфора, доказали роль ДНК как основного носителя генетической информации
В качестве объектов для своих исследований М. Дельбрюк и его сотрудники использовали мутантные бактериофаги так называемой Т-серии, поражающие кишечную палочку
Семь дней творения
Современные методы синтетической биологии позволяют не только вносить различные модификации в фаговые геномы, но и создавать полностью искусственные активные фаги. Технологически это несложно, нужно только синтезировать фаговый геном и ввести его в бактериальную клетку, а там он уже сам запустит все процессы, необходимые для синтеза белков и сборки новых фаговых частиц. В современных лабораториях на эту работу уйдет всего несколько дней.
Генетические модификации применяют, чтобы изменить специфичность фагов и повысить эффективность их терапевтического действия. Для этого наиболее агрессивные фаги снабжают узнающими структурами, связывающими их с целевыми бактериями. Также в вирусные геномы дополнительно встраивают гены, кодирующие токсические для бактерий белки, нарушающие метаболизм, — такие фаги более смертоносны для бактерий.
Универсальный способ защиты бактерий от всех внешних воздействий — так называемые биофильмы, пленки из ДНК, полисахаридов и белков, которые бактерии создают совместными усилиями и куда не проникают ни антибиотики, ни терапевтические белки. Такие биопленки — головная боль врачей, так как они способствуют разрушению зубной эмали, образуются на поверхности имплантов, катетеров, искусственных суставов, а также в дыхательных путях, на поверхности кожи и т. п. Для борьбы с биофильмами были сконструированы особые бактериофаги, содержащие ген, кодирующий специальный литический фермент, разрушающий бактериальные полимеры.
Большое число ферментов, сегодня широко использующихся в молекулярной биологии и генетической инженерии, были открыты в результате исследований бактериофагов.
Фаговые антибиотики
В терапевтических целях фаги необязательно использовать напрямую. За миллионы лет эволюции бактериофаги разработали арсенал специфических белков — инструментов для распознавания целевых микроорганизмов и манипуляций с биополимерами жертвы, на основе которых можно создавать противобактериальные препараты. Наиболее перспективными белками такого типа являются ферменты эндолизины, которые фаги используют для разрушения клеточной стенки при выходе из бактерии. Сами по себе эти вещества являются мощными антибактериальными средствами, нетоксичными для человека. Эффективность и направленность их действия можно повысить, изменив в них адресующие структуры — белки, специфически связывающиеся с определенными бактериями.
Большинство бактерий делятся по устройству клеточной стенки на грамположительные, мембрана которых покрыта очень толстым слоем пептидогликанов, и грамотрицательные, у которых слой пептидогликана расположен между двумя мембранами. Использование природных эндолизинов особенно эффективно в случае грамположительных бактерий (стафилококков, стрептококков и др.), поскольку пептидогликановый слой у них расположен снаружи. Грамотрицательные бактерии (синегнойная палочка, сальмонеллы, кишечная палочка и др.) являются менее доступной мишенью, поскольку ферменту, чтобы добраться до внутреннего пептидогликанового слоя, необходимо проникнуть сквозь внешнюю бактериальную мембрану.
Для преодоления этой проблемы были созданы так называемые артилизины — модифицированные варианты природных эндолизинов, содержащие поликатионные или амфипатические пептиды, которые дестабилизируют внешнюю мембрану и обеспечивают доставку эндолизина непосредственно к пептидогликановому слою. Артилизины обладают высокой бактерицидной активностью и уже показали свою эффективность при лечении отитов у собак (Briers et al., 2014).
Примером модифицированного эндолизина, избирательно действующего на определенные бактерии, является препарат P128 канадской компании GangaGen Inc. Он представляет собой биологически активный фрагмент эндолизина, соединенный с лизостафином — адресующей белковой молекулой, которая связывается с поверхностью клеток стафилококков. Полученный химерный белок обладает высокой активностью против разных штаммов стафилококка, в том числе обладающих множественной лекарственной устойчивостью.
Анализируя размножение фагов в присутствии целевых бактерий, можно количественно определить численность последних. Так как количество фаговых частиц в растворе возрастет пропорционально числу содержавшихся в нем бактериальных клеток, то для оценки численности бактерий достаточно определить титр бактериофага.
Специфичность и чувствительность такой аналитической реакции достаточно высока, а сами процедуры просты в исполнении и не требуют сложного оборудования. Важно, что диагностические системы, основанные на бактериофагах, сигнализируют о наличии именно живого патогена, тогда как другие методы, такие как ПЦР и иммуноаналитические, свидетельствуют лишь о наличии биополимеров, принадлежащих этой бактерии. Такого типа диагностические методы особенно удобны для использования в экологических исследованиях, а также в пищевой индустрии и сельском хозяйстве.
Вероятно, с помощью модифицированных фагов удастся решить и давнюю задачу глобальной важности — разработать дешевые и быстрые методы детекции возбудителей туберкулеза на ранней стадии заболевания. Задача эта очень сложна, поскольку микобактерии, вызывающие туберкулез, отличаются крайне медленным ростом при культивировании в лабораторных условиях. Поэтому диагностика заболевания традиционными методами может затягиваться на срок до нескольких недель.
Фаговая технология позволяет упростить эту задачу. Суть ее в том, что к образцам анализируемой крови добавляют бактериофаг D29, способный поражать широкий спектр микобактерий. Затем бактериофаги отделяют, и образец перемешивают с быстрорастущей непатогенной культурой микобактерий, также чувствительной к этому бактериофагу. Если в крови первоначально имелись микобактерии, которые были инфицированы фагами, то в новой культуре будет также наблюдаться наработка бактериофага. Таким образом можно выявить единичные клетки микобактерий, а сам процесс диагностики с 2–3 недель сокращается до 2–5 дней (Swift & Rees, 2016).
Фаговый дисплей
Из экспериментов Смита последовало два важных вывода: во-первых, используя технологию рекомбинантных ДНК, можно создавать огромные по разнообразию популяции численностью 10 6 –10 14 фаговых частиц, каждая из которых несет на своей поверхности разные варианты белков. Такие популяции назвали комбинаторные фаговые библиотеки. Во-вторых, выделив из популяции конкретный фаг (например, обладающий способностью связываться с определенным белком или органической молекулой), можно этот фаг размножить в бактериальных клетках и получить неограниченное число потомков с заданными свойствами.
Принципиальная схема процедуры биопеннинга — отбора высокоспецифичных рекомбинантных антител к конкретной мишени-антигену из комбинаторной библиотеки фагового дисплея на основе нитчатых бактериофагов. По: (Тикунова, Морозова, 2009)
На сегодня можно выделить два основных направления применения фагового дисплея. Технология на основе пептидов используется для исследования рецепторов и картирования сайтов связывания антител, создания иммуногенов и нановакцин, а также картирования сайтов связывания субстратов у белков-ферментов. Технология на основе белков и белковых доменов — для отбора антител с заданными свойствами, изучения белок-лигандных взаимодействий, скрининга экспрессируемых фрагментов комплементарной ДНК и направленных модификаций белков.
С помощью фагового дисплея можно вносить узнающие группировки во все виды поверхностных вирусных белков, а также в основной белок, формирующий тело бактериофага. Вводя в поверхностные белки пептиды с заданными свойствами, можно получить целый спектр ценных биотехнологических продуктов. Например, если этот пептид будет имитировать белок опасного вируса или бактерии, узнаваемый иммунной системой, то такой модифицированный бактериофаг представляет собой вакцину, которую можно просто, быстро и безопасно наработать.
Одним из важных применений метода фагового дисплея белков является создание фаговых библиотек рекомбинантных антител, где антигенсвязывающие фрагменты иммуноглобулинов расположены на поверхности фаговых частиц fd или М13. Особый интерес представляют библиотеки антител человека, поскольку такие антитела могут быть использованы в терапии без ограничения. В последние годы только на фармацевтическом рынке США продается около полутора десятка терапевтических антител, сконструированных с использованием этого метода.
Так как вирус представляет собой достаточно жесткую конструкцию с определенным соотношением размерностей, это обстоятельство позволяет использовать его для получения пористых наноструктур с известной площадью поверхности и нужным распределением пор в структуре. Как известно, именно площадь поверхности катализатора является критическим параметром, определяющим его эффективность. А существующие на сегодня технологии формирования на поверхности бактериофагов тончайшего слоя металлов и их оксидов позволяют получать катализаторы с чрезвычайно развитой регулярной поверхностью заданной размерности. (Lee et al., 2012).
Нитчатый бактериофаг М13, размножающийся в обычной кишечной палочке (а), может нести на своей поверхности рекомбинантные чужеродные белки, такие как антитела (б) либо пептиды (в). Он также может служить шаблоном для создания наноустройств и наноматериалов, таких как нанокристаллический катализатор с известной площадью поверхности и нужным распределением пор (г)
Путем покрытия нитчатых фагов золотом и двуокисью индия были получены электрохромные материалы — пористые нанопленки, меняющие цвет при изменении электрического поля, способные реагировать на изменение электрического поля в полтора раза быстрее известных аналогов. Подобного рода материалы перспективны для создания энергосберегающих ультратонких экранных устройств (Nam et al., 2012).
На основе комплексов бактериофага М13, двуокиси титана и одностенных углеродных нанотрубок были также созданы материалы для солнечных батарей (Dang et al., 2011).
Последние годы ознаменовались широкими исследованиями бактериофагов, которые находят себе все новые применения не только в терапии, но и в био- и нанотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Литература
1. Бактериофаги: биология и применение / Ред.: Э. Каттер, А. Сулаквелидзе. М.: Научный мир. 2012.
2. Стент Г., Кэлиндар Р. Молекулярная генетика. М.: Мир. 1974. 614 с.
3. Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acta Naturae. 2009. № 3. C. 6–15.
4. Mc Grath S., van Sinderen D. Bacteriophage: Genetics and Molecular Biology. Horizon Scientific Press, 2007.

Обзор
Джамбо-фаги вызывают образование внутри бактериальной клетки структуры из специального вирусного белка, похожей на клеточное ядро. Внутри такого псевдоядра находится вирусная ДНК, которую белковая оболочка надежно оберегает от защитных систем CRISPR/Cas и эндонуклеаз рестрикции.
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Загадочные джамбо-фаги
По состоянию на 2020 год в базе GenBank хранятся геномы более чем 150 джамбо-фагов. Большая часть из них относится к семейству Myoviridae и имеет длинные белковые хвосты, способные к сокращениям, а остальные принадлежат к семейству Siphoviridae, и хвосты у них не сокращаются. Стоит отметить, что джамбо-фаги довольно широко распространены в природе, однако долгое время они ускользали от внимания вирусологов из-за слишком большого размера вирусных частиц, который не позволял изолировать их с помощью стандартных протоколов для работы с бактериофагами [1].
В геномах джамбо-фагов наряду с генами, кодирующими структурные белки капсида и белки, необходимые для репликации генома, содержится множество генов, гомологи которых в других организмах на данный момент не известны. Например, в геноме фага φKZ, поражающего синегнойную палочку Pseudomonas aeruginosa, из более чем 300 идентифицированных генов лишь для 35 удалось найти родственников в геномах других организмов. Кроме того, даже у джамбо-фагов, поражающих одну и ту же бактерию, зачастую сходство по последовательностям минимально [1].
В больших, по меркам вирусов прокариот, геномах джамбо-фагов закодирован впечатляющий арсенал белков и РНК, необходимых для репликации, транскрипции и трансляции, что делает их в значительной мере независимыми от клеточных белков. Например, джамбо-фаг XacN1, инфицирующий бактерию Xanthomonas citri, кодирует 56 собственных тРНК, соответствующих всем 20 аминокислотам — абсолютный рекорд по количеству тРНК среди вирусов! Поскольку потребности джамбо-фагов в клеточных белках минимальны, спектр бактерий, заражаемых джамбо-фагами, весьма широк по сравнению с фагами, имеющими геномы меньшего размера [1].
Бактериофаги, у которых есть цитоскелет
Удивительно, но в геномах джамбо-фагов закодированы собственные цитоскелетные белки! Цитоскелет, состоящий из микротрубочек, актиновых и промежуточных филаментов, долгое время считался уникальной чертой эукариот, пока в 1991 году у кишечной палочки не описали гомолог тубулина (основного компонента микротрубочек), известный как FtsZ. Как и тубулин у эукариот, бактериальный тубулин участвует в процессе деления клетки. В 2012 году гомологи тубулина нашли у фага C-st, поражающего бактерию Clostridium botulinum (по размеру генома, однако, этот фаг до джамбо-фагов не дотягивает: длина его генома составляет около 186 т.п.о.). Чуть позже другой гомолог тубулина, получивший название PhuZ, был описан у упомянутого ранее джамбо-фага 201φ2-1, который инфицирует бактерию Pseudomonas chlororaphis. Белок PhuZ оказался весьма консервативным среди джамбо-фагов [2]. Но зачем бактериофагам так нужен белок цитоскелета, если у них и собственных клеток нет? Ответ оказался весьма неожиданным.
Исследования структуры PhuZ показали, что этот белок формирует трехцепочечные правозакрученные филаменты весьма сложного строения (рис. 1).

Рисунок 1. Белок PhuZ джамбо-фага 201φ2-1 в мономерной форме (а) и в виде филамента (б). Каждый филамент состоит из трех цепей (протофиламентов), окрашенных разными цветами.
При полимеризации PhuZ, как и в случае эукариотического тубулина, важную роль играет ГТФ: мономеры присоединяются к растущему филаменту в комплексе с ГТФ, после чего ГТФ гидролизуется до ГДФ. Наблюдение за поведением PhuZ, сшитого с зеленым флуоресцентным белком (GFP), в клетках бактерии Pseudomonas chlororaphis, инфицированных фагом 201φ2-1, показало, что для филаментов PhuZ характерны многие свойства, присущие эукариотическим микротрубочкам. Подобно микротрубочкам и некоторым бактериальным белкам цитоскелета, филаменты PhuZ полярны: растущие концы (плюс-концы), к которым присоединяются новые мономеры, обращены к центру клетки, в то время как не меняющиеся минус-концы закреплены у полюсов клеток. Кроме того, филаменты PhuZ стали первыми известными прокариотическими элементами цитоскелета, для которых характерна присущая микротрубочкам динамическая нестабильность: филаменты быстро переключаются с полимеризации на деполимеризацию, и наоборот. Ученые предполагают, что, как и в случае с микротрубочками, динамическую нестабильность филаментов PhuZ обеспечивает гидролиз ГТФ, который происходит при присоединении очередного мономера. Кроме того, как и у микротрубочек, на концах длинных филаментов PhuZ находятся ГТФ-кэпы, стабилизирующие филаменты и способствующие их росту [1].
Коробочка с сюрпризом: где джамбо-фаги хранят свою ДНК
И все же, зачем бактериофагам мог понадобиться свой собственный аналог тубулина? Ответить на этот вопрос помогла покадровая съемка бактериальных клеток Pseudomonas chlororaphis, чья плазмида кодирует флуоресцентно-меченный PhuZ, до и после инфицирования джамбо-фагом 201φ2-1 [3]. До момента заражения в цитоплазме клеток обнаруживались филаменты PhuZ, которые, хотя и демонстрировали динамическую нестабильность, были разбросаны по клетке случайным образом. После инфицирования фагом картина изменилась кардинальным образом: ранее неупорядоченные филаменты собрались в двухполюсную структуру, похожую на веретено деления, где минус-концы филаментов были заякорены у полюсов клетки, а растущие обращены в ее центр. В то же время окрашивание вирусной ДНК помогло показать, что после впрыскивания фагом своего генома в клетку у одного из ее полюсов, флуоресцентный сигнал от этой ДНК постепенно усиливался, видимо, из-за ее репликации. Параллельно с репликацией вирусная ДНК перемещалась в центр клетки за счет веретена из PhuZ, где в конце концов оформилась в большую структуру, первоначально названную инфекционным нуклеоидом, а сейчас более известную как фаговое ядро. При этом бактериальная ДНК оказывалась оттесненной фаговым ядром на периферию клетки, где постепенно разрушалась. Именно веретено из филаментов PhuZ сначала перемещает вирусную ДНК в центр клетки, а затем стабилизирует ее центральное положение до самого конца — до момента лизиса клетки. Эксперименты с мутантным PhuZ, лишенным способности к гидролизу ГТФ, показали, что в отсутствие веретена вирусная ДНК не достигает центра клетки, из-за чего эффективность производства новых вирусных частиц сокращается почти вдвое [1].

Рисунок 2. Локализация белка gp105 джамбо-фага 201φ2-1 в клетках бактерии Pseudomonas chlororaphis до инфицирования фагом (сверху) и после (снизу). gp105 сшит с GFP (зеленый цвет) и синтезируется с плазмидного вектора. ДНК окрашена синим, клеточная мембрана — красным. В присутствии вирусной ДНК gp105 образует вокруг нее сферическую оболочку. Вирусное псевдоядро локализовано строго в центре бактериальной клетки за счет биполярного веретена из белка PhuZ.
Однако в отличие от ядерной оболочки, которая представляет собой двуслойную мембрану, оболочка вирусного псевдоядра состоит из белка gp105 — самого обильно синтезируемого белка фага 201φ2-1. Внутри вирусного псевдоядра, помимо генетического материала фага, находятся белки, участвующие в репликации и транскрипции. Примечательно, что, когда вирусная ДНК фага достигает центра клетки, ее белковая оболочка начинает вращаться вокруг центральной оси — по-видимому, это обеспечивается за счет динамической нестабильности филаментов PhuZ, контактирующих с псевдоядром. Сменяющие друг друга рост и укорочение филаментов, взаимодействующих с белковой оболочкой, и заставляют псевдоядро вращаться (рис. 3) [1].

Рисунок 3. При инфицировании клетки джамбо-фагом филаменты PhuZ (красный) постепенно перемещают созревающее псевдоядро (зеленый, отмечено желтой стрелкой) в центр клетки (два левых столбца). Как видно по снимкам в правом столбце, центрально локализованное псевдоядро вращается под действием филаментов PhuZ. mpi — минуты после инфицирования.
На данный момент псевдоядра описаны у трех джамбо-фагов, поражающих бактерий рода Pseudomonas — 201φ2-1, φKZ и φPA3, а также у джамбо-фага PCH45, инфицирующего бактерии рода Serratia и филогенетически далекого от джамбо-фагов, поражающих псевдомонад. У всех этих вирусов имеется белок, образующий оболочку вокруг их геномной ДНК в цитоплазме бактерии, и белок, аналогичный тубулину. По-видимому, способность к образованию фагового ядра и специального веретена, обеспечивающего его центральную локализацию, является консервативной стратегией размножения джамбо-фагов [1].
В свежем исследовании ученых с биологического факультета МГУ им. М.В. Ломоносова показано, что фаговый генетический материал отделен от бактериального в период всего инфекционного цикла. На примере фага φKZ продемонстрировано, что после впрыскивания генетического материала в бактерию вирусная ДНК попадает в особые круглые компартменты, располагающиеся вблизи клеточной стенки бактерии. Число круглых компартментов соответствует количеству фагов, одновременно атаковавших одну и ту же клетку (рис. 4) [5].

Рисунок 4. Микрофотография клетки Pseudomonas aeruginosa, инфицированной джамбо-фагом φKZ, через 40 минут после инфицирования. Черные стрелки указывают на округлые компартменты, белая — на остатки бактериальной ДНК, голубая — на псевдоядро, красная — на собранные капсиды.
Почти одновременно с появлением круглых компартментов бактериальный нуклеоид перемещается из центра клетки к полюсу, противоположному точке впрыскивания фаговой ДНК, и так и остается на периферии клетки, при этом геномная ДНК бактерии постепенно разрушается. Точный механизм перемещения бактериальной ДНК пока детально не исследовался. Стоит отметить, что, по некоторым данным, полного разрушения бактериального генома не происходит, поскольку хозяйская ДНК покрывается специальными белками, защищающими ее от ДНКаз. Круглый компартмент же постепенно перемещается в центр клетки и, в конце концов, становится зрелым псевдоядром [5]. К заполненным капсидам в цитоплазме присоединяются хвосты, в результате чего образуются зрелые вирионы, которые выходят наружу после лизиса клетки (рис. 5).

Рисунок 5. Жизненный цикл джамбо-фага. После впрыскивания в клетку геном джамбо-фага оказывается внутри круглого компартмента, который за счет филаментов PhuZ постепенно перемещается в центр и становится псевдоядром. Центральное положение псевдоядра поддерживается филаментами PhuZ. Внутри псевдоядра происходит репликация вирусных геномов и транскрипция, причем вирусные мРНК каким-то образом выходят из ядра в цитоплазму, где бактериальные рибосомы синтезируют вирусные белки. Собранные вблизи клеточной мембраны капсиды пришвартовываются к вращающемуся ядру и наполняются генетическим материалом фага. После этого в цитоплазме к капсидам присоединяются хвосты — так формируются зрелые вирионы джамбо-фагов. Выход новых вирионов наружу происходит после лизиса клетки.
В той же работе с помощью электронной томографии было исследовано содержимое фагового псевдоядра. Оказалось, что фаговая ДНК в нем находится в виде филаментов, состоящих из одной-двух двойных спиралей ДНК. Авторам исследования также удалось рассмотреть глобулярные домены, связанные с фаговой ДНК. Возможно, эти глобулы образованы белками, аналогичными гистонам эукариот (рис. 6) [5].

Рисунок 6. Внутреннее содержимое инфицированной клетки Pseudomonas aeruginosa, визуализированное с помощью электронной томографии. P-N — сеть филаментов псевдоядра; на вставке (б) — ее 3D-реконструкция. Белая стрелка указывает на филамент из фаговой ДНК, белые треугольники — на белковые глобулы в составе филаментов псевдоядра.
Фаговое ядро как защитная стратегия
Бактерии обладают внушительным арсеналом средств защиты от бактериофагов и других мобильных генетических элементов: системы рестрикции-модификации, разнообразные системы CRISPR/Cas, система BREX и многие другие системы, список которых постоянно пополняется . Но и фаги не лыком шиты. В частности, многие из них продуцируют особые белки анти-CRISPR, подавляющие работу CRISPR/Cas на разных этапах.
Подробнее о защитных системах бактерий и способах их преодоления бактериофагами читайте в статьях [6–9].
Однако джамбо-фаги и тут не остались в стороне. В начале 2020 года две исследовательские группы почти одновременно сообщили, что джамбо-фаги устойчивы почти ко всем системам CRISPR/Cas, хотя не имеют белков анти-CRISPR. Выяснилось, что псевдоядро джамбо-фагов служит универсальным защитным механизмом против систем CRISPR/Cas, нацеленных на разрушение ДНК: его белковая оболочка просто не пропускает нуклеазы Cas внутрь! Кроме того, по крайней мере в случае фага φKZ, белковая оболочка вокруг вирусной геномной ДНК обеспечивает защиту еще и от эндонуклеаз рестрикции [10]. Казалось бы, эти фаги просто непобедимы!

Рисунок 7. Благодаря наличию псевдоядра, не подпускающего защитные бактериальные белки к фаговой ДНК, джамбо-фаги устойчивы к действию систем CRISPR/Cas и эндонуклеаз рестрикции, разрушающих ДНК. Однако рестриктазе EcoRI, сшитой с фаговым внутренним белком псевдоядра ORF152, все же удается проходить через защитную белковую оболочку. Системы CRISPR/Cas, действующие на уровне РНК, эффективно подавляют размножение джамбо-фагов: нуклеаза Cas13 разрушает вирусные мРНК, вышедшие из псевдоядра в цитоплазму, и тем самым блокирует синтез вирусных белков.
Системы CRISPR/Cas VI типа эффективны не только против фагов, инфицирующих Pseudomonas, но и против джамбо-фага, поражающего Serratia. Вероятно, наличие мощной неспецифической защиты от систем CRISPR/Cas, кроме систем VI типа, действующих на уровне РНК, является общей чертой джамбо-фагов [10], [12].
Несмотря на уже полученные интереснейшие результаты, многие аспекты биологии джамбо-фагов остаются неизвестными. Как регулируется транспорт белков в псевдоядре? Каким образом фаговые мРНК выходят из псевдоядра в цитоплазму? Все ли джамбо-фаги способны к образованию псевдоядра? На эти и многие другие вопросы ответа пока нет. Однако новые публикации, раскрывающие всё новые и новые особенности биологии джамбо-фагов, выходят все чаще, и можно не сомневаться, что в ближайшие годы мы узнаем об этих таинственных вирусах еще много неожиданного.

Бактериофаг – вирус, избирательно поражающий бактериальные клетки [1] .
Содержание:
Состояние вопроса
В ходе длительных исследований достоверно установлено, что антибактериальный эффект препаратов бактериофагов основан на внедрении генома фага в клетку бактерии с последующим его размножением внутри ее и лизисом инфицированной клетки. После выхода во внешнюю среду фаги повторно инфицируют и лизируют другие клетки до полного уничтожения патогенных бактерий в очаге воспаления [3] [1] .
Бактериофаги отличаются высокой специфичностью действия в отношении штаммов-хозяев, отсутствием токсичности, не способностью вызывать аллергические реакции и дисбактериоз. Они могут применяться в качестве самостоятельного лекарственного средства, а так же совместно с антибиотиками и иммуноукрепляющими препаратами [3] [1] .
Несмотря на масштабы накопленного научного материала многие вопросы, касающиеся биологических свойств бактериофагов, требуют дополнительных исследований. В частности не выяснена функция многих продуктов, синтезируемых фагами, нет единой схемы таксономии и морфологической классификации, нет стандартных наборов бактериофагов многих возбудителей, схем и регламента их применения [3] [1] .

Развитие бактериофага в культуре бактерий рода Xanthomonas

Морфология и структура
Как и прочие вирусы, во внеклеточной форме бактериофаги являются метаболически инертными частицами. Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками [1] .
Для обозначения бактериофагов используются буквы латинского и греческого алфавитов. В частности хорошо изучены фаги кишечной палочки: λ, ϕX174, fd, f2, R17, Т2 [1] .
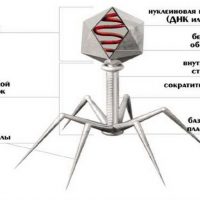
Большинство из фагов относятся к сложным вирусам и состоят из хорошо сформированной икосаэдрической (кубической) головки и хвоста (отростка) различной степени выраженности, иногда имеющего дополнительные структуры. Все структуры отростка имеют белковую природу. Размер фага колеблется от 20 до 200 нм. Средний диаметр головки – от 60 до 100 нм, длина отростка – 100–200 нм. Длина хвоста, как правило, в 2–4 разабольше диаметра головки [2] [1] .
Головка состоит из генетического материала (двух цепочечной или одноцепочечной нуклеиновой кислоты (РНК или ДНК) с ферментом транскрипаза в неактивном состоянии) и капсида (белковой оболочки). Нуклеиновая кислота и капсид вместе образуют нуклеокапсид [1] .
Хвост представляет собой белковую полую трубку окруженную чехлом, содержащим сократительные белки. Чехол является продолжением белковой оболочки головки. В основании хвоста находится АТФ-аза, регенерирующая энергию для инъекции генетического материала (сокращения чехла отростка бактериофага). У некоторых вирусов чехол сокращается, обнажая часть стержня. На конце хвоста у многих фагов присутствует базальная пластинка с тонкими длинными нитями, способствующими прикреплению его к бактерии. Кроме того в области базальной пластинки присутствует фермент – бактериофаговый лизоцим, способный разрушать муреин клеточной стенки бактерии [2] [1] .
Морфологические типы
Описание структуры и морфологии бактериофагов приведенное выше соответствует наиболее изученным Т-фагам (типовым фагам). Они составляют группу коли-дизентерийных фагов, включающую 7 представителей: 4 нечетных Т1, ТЗ, Т5 и Т7 и 3 четных Т2, Т4, Т6 [1] .
По форме вирусных частиц фаги делятся на шесть основных морфологических типов:
Вирусы бактерий. Бактериофаги. Классификация бактериофагов. Морфология бактериофагов. Типы бактериофагов.
Бактериофаги [от бактерии, + греч. phagein, поедать] — группа вирусов, паразитирующих в бактериальных клетках. Вирусы, вызывающие гибель инфицированных бактерий, известны как литические бактериофаги. Размножение и выход дочерних популяций вируса из бактерии сопровождается её гибелью и разрушением (лизисом). Бактериофаги широко распространены в природе — их выделяют из воды, почвы, организмов различных животных и человека. Принципы классификации бактериофагов аналогичны подходам к систематике вирусов вообще.
В основу классификации положены антигенная структура, морфология фагов, спектр действия, химический состав и др. Большинство фагов относится к ДНК-содержащим вирусам с нуклео-капсидом, организованным по принципу смешанной симметрии. По спектру действия выделяют типовые фаги (Т-фаги), лизирующие бактерии отдельных типов внутри вида, моновалентные фаги, лизирующие бактерии одного вида, и поливалентные фаги, лизирующие бактерии нескольких видов. Бактериофаги устойчивы к различным физическим и химическим воздействиям. Большинство из них без вреда переносит высокие температуры (50-70 °С), действие дезинфектаитов (за исключением кислот и формалина), прямой солнечный свет и УФ-облучение в низких дозах. Бактериофаги проявляют иммуногенные свойства, вызывая синтез специфических AT.
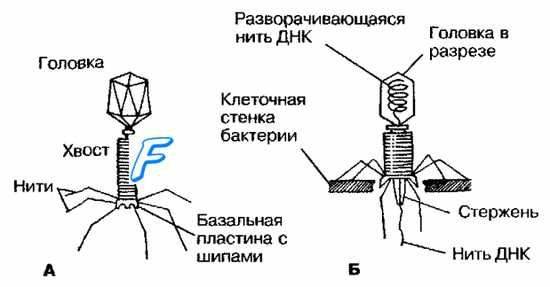
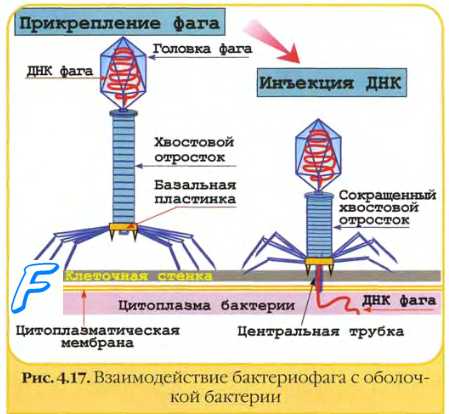
Рис. 5-10. Фаг Т4 кишечной палочки до контакта с бактерией (А) и в момент введения фаговой ДНК (Б).
Морфология бактериофагов. Типы бактериофагов
Строение бактериофагов наиболее полно охарактеризовано на основе изучения Т-фагов кишечной палочки (рис. 5-10). Внешне большинство бактериофагов напоминают сперматозоиды или головастиков, но среди них встречают и другие формы, на основании которых выделяют пять основных типов бактериофагов.
• К типу I бактериофагов относят ДНК-содержащие нитевидные фаги, лизирующие бактерии, содержащие F-плазмиды.
• Фаги типа II представлены головкой и рудиментом хвоста. Геном большинства из них образован молекулой РНК и лишь у фага jc-174 — однонитевой ДНК.
• Бактериофаги типа III имеют короткий хвост (например, Т-фаги 3 и 7).
• К типу IV относят фаги с несокращаюшимся хвостом и двухнитевой ДНК (например, Т-фаги 1 и 5).
• Фаги типа V имеют ДНК-геном, сокращающийся чехол хвоста, который заканчивается базаль-ной пластиной (например, Т-фаги 2 или 4).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Так мир познакомился с микроорганизмами, питающимися бактериями, которые много тысяч лет делали свое дело слаженно, не давая бактериям уничтожить все живое на земле. В 1921 г. Д. Мэйсон и Р. Брайон впервые описали успешное лечение стафилококковой инфекции кожи с помощью стафилококкового бактериофага. Во время Второй мировой войны бактериофаги использовались при гнойно-септических инфекциях, дизентерии, тифе и др.
Бактериофаги еще в прошлом столетии доказали свою эффективность и безопасность. Почему же бактериофаги до сих пор не стали основными средствами борьбы с инфекцией? Это объясняется несколькими причинами. Главная — открытие новой группы препаратов – антибиотиков, надолго оттеснившее интерес к бактериофагам. Плюс:
- недостаточная информированность врачей и пациентов,
- отсутствие фагов ко многим патогенным бактериям,
- неэффективность лечения в связи с неправильным подбором бактериофагов для лечения конкретного больного,
- недостаточно изученное иммунологическое взаимодействие бактериофагов и организма человека,
- отсутствие нормативно-правовых аспектов применения бактериофагов в лечении инфекций человека.
Что такое бактериофаги![Механизм]()
В 1939 году А. Флемингом был открыт антибиотик, и началась эра антибиотиков в лечении бактериальных инфекций. Появилось большое количество антибиотиков 1, 2, 3, 4 поколений, причем антибиотики последнего поколения, которыми пользуются и сейчас, появились еще в 70-е годы прошлого столетия. На Западе и Америке отказались от бактериофагов и активно начали применять антибиотики.
Но А. Флеминг предупреждал о некоторых обязательных моментах применения антибиотиков:
- строгих показаниях к назначению,
- соблюдении продолжительности и запрете прерывания курса лечения,
- адекватных дозах препарата,
- способах введения,
- назначения их обязательно врачом,
- отпуске антибиотиков исключительно по рецепту.
Несоблюдение хотя бы части этих требований могло привести и, как оказалось, приводит к кризису антибиотиковой эры. Бактерии перестают реагировать на препараты. Пока ещё действуют антибиотики последнего поколения, решая труднейшие клинические проблемы, но рассчитывать на появление новых антибиотиков не приходится.
Россия на сегодняшний день оказалась самой развитой страной в области микробиологии изучения бактериофагов. Бактериофаги – это естественные антагонисты бактерий.
Каков механизм действия бактериофагов
Сегодня многие заболевания вызываются стафилококками, стрептококками, клебсиеллами и другими бактериями, и успешно могут лечиться бактериофагами. Это естественная альтернатива антибиотикам, возврат к природе.
Какие преимущества имеют бактериофаги в лечении бактериальных инфекций
Бактериофаги много тысяч лет делали свое дело, не давая бактериям уничтожить все живое на земле.
Бактериофаги могут применяться и у беременных, и у детей, во всех возрастных группах людей. Противопоказаний к их применению нет.
Фаги совместимы с различными лекарствами, в том числе с антибиотиками, причем они уменьшают непереносимость (резистентность) бактерий к антибиотикам.
Курс лечения бактериофагами более короткий (7-14 дней). Фаги практически не дают побочных явлений. Они определяются бактериальной зараженностью и распадом бактерий с выделением эндотоксина, но они значительно меньше, чем при приеме антибиотиков, эти явления легко снимаются приёмом энтеросорбентов. Бактериофаги можно применять при аллергических реакциях на антибиотики.
Бактериофаги, благодаря своей специфичности воздействия на бактерии, не убивают хорошие бактерии и не изменяют нормальную микрофлору кишечника. Они, в отличие от антибиотиков, не нарушают микробиом человека.
Какие виды бактериофагов известны
Известно, что бактериофаги действуют на один штамм бактерий, поэтому производятся препараты бактериофагов, действующих против разных штаммов одного возбудителя:
- стафилококковый бактериофаг,
- сальмонеллезный бактериофаг,
- стрептококковый бактериофаг,
- клебсиеллёзный бактериофаг (Клебсиелла пневмония),
- бактериофаг псевдомонас (против синегнойной палочки).
Производятся препараты против двух и более возбудителей, поливалентные бактериофаги:
- бактериофаг дизентерийный, действующий на разные штаммы дизентерийной палочки,
- клебсиеллезный бактериофаг против трёх видов клебсиелл,
- бактериофаг бактериальный поливалентный очищенный (действует на стрептококк, стафилококк, протей, клебсиеллу пневмонию, кишечную палочку, синегнойную палочку),
- пиобактериальный комплексный бактериофаг (против стафилококка, стрептококка, двух видов протея, двух видов клебсиеллы, энтерококков, энтеропатогенной кишечной палочки, синегнойной палочки),
- бактериофаг интестин-бактериальный против дизентерийной палочки, сальмонеллы, кишечной палочки, протея, энтерококков, стафилококков, синегнойной палочки,
- пиобактериофаг поливалентный или секстафаг (против стафилококка, стрептококка, протея, синегнойной палочки, клебсиеллы пневмонии, энтеропатогенной кишечной палочки).
Особенность бактериофагов – узкая специфичность, в следствие чего они могут применяться против определенных штаммов бактерий, поэтому необходимо иметь большую коллекцию бактериофагов, из которой можно выбрать подходящий препарат или фаговый коктейль для конкретного пациента. Коллекция бактериофагов составляет более 200 препаратов.
Производителем бактериофагов в России является научно-производственное объединение Микроген — мировой лидер изучения бактериофагов.
При каких заболеваниях применяются бактериофаги
Бактериофаги применяются при:
- трофических язвах,
- раневых инфекциях,
- инфекциях органов дыхания,
- мочеполовой системы,
- желудочно-кишечных тракта,
- болезнях лор-органов и др. заболеваниях.
Инфекции желудочно-кишечного тракта, вызванные сальмонеллой, золотистым стафилококком, протеем, и др. и сопровождающиеся диареей (поносами), успешно лечатся бактериофагами.
Применяться бактериофаги при острых кишечных инфекциях могут:
- в виде монотерапии при легких формах,
- в сочетании с антибиотиками при
- средне-тяжелых формах болезни,
- бактерионосительстве – выделении энтеропатогенных бактерий,
- комплексной терапии условно-патогенной флоры и нарушении микробиома (микрофлоры) кишечника.
Используются бактериофаги в дерматологии, в детской практике, хирургии. С профилактической целью — в детских садах и школах для предотвращения эпидемий, например, дизентерии. Бактериофаги уже более 100 лет на службе человека. Может быть, как раз сейчас начинается эпоха бактериофагов. В новосибирском научном центре разрабатываются технологии персонализированного лечения. Медицинские центры Франции, Бельгии, Швейцарии проводят клинические исследования коктейлей бактериофагов.
![]()
Важным условием успешного лечения бактериофагами является знание микрофлоры тех органов, где предполагается бактериальная инфекция. Ниже приведены необходимые исследования микрофлоры для различных очагов заражения:
Участок заражения Обследование желудочно-кишечный тракт анализ на микробиом толстой кишки (на дисбактериоз) носоглотка мазок на микрофлору урологические заболевания посев мочи,
посев секрета простатыгинекологические заболевания мазки раневые поверхности и язвы,
в том числе при диабетической стопепосев В настоящее время при выявлении бактериального возбудителя болезни есть возможность определить его чувствительность к бактериофагу. Перед началом лечения необходимо пройти это обследование.
Как принимаются бактериофаги
Бактериофаги хранятся в холодильнике при температуре 2-8 градусов.
Бактериофаги — это крупные частицы. Они трудно проникают в ткани органов, поэтому лучше вводить их при лечении прямо к месту локализации инфекции. Это могут быть ингаляции при легочной патологии, промывания при лор-заболеваниях, аппликации при трофических язвах, ожогах, ранах. При инфекциях мочевыводящих путей для достижения успеха препараты бактериофагов вводятся в полость мочевого пузыря (хронический цистит).
Для внутреннего употребления есть бактериофаги во флаконах по 20 мл, 4 флакона в упаковке. Перед употреблением флакон следует подержать в руке, согреть, перелить в чистую посуду и принять внутрь. Принимать 2 раза в день натощак и после ужина, курс лечения 6 дней.
![Забор бактериофага из 100-мл флакона]()
Есть упаковки по 50 мл и 100 мл. Поскольку следует максимально сохранять стерильность препарата (при помутнении запрещён его приём), необходимый для однократного приёма объём следует набирать в шприц.
В настоящее время проводят лечение бактериофагами диабетической стопы. Из больных тканей берут мазок для выявления конкретных патогенных бактерий. Затем из коллекции бактериофагов подбирают те, которые способны ликвидировать именно эти бактерии. Бактериофаг наносят на стерильную салфетку, прикладывают к ране. Лечение около недели.
Бактериофаги применяются в медицине местно или внутрь. Еще в 30-ые годы прошлого столетия бактериофаги доказали свою безопасность и высокую эффективность в клинических условиях. Но покупать бактериофаги и лечиться самостоятельно не стоит.
Заключение
Не всегда бактериофаги могут заменить антибиотики. Так, если имеет место острая ситуация, когда заподозрена бактериальная инфекция, но нет времени определить бактериальный фон болезни, чтобы подобрать препарат бактериофаг, то применяется лечение антибиотиками. При хронических инфекционных болезнях, когда установлена нечувствительность бактерий к антибиотикам и бактериальный фон заболевания, предпочтение следует отдать бактериофагам.
Хотя бактериофаги, возможно, не смогут полностью заменить антибиотики, но вместе они могут бороться со многими серьезными болезнями в клинической практике.
Читайте также: